-
Medical journals
- Career
Akutní myokarditida u dospívajících
Authors: S. Mlynárová 1; S. Polanská 1; J. Pavlíček 1,2; P. Hanzlíková 2,3; P. Širůček 2,4; T. Gruszka 1,2; M. Hladík 1,2
Authors‘ workplace: Klinika dětského lékařství, Fakultní nemocnice Ostrava 1; Lékařská fakulta, Ostravská univerzita, Ostrava 2; Ústav radiodiagnostický, Fakultní nemocnice Ostrava 3; Klinika infekčního lékařství, Fakultní nemocnice Ostrava 4
Published in: Čes-slov Pediat 2021; 76 (1): 18-27.
Category: Original Papers
Overview
Akutní myokarditida je potenciálně závažné onemocnění. Průběh je velmi variabilní, nejčastější etiologie je virová. Autoři představují tři kazuistiky akutní myokarditidy, které se vyskytly u dospívajících chlapců v krátkém časovém období. Společnou symptomatologií byla bolest na hrudi, u všech byla detekována vyšší hladina troponinu a všichni měli pozitivní nález na magnetické rezonanci. U dvou případů byly sérologicky prokázány signifikantní titry Coxsackie viru, u jednoho byla potvrzena primoinfekce virem Epsteina-Barrové. Klinický průběh byl bez komplikací, pro nealterovanou srdeční funkci předpokládáme u všech pacientů dobrou prognózu. Doporučeno je celoživotní sledování.
Klíčová slova:
Troponin – infekce – magnetická rezonance – myokarditida
ÚVOD
Myokarditida je zánětlivé onemocnění srdečního svalu, charakterizované zánětlivým infiltrátem s nekrózou nebo degenerací myocytů. Incidence se vzhledem k variabilnímu průběhu tohoto onemocnění obtížně odhaduje, populační studie uvádějí výskyt okolo 10 na 100 000 obyvatel, autoptické studie pak identifikaci myokarditidy u 0,1 až 6 % vyšetřovaných pacientů [1–3]. Toto onemocnění je potenciálně letální, akutní myokarditida je prokázána ve 12 % náhlé srdeční smrti u adolescentů a mladých dospělých [4].
Etiologie akutní myokarditidy je infekční a neinfekční. Příčinou je většinou virové onemocnění, nejčastěji jsou identifikovány enteroviry (coxsackie viry skupiny B), parvoviry a herpetické viry [5]. Dále se uplatňují ECHO viry, viry influenzy, adenoviry, virus hepatitidy B. Z ostatních infekčních agens byly u myokarditid prokázány borrelie, Mycoplasma pneumoniae, rickettsie, aspergilová infekce, trypanosomy. Neinfekčními příčinami tohoto onemocnění jsou různá autoimunitní onemocnění nebo toxické lékové reakce. Virová myokarditida většinou proběhne ve třech fázích [6]. V první fázi infekce vstupuje genom viru do srdečních buněk, množí se a postupně aktivuje imunitní mechanismy. Následuje autoimunitní fáze s aktivací monocytů, uvolněním cytokinů, produkci protilátek, vytvořením imunokoplexů a aktivací T-lymfocytů a NK buněk. V třetí fázi může dojít vlivem cytokinů k reverzní remodelaci srdce, vývoji dilatační kardiomyopatie a progresivnímu srdečnímu selhání.
Myokarditida probíhá jako fulminatní, akutní nebo chronické onemocnění. Diagnostickým problémem je široké spektrum příznaků. Možný je zcela asymptomatický průběh, nespecifické příznaky, dysrytmie, známky srdečního selhání, kardiální šok s fatálním průběhem nebo náhlá smrt pacienta [7]. Pro pediatra je rovněž důležité, že klinické projevy závisí na věku dítěte. U novorozenců se akutní myokarditida může projevit nespecifickými příznaky celkové infekce, febriliemi, apatií, potížemi s krmením, apnoí, pocením nebo cyanózou. U starších dětí a adolescentů je klinika ještě více variabilní. Časté jsou nespecifické respirační nebo gastrointestinálni symptomy. Na myokarditidu upozorňuje bolest na hrudníku a tachykardie bez jiné zjevné příčiny. Varující jsou příznaky srdečního selhání s anamnézou předchozího virového infektu se subfebriliemi nebo febriliemi.
V diagnostice se uplatňuje vyjma standardního kardiologického vyšetření (EKG, echokardiografie) i možnost magnetické rezonance srdce (cardio MR-CMR). Používáme Lake Louise kritéria [8]. Základní CMR protokol pro vyšetření myokarditidy obsahuje T2 vážené skeny k detekci edému, dále hodnocení časného sycení – early gadolinium enhancement (EGE) a pozdního sycení myokardu – late gadolinium enhancement (LGE) [9]. V laboratoři je podstatná identifikace zvýšení hladin troponinu v krvi. Definitivní potvrzení diagnózy by přineslo provedení srdeční biopsie, mikroskopická diagnóza se pak stanovuje podle histopatologických a imunohistochemických kritérií [10, 11]. Onemocnění má velmi variabilní průběh, diagnostika patogena je obtížná, rozporuplné jsou diagnostické a terapeutické přístupy a prognóza je nejistá. Autoři představují „triplicitas casuum“ dospívajících chlapců s diagnózou akutní myokarditidy, kteří byli hospitalizováni v krátkém časovém období roku 2019.
KAUZISTIKY
Všichni tři pacienti byli přijati na Kliniku dětského lékařství Fakultní nemocnice Ostrava (KDL FNO) v průběhu 6 měsíců (duben až listopad 2019) s podezřením na akutní myokarditidu. Byli mužského pohlaví, měli téměř totožný věk a podobné bydliště v ostravském regionu.
Souhrn jejich symptomatologie, laboratorních hodnot troponinu (Troponin I-hs, norma 0–57 ng/l) a výsledků vyšetřovacích metod je uveden v tabulce 1.
Table 1. Souhrn anamnéz a vyšetření u všech pacientů. 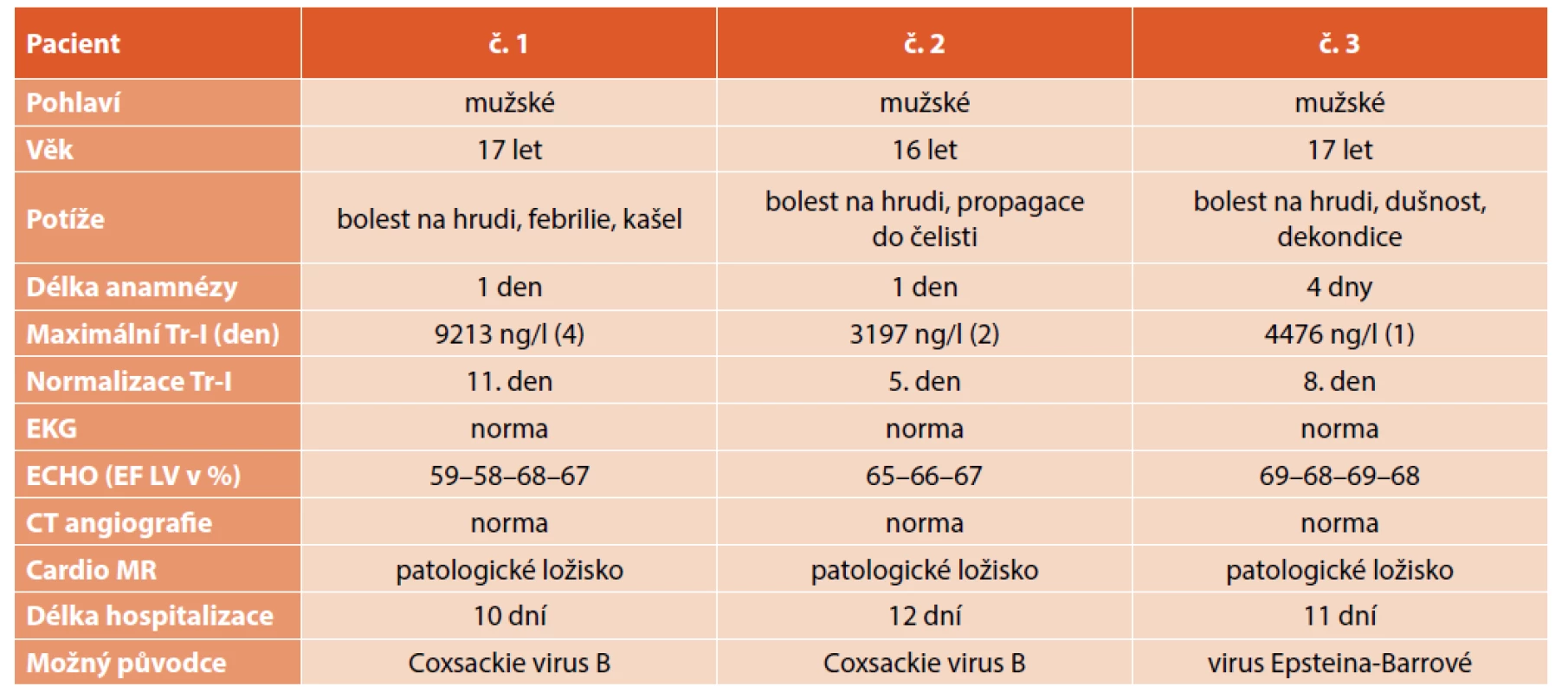
Tr I – Troponin I high sensitive, ECHO – echokardiografie, EF LV – ejekční frakce levé komory Případ č. 1
Sedmnáctiletý chlapec byl přijat pro náhle vzniklou bolest na hrudi, zimnici, suchý kašel a jednu febrilní špičku 40 °C na pracoviště mimo FNO. Klinickým projevům předcházela významná fyzická zátěž, nošení těžkých břemen na stavbě. Při přijetí byl kardiopulmonálně stabilní, bez klinických projevů srdečního selhávání. Ve vstupní laboratoři byl mírně zvýšen CRP (17 mg/l), vysoká hodnota troponinu (1733 ng/l). První kardiologické vyšetření provedl kardiolog pro dospělé, EKG křivka vykazovala nespecifické změny ST úseků v hrudních svodech bez jasných ischemických změn, echokardiografie (ECHO) prokázala normální ejekční frakci levé komory 58 % (norma >55 %). RTG hrudníku bylo bez patologického nálezu. Druhý den hospitalizace hladina troponinu stoupla na 8602 ng/l a pacient byl s diagnózou suspektní probíhající myokarditidy přeložen na pracoviště KDL FNO.
Vstupní EKG bylo identické jako na předešlém pracovišti, nedošlo k vývoji jasných ischemických změn, ECHO nevykazovalo strukturální nebo funkční patologii myokardu. Laboratoř potvrdila další vzestup troponinu na 9212 ng/l (4. den celkové hospitalizace), od této hodnoty troponin klesal k normalizaci 11. hospitalizační den. I přes progresi hodnot troponinu, bolesti na hrudi odezněly v průběhu 1. dne hospitalizace ve FNO, pacient byl dále již trvale afebrilní. Indikovali jsme CT angiografii a CMR srdce s pozdním sycením. CT angiografie nepopsala patologii koronárního řečiště. CMR neprokázala významnou poruchu systolické funkce, ejekční frakce levé komory (EF LV) byla 52 %. Dle sekvence T2 bylo identifikováno zvýšení signálu v segmentech 8–9 (anteroseptálně a inferoseptálně ve střední části komory) a 15–19 (dolní a laterální část apexu), které korelovalo s časným sycením EGE i pozdním sycením LGE intramyokardiálně s distribucí směrem subepikardiálně (obr. 1a, b). Pacient byl opakovaně kontrolován dětským kardiologem, EKG i ECHO nevykazovaly patologii. Ejekční frakce vzrostla na 67 %. V párové sérologii byly prokázány signifikantní titry (norma 8) protilátek ve virus neutralizačním testu (VNT) coxsackie viru B4, a to 64 … 128.
Obr. 1a. T1 GRE (Gradient-recall echo) sken v krátké ose srdeční s průkazem časného sycení subepikardiálně (šipka) v inferolaterálních segmentech.
Fig. 1a. T1W GRE scan in the short axis with early subepicardial enhancement (arrow) in inferolateral segments.
Obr. 1b. T1 sken v krátké ose srdeční technikou PSIR (Phasesensitive inversion recovery, sekvence k potlačení kontrastní látkou nasyceného myokardu) s detekcí intramyokardiálního až subepikardiálního sycení v opožděné fázi (šipka).
Fig. 1b. Short-axis T1W PSIR scan (IR sequence is used to suppress of saturated myocardium by contrast agency) with detection of the intramyocardial to subepicardial enhancement, the delayed phase (arrow).
Hospitalizace proběhla bez komplikací, specifická terapie ani antibiotika nebyla nutná. Hospitalizace trvala celkově 10 dní a pacient byl propuštěn v celkově dobrém stavu.
Případ č. 2
Sedmnáctiletý chlapec byl přijat na pracoviště KDL FNO s jednodenní anamnézou bolesti na hrudi s vyzařováním do čelisti. Potížím předcházel lehký respirační infekt týden před přijetím. Vstupní laboratoř prokázala zvýšenou hladinu troponinu (1965 ng/l), hraniční hodnotu kreatinkinázy (3,28 μkat/l) a téměř hraniční CRP (12 mg/l), ostatní laboratorní vyšetření byla bez odchylek. EKG křivka a RTG hrudníku byly bez patologie, pacient byl afebrilní, klinicky bez symptomatologie srdečního selhávání. Opakované kardiologické vyšetření vykazovalo normální EKG a ECHO. Provedená CT angiografie nedetekovala koronární patologii. Dle CMR byla průkazná mírná porucha systolické funkce – EF 45 %, dle T2 vážených skenů zvýšení signálu korelovalo v časném sycení v EGE i v opožděné fázi v LGE s distribucí jizvy intramyokardiálně a subepikardiálně, postiženy byly segmenty 3–4 (inferoseptálně až na dolní stěně báze levé komory) se zesílením perikardu a perikardiálním výpotkem 4–8 mm odpovídajícímu perimyokarditidě (obr. 2a, b, c, d). Sledování dynamiky hladin troponinu detekovalo maximální hladinu 3197 ng/l druhý den, další trend již byl klesající s normalizací 5. den hospitalizace.
Obr. 2a. T2 vážený sken s potlačením signálu tuku v dlouhé dvoudutinové ose srdeční detekuje zvýšený signál ve stěně levé komory bazálně, signál je zvýšen oproti svalovým strukturám (pektorální svaly).
Fig. 2a. T2W scan with the fat suppression in the long axis detects an increased signal in the left ventricular wall basally, the signal is increased compared to muscle structures (pectoral muscles).
Obr. 2b. T1 GRE sken v krátké ose srdeční s průkazem časného sycení subepikardiálně (šipka) inferoseptálně v typické distribuci pro zánětlivou infiltraci.
Fig. 2b. T1W GRE scan in the short cardiac axis with the detection of early enhancement subepicardially (arrow) inferoseptally, it is a typical distribution for inflammatory infiltration.
Obr. 2c. T1 PSIR sken v krátké ose srdeční s průkazem časného sycení subepikardiálně až intramyokardiálně (šipka) se zesílením naléhajícího perikardu.
Fig. 2c. T1W PSIR scan in the short xis with early enhancement subepicardially to intramyocardially (arrow), this figure shows enhancement of the pericardium too,
Obr. 2d. T1 PSIR sken v dvoudutinové dlouhé ose srdeční s průkazem časného sycení subepikardiálně až intramyokardiálně (šipka) – kolmá rovina zobrazení potvrzuje nález v ose krátké.
Fig. 2d. T1W PSIR scan in the two-chamber long axis with signal increasing of early enhancement subepicardially to intramyocardially (arrow) – the perpendicular plane of the image confirms the finding in the short axis.
Pacient byl po celou dobu oběhově stabilní, afebrilní, subjektivně již bez bolesti či pálení na hrudi. Specifická terapie nebyla indikována, propuštěn 12. den. V párové sérologii byly prokázány ve VNT (norma 8) titry 128…512 coxsackie viru B4, u sérotypu B1 pak 128…256, ostatní titry byly negativní a opakovaně nízké.
Případ č. 3
Šestnáctiletý aktivní sportovec měl čtyřdenní anamnézu bolestí na hrudi, slabosti a dekondice. Přijetí bylo indikováno na regionální pracoviště pro vývoj dušnosti. Symptomatologii předcházela kontuze hrudníku při sportu. Vstupní troponin byl 4476 ng/l, hraničně byly elevovány aminotransferázy, ostatní laboratorní hodnoty byly v normě. EKG nedetekovalo patologické změny, ECHO popsalo strukturálně normální srdce a normální ejekční frakci levé komory 70 %. Při CMR byla měřena mírná porucha systolické funkce, EF 41 %, průkazný byl zvýšený signál v T2 vážených skenech korelující s časným i pozdním sycením – EGE i LGE intramyokardiálně až subepikardiálně v S 4 (baze levé komory) (obr. 3a, b, c). Pro elevaci D-dimerů byla doplněna CT plic s angiografií, bez průkazu embolie nebo koronární patologie. První hladina troponinu byla nejvyšší, při kontrolách troponin klesal s normalizací 8. den. Pacient byl z kardiálního hlediska bez potíží a bez kardiopulmonální dekompenzace, došlo ale k vývoji bolestí v krku s rozvojem tonzilitidy s retencemi, klinicky dominovala výrazná krční lymfadenitida. V laboratoři se objevila leukocytóza s reaktivními lymfocyty, elevace ALT (7,2 μkat/l), AST (3,93 μkat/l), LD (12,98 μkat/l). Klinický obraz se rozvinul do infekční mononukleózy.
Obr. 3a. T1 GRE sken v krátké ose srdeční s průkazem časného sycení subepikardiálně (šipka) inferoseptálně až inferiorně – aktivní zánětlivé změny.
Fig. 3a. T1W GRE scan in short cardiac axis with evidence of the early saturation subepicardially (arrow) inferoseptally to inferiorly – active inflammatory changes.
Obr. 3b. T1 PSIR sken v krátké ose srdeční s průkazem časného sycení intramyokardiálně (šipka) – typická distribuce pro jizvení.
Fig. 3b. T1W PSIR scan in short axis with detection of the early intramyocardial saturation (arrow) – typical distribution for scarring.
Obr. 3c. T1 PSIR sken v double outlet projekci v dvoudutinové dlouhé ose srdeční s korelátem časného sycení intramyokardiálně (šipka) v kolmé ose na osu krátkou.
Fig. 3c. T1W PSIR scan in double outlet plane in the two-chamber long axis with the correlate of early saturation intramyocardially (arrow) in the perpendicular axis to the short axis.
Primoinfekce virem Epsteina-Barrové (EBV) byla prokázána virémií (PCR) i sérologicky (nízkoaviditní IgG). Terapie byla nespecifická, analgetika byla doplněna hepatoprotektivy. Dimise nastala 11. den hospitalizace.
DISKUSE
Zánětlivé postižení srdce je svou podstatou významné onemocnění, klinická zrádnost akutní myokarditidy spočívá ve velmi variabilním průběhu. Možné je zcela asymptomatické onemocnění nebo naopak vývoj srdečního selhání a náhlá smrt pacienta. Incidence myokarditid v populaci se obtížně vyjadřuje právě pro asymptomatické nebo nespecifické formy. Velké přehledy nejčastěji uvádějí populační výskyt 10–20 na 100 000 obyvatel [12]. Přes koncentraci této diagnózy na pracoviště FNO se pro malý počet případů k incidenci myokarditidy u dětí v regionu Moravskoslezského kraje nelze přesně vyjádřit. Lze ale posoudit počet hospitalizovaných. V obsáhlejších pediatrických souborech tvoří akutní myokarditidy přibližně 0,3 případů na 1000 hospitalizací [13]. V našem případě pak pacienti tvořili výskyt 1,4 případů na 1000 hospitalizací a rok, číslo bylo vyšší pravděpodobně pro nezvyklou kumulaci případů. Postižení myokardu je prokázáno až u 5 % virových onemocnění [14]. Maximum akutních myokarditid se vyskytuje v kojeneckém a adolescentním věku, v některých studiích je prokazována afinita k mužskému pohlaví [15, 16].
Publikované práce popisují značnou variabilitu hlavních klinických příznaků. Epidemiologické studie uvádějí, že 2/3 pacientů přicházejí k vyšetření s dyspnoí, u přibližně 1/3 jsou bolesti na hrudi nebo dysrytmie [17]. Všichni naši chlapci měli jako hlavní symptom bolest na hrudi. Vzhledem k věku logicky odpovídají spíše studiím u dospělých pacientů, kteří mají koronární syndrom většinou jako hlavní znak průběhu akutní myokarditidy [18]. Bolest na hrudi se při myokarditidě prakticky nevyskytuje u dětí pod 10 let. Většina dětských pacientů s akutní myokarditidou má v úvodu respirační příznaky a je diagnostikovaná jako pneumonie nebo asthma bronchiale. Respirační symptomatologie může být potencována nebo způsobena již probíhajícím srdečním selháváním. Myokarditida může probíhat pod nespecifickými příznaky nebo s gastrointestinálními symptomy. Varující je tachykardie a známky kardiální dekompenzace. U všech našich pacientů vstupní příznaky ale rychle odezněly, při monitoraci na JIP jsme již nepozorovali žádné klinické zhoršení.
Při podezření na myokarditidu je většinou prvním krokem zhodnocení laboratorních parametrů. Potvrzujeme mírně zvýšený CRP, který je vyšší přibližně u poloviny pacientů, nespecificky může být vyšší aktivita laktátdehydrogenázy a aminotransferáz, zejména AST se ukazuje jako užitečný a senzitivní marker pro myokarditidu [13]. Vysokou senzitivitu a specificitu má vyšetření troponinu, který je odrazem myokardiálního poškození [19]. Troponin je jednoznačně senzitivnější marker než CK-MB, na našem pracovišti již vyšetření CK-MB z kardiologického pohledu nevyžadujeme. Na našich pracovištích FNO v současnosti stanovujeme hladinu troponinu I hs (high sensitivity), naši pacienti dosahovali „tisícových“ hodnot, s maximy do 4. dne od počátku onemocnění. Zajímavý je poměrně pomalý pokles hodnot troponinu, i přes jasné zlepšení stavu jsme normální hodnoty zaznamenali u dvou případů až 2. týden hospitalizace. U dětí je patologická hodnota troponinu považována za průkaz probíhajícího onemocnění, přesto i u akutní myokarditidy může být hladina troponinu normální [20].
Tři uvedení chlapci byli vyšetřeni a monitorování dětským kardiologem. Celkově 80–95 % pacientů s myokarditidou má na EKG změny ST-T úseků, změny voltáží, známky hypertrofie, deviace elektrické osy, srdečních blokád [21]. Naši pacienti toto nepotvrzovali, navzdory vysokým hladinám troponinu byla EKG u všech bez jasných změn, u jednoho byly známky elevace ST úseků minimální a sporné, EKG křivky nepřispěly k dalšímu posunu v diagnostice. Echokardiografie je v případě tohoto onemocnění nespecifické vyšetření. Jeho úlohou je vyloučit jiné strukturální onemocnění srdce, výpotky a popsat systolickou a diastolickou funkci srdce [7]. Podstatný je trend vyšetřovaných parametrů, echokardiografie ale může přispět k identifikaci fulminantního průběhu [22]. Naši chlapci měli ECHO normální, nezaznamenali jsme prosáknutí ani edém, který je většinou septální. U prvního jsme identifikovali nižší ejekční frakci levé komory v začátku onemocnění se spontánní úpravou.
Vzhledem k věku bylo nutno vyloučit i koronární onemocnění. Indikace ke klasické katetrizační koronární angiografii je v dětském věku málo častá, u všech jsme ale doplnili neinvazivní CT angiografii s normálním nálezem na koronárním řečišti, které bývá u akutní myokarditidy většinou intaktní [23].
Zlatý standard pro stanovení akutní myokarditidy je endomyokardiální biopsie (EMB) [24]. Nejčastěji se bioptuje pravá komora cestou femorální žíly, méně často přes jugulární vénu, možná je i biopsie levé komory cestou arterie nebo venózně a pak v síních transseptálně [25]. Původní histopatologické hodnocení dle Dallaských kritérií (identifikace lymfocytárního infiltrátu spojeného s nekrózou a poškozením, které neodpovídá ischémii) bylo postupně rozšířeno o imunohistochemické vyšetření infiltrovaných leukocytů, tzv. Margburská kritéria (hodnocení počtu mononukleárních lymfocytů) a další parametry v dalších studiích (přítomnost T lymfocytů, hodnocení počtu monocytů) [10, 26, 27].
EMB je pro definitivní potvrzení myokarditidy nezbytná. Kromě vlastní diagnózy umožňuje přesnější typizaci zánětu a identifikaci infekčního patogena. U dospělých je vytvořena řada indikací nebo situací, kdy provádíme EMB. Indikace jsou nejčastěji vztahovány na nevysvětlitelné (po vyloučení specifických příčin) selhávání spojené s normální nebo dilatovanou levou komorou a arytmiemi. EMB má akutní a pozdní rizika. Mezi akutní patří perforace srdeční stěny, akutní tamponáda, poškození chlopně, vyvolání dysrytmie nebo srdečního bloku, pneumotorax, poškození velkých tepen, plicní embolizace. Mezi pozdní komplikace nejčastěji patří krvácení z místa přístupu, hluboká žilní trombóza a následky poškození trikuspidálního ústí [28]. EMB u dětí ve stabilním stavu rutinně neprovádíme, rizika převyšují zisk, vyšetření je relativně málo výtěžné. Ve vzorku nemusí být postižený myokard, biopsie je vyžadována minimálně ze tří míst myokardu, rizikem výkonu jsou mnohé komplikace a negativní EMB nevylučuje probíhající myokarditidu [29].
Dle některých doporučení je EMB možné indikovat u dětí ve stejných indikacích jako u dospělých [30]. Přesné načasování EMB je ale u dětí s neobjasněnou dysfunkcí levé komory zatím kontroverzní a při minimální symptomatologii není jasná její výhoda. Možné postupy a indikace ale existují i v dětském věku. U hemodynamicky stabilních pacientů je možno EMB indikovat při ejekční frakci levé komory menší než 45 % a pozitivním CMR pro myokarditidu, pokud nedojde ke zlepšení během 2–3 měsíců. U hemodynamicky nestabilních dětí, po úvodní 24hodinové stabilizaci, můžeme EBM provést během následujících 72 hodin. Děti v kardiogenním šoku mohou vyžadovat mechanickou srdeční podporu nebo extrakorporální membránovou oxygenaci a biopsii můžeme provést během zavádění těchto invazivních procedur [28]. U fulminantních průběhů je EMB doporučena, u některých typů myokarditidy je objasnění etiologie důležité. Obrovskobuněčná a nekrotizující eozinofilní myokarditida mají riziko vysoké mortality, ale dobrou odpověď na kortikosteroidy. Lymfocytární a hypersenzitivní myokarditida mají zase lepší prognózu. Hypersenzitivní myokarditida při reakci na jinou léčbu má rovněž dobrou odpověď na kortikoidy a navíc ji lze ovlivnit odstraněním nebo modifikací původní medikace [31]. Objasnění typu myokarditidy může vést ke specifické terapii, upřesnění prognózy, zařazení pacienta na čekací listinu k transplantaci nebo k indikaci mechanické podpory [7]. Potvrzení nebo vyloučení virového genomu, nejčastěji polymerázovou řetězovou reakcí, je podstatné před zahájením imunosupresivní terapie [30, 32]. Naši pacienti měli stabilní a dobrou funkci levé komory a nevykazovali klinickou alteraci, EMB jsme neindikovali.
Standardem se v poslední době stalo neinvazivní vyšetření magnetickou rezonancí (Lake Louise kritéria). V CMR jsme v T2 vážených skenech s potlačením tuku schopni detekovat edém myokardu, hodnotit časné sycení včetně dynamického skenu průchodu kontrastní látky myokardem – early gadolinium enhancement – EGE, který ovlivňuje hyperemie a infiltrace zánětlivými buňkami s možným kapilárním únikem. Tento znak umožňuje rozhodnout mezi akutní a chronickou formou nemoci. Velmi významnou sekvencí k posouzení přítomnosti nekrózy myocytů a fibrózy je opožděné sycení v sekvenci s potlačením signálu zdravého nasyceného myokardu (IR – inversion recovery s proměnným inverzním časem dle postupného dosycování sekvence PSIR - fázově senzitivní IR a sekvence magnitudová) – late gadolinium enhancement (LGE). Rozhodnutí o původu jizvení je podmíněno umístěním jizvy ve stěně srdeční komory. CMR obraz myokarditidy se liší od obrazu ischemického poškození [33]. Na rozdíl od ischemického poškození, u kterého je nejčastějším poškozením subendokardiální a transmurální léze, je typickou lokací pro myokarditidu léze subepikardiální až intramyokardiální s různou mírou zasažení stěny, toto potvrzujeme i u našich pacientů. Typickými oblastmi pro průkaz pozdního sycení jsou anterolaterální a posterolaterální segmenty levé komory – tzv. neischemická regionální distribuce. Souhlasným znakem v diagnóze myokarditidy je i přítomnost perikardiálních efuzí. Důležitou součástí CMR je zobrazení kinematickými sekvencemi (T1/T2 balancované echo), které umožní posoudit systolickou funkci srdeční komory a kalkulovat funkční parametry [34].
U všech našich případů CMR kalkulovala nižší ejekční frakci levé komory než echokardiografie. Všichni naši pacienti byli vyšetřeni v akutní fázi onemocnění, pro tyto CMR vykazuje nejvyšší senzitivitu, kardiomyopatické formy vykazují senzitivitu nižší, a proto je snaha rozšířit Lake Luise kritéria o další parametry zobrazení – T1 a T2 mapping (detekce intracelulárních změn spojená se zvýšením extracelulárního objemu, které prodlužuje T2 relaxační čas) [8]. Pro CMR u dětí je důležité, že transmurální sycení spojené s globální hypokinézou, dilatací levé komory s její ejekční frakcí pod 30 % je spojeno se špatnou prognózou [35]. Zároveň pozitivní pozdní sycení LGE je považováno za nezávislý prediktor budoucího remodelingu srdce [36]. Všichni naši pacienti měli LGE pozitivní, po ukončení hospitalizace byli již minimálně 1x zkontrolováni ultrazvukovým vyšetřením, dle ECHO zatím k žádnému remodelingu nedošlo. Odstup od onemocnění je ale u všech velmi krátký.
Příčinou myokarditidy je nejčastěji virové infekční agens [37]. Subklinické formy mohou být poměrně časté, běžně se však nezachytí. Závažné průběhy jsou vzácné. Mechanismy vzniku jsou přímé poškození patogenem, např. coxsackie viry, toxémií (Corynebacterium diphteriae) nebo autoimunitně zprostředkované (revmatická karditida) či nespecifické dopady v důsledku postižení endotelu (viry hepatitidy B, C, malárie, sepse včetně mykotické). Jako nejčastější infekční agens byly uváděny coxsackie viry skupiny B. Vztah k myo(peri)karditidám mají zejména sérotypy B1–B6. Jejich replikace v myocytu vede k nekróze, expozici intracelulárních antigenů typu myozinu a aktivaci imunitního systému. Tento mechanismus může vést k vývoji dilatační kardiomyopatie [38].
V posledních letech je patrný posun identifikace virových patogenů směrem k parvovirům (B19) a herpetickým virům [39]. Tyto viry mají jiný mechanismus účinku, napadají endotel cév a způsobující endoteliální dysfunkci. U dvou ze tří uvedených pacientů jsme nepřímo sérologicky potvrdili coxsackie viry. Jsou vysoce nakažlivé se sezonním maximem na konci léta, pak jejich výskyt s postupujícím podzimem klesá. Přenášejí se fekálně-orální cestou a spektrum jejich projevů je různorodé. Většinou se tyto virózy projeví tlakem za hrudní kostí, poruchami srdečního rytmu, nevolností, bolestí hlavy a horečkou [40]. U našich pacientů dominovala bolest na hrudi s rychlou úpravou. U jednoho pacienta jsme prokázali EB virus. U EB virové infekční mononukleózy jsou manifestní myokarditidy možné, popsané jsou i fulminantní průběhy nebo poruchy srdečního rytmu s letálním zakončením [41]. Manifestní myokarditidy jsou u EB infekce popisovány již v akutní fázi onemocnění, u našeho pacienta projevy myokarditidy předcházely vývoji klasického klinického projevu infekční mononukleózy. U hospitalizovaných pacientů bývá trvání kardiálních změn kratší, pro klidový režim s přispěním kortikoidů, omezující edém a infiltraci srdečního svalu reaktivními lymfocyty [42]. I náš případ byl bez komplikací, kortikoidy jsme zvažovali, ale nakonec neindikovali.
Prognóza je nejistá. Zásadní je vývoj dysfunkce myokardu, její trvání a úprava. Ejekční frakce levé komory menší než 30 % a významná mitrální regurgitace jsou spojeny s vývojem těžkého srdečního selhání [43]. Mortalita je vyšší v novorozeneckém a časném věku. Děti mají častěji fulminantní průběh než dospělí, tato forma má ale po překonání lepší prognózu než akutní průběh [41]. Celková mortalita v dětském věku se pohybuje okolo 10 %, úplně uzdravení je dokumentováno u 2/3 pacientů [44]. Přibližně 10 % dětí vyžaduje v pozdějším věku transplantaci srdce pro vývoj dilatační kardiomyopatie a chronického srdečního selhávání.
Hospitalizace všech našich pacientů byla bez komplikací. Léčba akutní myokarditidy je stále s mnoha otázkami. U mírných průběhů, stejných jako u našich případů, postačí klid na lůžku, monitorace vitálních funkcí, přijetí k hospitalizaci je ale vždy indikováno [29]. Nedoporučujeme nesteroidní antiflogistika. U pacientů s projevy srdečního selhávání a poruchou funkce levé komory je indikována podpůrná terapie. Vazodilatační terapie zahrnuje inhibitory angiotenzin konvertujícího enzymu, blokátory angiotenzinových receptorů, antagonisty aldosteronu, diuretika. Po stabilizaci stavu můžeme použít betablokátory. Digoxin v akutní fázi nepoužíváme, je ho možné ale indikovat pro chronickou léčbu. Při významném srdečním selhání je nutná inotropní podpora dobutaminem, dopaminem, milrinonem nebo levosimendanem, při kritické terapii adrenalinem. Nutná je terapie dysrytmií, výhodný se jeví amiodaron. U závažných a fulminantních forem bychom měli zvážit včasný transport do kardiocentra. Zde je možno, vyjma intenzivní farmakologické terapie, poskytnout i srdeční stimulaci, provést biopsii, zavést mechanickou srdeční podporu nebo extrakorporální membránovou oxygenaci. Poslední dvě metody mohou poskytnout časový interval k transplantaci srdce, která může být do budoucna u pacienta jediným řešením.
Specifická terapie myokarditid je stále diskutována [44]. Imunosupresiva rutinně nepoužíváme, potlačení imunologické odpovědi a perzistence viru v srdci je pro pacienta rizikem. Tato terapie je jasně ale indikována u obrovskobuněčné a eozinofilní myokarditidy, diagnóza by měla být stanovena dle EMB. U chronických forem myokarditid je možné použít kombinaci prednizonu a azathioprinu. Nutné je ale potvrzení trvání zánětu dle CMR a vyloučení perzistující virové infekce biopsií. Z možností imunomodulační terapie jsou u dětí nejčastěji použity imunoglobuliny. Předpoklad je, že dochází k potlačení imunologické odpovědi a odstranění produkovaných cytokinů a viru. Jejich použití je stále diskutabilní, není doložen jasný efekt u dospělých, ani u dětských pacientů. Zároveň mají minimální nežádoucí účinky a tak jsou na řadě pracovišť v akutní fázi myokarditidy používány [7, 45, 46]. Jasný účinek zatím není doložen ani u imunoadsorpce. Antivirotická terapie sice snižuje replikaci viru, problémem je včasnost diagnózy. Myokarditida se klinicky většinou projevuje až po inciální fázi virového onemocnění a podání antivirotik je již málo přínosné. Léčba interferonem může mít efekt u adenovirové nebo enterovirové etiologie. Opět má ale efekt jen v časné fázi onemocnění a může podporovat vznik autoimunitních reakcí.
U našich kazuistických případů se největším problémem nakonec ukázalo přijetí poučení pacienty při propuštění. Fyzickou aktivitu omezujeme na dobu 6 měsíců, či do ústupu zánětu v kontrolní EMB, anebo do restituce funkce levé komory [8]. Všichni byli aktivní sportovci a inklinovali k brzkému návratu ke sportu. V případě proběhlé akutní myokarditidy ale nelze doporučit aktivní sport po dobu minimálně 6–12 měsíců. Některé práce uvádějí restituci myokardu v období dalších 3–7 let [14]. Vzhledem k normální funkci levé komory během hospitalizace a následných kontrol předpokládáme dobré zotavení. Všem byla nabídnuta další péče, pravidelné kontroly dětským kardiologem a kontrolní CMR s větším odstupem.
ZÁVĚR
Akutní myokarditida je potenciálně závažné onemocnění. Nejčastější etiologie je virová. U dospívajících je nejčastějším příznakem bolest na hrudi, stejně jako u dospělých. Největší roli v diagnostice má stanovení hladiny troponinu v krvi a magnetická rezonance srdce dle stanovených doporučení. Endomyokardiální biopsii u dětí rutinně neprovádíme, ale i v dětském věku má své indikace. Při zachované funkci levé komory je průběh většinou bez komplikací a prognóza dobrá.
Pacienti s prodělanou myokarditidou vyžadují další sledování. Návrat ke sportu doporučujeme nejdříve za 6 měsíců po prodělaném onemocnění.
Použité zkratky:
CMR – cardio magnetic resonance (magnetická rezonance srdce a cév)
CT – computed tomography (výpočetní tomografie)
EF LV – ejekční frakce levé komory
EGE – early gadolinium enhancement (časné sycení gadoliniem)
ECHO – echokardiografie
EKG – elektrokardiogram
EMB – endomyokardiální biopsie
GRE – gradient-recall echo
KDL FNO – Klinika dětského lékařství Fakultní nemocnice Ostrava
LGE – late gadolinium enhancement (pozdní sycení gadoliniem)
PSIR – phase-sensitive inversion recovery
VNT – virus neutralizační test
Došlo: 20. 5. 2020
Přijato: 10. 7. 2020
Korespondující autor:
MUDr. Jan Pavlíček, Ph.D.
Klinika dětského lékařství
Fakultní nemocnice Ostrava
17. listopadu 1790/5
708 52 Ostrava-Poruba
e-mail: jan.pavlicek@fno.cz
Sources
1. Levine MC, Klugman D, Teach SJ. Update on myocarditis in children. Curr Opin Pediatr 2010; 22 (3): 278–283.
2. Ukimura A, Kishi K, Yamada T, et al. National survey of influenza myocarditis in Japanese children in three season. Clin Microbial 2014; 3 : 143.
3. Feigin VL, Roth GA, Naghavi M, et al. Global burden of stroke and risk factors in 188 countries, during 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet Neurol 2016; 15 (9): 913–924.
4. Stiller B. Managment of myocarditis in children: the current situation. Adv Exp Med Biol 2008; 609 : 196–215.
5. Chaloupecký V, et al. Dětská kardiologie. Praha: Galén, 2006.
6. Breinholt JP, Moulik M, Dreyer WJ, et al. Viral epidemiologic shift in inflammatory heart disease: the interesting involvement of parvovirus B19 in the myocardium of pediatric cardiac transplant patients. J Heart Lung Transplant 2010; 29 : 739–746.
7. Kunovský P, Olejník P. Diagnostika a liečba akútnej myokarditídy u detí. Pediatr Prax 2019; 20 (3): 122–127.
8. Krejčí J, Poloczková H. Inflammatory myocardial disease. Vnitr Lek 2019; 65 (10): 636–642.
9. Banka P, Robinson JD, Uppu SC, et al. Cardiovascular magnetic resonance techniques and findings in children with myocarditis: a multicenter retrospective study. J Cardiovasc Magn Reson 2015; 17 : 96.
10. Caforio AL, Pankuweit, S, Arbustini E, et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J 2013; 34 (33): 2636–2648.
11. Aretz HT. Myocarditis: the Dallas criteria. Hum Pathol 1987; 18 (6): 619–624.
12. Vos T, Barber RM, Bell B, et al. Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet 2015; 386 (9995): 743–800.
13. Freedman SB, Haladyn JK, Floh A, et al. Pediatric myocarditis: emergency department clinical findings and diagnostic evaluation. Pediatrics 2007; 120 (6): 1278–1285.
14. Al-Akchar M, Kiel J. Acute Myocarditis. In StatPearls 2018. https: //www.ncbi.nlm.nih.gov/books/NBK441847/.
15. Magnani JW, Danik HJS, Dec Jr GW, DiSalvo TG. Survival in biopsy-proven myocarditis: a long-term retrospective analysis of the histopathologic, clinical, and hemodynamic predictors. Am Heart J 2006; 151 (2): 463–470.
16. Caforio AL, Calabrese F, Angelini A, et al. A prospective study of biopsy-proven myocarditis: prognostic relevance of clinical and aetiopathogenetic features at diagnosis. Eur Heart J 2007; 28 (11): 1326–1333.
17. Hufnagel G, Pankuweit S, Richter A, et al. The European Study of Epidemiology and Treatment of Cardiac Inflammatory Diseases (ESETCID). First epidemiological results. Herz 2000; 25 (3): 279–285.
18. Mahrholdt H, Wagner A, Deluigi CC, et al. Clinical perspective. Circulation 2006; 114 (15): 1581–1590.
19. Soongswang J, Durongpisitkul K, Nana A, et al. Cardiac troponin T: a marker in the diagnosis of acute myocarditis in children. Pediatr Cardiol 2005; 26 (1): 45–49.
20. Simpson KE, Canter CE. Acute myocarditis in children. Expert Rev Cardiovasc Ther 2011; 9 (6): 771–783.
21. Kane DA, Fulton DR, Saleeb S, et al. Needles in hay: chest pain as the presenting symptom in children with serious underlying cardiac pathology. Congenit Heart Dis 2010; 5 (4): 366–373.
22. Felker GM, Boehmer JP, Hruban RH, et al. Echocardiographic findings in fulminant and acute myocarditis. J Am Coll Cardiol 2000; 36 (1): 227–232.
23. Schultz JC, Hilliard AA, Cooper Jr LT, Rihal CS. Diagnosis and treatment of viral myocarditis. Mayo Clin Proc 2009; 84 (11): 1001–1009.
24. Dominguez F, Kühl U, Pieske B, et al. Update on myocarditis and inflammatory cardiomyopathy: reemergence of endomyocardial biopsy. Rev Esp Cardiol (Engl Ed) 2016; 69 (2): 178–187.
25. Zhorne D, Petit CJ, Ing FF, et al. A 25‐year experience of endomyocardial biopsy safety in infants. Catheter Cardio Interv 2013; 82 (5): 797–801.
26. Maisch B, Bultman B, Factor S, et al. World Heart Federation consensus conference‘s definition on inflammatory cardiomyopathy (myocarditis): report from two expert committees on histology and viral cardiomyopathy. Heartbeat 1999; 4 : 3–4.
27. Frustaci A, Russo MA, Chimenti C. Randomized study on the efficacy of immunosuppressive therapy in patients with virus-negative inflammatory cardiomyopathy: the TIMIC study. Eur Heart J 2009; 30 : 1995–2002.
28. Das BB. Role of endomyocardial biopsy for children presenting with acute systolic heart failure. Pediatr Cardiol 2014; 35 (2): 191–196.
29. JCS Joint Working Group. Guidelines for diagnosis and treatment of myocarditis. Circ J 2011; 1102021098-1102021098.
30. Cooper LT, Baughman KL, Feldman AM, et al. The role of endomyocardial biopsy in the management of cardiovascular disease: a scientific statement from the American Heart Association, the American College of Cardiology, and the European Society of Cardiology Endorsed by the Heart Failure Society of America and the Heart Failure Association of the European Society of Cardiology. J Am Coll Cardiol 2007; 50 (19): 1914–1931.
31. From AM, Maleszewski JJ, Rihal CS. Current status of endomyocardial biopsy. Mayo Clin Proc 2011; 86 (11): 1095–1102.
32. Mahrholdt H, Goedecke C, Wagner A, et al. Cardiovascular magnetic resonance assessment of human myocarditis: a comparison to histology and molecular pathology. Circulation 2004; 109 (10): 1250–1258.
33. Sparrow PJ, Merchant, N, Provost YL, et al. CT and MR imaging findings in patients with acquired heart disease at risk for sudden cardiac death. Radiographics 2009; 29 (3): 805–823.
34. Friedrich MG, Sechtem U, Schulz-Menger J, et al. Cardiovascular magnetic resonance in myocarditis: A JACC White Paper. J Am Coll Cardiol 2009; 53 (17): 1475–1487.
35. Vashist S, Singh GK. Acute myocarditis in children: current concepts and management. Curr Treat Options Cardiovasc Med 2009; 11 (5): 383–391.
36. Natale L, De Vita A, Baldari C, et al. Correlation between clinical presentation and delayed-enhancement MRI pattern in myocarditis. Radiol Med 2012; 117 (8): 1309–1319.
37. Feldman A, McNamara D. Myocarditis. N Engl J Med 2000; 343 : 1388–1398.
38. Fairweather D, Stafford KA, Sung YK. Update on Coxsackie B3 myocarditis. Curr Opin Rheumatol 2012; 24 : 401–407.
39. Ginsberg F, Parrillo JE. Fulminant myocarditis. Crit Care Clin 2013; 29 (3): 465–483.
40. Beneš J, et al. Infekční lékařství. 1. vyd. Praha: Galén, 1990 : 1–442.
41. Amabile N, Fraisse A, Bouvenot J, et al. Outcome of acute fulminant myocarditis in children. Heart 2006; 92 (9): 1269–1273.
42. Kouba K, et al. Infekční mononukleóza. Praha: Avicenum, 1988 : 126–129.
43. Kühn B, Shapiro ED, Walls TA, Friedman AH. Predictors of outcome of myocarditis. Pediatr Cardiol 2004; 25 (4): 379–384.
44. English RF, Janosky JE, Ettedgui JA, Webber SA. Outcomes for children with acute myocarditis. Cardiol Young 2004; 14 (5): 488–493.
45. McNamara DM, Holubkov R, Starling RC, et al. Controlled trial of intravenous immuneglobulin in recent-onset dilated cardiomyopathy. Circulation 2001; 103 : 2254–2259.
46. Klugman D, Berger JT, Sable CA, et al. Pediatric patients hospitalized with myocarditis: a multi-institutional analysis. Pediatr Cardiol 2010; 31 (2): 222–228.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2021 Issue 1-
All articles in this issue
- Česko-slovenská pediatrie v roce 2021
-
Syndrom multisystémové zánětlivé odpovědi asociovaný s COVID-19 u dětí
Doporučený postup České pediatrické společnosti ČLS JEP - Naše skúsenosti s pediatrickým multisystémovým zápalovým syndrómom asociovaným s COVID-19 (PIMS-TS)
- Akutní myokarditida u dospívajících
- Předčasně narozené dítě
- Sekulární trend tělesného růstu a vývoje chlapců a dívek od 6 do 14 let v českých zemích za období 120 let (1895–2015)
- Dítě s VACTERL asociací – management diagnostiky a terapie orofaryngeální dysfagie
- Aktuální diagnostická kritéria neonatální sepse a systémové zánětlivé odpovědi u plodu a novorozence
- DĚDIČNÉ NÁDOROVÉ SYNDROMY V DĚTSKÉ ONKOLOGII
- Biomarkery v diagnostice neonatální sepse
- Význam vyšetření očního pozadí u akutních stavů v pediatrii
- Prof. MUDr. Jan Janda, CSc., osmdesátiletý
- Doc. MUDr. Jozef Hoza, CSc. – 80 let
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dítě s VACTERL asociací – management diagnostiky a terapie orofaryngeální dysfagie
- Aktuální diagnostická kritéria neonatální sepse a systémové zánětlivé odpovědi u plodu a novorozence
- Akutní myokarditida u dospívajících
- Naše skúsenosti s pediatrickým multisystémovým zápalovým syndrómom asociovaným s COVID-19 (PIMS-TS)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

