-
Medical journals
- Career
Naše skúsenosti s pediatrickým multisystémovým zápalovým syndrómom asociovaným s COVID-19 (PIMS-TS)
Authors: M. Igaz 1; M. Kostková 1; T. Bělohlávek 2; F. Olekšák 1; M. Jeseňák 1; Peter Bánovčin 1
Authors‘ workplace: Klinika detí a dorastu, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Univerzitná nemocnica Martin, Slovensko 1; Klinika detskej anesteziológie a intenzívnej medicíny, Jesseniova lekárska fakulta v Martine, Univerzita Komenského v Bratislave, Univerzitná nemocnica Martin, Slovensko 2
Published in: Čes-slov Pediat 2021; 76 (1): 10-17.
Category:
Overview
Ochorenie COVID-19 prebieha v detskej populácii obvykle asymptomaticky alebo s ľahkým priebehom. Je to spôsobené najmä chýbaním iných ochorení, ktoré by mohli svojou klinickou manifestáciou stav zhoršiť, ale napríklad aj vplyvom androgénov na expresiu ACE2 receptoru. Počet hospitalizácií detských pacientov s akútne prebiehajúcim ochorením COVID-19 je od začiatku pandémie nízky. V apríli 2020 však Svetová zdravotnícka organizácia upozornila na zvyšujúci sa počet hospitalizácií detských pacientov najmä na jednotkách intenzívnej starostlivosti s klinickou symptomatológiou podobnou sepse, Kawasakiho syndrómu, syndrómu toxického šoku alebo syndrómu aktivovaných makrofágov (MAS). Stav bol asociovaný s akútne prebiehajúcou alebo s prekonanou infekciou SARS-CoV-2.
Autori prezentujú dve kazuistiky detských pacientov s plne vyznačenou klinickou symptomatológiou pediatrického multisystémového zápalového syndrómu. V klinickom obraze dominovali febris remittens, kardiálna insuficiencia, non-purulentná konjuktivitída, palmárny a plantárny erytém, exantém. V laboratórnych parametroch bola prítomná vysoká zápalová aktivita a pozitívne protilátky proti SARS-CoV-2 v triede IgG. Liečení boli intravenóznymi imunoglobulínmi, systémovými kortikoidmi, antikoagulanciami a antiagreganciami. Bola potrebná vazoaktívna a inotropná podpora, v jednom prípade umelá pľúcna ventilácia. Adekvátny efekt imunosupresívnej a následnej imunomodulačnej liečby bol pozorovaný u oboch pacientov.
Klíčová slova:
COVID-19, PIMS-TS, pediatrický multisystémový zápalový syndróm
ÚVOD
Ochorenie COVID-19 má v detskej populácii obvykle benígny priebeh s miernymi, prípadne žiadnymi klinickými prejavmi. V porovnaní s dospelými pacientami sa u detských pacientov len zriedka stretávame so syndrómom náhleho respiračného zlyhania a pneumóniou s nutnosťou podpornej ventilácie [1]. Ochorenie môže mať závažný priebeh najmä v rizikových skupinách dospelých pacientov vo vyššom veku a s prítomnými komorbiditami (napr. obezita, kardiovaskulárne ochorenie, diabetes mellitus). Pre porovnanie, počet hospitalizovaných detských pacientov bol v Spojených štátoch amerických 8 na 100 000 obyvateľov. U dospelých pacientov bol tento pomer 164,5 na 100 000 obyvateľov. Zaujímavosťou však je, že 1 z 3 detských pacientov, ktorí boli hospitalizovaní, bol prijatý na jednotku intenzívnej starostlivosti. Takmer rovnaký pomer hospitalizácií na jednotky intenzívnej starostlivosti vzhľadom k počtu hospitalizovaných sa pozoruje aj u dospelých pacientov [2].
Od apríla 2020 sa v literatúre postupne začali objavovať informácie o detských pacientoch so závažnou multisystémovou symptomatológiou spojenou so šokovým stavom, imitujúcou septický šok s vysokou zápalovou aktivitou a známkami kardiálneho zlyhávania u predtým zdravých detí. Celkovo tento stav imitoval príznaky Kawasakiho syndrómu, syndrómu toxického šoku, sepsu či syndrómu aktivovaných makrofágov [3]. Zásadným rozdielom je však dokázaná anamnestická alebo prebiehajúca infekcia vírusom SARS-CoV-2 (pozitivita polymerázovej reťazovej reakcie – polymerase chain reaction – PCR testu, antigénového testu alebo pozitivita protilátok v triede IgM a/alebo IgG) alebo minimálne jasná epidemiologická súvislosť, teda úzky kontakt s SARS-CoV-2 pozitívnou osobou [4, 5]. Stav pomenovaný aj pediatrický multisystémový zápalový syndróm (pediatric inflammatory multisystem syndrome temporaly associated with SARS-CoV-2, PIMS-TS) alebo multisystémový inflamačný syndróm spôsobený koronavírusom (multisystem inflammatory syndrome in children associated with COVID-19, MIS-C) je teda s najväčšou pravdepodobnosťou priamo asociovaný s ochorením COVID-19 a má veľký potenciál stať sa novou nozologickou jednotkou. Diagnostické kritéria pre PIMS-TS podľa svetovej zdravotníckej organizácie (World Health Organization, WHO) sú uvedené v tabuľke 1 [4].
Table 1. Diagnostické kritéria pre PIMS-TS podľa WHO (preložené a upravená podľa Riphagen et al. 2020). 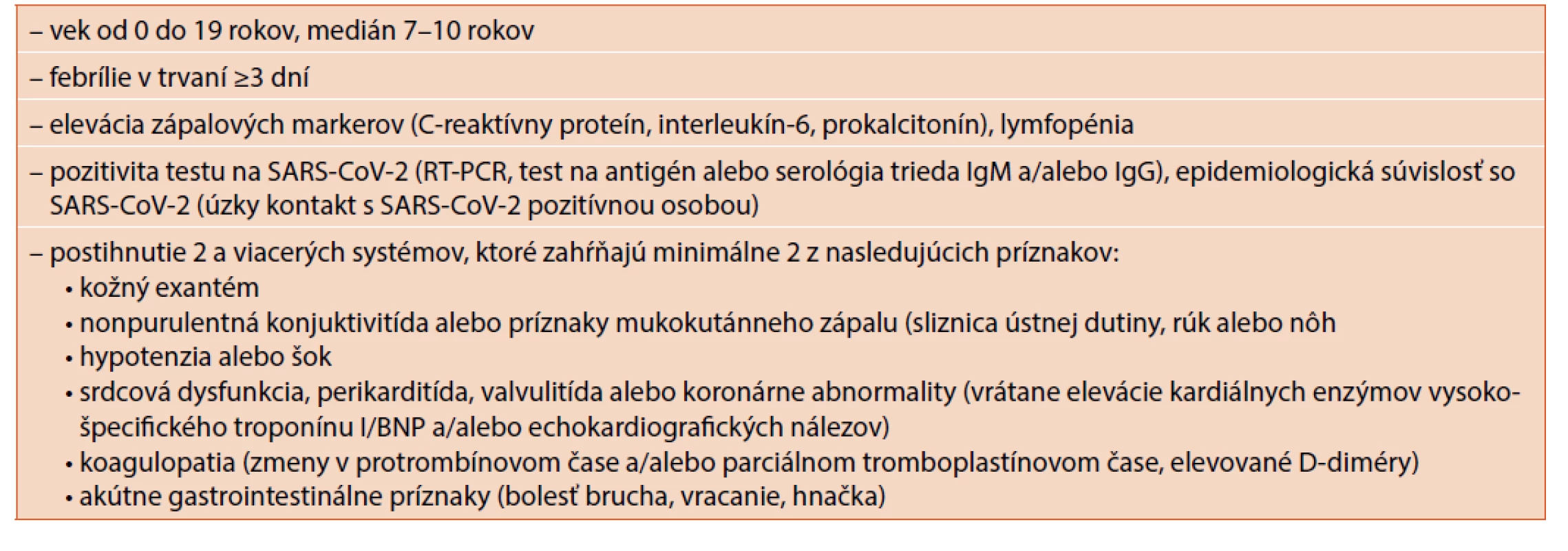
OPIS KLINICKÉHO PRÍPADU 1
Chlapec, 10-ročný, narodený z 3. fyziologickej gravidity, s primeranou popôrodnou adaptáciou. Doposiaľ zdravý, bez dispenzarizácie s primeranou chorobnosťou. Chlapec bol prijatý do regionálnej nemocnice s 3 dni trvajúcimi febríliami do 39,5 °C. V deň prijatia pacient zvracal a mal jednu riedku stolicu. V klinickom obraze bol febrilný, kardiopulmonálne stabilizovaný, koža bola čistá, bledoružová, bez patologických eflorescencií, prítomná hyperémia orofaryngu a krčná lymfadenopatia. Hmotnosť pacienta bola 33 kg. Vo vstupných laboratórnych parametroch bola prítomná elevácia nešpecifickej zápalovej aktivity – C-reaktívny proteín (CRP) 87,2 mg/l, (norma <5 mg/l), hyperglykémia 7,4 mmol/l (norma 3,3–5,6 mmol/l). V krvnom obraze nebola prítomná leukocytóza. Ordinovaná bola parenterálna hydratačná liečba balansovanými roztokmi. Pre suponovanú infekciu horných dýchacích ciest bola začatá antibiotická liečba (cefalosporín II. generácie). Potvrdená bola pozitivita anti-SARS-CoV-2 protilátok v triede IgG. Polymerázová reťazová reakcia s reverznou transkripciou (reverse transcriptase polymerase chain reaction) RT-PCR SARS-CoV2 bola opakovane negatívna. Aj napriek liečbe pretrvávali u dieťaťa febrílie, od 3. dňa hospitalizácie bola pozorovaná bilaterálna non-purulentná konjuktivitída, zvýraznená krčná lymfadenopatia, pridružil sa bilaterálny plantárny erytém. V laboratórnych parametroch bol zaznamenaný vzostup CRP na 206,7 mg/l, vzostup troponínu na 0,46 ng/l (norma 0–11,6 ng/l) a hyponatriémia 130 mmol/l (norma 132–144 mmol/l).
Na 4. deň bol pacient preložený do našej nemocnice. Pri preklade bol pacient febrilný (38,5 °C), hypotenzný 64/38 mm Hg (<50. percentil), bola prítomná tachykardia (112/min). V úvode bola ordinovaná objemová liečba hypotenzie (balansované roztoky), ktorá bola bez jednoznačného účinku. Bola prítomná oligúria, tachydyspnoe s potrebou oxygenoterapie 0,5–1 l kyslíka/min. V kontrolných laboratórnych parametroch bola pozorovaná elevácia zápalových parametrov, ferritín 349,2 µg/l (norma 15–150 µg/l), minerálová dysbalancia, elevácia N terminálnej časti molekuly prohormónu nátriuretického peptidu B – NT-proBNP 16 705,4 ng/l, (norma 0–125 ng/l) a troponínu I 214,7 ng/l. V krvnom obraze bola prítomná trombocytopénia ľahkého stupňa 105 x 109/l (norma 150–450 x 109/l). Suponovaná bola diagnóza PIMS-TS a bola začatá liečba intravenóznymi imunoglobulínmi – IVIG (v kumulatívnej dávke 2 g/kg), systémovými kortikoidmi (methyl-prednisolon intravenózne 1 mg/kg dvakrát denne), azitromycínom perorálne vzhľadom na možný imunomodulačný efekt. V imunologickom vyšetrení bola prítomná kritická celulárna porucha so známkami imunoparalýzy, korigovaná imunointervenčnou liečbou (azoximér bromid intramuskulárne, vzhľadom na vek off-label aplikácia). Na RTG snímke hrudníka (obr. 1) bol nález zápalových zmien vpravo a známky pľúcneho edému bilaterálne. Ultrasonograficky bol prítomný bilaterálny fluidothorax vpravo do 30 mm a vľavo do 10 mm, hepatosplenomegália, širšie hepatálne vény. Na echokardiografickom vyšetrení bola prítomná kardiálna insuficiencia, ejekčná frakcia cca 50 % (norma >55 %) a znížená funkcia ľavej komory. Od 4. dňa hospitalizácie došlo k rozvoju septického šoku s potrebou vazoaktívnej liečby noradrenalínom (NoA). Bol zavedený centrálny venózny katéter cestou vena femoralis vpravo. Po výkone bol pacient ponechaný intubovaný a na umelej pľúcnej ventilácii.
Table 2. Dynamika sledovaných parametrov u pacienta z klinického opisu 1. Časová súslednosť je zľava doprava. 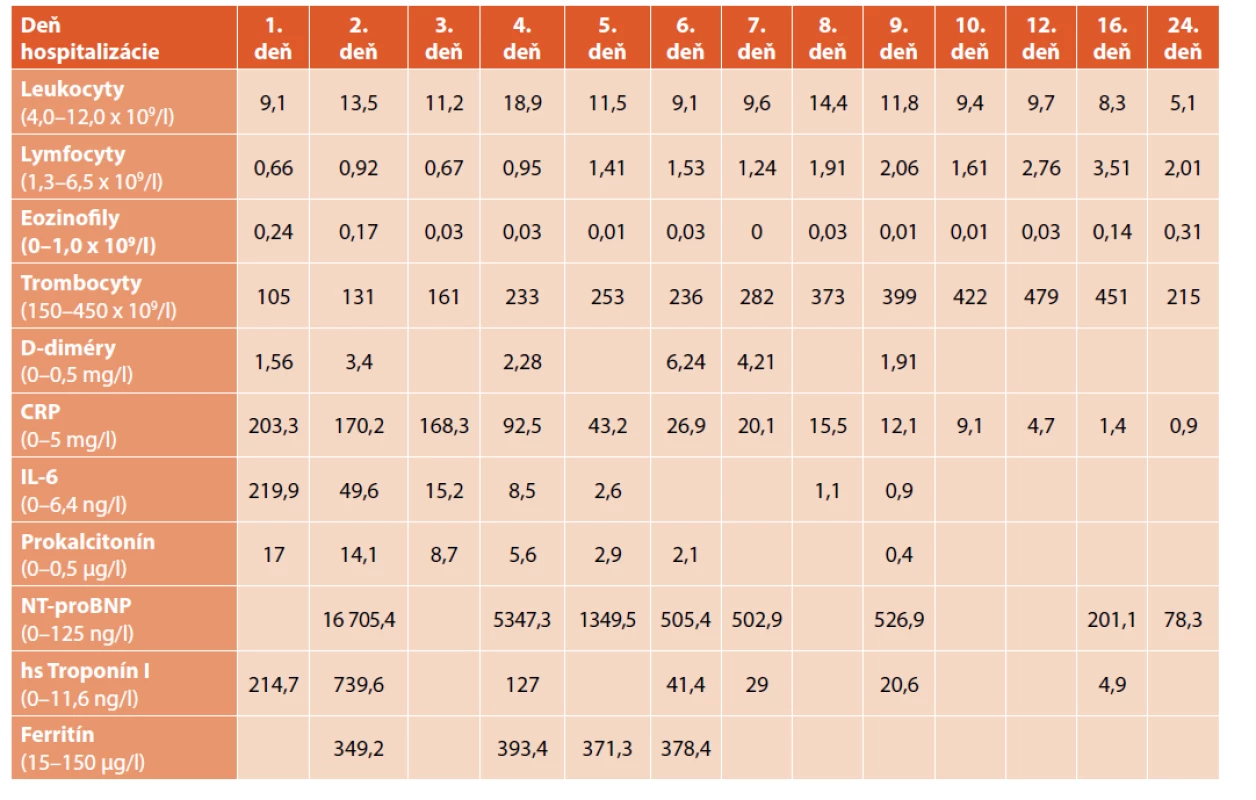
Image 1. RTG vyšetrenie pľúc pacienta z klinického prípadu 1 – prítomné bronchopneumonické zmeny viac vpravo s naznačeným fluidothoraxom bilaterálne.
Fig. 1. X-ray examination of the patient’s lungs from case report 1 – bronchopneumonic changes more to the right with bilateral pleural effusions.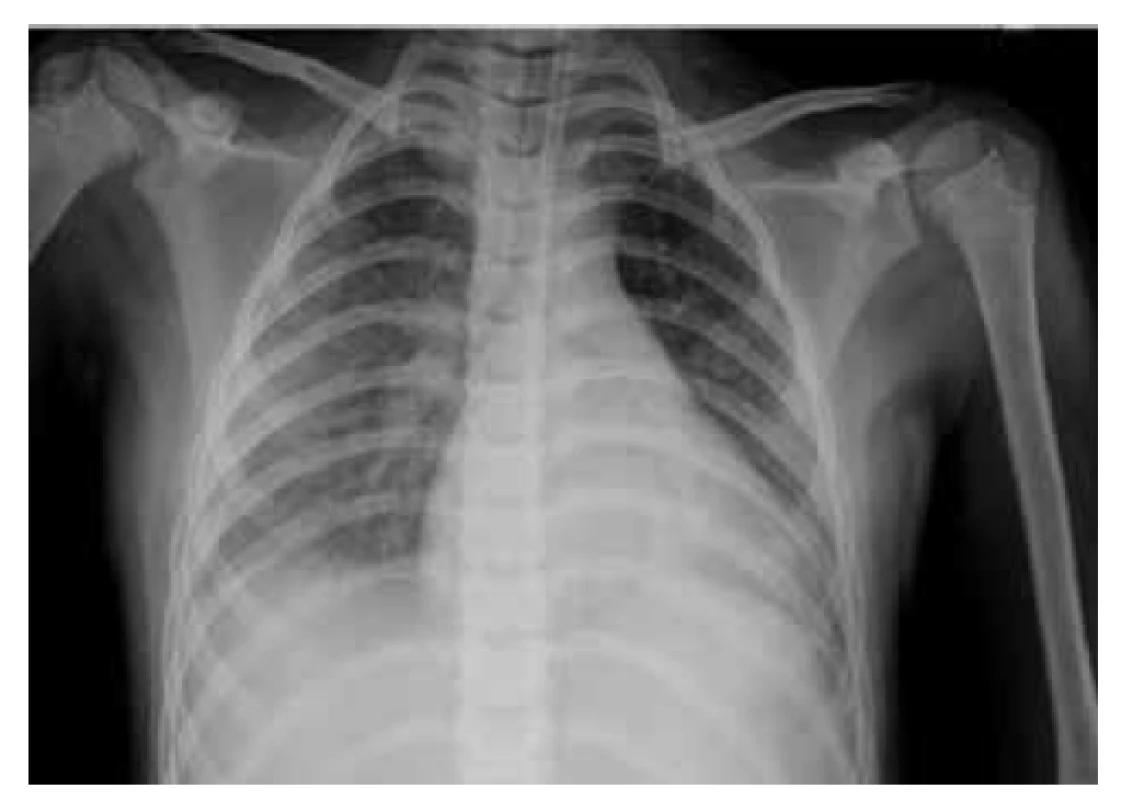
V ďalšom priebehu bol pacient subfebrilný, bola prítomná hraničná periférna perfúzia a hypotenzia s nutnosťou navýšenia vazoktívnej liečby. V laboratórnych parametroch bola prítomná hypokaliémia 2,4 mmol/l (norma 3,4–4,5 mmol/l). Na EKG bola prechodne zaznamenaná porucha rytmu (prolongované corrected QT interval – QTc, bradykardia). Po úprave vnútorného prostredia sa nález na EKG upravil. Diuréza bola podporovaná kontinuálnym podávaním kľučkových diuretík. Pokračovalo sa v podávaní IVIG, systémových kortikoidov (methyl-prednisolon) a antibiotík (karbapeném intravenózne, azitromycin perorálne). Podávala sa imunomodulačná liečba (azoximér bromid i.m.), antikoagulačná liečba heparínom s nízkou molekulovou hmotnosťou (low-molecular-weight heparin – LMWH) subkutánne, vitaminoterapia (orotát zinku, vitamín C a D) a lokálna liečba konjuktivitídy (hypromelóza). V ďalšom priebehu bol pacient afebrilný, kardiálne a ventilačne stabilizovaný. Po 93 hodinách bol pacient pri dostatočnej spontánnej dychovej aktivite a prítomných obranných reflexoch dýchacích ciest extubovaný. Auskultačne bolo dýchanie počuteľné v celom rozsahu, bilaterálne dorzobazálne oslabené, intermitentne boli počuteľné vlhké fenomény. Neurologické vyšetrenie bolo v norme.
V kontrolných laboratórnych parametroch bol pozorovaný pokles zápalovej aktivity, pokles kardiálnych markerov, pretrvávala hyponatrémia a elevácia hepatálnych enzýmov. V kontrolnom imunologickom vyšetrení bola prítomná kritická imunodeficiencia s postihnutím najmä T lymfocytov a NK buniek, vysoká expresia diferenčnej skupiny – cluster of differentiation CD38 pri nízkej expresii ľudský antigén hlavný histokompatibilný komplex (human leukocyte antigen – HLA-DR), nízka koexpresia, známky rozbehnutej imunoparalýzy, pokles respiračného vzplanutia sekundárne, ústup lymfopénie, vzostup CD4+ aj CD8+, normalizácia prirodzených zabijačských buniek (natural killer cells – NK cells) s ich pretrvávajúcou inaktivitou, pretrvávali známky imunoparalýzy, ktoré boli pri ďalšom vyšetrení upravené. V ďalšom priebehu v klinickom obraze bol pacient afebrilný. Kardiologický nález sa upravil, doplnený EKG Holter monitoring, ktorý bol bez nálezu arytmie.
Pacient bol v klinicky stabilizovanom stave demitovaný na 26. deň hospitalizácie. Ostáva v sledovaní v Centre pre vrodené poruchy imunity Kliniky detí a dorastu Jesseniovej lekárskej fakulty v Martine, Univerzita Komenského v Bratislave a Univerzitná nemocnica Martin (KDaD JLF UK a UN Martin).
OPIS KLINICKÉHO PRÍPADU 2
Dievča, 12-ročné, sa narodilo z fyziologickej tehotnosti, v dojčeneckom a predškolskom období bez zvýšenej chorobnosti. Bola sledovaná kardiológom pre familiárnu hypercholesterolémiu a akcidentálny systolický šelest bez štrukturálnej srdcovej chyby. Pacientka bola preložená z regionálnej nemocnice na naše oddelenie pre septický stav s rozvojom septického šoku, tachykardiou s hypotenziou. V laboratórnych parametroch dominovala vysoká nešpecifická zápalová aktivita a elevácia kardiálnych enzýmov. Pred hospitalizáciou bol u dieťaťa prítomný 5 dní trvajúci febrilný stav, prejavy gastroenteritídy (vracanie, hnačka) a bolesť brucha. Cca 3 týždne pred hospitalizáciou bola pozorovaná prechodná anosmia. V tom čase bol pomocou RT-PCR na SARS-CoV-2 vyšetrenia pozitívne testovaný otec pacientky.
Pri prijatí na našu kliniku bola pacientka febrilná do 39,7 °C, hypotenzná 77/41 mm Hg (<50. percentil), bola prítomná tachykardia 165/min. V objektívnom klinickom obraze dominovali bilaterálna non-purulentná konjuktivitída, krčná lymfadenopatia, palmárny erytém bilaterálne (obr. 2), na nohách, chrbte a bruchu splývavý makulózny exantém (obr. 3) s pruritom, znížený kožný turgor. Dýchanie bolo auskultačne bazálne bilaterálne oslabené, bez známok obštrukcie alebo počuteľných vlhkých dychových fenoménov. Bola prítomná sínusová tachykardia, bez jednoznačne počuteľného šelestu. Brucho bolo citlivé, bez známok peritoneálneho dráždenia, bez patologickej rezistencie. Hmotnosť pacientky pri prijatí bola 52 kg.
Image 2. Palmárny erytém pacientky z klinického prípadu 2.
Fig. 2. Palmar erythema of the patient from case report 2.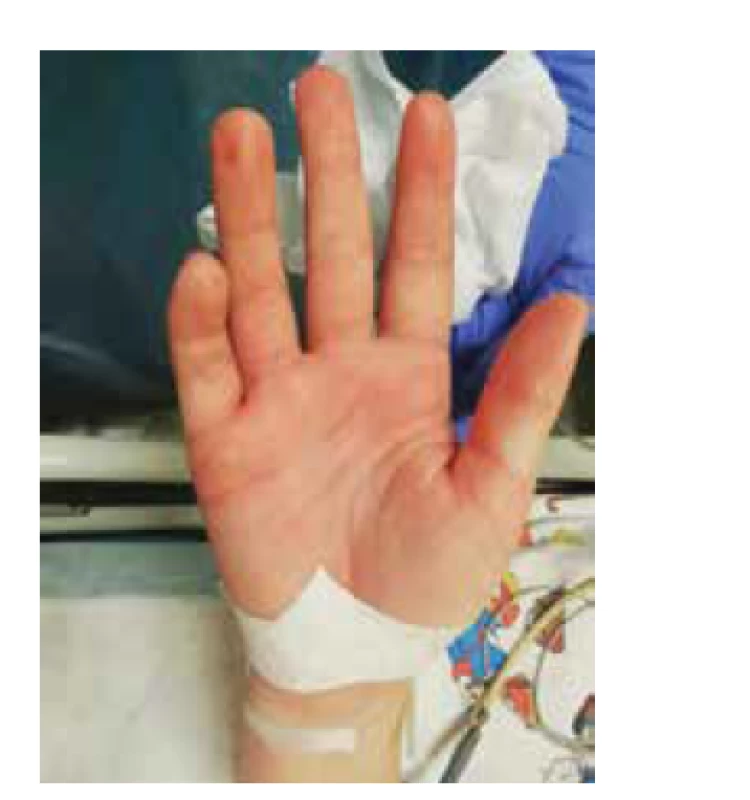
Image 3. A, B. Makulózny exantém na nohách (A) a chrbte (B) pacientky z klinického prípadu 2.
Fig. 3A, B. Macular rash on the legs (A) and back (B) of the patient from case report 2.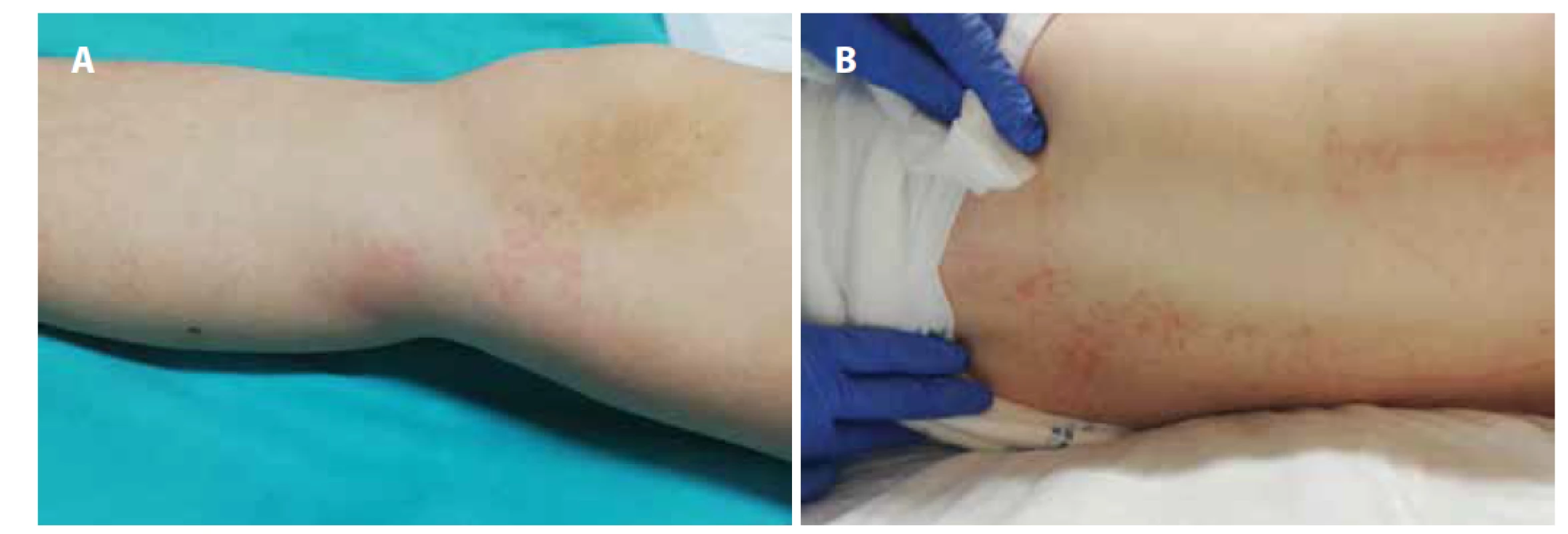
V laboratórnych parametroch bola v krvnom obraze pozorovaná lymfopénia 0,34 x 109/l (norma 1,3–6,5 x 109/l), trombocytopénia 65 x 109/l (norma 150–450 x 109/l). Boli pozitívne D-diméry 13,21 mg/l (norma 0–0,50 mg/l), elevácia nešpecifickej zápalovej aktivity – CRP 133,0 mg/l (norma <5 mg/l), interleukínu-6 – IL-6 785,05 ng/l (norma 0–6,40 ng/l), prokalcitonínu 15,76 μg/l (norma 0–0,5 μg/l), elevácia kardiálnych enzýmov NT-proBNP – 22 208,9 ng/l (norma 0–125,0 ng/l) a troponínu I 289,6 ng/l (norma 0–11,6 ng/l). Elevovaný bol tiež ferritín 1245 μg/l (norma 15–150 μg/l). Dynamika vybraných sledovaných parametrov v priebehu hospitalizácie je uvedená v tabuľke 3.
Table 3. Dynamika sledovaných parametrov u pacientky z klinického opisu 2. Časová súslednosť je zľava doprava. 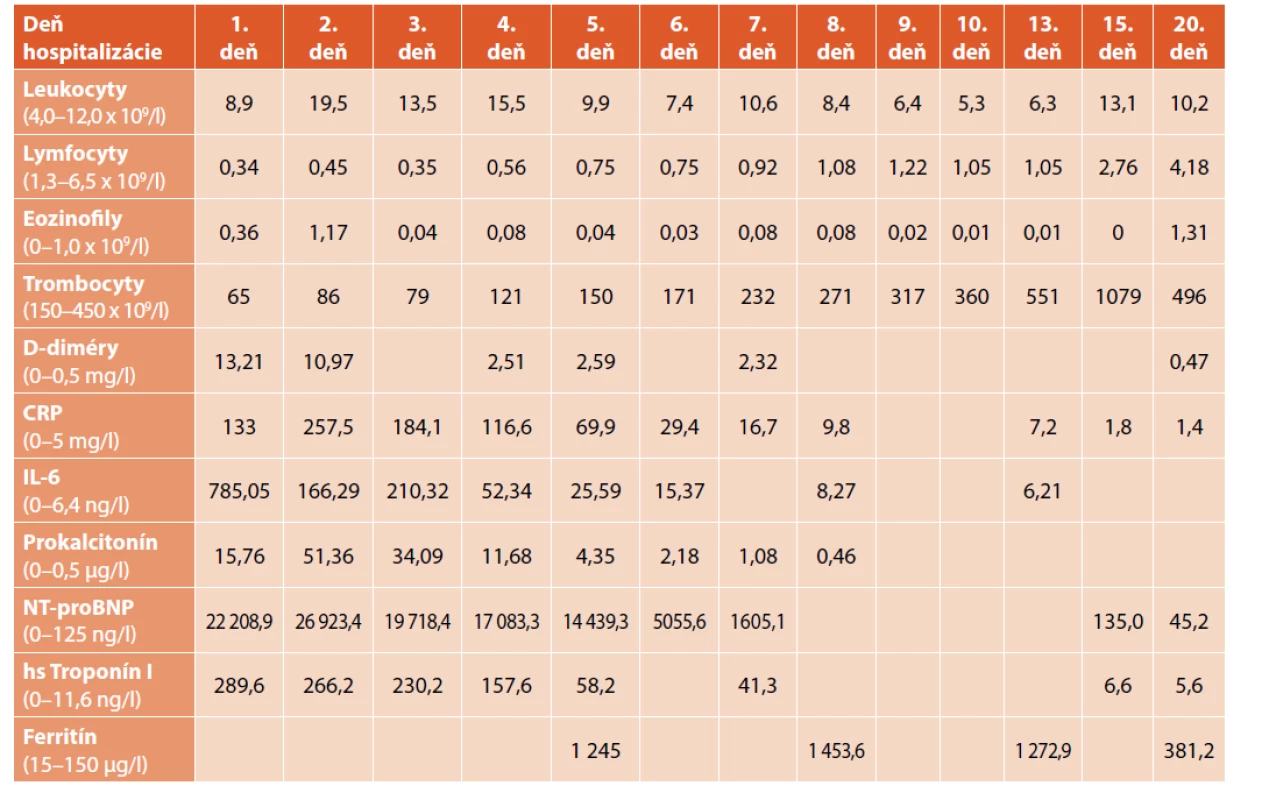
V imunoprofile bol pozorovaný obraz kritickej poruchy a imunoparalýzy, deficit najmä CD8+ T cytotoxických lymfocytov, ale aj CD4+ T-pomocných lymfocytov, s vysokou expresiou CD38 na T cytotoxických lymfocytoch, NK bunky v absolútnom počte v pásme referencie, avšak inaktívne (s vysokou expresiou CD159). Pozitívne boli protilátky proti SARS-CoV-2 v triede IgG.
Na vstupnej RTG snímke hrudníka bola prítomná bilaterálna bronchopneumónia (obr. 4). Ultrasonografiou bol verifikovaný fluidothorax do 12 mm vľavo a do 3 mm vpravo. Koronárne artérie boli echokardiograficky bez postihnutia. Bol prítomný obraz perimyokarditídy so zlyhávaním ľavej komory (ejekčná frakcia 15–30 %).
Image 4. RTG vyšetrenie pľúc pacientky z klinického prípadu 2 – obraz bilaterálnej bronchopneumónie.
Fig. 4. X-ray examination of the patient’s lungs from case report 2 – bilateral bronchopneumonia.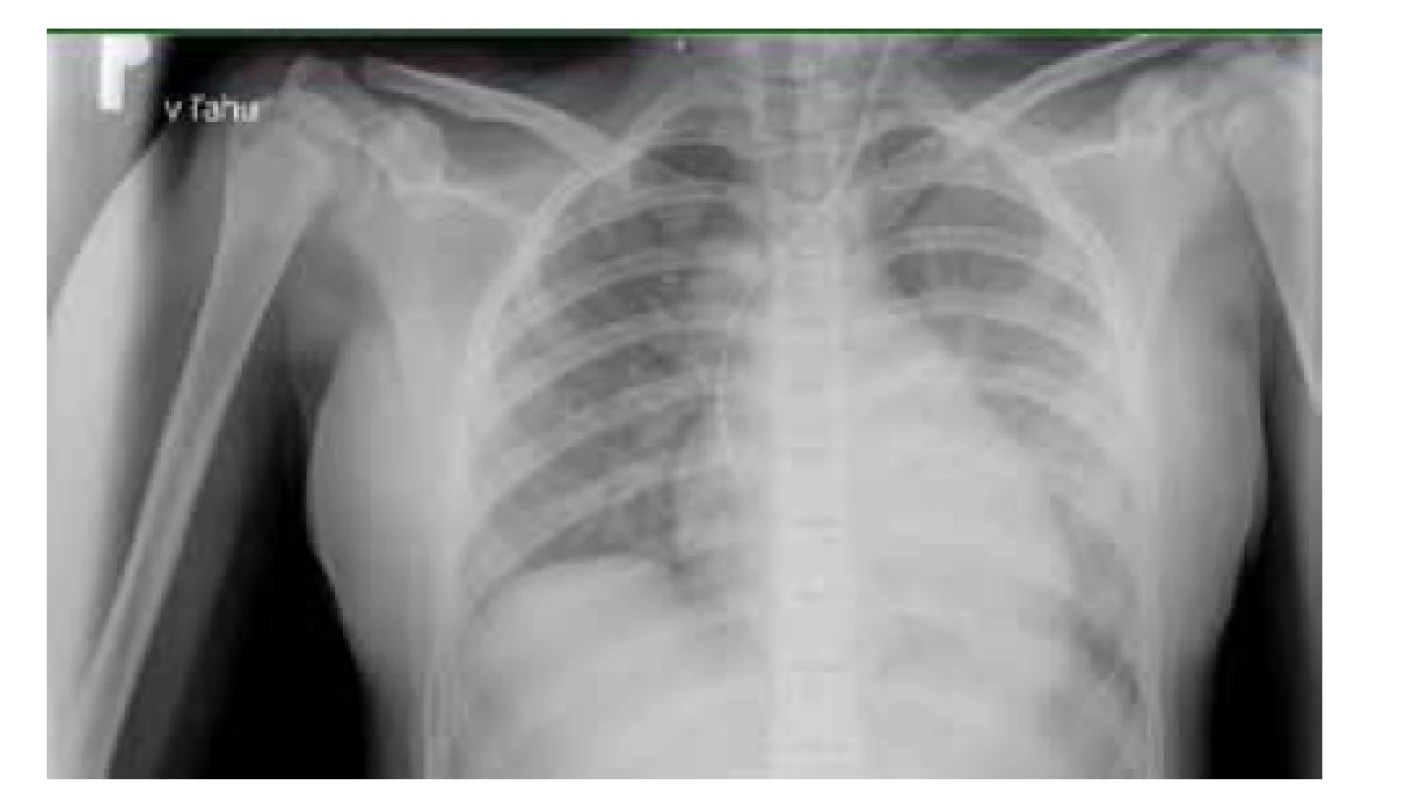
Do liečby boli ordinované široskospektrálne antibiotiká (karbapeném intravenózne) v kombinácii s antimykotikami. Vzhľadom k plnej klinickej expresii PIMS-TS boli podávané IVIG v imunosupresívnej dávke (2 g/kg v kumulatívnej dávke), systémové kortikosteroidy v nízkej modulačnej dávke (methylprednisolon 1 mg/kg 2x denne 14 dní, následne s postupnou detrakciou), imunomodulanciá (azoximér bromid intramuskulárne, vzhľadom na vek off-label aplikácia), vitaminoterapia (orotát zinku, vitamín C a D). Pre vysokú kvantitu D-dimérov bola začatá liečba LMWH v profylaktickej dávke, neskôr pri vzostupe trombocytov pridaná kyselina acetylsalicylová v dávke 100 mg jedenkrát denne. Klinický stav pacientky komplikovala hypotenzia s nutnosťou podávania kombinovanej vazoaktívnej liečby (dopamín s dobutamínom), pre pretrvávanie nízkych funkčných metrických parametrov srdca bol do liečby pridaný digoxín. Na uvedenej liečbe bola postupne pozorovaná normalizácia tlaku krvi, výrazné zlepšenie klinického stavu. Realizované bola počítačová tomografia pľúcneho parenchýmu s vysokým rozlíšením (high-resolution computed tomography – HRCT), kde pretrvával minimálny fluidothorax s priľahlými malými atelektázami (obr. 5).
Image 5. HRCT (high-resolution computed tomography) vyšetrenie pľúc pacientky z klinického prípadu 2 – bazálne prítomný drobný fluidothorax s priľahlými malými atelektázami pľúc bilaterálne, bez nálezu ground glass opacification typických pre bronchopneumóniu asociovanú s COVID-19.
Fig. 5. HRCT examination of patient’s lungs from case report 2 – pleural effusions with adjancent small lung atelectases bilaterally, without finding ground glass opacification typical of COVID-19 bronchopneumonia.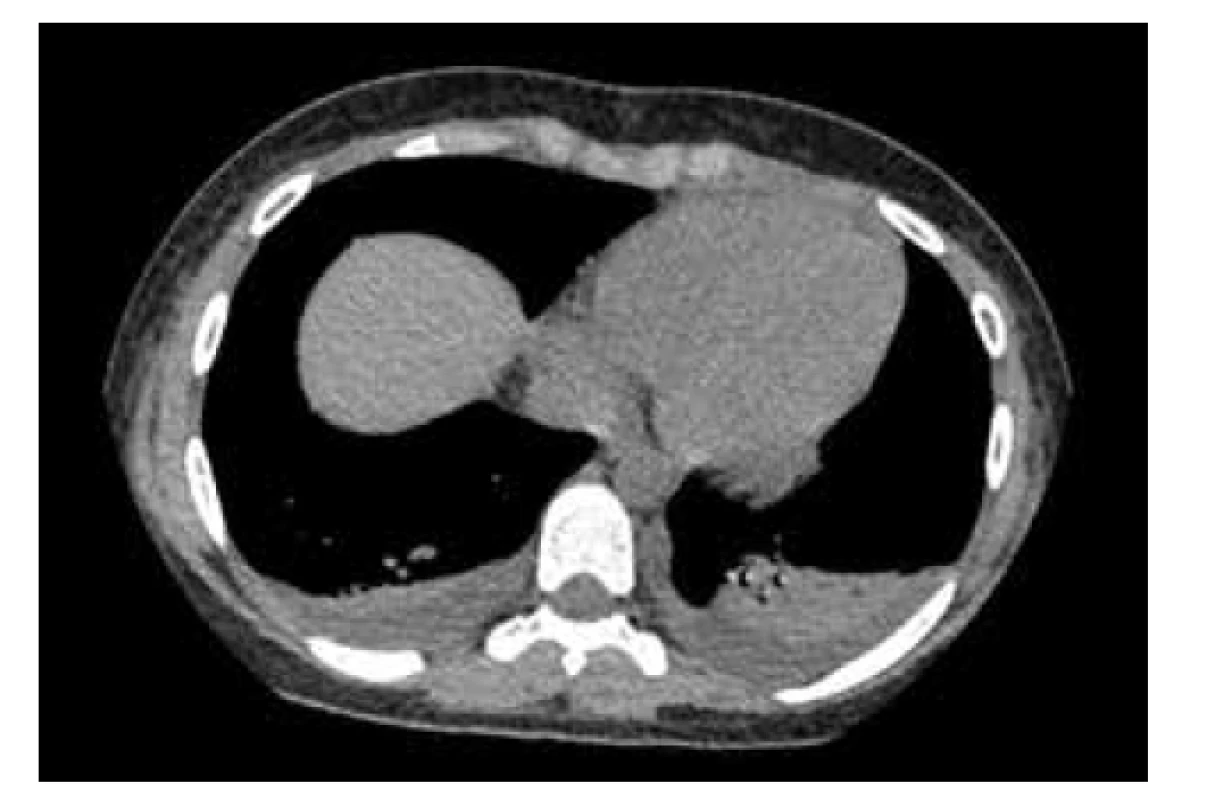
Pacientka bola v klinicky stabilizovanom stave na 20. deň hospitalizácie demitovaná do domácej a ambulantnej starostlivosti. Ostáva v sledovaní v Centre pre vrodené poruchy imunity KDaD JLF UK a UN Martin.
DISKUSIA
Pandémia ochorenia COVID-19 má v súčasnosti celosvetový dopad a významne zaťažila všetky zdravotnícke systémy. V priebehu posledných mesiacov však došlo k exponenciálnemu nárastu poznatkov súvisiacich s týmto ochorením a jeho jednotlivými klinickými aj laboratórnymi aspektami. Medzi najdôležitejšie poznatky patria vekovo-špecifické charakteristiky priebehu ochorenia a jeho komplikácií. Na jednej strane má infekcia COVID-19 u detských pacientov väčšinou ľahký priebeh nevyžadujúci hospitalizáciu. Na druhej strane sa objavuje diagnóza PIMS-TS, ktorá patrí medzi závažné komplikácie súvisiace s COVID-19 alebo asymptomatickou infekciou SARS-CoV-2. Od apríla 2020 boli pozorované prvé prípady PIMS-TS v severnom Taliansku [6], následne v Anglicku [4] a vo viacerých ďalších krajinách sveta [7–9], čo umožnilo lepšiu detekciu uvedeného stavu a následne aj zlepšilo manažment týchto pacientov.
V doteraz publikovaných prácach je určitá etnická predispozícia pediatrických pacientov s PIMS-TS, najväčšie zastúpenie tvoria pacienti z Afriky a Ázie [10]. V našom článku prezentujeme 2 kazuistické prípady detí vo veku 10 a 12 rokov zo strednej Európy (kaukazská rasa). PIMS-TS typicky postihuje staršie deti (veková kategória 9–15 rokov) v porovnaní s pacientami s Kawasakiho chorobou (veková kategória 2–5 rokov) [10].
Klinické príznaky pacienta s PIMS-TS zahŕňajú horúčku charakteru febris remittens, non-purulentnú konjuktivitídu, kardiálnu insuficienciu, gastrointestinálne príznaky, erytém a vývoj šokového stavu, v niektorých prípadoch sa uvádza aj neurologická symptomatika [4].
V laboratórnych parametroch je prítomná elevácia CRP, prokalcitonínu, interleukínu-6, ferritínu, D-dimérov a hypoalbuminémia [4, 11, 12]. Tiež bola opísaná aj trombocytopénia, ktorá je netypická pre Kawasakiho chorobu [12]. Okrem elevácie zápalových parametrov sa vyskytuje vysoká elevácia NT-proBNP (alebo BNP) korelujúca so známkami obehovej insuficiencie, len mierna elevácia troponínov, hyponatriémia a známky hepatálneho a renálneho poškodenia.
Pacienti v nami prezentovaných kazuistikách spĺňajú vyššie popísaný klinický obraz aj nález v laboratórnych parametroch vrátane trombocytopénie.
V liečbe PIMS-TS sa odporúča v prvom kroku podávanie IVIG a/alebo systémových glukokortikoidov intravenózne. Ďalej sa odporúča komplexná antikoagulačná liečba LMWH. V niektorých prípadoch v kombinácii s antiagregačnou liečbou. U pacientov s počtom trombocytov pod 150 x 109/l alebo s ochorením obličiek nie je odporúčané podávanie kyseliny acetylsalicylovej – ASA [15]. Doposiaľ publikovaná literatúra popisuje podávanie antiagregancií aj pri nižšom počte trombocytov [16]. V nami popisovaných prípadoch bola vzhľadom k trombocytopénii ordinovaná terapia LMWH subkutánne, po normalizácii počtu trombocytov boli do liečby pridané antiagreganciá (ASA).
Prezentovaní pacienti boli negatívne testovaní RT-PCR na SARS-CoV-2, no mali potvrdené pozitívne protilátky v triede IgG rovnako ako v doteraz publikovaných prácach. U takmer všetkých boli detegované protilátky v triede IgG ako marker prekonanej infekcie COVID-19 alebo rizikový kontakt s potvrdeným prípadom infekcie COVID-19. Iba ojedinele bola zachytená pozitivita RT-PCR na SARS-CoV-2 [4].
Neurologická symptomatológia (dezorientácia, meningizmus, bolesti hlavy) bola udávaná u 4 zo 6 pacientov s COVID-19 [12], pacient v prvom klinickom prípade mal po infekcii COVID-19 diskrétnu svalovú slabosť.
V doteraz publikovaných prípadoch bola v úvode diagnostikovaná kardiálna dysfunkcia s rôznym rozsahom postihnutia pravej a ľavej komory a koronárnych artérií [4, 11]. V našom prvom klinickom prípade šlo o kardiálnu insuficienciu s hypotenziou, zníženou funkciou ľavej komory a rozvojom šokového stavu a prechodnou nutnosťou umelej pľúcnej ventilácie, v druhom prípade o obraz perimyokarditídy so zlyhávaním ľavej komory s nutnosťou kombinovanej vazoaktívnej liečby.
Pacienti s PIMS-TS v porovnaní s pacientami s Kawasakiho chorobou majú navyše dominantne (u viac než 50 %) aj gastrointestinálne príznaky (bolesti brucha, vracanie, hnačka) [10] vyskytujúce sa v úvode aj u nami opísaných 2 pacientov.
Pri diferenciálnej diagnostike treba vylúčiť Kawasakiho chorobu, bakteriálnu sepsu, syndróm toxického šoku, hemofagocytujúce lymfohistiocytózy (MAS), vaskulitídu, systémový lupus erythematodes alebo iné vírusové infekcie imitujúce pediatrický zápalový multisystémový syndróm.
Existujú rôzne teórie vzniku PIMS-TS. Je pravdepodobné, že práve vírusová infekcia COVID-19 v nedávnej minulosti (pozitívne protilátky IgG na COVID-19 u 96 % pacientov s PIMS-TS) [13] môže spúšťať imunitnú reakciu napodobňujúcu Kawasakiho chorobu. Zaujímavým pozorovaním bol nález kritickej celulárnej imunodeficiencie s extrémne vysokou expresiou markerov imunitnej paralýzy proteínu 1 programovanej smrti (programmed cell death protein 1 – PD-1) a imunoglobulínu T buniek mucín 3 (T-cell immunoglobulin domain and mucin domain 3 – TIM-3), ktoré sa začali postupne normalizovať v priebehu liečby v korelácii so zlepšovaním klinického stavu.
Toto je prvá práca zo Slovenska prezentujúca 2 prípady PIMS-TS a tiež celkovo jedna z mála prác zo strednej Európy [17] zaoberajúca sa touto závažnou problematikou, čím upozorňuje na riziko výskytu diagnózy PIMS-TS aj v európskej populácii. Je dôležité diagnózu PIMS-TS u detí zvažovať pri výskyte febrílií s nejasným origom, čím možno rýchlou a správnou terapiou predchádzať ťažkému klinickému priebehu. Ak je v laboratórnych výsledkoch prítomná hyperinflamácia, mali by sa doplniť ďalšie vyšetrenia za účelom vylúčenia myokarditídy (troponín I, NT-proBNP a echokardiografické vyšetrenie) a tiež odobrať parametre cytokínovej búrky (laktátdehydrogenáza, fibrinogén, D-diméry, protrombínový čas) [10]. Rutinným vyšetrením by malo byť EKG a echokardiografické vyšetrenie. Nevyhnutná je včasná a správna liečba pozostávajúca z podania IVIG, systémových kortikosteroidov, LMWH, ASA. V prípadoch PIMS-TS rezistentných na podanie IVIG a kortikoidov je na zváženie podanie Anakinry (blokátor IL-1) počas 1–2 týždňov, infliximabu (blokátor tumor nekrotizujúceho faktoru alfa) v 1–2 dávkach alebo tocilizumabu (blokátor IL-6) počas 2–4 týždňov [14, 15].
ZÁVER
Patomechanizmy PIMS-TS nie sú úplne objasnené a manažment pacienta s PIMS je náročný a vyžaduje si multidisciplinárny prístup (pediatrický intenzivista, imunoalergológ, kardiológ, pediatrický reumatológ). Pre prognózu detského pacienta s diagnózou PIMS-TS je dôležité jej skoré rozpoznanie a správna terapia, na stanovenie dlhodobej prognózy sú potrebné ďalšie štúdie.
Táto publikácia vznikla vďaka podpore v rámci Operačného programu Integrovaná infraštruktúra pre projekt: Vytvorenie digitálnej biobanky na podporu systémovej verejnej výskumnej infraštruktúry, kód ITMS: 313011AFG4, spolufinancovaný zo zdrojov Európskeho fondu regionálneho rozvoja.
Korešpondenčná autorka:
MUDr. Martina Kostková, PhD.
Klinika detí a dorastu JLF UK a UN Martin
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: kostkova.ma@gmail.com
Sources
1. Han MS, Choi EH, Chang SH, et al. Clinical characteristics and viral RNA detection in children with coronavirus disease 2019 in the Republic of Korea. JAMA Pediatr 2021; 175 (1):73–80.
2. Kim L, Whitaker M, O’Halloran A, et al. Hospitalization rates and characteristics of children aged <18 years hospitalized with laboratory-confirmed COVID-19 – COVID-NET, 14 States, 2020. MMWR Morb Mortal Wkly Rep 2020; 69 (32): 1081–1088.
3. WHO Scientific Brief. Multisystem inflammatory syndrome in children and adolescents with COVID-19. 2020; 1–3. https://www.who.int/news-room/commentaries/detail/multisystem-inflammatory-syndrome-in-children-and-adolescents-with-covid-19.
4. Riphagen S, Gomez X, Gonzalez-Martinez C, et al. Hyperinflammatory shock in children during COVID-19 pandemic. Lancet 2020; 395 (10237): 1607–1608.
5. Oleksak F, Jesenak M, Kapustova L, et al. Pediatrický zápalový multisystémový syndróm asociovaný s COVID-19. Alergie 2020; (3): 181–185.
6. Verdoni L, Mazza A, Gervasoni A, et al. An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: an observational cohort study. Lancet 2020; 395 (10239): 1771–1778.
7. Cabrero-Hernández M, García-Salido A, Leoz-Gordillo I, et al. Severe SARS-CoV-2 infection in children with suspected acute abdomen: a case series from a tertiary hospital in Spain. Pediatr Infect Dis J 2020; 39 (8): 195–198.
8. Rauf A, Vijayan A, John ST, et al. Multisystem inflammatory syndrome with features of atypical Kawasaki disease during COVID-19 pandemic. Indian J Pediatr 2020; 87 : 745–747.
9. Kaushik S, Aydin SI, Derespina KR, et al. Multisystem inflammatory syndrome in children associated with severe acute respiratory syndrome coronavirus 2 infection: a multi-institutional study from New York City. J Pediatr 2020; 224 : 24–29.
10. Lawrensia S, Henrina J, Wijaya E, et al. Pediatric Inflammatory Multisystem Syndrome Temporally Associated with SARS-CoV-2: a New Challenge amid the Pandemic. SN Compr Clin Med 2020; 2 : 2077–2085.
11. Belhadjer Z, Bonnet D. Acute heart failure in multisystem inflammatory syndrome in children (MIS-C) in the context of global SARS-CoV-2 pandemic. Running title: Belhadjer et al. Pediatric acute heart failure and SARS-CoV-2 infection Covid-19. Circulation 2020; 33. https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.120.048360.
12. Chiotos K, Bassiri H, Behrens E, et al. Multisystem Inflammatory Syndrome in Children during the COVID-19 pandemic: a case series. J Pediatric Infect Dis Soc 2020; 9 (3): 393–398.
13. Davies P, Evans C, Kanthimathinathan HK, et al. Intensive care admissions of children with paediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2 (PIMS-TS) in the UK: a multicentre observational study. Lancet Child Adolesc Health 2020; 4 (9): 669–677.
14. The Royal College of Paediatrics and Child Health. West Midlands Guidance for the early recognition, investigation and management of the Paediatric Inflammatory Multisystem Syndrome Temporally Associated with SARSCoV2 pandemic. 2020. https://kids.bwc.nhs.uk/wp-content/uploads/2020/05/PIMS-TS-Guidance-05-05-20-v1.pdf.
15. European Centre for Disease Prevention and Control. Paediatric inflammatory multisystem syndrome and SARS-CoV-2 infection in children. ECDC 2020; 1–18. https://www.ecdc.europa.eu/sites/default/files/documents/covid-19-risk-assessment-paediatric-inflammatory-multisystem-syndrome-15-May-2020.pdf.
16. Goldenberg NA, Sochet A, Albisetti M. Consensus‐based clinical recommendations and research priorities for anticoagulant thromboprophylaxis in children hospitalised for COVID-19 – related illness. J Thromb Haemost 2020; 18 : 3099–3105.
17. Vičar J, Balatka V, Šácha O, et al. Pandemie COVID-19 z pohledu dětské kliniky krajské nemocnice. Čes-slov Pediat 2020; 75 (5): 267–270.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2021 Issue 1-
All articles in this issue
- Česko-slovenská pediatrie v roce 2021
-
Syndrom multisystémové zánětlivé odpovědi asociovaný s COVID-19 u dětí
Doporučený postup České pediatrické společnosti ČLS JEP - Our experience with pediatric inflammatory multisystem syndrome associated with COVID-19 (PIMS-TS)
- Acute myocarditis in adolescents
- Předčasně narozené dítě
- The secular trend of the physical growth and development of boys and girls aged 6 to 14 years over the past 120 years in the Czech lands
- Child with VACTERL association – management, diagnostics and treatment of oropharyngeal dysphagia
- Current diagnostic criteria of neonatal sepsis and systemic inflammatory response in the fetus and the newborn
- DĚDIČNÉ NÁDOROVÉ SYNDROMY V DĚTSKÉ ONKOLOGII
- Biomarkers in the diagnosis of neonatal sepsis
- Ophthalmoscopy in acute pediatric care
- Prof. MUDr. Jan Janda, CSc., osmdesátiletý
- Doc. MUDr. Jozef Hoza, CSc. – 80 let
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Child with VACTERL association – management, diagnostics and treatment of oropharyngeal dysphagia
- Current diagnostic criteria of neonatal sepsis and systemic inflammatory response in the fetus and the newborn
- Acute myocarditis in adolescents
- Our experience with pediatric inflammatory multisystem syndrome associated with COVID-19 (PIMS-TS)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

