-
Medical journals
- Career
Oxytocín a obezita
Authors: K. Pozorčiaková 1; M. Kostková 1; J. Vojtková 1; M. Čiljaková 1,2; Peter Bánovčin 1
Authors‘ workplace: Klinika detí a dorastu, JLF UK a UNM, Martin, Slovensko 1; Detské oddelenie NEDÚ, Ľubochňa, Slovensko 2
Published in: Čes-slov Pediat 2020; 75 (1): 40-45.
Category: Review
Overview
Obezita predstavuje závažné ochorenie, ktoré postihuje deti nielen v rozvinutých, ale aj v rozvojových krajinách. Obezita vedie k mnohým vážnych komplikáciám, ktoré u pacienta môžu viesť k skráteniu dĺžky, ako aj k zníženiu kvality života. Je potrebné venovať tomuto ochoreniu pozornosť už v detskom veku, keďže obezita u detí predisponuje k obezite v dospelom veku.
Oxytocín je hormón, ktorý sa syntetizuje v hypotalame a je známy hlavne svojimi účinkami pri pôrode a laktácii. Do popredia sa dostáva vplyv oxytocínu na metabolizmus – efekt na sekréciu inzulínu, lipolýzu a príjem potravy. U pacientov s obezitou boli zaznamenané zmeny koncentrácie oxytocínu. Intranazálne podávanie oxytocínu sa javí ako možná terapeutická metóda liečby obezity. Práce z posledného obdobia poukazujú na pokles hmotnosti, zlepšenie glukózového a lipidového metabolizmu po podaní oxytocínu, pričom zatiaľ neboli zaznamenané závažné nežiaduce účinky.
Klíčová slova:
Oxytocin – obezita – metabolický syndrom
ÚVOD
Celosvetová prevalencia nadváhy a obezity rastie nielen v detskom veku. Od roku 1980 sa prevalencia zdvojnásobila. Výrazný nárast je zaznamenaný u detí a adolescentov v rozvinutých krajinách. Avšak závažný vzostup nastal aj v rozvojových krajinách. Predpokladá sa, že do roku 2020 bude v detskej populácii celosvetová prevalencia nadváhy a obezity 9,1 %, pričom postihne 60 miliónov detí [1–3]. U slovenských a českých detí má obezita a nadváha taktiež stúpajúci trend. V sledovanom období 2001/2002–2013/2014 došlo k vzostupu nadváhy o viac ako 50 % [4, 5]. Obezita je po vylúčení endokrinopatií, monogénových a syndrómových foriem obezity zvyčajne multifaktoriálne ochorenie. Uplatňujú sa nesprávne stravovacie návyky, psychologické faktory, nízka pohybová aktivita a aj genetická predispozícia [6, 7]. Obezita má vážne zdravotné, ako aj sociálnoekonomické dôsledky. Je významným rizikovým faktorom širokého spektra ochorení (diabetes mellitus II. typu, ochorenia kardiovaskulárneho či pohybového systému, poruchy spánku, psychosociálne problémy) [8–11]. Nové možnosti liečby sú predmetom štúdií [12].
Oxytocín, nazývaný aj hormón lásky, je tvorený deviatimi aminokyselinami. Tvorí sa v hypotalame, hlavne v nucleus paraventricularis. Syntetizuje sa ako inaktívny prekurzorový proteín, ktorý je enzýmami rozložený na menšie fragmenty. Prekurzor obsahuje aj neurofyzín I, spolu s ktorým je oxytocín transportovaný do neurohypofýzy [13, 14]. K tvorbe oxytocínu dochádza aj v iných tkanivách – v retine, týmuse, pankrease, adipocytoch, placente, dreni nadobličiek, ováriách, maternici, obličkách, cievach, koži, v srdci, v žltom teliesku, amniu, intersticiálnych Leydigových bunkách [15, 16]. Oxytocín je metabolizovaný oxytocinázou (leucylcystinyl aminopeptidázou), pričom degradácia prebieha najmä v pečeni a obličkách [17, 18]. Oxytocínový receptor (OXTR) bol identifikovaný vo viacerých tkanivách – v myoepiteli prsnej žľazy, myometriu maternice, endometriu, deciduu, ováriu, semenníku, nadsemenníku, semenovode, obličke, srdci, týmuse, pankrease, adipocytoch ako aj v mozgu a mieche [15]. Po naviazaní oxytocínu na OXTR dochádza k aktivácii rôznych intracelulárnych signálnych dráh. Hlavná signálna dráha je cez Gq/fosfolipázu C/inozitol 1,4,5-trifosfát [15, 19]. Hlavná a najznámejšia funkcia oxytocínu je pri pôrode a laktácii. Významné sú aj jeho sociálne funkcie – vplyv na starostlivosť o potomstvo a materské správanie. K ďalším funkciám patrí vplyv na vývoj mozgu, kardiomyogenézu, osteogenézu, kontrakciu srdcového svalu, moduláciu parasympatika a sympatika či vplyv na nocicepciu, analgéziu a zmyslové vnímanie [13, 20].
ÚLOHA OXYTOCÍNU V METABOLIZME
Nové poznatky poukazujú na úlohu oxytocínu v metabolizme glukózy, lipolýze, β-oxidácii mastných kyselín či vplyv na zníženie príjmu potravy. Oxytocín je uvoľňovaný z neurohypofýzy a stimuluje ďalšie uvoľňovanie pozitívnou spätnou väzbou (čierne šípky). Moduluje metabolické procesy v tkanivách (sivé šípky), čo vedie k redukcii príjmu potravy a telesnej hmotnosti (obr. 1) [21].
Image 1. Zapojenie oxytocínu do metabolizmu. Oxytocín je uvoľňovaný z neurohypofýzy a stimuluje ďalšie uvoľňovanie pozitívnou spätnou väzbou (čierne šípky). Moduluje metabolické procesy v tkanivách (sivé šípky), čo vedie k redukcii príjmu potravy a telesnej hmotnosti.
Skratky: CCK – cholecystokinín, DVC – dorzálny vagálny komplex, NTS – nucleus tractus solitarius, PVN – nucleus paraventricularis, SON – nucleus paraopticus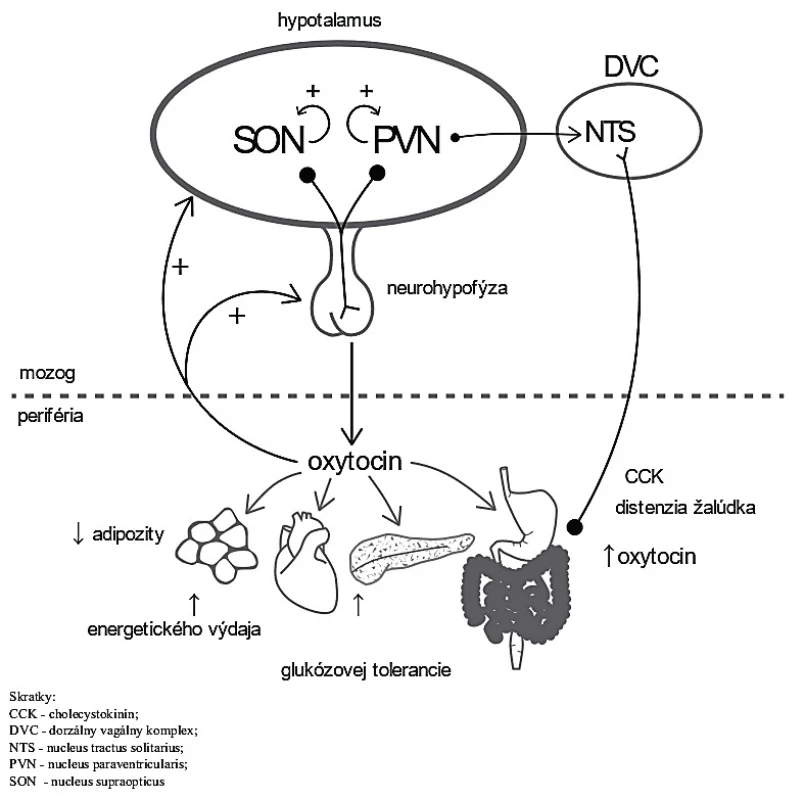
V štúdiách na zvieracích modeloch viedlo podávanie oxytocínu ku zlepšeniu inzulínovej senzitivity, zníženiu koncentrácie glukózy, k zlepšeniu vychytávania glukózy [22–24]. Metabolické účinky oxytocínu boli výraznejšie u zvierat s indukovanou obezitou [21]. Po intranazálnom podaní oxytocínu zdravým mužom došlo k menšiemu vzostupu glykémie, skorému zvýšeniu koncentrácie inzulínu a C-peptidu a taktiež sa zvýšila vnímavosť β-buniek pankreasu [25]. Zlepšenie inzulínovej senzitivity je spôsobené znížením glukotoxicity a lipotoxicity a taktiež reguláciou hormónov ako leptín a adiponektín [22, 26–28]. Oxytocín taktiež znižuje hypertrofiu pankreatických ostrovčekov [26, 29]. Okrem toho oxytocín ochraňuje β-bunky pankreasu pred bunkovou smrťou spôsobenou metabolickým stresom [30].
Oxytocín moduluje adipogenézu, zlepšuje lipidový profil znížením LDL cholesterolu, triacylglycerolov a zlepšením HDL cholesterolu, indukuje lipolýzu a β-oxidáciu mastných kyselín [22, 26]. Podanie oxytocínu bolo sprevádzané znížením plazmatickej koncentrácie triacyl-glycerolov, došlo k zvýšeniu hormón-senzitívnej lipázy v tukovom tkanive [22]. Navyše oxytocín redukoval expresiu syntázy mastných kyselín [31], viscerálny tuk a steatózu pečene [28].
Okrem toho oxytocín pôsobí modulačne na hypofyzárne aj periférne hormóny ako inzulín, cholecystokinín, adrenalín [13, 20]. Štúdie naznačujú spojenie medzi neurónmi oxytocínu a leptínom. Autori udávajú, že neuróny z nucleus paraventricularis produkujúce oxytocín môžu byť súčasťou leptínového okruhu zúčastňujúceho sa regulácie príjmu potravy a že leptín cieli na špecifickú subpopuláciu neurónov produkujúcich oxytocín [32]. Podanie oxytocínu viedlo k poklesu hmotnosti aj u leptín-rezistentných zvierat. Z toho vyplýva, že liečba oxytocínom môže čiastočne prekonať nedostatok leptínu alebo leptínovú rezistenciu [33]. Dlhodobé podávanie oxytocínu viedlo k výraznej redukcii telesného tuku, zníženiu glykémie nalačno, zlepšeniu inzulínovej senzitivity a glukózovej tolerancie u myší s deficitom leptínového receptora [34].
ZMENY KONCENTRÁCIE OXYTOCÍNU
Zmeny koncentrácie oxytocínu sú predmetom celosvetových štúdií. Štúdie prebiehajú na zvieracích modeloch, ale sledujú sa zmeny aj u ľudí. Veľa štúdií sa zaoberá zmenou koncentrácie oxytocínu u pacientov s autizmom, psychiatrickými poruchami [35, 36]. Štúdie sledujú zmeny koncentrácie oxytocínu v plazme, sére, moči či v likvore.
Na základe nových poznatkov o zapojení oxytocínu v metabolizme sa do popredia dostávajú štúdie zamerané na zmeny koncentrácie oxytocínu u zvierat ako aj ľudí s poruchami výživy – nadhmotnosťou či podvýživou. U pacientov s mentálnou anorexiou bola zistená znížená koncentrácia oxytocínu v likvore [37], v sére [38, 39] či v plazme [40]. Na druhej strane u pacientov s bulimia nervosa neboli zaznamenané zmeny koncentrácie oxytocínu [41].
Vo viacerých štúdiách bola zistená znížená koncentrácia oxytocínu asociovaná s obezitou u zvierat aj ľudí [42–45]. Znížená koncentrácia oxytocínu bola zistená u pacientov s diabetes mellitus II. typu [44, 46], ale aj u pacientov s diabetes mellitus I. typu [47]. Na druhej strane sú štúdie, v ktorých bola zistená zvýšená koncentrácia oxytocínu [48, 49, 50], prípadne vyššia koncentrácia oxytocínu u obéznych pacientov v porovnaní s obéznymi pacientami s diabetes mellitus II. typu [51, 52].
Zatiaľ prebehlo len veľmi málo štúdií zaoberajúcich sa vyšetrením koncentrácie oxytocínu v detskej populácii. Štúdia Binayho z roku 2017 sledovala sérové koncentrácie irisinu a oxytocínu u obéznych detí. V prospektívnej štúdii vyšetrovali 90 detí vo veku 10–18 rokov, pričom 30 detí tvorilo kontrolnú skupinu detí s veku primeranou hmotnosťou. Koncentrácia oxytocínu bola nižšia v skupine obéznych pacientov (10,17 ± 5,21 ng/l) v porovnaní s kontrolou (12,05 ± 4,43 ng/l). Nezistili signifikantný rozdiel medzi pohlaviami. Rovnako bolo zistené, že detskí obézni pacienti s metabolickým syndrómom mali signifikantný pokles koncentrácie oxytocínu v sére (8,65 ± 2,69 ng/l) oproti skupine obéznych pacientov bez metabolického syndrómu (10,87 ± 5,93 ng/l) [45]. Štúdia Lawsonovej z roku 2014 zisťovala sekréciu oxytocínu u adolescentných dievčat s primeranou váhou. U amenoreických atlétok koncentrácia oxytocínu pozitívne korelovala s váhou, BMI [53].
Nemenej zaujímavé sú štúdie pacientov s Praderovej-Williho syndrómom (PWS), ktorý je spojený so závažným stupňom obezity. U pacientov s PWS bola zaznamenaná redukcia počtu aj veľkosti neurónov nucleus paraventricularis produkujúcich oxytocín [54], taktiež bola zistená znížená funkcia génu pre OXTR [55]. Na druhej strane bola publikovaná štúdia, kde u pacientov s PWS bola plazmatická koncentrácia oxytocínu zvýšená [56]. Jednou z hypotéz je, že pacienti s PWS majú veľa inaktívnej formy oxytocínu. Štúdia z roku 2017 naznačuje, že deficit enzýmu prohormón konvertáza 1 (PC1) môže hrať rolu v hormonálnych abnormalitách pri PWS. Pričom PC1 je jedným z enzýmov, ktorý sa podieľa na štiepení oxytocínu [57]. U detí do 11 rokov bol zistený pozitívny vplyv podávania intranazálneho oxytocínu na sociálne, emočné správanie a príjem potravy. U adolescentov sa dané efekty nezistili [58]. U dojčiat viedlo podávanie oxytocínu k zlepšeniu sania a prehĺtania [59].
U pacientov s metabolickým syndrómom a diabetes mellitus II. typu bola koncentrácia oxytocínu signifikantne znížená v porovnaní s pacientami s obezitou a euglykémiou [51, 52]. Okrem toho oxytocín negatívne koreloval s glykozylovaným hemoglobínom, glykémiou nalačno [52, 60], koncentráciou betatrofínu [52]. Vzťah k adiponektínu je diskutabilný. Štúdie zistili pozitívnu [60], aj negatívnu koreláciu [51] s koncentráciou oxytocínu.
Signifikantne zníženú koncentráciu oxytocínu u pacientov s obezitou a diabetom II. typu potvrdila aj štúdia Qiana a kol. Nízky oxytocín bol asociovaný s vyšším BMI, obvodom pása, pomerom obvod pása/obvod bokov, cholesterolom, HOMA-IR [42]. Po rozdelení pacientov na základe sérovej koncentrácie oxytocínu bolo zistené, že pacienti s nízkou koncentráciou oxytocínu majú signifikantne vyššie riziko metabolického syndrómu [44]. K presne opačným výsledkom dospela štúdia Szulca a kol. Pacienti s vyšším sérovým oxytocínom mali vyššie riziko metabolického syndrómu, pričom vyšší oxytocín bol asociovaný s centrálnym tukom a obvodom pása [49]. Vyšší sérový oxytocín bol zaznamenaný aj u starších pacientov s metabolickým syndrómom. Autori taktiež zaznamenali vyššiu koncentráciu oxytocínu u mužov než u žien [61].
OXYTOCÍN AKO MOŽNOSŤ LIEČBY OBEZITY
Nakoľko má oxytocín peptidovú štruktúru, perorálne podávanie nie je účinné, preto sa intranazálne podávanie oxytocínu javí ako nádejné farmakologické riešenie obezity [27, 62, 63]. Štúdia na primátoch ukazuje, že intravenózne alebo intranazálne podaný oxytocín vo suprafyziologickej koncentrácii sa dostáva do mozgovomiechového moku [64]. Okrem toho exogénne podaný oxytocín podporuje endogénnu sekréciu oxytocínu, a to dvomi spôsobmi – priamo prostredníctvom autoreceptorov v nucleus paraventricularis a aj nepriamo cez periférne OXTR [22, 65]. Pri používaní bol oxytocín veľmi dobre tolerovaný, bez nežiaducich vedľajších účinkov alebo len s minimálnymi nežiaducimi účinkami [66–68]. Štúdie boli zatiaľ realizované len na malej vzorke pacientov, s nedostatočnou dĺžkou liečby, a preto sú potrebné ďalšie štúdie, aby sa preukázala účinnosť oxytocínu na sociálne správanie, ako aj vplyv na príjem potravy a vylúčili sa nežiadúce účinky pri dlhodobej liečbe intranazálnym oxytocínom.
Po jednorazovej dávke oxytocínu nedošlo k signifikantnej zmene apetítu počas 24 hodín u zdravej kontroly. Pacientky s bulímiou mali nižší príjem kalórií. Došlo aj k malému zvýšeniu senzitivity emocionálneho rozpoznávania v oboch skupinách. Avšak na pacientky s mentálnou anorexiou nebol zaznamenaný žiadny vplyv oxytocínu [69].
Chronický príjem oxytocínu znižuje príjem jedla a indukuje stratu hmotnosti. Potláča príjem karbohydrátov, redukuje príjem sacharózy, nápojov sladených fruktózou, ako aj vysoko tukovej potravy [22, 24, 28]. V pilotnej klinickej štúdii podávali ľuďom 4x denne oxytocín intranazálne alebo placebo po dobu 8 týždňov. Po 4 týždňoch došlo k redukcii hmotnosti o 4,6 ± 3,2 kg. Po 8 týždňoch bola hmotnosť o 8,9 ± 5,4 kg nižšia než pred začatím liečby. Väčší hmotnostný úbytok bol zaznamenaný v skupine pacientov s vyšším stupňom obezity. Pokles hmotnosti bol sprevádzaný aj zmenším obvodu pása a bokov. Počas štúdie neboli žiadne nežiaduce účinky [27]. Veľmi dôležité výsledky ukázala štúdia z roku 2016. U obéznych mužov mal oxytocín väčší inhibičný efekt na príjem potravy než u mužov s normálnou hmotnosťou [70]. Nemeckí autori skúmali efekt oxytocínu podávaného intranazálne na zdravých mužov. Oxytocín redukoval príjem potravy, obzvlášť čokoládových sušienok (cookies) o 25 % [71]. Redukcia kalorického príjmu po intranazálnom podaní oxytocínu bez nežiaducich účinkov sa potvrdila aj v štúdii amerických autorov [63]. Navyše po intranazálnom podaní oxytocínu došlo k zvýšenej kognitívnej kontrole túžby po jedle u žien [72].
Štúdie naznačujú, že dočasný energetický stav ako aj nadmerné energetické zásoby ovplyvňujú individuálnu odozvu na intranazálne podávaný oxytocín [73]. Väčší účinok oxytocínu u obéznych jedincov môže byť spôsobený vyššími hladinami cholesterolu, ktoré zvyšujú afinitu oxytocínu k jeho receptoru [15, 21].
Oxytocín ovplyvňuje redukciu hmotnosti nielen znížením príjmu potravy, ale aj zvyšuje výdaj energie a tým zabezpečuje udržanie redukcie hmotnosti [22–24]. Presný mechanizmus zatiaľ nie je známy, ale ukazuje sa, že môže viesť k zachovaniu čistej telesnej hmotnosti, aktivuje hnedé tukové tkanivo a konverziu bieleho tukového tkaniva na béžové tukové bunky, ktoré sú schopné termogenézy [53, 74].
ZÁVER
Oxytocín je komplexný hormón pôsobiaci na veľké množstvo telesných procesov. Súčasné štúdie sa zameriavajú hlavne na jeho zapojenie v metabolizme. Viaceré štúdie naznačujú, že nízke koncentrácie oxytocínu sú spojené s obezitou a obzvlášť s metabolickým syndrómom. Preto sa intranazálne podanie oxytocínu javí ako jedna z nových možností farmakoterapie obezity.
Práca bola podporená Grantom UK/229/2017.
Došlo: 6. 3. 2019
Přijato: 27. 3. 2019
MUDr. Katarína Pozorčiaková
Klinika detí a dorastu
JLF UK a UNM
Kollárova 2
036 01 Martin
Slovenská republika
e-mail: kpozorciakova@gmail.com
Sources
1. Ng M, Fleming T, Robinson M, et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet 2014; 384 (9945): 766–781.
2. WHO. Obesity and overweight. 2016. http://who.int/mediacentre/factsheets/fs311/en/.
3. De Onis M., Blössner M, Borghi E. Global prevalence and trends of overweight and obesity among preschool children. Am J Clin Nutr 2010; 92 (5): 1257–1264.
4. OECD. Obesity update. 2017. http://www.oecd.org/health/health-systems/Obesity-Update-2017.pdf.
5. OECD. Overweight and obesity among children. Health at a Glance 2017: OECD Indicators, OECD Publishing, Paris. https://doi.org/10.1787/health_glance-2017-22-en.
6. Hainer V, et al. Základy klinické obezitologie. 2. prepracované a doplnené vyd. Praha: Grada Publishing, 2011.
7. Toschke AM, Vignerova J, Lhotska L, et al. Overweight and obesity in 6 - to 14-year-old Czech children in 1991: protective effect of breast--feeding. J Pediatr 2002; 141 (6): 764–769.
8. Czippelová B, Turianiková Z, Krohová J, et al. Arterial stiffness in obese adolescents – a relation to vascular resistance and sympathetic nervous system activity. Acta Physiol 2017; 221: Suppl: S713.
9. Durdík P, Sujanska A, Suroviakova S, et al. Sleep architecture in children with common phenotype of obstructive sleep apnea. J Clin Sleep Med 2018; 14 (1): 9–14.
10. Šujanská A, Ďurdík P, Suroviaková S, et al. Chrápanie u detí predškolského a školského veku. Lek Obz 2016; 65 (11): 412–417.
11. Suroviaková S, Šujanská A, Ďurdík P, et al. Centrálne spánkove apnoe u detí. Lek Obz 2016; 65 (11): 433–437.
12. Pražienková V, Holubová M, Pelantová H, et al. Impact of novel palmitoylated prolactin-releasing peptide analogs on metabolic changes in mice with diet-induced obesity. PLoS One 2017; 12 (8): e0183449.
13. Javorka K, et al. Lekárska fyziológia. Tretie, prepracované a doplnené vydanie. Martin: Osveta, 2009.
14. Lane N. Oxygen: The Molecule that Made the World. Oxford: Oxford University Press, 2002.
15. Gimpl G, Fahrenholz F. The oxytocin receptor system: structure, function, and regulation. Physiol Rev 2001; 81 (2): 629–683.
16. Kiss A, Mikkelsen JD. Oxytocin – anatomy and functional assignments: a minireview. Endocr Regul 2005; 39 (3): 97–105.
17. NCBI. LNPEP leucyl and cystinyl aminopeptidase [Homo sapiens (human)]. 2019. https://www.ncbi.nlm.nih.gov/gene?Db=gene&Cmd=ShowDetailView&TermToSearch=4012.
18. Fjellestad-Paulsen A, Lundin S. Metabolism of vasopressin, oxytocin and their analogues [Mpa1, D-Arg8]-vasopressin (dDAVP) and [Mpa1, D-Tyr(Et)2, Thr4, Orn8]-oxytocin (anatocin) in human kidney and liver homogenates. Regul Pept 1996; 67 (1): 27–32.
19. Smith R. Parturition. N Engl J Med 2007; 356 (3): 271–283.
20. Yang HP, Wang L, Han L, et al. Nonsocial functions of hypothalamic oxytocin. ISRN Neuroscience 2013. doi: 10.1155/2013/179272.
21. Ho JM, Blevins JE. Coming full circle: Contributions of central and peripheral oxytocin actions to energy balance. Endocrinology 2013; 154 (2): 589–596.
22. Deblon N, Veyrat-Durebes C, Bourgoin L, et al. Mechanisms of the anti-obesity effects of oxytocin in diet-induces obese rats. PLoS One 2011; 6 (9): e25565.
23. Morton GJ, Thatcher BS, Reidelberger RD, et al. Peripheral oxytocin suppresses food intake and causes weight loss in diet-induced obese rats. Am J Physiol Endocrinol Metab 2012; 302: E124–E144.
24. Blevins JE, Graham JL, Morton GJ, et al. Chronic oxytocin administration inhibits food intake, increases energy expenditure, and produces weight loss in fructose-fed obese rhesus monkeys. Am J Physiol Regul Integr Comp Physiol 2015; 308: R431–R438.
25. Klement J, Ott V, Rapp K, et al. Oxytocin improves β-cell responsivity and glucose tolerance in healthy men. Diabetes 2017; 66 (2): 264–271.
26. Elabd SK, Sabry I, Mohasseb M, et al. Oxytocin as a novel therapeutic option for type I diabetes and diabetic osteopathy. Endocr Regul 2014; 48 (2): 87–102.
27. Zhang H, Wu C, Chen Q, et al. Treatment of obesity and diabetes using oxytocin or analogs in patients and mouse models. PLoS One 2013; 8: e61477.
28. Maejima Y, Iwasaki Y, Yamahara Y, et al. Peripheral oxytocin treatment ameliorates obesity by reducing food intake and visceral fat mass. Aging (Albany NY) 2011; 3 (12): 1169–1177.
29. Zhang G, Bai H, Zhang H, et al. Neuropeptide exocytosis involving synaptotagmin-4 and oxytocin in hypothalamic programming of body weight and energy balance. Neuron 2011; 69 (3): 523–535.
30. Watanabe S, Wei FY, Matsunaga T, et al. Oxytocin protects against stress-induced cell death in murine pancreatic β-cells. Sci Rep 2016; 6 : 25185.
31. Altirriba J, Poher AL, Caillon A, et al. Divergent effects of oxytocin treatment of obese diabetic mice on adiposity and diabetes. Endocrinology 2014; 155 (11): 4189–4201.
32. Perello M, Raingo J. Leptin activates oxytocin neurons of the hypothalamic paraventricular nucleus in both control and diet-induced obese rodents. PLoS One 2013; 8 (3): e59625.
33. Altirriba J, Poher AL, Rohner-Jeanrenaud F. Chronic oxytocin administration as a treatment against impaired leptin signaling or leptin resistance in obesity. Front Endocrinol (Lausanne) 2015; 6 : 119.
34. Plante E, Menaouar A, Danalache BA, et al. Oxytocin treatment prevents the cardiomyopathy observed in obese diabetic male db/db mice. Endocrinology 2015; 156 (4): 1416–1428.
35. Husarova VM, Lakatosova S, Pivovarciova A, et al. Plasma oxytocin in children with autism and its correlations with behavioral parameters in children and parents. Psychiatry Investig 2016;13 (2): 174–183.
36. Ozsoy S, Esel E, Kula M. Serum oxytocin levels in patients with depression and the effects of gender and antidepressant treatment. Psychiatry Res 2009; 169 (3): 249–252.
37. Kaye WH. Neuropeptide abnormalities in anorexia nervosa. Psychiatry Res 1996; 62 (1): 65–74.
38. Lawson EA, Donoho DA, Blum JI, et al. Decreased nocturnal oxytocin levels in anorexia nervosa are associated with low bone mineral density and fat mass. J Clin Psychiatry 2011; 72 (11): 1546–1551.
39. Afinogenova Y, Schmelkin C, Plessow F, et al. Low fasting oxytocin levels are associated with psychopathology in anorexia nervosa in partial recovery. J Clin Psychiatry 2016; 77 (11): e1483–e1490.
40. Hoffman ER, Brownley KA, Hamer RM, et al. Plasma, salivary, and urinary oxytocin in anorexia nervosa: a pilot study. Eat Behav 2012; 13 (3): 256–259.
41. Monteleone AM, Scognamiglio P, Volpe U, et al. Investigation of oxytocin secretion in anorexia nervosa and bulimia nervosa: Relationships to temperament personality dimensions. Eur Eat Disord Rev 2016; 24 (1): 52–56.
42. Qian W, Zhu T, Tang B, et al. Decreased circulating levels of oxytocin in obesity and newly diagnosed type 2 diabetic patients. J Clin Endocrinol Metab 2014; 99 (12): 4683–4689.
43. Gajdosechova L, Krskova K, Segarra AB, et al. Hypooxytocinaemia in obese zucker rats relates to oxytocin degradation in liver and adipose tissue. J Endocrinol 2014; 220 (3): 333–343.
44. Yuan G, Qian W, Pan R, et al. Reduced circulating oxytocin and high-molecular-weight adiponectin are risk factors for metabolic syndrome. Endocr J 2016; 63 (7): 655–662.
45. Binay Ç, Paketçi C, Güzel S, et al. Serum irisin and oxytocin levels as predictors of metabolic parameters in obese children. J Clin Res Pediatr Endocrinol 2017; 9 (2): 124–131.
46. Eisenberg Y, Dugas LR, Akbar A, et al. Oxytocin is lower in African American men with diabetes and associates with psycho-social and metabolic health factors. PLoS One 2018; 4 (13): e0190301.
47. Kujath AS, Quinn L, Elliott ME, et al. Oxytocin levels are lower in premenopausal women with type 1 diabetes mellitus compared with matched controls. Diabetes Metab Res Rev 2015; 31 (1): 102–112.
48. Schroeder M, Zahoory-Sharon O, Shbiro L, et al. Development of obesity in the Otsuka Long-Evans Tokushima Fatty rat. Am J Physiol Regul Integr Comp Physiol 2009; 297 (6): R1749–R1760.
49. Szulc P, Amri EZ, Varennes A, et al. High serum oxytocin is associated with metabolic syndrome in older men. Diabetes Res Clin Pract 2016; 122 : 17–27.
50. Schorr M, Marengi DA, Pulumo RL, et al. Oxytocin and its relationship to body composition, bone mineral density, and hip geometry across the weight spectrum. J Clin Endocrinol Metab 2017; 102 (8): 2814–2824.
51. Al-Nouaaimi MM, Kasabri V, Akour A, et al. Evaluation of the correlation of oxytocin plasma levels and metabolic syndrome biomarkers (leptin, adiponectin and resistin) in newly diagnosed type 2 diabetes patients in Jordan: A cross sectional study. Jordan J Pharmaceutical Sciences 2016; 9 (2).
52. Al-Rawashdeh A, Kasabri V, Bulatova N, et al. The correlation between plasma levels of oxytocin and betatrophin in non-diabetic and diabetic metabolic syndrome patients: A cross sectional study from Jordan. Diabetes Metab Syndr 2016; 11 (1): 59–67.
53. Lawson EA, Ackerman KE, Slattery M, et al. Oxytocin secretion is related to measures of energy homeostasis in young amenorrheic athletes. J Clin Endocrinol Metab 2014; 99 (5): E881–E885.
54. Swaab DF, Purba JS, Hofman MA. Alterations in the hypothalamic paraventricular nucleus and its oxytocin neurons (putative satiety cells) in Prader-Willi syndrome: a study of five cases. J Clin Endocrinol Metab 1995; 80 (2): 573–579.
55. Bittel DC, Kibiryeva N, Dasouki M, et al. A 9-year-old male with a duplication of chromosome 3p25.3p26.2: Clinical report and gene expression analysis. Am J Med Genet A 2006; 140 (6): 573–579.
56. Johnson L, Manardo, AM, Miller JL, et al. Elevated plasma oxytocin levels in children with Prader-Willi syndrome compared with healthy unrelated siblings. Am J Med Genet A 2016; 170 : 594–601.
57. Burnett LC, Leduc CA, Sulsona CR, et al. Deficiency in prohormone convertase PC1 impairs prohormone processing in Prader-Willi syndrome. J Clin Invest 2017; 127 : 293–305.
58. Kuppens RJ, Donze SH, Hokkens-Koelega ACS. Promising effects of oxytocin on social and food-related behavior in your children with Prader-Willi syndrome: a randomised, double-blind, controlled crossover trial. Clin Endocrinol 2016; 85 : 979–987.
59. Tauber M, Boulanouar K, Diene G, et al. The use of oxytocin to improve feeding and social skills in infants with Prader-Willi syndrome. Pediatrics 2017; 139: e20162976.
60. Akour A, Kasabri V, Bulatova N, et al. Association of oxytocin with glucose intolerance and inflammation biomarkers in metabolic syndrome patients with and without prediabetes. Rev Diabet Stud 2018; 14 (4): 364–371.
61. Hosny S, Bekhet M, Bahaaeldin A, et al. Serum oxytocin in elderly patiens with metabolic syndrome. Endocrine Abstracts 2018; 56: P564.
62. Blevins JE, Baskin DG. Translational and therapeutic potential of oxytocin as an anti-obesity strategy: insights from rodents, nonhuman primates and humans. Physiol Behav 2015; 152 : 438–449.
63. Lawson EA, Marengi DA, DeSanti RL, et al. Oxytocin reduces caloric intake in men. Obesity 2015; 23 (5): 950–956.
64. Lee MR, Scheidweiler KB, Diao XX, et al. Oxytocin by intranasal and intravenous routes reaches the cerebrospinal fluid in rhesus macaques: determination using a novel oxytocin aasay. Mol Psychiatry 2018; 23 (1): 115–122.
65. Zhang G, Cai D. Circadian intervention of obesity development via resting-stage feeding manipulation or oxytocin treatment. Am J Physiol Endocrinol Metab 201; 301 (5): E1004–E1012.
66. Macdonald E, Dadds MR, Brennan JL, et al. A review of safety, side-effects and subjective reactions to intranasal oxytocin in human research. Psychoneuroendocrinology 2011; 36 (8): 1114–1126.
67. Anagnostou E, Soorya L, Bian J, et al. Intranasal oxytocin in the treatment of autism spectrum disorders: a review of literature and early safety and efficacy data in youth. Brain Res 2014; 1580 : 188–198.
68. Miller JL, Tamura R, Butler MG, et al. Oxytocin treatment in children with Prader-Willi syndrome: a double-blind, placebo-controlled, crossover study. Am J Med Genet A 2017; 173 : 1243–1250.
69. Kim YR, Eom JS, Yang JW, et al. The impact of oxytocin on food intake and emotion recognition in patients with eating disorders: A double blind single dose within-subject cross-over design. PLoS One 2015; 10 (9): e0137514.
70. Thienel M, Fritsche A, Heinrichs M, et al. Oxytocin‘s inhibitory effect on food intake is stronger in obese than normal-weight men. Int J Obes (Lond) 2016; 40 (11): 1707–1714.
71. Ott V, Finlayson G, Lehnert H, et al. Oxytocin reduces reward-driven food intake in humans. Diabetes 2013; 62 (10): 3418–3425.
72. Striepens N, Schröter F, Stoffel-Wagner B, et al. Oxytocin enhances cognitive control of food craving in women. Hum Brain Mapp 2016; 37 (12): 4276–4285.
73. Olszewski PK, Klockars A, Levine AS. Oxytocin and potential benefits for obesity treatment. Curr Opin Endocrinol Diabetes Obes 2017; 24 (5): 320–325.
74. Takayanagi Y, Kasahara Y, Onaka T, et al. Oxytocin receptor-deficient mice developed late-onset obesity. Neuroreport 2008; 19 (9): 951–955.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2020 Issue 1-
All articles in this issue
- Editorial: Česko-slovenská Pediatrie v roce 2020
- Editorial: Současné možnosti genetické diagnostiky
- Rozšířené testování nosičství recesivních chorob (CarrierTest) v klinické praxi
- Děti narozené po asistované reprodukci v České republice v letech 2013–2015
- Vrodené a geneticky podmienené ochorenia dýchacieho traktu z pohľadu genetika
- Genetické příčiny syndromu náhlého úmrtí kojence. Co přineslo sekvenování nové generace
- Dědičné arytmické syndromy v dětském věku
- Nikdy nie je neskoro – herpetická encefalitída vyvolaná vírusom HSV1
- Oxytocín a obezita
- Poděkování spolupracovníkům za rok 2019
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nikdy nie je neskoro – herpetická encefalitída vyvolaná vírusom HSV1
- Dědičné arytmické syndromy v dětském věku
- Genetické příčiny syndromu náhlého úmrtí kojence. Co přineslo sekvenování nové generace
- Rozšířené testování nosičství recesivních chorob (CarrierTest) v klinické praxi
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

