-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Oxytocín a obezita
Oxytocin and obesity
Obesity is a serious illness affecting children not only in developed but also in developing countries. Obesity leads to many serious complications that can lead to a shortened life span of the patient and a decrease in quality of life. It is necessary to pay attention to this disease in childhood, because obesity in children predisposes to obesity in adulthood.
Oxytocin is a hormone that is synthesized in the hypothalamus and is known mainly for its effects in childbirth and lactation. Nowadays there is a focus on oxytocin involvement in metabolism - its effect on insulin secretion, lipolysis and food intake. Changes in concentration of oxytocin have been reported in obese patients. Intranasal administration of oxytocin appears to be a possible therapeutic method of obesity treatment. Recent studies have shown weight loss, improvement in glucose and lipid metabolism following oxytocin administration, and no serious adverse effects have been reported yet.
Keywords:
obesity – Oxytocin – metabolic syndrome
Autoři: K. Pozorčiaková 1; M. Kostková 1; J. Vojtková 1; M. Čiljaková 1,2; Peter Bánovčin 1
Působiště autorů: Klinika detí a dorastu, JLF UK a UNM, Martin, Slovensko 1; Detské oddelenie NEDÚ, Ľubochňa, Slovensko 2
Vyšlo v časopise: Čes-slov Pediat 2020; 75 (1): 40-45.
Kategorie: Přehledový článek
Souhrn
Obezita predstavuje závažné ochorenie, ktoré postihuje deti nielen v rozvinutých, ale aj v rozvojových krajinách. Obezita vedie k mnohým vážnych komplikáciám, ktoré u pacienta môžu viesť k skráteniu dĺžky, ako aj k zníženiu kvality života. Je potrebné venovať tomuto ochoreniu pozornosť už v detskom veku, keďže obezita u detí predisponuje k obezite v dospelom veku.
Oxytocín je hormón, ktorý sa syntetizuje v hypotalame a je známy hlavne svojimi účinkami pri pôrode a laktácii. Do popredia sa dostáva vplyv oxytocínu na metabolizmus – efekt na sekréciu inzulínu, lipolýzu a príjem potravy. U pacientov s obezitou boli zaznamenané zmeny koncentrácie oxytocínu. Intranazálne podávanie oxytocínu sa javí ako možná terapeutická metóda liečby obezity. Práce z posledného obdobia poukazujú na pokles hmotnosti, zlepšenie glukózového a lipidového metabolizmu po podaní oxytocínu, pričom zatiaľ neboli zaznamenané závažné nežiaduce účinky.
Klíčová slova:
Oxytocin – obezita – metabolický syndrom
ÚVOD
Celosvetová prevalencia nadváhy a obezity rastie nielen v detskom veku. Od roku 1980 sa prevalencia zdvojnásobila. Výrazný nárast je zaznamenaný u detí a adolescentov v rozvinutých krajinách. Avšak závažný vzostup nastal aj v rozvojových krajinách. Predpokladá sa, že do roku 2020 bude v detskej populácii celosvetová prevalencia nadváhy a obezity 9,1 %, pričom postihne 60 miliónov detí [1–3]. U slovenských a českých detí má obezita a nadváha taktiež stúpajúci trend. V sledovanom období 2001/2002–2013/2014 došlo k vzostupu nadváhy o viac ako 50 % [4, 5]. Obezita je po vylúčení endokrinopatií, monogénových a syndrómových foriem obezity zvyčajne multifaktoriálne ochorenie. Uplatňujú sa nesprávne stravovacie návyky, psychologické faktory, nízka pohybová aktivita a aj genetická predispozícia [6, 7]. Obezita má vážne zdravotné, ako aj sociálnoekonomické dôsledky. Je významným rizikovým faktorom širokého spektra ochorení (diabetes mellitus II. typu, ochorenia kardiovaskulárneho či pohybového systému, poruchy spánku, psychosociálne problémy) [8–11]. Nové možnosti liečby sú predmetom štúdií [12].
Oxytocín, nazývaný aj hormón lásky, je tvorený deviatimi aminokyselinami. Tvorí sa v hypotalame, hlavne v nucleus paraventricularis. Syntetizuje sa ako inaktívny prekurzorový proteín, ktorý je enzýmami rozložený na menšie fragmenty. Prekurzor obsahuje aj neurofyzín I, spolu s ktorým je oxytocín transportovaný do neurohypofýzy [13, 14]. K tvorbe oxytocínu dochádza aj v iných tkanivách – v retine, týmuse, pankrease, adipocytoch, placente, dreni nadobličiek, ováriách, maternici, obličkách, cievach, koži, v srdci, v žltom teliesku, amniu, intersticiálnych Leydigových bunkách [15, 16]. Oxytocín je metabolizovaný oxytocinázou (leucylcystinyl aminopeptidázou), pričom degradácia prebieha najmä v pečeni a obličkách [17, 18]. Oxytocínový receptor (OXTR) bol identifikovaný vo viacerých tkanivách – v myoepiteli prsnej žľazy, myometriu maternice, endometriu, deciduu, ováriu, semenníku, nadsemenníku, semenovode, obličke, srdci, týmuse, pankrease, adipocytoch ako aj v mozgu a mieche [15]. Po naviazaní oxytocínu na OXTR dochádza k aktivácii rôznych intracelulárnych signálnych dráh. Hlavná signálna dráha je cez Gq/fosfolipázu C/inozitol 1,4,5-trifosfát [15, 19]. Hlavná a najznámejšia funkcia oxytocínu je pri pôrode a laktácii. Významné sú aj jeho sociálne funkcie – vplyv na starostlivosť o potomstvo a materské správanie. K ďalším funkciám patrí vplyv na vývoj mozgu, kardiomyogenézu, osteogenézu, kontrakciu srdcového svalu, moduláciu parasympatika a sympatika či vplyv na nocicepciu, analgéziu a zmyslové vnímanie [13, 20].
ÚLOHA OXYTOCÍNU V METABOLIZME
Nové poznatky poukazujú na úlohu oxytocínu v metabolizme glukózy, lipolýze, β-oxidácii mastných kyselín či vplyv na zníženie príjmu potravy. Oxytocín je uvoľňovaný z neurohypofýzy a stimuluje ďalšie uvoľňovanie pozitívnou spätnou väzbou (čierne šípky). Moduluje metabolické procesy v tkanivách (sivé šípky), čo vedie k redukcii príjmu potravy a telesnej hmotnosti (obr. 1) [21].
Obr. 1. Zapojenie oxytocínu do metabolizmu. Oxytocín je uvoľňovaný z neurohypofýzy a stimuluje ďalšie uvoľňovanie pozitívnou spätnou väzbou (čierne šípky). Moduluje metabolické procesy v tkanivách (sivé šípky), čo vedie k redukcii príjmu potravy a telesnej hmotnosti.
Skratky: CCK – cholecystokinín, DVC – dorzálny vagálny komplex, NTS – nucleus tractus solitarius, PVN – nucleus paraventricularis, SON – nucleus paraopticus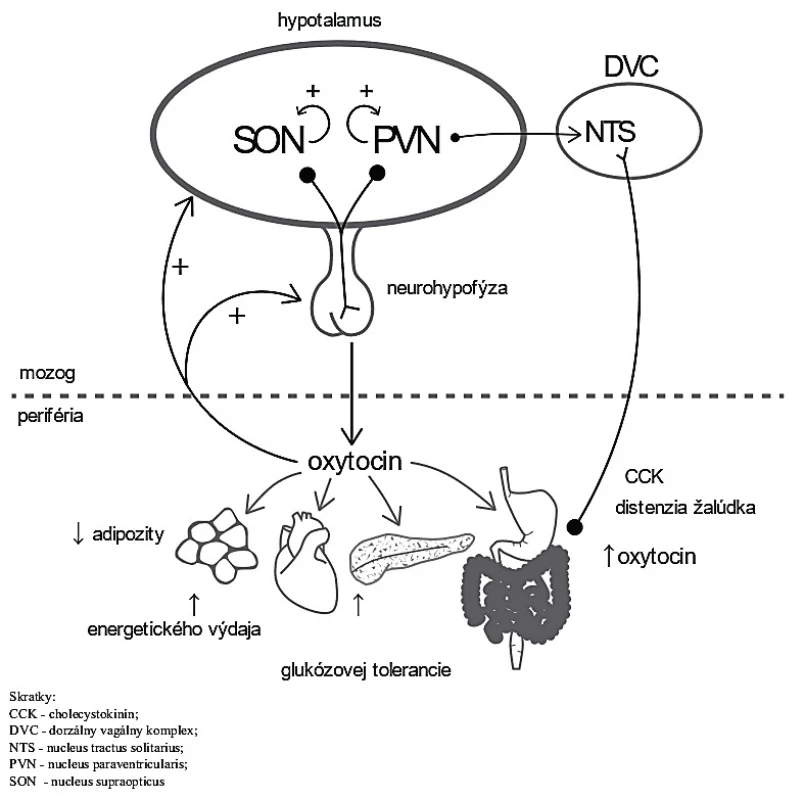
V štúdiách na zvieracích modeloch viedlo podávanie oxytocínu ku zlepšeniu inzulínovej senzitivity, zníženiu koncentrácie glukózy, k zlepšeniu vychytávania glukózy [22–24]. Metabolické účinky oxytocínu boli výraznejšie u zvierat s indukovanou obezitou [21]. Po intranazálnom podaní oxytocínu zdravým mužom došlo k menšiemu vzostupu glykémie, skorému zvýšeniu koncentrácie inzulínu a C-peptidu a taktiež sa zvýšila vnímavosť β-buniek pankreasu [25]. Zlepšenie inzulínovej senzitivity je spôsobené znížením glukotoxicity a lipotoxicity a taktiež reguláciou hormónov ako leptín a adiponektín [22, 26–28]. Oxytocín taktiež znižuje hypertrofiu pankreatických ostrovčekov [26, 29]. Okrem toho oxytocín ochraňuje β-bunky pankreasu pred bunkovou smrťou spôsobenou metabolickým stresom [30].
Oxytocín moduluje adipogenézu, zlepšuje lipidový profil znížením LDL cholesterolu, triacylglycerolov a zlepšením HDL cholesterolu, indukuje lipolýzu a β-oxidáciu mastných kyselín [22, 26]. Podanie oxytocínu bolo sprevádzané znížením plazmatickej koncentrácie triacyl-glycerolov, došlo k zvýšeniu hormón-senzitívnej lipázy v tukovom tkanive [22]. Navyše oxytocín redukoval expresiu syntázy mastných kyselín [31], viscerálny tuk a steatózu pečene [28].
Okrem toho oxytocín pôsobí modulačne na hypofyzárne aj periférne hormóny ako inzulín, cholecystokinín, adrenalín [13, 20]. Štúdie naznačujú spojenie medzi neurónmi oxytocínu a leptínom. Autori udávajú, že neuróny z nucleus paraventricularis produkujúce oxytocín môžu byť súčasťou leptínového okruhu zúčastňujúceho sa regulácie príjmu potravy a že leptín cieli na špecifickú subpopuláciu neurónov produkujúcich oxytocín [32]. Podanie oxytocínu viedlo k poklesu hmotnosti aj u leptín-rezistentných zvierat. Z toho vyplýva, že liečba oxytocínom môže čiastočne prekonať nedostatok leptínu alebo leptínovú rezistenciu [33]. Dlhodobé podávanie oxytocínu viedlo k výraznej redukcii telesného tuku, zníženiu glykémie nalačno, zlepšeniu inzulínovej senzitivity a glukózovej tolerancie u myší s deficitom leptínového receptora [34].
ZMENY KONCENTRÁCIE OXYTOCÍNU
Zmeny koncentrácie oxytocínu sú predmetom celosvetových štúdií. Štúdie prebiehajú na zvieracích modeloch, ale sledujú sa zmeny aj u ľudí. Veľa štúdií sa zaoberá zmenou koncentrácie oxytocínu u pacientov s autizmom, psychiatrickými poruchami [35, 36]. Štúdie sledujú zmeny koncentrácie oxytocínu v plazme, sére, moči či v likvore.
Na základe nových poznatkov o zapojení oxytocínu v metabolizme sa do popredia dostávajú štúdie zamerané na zmeny koncentrácie oxytocínu u zvierat ako aj ľudí s poruchami výživy – nadhmotnosťou či podvýživou. U pacientov s mentálnou anorexiou bola zistená znížená koncentrácia oxytocínu v likvore [37], v sére [38, 39] či v plazme [40]. Na druhej strane u pacientov s bulimia nervosa neboli zaznamenané zmeny koncentrácie oxytocínu [41].
Vo viacerých štúdiách bola zistená znížená koncentrácia oxytocínu asociovaná s obezitou u zvierat aj ľudí [42–45]. Znížená koncentrácia oxytocínu bola zistená u pacientov s diabetes mellitus II. typu [44, 46], ale aj u pacientov s diabetes mellitus I. typu [47]. Na druhej strane sú štúdie, v ktorých bola zistená zvýšená koncentrácia oxytocínu [48, 49, 50], prípadne vyššia koncentrácia oxytocínu u obéznych pacientov v porovnaní s obéznymi pacientami s diabetes mellitus II. typu [51, 52].
Zatiaľ prebehlo len veľmi málo štúdií zaoberajúcich sa vyšetrením koncentrácie oxytocínu v detskej populácii. Štúdia Binayho z roku 2017 sledovala sérové koncentrácie irisinu a oxytocínu u obéznych detí. V prospektívnej štúdii vyšetrovali 90 detí vo veku 10–18 rokov, pričom 30 detí tvorilo kontrolnú skupinu detí s veku primeranou hmotnosťou. Koncentrácia oxytocínu bola nižšia v skupine obéznych pacientov (10,17 ± 5,21 ng/l) v porovnaní s kontrolou (12,05 ± 4,43 ng/l). Nezistili signifikantný rozdiel medzi pohlaviami. Rovnako bolo zistené, že detskí obézni pacienti s metabolickým syndrómom mali signifikantný pokles koncentrácie oxytocínu v sére (8,65 ± 2,69 ng/l) oproti skupine obéznych pacientov bez metabolického syndrómu (10,87 ± 5,93 ng/l) [45]. Štúdia Lawsonovej z roku 2014 zisťovala sekréciu oxytocínu u adolescentných dievčat s primeranou váhou. U amenoreických atlétok koncentrácia oxytocínu pozitívne korelovala s váhou, BMI [53].
Nemenej zaujímavé sú štúdie pacientov s Praderovej-Williho syndrómom (PWS), ktorý je spojený so závažným stupňom obezity. U pacientov s PWS bola zaznamenaná redukcia počtu aj veľkosti neurónov nucleus paraventricularis produkujúcich oxytocín [54], taktiež bola zistená znížená funkcia génu pre OXTR [55]. Na druhej strane bola publikovaná štúdia, kde u pacientov s PWS bola plazmatická koncentrácia oxytocínu zvýšená [56]. Jednou z hypotéz je, že pacienti s PWS majú veľa inaktívnej formy oxytocínu. Štúdia z roku 2017 naznačuje, že deficit enzýmu prohormón konvertáza 1 (PC1) môže hrať rolu v hormonálnych abnormalitách pri PWS. Pričom PC1 je jedným z enzýmov, ktorý sa podieľa na štiepení oxytocínu [57]. U detí do 11 rokov bol zistený pozitívny vplyv podávania intranazálneho oxytocínu na sociálne, emočné správanie a príjem potravy. U adolescentov sa dané efekty nezistili [58]. U dojčiat viedlo podávanie oxytocínu k zlepšeniu sania a prehĺtania [59].
U pacientov s metabolickým syndrómom a diabetes mellitus II. typu bola koncentrácia oxytocínu signifikantne znížená v porovnaní s pacientami s obezitou a euglykémiou [51, 52]. Okrem toho oxytocín negatívne koreloval s glykozylovaným hemoglobínom, glykémiou nalačno [52, 60], koncentráciou betatrofínu [52]. Vzťah k adiponektínu je diskutabilný. Štúdie zistili pozitívnu [60], aj negatívnu koreláciu [51] s koncentráciou oxytocínu.
Signifikantne zníženú koncentráciu oxytocínu u pacientov s obezitou a diabetom II. typu potvrdila aj štúdia Qiana a kol. Nízky oxytocín bol asociovaný s vyšším BMI, obvodom pása, pomerom obvod pása/obvod bokov, cholesterolom, HOMA-IR [42]. Po rozdelení pacientov na základe sérovej koncentrácie oxytocínu bolo zistené, že pacienti s nízkou koncentráciou oxytocínu majú signifikantne vyššie riziko metabolického syndrómu [44]. K presne opačným výsledkom dospela štúdia Szulca a kol. Pacienti s vyšším sérovým oxytocínom mali vyššie riziko metabolického syndrómu, pričom vyšší oxytocín bol asociovaný s centrálnym tukom a obvodom pása [49]. Vyšší sérový oxytocín bol zaznamenaný aj u starších pacientov s metabolickým syndrómom. Autori taktiež zaznamenali vyššiu koncentráciu oxytocínu u mužov než u žien [61].
OXYTOCÍN AKO MOŽNOSŤ LIEČBY OBEZITY
Nakoľko má oxytocín peptidovú štruktúru, perorálne podávanie nie je účinné, preto sa intranazálne podávanie oxytocínu javí ako nádejné farmakologické riešenie obezity [27, 62, 63]. Štúdia na primátoch ukazuje, že intravenózne alebo intranazálne podaný oxytocín vo suprafyziologickej koncentrácii sa dostáva do mozgovomiechového moku [64]. Okrem toho exogénne podaný oxytocín podporuje endogénnu sekréciu oxytocínu, a to dvomi spôsobmi – priamo prostredníctvom autoreceptorov v nucleus paraventricularis a aj nepriamo cez periférne OXTR [22, 65]. Pri používaní bol oxytocín veľmi dobre tolerovaný, bez nežiaducich vedľajších účinkov alebo len s minimálnymi nežiaducimi účinkami [66–68]. Štúdie boli zatiaľ realizované len na malej vzorke pacientov, s nedostatočnou dĺžkou liečby, a preto sú potrebné ďalšie štúdie, aby sa preukázala účinnosť oxytocínu na sociálne správanie, ako aj vplyv na príjem potravy a vylúčili sa nežiadúce účinky pri dlhodobej liečbe intranazálnym oxytocínom.
Po jednorazovej dávke oxytocínu nedošlo k signifikantnej zmene apetítu počas 24 hodín u zdravej kontroly. Pacientky s bulímiou mali nižší príjem kalórií. Došlo aj k malému zvýšeniu senzitivity emocionálneho rozpoznávania v oboch skupinách. Avšak na pacientky s mentálnou anorexiou nebol zaznamenaný žiadny vplyv oxytocínu [69].
Chronický príjem oxytocínu znižuje príjem jedla a indukuje stratu hmotnosti. Potláča príjem karbohydrátov, redukuje príjem sacharózy, nápojov sladených fruktózou, ako aj vysoko tukovej potravy [22, 24, 28]. V pilotnej klinickej štúdii podávali ľuďom 4x denne oxytocín intranazálne alebo placebo po dobu 8 týždňov. Po 4 týždňoch došlo k redukcii hmotnosti o 4,6 ± 3,2 kg. Po 8 týždňoch bola hmotnosť o 8,9 ± 5,4 kg nižšia než pred začatím liečby. Väčší hmotnostný úbytok bol zaznamenaný v skupine pacientov s vyšším stupňom obezity. Pokles hmotnosti bol sprevádzaný aj zmenším obvodu pása a bokov. Počas štúdie neboli žiadne nežiaduce účinky [27]. Veľmi dôležité výsledky ukázala štúdia z roku 2016. U obéznych mužov mal oxytocín väčší inhibičný efekt na príjem potravy než u mužov s normálnou hmotnosťou [70]. Nemeckí autori skúmali efekt oxytocínu podávaného intranazálne na zdravých mužov. Oxytocín redukoval príjem potravy, obzvlášť čokoládových sušienok (cookies) o 25 % [71]. Redukcia kalorického príjmu po intranazálnom podaní oxytocínu bez nežiaducich účinkov sa potvrdila aj v štúdii amerických autorov [63]. Navyše po intranazálnom podaní oxytocínu došlo k zvýšenej kognitívnej kontrole túžby po jedle u žien [72].
Štúdie naznačujú, že dočasný energetický stav ako aj nadmerné energetické zásoby ovplyvňujú individuálnu odozvu na intranazálne podávaný oxytocín [73]. Väčší účinok oxytocínu u obéznych jedincov môže byť spôsobený vyššími hladinami cholesterolu, ktoré zvyšujú afinitu oxytocínu k jeho receptoru [15, 21].
Oxytocín ovplyvňuje redukciu hmotnosti nielen znížením príjmu potravy, ale aj zvyšuje výdaj energie a tým zabezpečuje udržanie redukcie hmotnosti [22–24]. Presný mechanizmus zatiaľ nie je známy, ale ukazuje sa, že môže viesť k zachovaniu čistej telesnej hmotnosti, aktivuje hnedé tukové tkanivo a konverziu bieleho tukového tkaniva na béžové tukové bunky, ktoré sú schopné termogenézy [53, 74].
ZÁVER
Oxytocín je komplexný hormón pôsobiaci na veľké množstvo telesných procesov. Súčasné štúdie sa zameriavajú hlavne na jeho zapojenie v metabolizme. Viaceré štúdie naznačujú, že nízke koncentrácie oxytocínu sú spojené s obezitou a obzvlášť s metabolickým syndrómom. Preto sa intranazálne podanie oxytocínu javí ako jedna z nových možností farmakoterapie obezity.
Práca bola podporená Grantom UK/229/2017.
Došlo: 6. 3. 2019
Přijato: 27. 3. 2019
MUDr. Katarína Pozorčiaková
Klinika detí a dorastu
JLF UK a UNM
Kollárova 2
036 01 Martin
Slovenská republika
e-mail: kpozorciakova@gmail.com
Zdroje
1. Ng M, Fleming T, Robinson M, et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet 2014; 384 (9945): 766–781.
2. WHO. Obesity and overweight. 2016. http://who.int/mediacentre/factsheets/fs311/en/.
3. De Onis M., Blössner M, Borghi E. Global prevalence and trends of overweight and obesity among preschool children. Am J Clin Nutr 2010; 92 (5): 1257–1264.
4. OECD. Obesity update. 2017. http://www.oecd.org/health/health-systems/Obesity-Update-2017.pdf.
5. OECD. Overweight and obesity among children. Health at a Glance 2017: OECD Indicators, OECD Publishing, Paris. https://doi.org/10.1787/health_glance-2017-22-en.
6. Hainer V, et al. Základy klinické obezitologie. 2. prepracované a doplnené vyd. Praha: Grada Publishing, 2011.
7. Toschke AM, Vignerova J, Lhotska L, et al. Overweight and obesity in 6 - to 14-year-old Czech children in 1991: protective effect of breast--feeding. J Pediatr 2002; 141 (6): 764–769.
8. Czippelová B, Turianiková Z, Krohová J, et al. Arterial stiffness in obese adolescents – a relation to vascular resistance and sympathetic nervous system activity. Acta Physiol 2017; 221: Suppl: S713.
9. Durdík P, Sujanska A, Suroviakova S, et al. Sleep architecture in children with common phenotype of obstructive sleep apnea. J Clin Sleep Med 2018; 14 (1): 9–14.
10. Šujanská A, Ďurdík P, Suroviaková S, et al. Chrápanie u detí predškolského a školského veku. Lek Obz 2016; 65 (11): 412–417.
11. Suroviaková S, Šujanská A, Ďurdík P, et al. Centrálne spánkove apnoe u detí. Lek Obz 2016; 65 (11): 433–437.
12. Pražienková V, Holubová M, Pelantová H, et al. Impact of novel palmitoylated prolactin-releasing peptide analogs on metabolic changes in mice with diet-induced obesity. PLoS One 2017; 12 (8): e0183449.
13. Javorka K, et al. Lekárska fyziológia. Tretie, prepracované a doplnené vydanie. Martin: Osveta, 2009.
14. Lane N. Oxygen: The Molecule that Made the World. Oxford: Oxford University Press, 2002.
15. Gimpl G, Fahrenholz F. The oxytocin receptor system: structure, function, and regulation. Physiol Rev 2001; 81 (2): 629–683.
16. Kiss A, Mikkelsen JD. Oxytocin – anatomy and functional assignments: a minireview. Endocr Regul 2005; 39 (3): 97–105.
17. NCBI. LNPEP leucyl and cystinyl aminopeptidase [Homo sapiens (human)]. 2019. https://www.ncbi.nlm.nih.gov/gene?Db=gene&Cmd=ShowDetailView&TermToSearch=4012.
18. Fjellestad-Paulsen A, Lundin S. Metabolism of vasopressin, oxytocin and their analogues [Mpa1, D-Arg8]-vasopressin (dDAVP) and [Mpa1, D-Tyr(Et)2, Thr4, Orn8]-oxytocin (anatocin) in human kidney and liver homogenates. Regul Pept 1996; 67 (1): 27–32.
19. Smith R. Parturition. N Engl J Med 2007; 356 (3): 271–283.
20. Yang HP, Wang L, Han L, et al. Nonsocial functions of hypothalamic oxytocin. ISRN Neuroscience 2013. doi: 10.1155/2013/179272.
21. Ho JM, Blevins JE. Coming full circle: Contributions of central and peripheral oxytocin actions to energy balance. Endocrinology 2013; 154 (2): 589–596.
22. Deblon N, Veyrat-Durebes C, Bourgoin L, et al. Mechanisms of the anti-obesity effects of oxytocin in diet-induces obese rats. PLoS One 2011; 6 (9): e25565.
23. Morton GJ, Thatcher BS, Reidelberger RD, et al. Peripheral oxytocin suppresses food intake and causes weight loss in diet-induced obese rats. Am J Physiol Endocrinol Metab 2012; 302: E124–E144.
24. Blevins JE, Graham JL, Morton GJ, et al. Chronic oxytocin administration inhibits food intake, increases energy expenditure, and produces weight loss in fructose-fed obese rhesus monkeys. Am J Physiol Regul Integr Comp Physiol 2015; 308: R431–R438.
25. Klement J, Ott V, Rapp K, et al. Oxytocin improves β-cell responsivity and glucose tolerance in healthy men. Diabetes 2017; 66 (2): 264–271.
26. Elabd SK, Sabry I, Mohasseb M, et al. Oxytocin as a novel therapeutic option for type I diabetes and diabetic osteopathy. Endocr Regul 2014; 48 (2): 87–102.
27. Zhang H, Wu C, Chen Q, et al. Treatment of obesity and diabetes using oxytocin or analogs in patients and mouse models. PLoS One 2013; 8: e61477.
28. Maejima Y, Iwasaki Y, Yamahara Y, et al. Peripheral oxytocin treatment ameliorates obesity by reducing food intake and visceral fat mass. Aging (Albany NY) 2011; 3 (12): 1169–1177.
29. Zhang G, Bai H, Zhang H, et al. Neuropeptide exocytosis involving synaptotagmin-4 and oxytocin in hypothalamic programming of body weight and energy balance. Neuron 2011; 69 (3): 523–535.
30. Watanabe S, Wei FY, Matsunaga T, et al. Oxytocin protects against stress-induced cell death in murine pancreatic β-cells. Sci Rep 2016; 6 : 25185.
31. Altirriba J, Poher AL, Caillon A, et al. Divergent effects of oxytocin treatment of obese diabetic mice on adiposity and diabetes. Endocrinology 2014; 155 (11): 4189–4201.
32. Perello M, Raingo J. Leptin activates oxytocin neurons of the hypothalamic paraventricular nucleus in both control and diet-induced obese rodents. PLoS One 2013; 8 (3): e59625.
33. Altirriba J, Poher AL, Rohner-Jeanrenaud F. Chronic oxytocin administration as a treatment against impaired leptin signaling or leptin resistance in obesity. Front Endocrinol (Lausanne) 2015; 6 : 119.
34. Plante E, Menaouar A, Danalache BA, et al. Oxytocin treatment prevents the cardiomyopathy observed in obese diabetic male db/db mice. Endocrinology 2015; 156 (4): 1416–1428.
35. Husarova VM, Lakatosova S, Pivovarciova A, et al. Plasma oxytocin in children with autism and its correlations with behavioral parameters in children and parents. Psychiatry Investig 2016;13 (2): 174–183.
36. Ozsoy S, Esel E, Kula M. Serum oxytocin levels in patients with depression and the effects of gender and antidepressant treatment. Psychiatry Res 2009; 169 (3): 249–252.
37. Kaye WH. Neuropeptide abnormalities in anorexia nervosa. Psychiatry Res 1996; 62 (1): 65–74.
38. Lawson EA, Donoho DA, Blum JI, et al. Decreased nocturnal oxytocin levels in anorexia nervosa are associated with low bone mineral density and fat mass. J Clin Psychiatry 2011; 72 (11): 1546–1551.
39. Afinogenova Y, Schmelkin C, Plessow F, et al. Low fasting oxytocin levels are associated with psychopathology in anorexia nervosa in partial recovery. J Clin Psychiatry 2016; 77 (11): e1483–e1490.
40. Hoffman ER, Brownley KA, Hamer RM, et al. Plasma, salivary, and urinary oxytocin in anorexia nervosa: a pilot study. Eat Behav 2012; 13 (3): 256–259.
41. Monteleone AM, Scognamiglio P, Volpe U, et al. Investigation of oxytocin secretion in anorexia nervosa and bulimia nervosa: Relationships to temperament personality dimensions. Eur Eat Disord Rev 2016; 24 (1): 52–56.
42. Qian W, Zhu T, Tang B, et al. Decreased circulating levels of oxytocin in obesity and newly diagnosed type 2 diabetic patients. J Clin Endocrinol Metab 2014; 99 (12): 4683–4689.
43. Gajdosechova L, Krskova K, Segarra AB, et al. Hypooxytocinaemia in obese zucker rats relates to oxytocin degradation in liver and adipose tissue. J Endocrinol 2014; 220 (3): 333–343.
44. Yuan G, Qian W, Pan R, et al. Reduced circulating oxytocin and high-molecular-weight adiponectin are risk factors for metabolic syndrome. Endocr J 2016; 63 (7): 655–662.
45. Binay Ç, Paketçi C, Güzel S, et al. Serum irisin and oxytocin levels as predictors of metabolic parameters in obese children. J Clin Res Pediatr Endocrinol 2017; 9 (2): 124–131.
46. Eisenberg Y, Dugas LR, Akbar A, et al. Oxytocin is lower in African American men with diabetes and associates with psycho-social and metabolic health factors. PLoS One 2018; 4 (13): e0190301.
47. Kujath AS, Quinn L, Elliott ME, et al. Oxytocin levels are lower in premenopausal women with type 1 diabetes mellitus compared with matched controls. Diabetes Metab Res Rev 2015; 31 (1): 102–112.
48. Schroeder M, Zahoory-Sharon O, Shbiro L, et al. Development of obesity in the Otsuka Long-Evans Tokushima Fatty rat. Am J Physiol Regul Integr Comp Physiol 2009; 297 (6): R1749–R1760.
49. Szulc P, Amri EZ, Varennes A, et al. High serum oxytocin is associated with metabolic syndrome in older men. Diabetes Res Clin Pract 2016; 122 : 17–27.
50. Schorr M, Marengi DA, Pulumo RL, et al. Oxytocin and its relationship to body composition, bone mineral density, and hip geometry across the weight spectrum. J Clin Endocrinol Metab 2017; 102 (8): 2814–2824.
51. Al-Nouaaimi MM, Kasabri V, Akour A, et al. Evaluation of the correlation of oxytocin plasma levels and metabolic syndrome biomarkers (leptin, adiponectin and resistin) in newly diagnosed type 2 diabetes patients in Jordan: A cross sectional study. Jordan J Pharmaceutical Sciences 2016; 9 (2).
52. Al-Rawashdeh A, Kasabri V, Bulatova N, et al. The correlation between plasma levels of oxytocin and betatrophin in non-diabetic and diabetic metabolic syndrome patients: A cross sectional study from Jordan. Diabetes Metab Syndr 2016; 11 (1): 59–67.
53. Lawson EA, Ackerman KE, Slattery M, et al. Oxytocin secretion is related to measures of energy homeostasis in young amenorrheic athletes. J Clin Endocrinol Metab 2014; 99 (5): E881–E885.
54. Swaab DF, Purba JS, Hofman MA. Alterations in the hypothalamic paraventricular nucleus and its oxytocin neurons (putative satiety cells) in Prader-Willi syndrome: a study of five cases. J Clin Endocrinol Metab 1995; 80 (2): 573–579.
55. Bittel DC, Kibiryeva N, Dasouki M, et al. A 9-year-old male with a duplication of chromosome 3p25.3p26.2: Clinical report and gene expression analysis. Am J Med Genet A 2006; 140 (6): 573–579.
56. Johnson L, Manardo, AM, Miller JL, et al. Elevated plasma oxytocin levels in children with Prader-Willi syndrome compared with healthy unrelated siblings. Am J Med Genet A 2016; 170 : 594–601.
57. Burnett LC, Leduc CA, Sulsona CR, et al. Deficiency in prohormone convertase PC1 impairs prohormone processing in Prader-Willi syndrome. J Clin Invest 2017; 127 : 293–305.
58. Kuppens RJ, Donze SH, Hokkens-Koelega ACS. Promising effects of oxytocin on social and food-related behavior in your children with Prader-Willi syndrome: a randomised, double-blind, controlled crossover trial. Clin Endocrinol 2016; 85 : 979–987.
59. Tauber M, Boulanouar K, Diene G, et al. The use of oxytocin to improve feeding and social skills in infants with Prader-Willi syndrome. Pediatrics 2017; 139: e20162976.
60. Akour A, Kasabri V, Bulatova N, et al. Association of oxytocin with glucose intolerance and inflammation biomarkers in metabolic syndrome patients with and without prediabetes. Rev Diabet Stud 2018; 14 (4): 364–371.
61. Hosny S, Bekhet M, Bahaaeldin A, et al. Serum oxytocin in elderly patiens with metabolic syndrome. Endocrine Abstracts 2018; 56: P564.
62. Blevins JE, Baskin DG. Translational and therapeutic potential of oxytocin as an anti-obesity strategy: insights from rodents, nonhuman primates and humans. Physiol Behav 2015; 152 : 438–449.
63. Lawson EA, Marengi DA, DeSanti RL, et al. Oxytocin reduces caloric intake in men. Obesity 2015; 23 (5): 950–956.
64. Lee MR, Scheidweiler KB, Diao XX, et al. Oxytocin by intranasal and intravenous routes reaches the cerebrospinal fluid in rhesus macaques: determination using a novel oxytocin aasay. Mol Psychiatry 2018; 23 (1): 115–122.
65. Zhang G, Cai D. Circadian intervention of obesity development via resting-stage feeding manipulation or oxytocin treatment. Am J Physiol Endocrinol Metab 201; 301 (5): E1004–E1012.
66. Macdonald E, Dadds MR, Brennan JL, et al. A review of safety, side-effects and subjective reactions to intranasal oxytocin in human research. Psychoneuroendocrinology 2011; 36 (8): 1114–1126.
67. Anagnostou E, Soorya L, Bian J, et al. Intranasal oxytocin in the treatment of autism spectrum disorders: a review of literature and early safety and efficacy data in youth. Brain Res 2014; 1580 : 188–198.
68. Miller JL, Tamura R, Butler MG, et al. Oxytocin treatment in children with Prader-Willi syndrome: a double-blind, placebo-controlled, crossover study. Am J Med Genet A 2017; 173 : 1243–1250.
69. Kim YR, Eom JS, Yang JW, et al. The impact of oxytocin on food intake and emotion recognition in patients with eating disorders: A double blind single dose within-subject cross-over design. PLoS One 2015; 10 (9): e0137514.
70. Thienel M, Fritsche A, Heinrichs M, et al. Oxytocin‘s inhibitory effect on food intake is stronger in obese than normal-weight men. Int J Obes (Lond) 2016; 40 (11): 1707–1714.
71. Ott V, Finlayson G, Lehnert H, et al. Oxytocin reduces reward-driven food intake in humans. Diabetes 2013; 62 (10): 3418–3425.
72. Striepens N, Schröter F, Stoffel-Wagner B, et al. Oxytocin enhances cognitive control of food craving in women. Hum Brain Mapp 2016; 37 (12): 4276–4285.
73. Olszewski PK, Klockars A, Levine AS. Oxytocin and potential benefits for obesity treatment. Curr Opin Endocrinol Diabetes Obes 2017; 24 (5): 320–325.
74. Takayanagi Y, Kasahara Y, Onaka T, et al. Oxytocin receptor-deficient mice developed late-onset obesity. Neuroreport 2008; 19 (9): 951–955.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2020 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Děti narozené po asistované reprodukci v České republice v letech 2013–2015
- Vrodené a geneticky podmienené ochorenia dýchacieho traktu z pohľadu genetika
- Genetické příčiny syndromu náhlého úmrtí kojence. Co přineslo sekvenování nové generace
- Dědičné arytmické syndromy v dětském věku
- Editorial: Česko-slovenská Pediatrie v roce 2020
- Nikdy nie je neskoro – herpetická encefalitída vyvolaná vírusom HSV1
- Editorial: Současné možnosti genetické diagnostiky
- Oxytocín a obezita
- Poděkování spolupracovníkům za rok 2019
- Rozšířené testování nosičství recesivních chorob (CarrierTest) v klinické praxi
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nikdy nie je neskoro – herpetická encefalitída vyvolaná vírusom HSV1
- Dědičné arytmické syndromy v dětském věku
- Genetické příčiny syndromu náhlého úmrtí kojence. Co přineslo sekvenování nové generace
- Rozšířené testování nosičství recesivních chorob (CarrierTest) v klinické praxi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



