-
Medical journals
- Career
Je prognóza solitárnej obličky u detí priaznivá?
Authors: G. Koľvek 1; Ľ. Podracká 2
Authors‘ workplace: Klinika detí a dorastu, LF UPJŠ a DFN, Košice 1; I. detská klinika LFUK a DFNsP, Bratislava 2
Published in: Čes-slov Pediat 2015; 70 (5): 282-286.
Category: Original Papers
Overview
Cieľom prospektívnej klinickej štúdie bolo posúdiť kumulatívny výskyt zvýšenej albuminúrie, hypertenzie a zníženia glomerulovej filtrácie (eGFR) ako dôkaz poškodenia obličiek u detí so solitárnou funkčnou obličkou (SO). V súbore 42 detí (23 chlapcov, 27 detí s vrodenou a 15 detí so získanou príčinou solitárnej obličky) sme prospektívne v pravidelných intervaloch vyšetrovali krvný tlak, albuminúriu a eGFR, vypočítali kumulatívnu incidenciu rizikových faktorov a analyzovali dĺžku prežívania bez „poškodenia“ obličiek. Medián nefrologického sledovania bol 4,8 ± 4,4 rokov. Počas sledovania splnilo kritériá poškodenia obličiek definovaného prítomnosťou hypertenzie (10/42; 23,8 %), závažne zvýšenej albuminúrie (3/42; 7,1 %) a signifikantne redukovanej eGFR (<60 ml/min/1,73 m2) (5/42; 11,9 %), a/alebo užívaním antihypertenzíva (11/42; 26,2 %) spolu 16 zo 42 pacientov (38,1 %). Deti so solitárnou obličkou asociovanou s vrodenou vývojovou chybou (CAKUT) mali signifikantne častejšie poškodenie obličiek (medián rozvoja poškodenia obličiek 12,8 rokov).
Záver:
Poškodenie obličiek sa vyvíja u významnej časti pacientov so SO už v detskom veku, a to najmä u tých s CAKUT v jednostrannej obličke. U každého dieťaťa so solitárnou obličkou je potrebné pravidelne vyšetrovať albuminúriu, krvný tlak a eGFR.Kľúčové slová:
albuminúria, deti, glomerulová filtrácia, hypertenzia, solitárna obličkaÚVOD
V roku 1988 Brenner et al. postulovali priekopnícku hypotézu hyperfiltrácie, ktorá vychádzala z originálnych experimentov na potkanoch so subtotálnou nefrektómiou [1, 2]. Podľa tejto jedinečnej hypotézy zníženie počtu funkčných nefrónov navodí hemodynamické zmeny v zostávajúcich (remnantných) glomeruloch, čo vedie v konečnom dôsledku ku skleróze glomerulov [3, 4]. Hypotézu hyperfiltrácie podporujú výsledky originálnych histomorfometrických analýz z autopsií ako aj výsledky klinických pozorovaní u hypertonikov [5, 6, 7]. Vrodený počet nefrónov, ktorý medzi jednotlivcami varíruje od 200 tisíc až po viac ako 2,5 milióna na jednu obličku, sa môže analogicky chápať ako určujúci faktor prežívania obličiek [8, 9]. Avšak meranie počtu ba ani odhady počtu nefrónov in vivo zatiaľ nie sú reálne.
Z tohto aspektu solitárna funkčná oblička (SO) predstavuje unikátny model redukcie obličkovej masy a podľa teórie hyperfiltrácie by mala postupne viesť ku sklerotizácii glomerulov a systémovej hypertenzii. V kontraste s tým sa javí stabilná funkcia zostávajúcej obličky u živých darcov štepu (viac ako 25 rokov od nefrektómie) ako „nelogický” paradox [10, 11]. Aj názory na danú problematiku u detí nie sú jednotné a o prognóze SO sa roky vedú ostré vedecké spory. Kým niektorí vyzdvihujú priaznivé výsledky (čo je v protiklade s Brennerovou hypotézou) [12], iní poukazujú na rozvoj dlhodobých následkov u detí s nefrektómiou [13, 14] aj u detí s vrodenou SO [15]. Jasno do danej problematiky môžu vniesť longitudinálne sledovania, no tie sú referované iba sporadicky. V roku 2009 Sanna-Cherchi et al. prezentovali longitudinálnu analýzu prežívania obličiek u dospelých s CAKUT. Výsledky preukázali, že signifikantná skupina chorých s anomáliou v unilaterálnej obličke dospela do terminálnej urémie vo včasnej dospelosti [16]. Ešte znepokojúcejšie sú recentné dáta Westlanda et al., ktorí v obsiahlej multicentrickej holandskej štúdii zistili medián nástupu poškodenia obličiek dokonca len 14,8 rokov (14,9 rokov pre vrodenú príčinu SO) [17]. Treba však kriticky uviesť, že závery obidvoch štúdií sa pre rozdiely v zbere dát či dizajne nedajú priamo porovnávať.
Dovtedy, kým sa nenájde valídna metóda na detekciu počtu nefrónov in vivo, budeme sa v klinickej praxi opierať najmä o longitudinálne observačné štúdie vykonané v súlade s konsenzuálnymi odporúčaniami Kidney Disease Improving Global Outcome (KDIGO). Vychádzajúc z praktických záverov komplexných odporúčaní expertov KDIGO sa považuje za nepriaznivé prognostické riziko (bez ohľadu na etiológiu nefropatie či trvanie zníženej funkcie obličiek) hodnota glomerulovej filtrácie GFR <60 ml/min/1,73 m2 a zvýšená albuminúria, ktorá sa ešte diferencuje na mierne zvýšenú (>30 mg/24 hodín) a závažne zvýšenú (>300 mg/24 hodín) [18].
Cieľom našej prospektívnej štúdie bolo zistiť kumulatívnu incidenciu 1) závažne zvýšenej albuminúrie, 2) hypertenzie a 3) signifikantne zníženej glomerulovej filtrácie u detí so SO, a determinovať stupeň poškodenia obličiek porovnateľnou metódou ako Westland et al. [17].
METODY
Pacienti
Do tejto prospektívnej štúdie boli zaradené všetky deti so SO v sledovaní terciárneho centra pre detskú nefrológiu Lekárskej fakulty a Detskej fakultnej nemocnice Univerzity P. J. Šafárika v Košiciach (n = 47). SO bola definovaná ako unilaterálna absencia obličky na ultrazvuku, potvrdená scintigrafiou obličiek. Zo všetkých sledovaných detí sme vyradili 5 pacientov po nefrektómii pre zhubné ochorenie (Wilmsov tumor: 3, karcinóm obličky: 1, neuroblastóm: 1), aby sme vylúčili vedľajšie vplyvy potenciálne nefrotoxickej chemoterapie. Analyzovaný klinický súbor takto tvorilo 42 pacientov, ktorých sme podľa etiológie rozdelili na podskupinu s vrodenou alebo získanou príčinou SO. Príčinou vrodenej SO bola jednostranná agenéza/aplázia alebo multicystická dysplázia. Deti, ktoré podstúpili jednostrannú nefrektómiu, sme zaradili do skupiny získaných príčin. Indikácie pre nefrektómiu sú uvedené v tabuľke 1.
Za účelom preskúmania vplyvu vrodených vývojových anomálii obličiek a močových ciest (CAKUT) na „renálnu“ prognózu boli pacienti rozdelení do dvoch kategórií: „CAKUT+“ (t.j. CAKUT v SO) a „CAKUT-“. Určujúca bola (ne)prítomnosť CAKUT v ultrazvukovom obraze a DMSA skene. Sedem z 12 pacientov (58,3 %) malo vezikoureterový reflux, 3/12 deti (25,0 %) mali dyspláziu a 2/12 (16,7 %) mali v SO hydronefrózu.
Merania
Krvný tlak bol meraný auskultačnou metódou s adekvátnou šírkou manžety. Na minimalizovanie vplyvu stresu sme použili najnižšiu hodnotu z (troch) meraní. Hypertenziu sme definovali ako systolický a/alebo diastolický krvný tlak ≥95. percentil pre daný vek, pohlavie a výšku [19]. Definíciu závažne zvýšenej albuminúrie (albuminúria >300 mg/24 hodín v zbieraných 24-hodinových vzorkách moču) sme prebrali z terminológie KDIGO [18, 20]. Estimovanú glomerulovú filtráciu (eGFR) sme kalkulovali podľa originálnej Schwartzovej formuly (eGFR = k x výška/koncentrácia sérového kreatinínu) [21], sérový kreatinín sa vyšetroval Jaffeho metódou. Nedávno publikovaná nová Schwartzova formula sa pre odhad eGFR nehodila, keďže bola navrhnutá pre enzymatickú metódu merania kreatinínu [22]. Signifikantné zníženie eGFR sme definovali ako eGFR <60 ml/min/1,73 m2 (chronická obličková choroba 3.–5. stupňa). Poškodenie obličiek bolo definované ako pretrvávajúca prítomnosť niektorého z nasledovných príznakov: hypertenzia a/alebo závažne zvýšená albuminúria a/alebo signifikantne znížená eGFR a/alebo užívanie antihypertenzív alebo antiproteinurickej medikácie [17]. Inhibítory angiotenzín konvertujúceho enzýmu sme indikovali pri hypertenzii [19], alebo ak albuminúria dosiahla závažne zvýšenú hodnotu (podľa definície KDIGO) [18].
Štatistika
Prvým krokom analýzy bolo zhodnotenie etiológie SO a klinických charakteristík v celom sledovanom súbore a v podskupinách podľa typu etiológie (vrodené verzus získané). V druhom kroku sme štatisticky vyhodnotili kumulatívnu incidenciu rôznych foriem poškodenia obličiek, opäť ako celok a podľa etiológie. Kaplanovou-Meierovou analýzou sme vypočítali dĺžku renálneho prežívania u chorých bez definovaných prejavov poškodenia obličiek, a tiež podľa etiológie a (ne)prítomnosti CAKUT v SO. Na porovnanie štatistickej významnosti rozdielov medzi skupinami sme použili chí-kvadrátové testy (kategoriálne premenné). Za hladinu štatistickej významnosti sme považovali p = 0,05. Štatistické analýzy sme vykonali použitím softvéru SPSS 20.0.
VÝSLEDKY
Klinické charakteristiky súboru
Súbor tvorí 42 pacientov so SO (23 chlapcov), z nich 27 s renálnou agenézou (64,3 %). Etiológiu SO v celom súbore detí uvádza tabuľka 1. SO sa zvyčajne zistila pri náhodnom ultrazvukovom vyšetrení, pričom v 10/42 (23,8 %) prípadoch boli už v čase identifikácie jednej obličky prítomné aj laboratórne známky renálneho poškodenia. U 5/42 pacientov (11,9 %) sa SO podchytila už neonatálnym skríningom. Priemerná doba prospektívneho sledovania bola 4,8 ± 4,4 rokov, pričom priemerný vek detí v čase poslednej nefrologickej kontroly bol 11,3 ± 6,3 rokov. Vekový rozdiel medzi pacientami s vrodenou a získanou SO nebol štatisticky významný (11,1 vs. 11,6 rokov, p = 0,65). Kongenitálna obštrukcia uropoetického traktu (CAKUT) bola prítomná u 12 (28,6 %) pacientov, pričom zastúpenie CAKUT bolo v skupine s vrodenými aj získanými príčinami SO rovnomerné (p = 0,80).
Table 1. Etiológia solitárnej obličky (SO). 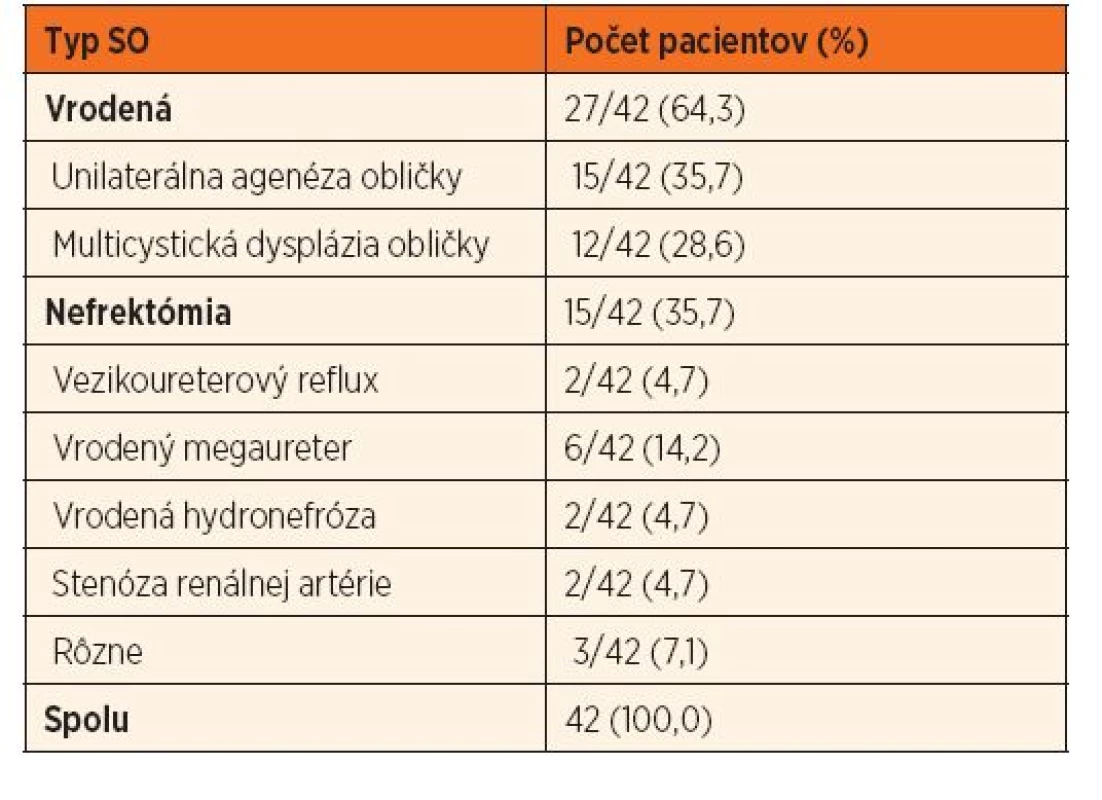
Poškodenie obličiek
Tabuľka 2 dokumentuje, že 16/42 (38,1 %) pacientov spĺňalo kritériá pre poškodenie obličiek. Rozdiely vo výskyte renálneho poškodenia medzi skupinou s vrodenou resp. získanou príčinou SO nebol štatisticky významný (p = 0,39; tab. 2), ale vysoko signifikantne sa líšil, ak sme súbor rozdelili podľa prítomnosti CAKUT (p <0,01; tab. 3). Priemerný vek pacientov s dokázaným renálnym poškodením bol 11,0 rokov.
Table 2. Kumulatívna incidencia obličkového „poškodenia“ u pacientov so SO (spolu a podľa príčiny). 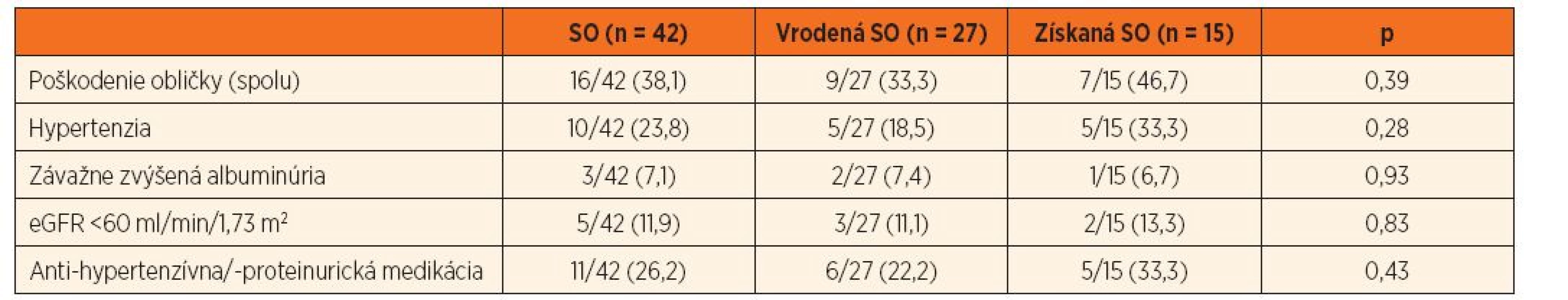
Súčet percent jednotlivých subtypov „poškodenia“ je vyšší než celkové percento pacientov s „poškodením“, keďže pacienti môžu mať viacero subtypov definujúcich „poškodenie“ súčasne. SO – solitárna oblička, eGFR – estimovaná glomerulová filtrácia Table 3. Kumulatívna incidencia obličkového „poškodenia“ u pacientov so SO (spolu a podľa CAKUT+/-). 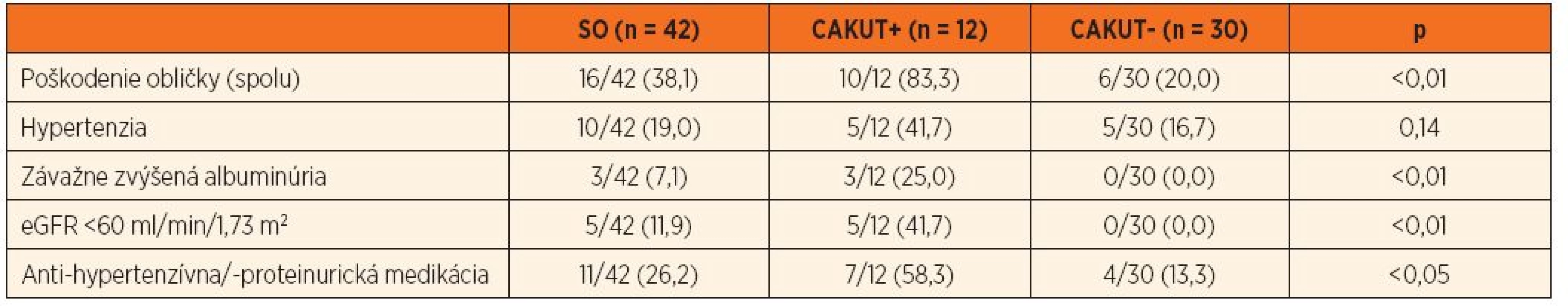
Súčet percent jednotlivých subtypov „poškodenia“ je vyšší než celkové percento pacientov s „poškodením“, keďže pacienti môžu mať viacero subtypov definujúcich „poškodenie“ súčasne. eGFR – estimovaná glomerulová filtrácia; CAKUT – kongenitálna anomália obličky a/alebo močového traktu Hypertenzia, závažne zvýšená albuminúria a významne redukovaná hodnota eGFR sa v priebehu prospektívneho sledovania zistila u 10/42 (23,8 %), 3/42 (7,1 %) resp. 5/42 (11,9 %) detí. Antihypertenzívny alebo antiproteinurický liek dlhodobo užívalo 11/42 (26,2 %) pacientov. Priemerná hodnota eGFR pri poslednom nefrologickom vyšetrení bola 83,2 ± 26,4 ml/min/1,73 m2. Multivariačnou štatistickou analýzou sme potvrdili, že kumulatívna incidencia hypertenzie, závažne zvýšená albuminúria a výrazne redukovaná eGFR boli signifikantne častejšie v podskupine s CAKUT+ v porovnaní s CAKUT - (tab. 2 a 3).
Z celej kohorty do terminálnej urémie dospeli 2/42 deti (4,8 %), vo veku 6 a 16 rokov, pričom v obidvoch prípadoch mali pacienti solitárnu dysplastickú obličku. Kaplanovou-Meierovou analýzou sme preukázali, že medián času do poškodenia obličiek v celom súbore bol 12,8 rokov. Po 10 resp.15 rokoch zostalo bez poškodenia obličiek „len“ 70,8 % resp. 43,5 % pacientov (graf 1).
Graph 1. Súbor pacientov so solitárnou obličkou sledovaných v rokoch 2007–2014 (medián sledovania 4,8 rokov; medián času do poškodenia obličiek 12,8 rokov). 
Je zaujímavé, že priemerný čas do poškodenia obličiek sa signifikantne nelíšil pri porovnávaní pacientov podľa etiologickej príčiny SO (vrodená 13,3 rokov vs. získaná 12,9 rokov, p = 0,91). Na druhej strane, v selektovanej podskupine detí s CAKUT+ sme (v porovnaní s CAKUT-) zistili hranične významne kratší medián času do rozvoja poškodenia obličiek (19,0 rokov vs. 10,6 rokov; p = 0,06).
DISKUSIA
Výsledky našej prospektívnej klinickej štúdie ukazujú, že solitárna oblička nemusí byť „benígna“ a u významnej časti detí (38,1 %) s jednostrannou obličkou možno očakávať včasný rozvoj renálneho poškodenia, a to už vo veku 11,0 rokov (medián) [23]. Navyše, u 11,9 % pacientov došlo počas sledovaného obdobia k významnej redukcii eGFR (pod 60 ml/min/1,73 m2), ba čo viac, až 4,8 % detí z našej kohorty dospelo do terminálnej urémie ešte v detstve.
Naše klinické zistenia sú v súlade s recentnou štúdiou Westlanda et al., ktorí v holandskej vzorke 407 detí preukázali, že poškodenie obličiek sa môže vyvinúť až u 37 % pacientov so SO, a to už v priemernom veku 6,4 ± 5,9 rokov [17]. V rozpore s našimi závermi zistili Jaoude et al. naopak významný rozdiel v prospech pacientov s vrodenou SO, čo vysvetľujú lepšou funkčnou adaptáciou [13]. Na druhej strane, z hľadiska rizika včasného rozvoja renálneho poškodenia je dôležitá prítomnosť anomálie (CAKUT), a to nezávisle od toho, či ide o kongenitálnu alebo získanú solitárnu obličku. Podporujú to výsledky Westlanda et al. aj naše pozorovania. Dve deti v našom súbore (4,8 %) dosiahli koncové štádium obličkového zlyhania vo veku 6 a 16 rokov. Obidve deti mali v solitárnej obličke aj závažnú kongenitálnu anomáliu uropoetického traktu. Vysoké riziko progresie renálneho zlyhania dokumentujú tiež alarmujúce analýzy veľkého súboru 312 mladých dospelých s CAKUT [16]. Až polovica pacientov s anomáliou v solitárnej obličke diagnostikovanou v detstve vyžadovala dialýzu vo veku 30 rokov. Autori uzatvárajú, že za horšiu prognózu môžu byť zodpovedné subklinické defekty v unilaterálnej obličke a prísnejšia selekcia pacientov. Priame porovnanie s našou „klinickou vzorkou“ nie je možné, najmä pre kratšiu vekovú hranicu observácie. Na druhej strane, naša štúdia vhodne vypĺňa medzeru medzi mladými pacientmi v súbore Westlanda a dospelými pacientmi v práci Sanna-Cherchi. Napriek týmto obmedzeniam, vo všetkých štúdiách je zjavný vzostupný trend rizika poškodenia obličiek so stúpajúcim vekom. Monitorovaním 24-hodinového tlaku krvi (ABPM) by sa počet patologických nálezov pravdepodobne ešte zvýšil [24].
V ostatných desaťročiach rastie počet štúdií, ktoré podporujú vynikajúcu dlhodobú renálnu prognózu živých darcov obličky [10, 11, 25]. Tieto sa často vyzdvihujú ako argument zdôvodňujúci priaznivé výsledky pacientov so SO. Podľa nášho názoru, však živých darcov obličiek nemožno porovnávať s nefrektomovanými deťmi, a to hneď z niekoľkých dôvodov. Po prvé, hyperfiltrácia má pravdepodobne závažnejšie dlhodobé dôsledky, ak sa nefrektómia vykonala v detstve [14, 25]. Po druhé, dá sa očakávať že prežívanie detí s jednou obličkou presiahne časový horizont pediatrického sledovania a preto nemožno vylúčiť, že funkčné zmeny sa môžu vyvinúť neskôr (až po 30-tich rokoch), ako upozorňujú Brenner a Mackenzie a nedávno aj Siomou et al. [4, 7]. Po tretie, selekcia zdravých živých darcov môže znamenať výber pacientov s nadpriemerným počtom nefrónov, čo môže skresliť obraz o skutočnom stave rozvoja komplikácií pacientov so solitárnou obličkou [26].
Je tiež otázne, či závery z prevažne západoeurópskych krajín možno priamo aplikovať na slovenské obyvateľstvo. V tomto kontexte sa zdajú najrelevantnejšie porovnania s populáciou českých detí. V roku 1991 Janda informoval o 40 detských pacientoch so SO (23 s agenézou, v priemernom veku 11,9 ± 4,3 rokov a 17 po nefrektómii s priemerným vekom 7,8 ± 3,9 rokov), z ktorých až ¾ malo mikroalbuminúriu. Žiadne dieťa v sledovanom období nebolo v chronickej renálnej insuficiencii [27]. V roku 2006 Seeman a spol. reportovali výsledky pacientov s jednostrannou renálnou agenézou rozdelených na podskupiny podľa (ne)prítomnosti jaziev na DMSA skene. Autori zistili, že známky poškodenia boli signifikantne frekventnejšie u pacientov s jazvami [28]. Limitáciou citovanej štúdie je jej prierezový charakter, s priemerným vekom 10,0 rokov, čo obmedzuje predikciu longitudinálnej „renálnej“ prognózy, keďže pre progresiu je kritické najmä obdobie puberty. Svedčia o tom demografické údaje z talianskeho registra ItalKid a európskeho multicentrického pediatrického registra ESPN, ktoré jednoznačne preukázali, že progresia renálneho zlyhania prudko stúpa počas puberty, preto rovnaký vývojový trend možno očakávať aj u detí so SO [29, 30]. Tento určujúci trend je zjavný aj z našich doterajších pozorovaní (graf 1).
Silnou stránkou našej štúdie je longitudinálne prospektívne sledovanie detí so SO a dynamické monitorovanie laboratórnych a klinických markerov v súlade s odporúčaniami KDIGO. Hlavnou limitáciou je relatívne nízky počet pacientov, čo obmedzuje výpovednú silu štúdie. Po druhé, významnú časť našej kohorty tvoria deti so SO, ktoré vykazovali klinické príznaky už v čase zaradenia do štúdie (23,8 %) a preto môžu naše zistenia silný vplyv SO preceňovať. Tieto limitácie môže preklenúť longitudinálna prospektívna celopopulačná štúdia na veľkom počte pacientov.
ZÁVER
Renálne poškodenie pri solitárnej obličke sa u značnej časti pacientov rozvíja už v detskom veku, a to najmä u jedincov s anomáliou v jednostrannej obličke. Starostlivé sledovanie týchto pacientov a pravidelné monitorovanie albuminúrie, krvného tlaku a eGFR umožňuje včasnú detekciu incipientného renálneho poškodenia a začatie adekvátnej liečby.
Článok vyšiel s podporou grantu VEGA 1/0172/14.
Došlo: 5. 11. 2014
Přijato: 17. 2. 2015
Prof. MUDr. Ľudmila Podracká, CSc.
I. detská klinika LFUK a DFNsP
Limbova 1
833 40 Bratislava
Slovenská republika
e-mail: ludmila.podracka@fmed.uniba.sk
Sources
1. Brenner BM, Garcia DL, Anderson S. Glomeruli and blood pressure. Less of one, more the other? Am J Hypertens 1988; 1 : 335–347.
2. Hostetter TH, Olson JL, Rennke HG, et al. Hyperfiltration in remnant nephrons: a potentially adverse response to renal ablation. Am J Physiol 1981; 241: F85–93.
3. Brenner BM. Nephron adaptation to renal injury or ablation. Am J Physiol 1985; 249: F324–337.
4. Brenner BM, Mackenzie HS. Nephron mass as a risk factor for progression of renal disease. Kidney Int 1997; 63 (Suppl): S124–127.
5. Hoy WE, Hughson MD, Singh GR, et al. Reduced nephron number and glomerulomegaly in Australian Aborigines: a group at high risk for renal disease and hypertension. Kidney Int 2006; 70 : 104–110.
6. Keller G, Zimmer G, Mall G, et al. Nephron number in patients with primary hypertension. N Engl J Med 2003; 348 : 101–108.
7. Siomou E, Giapros V, Papadopoulou F, et al. Growth and function in childhood of a normal solitary kidney from birth or from early infancy. Pediatr Nephrol 2014; 29 : 249–256.
8. Bertram JF, Douglas-Denton RN, Diouf B, et al. Human nephron number: implications for health and disease. Pediatr Nephrol 2011; 26 : 1529–1533.
9. Hoy WE, Rees M, Kile E, et al. A new dimension to the Barker hypothesis: low birthweight and susceptibility to renal disease. Kidney Int 1999; 56 : 1072–1077.
10. Goldfarb DA, Matin SF, Braun WE, et al. Renal outcome 25 years after donor nephrectomy. J Urol 2001; 166 : 2043–2047.
11. Hakim RM, Goldszer RC, Brenner BM. Hypertension and proteinuria: long-term sequelae of uninephrectomy in humans. Kidney Int 1984; 25 : 930–936.
12. Robitaille P, Mongeau JG, Lortie L, et al. Long-term follow-up of patients who underwent unilateral nephrectomy in childhood. Lancet 1985; 1 : 1297–1299.
13. Abou Jaoude P, Dubourg L, Bacchetta J, et al. Congenital versus acquired solitary kidney: is the difference relevant? Nephrol Dial Transplant 2010; 26 : 2188–2194.
14. Argueso LR, Ritchey ML, Boyle ET Jr, et al. Prognosis of children with solitary kidney after unilateral nephrectomy. J Urol 1992; 148 : 747–751.
15. Argueso LR, Ritchey ML, Boyle ET Jr, et al. Prognosis of patients with unilateral renal agenesis. Pediatr Nephrol 1992; 6 : 412–416.
16. Sanna-Cherchi S, Ravani P, Corbani V, et al. Renal outcome in patients with congenital anomalies of the kidney and urinary tract. Kidney Int 2009; 76 : 528–533.
17. Westland R, Kurvers RA, van Wijk JA, et al. Risk factors for renal injury in children with a solitary functioning kidney. Pediatrics 2013; 131: e478–485.
18. Kidney Disease: Improving Global Outcomes Clinical Practice Guidelines for the Evaluation and Management of Chronic Kidney Disease. Kidney Int 2013; Suppl 3 : 15–18.
19. National High Blood Pressure Education Program Working Group on High Blood Pressure in Children and Adolescents. The fourth report on the diagnosis, evaluation, and treatment of high blood pressure in children and adolescents. Pediatrics 2004; 114 : 555–576.
20. Mogensen CE, Vestbo E, Poulsen PL, et al. Microalbuminuria and potential confounders. A review and some observations on variability of urinary albumin excretion. Diabetes Care 1995; 18 : 572–581.
21. Schwartz GJ, Haycock GB, Edelmann CM Jr, et al. A simple estimate of glomerular filtration rate in children derived from body length and plasma creatinine. Pediatrics 1976; 58 : 259–263.
22. Schwartz GJ, Munoz A, Schneider MF, et al. New equations to estimate GFR in children with CKD. J Am Soc Nephrol 2009; 20 : 629–637.
23. Kolvek G, Podracka L, Rosenberger J, et al. Solitary functioning kidney in children – a follow-up study. Kidney Blood Press Res 2014; 39 : 272–278.
24. Saran R, Marshall SM, Madsen R, et al. Long-term follow-up of kidney donors: a longitudinal study. Nephrol Dial Transplant 1997; 12 : 1615–1621.
25. Okuda S, Motomura K, Sanai T, et al. Influence of age on deterioration of the remnant kidney in uninephrectomized rats. Clin Sci (Lond) 1987; 72 : 571–576.
26. Chevalier RL. When is one kidney not enough? Kidney Int 2009; 76 : 475–477.
27. Janda J, Stolcova P, Sikut M, et al. The solitary kidney in children and adolescents. Morphologic and functional characteristics. Čes-slov Pediat 1991; 46 : 195–199.
28. Seeman T, Patzer L, John U, et al. Blood pressure, renal function, and proteinuria in children with unilateral renal agenesis. Kidney Blood Press Res 2006; 29 : 210–215.
29. Ardissino G, Testa S, Dacco V, et al. Puberty is associated with increased deterioration of renal function in patients with CKD: data from the ItalKid Project. Arch Dis Child 2012; 97 : 885–888.
30. ESPN/ERA-EDTA Registry. ESPN/ERA-EDTA Registry 2010 annual report. Academic Medical Center, Department of Medical Informatics, Amsterdam. 2012.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2015 Issue 5-
All articles in this issue
- Vybrané špecifiká ultrasonografie pľúc v detskom veku
- Asociácia genetických polymorfizmov metyléntetrahydrofolát reduktázy s vrodenými chybami srdca v slovenskej populácii
- Črevná permeabilita a SCORAD u detí s atopickou dermatitídou po 6-týždňovom podávaní Lactobacillus rhamnosus GG (pilotná štúdia)
- Je prognóza solitárnej obličky u detí priaznivá?
- Intrafamiliárna fenotypová variabilita klasického Marfanovho syndrómu
- Vzácný případ DiGeorgeova syndromu s anomáliemi končetin: přínos vyšetření metodou SNP microarrayí?
- Metabolické kostní onemocnění při nezralosti
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metabolické kostní onemocnění při nezralosti
- Vybrané špecifiká ultrasonografie pľúc v detskom veku
- Vzácný případ DiGeorgeova syndromu s anomáliemi končetin: přínos vyšetření metodou SNP microarrayí?
- Asociácia genetických polymorfizmov metyléntetrahydrofolát reduktázy s vrodenými chybami srdca v slovenskej populácii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

