-
Medical journals
- Career
Vybrané špecifiká ultrasonografie pľúc v detskom veku
: V. Zoľák 1; S. Nosáľ 1; B. Zoľáková 2; M. Fedor 1; M. Janíková 1
: Klinika detskej anestéziológie a intenzívnej medicíny JLF UK a UNM, Martin prednosta doc. MUDr. S. Nosáľ, PhD. 1; Neonatologická klinika JLF UK a UNM, Martin prednosta prof. MUDr. M. Zibolen, PhD. 2
: Čes-slov Pediat 2015; 70 (5): 259-266.
: Original Papers
Úvod:
Ultrasonografia pľúc (LUS) je jednou z najmladších vyšetrovacích metód pľúc, ktorá sa v súčasnosti používa na diagnostiku respiračných ochorení. Jednoduchosť, rýchlosť a spoľahlivosť tejto metódy ju predurčujú na širšie využitie v klinickej praxi.Cieľ:
Porovnať literatúrou udávané LUS nálezy u dospelých pacientov s detskou populáciou; porovnať tri typy sond pre detskú LUS; stanoviť parametre LUS obrazu zdravého dieťaťa, zistiť rozdiel v LUS medzi ventilovanými a neventilovanými deťmi, vypočítať senzitivitu a špecificitu LUS pre vybrané respiračné ochorenia.Metódy:
Do štúdie bolo zaradených 135 detí. 45 detí bolo zaradených do sledovanej skupiny. Kontrolnú skupinu tvorilo 90 detí (62 zdravých nehospitalizovaných detí, 28 hospitalizovaných kriticky chorých detí bez respiračnej patológie).Výsledky:
Porovnaním jednotlivých artefaktov sme nezaznamenali štatistický rozdiel v 10 základných znakoch (p = 0,1–0,687). Interobservačnou analýzou sme zistili nevhodnosť použitia mikrokonvexnej sondy v pediatrii (zhoda s lineárnou a konvexnou sondou 15,56 % a 11,76 %). V kontrolnej skupine sme zaznamenali fyziologický nález u všetkých detí, „fyziologické“ B-línie boli prítomné u 38,7 % zdravých detí a u 28,5 % kriticky chorých detí bez respiračnej patológie. Pri analýze LUS obrazu u ventilovaných a neventilovaných detí sme nezistili štatistický významný rozdiel (p = 0,744–1,0). Stanovili sme senzitivitu a špecificitu pre vybrané respiračné ochorenia (pneumónia 94,5 % a 98 %, kontúzia 91,8 % a 98,0 %, atelektáza 83,3 % a 97,1 %, ARDS 90,9 % a 95,2 %).Záver:
Ultrasonografia pľúc má výnimočnú úlohu pri diagnostike respiračných ochorení v detskom veku. Pri porovnaní s dospelou populáciou existujú pre detský vek určité odlišnosti a špecifiká.Kľúčové slová:
screening, nedoslýchavost, novorozenec, otoakustické emiseÚVOD
V minulosti sa za jediné možnosti vyšetrenia pľúc u detí považovali röntgen pľúc (RTG), počítačová tomografia (CT) a prípadne magnetická rezonancia (MRI). Vzhľadom na významné akustické artefakty produkované vzduchom a kostným tkanivom sa v minulosti považoval hrudník za nedostupný priestor pre ultrasonografické vyšetrenie pľúc (LUS). Niektoré pľúcne ochorenia a patologické stavy však umožnili v hrudníku vytvorenie akustického okna, čo viedlo niektorých sonografistov k zisteniu nových a zaujímavých poznatkov. Postupnými pokrokmi v LUS, založenými na analýze a interpretácii artefaktov vytvorenými na rozhraní vzduchu a tekutiny, došlo k pochopeniu a odhaleniu spoľahlivého zdroja informácii o aktuálnom stave pľúc. LUS pravdepodobne nenahradí RTG alebo CT vyšetrenie pľúc, ale má obrovský význam pri poskytnutí dôležitých informácií získaných rýchlo a bezpečne, čo má pre deti v kritickom stave obzvlášť dôležitý význam [1]. Ďalšou výhodou, ktorú má LUS na rozdiel od ostatných metód, je dynamické namiesto statického zobrazenia pľúcnych funkcií. Manažment detského pacienta s respiračným ochorením vyžaduje spoľahlivú zobrazovaciu metódu, ktorá je esenciálna pre správne stanovenie diagnózy a optimálnu liečbu. Nevýhodou niektorých klasických zobrazovacích metód je nutnosť transportu pacienta na dané vyšetrenie, vysoká radiačná záťaž, časová a finančná náročnosť vyšetrenia. LUS môžeme charakterizovať ako rýchlu a spoľahlivú bedside metódu, ktorú môžeme kedykoľvek bez obmedzenia zopakovať bez nutnosti transportu pacienta na vyšetrenie. Takisto dieťa nevystavujeme radiačnej záťaži.
Ultrasonografia pľúc je založená na 7 základných princípoch. Vyšetrenie je štandardizované a v princípe sa riadi medzinárodnými odporúčeniami [2]. Ich značnou nevýhodou je, že sú prevažne venované dospelej populácii; deťom a novorodencom sa venujú len okrajovo. V zásade je pre správnu interpretáciu LUS nevyhnutná znalosť 10 základných znakov a artefaktov [3, 4]. Základným znakom je A-línia, ktorá je opakovaním pleurálnej línie (tvorená viscerálnou a parietálnou pleurou). Znak kĺzania pľúc je dynamický artefakt, ktorý vzniká na pleurálnej línii počas dychového cyklu – pohyb parietálnej pleury oproti viscerálnej pleure. Základným patologickým znakom je B-línia – hyperechogénny artefakt odstupujúci kolmo z pleurálnej línie.
CHARAKTERISTIKA SÚBORU
Prospektívnu klinickú štúdiu sme realizovali v období máj 2012 až december 2014 na Klinike detskej anestéziológie a intenzívnej medicíny JLF UK a UN Martin. Do štúdie bolo zaradených celkovo 135 detí. V sledovanej skupine I bolo 45 kriticky chorých detí s respiračnou insuficienciou rôzneho stupňa a rôznej etiológie – podskupina ICU. Do kontrolnej skupiny II bolo zaradených 90 detí bez diagnostikovanej respiračnej patológie (62 úplne zdravých detí – podskupina FYZ; a 28 kriticky chorých detí – podskupina ICU-N), hospitalizovaných na našej klinike alebo vyšetrených ambulantne (primárne indikované USG vyšetrenie iného ako respiračného systému). Štúdia bola realizovaná so súhlasom etickej komisie. Informovaný súhlas bol vyžadovaný buď od zákonného zástupcu vyšetrovaného dieťaťa, alebo v prípade adolescenta nad 18 rokov od samotného vyšetrovaného subjektu. Základné charakteristiky oboch skupín uvádzame v tabuľke 1.
1. Základné charakteristiky oboch skupín. 
SD – štandardná odchýlka METÓDY
Všetky deti boli vyšetrené pomocou ultrasonografu (USG) SonoSite M-Turbo (Bothell, WA, USA) v štandardnej supinačnej polohe. Podľa možností sme vyšetrovali aj dorzálne zóny hrudníka. Každé dieťa bolo vyšetrené lineárnou sondou (5–10 MHz) a konvexnou abdominálnou sondou (2–5 MHz). Niekoľko detí, v oboch skupinách, sme vyšetrili aj pomocou mikrokonvexnej sondy (3,5–5 MHz). Sonda bola umiestnená nad medzirebrovým priestorom, kolmo na prebiehajúce rebrá s kurzorom smerujúcim kraniálne. Analyzovali sme prítomnosť 10 základných znakov, prípadne iných v literatúre popísaných artefaktov. Získané údaje boli štatisticky vyhodnotené počítačovým programom SPSS (v. 22, Chicago, IL, USA). Všetky premenné boli pred samotnou analýzou otestované na normálnu distribúciu. Pre porovnanie sme použili: Pearsonov chi-kvadrátový test, interobservačný test vzájomnej zhody, Mannov-Whitneyho test a Kruskallov-Wallisov test. Za štatisticky významnú hodnotu sme považovali p <0,05. Analýza senzitivity, špecificity, pozitívnej a negatívnej prediktívnej hodnoty (PPV a NPV) je uvádzaná aj v rozmedzí 95% intervalu spoľahlivosti (CI).
VÝSLEDKY
V rámci našej práce sme si stanovili niekoľko cieľov. Prvým bolo porovnanie, či sa v literatúre popisované fyziologické a patologické znaky a artefakty vyskytujú aj v pediatrickej populácii. Porovnaním jednotlivých znakov a artefaktov sme nezaznamenali štatisticky významný rozdiel v 10 základných znakoch (Pearsonov chi-kvadrátový test, p = 0,1–0,687). U detí, rovnako ako u dospelých, sa vyskytujú A - aj B-línie, prítomné je takisto kĺzanie pľúc (v M-móde rovnaký znak pobrežia). U detí sa rovnako znázorňujú pleurálne aj subpleurálne konsolidácie pľúc, ďalej pri pneumóniách sme často zachytili drobné peripneumonické výpotky (znak sínusoidy v M-móde).
Ďalším problémom, ktorý v súčasnej literatúre nie je takmer vôbec objasnený, je výber USG sondy pre spoľahlivé vyšetrenie. Porovnali sme LUS obrazové záznamy z 3 vyšetrení toho istého miesta u viacerých pacientov pomocou mikrokonvexnej, lineárnej a konvexnej sondy. Výsledky sme porovnali pomocou interobservačnej analýzy so stanovením κ-koeficientu. Dosiahli sme 94,81%-nú konkordanciu použitím lineárnej a konvexnej USG sondy. Použitie mikrokonvexnej sondy sa zhodovalo s ostatnými 2 sondami na 11,8–15,6 %. Podrobné výsledky uvádzame v tabuľke 2.
2. Interobservačná analýza 3 ultrazvukových sond. 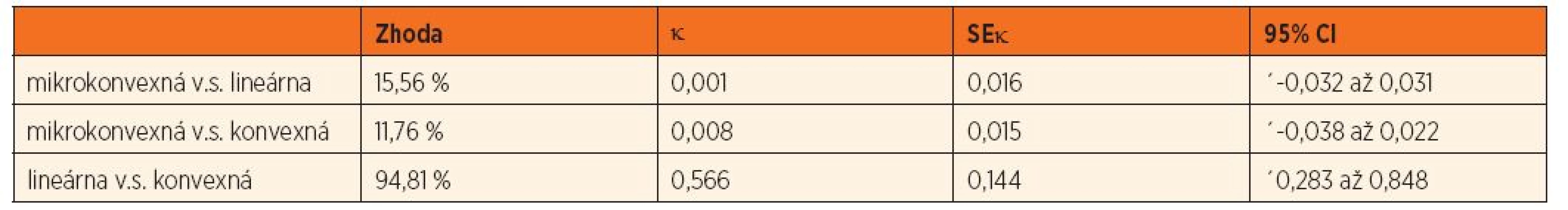
κ = kappa koeficient, SE = štandardná chyba, 95% CI = 95% interval spoľahlivosti (dolná a horná hranica) Rovnako dôležitým cieľom bolo pre nás overenie, či je LUS vhodná a spoľahlivá metóda pre detský vek. V skupine II sme zaznamenali fyziologický nález u všetkých 90 detí. V tejto skupine sme takisto zaznamenali aj izolované B-línie, ktoré sa vyskytujú približne u jednej tretiny zdravej populácie. V podskupine FYZ sme ich identifikovali u 24 detí (38,7 %), z nich u 15 detí (62,5 %) len v jednom vyšetrovanom regióne, u 6 detí (25 %) v dvoch regiónoch a u 3 detí (12,5 %) v 3 regiónoch. V podskupine ICU-N sa tento artefakt vyskytoval u 8 detí (28,5 %), z toho u 6 detí (75 %) len v jednom regióne a u 2 detí (25 %) v 2 regiónoch. Zaujímavým je aj najčastejší výskyt tohto artefaktu podľa definovaných bodov. V podskupine FYZ sa tento artefakt najčastejšie vyskytoval dolných bodoch, v podskupine ICU-N sa vyskytoval vo všetkých bodoch s rovnakou frekvenciou. Nebol zaznamenaný štatisticky významný rozdiel medzi distribúciou B-línií medzi podskupinami (p >0,05), ani podľa jednotlivých bodov (p >0,05). Podrobný prehľad poskytuje tabuľka 3.
3. Podrobný prehľad zachytených B-línii v kontrolnej skupine. 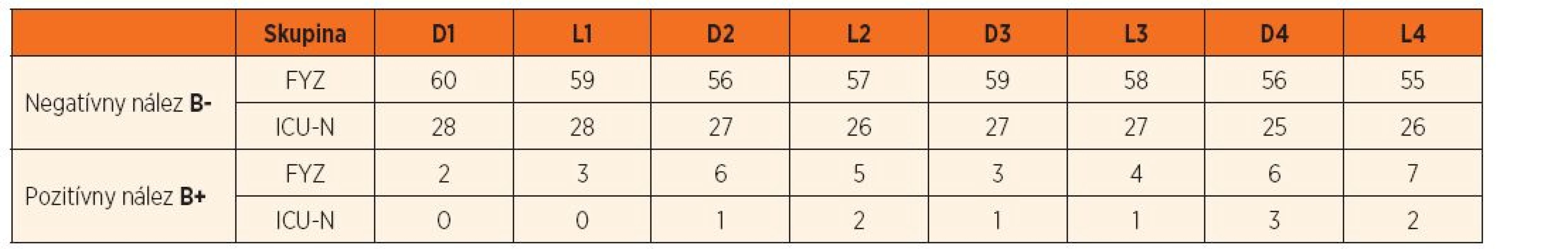
Detekcia B-línií v kontrolných skupinách podľa jednotlivých vyšetrovaných regiónov (počet detí). D – pravá strana, L – ľavá strana, FYZ – zdravé nehospitalizované deti, ICU-N – kriticky choré deti bez respiračnej patológie Ďalšou našou hypotézou, ktorá nie je v súčasnosti dostatočne vysvetlená, je možný rozdiel v USG obraze medzi ventilovanými a neventilovanými pacientami. Analyzovali sme zmeny u 20 ventilovaných detí, u ktorých bolo pred a po extubácii realizované LUS vyšetrenie. U týchto detí (podskupiny ICU a ICU-N) boli diagnostikované nasledovné diagnózy: pneumónia (7x), kontúzia pľúc (4x), bronchiolitída (2x) a atelektáza pľúc (1x), u 6 detí bol negatívny nález (UPV indikovaná pre ochorenia centrálneho nervového systému). Sledované boli zmeny A - a B-líniií, znaku kĺzania pľúc, pleurálnych a subpleurálnych konsolidácií, bronchogramov a pleurálnych výpotkov.
Z uvedenej tabuľky 4 jednoznačne vyplýva, že umelá pľúcna ventilácia nemá vplyv na obraz LUS. V súbore našich pacientov sme v ani jednom prípade nezaznamenali zásadný rozdiel v LUS počas ventilácie a po odpojení detských pacientov od umelej pľúcnej ventilácie.
4. Porovnanie LUS nálezov u detí na umelej pľúcnej ventilácii a krátko po extubácii. 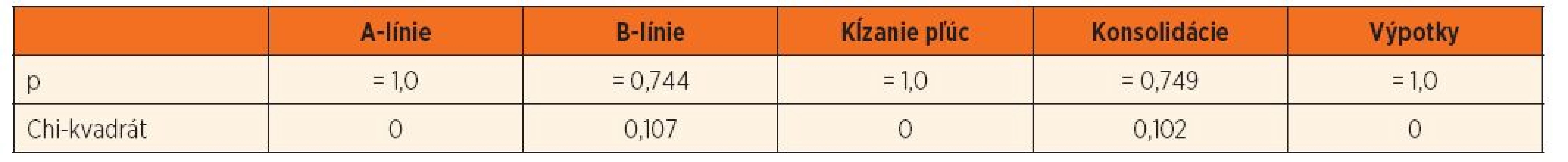
Posledným cieľom našej štúdie bolo stanovenie senzitivity a špecificity LUS pre vybrané respiračné ochorenia. Diagnóza bola stanovená na základe klinických a pomocných zobrazovacích a laboratórnych vyšetrení. Výsledky uvádzame v prehľadnej tabuľke 5.
5. Stanovenie senzitivity a špecificity LUS pre vybrané respiračné ochorenia u detí. 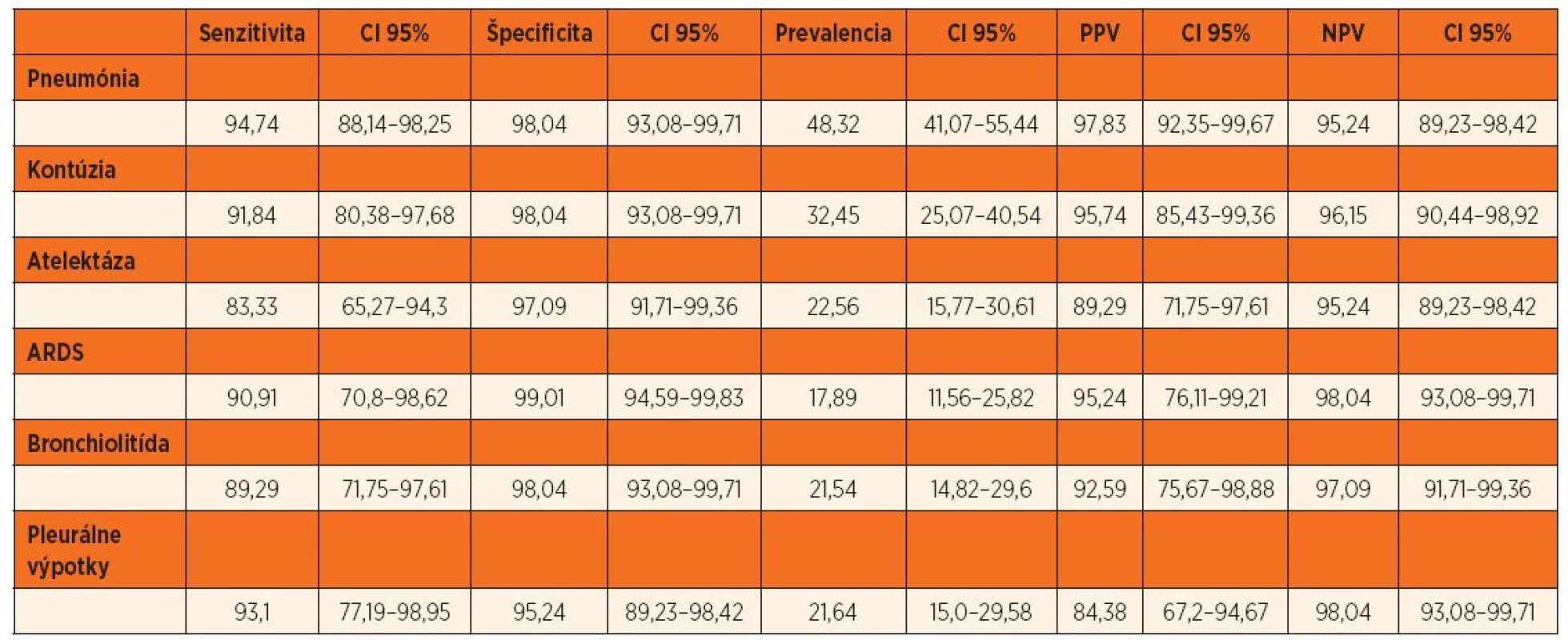
95% CI = 95% interval spoľahlivosti, PPV = pozitívna prediktívna hodnota, NPV = negatívna prediktívna hodnota DISKUSIA
Ultrasonografia pľúc sa postupne dostáva do popredia nielen v rámci akútnej starostlivosti pri diagnostike etiológie akútneho respiračného zlyhania, ale využíva sa jej obrovský prínos pri každodennej diagnostike a kontrole klinického stavu pacienta. Pre správne zhodnotenie LUS nálezu je nevyhnutné získať kvalitný záznam, pomocou ktorého dokážeme správne interpretovať získaný výsledok. Na obrázkoch 1, 2 a 3 uvádzame praktické využitie našej druhej hypotézy, ktoré môže zásadne ovplyvniť interpretáciu LUS.
1. USG obraz pľúc v pravom hornom kvadrante (D1) získaný mikrokonvexnou sondou. Pomocou tejto sondy nedokážeme spoľahlivo identifikovať ani jeden zo základných znakov (pleurálna línia, A- alebo B-línia) (foto archív KDAIM). Fig. 1. Image of LUS in upper right zone by microconvex probe. Using this probe we are unable to reliably identify any of basic signs/artifact (pleural line, A- or B- line) (archive KDAIM). 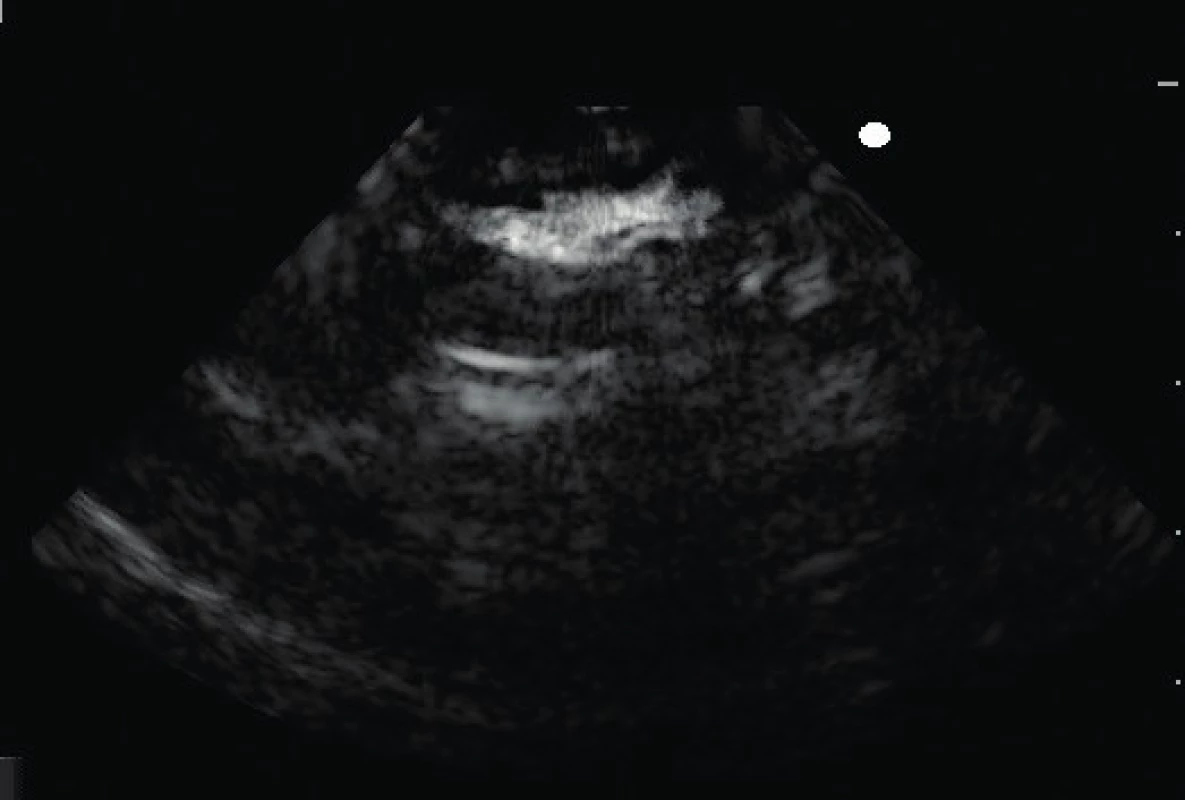
2. USG obraz pľúc v pravom hornom kvadrante (D1) u tej istej pacientky ako na obr. 1, získanom konvexnou (abdominálnou) sondou. Pomocou tejto sondy získavame kvalitnejší obraz, dokážeme identifikovať pleurálnu líniu, takisto rozoznávame A-línie, naznačené subpleurálne konsolidácie (foto archív KDAIM). Fig. 2. Image of LUS in upper right zone in same patient as in fig. 1 by convex (abdominal) transducer. By this probe we receive better quality image with ability to identify pleural line, we can also recognize A-lines, subpleural consolidations outlined (archive KDAIM). 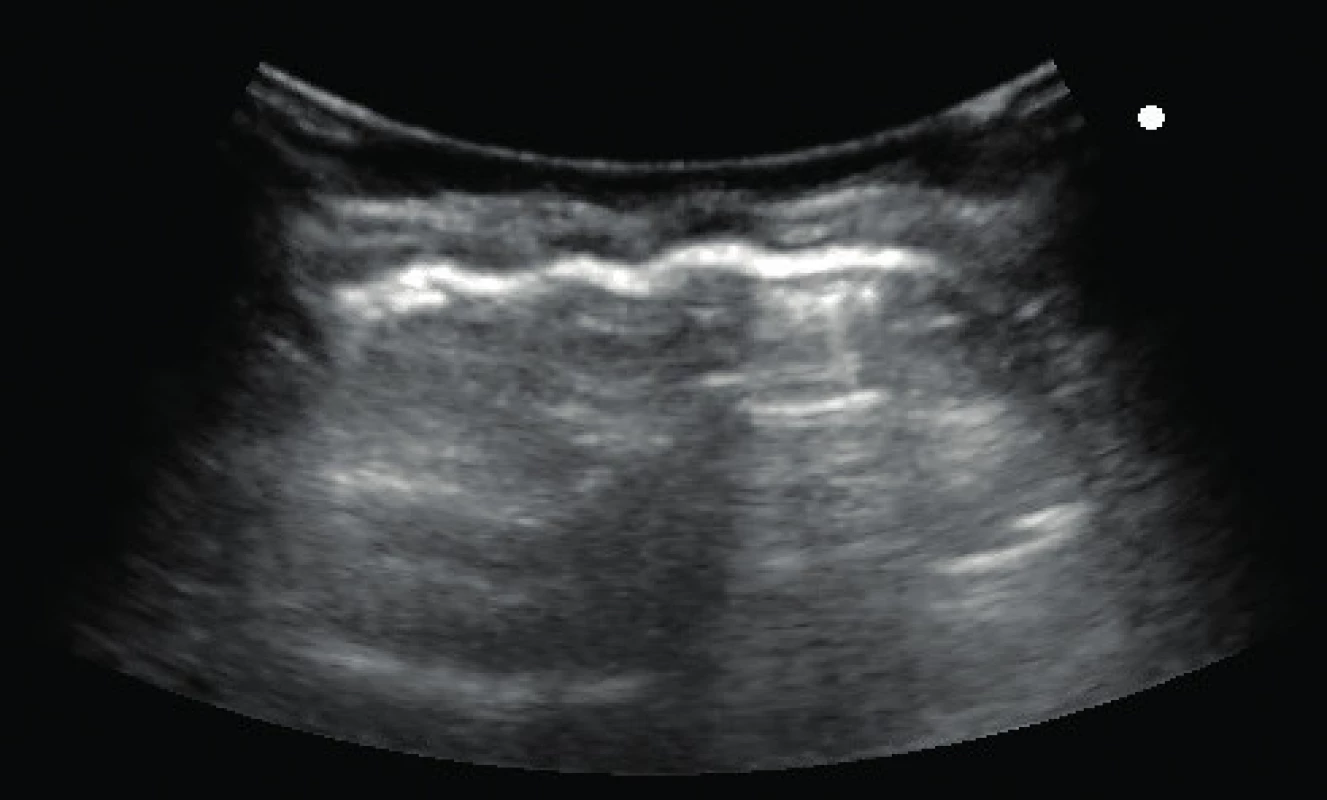
3. USG obraz pľúc v pravom hornom kvadrante (D1) u tej istej pacientky ako na obrázkoch 1 a 2, získanom lineárnou sondou. Pomocou tejto sondy získavame najkvalitnejší záznam z blízkosti pleurálnej línie, jednoznačne dokážeme identifikovať subpleurálne konsolidácie (foto archív KDAIM). Fig. 3. Image of LUS in same zone in same patient as in previous figures (1 and 2) by linear probe. Best quality image with details in area of pleural line, reliably identified subpleural consolidations (archive KDAIM). 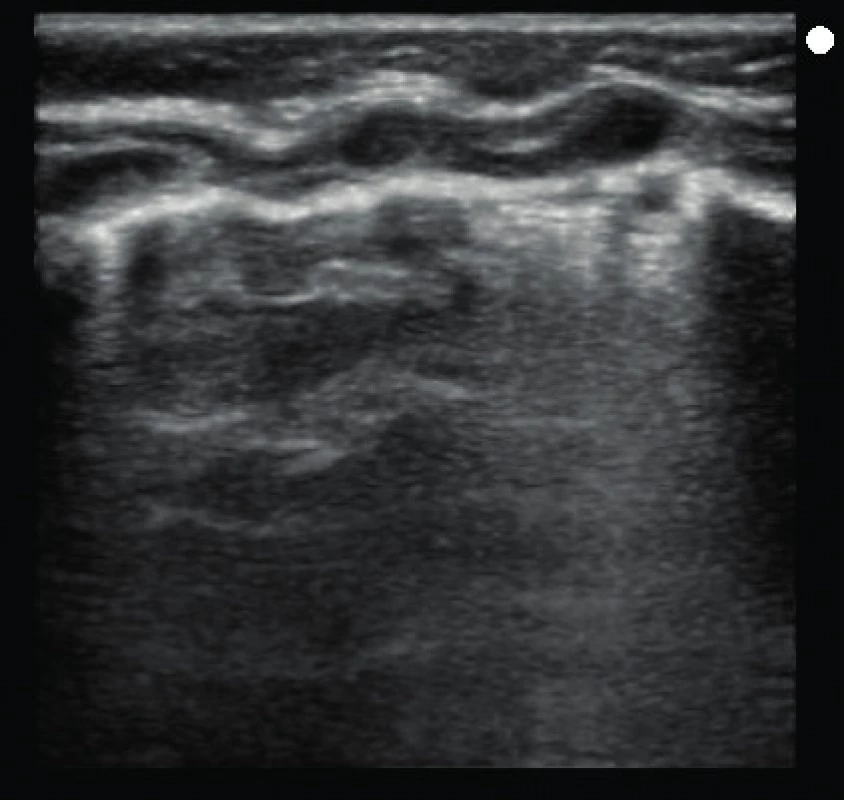
Na uvedených obrázkoch uvádzame „rovnaký“ USG nález jednej pacientky s použitím troch rôznych typov USG sond. Použitie mikrokonvexnej sondy, ktorá sa v dospelej akútnej medicíne uvádza na prvom mieste, je pre použitie v detskej populácii absolútne nevhodné a obraz získaný touto sondou sa prakticky nedá vyhodnotiť. Na nasledujúcich dvoch obrázkoch vidíme podstatne kvalitnejší obraz patologického nálezu v blízkosti pleurálnej línie použitím konvexnej abdominálnej sondy, ale najkvalitnejší obrazový záznam sme získali pomocou lineárnej sondy. Náš záver sa zhoduje aj so záverom niekoľkých štúdií, ktoré porovnávali vhodnosť USG sondy pri samotnom vyšetrení pľúc pomocou USG. Copetti et al. uvádzajú, že pri vyšetrení pľúc u detí je vhodná lineárna sonda s vysokým rozlíšením (7,5–12 MHz) a LUS neposkytuje iný obraz ako u dospelých [5]. V aktuálnom medzinárodnom odporúčaní sa objavuje zmienka o výhodnosti použitia lineárnej sondy pri diagnostike povrchových štruktúr a konvexnej (abdominálnej) sondy pri diagnostikovaní hlbšie lokalizovaných štruktúr [2].
4. USG obraz pri meniacom sa pomere vzduch:tekutina. V ľavej časti obrázka vidíme normálny LUS nález tvorený len A-líniami (fyziologický nález). Pri postupne klesajúcom pomere vzduchu a narastajúcom obsahu vody dochádza k objaveniu sa B-línií – pri nižšom objeme od seba oddelených (B7- až B3-línie), neskôr splývajúcich do celku (biele pľúca – Birolleauov variant). V pravej časti obrázku vidíme obraz komprimovaných nevzdušných pľúc (echogénna časť) pri pleurálnom výpotku (anechogénna časť), upravené podľa [4]. Fig. 4. LUS image in changing air:fluid ratio. In left part of the picture normal LUS with A-lines shown (physiologic finding). With further fluid progression (air decreasing and fluid increasing) B-lines occur with variability from B7 to B3-lines to diffuse picture (Birolleau variant). On the right side of picture consolidated airless lungs (echogenic part) with plerual effusion (anechogenic part) are visible, modification by [4]. ![USG obraz pri meniacom sa pomere vzduch:tekutina. V ľavej časti obrázka vidíme normálny LUS nález tvorený len A-líniami (fyziologický nález). Pri postupne klesajúcom pomere vzduchu a narastajúcom obsahu vody dochádza k objaveniu sa B-línií – pri nižšom objeme od seba oddelených (B7- až B3-línie), neskôr splývajúcich do celku (biele pľúca – Birolleauov variant). V pravej časti obrázku vidíme obraz komprimovaných nevzdušných pľúc (echogénna časť) pri pleurálnom výpotku (anechogénna časť), upravené podľa [4].
Fig. 4. LUS image in changing air:fluid ratio. In left part of the picture normal LUS with A-lines shown (physiologic finding). With further fluid progression (air decreasing and fluid increasing) B-lines occur with variability from B7 to B3-lines to diffuse picture (Birolleau variant). On the right side of picture consolidated airless lungs (echogenic part) with plerual effusion (anechogenic part) are visible, modification by [4].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/ae63551e1f17b467396147a2fe5ff11b.jpg)
Tieto všeobecné princípy vzniku a diagnostiky artefaktov môžeme aplikovať aj v pediatrii, vo všeobecnosti sú patologické nálezy opísané v dospelej populácii veľmi podobné tým ako u detí [4–6]. V našom súbore pacientov sme dokázali identifikovať základné fyziologické a patologické artefakty, ktoré sa principiálne nelíšia od dospelej populácie. Určité odlišnosti existujú pri posudzovaní znaku kĺzania pľúc, B3 a B7 línií (menšie vzdialenosti u malých detí), v zásade však nemajú vplyv pre ich správnu identifikáciu.
V našom kontrolnom súbore sme dokázali u všetkých detí bez respiračnej patológie negatívny nález pomocou LUS. Zaujímavý je však nález „fyziologických“ B-línií u detí, u ktorých neboli prítomné známky respiračnej patológie (negatívny auskultačný nález, neprítomné známky infekcie) a takisto v ICU-N aj negatívny RTG pľúc. B-línie sme častejšie pozorovali v podskupine FYZ (38,7 % detí) ako v podskupine ICU-N (28,5 % detí). Nezaznamenali sme rozdiel v proporcionalite tohto znaku medzi neventilovanými a ventilovanými deťmi v ICU-N. Čo sa týka miesta identifikácie týchto B-línií, u zdravých detí boli najčastejšie v dolných regiónoch, ventrálnych aj dorzálnych, v podskupine ICU-N najčastejšie vo ventrálnych zónach. Najčastejšie sme ich pozorovali pomocou lineárnej vysokofrekvenčnej sondy, pomocou konvexnej sondy bolo zachytených podstatne menej prípadov. V literatúre sme našli len práce zaoberajúce sa touto problematikou v dospelej populácii. Niekoľko prác uvádza, že B-línie sa môžu identifikovať v laterobazálnych oblastiach pľúc zhruba u 14–28 % zdravej dospelej populácie. V štúdii podľa Copetti et al., zobrazili B-línie v akejkoľvek hrudnej oblasti u zdravých pacientov, vždy však bol tento nález izolovaný a väčšinou sa projikoval do laterobazálnych častí pľúc [5]. Ďalším faktom je, že nález fokálnych B+ línií môže detekovať okolitú izolovanú alveolárnu konsolidáciu akejkoľvek etiológie. Záverom týchto štúdii bola teda otázka, či nález B+ línií v nejakom regióne pľúc je asociovaný s difúznym intersticiálnym postihnutím pľúc, čo je však skôr nepravdepodobné. Až práca Agricola et al. definovala ako pozitívne vyšetrenie nález bilaterálne sa vyskytujúcich viacerých B+ línií buď diseminovaných ponad celé anterolaterálne časti pľúc alebo lokalizované v laterálnych častiach pľúc [7]. Podrobnejšie kritéria, ktoré sú pre každodenné použitie v klinickej praxi nevyhnutné, definovali Volpicelii et al. v roku 2006. Ako jednoznačnú hranicu medzi normálnym nálezom „fyziologických“ B-línií a diagnózou difúzneho alveolo-intersticiálneho syndrómu stanovili prítomnosť B+ línií v minimálne dvoch regionóch na každej polovici hrudníka pri použití metodiky 4 regiónov na každej polovici hrudníka [8]. Na základe tejto definície, nález B-línií v našich skupinách FYZ a ICU-N nemôžeme považovať za pozitívny, a teda patologický nález. Veľkou nevýhodou znaku B+ línii je nízka špecificita. V súčasnosti neexistujú kritéria, ktoré by dokázali odlíšiť etiológiu B+ línií, teda či sa jedná o kardiogénny pôvod, zápalový pľúcny edém, pľúcnu fibrózu alebo intersticiálnu pneumóniu. Zahrnutie USG metodiky do diagnostického algoritmu by v budúcnosti mohlo priniesť presnejšiu diferenciálnu diagnostiku.
Pôvod B-línií nie je v súčasnosti úplne známy, ale predpokladá sa jeho vznik spôsobený interakciou ultrasonografického echa pri prechode rôznymi oblasťami pľúc s rôznym obsahom tekutiny a vzduchu. Na princípe meniaceho sa pomeru vzduchu a tekutiny je v podstate postavená analýza B-línií, ktoré menia svoje charakteristické črty (B7, B3 alebo Biroleauov variant) v závislosti od množstva tekutiny v alveoloch alebo interstíciu (čierno-biele resp. biele pľúca). Pri ďalšej progresii v zmysle zvyšovania obsahu tekutiny v alveoloch získame obraz, ktorý sa podobá na parenchýmové vnútrobrušné orgány – konsolidované pľúca (sivé pľúca), obr. 4. Viacerými štúdiami boli potvrdené nálezy B+ línií pri viacerých nozologických jednotkách, napr. nález B7 línií pri pneumónii, bronchiolitíde, kontúzii pľúc, B3 pri ARDS alebo edéme pľúc, Biroleauov variant pri ťažkom stupni ARDS alebo pľúcneho edému. B3 a B7 línie sú vertikálnymi artefaktami s B-líniami vzájomne od seba vzdialenými o 3 resp. 7 mm. Tento záver bol vyslovený na základe štúdií, pri ktorých sa porovnávali získané nálezy pomocou CT vyšetrenia pľúc a USG pľúc u pacientov s rôznymi pľúcnymi ochoreniami. Napr. B7 línie sú na CT vyšetrení pľúc odrazom zhrubnutého interstícia, B3 línie sú ekvivalentnom CT obrazu mliečneho skla napr. pri ARDS [3]. Viac ako dve B-línie označujeme na základe poslednej nomenklatúry ako B+ línie, sú patologickým znakom [2].
Znak kĺzania pľúc je jedným z prvých a základných prvkov, ktoré pri LUS diagnostikujeme [9]. V našom súbore sme tento znak diagnostikovali u všetkých zdravých detí a rovnako aj v podskupine kriticky chorých detí bez respiračnej patológie. V sledovanej skupine I sme tento znak neidentifikovali u pacienta s pneumothoraxom, po operácii pľúc s arteficiálnym pneumothoraxom a atelektázou pľúc. V určitom percente prípadov pacientov s pneumóniou sme pozorovali tento znak podstatne oslabený, ale u každého bol prítomný. V štúdii podľa Copetti et al. bol jedným z diagnostických prejavov pneumónie aj vymiznutý znak kĺzania pľúc [5]. Podľa viacerých štúdií je chýbanie znaku kĺzania pľúc spojené buď s pneumothoraxom alebo atelektázou [10, 11]. Znak kĺzania pľúc dosahuje u zdravej populácie špecificitu 92%, u kriticky chorých pacientov klesá na 78 % a u pacientov s akútnym respiračným distresom dosahuje špecificitu asi 60 %. U dyspnoických pacientov má vymiznuté kĺzanie pľúc pozitívnu prediktívnu hodnotu 27 % pre diagnózu pneumothoraxu, preto chýbajúce kĺzanie pľúc neznamená prítomnosť pneumothoraxu [12]. Existuje mnoho ďalších okolností, ktoré dokážu oslabiť alebo úplne potlačiť kĺzanie pľúc – vysokofrekvenčná ventilácia, masívna atelektáza vrátane jednostrannej selektívnej intubácie, akútna pleuritída a stav po mechanickej pleurodéze [13].
Niekoľko odborných prác sa zaoberalo echogénnymi vlastnosťami alveolárnych konsolidácií a ich významom pri diagnostike pneumónii, pľúcneho infarktu a atelektázy 13]. Alveolárna konsolidácia je stav, pri ktorom došlo v alveoloch ku zmene v pomere tekutiny a vzduchu – zvýšil sa obsah tekutiny, ktorý nie je možné vždy zachytiť tradičnými zobrazovacími metódami alebo auskultáciou [14]. V situácii, keď je vzduch v pľúcach v tesnej blízkosti pleury nahradený tekutinou a medzi touto časťou pľúc a pleurou už nie je ďalšia prevzdušnená časť pľúc, dokážeme pomocou USG vizualizovať konsolidáciu pľúc [3]. Alveolárne konsolidácie sú často vizualizované práve preto, že dané oblasti sa nachádzajú blízko pri povrchu pľúc. Konsolidácie sa vo všeobecnosti zobrazujú ako hypoechogénne alebo až anechogénne útvary odstupujúce z pleury zasahujúce do hbších štruktúr pľúc s nepravidelnou hranicou, ktorá ich oddeľuje od hyperechogénnych vzdušných častí pľúc. Tento obraz sa zvykne označovať ako povrchový tekutinový alveologram, v minulosti bol označovaný ako znak útržku [4, 15]. Tento artefakt má relatívne limitovanú špecificitu pri odlíšení medzi pneumóniou, tumorom pľúc, atelektázou, pľúcnym infarktom alebo kontúziou pľúc [2]. Analýza tvaru a hraníc pľúcnej lézie často umožňuje oddiferencovanie zápalovej konsolidácie spôsobenej napr. pneumóniou (kde sú hranice nejasné, nepravidelné, často majú bizarný tvar) od periférneho pľúcneho infarktu spôsobeného embóliou s ostrými hranicami, alebo periférnych pľúcnych malignít s ostrými hranicami a okrúhlym tvarom [16]. V našom súbore sme identifikovali 8 pacientov s pneumóniou s pľúcnymi konsolidáciami, ktorých ohraničenie nebolo jasné, a veľmi často sme detekovali povrchový tekutinový alveologram. Vo včasnej fáze pneumónie dominuje homogénna echogenita, naopak pri progresii alebo komplikáciách dochádza k objaveniu sa nehomogénneho obrazu [17]. Znak podobný tkanivu je typickým pre masívnu konsolidáciu pľúc najčastejšie spôsobenú pneumóniou [18].
Dôležitými ukazovateľmi pri oddiferencovaní pneumónie od iných typov konsolidácie pľúc sú bronchogramy, ktoré môžu byť buď vzdušné, alebo tekutinové. Bronchogram je spôsobený tým, že vo vnútri bronchu sú uväznené vzduch alebo tekutina a dotvárajú tak obraz konsolidácie. Pri uväznení vzduchu v bronchu diagnostikujeme lineárny echogénny obraz, pri naplnení bronchu tekutinou anechogénny obraz často lentilkového typu. Vzdušný bronchogram veľmi často vytvára počas inspíria centrifugálne pohyby (zobrazené v M-móde), čo je vysoko špecifický príznak neretraktilnej konsolidácie spôsobenej pneumóniou. Statický vzdušný bronchogram je znakom neskorého štádia retraktilnej lézie pľúc spôsobenej atelektázou pľúc [3, 19].
Ako pľúcny pulz označujeme charakteristické vibrácie (zobrazené v M-móde), ktoré sa prenášajú neventilovanými konsolidovanými pľúcami v rytme srdcovej akcie. Rovnako ho dokážeme identifikovať pri jednostrannej intubácii pľúc alebo v distálnych častiach pľúc za hlienovou zátkou [11, 15].
Ultrasonografia sa pri diagnostike pľúcnych výpotkov používa už viac ako 40 rokov [20]. Miesto vyšetrenia pľúcnych výpotkov vychádza logicky z najčastejšie sa vyskytujúcich lokalizácií výpotkov teda nad bránicou. Väčšina výpotkov je anechogénna a musí spĺňať nasledujúce tri zásadné podmienky: 1) musia byť identifikované anatomické hranice pľúcneho výpotku – hrudná stena, bránica, subdiafragmatické orgány a pľúca, 2) nachádzame relatívne anechogénny priestor – samotný výpotok a 3) detekujeme dynamické zmeny – znak sínusoidy, znak medúzy, znak planktónu, znak hematokritu [21, 22].
Termínom „plávajúce pľúca“ označujeme stav, pri ktorom vizualizujeme pomalé, undulujúce pohyby komprimovaných pľúc v pleurálnom výpotku. Tento nález môže niekedy úplne absentovať v prípade veľmi malých výpotkov. V takom prípade zaznamenávame počas dychového cyklu pohyb vzdušných pľúc ponad výpotok. Tento pohyb môžeme zaznamenať prostredníctvom M-módu, kedy sa nám počas dychového cyklu vizualizuje pohyb viscerálnej pleury k a od hrudnej steny, a vytvára tak v reálnom čase sínusoidu, znak sínusoidy. Tento znak má špecificitu 97 % v diagnostike pľúcnych výpotkov [23]. Pri vyšetrení pľúc je potrebné vyšetriť celú oblasť hrudníka, pomocou čoho dokážeme identifikovať aj veľmi drobné výpotky v objeme 5 ml [21]. Použitie ultrasonografie v diagnostike pľúcnych výpotkov má jednoznačne väčší prínos v porovnaní s klasickým RTG pľúc [24]. Na viac, pri použití USG dokážeme definovať aj etiológiu výpotku. Všetky transudáty sú vždy anechogénne. Exudáty môžu byť anechogénne, ale často majú aspoň určitý stupeň echogenity, čo môže mať viacero foriem. Napr. echogénna tkanivová drvina môže plávať v inak anechogénnom výpotku (znak planktónu), inokedy vizualizujeme fibrínové vlákna alebo dokonca septácie. Tieto sú väčšinou asociované s purulentným výpotkom. Veľmi husté purulentné výpotky dokážu takmer imitovať obraz podobný tkanivu, od ktorého ich dokážeme odlíšiť pomocou vyššie uvedených dynamických zmien. V určitých prípadoch hemothoraxu dokážeme dokonca identifikovať postupnú sedimentáciu hematokritu v určitom mieste [12, 25, 26].
Celkovo najviac štúdii o LUS je venovaných porovnaniu s tradičnými metódami diagnostiky respiračných ochorení. V tejto práci uvádzame len vypočítané hodnoty senzitivity a špecificity pre LUS, porovnanie s RTG a auskultáciou je predmetom iného odborného článku autorov. V štúdii podľa Iuriho dosiahli pomocou USG senzitivitu 91,7 % a špecificitu 100 % pri diagnostike pneumónie u detí len na základe identifikácie pľúcnych konsolidácií. Pri diagnóze pleurálnych výpotkov dosiahli senzitivitu aj špecificitu 100 %. V inej štúdii 103 detí prijatých pre suspektnú pneumóniu sa uvádza senzitivita LUS 97,9 %, špecificita 94,5 %, pozitívna prediktívna hodnota 94,0 % a negatívna prediktívna hodnota 98,1 % [27]. Pri diagnostike pneumónie sme pomocou LUS dosiahli senzitivitu 94,7 % a špecificitu 98 %, pri pleurálnych výpotkoch senzitivitu 93,1 % a špecificitu 95,2 %. V štúdiach dospelých pacientov sa senzitivita LUS pri pneumónii pohybuje okolo 88 až 90 %. Pre porovnanie, použitím auskultácie je diagnostika pleurálnych výpotkov so senzitivitou 42 % a špecificitou 90 %, použitím RTG je senzitivita 39 % a špecificita 85 %, LUS senzitivita 92–94 % a špecificita 93–97 % [15].
Kontúzie pľúc bývajú najčastejším nálezom u detí s tupou traumou hrudníka. V sledovanej skupine sme kontúziu pľúc diagnostikovali pomocou LUS so senzitivitou 92 % a špecificitou 98 %.
Atelektáza pľúc bola v skupine I diagnostikovaná so senzitivitou 83 % a špecificitou 97 %, je však potrebné dodať, že najčastejšie bývajú u ventilovaných pacientov lokalizované v paravertebrálnych segmentoch pľúc, ktoré sú pre LUS dostupné len pri miernom náklone pacienta na stranu. Použitie samotného znaku pľúcneho pulzu má pre diagnostiku atelektázy pľúc navodenú selektívnou jednostrannou intubáciou pľúc senzitivitu 90 %. V štúdii podľa Acosta et al porovnávali LUS s MRI pri diagnostike atelektázy pľúc u 15 detí. LUS dosiahla senzitivitu 88 % (95% CI 74–96 %) a špecificitu 89 % (95% CI 83–92 %) [11].
Senzitivita LUS pri ARDS dosiahla v našom súbore 91 % a špecificita 99 %. Pri ARDS závisí LUS obraz od štádia ARDS, teda či sa jedná o fokálne alebo difúzne zmeny [2].
Bronchiolitídu sme diagnostikovali pomocou LUS so senzitivitou 89,3 % a špecificitou 98 %. LUS pri bronchiolitíde konštantne zobrazuje bilaterálneho postihnutia pľúc, často sa zobrazujú zdravé úseky pľúc striedajúce sa s oblasťami pľúc so subpleurálnymi konsolidáciami (1–3 cm), ktoré sú spôsobené malými atelektázami. Tieto konsolidácie pľúc sú často obklopené B líniami, ktoré sú koalescentné. Väčšie konsolidácie nachádzame menej častejšie, ako bývajú typicky asociované s ťažším priebehom ochorenia. V počiatočných štádiách ochorenia sú najprv postihnuté paravertebrálne časti pľúc, často môžeme pozorovať pľúcne výpotky [28].
ZÁVER
LUS je alternatívnou zobrazovacou metódou vyšetrenia pľúc, pomocou ktorej dokážeme spoľahlivo diagnostikovať niektoré respiračné ochorenia aj v detskom veku. Pri výbere USG sondy odporúčame lineárnu a konvexnú sondu, mikrokonvexná USG sonda, ktorá sa štandardne odporúča v dospelej medicíne, je u detí viac-menej nepoužiteľná. Pri zameraní vyšetrenia na patológie v blízkosti pleurálnej línie jednoznačne odporúčame lineárnu sondu, pri analýze hlbšie uložených pľúcnych patológií zasa konvexnú – abdominálnu sondu. V našej práci sme nedokázali vizuálny rozdiel v LUS medzi ventilovanými a neventilovanými deťmi. Približne u tretiny zdravej populácie nachádzame pri LUS vyšetrení „fyziologické“ B-línie. Dosiahnuté hodnoty senzitivity a špecificity pri diagnostike akútnych respiračných ochorení predurčujú LUS ako alternatívny nástroj zobrazenia pľúc v klinickej praxi pediatra.
Došlo: 1. 4. 2015
Přijato: 4. 9. 2015
MUDr. Vladimír Zoľák
Klinika detskej anestéziológie a intenzívnej medicíny
Jesseniova LF, Univerzita Komenského
Univerzitná nemocnica Martin
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: vzolak@gmail.com
Sources
1. Barillari A, Fioretti M. Lung ultrasound: a new tool for the emergency physician. Intern Emerg Med 2010; 5 : 335–340.
2. Volpicelli G, Elbarbary M, Blaivas M, et al. International evidence-based recommendations for point-of-care lung ultrasound. International Liaison Committee on Lung Ultrasound (ILC-LUS) for International Consensus Conference on Lung Ultrasound (ICC-LUS). Intensive Care Med 2012 Apr; 38 (4): 577–591.
3. Lichtenstein D. Whole Body Ultrasonography in the Critically Ill. 2nd ed. Berlin: Heidelberg: Springer-Verlag, 2010. ISBN: 978-3-642-05327-6.
4. Gargani L, Volpicelli G. How I do it: Lung ultrasound. Cardiovasc Ultrasound 2014 Jul 4; 12 : 25.
5. Copetti R, Cattarossi L. Ultrasound diagnosis of pneumonia in children. Radiol Med 2008, 113 : 190–198.
6. Lichtenstein DA. Lung ultrasound in the critically ill. Ann Intensive Care 2014; 1 : 315–322.
7. Agricola E, et al. ‘Ultrasound comet-tail images’: a marker of pulmonary edema: a comparative study with wedge pressure and extravascular lung water. Chest 2005; 127 : 1690–1695.
8. Volpicelli G, Mussa A, Garofalo G. Bedside lung ultrasound in the assessment of alveolar-interstitial syndrome. Am J Emerg Med 2006; 24 : 689–696.
9. Tomà P, Owens C. Chest ultrasound in children: critical appraisal. Pediatr Radiol 2013; 43 : 1427–1434.
10. Mong A, Epelman M, Darge K. Ultrasound of the pediatric chest. Pediatr Radiol 2012; 42 : 1287–1297.
11. Acosta CM, et al. Accuracy of transthoracic lung ultrasound for diagnosing anesthesia-induced atelectasis in children. Anesthesiology 2014 Jun; 120 (6): 1370–1379.
12. Mayo P, Beaulieu Y, Doelken P, et al. American College of Chest Physicians/La Société de Réanimation de Langue Française statement on competence in critical care ultrasonography. Chest 2009; 4 : 1050–1060.
13. Riccabona M. Ultrasound of the chest in children (mediastinum excluded). Eur Radiol 2008; 18 : 390–399.
14. Via G, Storti E, Gulati G, et al. Lung ultrasound in the ICU: From diagnostic instrument to respiratory monitoring tool. Minerva Anestesiol 2012; 78 : 1282–1296.
15. Lichtenstein D, Lascols N, Mezičre G, et al. Ultrasound diagnosis of alveolar consolidation in the critically ill. Intensive Care Med 2004; 30 : 276–281.
16. Caiulo VA, Gargani L, Caiulo S, et al. Lung ultrasound characteristics of community-acquired pneumonia in hospitalized children. Pediatr Pulmonol 2013; 48 : 280–287.
17. Kurian J, Levin TL, Han BK, et al. Comparison of ultrasound and CT in the evaluation of pneumonia complicated by parapneumonic effusion in children. AJR Am J Roentgenol 2009; 193 : 1648–1654.
18. Coley BD. Chest sonography in children: Current indications, techniques, and imaging findings. Radiol Clin N Am 2011; 49 : 825–846
19. Volpicelli G, Silva F, Radeos M. Real-time lung ultrasound for the diagnosis of alveolar consolidation and interstitial syndrome in the emergency department. Eur J Emerg Med 2010 Apr; 17 (2): 63–72.
20. Yang PC, et al. Value of sonography in determining the nature of pleural effusion: analysis of 320 cases. AJR Am J Roentgenol 1992; 159 : 29–33.
21. Vignon P, et al. Quantitative assessment of pleural effusion in critically ill patients by means of ultrasonography. Crit Care Med 2005; 33 : 1757–1763.
22. Arberlot CH, Ferrari F, Bouhemad B, et al. Lung ultrasound in acute respiratory distress syndrome and acute lung injury. Cur Opin Crit Care 2008; 14 : 70–74..
23. Zechner PM, et al. Lung ultrasound in acute and critical care medicine. Anaesthesist 2012 Jul; 61 (7): 608–617.
24. Gardelli G, et al. Chest ultrasonography in the ICU. Respir Care 2012 May; 57 (5): 773–781.
25. Lichtenstein D. Ultrasound examination of the lungs in the intensive care unit. Pediatr Crit Care Med 2009; 10 (6): 693–698.
26. Noble VE, Nelson BP. Manual of Emergency and Critical Care Ultrasound. 2nd ed. Cambridge: Cambridge University Press, 2011. ISBN 978-0-521-17091-8.
27. Esposito S, Papa SS, Borzani I, et al. Performance of lung ultrasonography in children with community-acquired pneumonia. Ital J Pediatr 2014; 17 (4): 37–40.
28. Caiulo VA, Gargani L, Caiulo S, et al. Lung ultrasound in bronchiolitis: comparison with chest x-ray. Eur J Pediatr 2011; 170 : 1427–1433.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2015 Issue 5-
All articles in this issue
- Special topics in lung ultrasound in children
- Association between genetic polymorphisms of methylenetetrahydrofolate reductase and congenital heart disease in Slovak population
- Intestinal permeability and SCORAD of children with atopic dermatitis after six weeks supplementation of Lactobacillus rhamnosus GG (the pilot study)
- Favourable prognosis of solitary kidney in children?
- Intrafamiliar phenotype variability of classic Marfan syndrome
- Rare case of patient with DiGeorge syndrome and limbs anomalies: the benefit of SNP microarray analysis?
- Metabolic bone disease of prematurity – review article
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metabolic bone disease of prematurity – review article
- Special topics in lung ultrasound in children
- Rare case of patient with DiGeorge syndrome and limbs anomalies: the benefit of SNP microarray analysis?
- Association between genetic polymorphisms of methylenetetrahydrofolate reductase and congenital heart disease in Slovak population
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

