-
Medical journals
- Career
Metabolické kostní onemocnění při nezralosti
: T. Matějek 1; M. Navratilova 1; Z. Kokštein 1; V. Palička 2
: Dětská klinika FN a LF UK, Hradec Králové přednosta prof. MUDr. M. Bayer, CSc. 1; Ústav klinické biochemie a diagnostiky FN a LF UK, Hradec Králové přednostka MUDr. L. Pavlíková 2
: Čes-slov Pediat 2015; 70 (5): 303-312.
: Review
Nezralí novorozenci, zejména ti, kteří se narodí před 28. gestačním týdnem, jsou ohroženi redukcí obsahu kostního minerálu, protože největší část mineralizace fetálního skeletu se odehrává ve třetím trimestru těhotenství s maximem v termínu porodu. Postnatálně, vlivem časněji zahájené přestavby skeletu, relativně rychlému růstu kosti a nízké retenci minerálů (ve srovnání s intrauterinní) dochází k další významné redukci kostní denzity. Důsledkem těchto změn u nedonošených dětí je jednotka označovaná jako metabolické kostní onemocnění (MBD).
I přes významný pokrok intenzivní novorozenecké péče v posledních 20 letech se incidence MBD u nedonošených novorozenců nezměnila (30–55 %). Zdá se, že výskyt patologických fraktur na podkladě MBD klesá, přesto je zde ale více než 10% riziko této časné komplikace. Rozdíly ve stavbě skeletu původně nezralých novorozenců oproti zdravé populaci pozorované ve školním věku nebo u mladých dospělých (redukce finální tělesné výšky, event. kostní denzity) mohou představovat významný rizikový faktor k rozvoji časné osteoporózy v dospělosti. Rizikové faktory přispívající k rozvoji kostní patologie u nezralých novorozenců jsou dobře zdokumentovány. Diagnostika MBD je založena na stanovení biochemických parametrů kostního metabolismu. Nízká hladina sérového fosforu a vysoká hladina alkalické fosfatázy je považována za zlatý standard, přestože byla opakovaně demonstrována jejich značně omezená spolehlivost. Základem úspěšné léčby je důsledná prevence, která spočívá v časné optimální nabídce vápníku, fosforu a vitaminu D cestou parenterální i enterální výživy. Tento článek nabízí souhrnné aktuální informace o patofyziologii, incidenci, diagnostice, léčbě a následcích MBD u nezralých novorozenců.Klíčová slova:
metabolické kostní onemocnění při nezralosti, osteopenie, vitamin D, parathormon, alkalická fosfatáza, novorozenecÚvod
V posledních letech je v souvislosti se zlepšováním péče o novorozence s velmi a extrémně nízkou porodní hmotností věnována zvýšená pozornost dlouhodobým následkům nezralosti. Mezi ně lze zařadit i případnou redukci definitivní tělesné výšky a nedosažení dostatečné vrcholové kostní hmoty s možným vlivem na vznik časné osteoporózy v dospělosti. Důvodem těchto problémů je významné snížení kostní minerální denzity (BMD) v prvních měsících života, v literatuře variabilně označované jako metabolické kostní onemocnění (MBD – metabolic bone disease), osteopenie, osteomalacie či rachitida při nezralosti. Optimální přístup s cílem prevence rozvoje MBD je stále zahalen řadou kontroverzí.
Tento přehledový článek nabízí souhrnné aktuální informace o terminologii kostní patologie, incidenci, následcích, diagnostice a léčbě metabolického kostního onemocnění nezralých novorozenců.
Terminologie kostní patologie
Fyziologický proces kostní mineralizace (tvorba hydroxyapatitu) probíhá ve dvou krocích: 1) skupina osteoblastů vytvoří depozita organické kostní matrix (= osteoid) na povrchu již mineralizované kosti; 2) s odstupem několika dnů dochází k zabudování minerálů (vápník, fosfor a další) do tohoto nově syntetizovaného osteoidu (= mineralizace). U nedonošených novorozenců je nutné počítat s možným narušením obou těchto pochodů, tj. jak s tvorbou organické kostní matrix (osteoid), tak s poruchou vlastní mineralizace. Tím se dostáváme k nejčastějším patologickým stavům skeletu nezralých novorozenců – osteopenii a osteomalacii [1].
Osteomalacie je porucha fyziologického procesu mineralizace, tj. inkorporace minerálů do nově vytvořené kostní matrix [1]. To vede k akumulaci nemineralizovaného osteoidu s „měknutím“ kosti, což se může u novorozence klinicky prezentovat jako dolichocefalické oploštění lebky. Na prostém RTG zápěstí často diagnostikujeme „vymytý“ vzhled kosti. Pokud porucha mineralizace postihuje i růstové chrupavky, pak mluvíme o rachitidě, pro kterou je typická neostrá/nepravidelná hranice mezi růstovou chrupavkou a metafýzou na RTG zápěstí (obr. 1). Po dobu otevřených růstových chrupavek se oba stavy (osteomalacie a rachitida) vyskytují současně. Etiologicky se na rozvoji osteomalacie/rachitidy podílí zejména nedostatečný přísun vápníku, fosforu, potažmo vitaminu D [1, 2].
1. RTG zápěstí zobrazující typický obraz „vymyté kosti“ a neostrá/nepravidelná hranice mezi růstovou chrupavkou a pohárkovitě deformovanou metafýzou (označeno šipkou) jako známky steomalacie/rachitidy. Fig. 1. Radiograph of the wrist showing the typical image of „washed out bone appearance“ and fuzzy/irregular border between the growth cartilage and the bony metaphysis (arrow) as signs of steomalacia/rickets. 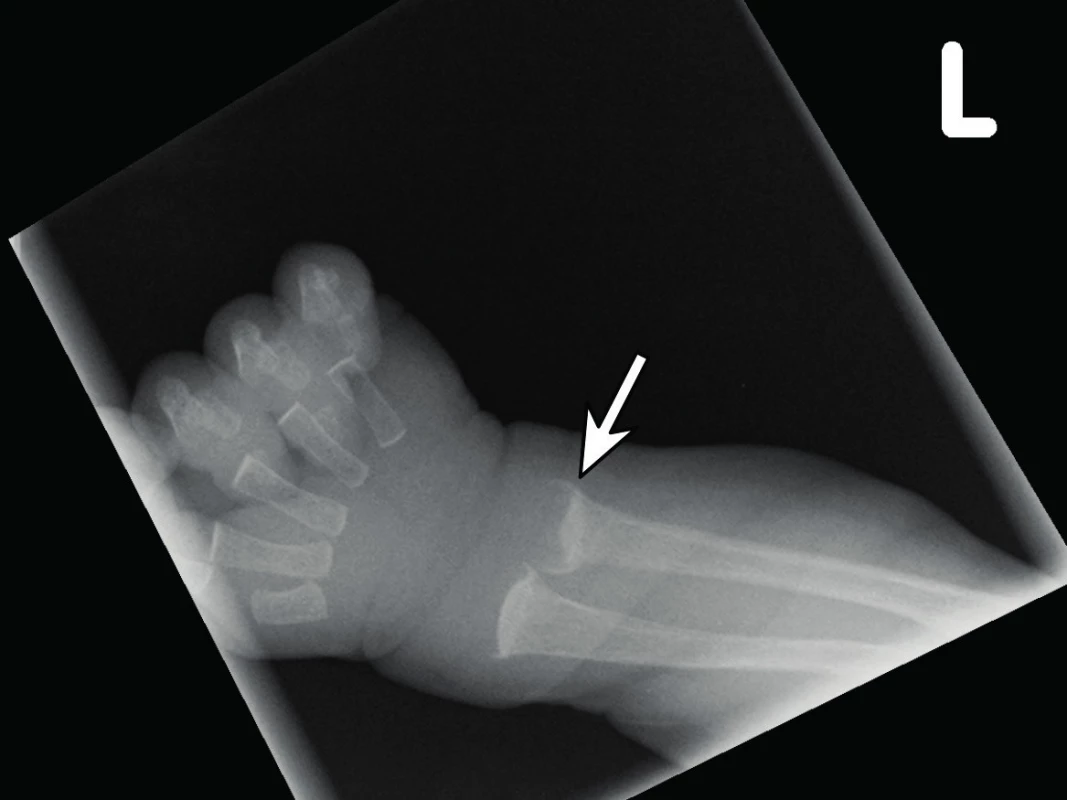
Osteopenie je podle Raucha [1] snížené množství kostní tkáně, což na strukturální úrovni znamená sníženou tloušťku kompaktní kosti a sníženou tloušťku nebo počet trámců spongiózní kosti. Osteopenie je u nezralých novorozenců způsobena nedostatečnou depozicí či zvýšenou resorpcí osteoidu, přičemž na rozdíl od osteomalacie je mineralizace zbylého osteoidu normální. Důvodem osteopenie můžou být závažná systémová onemocnění, vedlejší efekt léků či nedostatek mechanické stimulace [1, 2].
Na základě definice osteomalacie a osteopenie je zřejmé, že v etiologii kostního onemocnění nedonošených novorozenců se ve většině případů uplatňují oba tyto patologické procesy, které nelze odlišit ani zobrazovacím vyšetřením [1]. Osteopenie, osteomalacie/rachitida, osteopatie nedonošených jsou názvy zavádějící, nepostihující komplexnost problematiky. Dále je chybou interpretovat RTG popis rachitidy u nezralých novorozenců jako vitamin D deficitní rachitidu. Z těchto důvodů se „metabolické kostní onemocnění“ jeví jako nejvhodnější označení pro onemocnění postihující rychle rostoucí kosti nedonošených novorozenců. Z výše uvedeného vyplývá, že v patofyziologii MBD se kombinují tyto příčiny – ztráta fetální akrece vápníku (Ca) a fosforu (P), časnější začátek přestavby kostí, nedostatečný přísun minerálů (osteomalacie/rachitida) a porucha formace kostní matrix (osteopenie).
Vliv předčasného porodu na kostní metabolismus
Dětství a adolescence představuje období vrcholu tvorby kostní hmoty (PBM – peak bone mass), čehož je dosaženo na konci druhé životní dekády. Kostní síla je ze 70 % určována kostní minerální denzitou (BMD – bone mineral density) a ze 30 % pak kostní kvalitou. Na kostní kvalitě se podílí architektura, mineralizace, kostní obrat či nahromaděná poškození (mikrofraktury) [2]. V klinické praxi nemáme v současné době k dispozici přístroj, který by uměl změřit kostní sílu, proto ji odhadujeme pomocí BMD, kterou měříme kostní denzitometrií. Fyziologická hodnota BMD je u každého dospělého jedince určena rovnováhou mezi dosaženým vrcholem kostní hmoty a ztrátou kostní hmoty vlivem stárnutí. U jedinců, u kterých v průběhu dětství a adolescence nedosáhne kostní hmota patřičných vrcholových hodnot, může dojít k narušení této rovnováhy a tím k rozvoji osteoporózy mnohem dříve [2].
Pokrok v intenzivní péči o novorozence vedl v posledních 20 letech k výraznému zlepšení přežívání nezralých novorozenců. Nicméně u novorozenců s extrémně nízkou porodní hmotností pod 1000 g (ELBW – extreme low birth weight) je nadále potřeba počítat s významnou incidencí časné a pozdní morbidity [3]. Do popředí zájmu neonatologů se dostaly mimo jiné i nutriční požadavky. Cílem výživy nezralých novorozenců je přiblížit dodávku živin k intrauterinnímu příjmu zdravého fétu. Správné složení výživy je také důležité pro správný vývoj a mineralizaci skeletu. Nezralí novorozenci, zejména ti, kteří se narodí před 28. gestačním týdnem, jsou ohroženi nižší BMD, protože největší část kostní mineralizace fetálního skeletu se odehrává ve třetím trimestru těhotenství s maximem krátce před vlastním porodem. Postnatálně vlivem časněji zahájené přestavby skeletu, relativně rychlému růstu kosti a nízké retenci minerálů (ve srovnání s intrauterinní) dochází k další signifikantní redukci kostní denzity. Výsledkem těchto postnatálních změn u nedonošených dětí je metabolické kostní onemocnění se všemi možnými důsledky [4].
Většina studií popisujících incidenci MBD při nezralosti byla provedena v 80. a 90. letech minulého století a týkala se novorozenců velmi nízké porodní hmotnosti pod 1500 g (VLBW – very low birth weight). Tato „historická“ incidence MBD se pohybovala v rozmezí 30–50 % [5, 6]. Podle recentních retrospektivních studií je incidence MBD u novorozenců s porodní hmotností mezi 1000–1500 g (VLBW) do 10 %. Naproti tomu pro novorozence s porodní hmotností pod 1000 g (ELBW) se incidence MBD pohybuje kolem 30 %. Pro novorozence s porodní hmotností pod 600 g je incidence až 55 % [6, 7]. Je třeba mít na paměti, že vzhledem k absenci široce akceptovaných diagnostických kritérií je přesná incidence MBD stále diskutabilní. Výše zmíněné studie využívaly k diagnostice prosté RTG vyšetření, o kterém je známo, že je zatíženo chybou subjektivního vnímání a k zachycení známek MBD je potřeba minimálně 20–40 % demineralizace skeletu [5, 6, 8]. Z těchto důvodů je možno reálně uvažovat o incidenci ještě vyšší.
2. Fraktura pravého femuru jako následek metabolického kostního onemocnění při nezralosti. Fig. 2. Fracture of the right femur as a result of metabolic bone disease of prematurity. 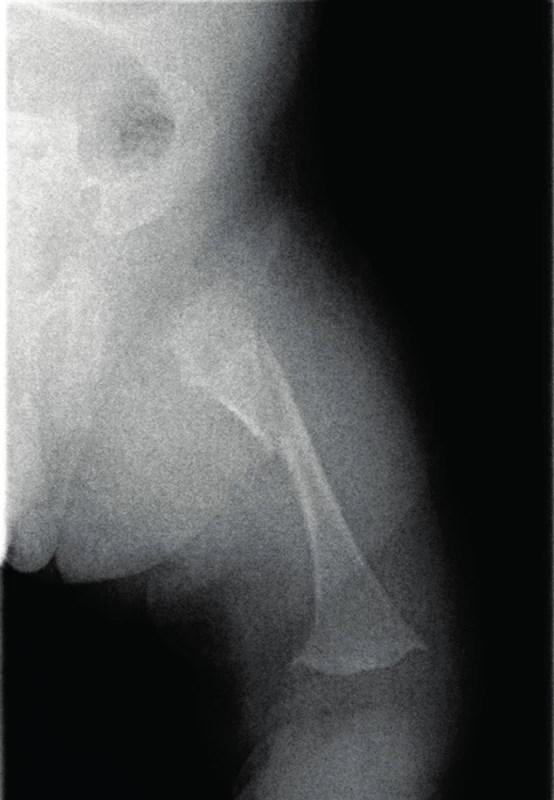
Proč se vlastně MBD u nezralých novorozenců zabývat? Existují krátkodobé a dlouhodobé následky a jaký je jejich dopad na další vývoj dítěte? Odpovědět na tyto otázky není na základě současných poznatků snadné. Mezi krátkodobé následky řadíme zlomeniny kostí. Koncem minulého století se incidence fraktur pohybovala mezi 10–30 % [5, 9]. Podle některých autorů [4, 5] se v posledních letech četnost fraktur snížila, což podporuje i recentní práce Viswanathana [6] se zjištěnou incidencí zlomenin 12,2 % u skupiny ELBW novorozenců. Nejčastěji se jednalo o náhodně zjištěné zlomeniny žeber (až 70 %) při RTG vyšetření z jiné indikace, v menším zastoupení pak fraktury humeru (20 %) nebo femuru (10 %, obr. 2) [6]. Obvykle se zlomeniny objevují od 10.–12. týdne života a jejich výskyt klesá do šestého měsíce nekorigovaného věku. Do přímé souvislosti jsou dávány tyto rizikové faktory: totální parenterální výživa trvající déle než čtyři týdny, cholestáza, těžší formy bronchopulmonální dysplazie, léčba kortikosteroidy či furosemidem déle než dva týdny [6, 9]. V současné době nejsou známy dlouhodobé následky fraktur vzniklé v tomto věku [5]. Souvislost mezi MBD, dolichocefalií a myopií byla předmětem zkoumání, ale nebyla potvrzena [5, 10].
K rozvaze nad dlouhodobými následky MBD u novorozenců je k dispozici jen omezené množství klinických studií. Z několika prací vyplývá, že u původně nezralých novorozenců dochází při srovnání s donošenými k normalizaci kostní denzity v rozmezí 6 měsíců až 2 let [11–13]. Logicky se tedy nabízí odpověď, že MBD u nezralých novorozenců nemá vliv na další vývoj skeletu. Nicméně další follow-up původně nezralých novorozenců ukazuje signifikantní tendenci k nižší tělesné výšce a obvykle i redukci kostní denzity. Bowden u 8letých původně nezralých novorozenců prokázal výšku o 4,9 cm nižší, než měla kontrolní skupina původně donošených novorozenců. Významný rozdíl v parametrech denzitometrie nebyl prokázán [14]. Ke stejnému zjištění dospěl i Smith [15]. V jiné studii byla u 20 novorozenců pod 1500 g také prokázána signifikantní redukce tělesné výšky, ale i kostní denzity, a to mezi 5.–9. rokem ve srovnání s populačními daty [16]. U více než 200 novorozenců s porodní hmotností pod 1850 g narozených v Anglii v letech 1982–1985 byla ve 20 letech věku prokázána nižší tělesná výška a snížená kostní denzita bederní páteře. U hypotrofických novorozenců s porodní hmotností pod 1250 g byly tyto změny ještě výraznější [17].
Souhrnně lze říci, že i přes významný pokrok intenzivní novorozenecké péče v posledních 20 letech, jak po stránce výživy (např. strategie parenterální výživy, časná enterální výživa, umělé mléčné formule pro nedonošené novorozence, fortifikace mateřského mléka atd.), tak ve smyslu zlepšení managementu ventilační podpory a bronchopulmonální dysplazie, se incidence MBD nezměnila. Došlo ale k přesunu onemocnění na novorozence nejnižší váhové kategorie (ELBW). Zdá se, že incidence patologických fraktur na podkladě MBD se snižuje, přesto je zde ale více než 10% riziko této časné komplikace [6]. Rozdíly ve skeletu původně nezralých novorozenců oproti zdravé populaci pozorované ve školním věku nebo u mladých dospělých (redukce finální tělesné výšky, event. kostní denzity) mohou představovat významný rizikový faktor k rozvoji časné osteoporózy. Pokud by tomu tak bylo, pak by se jednalo o závažnou dlouhodobou morbiditu. K rozklíčování této problematiky jsou zapotřebí další dlouhodobé observační studie.
Rizikové faktory MBD
Etiologie metabolického kostního onemocnění u nezralých novorozenců je multifaktoriální, nejvýznamnější je nedostatečná nutrice, nelze ale opomíjet i vlivy prostředí a vlivy biomechanické.
Existuje celá řada rizikových faktorů, které jsou dávány do spojení s rozvojem MBD (tab. 1). Většina jich je s výživou přímo nebo nepřímo spojena. V posledním trimestru těhotenství dochází k retenci 2/3 kalcia a fosforu ve fetálním skeletu. Zásadní roli v tomto procesu hraje placenta, tudíž při poruše její funkce např. při preeklampsii nebo zánětu lze předpokládat alteraci retence minerálů do kosti. Tomu odpovídá zvýšená incidence MBD u hypotrofických novorozenců [5]. Předčasným porodem jsou děti velmi a extrémně nízké porodní hmotnosti ochuzeny o výhodnou intrauterinní akreci minerálů a postnatálně jsou velmi náchylné na nedostatečný příjem kalcia a fosforu, což je klíčový faktor vedoucí k redukci kostní mineralizace a k rozvoji MBD. Problémy se zajištěním dostatečného příjmu potřebných živin a minerálů u nezralých novorozenců nesouvisí jen s vlastní nezralostí, ale vliv zde má také neonatální morbidita, která se zásadní měrou podílí na délce parenterální výživy (PN) a přidružené medikamentózní léčbě. Dodávka vápníku a fosforu v PN je omezená z důvodu špatné rozpustnosti minerálů v používaných roztocích. Dalším problémem PN je vysoký obsah hliníku v roztocích PN (zejména kalciové a fosfátové roztoky, aminokyseliny, albumin). Akumulace hliníku vede k poruše tvorby kostní matrix a mineralizace kostí [2]. Léky, které nejvíce zvyšují riziko neadekvátní kostní mineralizace, shrnuje tabulka 1.
1. Metabolické kostní onemocnění při nezralosti – rizikové faktory. 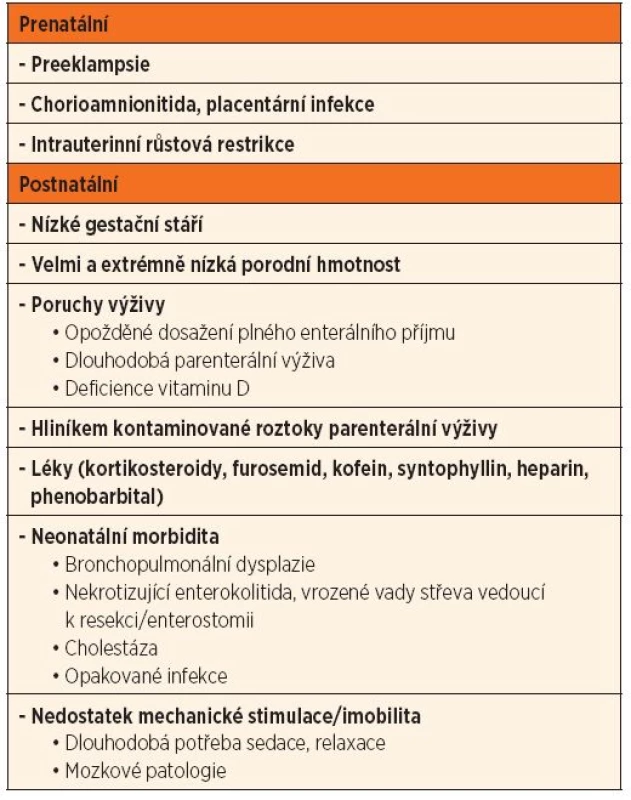
Jedná se zejména o dlouhodobější podávání kortikosteroidů a furosemidu. Kortikosteroidy inhibují funkci osteoblastů, dále redukují střevní absorpci a tubulární reabsorpci kalcia (vede ke kalciurii se zvýšeným rizikem nefrokalcinózy). Furosemid a další kličková diuretika zvyšují renální ztráty Ca a tím vedou k jeho negativní bilanci (thiazidová diuretika mají opačný efekt). Aminophylliny (kofein, syntophyllin) též vedou ke zvýšeným ztrátám Ca do moči, nicméně významnost je oproti steroidům a furosemidu podstatně nižší. Dlouhodobé podávání heparinu je také asociováno s poklesem kostní denzity. Heparin snižuje aktivitu osteoblastů, vede k abnormálnímu metabolismu vitaminu D a k sekundární hyperparathyreóze. A konečně, dlouhodobé užívání phenobarbitalu (a/nebo phenytoinu) urychluje degradaci vitaminu D, což může vést k nedostatečnému vstřebávání Ca [2].
Fyzická aktivita hraje klíčovou roli při mineralizaci kosti. Vývoj skeletu je určován funkčními požadavky, což znamená, že kostní síla/pevnost (určována ze 70 % kostní denzitou) roste pouze v případě zvyšujících se nároků na udržení kostní stability. Největší nároky na udržení kostní stability kladou svalové kontrakce, na což kost reaguje posílením mineralizace s cílem zvýšení kostní síly [1, 2, 18, 19]. Nedostatek fyzické aktivity vlivem dlouhodobé sedace, relaxace či z důvodu poškození mozku vede ke zvýšené kostní resorpci a je to dobře popsaný rizikový faktor pro rozvoj MBD [4, 20].
Diagnostika MBD
K rozvoji metabolického kostního onemocnění nezralých novorozenců dochází typicky mezi 6.–12. postnatálním týdnem [2, 21]. Diagnostika MBD je stejně jako u jiného onemocnění založena na anamnéze (identifikace rizikových pacientů), klinickém stavu, zobrazovacích vyšetřeních a pravidelném sledování biochemických markerů. Mezi děti s nejvyšším rizikem patří ELBW a VLBW novorozenci s komplikovaným průběhem – opakované infekce, dlouhodobé ventilační obtíže (bronchopulmonální dysplazie s kortikosteroidy) a významná resekce střeva s eventuální enterostomií nebo syndromem krátkého střeva (viz také tab. 1). Klinický průběh je obvykle asymptomatický. Pravděpodobně nejčastější manifestací rozvoje MBD je nález osteomalacie/rachitidy skeletu na RTG snímku provedeném z jiné indikace. Méně často je prvním příznakem až fraktura žeber a//nebo dlouhých kostí.
Zobrazovací vyšetření
RTG vyšetření je nejrozšířenější a nejběžněji užívanou zobrazovací metodou k objektivizaci stavu skeletu v případě podezření na MBD. Není ale přínosné pro časnou diagnostiku MBD, navíc je zatíženo subjektivní chybou. Viditelné změny, jako zvýšená průsvitnost kosti při RTG vyšetření („vymyté“ kosti“) nebo rachitické změny růstových štěrbin, lze detekovat až při 20–40% snížení mineralizace kosti (obr. 1) [5, 6, 8].
Kostní denzitometrie měří kostní denzitu (BMD) a ta vyjadřuje množství minerálů v kosti (BMC – bone mineral content) ve sledovaném úseku (v g/cm2) nebo objemu kosti (v g/cm3). Nejrozšířenějším systémem denzitometrie je dvoufotonová RTG absorpční fotometrie (DEXA), která je v současné době považována za zlatý standard pro vyšetření dospělých. Radiační dávka je pro novorozence zanedbatelná [21]. Výsledky denzitometrického vyšetření se vyjadřují jako T - nebo Z-skóre. T-skóre udává počet odchylek výsledku vyšetření od tabulkové hodnoty kostní minerální denzity mladých zdravých jedinců stejného pohlaví (normativní data). Z-skóre vyjadřuje totéž, ale porovnává výsledek vyšetření s průměrnými hodnotami u osob stejného pohlaví i věku. Skóre +1 až -1 směrodatná odchylka se považuje za normální. Větší odchylky vypovídají o různém stupni řídnutí kostí. DEXA je považována za neinvazivní, bezpečné a velmi citlivé vyšetření kostní denzity i u donošených a nedonošených novorozenců [4]. Významným problémem je velmi omezená možnost tyto výsledky porovnávat s normativními daty pro výpočet T - nebo Z-skóre, tj. posoudit odchylku od zdravé populace novorozenců. Se zavedením speciálního neonatálního softwaru, obsahujícího průměrné hodnoty zdravých donošených novorozenců, se nově tato možnost nabízí pro donošené novorozence. I přesto, že existují historická normativní data celotělové denzitometrie pro nezralé novorozence [22], lze tato data použít jen obtížně pro srovnání s výsledky nezralých novorozenců získanými na jiných přístrojích s rozdílným softwarem. Navíc z důvodu špatné dostupnosti přístroje a omezené možnosti transportu nezralého novorozence na vyšetření je velmi nepravděpodobné zavedení rutinního vyšetření denzitometrie v klinické praxi, její nezastupitelné místo zůstává prozatím v oblasti neonatologického klinického výzkumu.
Biochemické markery kostního metabolismu
Kalcium
Vyšetřování sérového kalcia je nepřínosné k diagnostice MBD. Důvodem je precizní hormonální regulace zajištující stabilní kalcémii i za cenu významné demineralizace kosti [4, 5].
Fosfor
Pokles sérové hladiny fosforu pod 1,8 mmol/l, tj. pod hodnotu renálního prahu pro fosfor, je u nedonošených novorozenců možné naopak považovat za známku fosfátového deficitu a současně je významně asociován s vysokým rizikem rozvoje MBD. Vyšetření má dobrou specificitu (95 %), ale velmi nízkou senzitivitu (50 %) [4, 23].
Alkalická fosfatáza (ALP)
Mezi markery kostní formace řadíme sérový osteokalcin, PINP (procollagen type I N-terminal propeptide) a sérovou hladinu alkalické fosfatázy [2]. Pro osteokalcin a PINP jsou k dispozici referenční meze pro pediatrickou populaci [24]. V současné době však neexistují data podporující využitelnost těchto parametrů k diagnostice MBD při nezralosti. Tkáňově nespecifická alkalická fosfatáza existuje zejména ve třech isoformách – kostní, jaterní a ledvinná. U novorozenců představuje kostní isoforma 90 % celkové ALP [8, 20]. Kostní ALP je bohatě obsažena ve fosfolipidové stěně vezikuly, která vzniká z membrány osteoblastu. Zde působí jako transferáza pro fosfáty, kalcium vstupuje do vezikuly difuzí. Vzniká hydroxyapatitový krystal, který se po protržení stěny vezikuly spojí s kolagenem I a tím se vytváří v osteoidu nidus pro další krystalizaci. Ta pokračuje pouze v přítomnosti dostatečného množství Ca a P. Elevace ALP reflektuje zvýšený obrat a ruptury vezikul jako snahu osteoblastů podpořit kostní mineralizaci. K tomu dochází jak při kostní formaci (normální růst, ale i hojení MBD), tak i při nedostatku substrátu k tvorbě hydroxyapatitu (neadekvátní mineralizace) [8]. Při cholestáze také dochází k elevaci celkové ALP, ale vyšetření bilirubinu a jaterních enzymů nám vcelku přesně odliší cholestázu s poškozením hepatocytu od zvýšení kostní isoformy ALP. Na základě několika studií bylo prokázáno, že vyšetření kostní ALP nepřináší zlepšení senzitivity (73 %) či specificity (73–80 %) pro MBD při nezralosti ve srovnání s analýzou celkové ALP, které je finančně podstatně méně nákladné [23, 25]. Situace se dále komplikuje při deficitu zinku či malnutrici, kdy může být naopak hladina ALP nepřiměřeně nízká. S tímto problémem se můžeme setkat u novorozenců po resekci střeva a/nebo s enterostomií vyžadující dlouhodobou parenterální výživu.
ALP je dostupný a běžně užívaný parametr kostního metabolismu v neonatologii, nicméně je to test s velmi limitovanou užitečností. Hung zjistil, že hodnota ALP nad 12 µkat/l (700 IU/l) ve 3. týdnu života má velmi nízkou senzitivitu a specificitu (73 %) pro rozvoj MBD v dalším postnatálním průběhu [25]. Částečně lze ALP využít v panelu s dalšími markery, zejména fosforem. M. Ch. Backström prokázala, že spojení ALP a P poskytuje 100% senzitivitu, ale pouze 70% specificitu pro sníženou kostní denzitu [23]. Nebyla prokázána souvislost mezi ALP a hladinou vitaminu D u novorozenců velmi nízké porodní hmotnosti. Vysoké hladiny ALP nekorelují s hladinami kalcitrolu a vysoké dávky vitaminu D nemají efekt na hladinu ALP [8]. Další studie neprokázaly žádnou souvislost mezi ALP a RTG známkami demineralizace kosti či kostní denzitou na denzitometrii. Z toho vyplývá, že ALP nereflektuje minerální zásoby pacienta, nelze podle žádné její hodnoty řídit suplementaci Ca a P. ALP měřená v průběhu hospitalizace nebo při propuštění nemůže spolehlivě predikovat přítomnost nebo tíži MBD [7, 8, 26].
Odpady kalcia a fosforu do moči
Renální nálož Ca vychází z rozdílu mezi střevní absorpcí a kostní retencí. Měkko-tkáňová retence je považována za zanedbatelnou. Renální exkrece vápníku hraje minimální roli v homeostáze vápníku. Hlavními faktory ovlivňujícími odpady Ca do moči u nezralých novorozenců jsou nedostatek fosforu (není substrát pro tvorbu hydroxyapatitu → kalciurie), nedostatečný příjem/vstřebání vápníku a léky (furosemid, kortikosteroidy, kofein, aminophyllin → kalciurie i přes možný absolutní nedostatek). Absorpce fosfátů ve střevě je velmi efektivní a neregulovaná. Ledviny mají klíčovou úlohu v udržování sérové hladiny fosforu cestou jeho exkrece (regulováno pomocí parathormonu (PTH) a fibroblastového růstového faktoru 23 (FGF23) [27, 28]. Tubulární reabsorpce je aktivní a saturabilní proces. K fosfaturii dochází při překročení renálního prahu pro fosfor, tím by u VLBW novorozenců měla být sérová hladina P 1,8 mmol/l. Při poklesu pod tuto hodnotu v séru je všechen P z moči vstřebán. Maximální sérová hodnota P, nad kterou je 100% saturována reabsorpce, je 2,45 mmol/l (další zvýšení renální nálože zvyšuje pouze odpady do moči) [27]. U extrémně nezralých novorozenců (23.–25. gestační týden) je renální práh pro fosfor ještě snížen. I při fosfatémii kolem 1 mmol/l byla zjištěna pozitivní exkrece P v prvních 5 týdnech života, později renální práh stoupá k sérové hodnotě 1,8 mmol/l [29].
K posouzení adekvátního příjmu minerálů potřebných k tvorbě hydroxyapatitu lze využít stanovení prostých močových koncentrací Ca a P nebo jejich kreatininové indexy, které zohledňují zahuštění moči. Další možností je výpočet tubulární reabsorpce fosfátů (TRP) podle vzorce: 1 - (U-P (mmol/l) x S-krea (mmol/l) / (U-krea (mmol/l) x S-P (mmol/l)) x 100 [30]. Tubulární reabsorpce nad 95 % je považována za známku nedostatku P v organismu. TRP má však několik nevýhod. Za prvé je to relativně složitý výpočet s nutností znalosti sérové hodnoty kreatininu, která je u nedonošených novorozenců často nulová a znemožňuje vlastní výpočet TRP. Za druhé nám TRP neposkytuje žádnou informaci o stavu zásob kalcia. A za třetí může být ovlivněna sekundární hyperparathyreózou při depleci Ca (TRP bude jistě pod 95 % při fosfaturii vyvolané parathormonem). 24hodinové sběry moči jsou v neonatologii nepraktické. Jako nejlépe korelující s 24hodinovým se ukázal být 6hodinový noční sběr moči [31]. Limitací vyšetření odpadů Ca a P do moči stále zůstává absence jednoznačných referenčních mezí pro nezralé novorozence. Sledováním odpadů Ca a P do moči s cílem stanovení jejich mezních hodnot u nezralých novorozenců se v minulosti zabývaly pouze dvě studie. F. Pohland zjistil, že u novorozenců, kteří měli více než 1,2 mmol/l Ca a 0,4 mmol/l P alespoň v 50 % vzorků moče, byla zjištěna kostní minerální akrece srovnatelná s intrauterinní [32]. Studie vycházela z předpokladu lehce pozitivních odpadů Ca a P do moči, kdy lze očekávat dostatečné sérové hladiny minerálů k dobré kostní minerální akreci. Je nutné upozornit, že se jedná o studii z roku 1994, která nevzala v úvahu morbiditu a medikaci u sledovaných novorozenců. Je možné spekulovat, že doporučované odpady Ca a P do moči a lepší kostní akreci měly jen „zdravější děti“. Výsledkem Aladangadyho sledování Ca/krea a P/krea indexů v moči od čtvrtého postnatálního týdne u 186 nezralých novorozenců (24.–34. gestační týden) byl návrh referenčních mezí pro tyto parametry (10. a 90. percentil pro Ca/krea 0,5 a 3; 10. a 90. percentil pro P/krea 4 a 25) [33]. Cílem studie nebylo prokázat benefit udržování indexů v daném rozmezí, čili zda zlepšují kostní minerální akreci. Správnost referenčních mezí Ca/krea a P/krea indexů se opírala o nepřímé hodnocení dobré kondice kostí nezralých novorozenců na základě sérologických kostních markerů (Ca, P, ALP).
Souhrnně lze říci, že močové odpady Ca a P také nelze využít jako spolehlivý marker pro diagnostiku MBD. Zdá se však, že by jejich změny mohly předcházet odchylkám v sérových parametrech [34]. Pokud by se dalším výzkumem podařilo stanovit referenční meze cílené na zlepšení kostní minerální akrece a odpovídaly by dnešním výživovým zvyklostem, pak by jejich přínosnost významně stoupla.
Vitamin D
V průběhu vývoje lidského jedince se situace mění. Zatímco součinnost PTH a PTHrP (PTH related peptide) je prenatálně nezbytná pro normální vývoj a optimální mineralizaci fetálního skeletu, tak přítomnost vitaminu D (kalcidiolu, kalcitriolu) není pro správný vývoj fetálního skeletu vyžadována [35-37]. Postnatální úlohou aktivovaného vitaminu D (kalcitriolu) je zajištění absorpce Ca (v menší míře i P) ze střeva. Zdá se, že hydroxylace vitaminu D na kalcitriol je funkční od prvního dne života i u nezralých novorozenců [38]. Určitá data nicméně naznačují, že vstřebávání Ca ze střeva je u velmi nezralých novorozenců v prvním měsíci života zajištěno zejména pasivní difuzí. Současně se v průběhu čtyř týdnů, v souvislosti s maturací střevní sliznice, zvyšuje vstřebávání vitaminu D a také exprese receptorů pro kalcitriol a asociovaných Ca transportních proteinů (Calbindin D9K, D28K). Postupně se dominantním mechanismem pro absorpci kalcia ze střeva stává aktivní transport řízený kalcitriolem [35, 36, 39, 40]. Nejlepší marker k hodnocení stavu zásob vitaminu D je 25-hydroxyvitamin D (25OHD, kalcidiol) [41, 42].
V posledních letech se objevila řada studií poukazujících na insuficientní (pod 50 nmol/l) až deficientní (pod 25 nmol/l) hladiny 25OHD u těhotných žen a jejich donošených i nedonošených novorozenců [43–47]. Monangi zjistil, že až u 2/3 matek a jejich nezralých novorozenců byla zaznamenána insuficientní hladina 25OHD [44]. Současně bylo prokázáno, že tyto hladiny spolu silně korelují. Hladina 25OHD u donošeného novorozence obvykle dosahuje 70–100 % hladiny matky [35].
Navzdory deficienci vitaminu D u matky nebyl prokázán vliv na pupečníkové hodnoty kalcia, fosforu, morfologii skeletu či obsah minerálů v kosti (BMC) u donošeného novorozence [36]. Několik recentních studií ale ukázalo, že hypovitaminóza D u matky a následně i v pupečníkové krvi donošeného novorozence souvisí s možným rozvojem následujících onemocnění: diabetes mellitus I. typu v dětství [48], alergie [49], porucha neurokognitivního vývoje (porucha řeči) [50]. Navíc existují přesvědčivé důkazy, že nízká hladina vitaminu D vede k poruše funkce imunitního systému u novorozence. Jednak na úrovni střevní sliznice, kde je jeho přítomnost vyžadována k produkci antimikrobiálního peptidu cathelicidinu a β defensinu [51], tak i na úrovni sliznice dýchacích cest [52]. Camargo zjistil, že hladina vitaminu D je nepřímo úměrná riziku infekcí dýchacích cest a pískotů ve věku třech měsíců [53]. Další práce popisuje vyšší riziko časné sepse ve skupině donošených novorozenců s hladinou vitaminu D pod 50 nmol/l [54].
Jaký je ale důsledek nízkých sérových hladin vitaminu D pro nedonošeného novorozence? Hypovitaminóza D patří také do rizikových faktorů rozvoje metabolického kostního onemocnění při nezralosti (MBD), cestou sekundární hyperparathyreózy vede k resorpci Ca z kostí. Posouzením vlivu hladiny vitaminu D na incidenci neonatální morbidity a mortality nezralých novorozenců se zabývala recentní práce irských autorů [55]. Byla zjištěna statisticky významná souvislost mezi hladinou 25OHD pod 30 nmol/l a potřebou kyslíku a IPPV během stabilizace na porodním sále, dále delší potřebou asistované ventilace a rozvojem NEC během pobytu na JIP pro novorozence. Jistou limitací této práce je zvolená mezní hodnota 25OHD (30 nmol/l), která mohla vést ke zkreslení výsledků. Z našeho pohledu by bylo vhodnější použít hodnotu všeobecně považovanou pro pediatrickou populaci jako hranici mezi insuficiencí a suficiencí (50 nmol/l) [35, 42, 56, 57].
Souhrnně lze konstatovat, že nezralí novorozenci jsou díky časté insuficienci vitaminu D u matek náchylní k hypovitaminóze D se všemi u donošených novorozenců výše popsanými možnými negativními dopady, ačkoliv to nebylo doposud prokázáno. Přestože vitamin D hraje významnou roli v kalcium-fosfátovém metabolismu, stanovování jeho sérové hladiny v rámci diagnostiky MBD není součástí základního panelu vyšetřování [42, 58], protože prozatím neexistují žádná klinická data, která by to podporovala. Jednoznačná souvislost mezi MBD z nezralosti a hypovitaminózou D nebyla v literatuře popsána. Zvýšená suplementace vitaminu D snižuje výskyt jeho insuficience, nebyl ale prokázán vliv na BMC či BMD [47, 59]. Doporučení obvykle zmiňují opatrnost u novorozenců s rizikem malabsorpce (cholestáza, resekce střeva), kde je vhodné sérovou hladinu vitaminu D vyšetřit. Jako bezpečná je považována sérová hladina 25OHD nad 50 nmol/l pro všechny pediatrické pacienty [35, 42, 57]. Nelze však opomenout fakt, že prozatím nebyl u nezralých novorozenců prokázán jakýkoliv benefit udržování sérové hladiny 25OHD nad 50 nmol/l.
Parathormon
Příštítná tělíska jsou velmi citlivá na výkyvy ionizovaného kalcia. V případě nedostatku vápníku v organismu dochází ke zvýšenému vyplavování PTH. Parathormon stimuluje proliferaci a diferenciaci osteoklastů a tím vede k dalšímu vyplavování minerálů již z demineralizované kosti nezralých novorozenců. V posledních letech se objevily práce upozorňující na vztah sekundární hyperparathyreózy a metabolického kostního onemocnění při nezralosti, zejména u novorozenců nejnižších váhových kategorií s mnohočetnou morbiditou [60–62]. Vzestup parathormonu by měl být citlivým ukazatelem deficitu vápníku i u nedonošených novorozenců. Moreira [63] se na základě své prospektivní studie zahrnující 79 nezralých novorozenců s porodní hmotností pod 1250 g domnívá, že PTH by mohl být časný marker pro MBD s lepší specificitou, než má ALP. Podle současných poznatků není zřejmé, zda jsou referenční meze pro PTH u nedonošených novorozenců shodné či odlišné od těch, které se využívají u donošených novorozenců a dospělých [60–62]. Při neznalosti těchto referenčních rozmezí lze spekulovat, že zvýšené hladiny PTH jsou přiměřené adaptačním procesům nezralých novorozenců. Současně se žádná studie nezabývala souvislostí mezi rozvojem sekundární hyperparathyreózy u nezralých novorozenců a snížením kostního minerálního obsahu vyšetřeném kostní denzitometrií. K zodpovězení těchto otázek je zapotřebí dalších studií s cílem stanovení fyziologických mezí PTH pro nedonošené novorozence, odhalení skutečné incidence sekundární hyperparathyreózy v souvislosti s rozvojem MBD.
Léčba MBD
Základem úspěšné léčby MBD a tím snížení rizika možných následků tohoto onemocnění je důsledná prevence nedostatečné dodávky substrátů pro mineralizaci kosti. Podstatou prevence/léčby MBD je časná optimální nabídka vápníku, fosforu a vitaminu D cestou parenterální i enterální výživy.
Parenterální výživa
V průběhu intrauterinního vývoje (mezi 25.–38. gestačním týdnem) dochází k fetální akreci 2/3 minerálů, a to 120–160 mg/kg/den kalcia a 60–75 mg/kg/den fosforu [2]. V parenterální výživě jsou kalcium a fosfor přímo dostupné pro metabolismus, ale limitujícím faktorem je precipitace Ca a P v roztoku neboli špatná rozpustnost kalciových a fosfátových solí. Lepší rozpustnost těchto solí a tím vyšší retenci Ca a P do kosti zajištuje – molární poměr Ca : P 1–1,3 : 1 (hmotnostní poměr 1,3–1,7 : 1), užití organických solí (kalcium glukonát, kalcium chlorát nebo glycerol fosfát sodný). Nevýhodou velmi oblíbeného Ca glukonátu je vyšší kontaminace hliníkem. Obsah Ca do 60 mg/100 ml a P do 47 mg/100 ml roztoku parenterální výživy je spojen se stabilní kostní a minerálovou homeostázou (retence Ca a P přes 90 %), bez zvýšeného rizika hyperkalciurie. Většina v současnosti užívaných roztoků parenterální výživy nám dovolí dosáhnout přibližně 60–70 % fyziologických intrauterinních potřeb Ca a P (90 mg/kg/d, resp.ve 70 mg/kg/d, tj. do maximální dávky 2,25 mmol/kg/d) [2, 4, 64]. Studie na poli parenterální výživy jasně prokázaly, že deficience vitaminu D je při totální parenterální výživě u novorozenců vzácná a není důvodem rozvoje MBD. Dodávka 160–400 IU/kg/den v lipidových emulzích je dostatečná (např. Vitalipid obsahuje 40 IU/ml) [2]. Doporučené dávky minerálů a vitaminu D pro parenterální výživu nezralých novorozenců shrnuje tabulka 2.
2. Doporučené dávky minerálů a vitaminu D pro parenterální výživu nezralých novorozenců. 
(1 mmol = 40 mg Ca; 1 mmol = 31 mg P) Enterální výživa
Adekvátní enterální výživa s optimálním obsahem a poměrem kalcia a fosforu pro tvorbu hydroxyapatitu má klíčovou úlohu v prevenci MBD nezralých novorozenců. Z gastrointestinálního traktu se vstřebává přibližně 50–60 % kalcia a 80–90 % fosforu [2, 4, 42]. Bilanční metabolické studie u nezralých novorozenců, krmených fortifikovaným mateřským mlékem nebo formulí pro nedonošené novorozence, prokázaly, že maximální možná retence kalcia a fosforu je 60–90 mg/kg/den, resp. 50–75 mg/kg/d. I když tyto hodnoty jsou nižší než zjištěná intrauterinní akrece, zdá se, že jsou dostatečné k prevenci rozvoje MBD. Na základě informací o vstřebatelnosti a retenci kalcia a fosforu byla vytvořena stávající doporučení (tab. 3).
3. Doporučené dávky minerálů a vitaminu D pro enterální výživu nezralých novorozenců. 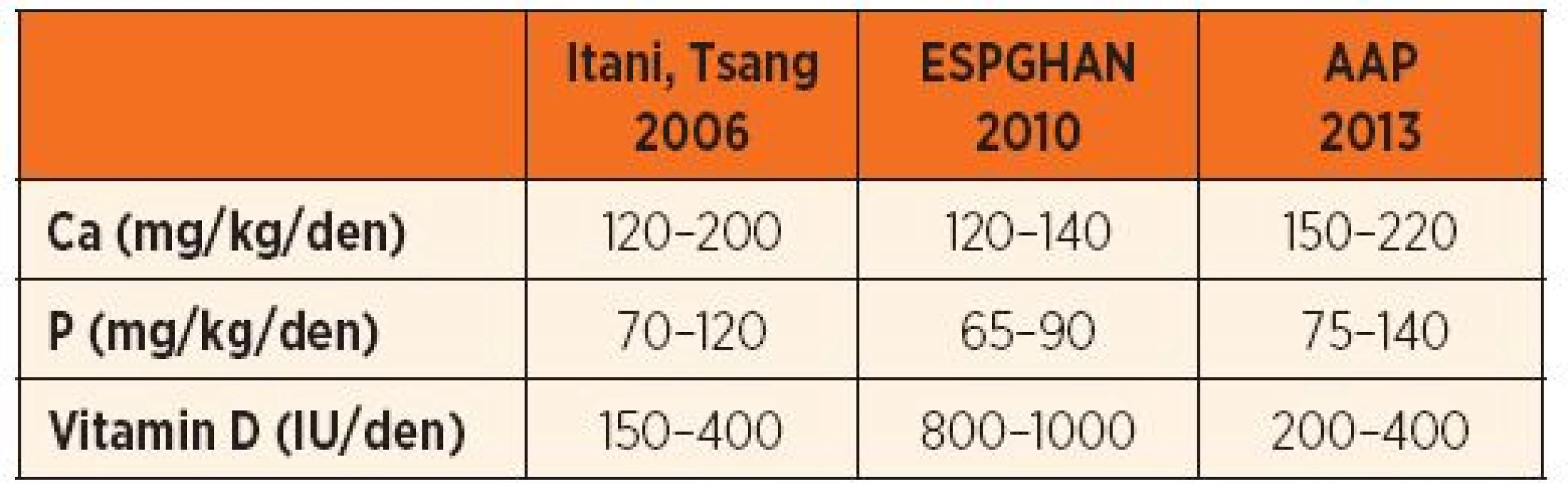
V zámoří přikládají větší význam pasivní difuzi Ca a P přes střevní stěnu [2, 42], kdežto v Evropě převládá názor nezastupitelnosti aktivního vitamin D dependentního transportu vápníku a částečně i fosforu ze střeva [40]. To se odráží v oficiálních doporučeních, Americká akademie pro pediatrii (AAP) doporučuje maximalizovat dodávku Ca a P (až 220 mg/kg/den Ca; 140 mg/kg/den P), kdežto Evropská asociace pro dětskou gastroenterologii a výživu (ESPGHAN) navrhuje nižší dávky minerálů (140 mg/kg/den Ca; 90 mg/kg/den P), ale dvojnásobně vyšší dávku vitaminu D (1000 IU/den versus 400 IU/den) [40, 42].
Závěr
I přes významný pokrok intenzivní novorozenecké péče v posledních 20 letech se incidence MBD při nezralosti podle dostupných dat nezměnila (30–55 %). Došlo ale k přesunu onemocnění na novorozence nejnižší váhové kategorie (pod 1000 g). Zdá se, že incidence patologických fraktur na podkladě MBD se snižuje, přesto existuje více než 10% riziko této časné komplikace. V patofyziologii MBD se kombinují tyto příčiny – ztráta fetální akrece Ca a P, časnější začátek přestavby kostí, nedostatečný přísun minerálů a porucha formace kostní matrix.
Na základě řady reviews včetně tohoto článku se ukazuje, že žádný z běžně využívaných parametrů kostního metabolismu není dostatečně validní pro diagnostiku MBD. Současně nelze žádný označit za zlatý standard pro časnou diagnostiku MBD u nezralých novorozenců. Nově se zdá, že parathormon by mohl být slibným markerem s vyšší specificitou pro MBD, než má ALP. Další studie jsou ale nutné, zejména k objasnění fyziologických norem PTH pro nezralé novorozence a vztahu sekundární hyperparathyreózy ke kostní denzitě. Nezralí novorozenci jsou vzhledem k časté hypovitaminóze D u matek náchylní k rozvoji deficitu vitaminu D. Dopad nízkých hladin vitaminu D na časnou a pozdní morbiditu nezralých novorozenců by měl být předmětem dalších studií. V prevenci onemocnění je velmi důležitá maximalizace dodávky Ca a P v parenterální výživě (až 2,25 mmol/kg/den) s následnou enterální výživou fortifikovaným mateřským mlékem nebo formulí pro nedonošené novorozence.
Došlo: 30. 6. 2015
Přijato: 31. 7. 2015
MUDr. Tomáš Matějek
Dětská klinika FN a LF UK
Sokolská 581
500 05 Hradec Králové
e-mail: xmatt01@seznam.cz
Sources
1. Rauch F, Schoenau E. Skeletal development in premature infants: a review of bone physiology beyond nutritional aspects. Arch Dis Child Fetal Neonatal Ed 2002; 86 (2): 82–85.
2. Hay W, Thureen P. Neonatal Nutrition and Metabolism. 2nd ed. Cambridge: Cambridge University Press, 2006 : 185–259.
3. Stoll BJ, Hansen NI, Bell EF, et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics 2010; 126 (3): 443–456.
4. Pieltan C, de Halleux V, Senterre Th, Rigo J. Prematurity and bone health. World Rev Nutr Diet 2013; 130 : 181–188.
5. Harrison CM. Osteopenia in preterm infants. Arch Dis Child Fetal Neonatal Ed 2013; 98 : 272–275.
6. Viswanathan S, Khasawneh W, McNelis K, et al. Metabolic bone disease: a continued challenge in extremely low birth weight infants. J Parenter Enteral Nutr 2014; 38 (8): 982–990.
7. Mitchell SM, Rogers SP, Hicks PD, et al. High frequencies of elevated alkaline phosphatase activity and rickets exist in extremely low birth weight infants despite current nutritional support. BMC Pediatr 2009; 9 : 47.
8. Tinnion RJ, Embleton ND. How to use... alkaline phosphatase in neonatology. Arch Dis Child Educ Pract Ed 2012; 97 (4): 157–163.
9. Bishop N, Sprigg A, Dalton A. Unexplained fractures in infancy: looking for fragile bones. Arch Dis Child 2007; 92 (3): 251–256.
10. Gerding H, Busse H. Myopia of prematurity (MOP) is definitely not a consequence of skull deformation. Eur J Pediatr 1995; 154 (3): 245–247.
11. Ichiba H, Shintaku H, Fujimaru M, et al. Bone mineral density of the lumbar spine in very-low-birth-weight infants: a longitudinal study. Eur J Pediatr 2000; 159 (3): 215–218.
12. Yeste D, Almar J, Clemente M, et al. Areal bone mineral density of the lumbar spine in 80 premature newborns: a prospective and longitudinal study. J Pediatr Endocrinol Metab 2004; 17 (7): 959–966.
13. Quintal VS, Diniz EM, de Caparbo VF, Pereira RM. Bone densitometry by dual-energy X-ray absorptiometry (DXA) in preterm newborns compared with full-term peers in the first six months of life. J Pediatr (Rio J) 2014; 90 (6): 556–562.
14. Bowden LS, Jones CJ, Ryan SW. Bone mineralisation in ex-preterm infants aged 8 years. Eur J Pediatr 1999; 158 (8): 658–661.
15. Smith CM, Coombs RC, Gibson AT, Eastell R. Adaptation of the Carter method to adjust lumbar spine bone mineral content for age and body size: application to children who were born preterm. J Clin Densitom 2006; 9 (1): 114–119.
16. Chan GM, Armstrong C, Moyer-Mileur L, Hoff C. Growth and bone mineralization in children born prematurely. J Perinatol 2008; 28 (9): 619–623.
17. Fewtrell MS, Williams JE, Singhal A, et al. Early diet and peak bone mass: 20 year follow-up of a randomized trial of early diet in infants born preterm. Bone 2009; 45 (1): 142–149.
18. Frost HM, Schönau E. The „muscle-bone unit“ in children and adolescents: a 2000 overview. J Pediatr Endocrinol Metab 2000; 13 (6): 571–590.
19. Rauch F, Schoenau E. The developing bone: slave or master of its cells and molecules? Pediatr Res 2001 Sep; 50 (3): 309–314.
20. Harrison CM, Johnson K, McKechnie E. Osteopenia of prematurity: a national survey and review of practice. Acta Paediatr 2008; 97 (4): 407–413.
21. Bayer M., Kutílek Š, a kol. Metabolická onemocnění skeletu u dětí. 1. vyd. Praha: Grada Publishing, 2002 : 185–193.
22. Rigo J, Nyamugabo K, Picaud JC, et al. Reference values of body composition obtained by dual energy X-ray absorptiometry in preterm and term neonates. J Pediatr Gastroenterol Nutr. 1998;27(2):184-90.
23. Backström MC, Kouri T, Kuusela AL, et al. Bone isoenzyme of serum alkaline phosphatase and serum inorganic phosphate in metabolic bone disease of prematurity. Acta Paediatr 2000; 89 (7): 867–873.
24. Bayer M. Reference values of osteocalcin and procollagen type I N-propeptide plasma levels in a healthy Central European population aged 0-18 years. Osteoporos Int 2014; 25 (2): 729–736.
25. Hung YL, Chen PC, Jeng SF, et al. Serial measurements of serum alkaline phosphatase for early prediction of osteopaenia in preterm infants. J Paediatr Child Health 2011; 47 (3): 134–139.
26. Faerk J, Peitersen B, Petersen S, Michaelsen KF. Bone mineralisation in premature infants cannot be predicted from serum alkaline phosphatase or serum phosphate. Arch Dis Child Fetal Neonatal Ed 2002; 87 (2): 133–136.
27. De Curtis M, Rigo J. Nutrition and kidney in preterm infant. J Matern Fetal Neonatal Med 2012; 25 : 55–59.
28. Quarles LD. Endocrine functions of bone in mineral metabolism regulation. J Clin Invest 2008; 118 (12): 3820–3828.
29. Hellstern G, Pöschl J, Linderkamp O. Renal phosphate handling of premature infants of 23-25 weeks gestational age. Pediatr Nephrol 2003; 18 (8): 756–758.
30. Janota J, Straňák Z. Neonatologie. 1. vyd. Praha: Mladá fronta, 2013 : 294–297.
31. Boehm G, Wiener M, Schmidt C, et al. Usefulness of short-term urine collection in the nutritional monitoring of low birthweight infants. Acta Paediatr 1998; 87 (3): 339–343.
32. Pohlandt F. Prevention of postnatal bone demineralization in very low-birth-weight infants by individually monitored supplementation with calcium and phosphorus. Pediatr Res 1994; 35 (1): 125–129.
33. Aladangady N, Coen PG, White MP, et al. Urinary excretion of calcium and phosphate in preterm infants. Pediatr Nephrol 2004; 19 (11): 1225–1231.
34. Catache M, Leone CR. Role of plasma and urinary calcium and phosphorus measurements in early detection of phosphorus deficiency in very low birthweight infants. Acta Paediatr 2003; 92 (1): 76–80.
35. Kovacs CS. Bone development in the fetus and neonate: role of the calciotropic hormones. Curr Osteoporos Rep 2011 Dec; 9 (4): 274–283.
36. Kovacs CS. Bone metabolism in the fetus and neonate. Pediatr Nephrol 2014; 29 (5): 793–803.
37. Rodriguez A, García-Esteban R, Basterretxea M, et al. Associations of maternal circulating 25-hydroxyvitamin D3 concentration with pregnancy and birth outcomes. BJOG 2014; doi: 10.1111/1471-0528.13074.
38. Salle BL, Delvin EE, Lapillonne A, et al. Perinatal metabolism of vitamin D. Am J Clin Nutr 2000; 71 (5): 1317–1324.
39. Hsu SC, Levine MA. Perinatal calcium metabolism: physiology and pathophysiology. Semin Neonatol 2004; 9 (1): 23–36.
40. Agostoni C, Buonocore G, Carnielli VP, et al. Enteral nutrient supply for preterm infants: commentary from the European Society of Paediatric Gastroenterology, Hepatology and Nutrition Committee on Nutrition. J Pediatr Gastroenterol Nutr 2010; 50 (1): 85–91.
41. Ferenczová J, Podracká Ľ. Vitamín D – nový pohľad na starý vitamín. Čes-slov Pediat 2009; 64 (7–8): 344–351.
42. Abrams SA. Committee on Nutrition. Calcium and vitamin d requirements of enterally fed preterm infants. Pediatrics 2013; 131 (5): e1676–1683.
43. Við Streym S, Kristine Moller U, Rejnmark L et al. Maternal and infant vitamin D status during the first 9 months of infant life-a cohort study. Eur J Clin Nutr 2013; 67 (10): 1022–1028.
44. Monangi N, Slaughter JL, Dawodu A, et al. Vitamin D status of early preterm infants and the effects of vitamin D intake during hospital stay. Arch Dis Child Fetal Neonatal Ed 2014; 99 (2): F166–168.
45. Dawodu A, Nath R. High prevalence of moderately severe vitamin D deficiency in preterm infants. Pediatr Int 2011; 53 (2): 207–210.
46. Javaid MK, Crozier SR, Harvey NC, et al. Maternal vitamin D status during pregnancy and childhood bone mass at age 9 years: a longitudinal study. Lancet 2006; 367 (9504): 36–43.
47. Natarajan CK, Sankar MJ, Agarwal R, et al. Trial of daily vitamin D supplementation in preterm infants. Pediatrics 2014; 133 (3): e628–634.
48. Zipitis CS, Akobeng AK. Vitamin D supplementation in early childhood and risk of type 1 diabetes: a systematic review and meta-analysis. Arch Dis Child 2008; 93 (6): 512–517.
49. Reinholz M, Ruzicka T, Schauber J. Vitamin D and its role in allergic disease. Clin Exp Allergy 2012; 42 (6): 817–826.
50. Whitehouse AJ, Holt BJ, Serralha M, et al. Maternal serum vitamin D levels during pregnancy and offspring neurocognitive development. Pediatrics 2012; 129 (3): 485–493.
51. Walker VP, Zhang X, Rastegar I, et al. Cord blood vitamin D status impacts innate immune responses. J Clin Endocrinol Metab 2011; 96 (6): 1835–1843.
52. Dinlen N, Zenciroglu A, Beken S, et al. Association of vitamin D deficiency with acute lower respiratory tract infections in newborns. J Matern Fetal Neonatal Med 2015; 19 : 1–5.
53. Camargo CA Jr, Ingham T, Wickens K, et al. Cord-blood 25-hydroxyvitamin D levels and risk of respiratory infection, wheezing, and asthma. Pediatrics 2011; 127 (1): 180–187.
54. Cetinkaya M, Cekmez F, Buyukkale G, et al. Lower vitamin D levels are associated with increased risk of early-onset neonatal sepsis in term infants. J Perinatol 2015; 35 (1): 39–45.
55. Onwuneme C, Martin F, McCarthy R, et al. The Association of vitamin D status with acute respiratory morbidity in preterm infants. J Pediatr 2015; 166 (5): 1175–1180.
56. Misra M, Pacaud D, Petryk A, et al. Vitamin D deficiency in children and its management: review of current knowledge and recommendations. Pediatrics 2008; 122 (2): 398–417.
57. Ross AC, Taylor CL, Yaktine AL, et al. Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D and Calcium. Dietary Reference Intakes for Calcium and Vitamin D. Washington (DC): National Academies Press (US), 2011.
58. Harrison CM, Johnson K, McKechnie E. Osteopenia of prematurity: a national survey and review of practice. Acta Paediatr 2008; 97 (4): 407–413.
59. Backström MC, Mäki R, Kuusela AL, et al. Randomised controlled trial of vitamin D supplementation on bone density and biochemical indices in preterm infants. Arch Dis Child Fetal Neonatal Ed 1999; 80 (3): 161–166.
60. Lothe A, Sinn J, Stone M. Metabolic bone disease of prematurity and secondary hyperparathyroidism. J Paediatr Child Health 2011; 47 (8): 550–553.
61. Moreira A, February M, Geary C.. Parathyroid hormone levels in neonates with suspected osteopenia. J Paediatr Child Health 2013; 49: E12–E16.
62. Yeşiltepe Mutlu G, Kırmızıbekmez H, Ozsu E, et al. Metabolic bone disease of prematurity: report of four cases. J Clin Res Pediatr Endocrinol 2014; 6 (2): 111–115.
63. Moreira A, Swischuk L, Malloy M, Mudd D. Parathyroid hormone as a marker of metabolic bone disease of prematurity. J Perinatol 2014; 34 (10): 787–791.
64. Pereira-da-Silva L, Costa A, Pereira L, et al. Early high calcium and phosphorus intake by parenteral nutrition prevents short-term bone strength decline in preterm infants. J Pediatr Gastroenterol Nutr 2011; 52 (2): 203–209.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2015 Issue 5-
All articles in this issue
- Special topics in lung ultrasound in children
- Association between genetic polymorphisms of methylenetetrahydrofolate reductase and congenital heart disease in Slovak population
- Intestinal permeability and SCORAD of children with atopic dermatitis after six weeks supplementation of Lactobacillus rhamnosus GG (the pilot study)
- Favourable prognosis of solitary kidney in children?
- Intrafamiliar phenotype variability of classic Marfan syndrome
- Rare case of patient with DiGeorge syndrome and limbs anomalies: the benefit of SNP microarray analysis?
- Metabolic bone disease of prematurity – review article
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metabolic bone disease of prematurity – review article
- Special topics in lung ultrasound in children
- Rare case of patient with DiGeorge syndrome and limbs anomalies: the benefit of SNP microarray analysis?
- Association between genetic polymorphisms of methylenetetrahydrofolate reductase and congenital heart disease in Slovak population
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

