-
Medical journals
- Career
Asociácia genetických polymorfizmov metyléntetrahydrofolát reduktázy s vrodenými chybami srdca v slovenskej populácii
: M. Záhorec 1; D. Ilenčíková 2; S. Požgayová 2; P. Olejník 3; P. Škrak 1; Ľ. Kováčiková 1; L. Kovács 2; J. Mašura 3
: Oddelenie anestéziológie a intenzívnej medicíny, Detské kardiocentrum, Národný ústav srdcových a cievnych chorôb, Bratislava primárka doc. MUDr. Ľ. Kováčiková, PhD. 1; Laboratórium klinickej a molekulovej genetiky, II. detská klinika Lekárskej fakulty Univerzity Komenského a Detskej fakultnej nemocnice s poliklinikou, Bratislava prednosta prof. MUDr. L. Kovács, DrSc., MPH 2; Klinika detskej kardiológie Lekárskej fakulty Univerzity Komenského, Detské kardiocentrum, Národný ústav srdcových cievnych chorôb, Bratislava prednosta prof. MUDr. J. Mašura, CSc. 3
: Čes-slov Pediat 2015; 70 (5): 267-272.
: Original Papers
Ciele:
Perikoncepčné užívanie vitamínových prípravkov s kyselinou listovou je asociované s poklesom prevalencie vrodených chýb srdca (VCHS) u živonarodených detí. Polymorfizmy 677 C→T a 1298 A→C génu pre enzým metyléntetrahydrofolát reduktáza (MTHFR) ovplyvňujú využitie kyseliny listovej v organizme a sú v niektorých prácach asociované so zvýšeným výskytom VCHS. Cieľom štúdie bolo zistiť asociáciu polymorfizmov 677 C→T a 1298 A→C s výskytom VCHS v slovenskej populácii a vyhodnotiť perikoncepčné užívanie vitamínov u slovenských matiek detí s VCHS.Metodika:
V rokoch 2011–2014 bolo prospektívne vyšetrených na polymorfizmy 677 C→T a 1298 A→C génu pre enzým MTHFR 204 pacientov s VCHS, 144 matiek detí s VCHS a 144 kontrolných vzoriek od detí bez vrodených chýb.Výsledky:
V skupine detí s VCHS bol výskyt genotypu 677TT s trendom k nižšiemu výskytu ako v kontrolnej skupine (OR = 0,42, 95% CI 0,18–1,01; p = 0,06). V skupine matiek pacientov boli genotypy 1298CT a 1298CC menej početné ako v kontrolnej skupine (OR = 0,51, 95% CI 0,31–0,84; p = 0,009 resp. OR = 0,78, 95% CI 0,13–1,04; p = 0,06).
Multivitamíny s obsahom folátu užívalo perikoncepčne 18,1 % matiek detí s VCHS, v čase už potvrdenej gravidity bolo užívanie vyššie (67,4 %; p <0,0001). Ženy, ktoré fajčili v čase otehotnenia, užívali vitamíny v perikoncepčnom období menej často ako ženy bez abúzu nikotínu (6,5 % vs. 21,8 %; p = 0,035).Záver:
V slovenskej populácii detí s VCHS a ich matiek nebol dokázaný zvýšený výskyt polymorfizmov MTHFR s rizikom zníženej hladiny kyseliny listovej. Naopak, časť potenciálne rizikových genotypov bola menej početná. Perikoncepčne užívala multivitamíny s obsahom kyseliny listovej menej ako pätina matiek detí s VCHS.Kľúčové slová:
kyselina listová, vývojové chyby srdca, metyléntetrahydrofolát reduktáza, genetický polymorfizmus, prevenciaÚVOD
Prevalencia klinicky významných vrodených chýb srdca (VCHS) dosahuje 0,5–0,9 % u živonarodených detí, pričom ide o najčastejšiu vrodenú vývojovú anomáliu. Anatómia VCHS je vysoko heterogénna a etiológia vzniku VCHS je multifaktoriálna a z veľkej časti ešte neobjasnená. Na vzniku VCHS sa s určitosťou podieľajú genetické faktory (asi u 15 % pacientov s VCHS sú identifikované extrakardiálne postihnutia zaradené do syndrómu s dokázanou genetickou anomáliou) a environmentálne faktory (choroby matky, teratogény, infekčné ochorenia matky a iné). Vo väčšine jednotlivých prípadov nie je možné dokázať kauzalitu vzniku VCHS a predpokladá sa komplexná interakcia vulnerabilného genotypu s environmentálnou záťažou [1].
Kyselina listová (vitamín B9) má špecifický význam v procese zdravého rastu a vývoja embrya. Spolu s ostatnými kofaktormi zabezpečuje efektívny transport a využitie jednouhlíkových zvyškov potrebných pri syntéze nukleotidov, premenu homocysteínu na metionín, alebo metyláciu transferovej ribonukleovej kyseliny [2]. Denná potreba kyseliny listovej je cca 100 µg, ale u tehotnej ženy sa zvyšuje až na 400–800 µg. Štúdie ukázali, že túto zvýšenú potrebu nie je možné pokryť „len“ vyváženou stravou, ale na udržanie normálnych hladín folátu v tehotenstve je potrebná suplementácia výživovými doplnkami [3, 4]. Záujem o vplyv metabolizmu kyseliny listovej na vznik vrodených vývojových chýb vznikol na základe epidemiologickej práce o pozitívnom vplyve perikoncepčnej suplementácie na znížený výskyt rázštepov neurálnej trubice [5]. Následne maďarskí autori analyzovali vplyv tejto intervencie na iné vrodené anomálie a poukázali na 43% redukciu rizika vzniku VCHS, najmä defektov komorového septa a konotrunkálnych anomálií [4].
Efektivita a rovnováha folátového metabolizmu je závislá nielen od dostatočného príjmu a vstrebávania kyseliny listovej a nutričného stavu iných mikronutrientov (najmä vitamíny B6 a B12), ale aj od genotypu jedinca. Metyléntetrahydrofolát reduktáza (MTHFR) je jedným z hlavných regulačných enzýmov metabolizmu kyseliny listovej a homocysteínu, ktorý katalyzuje premenu 10-metyléntetrahydrofolátu na 5-metyltetrahydrofolát. Aktívna forma vitamínu, 5-metyltetrahydrofolát je darcom metylovej skupiny pre remetyláciu homocysteínu na metionín. Nukleotidové polymorfizmy génu MTHFR 677 C→T a 1298 A→C sú spojené so zníženou aktivitou enzýmu. Homozygotný stav 677TT (tzv. „termolabilná forma“, 50% redukcia aktivity enzýmu pri teplote 37 °C), ktorý je pozorovaný asi u 11 % bielej populácie, je asociovaný s nižšími hladinami kyseliny listovej (genotyp 677TT je spojený s o 25 % nižšími hladinami aktívneho folátu ako genotyp 677CC) a vyššími hladinami homocysteínu v plazme. Efekt genotypu nie je aditívny, takže rozdiel v hladinách folátu medzi genotypmi 677CC a 677CT je minimálny [6]. Druhým najčastejším polymorfizmom génu MTHFR, ktorý spôsobuje zníženú aktivitu enzýmu, ale nie je termolabilný, je 1298 A→C [7]. Najväčšie nedávne zahraničné práce študujúce asociáciu polymorfizmov 677 C→T a 1298 A→C s výskytom VCHS dospeli k rozdielnym záverom s potvrdením [8, 9], resp. nedokázaním [10] vplyvu genotypu MTHFR na vznik VCHS.
Cieľom prospektívnej porovnávacej štúdie bolo zistiť asociáciu polymorfizmov 677 C→T a 1298 A→C s výskytom VCHS v slovenskej populácii a vyhodnotiť perikoncepčné užívanie vitamínov s obsahom kyseliny listovej u slovenských matiek detí s VCHS.
METODIKA
Vzorky krvi pre potreby štúdie boli získané v Detskom kardiocentre v Bratislave v rokoch 2011–2014 od hospitalizovaných pacientov s VCHS (n = 204) a ich matiek (n = 144). Po schválení štúdie nemocničnou etickou komisiou v roku 2010 bol získaný informovaný súhlas rodičov so zaradením do štúdie a odberom krvi dieťaťa a súhlas matky s jej odberom krvi. Súčasťou štúdie bolo vyplnenie dotazníka matkou so zameraním na demografické údaje, užívanie multivitamínových prípravkov a niektoré rizikové faktory pre vznik VCHS u plodu. Inklúznymi kritériami boli klinicky významná VCHS s potrebou intervenčnej liečby u dieťaťa a vek dieťaťa do 4 rokov v čase vyplnenia dotazníka z dôvodu získania spoľahlivých odpovedí na otázky o perikoncepčnom a tehotenskom období matky. Deti s trizómiou 21 (n = 29) boli zaradené do štúdie z dôvodu literárnych údajov o možnom súvise polymorfizmov MTHFR génu matiek s výskytom Downovho syndrómu a fenotypovou penetranciou VCHS u týchto detí [11]. Táto skupina pacientov bola vyhodnotená samostatne. Exklúznym kritériom bol dôkaz iného genetického syndrómu zvyšujúceho riziko VCHS u dieťaťa (iné trizómie, Turnerov syndróm, mikrodelécia 22q11 a iné). Kontrolnú skupinu predstavovali deti bez VCHS (n = 144) a bez iných vrodených alebo chronických ochorení, u ktorých sa v rokoch 2011–2012 stanovoval polymorfizmus sledovaných génov v rámci iných štúdií v Detskej fakultnej nemocnici s poliklinikou v Bratislave.
U všetkých členov súboru bola odobratá vzorka krvi (1–2 ml) do skúmavky EDTA. V molekulovo-genetickom laboratóriu II. Detskej kliniky Lekárskej fakulty Univerzity Komenského v Bratislave bola vykonaná izolácia DNA pomocou komerčne dostupného setu (Gentra®, Puregene® Blood Kit; Qiagen, Nemecko). Analýza polymorfizmov 677 C→T a 1298 A→C génu MTHFR bola realizovaná polymerázovou reťazovou reakciou (polymerase chain reaction, PCR) a následným štiepením reštrikčnou endonukleázou s vizualizáciou na gélovej elektroforéze. Pri polymorfizme 677 C→T sa reštrikčným štiepením PCR produktu získali dva fragmenty s veľkosťou 175 párov báz (bp) a 23 bp (mutovaný homozygotný genotyp 677TT), jeden neštiepený fragment s veľkosťou 198 bp (tzv. „divý“ genotyp – „wild type“ 677CC) alebo všetky tri fragmenty 198 bp, 175 bp a 223 bp (heterozygotný genotyp 677CT). Pri polymorfizme 1298 A→C sa štiepením PCR produktu získali dva fragmenty s veľkosťou 204 bp a 37 bp („divý“ genotyp 1298AA), jeden fragment 241 bp (mutovaný homozygot 1298CC) alebo tri fragmenty 241 bp, 204 bp a 37 bp u heterozygota s genotypom 1298AC.
Zozbierané dáta boli počítačovo spracované a následne štatisticky vyhodnotené pomocou programu JMP 4.0.2® (SAS Institute). Kontinuálne dáta sú prezentované ako priemer a smerodajná odchýlka (SD). Nominálne dáta sú prezentované ako percentuálny podiel. Asociácia polymorfizmov s výskytom VCHS bola stanovená výpočtom pomeru rizík (Odds ratio, OR) a 95% intervalu spoľahlivosti.
VÝSLEDKY
Na základe vyhodnotenia 132 dotazníkov matiek detí s VCHS bolo zistené perikoncepčné a tehotenské užívanie multivitamínových doplnkov, resp. kyseliny listovej. V perikoncepčnom období užívalo pravidelne multivitamíny 13,6 % (n = 18) a samostatne kyselinu listovú 4,5 % žien (n = 6). Celkovo v tomto období užívalo pravidelne prípravok s obsahom folátu 18,1 % tehotných. Z matiek detí s trizómiou 21 užívali perikoncepčne vitamíny 4 z 18 (22,2 %), čo je bez rozdielu oproti ostatným matkám (17,5 %; p = 0,64).
Po potvrdení tehotnosti pravidelne užívalo mutivitamíny 60,6 % tehotných a samostatne kyselinu listovú ďalších 6,8 % žien detí s VCHS. Celkové užívanie prípravkov s obsahom kyseliny listovej ženami v čase už preukázanej gravidity bolo 67,4 %, pričom perikoncepčne len 18,1 % (p <0,0001).
Vrodené vývojové chyby srdca u prvostupňových príbuzných uviedlo 8 zo 132 matiek (6,0 %), cukrovkou trpelo 2,3 % matiek. Pri analýze podľa ukončeného najvyššieho vzdelania matiek bolo užívanie vitamínov perikoncepčne nasledovné: 26 % vysokoškolsky vzdelaných, 15 % stredoškolsky vzdelaných a 14 % žien so základným vzdelaním (p = 0,30). Fajčenie v čase otehotnenia uviedlo 23,5 % matiek. Matky so základným vzdelaním fajčili v tomto období častejšie ako vysokoškolsky vzdelané matky (42,9 % vs. 11,9 %; p = 0,04). Ženy, ktoré fajčili v čase otehotnenia, užívali menej často vitamíny v perikoncepčnom období ako ženy bez abúzu nikotínu (6,5 % vs. 21,8 %; p = 0,035). Priemerný index telesnej hmotnosti (Body Mass Index, BMI) bol u matiek v čase otehotnenia 23,4 +/ - 4,15. Nadváhu (BMI 25–30) v čase otehotnenia uviedlo v dotazníku 25 % žien a obezitu (BMI >30) 5,4 % žien.
Polymorfizmy 677 C→T a 1298 A→C génu pre enzým MTHFR boli vyšetrené u 204 pacientov (z toho 29 malo Downov syndróm) a 144 matiek (19 matiek dieťaťa s Downovým syndrómom). Percentuálne zastúpenia jednotlivých genotypov v podskupinách pacientov s VCHS, matiek detí s VCHS, detí s trizómiou 21 a VCHS, matiek detí s trizómiou 21 a VCHS a v kontrolnej skupine (n = 144) sú uvedené v tabuľke 1.
1. Zastúpenie jednotlivých genotypov polymorfizmov 677 C‒˃T a 1298 A‒˃C génu MTHFR. 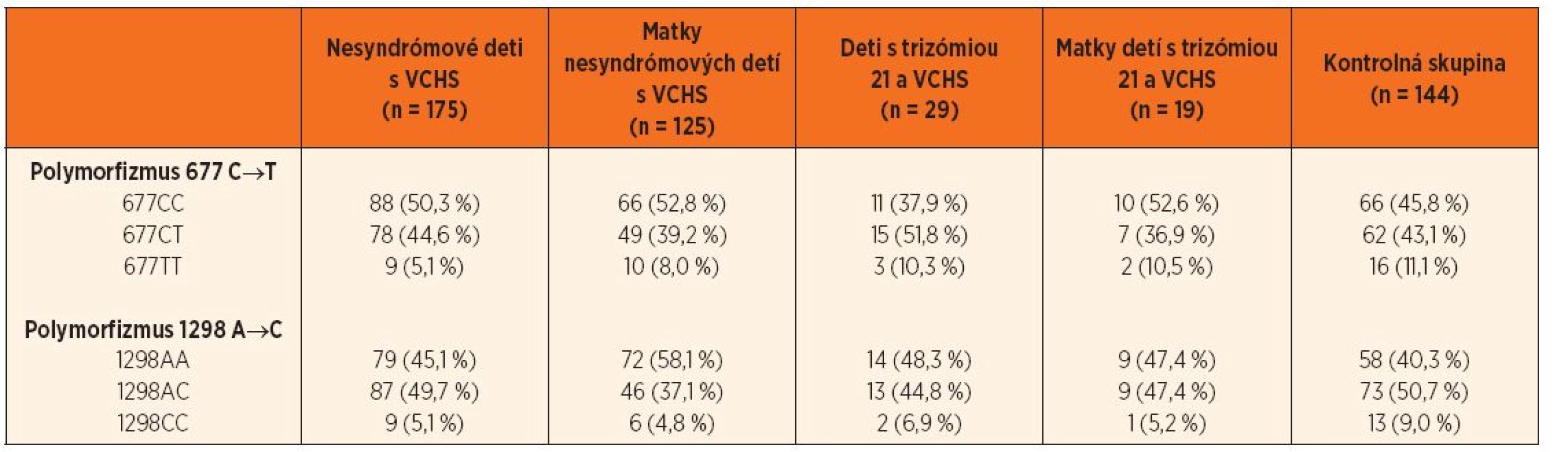
MTHFR – metyléntetrahydrofolát reduktáza, VCHS – vrodené chyby srdca V skupine nesyndrómových detí s VCHS bol výskyt genotypu 677TT hranične menej zastúpený (OR = 0,42, 95% CI 0,18–1,01; p = 0,06) ako v kontrolnej skupine. V skupine matiek nesyndrómových pacientov boli genotypy 1298CT a 1298CC menej početné ako v kontrolnej skupine (OR = 0,51, 95% CI 0,31–0,84; p = 0,009, resp. OR = 0,78, 95% CI 0,13–1,04; p = 0,06) (tab. 2 a 3).
2. Pomer rizík (OR; 95% CI) výskytu genetického polymorfizmu 677 C‒˃T u nesyndrómových detí s VCHS a ich matiek, detí s trizómiou 21 a VCHS a ich matiek oproti kontrolnej skupine. 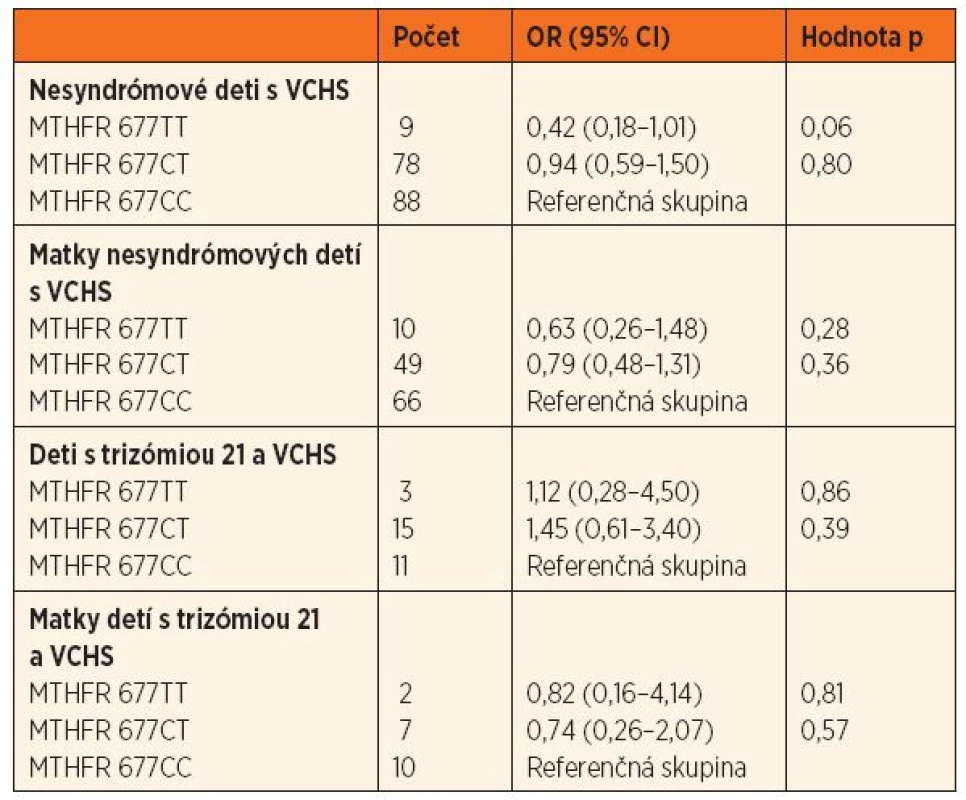
VCHS – vrodené chyby srdca; OR – odds ratio, pomer rizík; CI – confidence interval, interval spoľahlivosti; MTHFR – metyléntetrahydrofolát reduktáza 3. Pomer rizík (OR; 95% CI) výskytu genetického polymorfizmu 1298 A‒˃C u nesyndrómových detí s VCHS a ich matiek, detí s trizómiou 21 a VCHS a ich matiek oproti kontrolnej skupine. 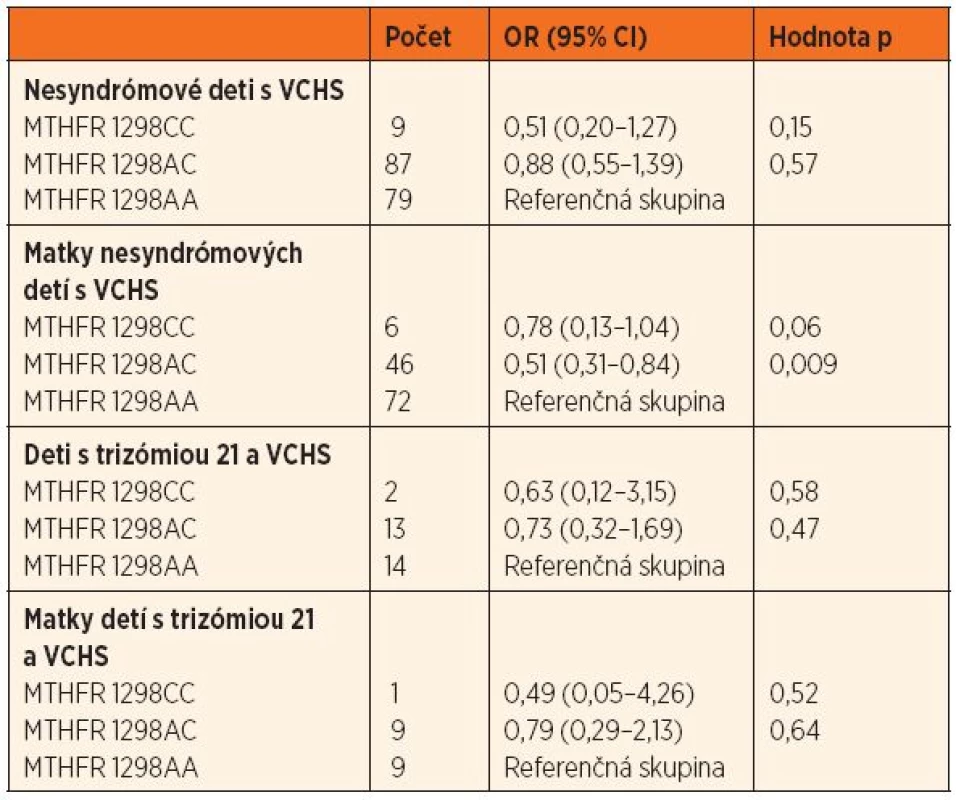
VCHS – vrodené chyby srdca; OR – odds ratio, pomer rizík; CI – confidence interval, interval spoľahlivosti; MTHFR – metyléntetrahydrofolát reduktáza DISKUSIA
Vrodené chyby srdca predstavujú významný zdroj novorodeneckej morbidity a mortality. Postupné objasňovanie komplexnej etiológie VCHS s následnou efektívnejšou primárnou prevenciou je dlhodobým cieľom výskumu v tejto oblasti. Perikoncepčné obdobie je obvykle definované rôzne v rozmedzí 4–14 týždňov pred otehotnením a 8–10 týždňov po ňom [4, 12], pričom je mimoriadne dôležité z hľadiska správnej organogenézy plodu. Štrukturálny a funkčný základ srdca sa vytvára už v najvčasnejšej fáze vývoja plodu a akcia srdca bola zachytená už od konca 1. mesiaca tehotenstva [13].
Nízky príjem kyseliny listovej perikoncepčne pôsobí negatívne na vývoj srdca u laboratórnych zvierat a je asociovaný so zvýšeným výskytom VCHS [14]. Vo väčšine veľkých populačných štúdií autori konštatovali ochranný efekt perikoncepčnej substitúcie multivitamínového prípravku s obsahom kyseliny listovej na vznik VCHS (redukcia rizika o 20–43 %), pričom najvyššia redukcia rizika bola zaznamenaná v skupinách defektov komorového septa a tzv. konotrunkálnych chýb (hlavne Fallotova tetralógia) [4, 15–17]. Naopak, užívanie liekov s antagonistickým účinkom na metabolizmus kyseliny listovej (napr. sulfonamidy) vo včasnom tehotenstve zvyšuje riziko VCHS u plodu [18]. Negatívny vplyv insuficiencie metabolizmu kyseliny listovej pri morfogenéze srdca môže súvisieť so zvýšenou hladinou homocysteínu [19], resp. s poruchou syntézy nukleových kyselín [20]. Globálne je miera perikoncepčného príjmu vitamínových suplementov suboptimálna (1–50 %), a to aj po aktívnych kampaniach v mnohých krajinách [21]. Literárne údaje z industrializovaných krajín pritom udávajú, že okolo 50 % tehotenstiev je plánovaných [4, 21].
V aktuálnej štúdii 18 % slovenských matiek detí s VCHS užívalo vitamíny v čase otehotnenia, čo poukazuje na podobne nízku mieru suplementácie na Slovensku ako v minulosti [22, 23]. V jednej zo štúdií na slovenskej populácii bola miera perikoncepčnej suplementácie kyselinou listovou u matiek zdravých detí 17,8 %. Išlo o tehotenstvá 107 matiek v rokoch 2001–2010 [23]. Dodatočné štatistické porovnanie aktuálneho súboru matiek detí s VCHS (132 tehotenstiev v rokoch 2007–2014) s uvedenou vzorkou matiek detí bez vrodenej chyby neidentifikuje rozdiel v užívaní folátu (p = 0,93), aj keď časové obdobie zberu dát nie je identické.
Koncom 90-tych rokov minulého storočia zaviedli niektoré krajiny na základe uvedených poznatkov fortifikáciu múky vitamínmi skupiny B (kyselina listová, B6, B12). Kanadská epidemiologická štúdia porovnávala prevalenciu komplexných VCHS pred zavedením plošnej fortifikácie (rok 1998) a po nej v provincii Quebec. Výskyt komplexných VCHS (konotrunkálne chyby, defekty atrioventrikulárneho septa, chyby s jednokomorovou fyziológiou) klesol po začatí fortifikácie o 36 % [24]. Podobné plošné obohatenie múky o vitamíny B6, B12 a kyselinu listovú zaviedli postupne aj v USA, Austrálii a iných krajinách. V Európe sa spustil program fortifikácie len v Maďarsku a nedávno aj vo Veľkej Británii [25]. Americká štúdia dokumentovala po intervencii zvýšenie hladiny folátu v krvi obyvateľstva o vyše 100 % [26], avšak výsledky intervencie na prevalenciu VCHS v USA nie sú zatiaľ zverejnené.
Pri absencii fortifikácie na Slovensku a nízkom percente užívania vitamínov tehotnými je pravdepodobné, že priemerné hladiny kyseliny listovej u slovenských matiek sú znížené. Po lekárskom potvrdení otehotnenia (zväčša 2.–3. mesiac gravidity) začína užívať vitamíny s kyselinou listovou viac ako dve tretiny slovenských matiek. V tomto období je však už veľká časť organogenézy rozbehnutá, a preto je prospešnosť užívania suplementov v prevencii vrodených vývojových chýb pravdepodobne obmedzená [4].
Ženy s nižším ukončeným vzdelaním užívajú multivitamíny perikoncepčne menej často ako vzdelanejšie ženy [27]. V slovenskej štúdii nebol rozdiel užívania vitamínov podľa stupňa vzdelania významný zrejme aj v dôsledku nižšieho počtu zúčastnených matiek. Ženy s ukončeným základným vzdelaním fajčili v čase otehotnenia častejšie ako ženy s vysokoškolským vzdelaním. Literárne údaje jednoznačne nepotvrdzujú asociáciu abúzu nikotínu matiek s VCHS u plodu [1], ale naša analýza ukázala, že ženy, ktoré fajčili perikoncepčne, užívali menej často multivitamíny. Môže ísť o dôsledok nižšieho socioekonomického stavu, vyššieho podielu neplánovaných gravidít a z toho vyplývajúcej horšej perikoncepčnej životosprávy v tejto podskupine matiek. Obezita matky je asociovaná s miernym zvýšením výskytu VCHS u plodov [1]. V slovenskej štúdii trpela v čase otehotnenia nadváhou (BMI 25–30) štvrtina matiek detí s VCHS a 5,4 % žien bolo obéznych (BMI >30). Podľa Eurostatu bolo na Slovensku v roku 2009 obéznych 1,3 % žien vo veku 18–24 rokov a 7,8 % žien vo veku 25–44 rokov [28].
Deficit aktívnych metabolitov kyseliny listovej môže byť spôsobený jej nízkym príjmom, ale aj genetickou dispozíciou pre nižšiu efektivitu jednotlivých vetiev jej metabolizmu. Homozygotný stav 677TT u matky alebo plodu je popisovaný ako nezávislý rizikový faktor pre vznik rázštepov nervovej trubice u plodu [29]. Košickí autori nepotvrdili túto asociáciu v slovenskej populácii [30]. Na možný vplyv genetického polymorfizmu 677 C→T enzýmu MTHFR pri vzniku VCHS upozornila ako prvá menšia nemecká štúdia [31]. Genotyp 677TT u detí bol asociovaný s dvojnásobným výskytom VCHS (OR = 2,2; 95% CI 1,2–4,3; p = 0,027). Nasledujúce práce priniesli nejednoznačné výsledky. Holandskí autori dokázali asociáciu genotypu 677TT u matiek detí s VCHS, pokiaľ ženy neužívali perikoncepčne kyselinu listovú [32]. Hraničná významnosť materského polymorfizmu 677TT bola potvrdená aj v práci analyzujúcej vyše 700 triád pacientov s konotrunkálnymi anomáliami a ich rodičov (relatívne riziko, RR = 1,4, 95% CI 0,95–2,04) [9] a v metaanalýze viacerých menších štúdií [33]. Iná metaanalýza dokumentovala zvýšené riziko dieťaťa pre vznik VCHS pri genotype 677TT (OR = 1,610, 95% CI 1,37–1,89), ale len u žltej a nie u bielej rasy [8]. Súborná analýza publikovaných prác do roku 2012 obsahujúca 5814 pacientov s VCHS (z toho 77 % bieleho etnika), 1781 matiek a 10 056 kontrol však nepreukázala asociáciu genotypu 677TT so zvýšeným výskytom VCHS u detí (OR = 0,96; 95% CI 0,87–1,07), ani u ich matiek (OR = 1,13; 95% CI 0,87–1,47) [10].
Asociácii polymorfizmu 1298 A→C s VCHS sa v literatúre venuje výrazne menej pozornosti a výsledky sú taktiež rozporuplné. Dve najväčšie analýzy detí s VCHS a ich rodičov zaznamenali zvýšený prenos A alely na choré dieťa. Deti s najčastejším genotypom 1298AA (spojeným s najvyššou aktivitu enzýmu MTHFR) boli podľa týchto prác štatisticky vo vyššom riziku vzniku VCHS oproti deťom s AC, resp. CC genotypom [9, 20]. Naopak, tureckí autori v nedávnej štúdii zaznamenali asociáciu medzi genotypom 1298CC u detí a výskytom konotrunkálnych chýb (OR = 3,01; 95% CI 1,16–7,83) [34].
V slovenskej populácii bol zaznamenaný trend k nižšiemu výskytu genotypu 677TT u detí s VCHS oproti kontrolnej skupine. Pri polymorfizme 1298 A→C boli materské genotypy 1298AC a CC asociované s nižším výskytom VCHS u detí. V oboch prípadoch ide o formy génov, ktoré sú spojené so zníženou aktivitou enzýmu MTHFR a teda menej efektívnou remetyláciou homocysteínu na metionín. Zvýšené hladiny homocysteínu u matiek sú dokumentované ako jeden z asociovaných faktorov pre vznik VCHS u plodu [19]. Na druhej strane, prednostné nasmerovanie metabolizmu na detoxikáciu homocysteínu môže znižovať využívanie folátu (hlavne pri jeho nedostatočnom príjme) v biochemickej kaskáde syntézy nukleových kyselín. V čase včasnej organogenézy je bezchybná syntéza nukleových kyselín veľmi dôležitá. Ochranný efekt alel 677T a 1298C môže byť potenciovaný dostatočným perikoncepčným príjmom kyseliny listovej, čo ochráni matku pred zvýšenými hladinami homocysteínu, pričom genotyp plodu podporuje bezchybnú syntézu purínov a pyrimidínov [20].
Osobitne bola vyhodnotená skupina detí s trizómiou 21, ktorá je najčastejšou príčinou mentálnej retardácie v detskom veku s prevalenciou 1 : 700–800 živonarodených detí. U detí s trizómiou 21 je výskyt VCHS 40–50 %. V brazílskej štúdii bolo zaznamenané dvojnásobné riziko pre vznik VCHS u dieťaťa s Downovým syndrómom v prípade matkinho genotypu 677TT alebo CT, ak matka neužívala perikoncepčne kyselinu listovú [11]. Výsledky slovenskej štúdie na limitovanej vzorke nepotvrdili žiadnu odchýlku výskytu polymorfizmov 677 C→T alebo 1298 A→C u detí s DS alebo ich matiek v porovnaní s kontrolnou skupinou nesyndrómových detí.
Zo súčasných literárnych údajov vyplýva skôr dôležitosť dostatku substrátov pre efektivitu všetkých metabolických ciest ovplyvnených kyselinou listovou ako význam sledovaných foriem genetického polymorfizmu. Zastúpenie polymorfizmov MTHFR v slovenskej populácii rodín s výskytom VCHS je v súlade s protikladnými výsledkami medzinárodných prác, kde môžu zohrávať úlohu skôr geografické a nutričné špecifiká ako skutočný efekt konkrétneho genotypu.
Prospektívna kontrolovaná štúdia mala niekoľko limitácií. Dotazníkové údaje o perikoncepčnom užívaní vitamínov boli získané len od matiek detí s VCHS, čo bránilo optimálnej analýze vplyvu tejto intervencie na vznik VCHS u živonarodených detí. Počet párov matka-dieťa bol nedostatočný aj pre relevantnú subanalýzu v jednotlivých podskupinách VCHS s predpokladaným spoločným vývojovým mechanizmom (konotrunkálne chyby, defekty komorového septa, chyby ľavého srdca a iné).
ZÁVER
Kyselina listová má špecifický význam pri včasnej organogenéze vrátane vývoja srdca. Na Slovensku perikoncepčne užíva výživové prípravky s obsahom kyseliny listovej menej ako pätina matiek detí s VCHS. V slovenskej populácii detí s VCHS a ich matiek nebol dokázaný zvýšený výskyt polymorfizmov MTHFR s rizikom zníženej hladiny aktívneho folátu. Naopak, časť potenciálne rizikových genotypov bola menej početná. Protichodné výsledky publikovaných štúdií vrátane analýzy slovenského súboru naznačujú skôr význam dostatočného príjmu a perikoncepčnej rovnováhy jednotlivých vetiev metabolizmu kyseliny listovej ako existenciu ochranného, resp. rizikového polymorfizmu na študovaných miestach génu pre MTHFR.
Štúdia bola finančne podporená grantom VEGA 1/0593/11.
Došlo: 20. 5. 2015
Přijato: 7. 8. 2015
MUDr. Martin Záhorec
Oddelenie anestéziológie a intenzívnej medicíny
Detské kardiocentrum
Národný ústav srdcových a cievnych chorôb, a.s.
Limbová 1
833 51 Bratislava
Slovenská republika
e-mail: marzahorec@gmail.com
Sources
1. Botto LD. Epidemiology and prevention of congenital heart defects. In: Allen HD, Driscoll DJ et al (eds). Moss´s and Adams Heart Disease in Infants, Children and Adolescents. 8th ed. Philadelphia, USA: Lippincott Williams & Wilkins, 2013 : 577–616.
2. Verkleij-Hagoort AC, de Vries JHM, Ursem NTC, et al. Dietary intake of B-vitamins in mothers born a child with congenital heart defect. Eur J Nutr 2006; 45 : 478–486.
3. Šabová L, Kovács L. Kyselina listová a vrodené vývojové chyby. Pediatr Prax 2008; 1 : 36–38.
4. Czeizel AE, Dudás I, Vereczkey A, et al. Folate deficiency and folic acid supplementation: the prevention of neural-tube defects and congenital heart defects. Nutrients 2013; 5 : 4760–4775.
5. Czeizel AE, Dudás I. Prevention of the first occurrence of neural-tube defects by periconceptional vitamin supplementation. N Engl J Med 1992; 327 : 1832–1835.
6. Yang QH, Botto LD, Gallagher M, et al. Prevalence and effects of gene-gene and gene-nutrient interactions on serum folate and serum total homocysteine concentrations in the United States: findings from the third National Health and Nutrition Examination Survey DNA Bank. Am J Clin Nutr 2008; 88 : 232–246.
7. van der Put NM, Gabreëls F, Stevens EM, et al. A second common mutation in the methylenetetrahydrofolate reductase gene: an additional risk factor for neural-tube defects? Am J Hum Genet 1998; 62 : 1044–1051.
8. Wang W, Hou Z, Wang C, et al. Association between 5, 10-methylen-etetrahydrofolate reductase (MTHFR) polymorphisms and congenital heart disease: A meta-analysis. Meta Gene 2013; 1 : 109–125.
9. Goldmuntz E, Woyciechowski S, Renstrom D, et al. Variants of folate metabolism genes and the risk of conotruncal cardiac defects. Circ Cardiovasc Genet 2008; 1 : 126–132.
10. Mamasoula C, Prentice RR, Pierscionek T, et al. Association between C677T polymorphism of methylenetetrahydrofolate reductase and congenital heart disease. Circ Cardiovasc Genet 2013; 6 : 347–353.
11. Brandalize APC, Bandinelli E, dos Santos PA, et al. Evaluation of C677T and A1298C polymorphisms of MTHFR gene as maternal risk factors for Down syndrome and congenital heart disease. Am J Med Genet 2009; 149A: 2080–2087.
12. Steegers-Theunissen RP, Twigt J, Pestinger V, et al. The periconceptional period, reproduction and long-term health of offspring: the importance of one-carbon metabolism. Hum Reprod Update 2013; 19 : 640–655.
13. Moorman A, Webb S, Brown NA, et al. Development of the heart: (1) formation of the cardiac chambers and arterial trunks. Heart 2003; 89 : 806–814.
14. Li D, Rozen R. Maternal folate deficiency affects proliferation, but not apoptosis, in embryonic heart. J Nutr 2006; 136 : 1774–1778.
15. Botto LD, Mulinare J, Erickson JD. Do multivitamin or folic acid supplements reduce the risk for congenital heart defects? Evidence and gaps. Am J Med Genet 2003; 121A: 95–101.
16. Van Beynum IM, Kapusta L, Bakker MK, et al. Protective effect of periconceptional folic acid supplements on the risk of congenital heart defects: A registry-based case-control study in the northern Netherlands. Eur Heart J 2010; 31 : 464–471.
17. Goh YI, Bollano E, Einarson TR, Koren G. Prenatal multivitamin supplementation and rates of congenital anomalies: a meta-analysis. J Obstet Gynaecol Can 2006; 28 : 680–689.
18. Hernandez-Diaz S, Werner MM, Walker AM, et al. Folic acid antagonists during pregnancy and the risk of birth defects. N Engl J Med 2000; 343 : 1608–1614.
19. Verkleij-Hagoort A, Bliek J, Sayed-Tabatabaei F, et al. Hyperhomocysteinemia and MTHFR polymorphisms in association with orofacial clefts and congenital heart defects: a meta-analysis. Am J Med Genet A 2007; 143A: 952–960.
20. Hobbs CA, James SJ, Parsian A, et al. Congenital heart defects and genetic variants in the methylenetetrahydrofolate reductase gene. J Med Genet 2006; 43 : 162–166.
21. Ray JG, Singh G, Burrows RF. Evidence for suboptimal use of periconceptional folic acid supplements globally. BJOG 2004; 111 : 399–408.
22. Horn F, Sabova L, Pinterova E, et al. Prevention of neural tube defects by folic acid – awareness among women of childbearing age in Slovakia. Bratisl Lek Listy 2014; 115 : 91–97.
23. Sabova L. Génové polymorfizmy metabolizmu kyseliny listovej v etiológii defektov neurálnej rúry a Downovho syndrómu. Bratislava: Univerzita Komenského, 2010 : 84–87.
24. Ionescu-Ittu R, Marelli AJ, Mackie AS, et al. Prevalence of severe congenital heart disease after folic acid fortification of grain products: time trend analysis in Quebec, Canada. BMJ 2009; 338: b1673.
25. Crider KS, Bailey LB, Berry RJ. Folic acid food fortification – its history, effect, concerns, and future directions. Nutrients 2011; 3 : 370–384.
26. Pfeiffer CM, Johnson CL, Jain RB, et al. Trends in blood folate and vitamin B12 concentrations in the United States, 1988–2004. Am J Clin Nutr 2007; 86 : 718–727.
27. Peyvandi S, Rychik J, Zhang X, et al. Preconceptual folic acid use and recurrence risk counceling for congenital heart disease. Congenit Heart Dis 2014; Jul 24, doi: 10.1111/chd.12206. [Epub ahead of print].
28. Eurostat Press Office: Between 8% and 25% of adults are obese across Member states. [cit. 2014-05-05]. Dostupné na internete: http://ec.europa.eu/eurostat/documents/2995521/5032782/3-24112011-BP-EN.PDF/831f0ca4-7105-4045-9e25-604141ef5108.
29. Behunová J, Podracká Ľ. Rázštepy nervovej trubice – súčasné pohľady na etiopatogenézu a možnosti prevencie kyselinou listovou. Čes-slov Pediat 2008; 63 : 38–46.
30. Behunova J, Klimcakova L, Zavadilikova E, et al. Methylenetetrahydrofolate reductase gene polymorphisms and neural tube defects epidemiology in the Slovak population. Birth Defects Res A Clin Mol Teratol 2010; 88 : 695–700.
31. Junker R, Kotthoff S, Vielhaber H, et al. Infant methylenetetrahydrofolate reductase 677TT genotype is a risk factor for congenital heart disease. Cardiovasc Res 2001; 51 : 251–254.
32. van Beynum IM, Kapusta L, den Heijer M, et al. Maternal MTHFR C>T is a risk factor for congenital heart defects: Effect modification by periconceptional folate supplementation. Eur Heart J 2006; 27 : 981–987.
33. van Beynum IM, den Heijer M, Blom HJ, et al. The MTHFR 677C->T polymorphism and the risk of congenital heart defects: a literature review and meta-analysis. QJM 2007; 100 : 743–753.
34. Sayin Kocakap BD, Sanli C, Cabuk F, et al. Association of MTHFR A1298C polymorphism with conotruncal heart disease. Cardiol Young 2014; 30 : 1–6.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2015 Issue 5-
All articles in this issue
- Special topics in lung ultrasound in children
- Association between genetic polymorphisms of methylenetetrahydrofolate reductase and congenital heart disease in Slovak population
- Intestinal permeability and SCORAD of children with atopic dermatitis after six weeks supplementation of Lactobacillus rhamnosus GG (the pilot study)
- Favourable prognosis of solitary kidney in children?
- Intrafamiliar phenotype variability of classic Marfan syndrome
- Rare case of patient with DiGeorge syndrome and limbs anomalies: the benefit of SNP microarray analysis?
- Metabolic bone disease of prematurity – review article
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metabolic bone disease of prematurity – review article
- Special topics in lung ultrasound in children
- Rare case of patient with DiGeorge syndrome and limbs anomalies: the benefit of SNP microarray analysis?
- Association between genetic polymorphisms of methylenetetrahydrofolate reductase and congenital heart disease in Slovak population
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

