-
Medical journals
- Career
Štúdium lokálnych anestetík Časť 185: Termodynamické parametre heptakaíniumchloridu v prostredí roztoku NaBr*
Authors: F. Andriamainty; J. Čižmárik; I. Malík
Authors‘ workplace: Univerzita Komenského Bratislava, Farmaceutická fakulta, Katedra farmaceutickej chémie
Published in: Čes. slov. Farm., 2008; 57, 260-264
Category: Original Articles
Overview
Kritická micelová koncentrácia (CMC) lokálneho anestetika heptakaíniumchloridu v prostredí NaBr (0,1 mol/l a 0,2 mol/l) bola určená spektrofotometricky v UV oblasti spektra v teplotnom intervale t = 20–40 °C a pri pH ≈ 4,5–5,0. Závislosť CMC od teploty T mala tvar „U“ (U-shaped) s minimom pri teplote t = 25 °C. Zo závislosti ln (CMC)od T sme fitovaním polynómom druhého stupňa získali parabolické rovnice pre jednotlivé koncentrácie študovanej látky, z ktorých boli pomocou modelu fázovej separácie vypočítané termodynamické parametre micelizácie, ako sú: štandardná mólová Gibbsova energia (∆G°), entalpia (∆H°) a entropia (∆S°).
Kľúčové slová:
heptakaíniumchlorid – kritická micelová koncentrácia (CMC) – termodynamika – štandardná mólová Gibbsova energia – entropia – entalpiaÚvod
Lokálne anestetikum, heptakaíniumchlorid na základe jeho vlastností a chovania sa v roztoku možno zaradiť medzi tenzidy.
Po rozpustení tenzidov vo vode vznikajú pri prekročení tzv. kritickej micelovej koncentrácie (critical micelle concentration – CMC) spontánne agregáty. Ich charakter, veľkosť a tvar ovplyvňuje celé spektrum okolností. Najvýznamnejší z nich je vplyv štruktúry amfifilu, zanedbateľný však nie je ani vplyv zloženia systému a teploty. Hnacou silou agregácie sú tzv. hydrofóbne interakcie. Ich podstatou je pomerne značný vzrast entrópie pri prechode tenzidu z monomérneho do agregovaného stavu; tento vzrast entrópie je spôsobený desolvatáciou hydrofóbnych alkylových reťazcov. Z hľadiska entalpie môže byť agregácia tenzidov procesom exotermickým (väčšinou v prípade iónových tenzidov) alebo endotermickým (väčšinou v prípade neiónových tenzidov); zmena entalpie pri agregácii sa pohybuje okolo (10 kJ.mol-1) 1, 2).
Ďalšou nevyhnutnou podmienkou vzniku miciel z aniónových či katiónových tenzidov je, aby teplota systému bola vyššia ako tzv. Krafftova teplota (Krafftov bod). Na krivke závislosti pozorovanej rozpustnosti amfifilu od teploty sa začiatok tvorby agregátov prejaví zreteľným zlomom (Krafftov bod). Zatiaľ čo pod Krafftovou teplotou je rozpustnosť tenzidu vo vode nepatrná, nad touto teplotou pozorovaná rozpustnosť amfifilu vo vode v dôsledku tvorby agregátov výrazne vzrastá (často i o niekoľko rádov). Vzhľadom k tomu, že sa v prípade aplikácie tenzidov zvyčajne pracuje pri teplotách zreteľne vyšších, ako je Krafftova teplota, uvádza sa väčšinou ako nutná podmienka vzniku agregátov po prekročení kritickej micelovej koncentrácie. Krafftova teplota odráža rozdiely medzi energiami tenzidu v kryštalickom stave a v stave agregátov v roztoku. Z tohto dôvodu závisí významne od štruktúry tenzidu, hlavne od počtu, dĺžky a vetvení hydrofóbnych alkylových reťazcov, ďalej od prítomnosti ďalších polárnych segmentov v molekule a pod. U neiónových tenzidov je analógiou Krafftovej teploty tzv. bod zákalu1) (cloud point).
V doterajších prácach 3–5) sme študovali termodynamické parametre heptakaíniumchloridu s prímesou elektrolytov NaCl a KBr poprípade s prídavkom metanolu, etanolu a propanolu. Kedže na termodynamické parametre majú značný vplyv aj anióny prímesi elektrolytu, v tejto práci sme zvolili NaBr pre väčší rozmer Br- ako má Cl-. Z tohto štúdia a jeho zovšeobecnenia očakávame možnosť prispieť k teórii mechanizmu vzniku miciel študovaných látok.
V predkladanej práci sme sa preto zamerali na stanovenie kritickej micelovej koncentrácie (CMC) heptakaíniumchloridu v prostredí roztoku NaBr spektroskopickou metódou a súčasne aj štúdium termodynamických vlastností micelizácie – zmeny štandardnej mólovej Gibbsovej energie (∆G°), entalpie (∆H°) a entrópie (∆S°), umožňujúce pochopenie zmien vlastností micelových roztokov, ku ktorým dochádza v dôsledku pôsobenia uvedených faktorov. Tieto veličiny môžu byť zistené zo zmien CMC v závislosti od teploty s použitím fyzikálno-chemických metód a následným fitovaním týchto hodnôt na základe zvoleného modelu micelizácie. Dôležitosť štúdia termodynamiky vo farmaceutickej chémii spočíva v skutočnosti, že množstvo procesov, ako je napr. rozdeľovanie solventa medzi navzájom nemiešateľné fázy, rozpustnosť liečiv, micelizácia alebo tiež interakciu medzi liečivom a receptorom môžeme definovať aj v zmysle termodynamických čiže energetických aspektov.
POKUSNÁ ČASŤ
Študované látky a prístroje
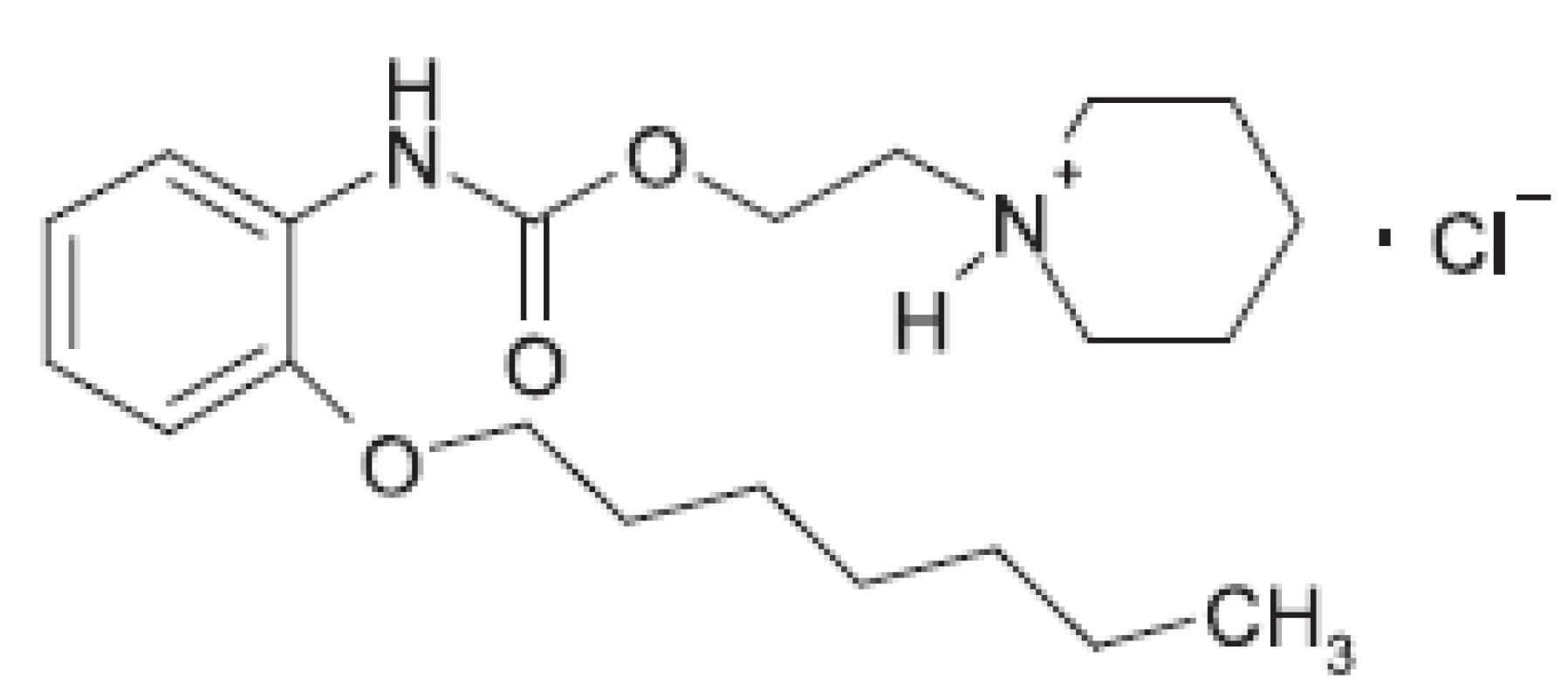
Študovanou látkou bolo lokálne anestetikum heptakaíniumchlorid. Chemicky je to N-[2-(2-heptyloxyfenylkarbamoyloxy)-etyl]-piperidíniumchlorid, s pracovným označením (XIX), ktorá bola pripravená na Katedre farmaceutickej chémie FaF UK v Bratislave podľa práce 6), kde je interpretovaný aj jej biologický účinok (obr. 1).
Prístroje
Spectrofotometer HP 8452 A Diode Array (Hewlett Packard, Nemecko); analytické váhy (WA 33 typ PRL T A 13/1, Techma Robot, Poľsko); pH meter (Portamess 943 pH, Elekronische Messgeräte GmbH Co., Nemecko); Termostat (Veb ML W Prüfgerate-Werk Medingen/ Sity/, Nemecko).
Pracovný postup
Pripravili sme zásobné roztoky študovanej látky XIX s koncentráciou c = 10-3 mol/l rozpustením stanoveného množstva látky v 0,1 mol/l a 0,2 mol/l roztokoch bromidu sodného.
Z jednotlivých základných roztokov sme pripravili sériu roztokov s klesajúcou koncentráciou riedením destilovanou vodou. Pri každej koncentrácii sme pri teplotách t = 20 oC, 25 oC, 30 oC, 35 oC a 40 oC a pH 4,5–5,0 zaznamenávali priebeh spektra danej látky proti porovnávaciemu roztoku (príslušný základný roztok NaBr) v ultrafialovej oblasti spektra v rozsahu vlnových dĺžok 190–350 nm. Zaznamenali sme hodnoty absorbancie pri vlnovej dĺžke λmax = 234 nm.
Model fázovej separácie (Pseudofázový model)
Pseudofázový model je jednoduchší ako model založený na pôsobení aktívnych hmotností. Jeho jednoduchosť umožňuje využitie pri zmiešaných tenzidoch, čo pri druhom modele nie je možné. Táto teória je vhodná aj pre micely s vysokým agregačným číslom 7).
Na výpočet termodynamických parametrov možno využiť závislosť CMC od teploty:
1n(CMC) = f (T).
Podľa modelu fázovej separácie potom možno zmenu štandardnej mólovej Gibbsovej energie, entalpie a entrópie vypočítať pomocou vzťahov popísaných v práci 8).
VÝSLEDKY A DISKUSIA
Hodnotu CMC sme určili ako priesečník dvoch extrapolovaných kriviek, ktoré interpretovali závislosť absorbancie A ako funkciu koncentrácie c 9). Na extrapoláciu kriviek sme použili komerčný program OriginPro 7.5 (http://www.OriginLab.com).
Hodnoty CMC sa pohybovali v rozmedzí od 4,9195.10-4 mol/l do 5,7030.10-4 mol/l v 0,1 mol/l roztoku NaBr, a od 4,7382.10-4 mol/l do 4,7856.10-4 mol/l v 0,2 mol/l roztoku NaBr.
Hodnoty CMC, ln(CMC) v závislosti od T (K) sú zaznamenané v tabuľkách 1 a 2. Hodnoty ln(CMC) v závislosti od teploty T sú uvedené na obrázkoch 2 a 3. Závislosť ln(CMC) od teploty má tvar „U“ („U-shaped“). Hodnoty boli fitované polynómom druhého stupňa. Polynomické rovnice (y = ln(CMC)=A+B.T+C.T2) a korelačné koeficienty (R) látky XIX v 0,1 mol/l, resp. 0,2 mol/l roztokoch NaBr boli nasledovné:
Table 1. Zistené hodnoty CMC a ln(1/CMC) pri látke XIX v 0,1 mol/l roztoku NaBr 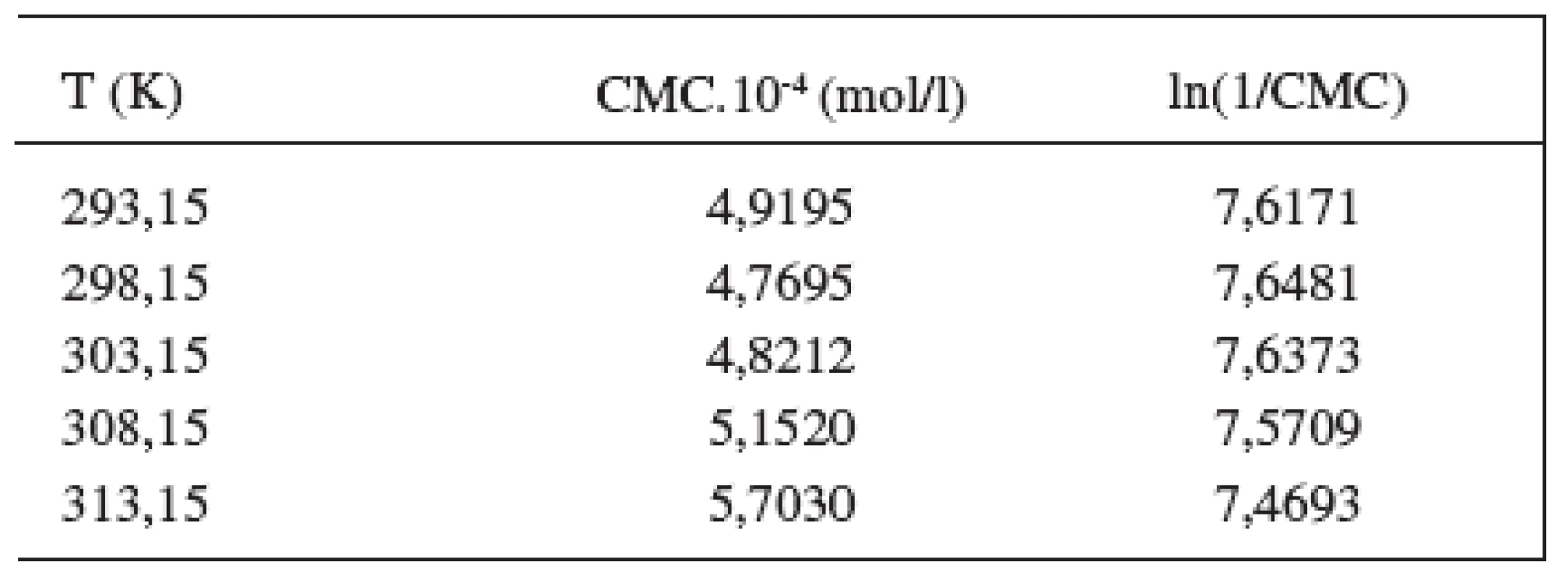
Table 2. Zistené hodnoty CMC a ln(1/CMC) pri látke XIX v 0,2 mol/l roztoku NaBr 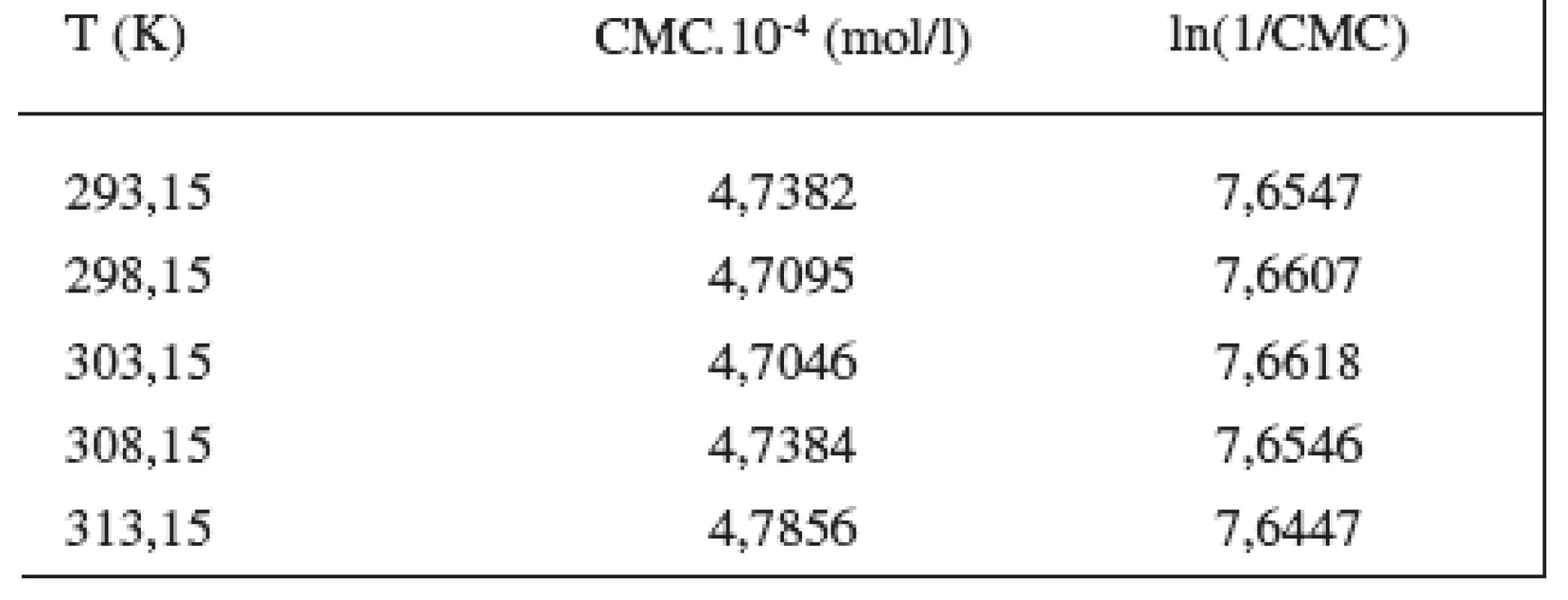
Image 2. Závislosť ln(CMC) od T pre látku XIX (0,1mol/l NaBr) 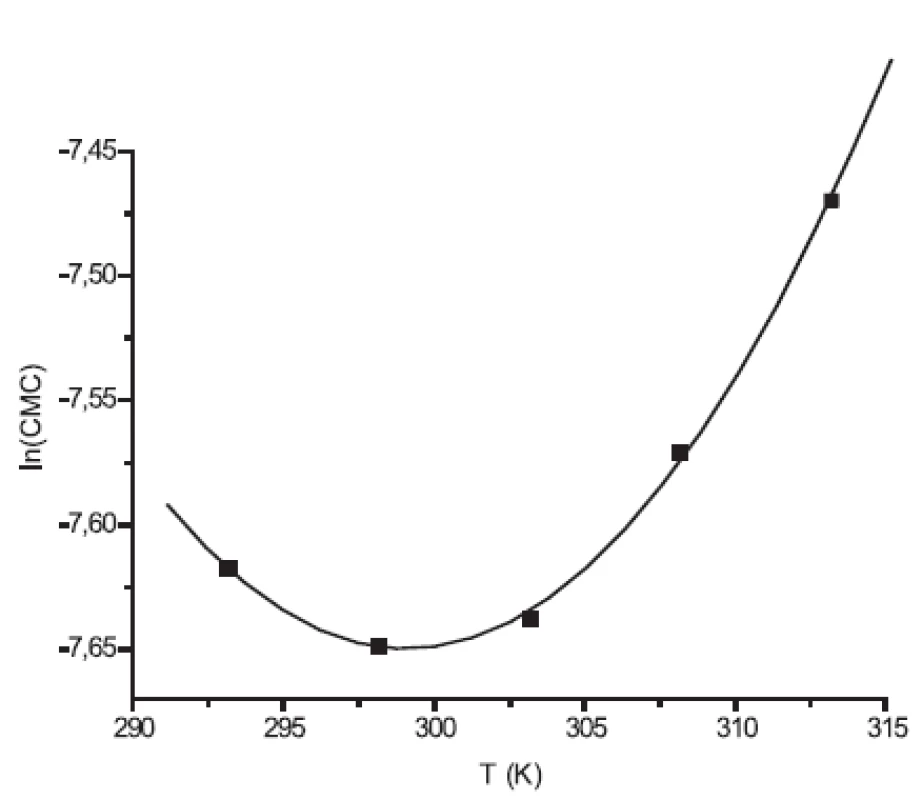
Image 3. Závislosť ln(CMC) od T pre látku XIX (0,2 mol/l NaBr) 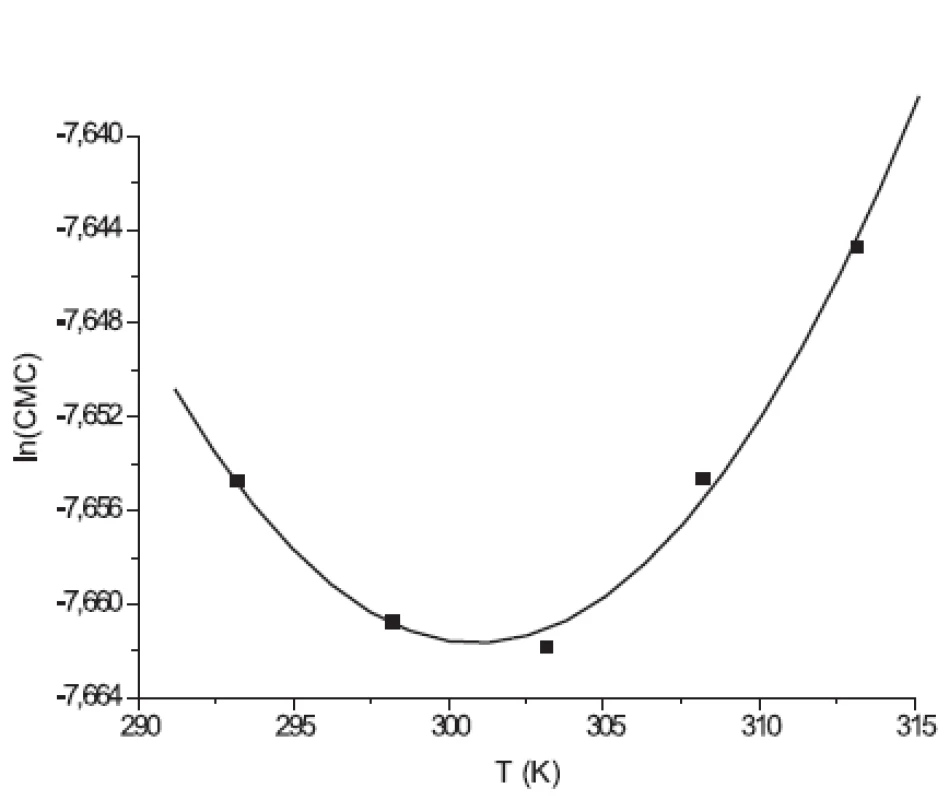
y = (74,34Ī3,18) + (-0,548Ī0,021)T + (0,00092 Ī 3,47.10-5)T2;
R = 0,999; N = 5 (0,1 mol/l NaBr)
a
y = (2,71Ī0,89) + (-0,069 Ī 0,006)T + (0,00011 Ī 0,97.10-5)T2;
R = 0,995; N = 5 (0,2 mol/l NaBr)
Hodnota ln(CMC) s teplotou klesala až po T = 298,73K v 0,1 mol/l roztoku NaBr a až po T = 301,25K v 0,2 mol/l roztoku NaBr, a potom stúpala. V našej predchádzajúcej práci 8) sme predpokladali, že tento postupný pokles CMC je zapríčinený desolvatačným procesom prebiehajúcim na koncovej časti postranného reťazca. V minime CMC nastal zlom, po ktorom bol pozorovaný nárast CMC, čo je pravdepodobne spôsobené agregáciou uhľovodíkového reťazca a vytvorením miciel.
Z obrázku 4 vyplýva, že hodnoty CMC roztokov látok v 0,1 mol.l-1 NaBr a 0,2 mol.l-1 NaBr boli vyššie ako hodnoty CMC roztokov látok v destilovanej vode. Nepodporovanie micelizácie (oproti destilovanej vode) je pravdepodobne spôsobené relatívne väčším van der Waalsovým polomerom aniónu Br-. Na druhej strane z dosiahnutých výsledkov súčasne vyplýva, že vyššia koncentrácia soli (0,2 mol.l-1 NaBr v porovnaní s 0,1 mol.l-1 NaBr) v roztoku podporuje formáciu miciel. Zovšeobecnením možno konštatovať, že prítomnosť Br- vo vyššej koncentrácii podporuje vznik miciel, takže pre tvorbu potenciálnych liekových foriem založených na roztokoch heptakaínu (injekcie, infúzie) by sa odporúčala nižšia koncentrácia roztoku NaBr alebo roztoku s NaCl.
Image 4. Závislosť CMC od T pre látku XIX (H2O, 0,1 mol/l NaBr a 0,2 mol/l NaBr) 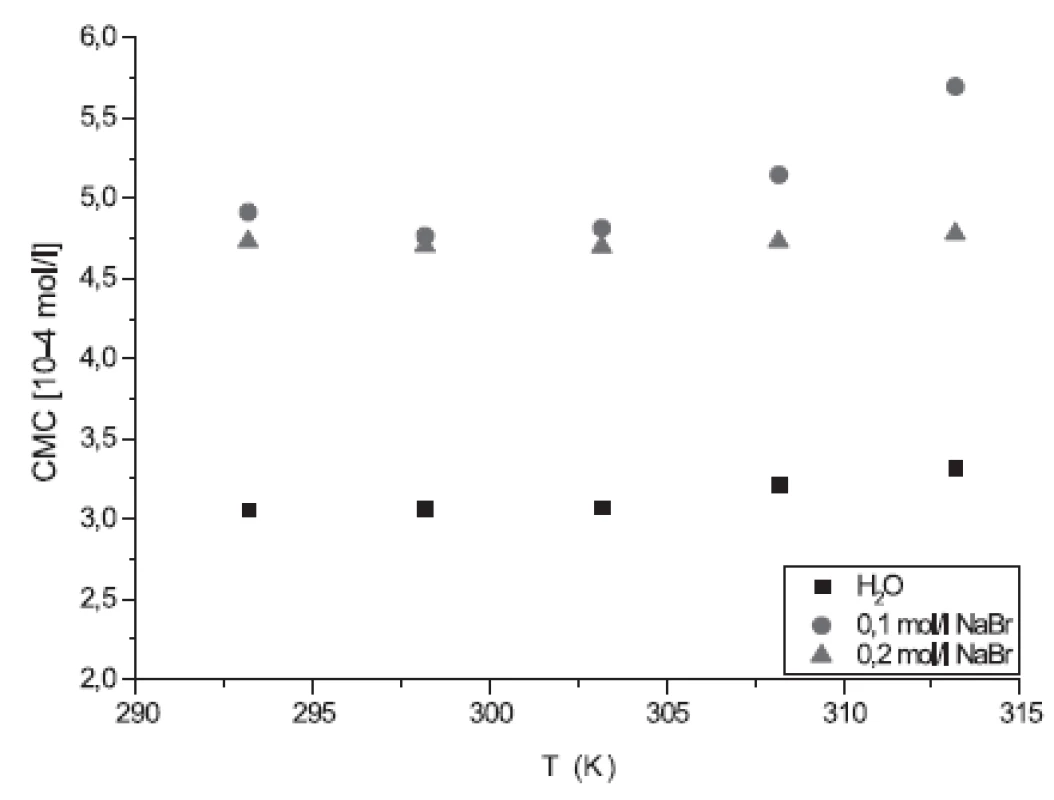
V práci sme sa tiež zamerali na štúdium termodynamických parametrov micelizácie látky XIX vo vodných roztokoch 0,1 mol/l NaBr a 0,2 mol/l NaBr: Študovanými termodynamickými parametrami boli zmena štandardnej mólovej Gibbsovej energie (∆G°), entalpie (∆H°)a entropie (∆S°). Tieto parametre sme počítali podľa modelu fázovej separácie (PS) komerčným programom Power Basic.
Z tabuliek 3 a 4 ilustrujúcich priebeh závislostí termodynamických parametrov od teploty vyplývajú nasledujúce závery: Hodnoty štandardnej mólovej Gibbsovej energie (∆G°) sú záporné a s teplotou klesajú len veľmi málo. Výraznejšie sú poklesy hodnôt štandardnej mólovej entalpie (∆H°). Z týchto výsledkov vyplýva, že micelizačný proces sa so zvyšujúcou teplotou stáva exotermickejším. K podobným záverom sme dospeli v predchádzajúcich prácach 8, 10, 11). Hodnoty štandardnej mólovej entropie (∆S°) klesajú so stúpajúcou teplotou.
Table 3. Termodynamické parametre látky XIX v 0,1 mol/l NaBr 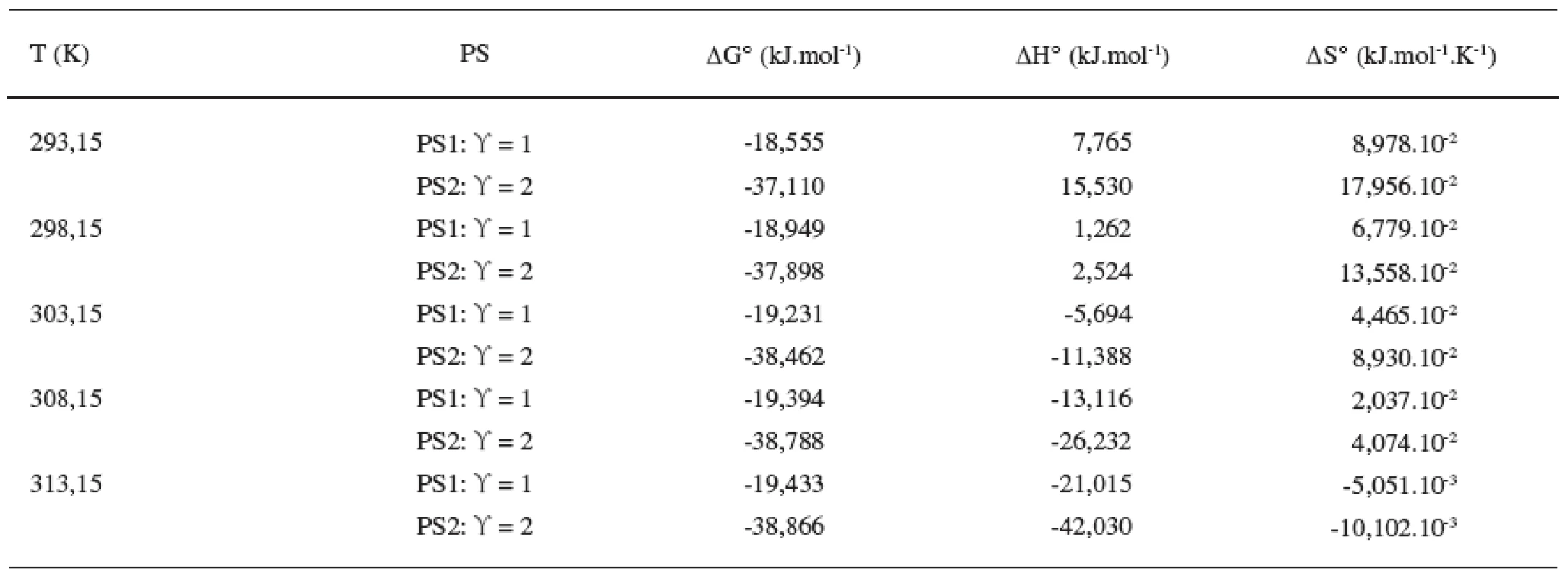
Table 4. Termodynamické parametre látky XIX v 0,2 mol/l NaBr 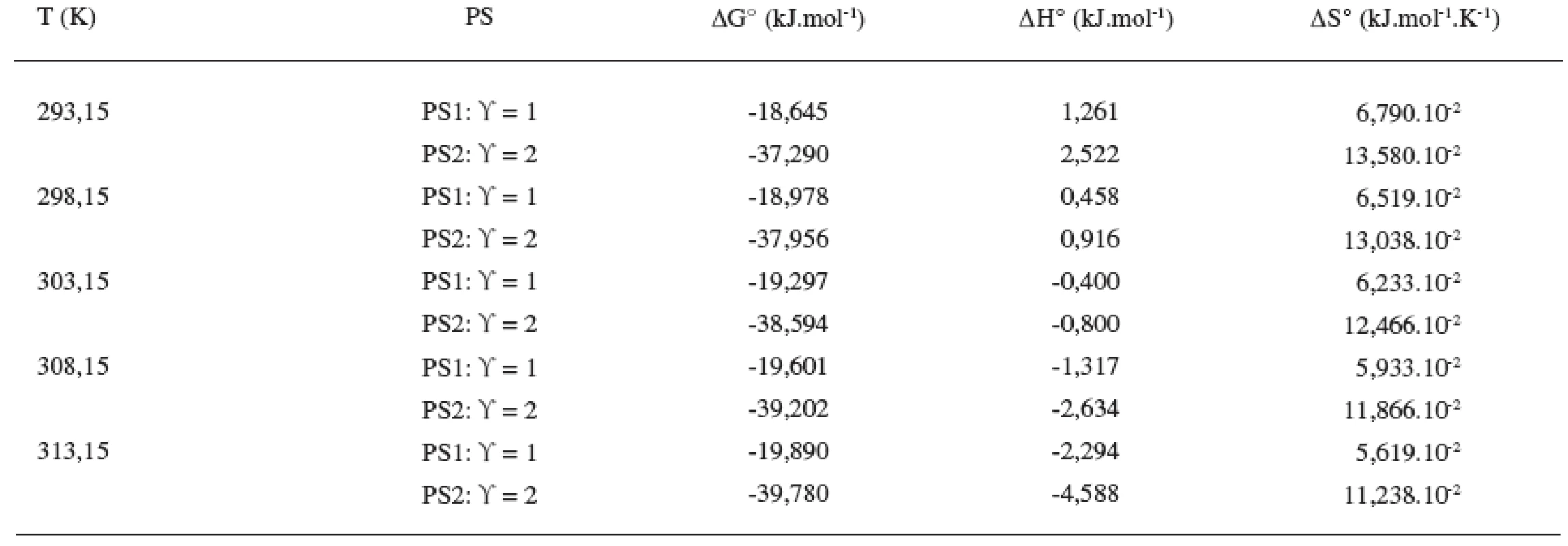
Táto práca vznikla a je zahrnutá a do projektu VEGA č. 1/4291/07.
Došlo 2. září 2008
Přijato 7. října 2008
Adresa pre korešpondenciu:
Mgr. Fils Andriamainty, PhD.
Katedra farmaceutickej chémie FaF UK
Odbojárov 10, 832 32 Bratislava, Slovenská republika
e-mail: mouanda@fpharm.uniba.sk
Sources
1. Myers, D.: Surfaces, interfaces, and colloids. Weinheim, Verlag Chemie, 1991.
2. Atkins, P., de Paula, J.: Atkins’ Physical Chemistry, 7th Ed. Oxford: Oxford University Press, 2002.
3. Andriamainty, F., Čižmárik, J.: Farm. Obzor, 2004; 73, 100–102.
4. Andriamainty, F., Čižmárik, J., Holíková, M.: Sci. Pharm., 2004; 72, 221–225.
5. Andriamainty, F., Čižmárik, J., Zúdorová, Z. et al.: Pharmazie, 2007; 62, 77–78.
6. Čižmárik, J., Borovanský, A., Švec, P.: Acta Facult. Pharm., Univ. Comenianae 1976; 29, 53–76.
7. Healy, T. W., Drummond, C. J., Grieser, F., Murray, B. S.: Langmuir, 1990; 6, 506–508.
8. Andriamainty, F., Čižmárik, J., Malík, I., Horvat, S.: Čes. slov. Farm., 2008; 57, 119–125.
9. Ščukin, E. D., Percov, A. V., Amelinová, E. A.: Koloidní chemie. 1. vydání. Praha: Academia, 1990, 303–333.
10. Andriamainty, F., Čižmárik, J.: Pharmazie, 1999; 54, 629–630.
11. Andriamainty, F., Čižmárik, J.: Pharmazie, 58, 2003; 440–441.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2008 Issue 6-
All articles in this issue
- Spotřeba hypolipidemik v České republice v letech 2000–2007
- Testování efektu 2’, 3, 4’-trihydroxychalkonu u experimentálního diabetes mellitus – pilotní studie
- Stanovení metoprololu a jeho metabolitu α-hydroxymetoprololu v séru metodou HPLC s fluorescenční detekcí
- Štúdium lokálnych anestetík Časť 185: Termodynamické parametre heptakaíniumchloridu v prostredí roztoku NaBr*
- Optimalizácia extrakčnej metódy na stanovenie metadónu a jeho metabolitu EDDP v moči plynovou chromatografiou
- Vliv koncentrace lipofilního nosiče na vlastnosti hydrofilně-lipofilních matricových systémů
- Možnosti ovplyvnenia liberácie alaptidu z dermálnych polotuhých liekov
- Vliv hlohového extraktu na funkci mitochondrií srdce
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Možnosti ovplyvnenia liberácie alaptidu z dermálnych polotuhých liekov
- Štúdium lokálnych anestetík Časť 185: Termodynamické parametre heptakaíniumchloridu v prostredí roztoku NaBr*
- Optimalizácia extrakčnej metódy na stanovenie metadónu a jeho metabolitu EDDP v moči plynovou chromatografiou
- Vliv koncentrace lipofilního nosiče na vlastnosti hydrofilně-lipofilních matricových systémů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career