-
Medical journals
- Career
Huntingtonova nemoc se začátkem v seniu – přehlížená diagnóza
Authors: P. Ressner; P. Bártová; J. Horáková; P. Krulová; V. Jaremová; D. Beránková; M. Bar
Authors‘ workplace: Neurologická klinika FN Ostrava
Published in: Cesk Slov Neurol N 2018; 81(4): 484-486
Category: Letters to Editor
doi: https://doi.org/10.14735/amcsnn2018484Overview
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manu script met the ICMJE “uniform requirements” for biomedical papers.
Vážená redakce,
Huntingtonova nemoc (HN) je autosomálně dominantně dědičné onemocnění projevující se poruchami volní motoriky, mimovolními pohyby, zejména choreatickým syndromem v kombinaci s progresivní kognitivní deteriorací a různými poruchami chování [1]. Adultní varianta HN obvykle začíná mezi 30. a 50. rokem života, nejčastěji ve čtvrté dekádě. Juvenilní forma (Westphalova varianta) činí 5 % všech HN, a začíná před věkem 21 let. U juvenilní formy HN obvykle dominuje parkinsonský anebo dystonický syndrom a chorea se vyskytuje jen minimálně. Pro senilní formy HN s počátkem po 60. roce života (4,4–11,5 % případů) je typický pozvolný rozvoj neinvalidizujícího choreatického syndromu a zpočátku neinvalidizujícího kognitivního deficitu [2].
Onemocnění je způsobeno mutací v CAG tripletu se zmnožením jeho repetic na genu IT15 v chromozomální pozici 4p16.3. Normální počet repetic je v rámci polymorfismu příslušného genu 15–20, přičemž jako horní hranice normy je uváděno 26 repetic. Pokud je počet repetic 27–35, není tento stav spojen s vznikem nemoci, ale představuje riziko další expanze se vznikem onemocnění v další generaci [1]. K výraznější expanzi počtu CAG tripletů obvykle dochází při paternálním přenosu při dozrávání spermií v nadvarleti. Osoby s počtem > 40 CAG tripletů se obvykle dožijí plného rozvoje nemoci. Při počtu repetic 36–39 nemusí dojít k plné penetranci nebo rozvoji v seniu. Obecně platí, že čím je vyšší počet repetic CAG, tím je pravděpodobnost vzniku onemocnění v nižším věku a s těžším průběhem [1,3].
79letý pacient byl doporučen k vyšetření do specializované ambulance pro diagnostiku a léčbu demencí ze spádové neurologické ambulance. Odeslán byl s kognitivním deficitem dosahujícím stupně mírné demence s dominujícími poruchami paměti a s poruchou stability stoje a chůze, popisované jako porucha chůze v rámci paleocerebelárního syndromu a lehkého neocerebelárního syndromu oboustranně. Podle dokumentace obtíže začaly před 10 lety náhle, tehdy byl stav uzavřen jako lakunární ischemická kmenová CMP. Na CT mozku (obr. 1) byla nalezena atrofie mozku kortikální i subkortikální s rozšířením obou postranních komor, popsána je i lehká leukoaraióza. Podle pacienta došlo spontánně k úpravě stavu.
Image 1. CT mozku z roku 2006, nativní zobrazení. Atrofie mozku kortikosubkortikální, lehké známky subkortikální mikroangiopatie, atrofie caput nuclei caudati oboustranně.
Fig. 1. CT brain scan from 2006, non-enhanced. Corticosubcortical atrophy and slight subcortical leukoaraiosis, bilateral atrophy of the caudate nucleus.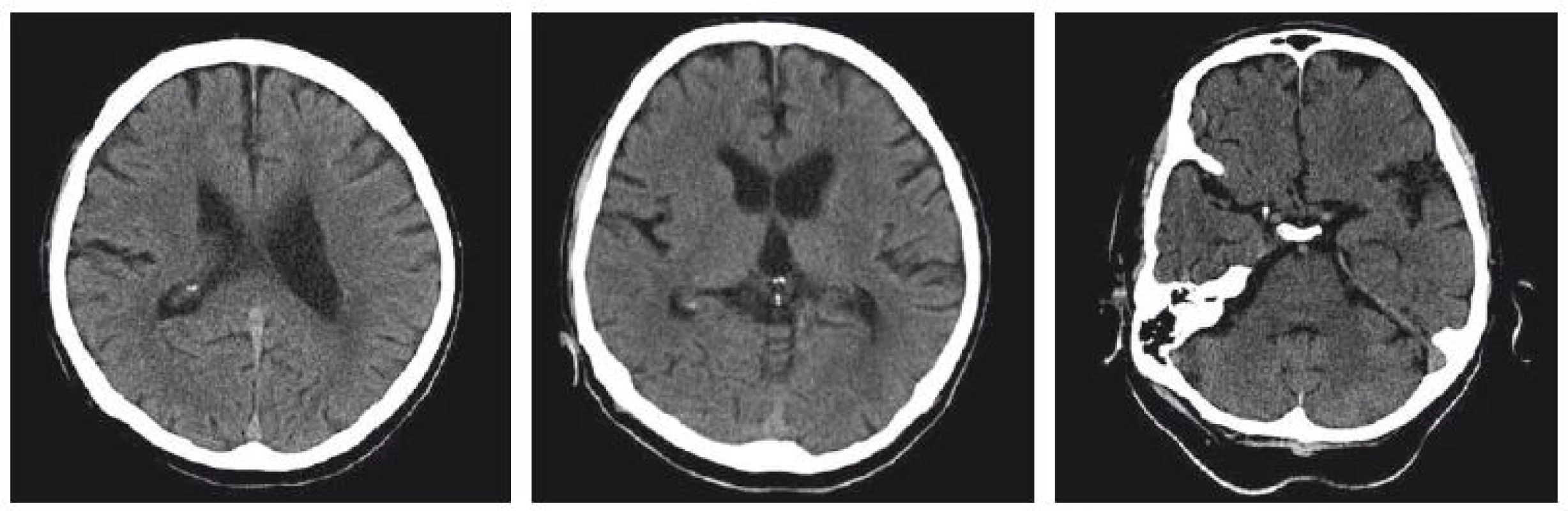
Podle rodinných příslušníků došlo před 3 lety nastala u pacienta náhlá recidiva poruchy stability chůze a nově se objevily poruchy paměti se zpomalením psychomotorického tempa. Na CT nebyla zaznamenána progrese či nové ložiskové změny v mozkovém parenchymu. Stav byl uzavřen jako nová lakunární CMP.
Při prvním vyšetření u nás pacient subjektivně udával potíže se stabilitou chůze, artikulací a zhoršeným zapamatováním nových událostí a jmen. V kognitivním screeningu byly patrné poruchy paměti a orientace čase (vstupní test Mini-Mental State Examination [MMSE] dosáhl vyšetřovaný 23 bodů). Řeč byla lehce dysartrická, její tempo zpomalené, charakter dysartrie nevylučoval mozečkovou symptomatiku, nebyla vyjádřena jednoznačně sakadovaná řeč, ale dysartrie byla spíše extrapyramidového, hyperkinetického typu, jazyk plazil středem a udržel vyplazený déle než 10 s. Další nález na hlavových nervech byl normální. Na končetinách byl nález bez paréz, ale taxe zejména na horních končetinách byla narušována mírnými dyskinézami choreatického typu. V chůzi byla rozšířená báze, instabilní bez lateralizace, zejména při otočce. Při tandemové chůzi byl výrazně instabilní. Posturální instabilita byla patrná i při opakovaném provedení pull testu. Chorea narušovala délku, pravidelnost a rychlost kroků. Během chůze se objevovaly ojedinělé rychlé pohyby rameny a náhlé stočení trupu do rotace, které působilo jako vyrovnávání nestability, což již byly ale příznaky spadající do obrazu choreatického syndromu. Iritační pyramidové jevy nebyly přítomny. Autonomní dysfunkce nebyla přítomna. Krevní tlak byl naměřen 146/94 mmHg. Pacient uvedl, že se léčí pouze pro hypertenzi, pravidelně užívá léky – kombinaci antihypertenziv a antiagregační terapii po prodělané CMP, psychofarmaka ani antiemetika nikdy neužíval.
V rodinné anamnéze bylo při vstupním vyšetření zjištěno, že jeho matka zemřela na karcinom v gynekologické oblasti v 45 letech, otec zemřel na CMP v 76 letech. Pacient měl celkem 8 sourozenců, z nich je 6 v současnosti žijících. Dva jeho bratři již zemřeli, ale příčinu úmrtí se nepodařilo zjistit. Následně vyšlo najevo, že jeho 70letý bratr je léčen ve specializovaném neurologickém centru v jiném kraji pro více než 5 let trvající choreatický syndrom s výraznou posturální instabilitou a pády. Při vyžádání zapůjčení dokumentace bylo potvrzeno, že má geneticky verifikovanou HN s alelickou kompozicí 17/41 CAG tripletů. Dále se ukázalo, že jediná jeho sestra, v současnosti 89letá, je umístěna v zařízení pro dlouhodobě nemocné seniory, v době vyšetření našeho pacienta byla po pádu s poraněním hlavy, má poruchy stability stoje a chůze a demenci, geneticky nebyla vyšetřena, její neurologické vyšetření v naší ambulanci není možné a telefonicky od ošetřujícího lékaře bylo zjištěno, že nemá choreatické dyskinézy. Pacient má dvě dcery, jednu dceru 55letou, nemocnou údajně s mozkomíšní RS, která odmítá vyšetření zaměřené na HN, a druhou, zdravou, 57letou dceru. Babička i dědeček z matčiny i otcovy strany neměli příznaky poruch hybnosti, chování či demenci, pacient je znal, zemřeli dle pacienta i jeho manželky stářím, bližší diagnóza není známa.
Pro podezření na neurodegenerativní proces byla provedena MR mozku (obr. 2), kde se ukázala již dříve popisovaná kortikální atrofie, vaskulární změny v bílé hmotě hemisfér a symetrická atrofie striata, nebyla popisována výraznější atrofie v oblastech hipokampů. Neuropsychologické vyšetření prokázalo lehký syndrom demence subkortikálního typu. Nevykazoval úzkostné ani depresivní projevy, známky iritability, agrese a ani psychotické symptomy. Náhled pacienta byl částečně snížený. Po písemném souhlasu pacienta byl proveden odběr na DNA analýzu, a následně se tak potvrdila klinická diagnóza HN (17/40 CAG tripletů).
Image 2. MR mozku z roku 2016, FLAIR. Leukoaraióza a drobné ischemické lakuny v bazálních gangliích oboustranně, atrofie mozku kortikosubkortikální, atrofie caput nuclei caudati oboustranně (označeno šipkami).
Fig. 2. MRI brain scan from 2016, FLAIR. Leucoaraiosis and small post-ischemic lacunes in bilateral basal ganglia, corticosubcortical brain atrophy, bilateral atrophy of the caudate nucleus (arrows).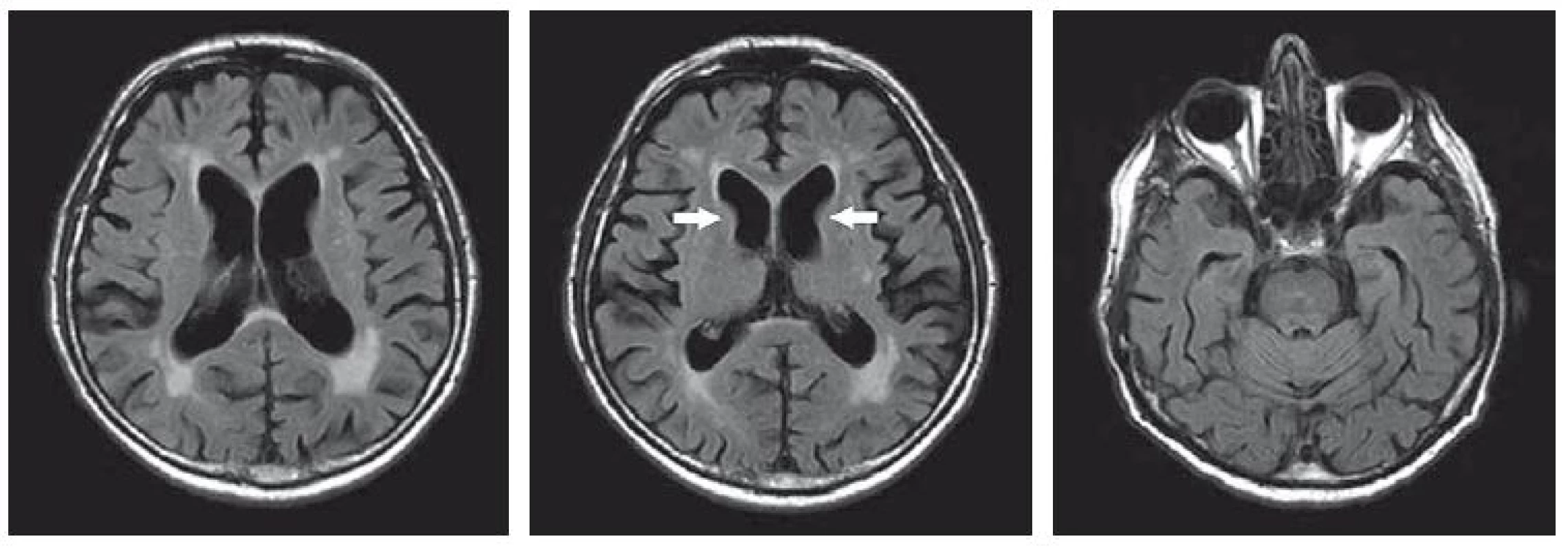
Po nasazení tiapridu v celkové dávce 200 mg/den došlo k uspokojivému zmírnění dyskinéz [1]. Přestože v průběhu následujících 2 let chorea a posturální instabilita pozvolna progredovaly, pacient je stále schopen pohybovat se samostatně a bez pádů. Kognitivní deficit se orientačně výrazněji nezhoršil (poslední MMSE po 2 letech 22 bodů) a závažné poruchy chování nevykazuje.
Pozdní nástup HN je obvykle velmi pozvolný. Z neurologických příznaků dominuje neinvalidizující a mnohdy jen diskrétní choreatický syndrom. Kognitivní deficit progreduje pomalu a je často zdravotníky přičítán vaskulárnímu postižení nebo Alzheimerově nemoci. Laiky může být chybně považován za projevy stáří. Pokud není chorea patrná, pak nevedou k podezření na HN ani úzkostné poruchy a deprese běžně se vyskytující v seniu. Proto je u mnohých pacientů nemoc dlouho nerozpoznána nebo diagnostikována až zpětně na základě manifestace v další generaci [2]. U našeho pacienta byly pozorovány výše popsané poruchy chůze s nestabilitou a porucha cílené taxe na horních a dolních končetinách, které byly zpočátku mylně považovány za mozečkové příznaky. Pohyby rameny, náhlé stočení trupu do rotace, které působilo jako vyrovnávání nestability, vedly naše úvahy dále k možnosti choreatického syndromu. Z naší ambulance máme zkušenost, že záměna lehké chorey za mozečkovou ataxii a poruchu stoje a chůze není ojedinělá a v počátcích onemocnění HN je tato záměna častá. Mírné choreatické pohyby mohou narušovat cílenou taxi a tak nemusí být považovány primárně za choreu. Navíc, některé příznaky choreatického syndromu nemusí být vyjádřeny a u našeho pacienta nebyl přítomen např. příznak jazyka. Při tomto příznaku pacient není schopen udržet vyplazený jazyk v klidu, pohybuje jím a především jej mimovolně zatahuje zpět do úst. Také pohyby jazykem do stran váznou, jsou nekoordinované, což u našeho pacienta nebylo pozorováno. Další popisovaný příznak u choreatického syndromu, a to příznak dojičky, nebyl přítomen. Při něm by při stisku ruky pacient měl mimovolně povolovat a svírat dlaň, jakoby stisknuté prsty lékaře „žmoulal“ [4].
U jedinců s pozdní formou HN se nejčastěji prokáže 36–42 CAG tripletů. S rostoucím počtem CAG tripletů je tendence ke snižování věku klinického počátku nemoci HN [1]. Retrospektivní i prospektivní klinické studie ukazují, že samotný počet CAG tripletů predikuje počátek nemoci přibližně jen v 60 % případů [5]. Například u jedinců, kteří mají 44 repetic CAG, byl zaznamenán začátek onemocnění v rozpětí 31–66 let [6]. I u jedinců se stejnou alelickou kompozicí se věk nástupu nemoci může lišit o více než 20 let [7]. Na věku počátku a klinickém průběhu nemoci se podílí i další genetické a enviromentální faktory [3]. Prezentovaný pacient má alelickou kompozici CAG repetic v mutovaném genu 17/40. 40 repetic CAG je již v pásmu plné penetrace genu, ale je na jeho spodní hranici. Proto lze předpokládat pozdní začátek onemocnění, to odpovídá našemu klinickému pozorování, které je v souladu s literárními údaji viz výše. Stabilita klinického stavu pacienta ale dává možnost i podílu cévní etiologie potíží, neboť na MR mozku je patrna leukoaraióza s mikroangiopatií i v bazálních gangliích. Jednoznačnou apraxii či přítomnost iritačních pyramidových příznaků jsme nezaznamenali, což bychom jinak u popisovaných cévních změn mohli očekávat.
Onemocnění sestry pacienta v 89 letech s demencí a pády nejasné etiologie nevylučuje rovněž počátek HN, ale nemáme možnost doplnit genetické vyšetření, které pacientka aktivně odmítá. U 70letého bratra pacienta byl začátek HN zaznamenán v 65 letech při alelické kompozici 17/41. Má téměř stejný rozsah CAG repetic jako náš pacient. U našeho pacienta byla diagnóza stanovena v 79 letech, ale je možné, že se první příznaky objevily již v 69 letech, kdy byly považovány za CMP, nebo v 75 letech, kdy byly považovány za recidivu CMP. I přes možný rozdíl ve věku začátku HN u našeho pacienta a jeho bratra, jenž činí 10 let, tento rozdíl v začátku HN koresponduje s údaji v literatuře [5,6].
Alelická kompozice CAG repetic 17/40 u prezentovaného pacienta dává také možnost další úvaze, a sice že onemocnění bylo předáno paternální hereditou od otce, který měl méně repetic, a byl tedy v pásmu normy nebo v pásmu s neúplnou penetrací. U otce pacienta chronické poruchy hybnosti a kognitivních funkcí nebyly zaznamenány, ale zemřel i ve věku, který je nižší než věk našeho pacienta v době záchytu potíží. Maternální přenos rovněž nelze vyloučit, neboť matka pacienta zemřela ve středním věku, tudíž i před případným možným transparentním začátkem onemocnění.
Na CT mozku našeho pacienta (obr. 1) je patrna atrofie mozku, leukoaraióza není výrazněji vyjádřena, i když byla v popisu snímků uvedena, ale je přítomna již atrofie caput nuclei caudati (CNC), a to oboustranně. K rozvoji makroskopicky patrné atrofie CNC dochází mnoho let před klinickou manifestací HN [8]. Pokud není radiolog předem informován, nemusí těmto změnám věnovat pozornost. Na druhé straně může klinik nadhodnocovat význam a rozsah cévních změn, zejména u pacienta ve vyšší věkové kategorii.
Při současném výskytu chorey, kognitivního deficitu anebo poruchy chování v seniu je vždy nutno myslet jak na běžné příčiny (vaskulární a poléková chorea), tak i na vzácné diagnózy (např. spinocerebelární ataxii typu 17, FXTAS, HN) [1,9]. Je nutno vždy vycházet z komplexního a kompletního vyšetření pacienta, kde možná opomenutí nebo nedostatek informací i z oblasti rodinné a osobní anamnézy mohou výrazně oddálit správné stanovení diagnózy. Stanovení diagnózy HN i přes to, že kauzální terapie je nadále nedostupná, má zásadní význam pro osoby v riziku.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 28. 10. 2017
Přijato do tisku: 10. 4. 2018
MUDr. Pavel Ressner, Ph.D.
Neurologická klinika FN Ostrava
17. listopadu 1790 708 52 Ostrava-Poruba
e-mail: pavel.ressner@seznam.cz
Sources
1. Roth J. Huntingtonova nemoc. Cesk Slov Neurol N 2010; 73/106 (2): 107–123.
2. Chaganti SS, McCruscer EA, Loy CT. What we know about late onset Huntington’s disease? J Huntington Dis 2017; 6 (2): 95–103. doi: 10.3233/JHD-170247.
3. Sun YM, Zhang YB, Wu ZY. Huntington's disease: relationship between phenotype and genotype. Mol Neurobiol 2017; 54(1): 342–348. doi: 10.1007/s12035-015-9662-8.
5. Walker FO. Huntington‘s disease. Lancet 2007; 369 (9557): 218–228.
6. Myers R. Huntington disease genetics. Neuro RX 2004; 1 (2): 255–262. doi: 10.1602/neurorx.1.2.255.
7. Klempíř J, Židovská J, Stochl J et al. The number of CAG repeats within the normal allele does not influence the age of onset in Huntington‘s disease. Mov Disord 2011; 26 (1): 125–129. doi: 10.1002/mds.23436.
8. Aylward EH, Nopoulos PC, Ross CA et al. Longitudinal change in regional brain volumes in prodromal Huntington disease. J Neurol Neurosurg Psychiatry 2011; 82 (4): 405–410. doi: 10.1136/jnnp.2010.208 264.
9. Klempíř J, Mikulenková D, Písačka M et al. Diferenciální diagnostika neuroakantocytóz. Cesk Slov Neurol N 2009; 72/105 (1) : 24–29.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2018 Issue 4-
All articles in this issue
- Detekce nestabilního karotického plátu v prevenci ischemické cévní mozkové příhody
- Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - ANO
- Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - NE
- Agresívna liečba intracerebrálnej hemoragie so znižovaním krvného tlaku a indikáciou operácie
- Léčba cílená na B lymfocyty – významný pokrok v léčbě roztroušené sklerózy
- Možnosti regulace neuroimunitních a neuroendokrinních dějů pomocí fyzioterapie
- Parietální atrofický skór na magnetické rezonanci mozku u normálně stárnoucích osob
- Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie
- Rozdíly v klinických, radiologických a léčebných modalitách intramedulárních arachnoidálních cyst a syringomyelie v oblasti krční páteře – 12 případů
- Vzťah medzi intenzitou tinnitu a mierou senzorineurálnej straty sluchu z aspektu prínosu hyperbarickej oxygenoterapie
- Antiagregačná a antikoagulačná liečba pri karotickej endarterektómii
- Srovnání účinnosti subkutánně podávaného interferonu β-1a 44 μg, dimetyl fumarátu a fingolimodu v reálné klinické praxi – multicentrická observační studie
- Soubor obrázků s protikladnou náročností pojmenovatelnosti
- Faryngo-cerviko-brachiální varianta Guillain-Barrého syndromu
- Oboustranná paréza nervus abducens po úrazu hlavy a krční páteře
- Huntingtonova nemoc se začátkem v seniu – přehlížená diagnóza
- Skoré pooperačné komplikácie po plánovaných operáciách degenerovanej driekovej chrbtice u starších pacientov
- Bradykininem indukovaný angioedém po podání tkáňového aktivátoru plazminogenu u akutní cévní mozkové příhody – terapie s nebo bez inhibitoru C1 esterázy
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Antiagregačná a antikoagulačná liečba pri karotickej endarterektómii
- Oboustranná paréza nervus abducens po úrazu hlavy a krční páteře
- Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie
- Huntingtonova nemoc se začátkem v seniu – přehlížená diagnóza
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

