-
Medical journals
- Career
Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie
: I. Humhej 1; I. Ibrahim 2; M. Sameš 1; Jaroslav Tintěra 2; D. Hořínek 3; I. Čižmář 4
: Neurochirurgická klinika FZS UJEP, Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem o. z. 1; Základna radiodiagnostiky a intervenční radiologie, IKEM, Praha 2; Neurochirurgická klinika dětí a dospělých 2. LF UK a FN Motol, Praha 3; Traumatologická klinika LF UP a FN Olomouc 4
: Cesk Slov Neurol N 2018; 81(4): 420-426
: Original Paper
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amcsnn2018csnn.eu3Cíl: Vyvinout vyšetřovací protokol umožňující zobrazení funkční integrity a mikrostrukturálního postižení periferních nervů (PN) v různých lokalitách pomocí difuzního tenzoru (DTI). Následně implementovat vyšetřovací protokol do klinické praxe.
Soubor a metodika:
Vyšetřili jsme 15 zdravých dobrovolníků a 15 pacientů na 3T MR přístroji pomocí metody DTI. Snažili jsme se zobrazit brachiální plexus, lumbosakrální plexus a průběh PN na končetinách u zdravých dobrovolníků. U pacientů jsme cílili vyšetření na postižené úseky PN za účelem zobrazit tyto patologie.Výsledky:
Podařilo se nám získat validní zobrazení brachiálního i lumbosakrálního plexu a průběhu PN na končetinách pomocí DTI. Setkali jsme se s některými limitacemi metody, zejména pohybovými artefakty, narušujícími kvalitní zobrazení nervových struktur, a problémy s odlišením nervových vláken od vláken svalových. Tyto technické problémy mohou být do určité míry eliminovány využitím adekvátních cívek, optimalizací zobrazovacích protokolů a metodikou následného zpracování dat.Závěr:
Přes některé technické limitace práce demonstruje možnost získat validní zobrazení PN v různých lokalitách prostřednictvím metody DTI. DTI představuje doplňkovou neinvazivní zobrazovací techniku poskytující cenné informace využitelné v rozhodovacím diagnostickém a léčebném procesu u nejrůznějších patologií PN. Technologický pokrok a další zdokonalování metod MR v budoucnu pravděpodobně povede k rozšíření a širšímu uplatnění této techniky v klinické praxi.Klíčová slova:
magnetická rezonance – zobrazení difuzního tenzoru – MR traktografie – periferní nervy – brachiální plexus – lumbosakrální plexusÚvod
MR je vyšetřovací metoda umožňující excelentní zobrazení měkkých tkání a patří dnes k běžně využívaným zobrazovacím modalitám. Představuje dominantní techniku nejen ke zobrazení CNS (mozku a míchy), ale stále častěji i ke znázornění periferních nervů (PN) v různých lokalitách. Ke zobrazení PN lze využít konvenční techniky MR, mezi které patří např. T1 vážené, T2 vážené, proton denzitní a STIR (short tau inversion recovery) sekvence, dále techniku k selektivnímu zobrazení PN zvanou MR neurografie (MRN) poskytující přesné 3D anatomické zobrazení PN na základě zvýraznění jejich signálů a v poslední době i zobrazení pomocí difuzního tenzoru (diffusion tensor imaging; DTI). Konvenční kvalitativní metody MR sice poskytují vynikající rozlišení měkkých tkání, nicméně neumožňují zachytit některé bližší strukturální detaily nervových struktur, např. bílé hmoty mozkové a intraneurálně lokalizovaných vláken. Tuto nevýhodu doplňuje metoda DTI, která poskytuje možnost kvantitativně zobrazit jak dráhy bílé hmoty mozku, tak jednotlivá vlákna PN a měřit jejich integritu [1].
DTI představuje poměrně novou metodu, jejíž technické základy byly poprvé popsány v roce 1994 [2]. Vychází z principů difuzí váženého zobrazení (diffusion weighted imaging; DWI), které odráží difuzivitu molekul vody (protonů vodíku vázaných v molekulách vody) ve tkáni. Využívá přídatných magnetických gradientů, které konvenční MR sekvence neobsahují [3]. Difuze (Brownův pohyb) hraje v biologickém prostředí důležitou roli při transportu životně důležitých metabolitů a poskytuje informaci o mikrostruktuře dané tkáně. Difuze molekul vody je v různých biologických systémech rozdílná v závislosti na geometrii a fyzikálně-chemických vlastnostech tkáně. Přítomnost některých struktur (jako jsou např. buněčné membrány, myelinové obaly axonů, makromolekuly) představuje překážky či omezení pro pohyb molekul vody v určitých směrech. Neuronální axony jsou příkladem prostředí, ve kterém je míra difuze vysoce závislá na mikroarchitektuře nervových vláken. Nejsnadněji probíhá ve směru dlouhé osy axonů. Naopak v kolmé ose je omezená, protože difuzi brání myelinové pochvy a neuronální buněčné membrány (anizotropní difuze) [1,3]. Rozpad myelinových pochev či buněčných membrán axonů u nejrůznějších patologií PN je spojen se snížením anizotropie zachytitelným pomocí invariantních veličin DTI. Nejpoužívanějšími veličinami jsou frakční anizotropie (FA – skalární veličina odvozená od vlastních hodnot matice tenzoru [eigenvalues] udávající míru anizotropie v každém voxelu, která odráží uspořádání a mikroarchitekturu tkáně) a aparentní difuzní koeficient (ADC – udávající průměrnou difuzivitu v každém voxelu bez ohledu na směr difuze v tkáních). Teoretické základy difuze vč. zpracování dat DWI byly detailněji popsány v roce 2013 Ibrahimem et al [4].
Následné softwarové zpracování získaných dat umožňuje 3D zobrazení průběhu nervových drah v prostoru, takzvanou MR traktografii (diffusion tensor tractography; DTT). DTT je založena na „stopování“ (fiber-tracking) převládajícího směru difuze v jednotlivých voxelech za předpokladu, že ten odpovídá skutečnému průběhu nervových vláken [5]. K vytvoření přesnější anatomické představy DTT umožňuje vytvoření projekce průběhu nervových drah do základních strukturálních obrazů konvenčních MR sekvencí [3].
V klinické praxi se metoda DTI široce a úspěšně využívá k vizualizaci traktů bílé hmoty mozku, což má velký význam zejména v rámci předoperačního plánování u pacientů s tumory a jinými ložiskovými lézemi mozku [6]. Zmenšuje se tak riziko subkortikálního poranění důležitých drah, které by vedlo ke vzniku neurologického deficitu. První využití metody DTT v neuronavigaci při resekcích tumorů mozku v ČR provedli v roce 2008 Zolal et al [7].
V posledních letech se metoda DTI začíná využívat k zobrazování PN jak na zvířecích modelech [8 – 11], tak v humánní medicíně [12 – 16]. Fakt, že DTI měří funkční integritu a odráží i mikrostrukturální postižení PN, lze využít zejména u zavřených poranění PN, např. trakčních lézí brachiálního nebo lumbosakrálního plexu, některých vzácných či atypických úžinových syndromů a tumorů PN. U všech zmíněných patologií PN mohou informace z DTI ovlivnit strategii léčebného postupu.
Vyvinutí vyšetřovacího protokolu umožňujícího zobrazit PN pomocí metody DTI a následné využití protokolu v klinické praxi u pacientů s postižením PN představovalo cíl naší práce.
Soubor a metodika
Vyšetření na 3T MR přístroji (Siemens Magnetom Trio, Erlangen, Německo) pomocí metody DTI podstoupilo, po získání informovaného souhlasu, 15 zdravých dobrovolníků (10 mužů, 5 žen; průměrný věk 32 let; rozptyl 19 – 46 let) a 15 pacientů (6 mužů, 9 žen; průměrný věk 41 let; rozptyl 16 – 66 let) s různými afekcemi PN. Za pomoci speciálních vyšetřovacích cívek (krčních a povrchových) jsme se snažili zobrazit brachiální plexus (BP), lumbosakrální plexus (LSP) a průběh PN na končetinách u zdravých dobrovolníků a pacientů s neuropatií PN. Postižení PN u pacientů zahrnovala posttraumatické léze BP, LSP, syndrom horní hrudní apertury (TOS), extralaterální hernie disku bederní páteře a tumory PN. Všichni pacienti byli před provedením DTI neurologicky vyšetřeni, podstoupili elektrofyziologické vyšetření (EMG) a případně některá grafická vyšetření (konvenční MR a event. CT perimyelografii u poranění BP a LSP; RTG, ultrazvuk a konvenční MR u TOS; MR u extralaterálních hernií disku; ultrazvuk a konvenční MR u tumorů PN).
Vyšetřovací protokol
Pro měření MR obrazů pro DTI byla použita sekvence spinového echa s akvizicí dat technikou echo-planar imaging (SE-EPI) s 30 směry difuzních gradientů pro LSP a 64 pro BP a dvěma hodnotami b-faktoru (0 a 700 s/ mm2 pro LSP, 0 a 800 s/ mm2 pro BP). Akcelerační faktor 2, velikost voxelu 3 × 3 × 3 mm3, počet vrstev 80 (pro LSP) a 66 (pro BP) v transverzální rovině. Repetiční/ echo čas (TR/ TE) 12 000/ 80 ms (pro LSP) a 10 000/ 86 ms (pro BP), akviziční čas měření 10 min.
Pro MR neurografické účely byly provedeny 3D T2-STIR obrazy s následujícími parametry: velikost voxelu 1 × 1 × 1 mm3, TR/ TE 1 600/ 150 ms, TI 196 ms a čas měření byl 10 min.
Zpracování dat a analýza
Naměřená data jsou velmi náchylná k několika typům artefaktů (pohybové atrefakty, prostorové distorze obrazů a úbytek signálu v oblastech s velmi rozdílnou susceptibilitou tkání), proto je nutné provést příslušné korekce. V rámci pre-procesu byly tyto korekce dat provedeny v prostředí FSL (Analysis Group, FMRIB, Oxford, UK) (https:/ / fsl.fmrib.ox.ac.uk/ ). Poté následoval výpočet difuzního tenzoru a jeho diagonalizace v každém voxelu. Z vyhodnocených parametrů DTI lze pak zobrazit nervové svazky a také kvantitativně posoudit jejich integritu. Pro rekonstrukci průběhu PN byl použit veřejně dostupný program DSI studio (Fang-Cheng (Frank) Yeh, University of Pittsburgh, PA, USA) (http:/ / dsi-studio.labsolver.org/ ).
Při rekonstrukci průběhu svazků se nejprve vybere startovací oblast (seed point, region of interest; ROI) a algoritmus postupně propojí jednotlivé hlavní vektory voxelů. Tento proces pokračuje tak dlouho, dokud hodnota FA neklesne pod stanovený kritický limit (např. FA 0,3) nebo pokud velikost úhlu mezi hlavními vektory v sousedních voxelech nepřekročí stanovený mezní úhel (např. 45°). Pro rekonstrukci PN byla použita kombinace dvou metod, tzv. brute-force (zobrazení všech nervových svazků, není vybrána žádná specifická startovací oblast) a multi-ROI approach, tedy zobrazení jednotlivých nervů pomocí výběru 2 – 3 oblastí podél průběhu nervu (ROI-1 umístěna proximálně u kořene nervu, ROI-2 uprostřed a ROI-3 distálně, kde byl ještě vidět průběh nervu). Rekonstrukce PN byla provedena metodou Generalized Q-sampling Imaging (GQI, DSI studio), která je založena na denzitě spinů s určitou pravděpodobností difuze v různých směrech. Metoda GQI pracuje s veličinou nazývanou normalizovaná kvantitativní anizotropie (NQA) (místo FA u klasické DTI). Na rozdíl od hodnot FA se totiž NQA významně liší v PN a svalech. Veličina NQA byla prahována hodnotou 0,03 a použitý mezní úhel byl stanoven na 45°. ROI byly vybrány manuálně se stejnou velikostí na obrazech NQA.
Výsledky
Pomocí DTI se nám podařilo získat validní data (kvalitní data se vzájemně srovnatelnými výsledky a s minimem pohybových a susceptibilních artefaktů) u 67 % zdravých dobrovolníků (10/ 15) a 73 % pacientů (11/ 15). U všech jsme následně provedli 3D rekonstrukci nervových svazků technikou DTT a zobrazili tak průběh PN na končetinách (obr. 1, 2), struktury BP (obr. 3, 4) a LSP (obr. 5, 6). Podrobnější charakteristiku souboru vyšetřených pacientů představuje tab. 1.
1. Charakteristika souboru pacientů s afekcemi periferních nervů. 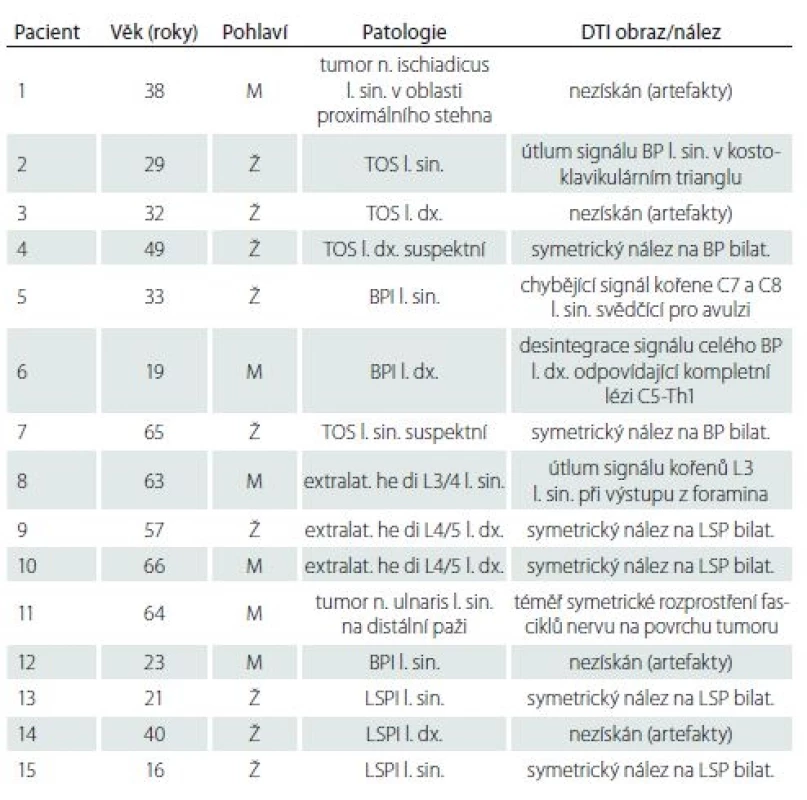
BP – brachiální plexus; BPI – poranění brachiálního plexu; DTI – zobrazení pomocí difuzního tenzoru; extralat. he di – extralaterální hernie disku; l. dx. – vpravo; l. sin – vlevo; M – muž; n. – nervus; LSP – lumbosakrální plexus; LSPI – poranění lumbosakrálního plexu; TOS – thoracic outlet syndrome; Ž – žena 1. MR traktografie nervus ischiadicus vpravo v oblasti stehna u zdravého dobrovolníka (muž, 32 let).
Fig. 1. MR tractography of the right sciatic nerve in the thigh area of a healthy volunteer (male, 32 years).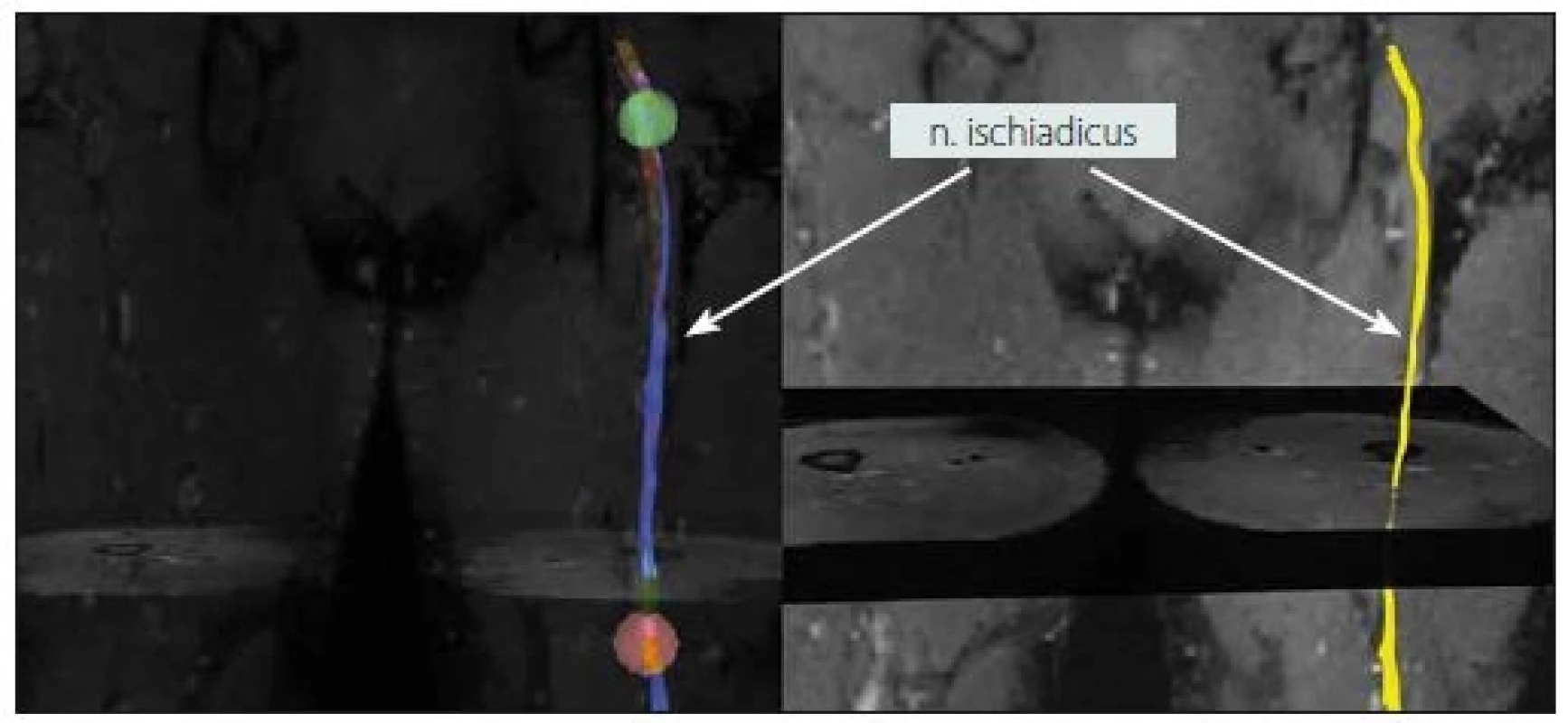
2. MR traktografie nervus ulnaris s tumorem v oblasti levé distální paže zachycující rozprostření fasciklů na povrchu tumoru (muž, 64 let).
Fig 2. MR tractography of the ulnar nerve with a tumor in the distal left arm capturing the spread of the fascicles on the tumor surface (male, 64 years).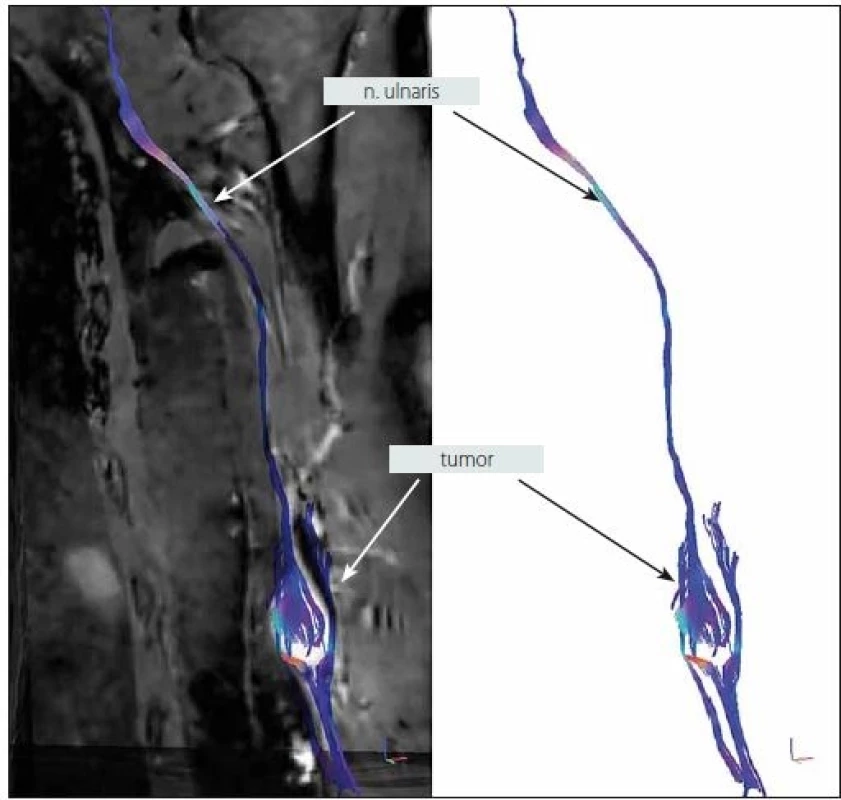
3. MR traktografie oboustranného brachiálního plexu u zdravého dobrovolníka (žena, 24 let).
Fig. 3. MR tractography of the bilateral brachial plexi in a healthy volunteer (female, 24 years).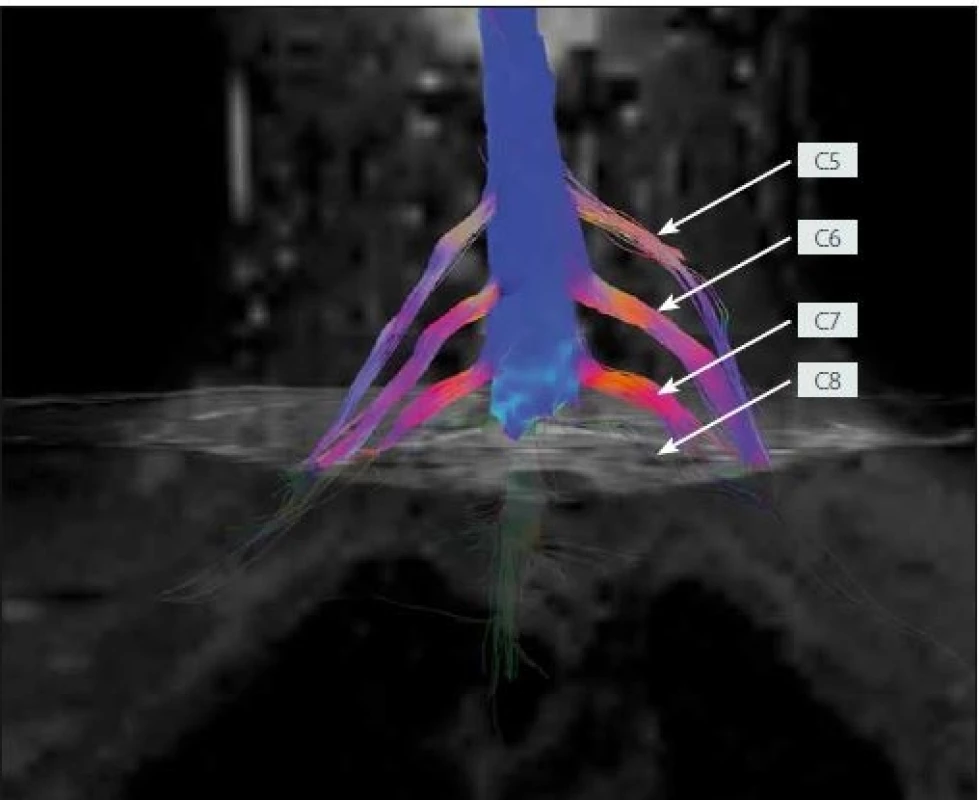
4. MR traktografie oboustranného brachiálního plexu po poranění zobrazující chybějící signál kořenů C7 a C8 vlevo odpovídající avulzi (žena, 33 let).
Fig. 4. MR tractography of the bilateral brachial plexi following injury showing the missing signal of the left C7 and C8 spinal roots corresponding to avulsion (female, 33 years).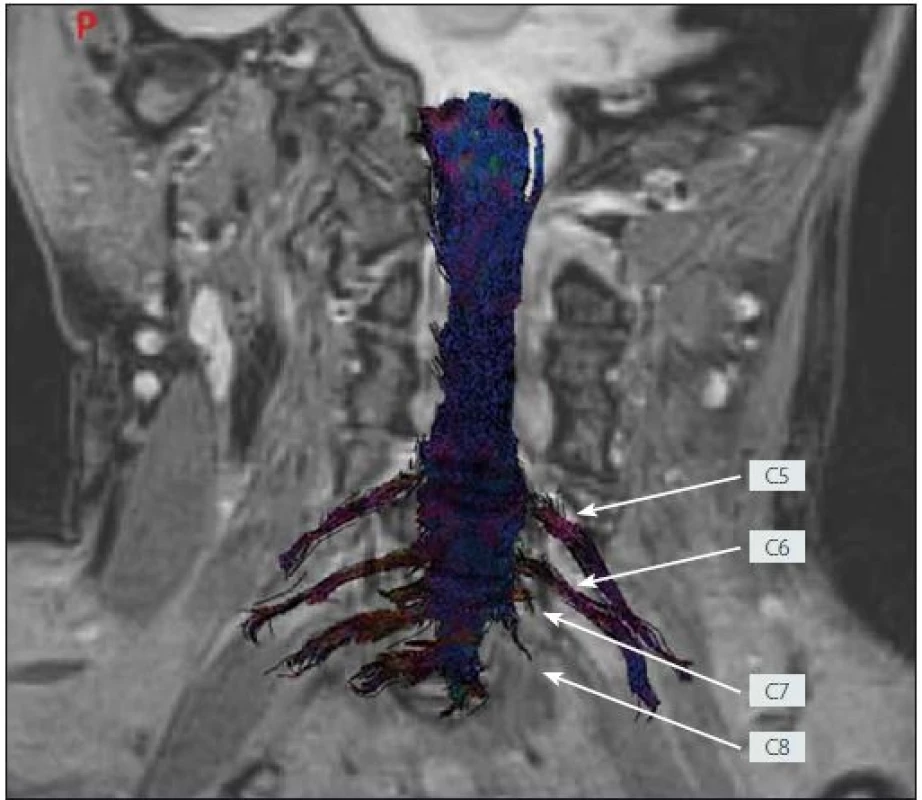
5. MR traktografie oboustranného lumbosakrálního plexu u zdravého dobrovolníka (muž, 25 let).
Fig. 5. MR tractography of the bilateral lumbosacral plexi in a healthy volunteer (male, 25 years).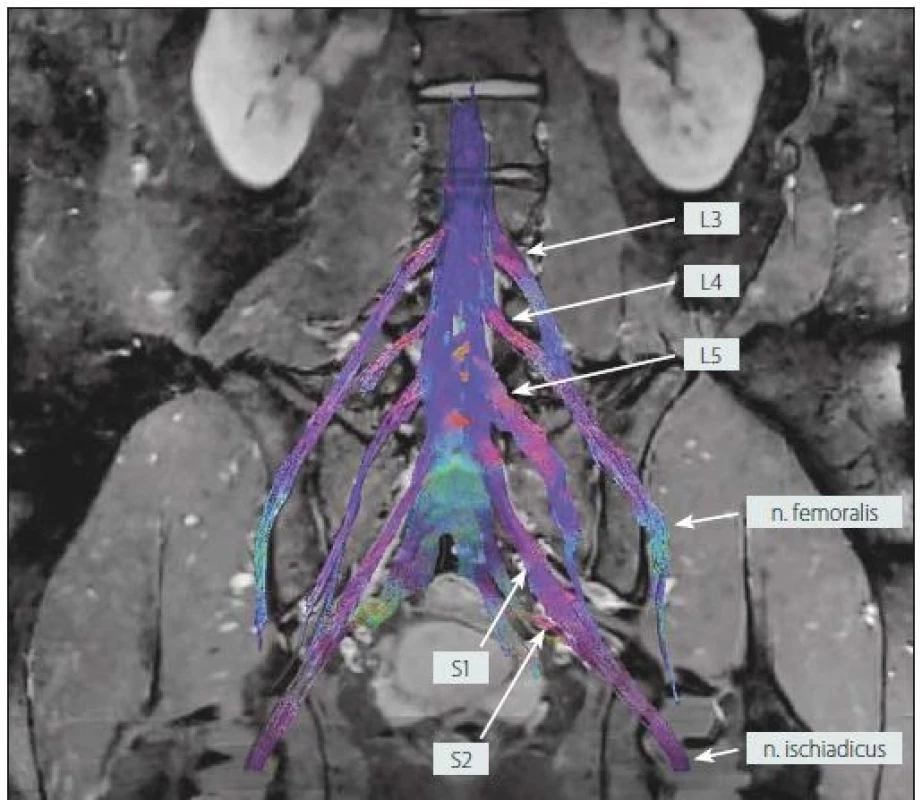
6. 3D MR neurografie (sekvence STIR-SPACE, maximum intensity projection; MIP) – levý obrázek a MR traktografie – pravý obrázek oboustranného lumbosakrálního plexu s nálezem extralaterální hernie disku L3/4 vlevo (muž, 63 let). Na pravém obrázku lze na MR traktografii pozorovat útlum signálu kořene L3 vlevo při jeho výstupu z foramina, což odpovídá lokalizaci extralaterální hernie disku.
Fig. 6. 3D MR neurography (STIR-SPACE sequence, maximum intensity projection; MIP) – left picture and MR tractography – right picture of the bilateral lumbosacral plexi with left L3/4 extralateral disc herniation (male, 63 years). In the right picture, left L3 root signal attenuation can be observed on MR tractography at its exit from the foramen, which corresponds to the localization of the extralateral disc herniation.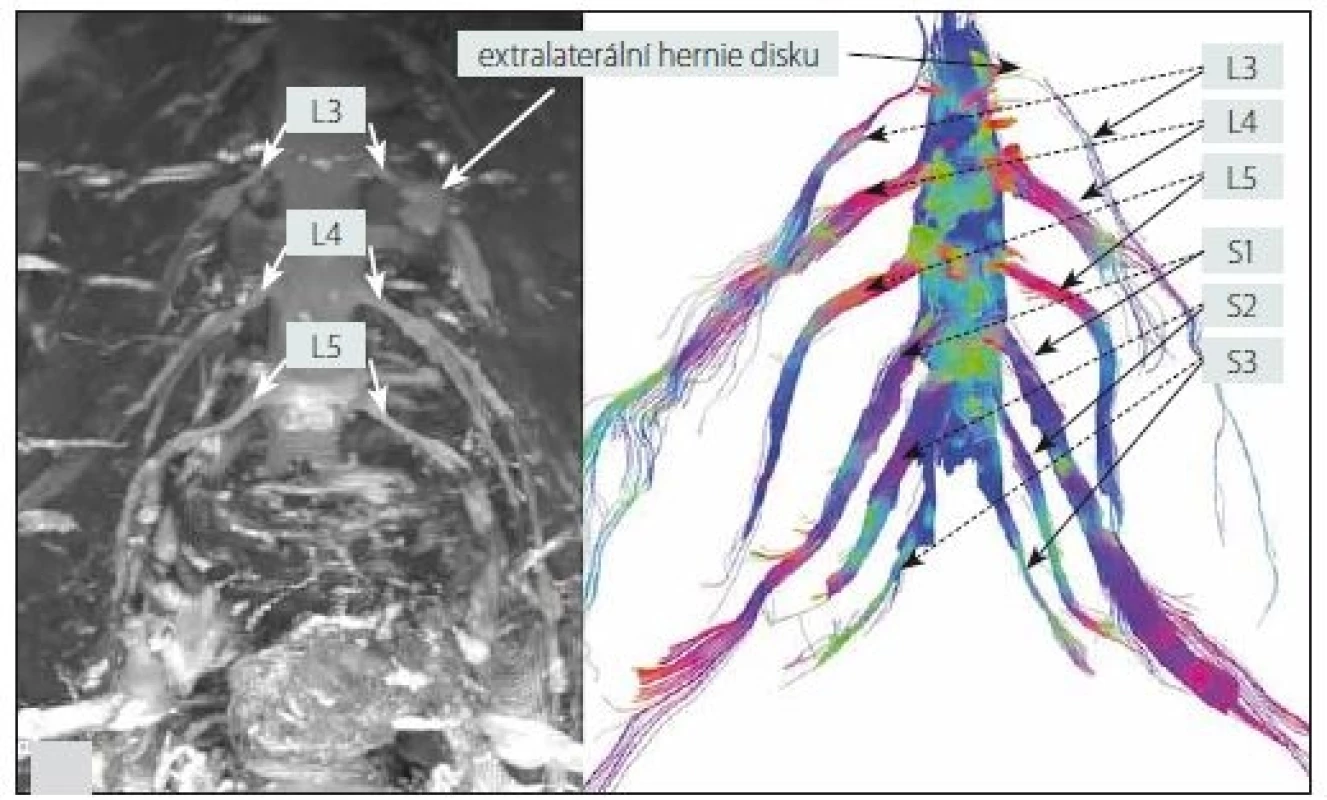
Při získávání a následném zpracování dat (postprocessingu) jsme zaznamenali některé limitace, v jejichž důsledku nebylo možné provést zobrazení nervových struktur metodou DTI u všech vyšetřených dobrovolníků i pacientů. Jednalo se zejména o již zmíněné pohybové a susceptibilní artefakty (distorze nebo změny signálu v důsledku nehomogenit magnetického pole – např. v okolí metalických implantátů) znemožňující získat validní data odpovídající kvality a problémy s odlišením nervových vláken od okolních struktur, zejména pak svalové tkáně.
Diskuze
Metoda DTI byla původně vyvinuta k zobrazení průběhu a strukturální integrity neuronálních traktů bílé hmoty mozku [17], později i krční míchy [18,19]. První úspěšnou aplikaci techniky DTI k zobrazení PN (proximálního úseku nervus ischiadicus u třech zdravých dobrovolníků) provedli v roce 2004 Skorpil et al [20]. Od té doby byla publikována řada prací využívajících metodu DTI u chronických kompresivních neuropatií (např. syndromu karpálního tunelu [21 – 24], syndromu kubitálního tunelu [25,26], TOS [27]), poranění PN [28 – 35] (vč. BP [29 – 31] a LSP [32 – 35]) a tumorů PN [36 – 38]. Tato postižení PN vedou často k mikrostrukturálním změnám (demyelinizaci, axonální degeneraci), které mohou techniky DTI a DTT, na rozdíl od konvenčních metod MR, zobrazit. Tyto pokročilé techniky MR se mohou stát při jejich optimalizaci součástí vyšetřovacích protokolů, a mohou tak být zavedeny do rutinní klinické praxe. Jejich význam a hlavní přínos spatřujeme nejen při zobrazování klinicky zřejmých afekcí PN, ale zejména u některých atypických a vzácných kompresivních neuropatií (např. TOS), kde klinické vyšetření pacienta, elektrofyziologický nález a případná standardní grafická vyšetření nedostačují ke stanovení exaktní diagnózy či určení adekvátního léčebného postupu. Důležitou roli mohou hrát také u pacientů s perzistujícími potížemi po operacích úžinových syndromů nebo u jejich recidiv. Velký přínos mohou techniky DTI a DTT znamenat pro traumata PN, zejména zavřené trakční či kontuzní léze. U těchto poranění umožní získat informace o zachování či ztrátě integrity nervových vláken [39] a případné spontánně probíhající regeneraci ještě před tím, než regenerující axony dosáhnou nejbližších svalových efektorů, a tudíž získáme první EMG známky regenerace PN [28]. Průběh regenerace PN po mikrochirurgických rekonstrukcích představuje další potenciální využití techniky DTI v budoucnu. U tumorů PN může zobrazení průběhu axonálních svazků pomoci v plánování operačního přístupu a bezpečného odstranění tumoru s minimalizací rizika vzniku neurologického deficitu [36,37]. Mezi možné aplikace metody DTI patří rovněž některé polyneuropatie, např. chronická zánětlivá demyelinizační polyneuropatie [40].
Zobrazování PN pomocí DTI s sebou přináší některá omezení a nástrahy. Patří mezi ně zejména limitované prostorové rozlišení s ohledem k relativně malému axiálnímu průměru PN, dále omezená možnost odlišení vyšetřovaných PN od některých paralelně směřujících anatomických struktur (zejména svalů), problematické zobrazení PN umístěných výrazně excentricky v magnetu MR skeneru a také nehomogenity magnetického pole v okolí krku a plic při zobrazování struktur BP [1]. Dostatečně kvalitního zobrazení jsme nebyli schopni dosáhnout u 33 % zdravých dobrovolníků a 27 % pacientů. Existují některé způsoby a doporučení, jak částečně eliminovat výše zmíněné komplikace vyšetření. Patří mezi ně využití optimálních dedikovaných povrchových vícekanálových cívek (problém zejména při vyšetření BP a některých periferních partií končetin), umístění vyšetřované části těla co nejblíže středu magnetu MR skeneru (např. pozice na břiše se vzpaženou horní končetinou umístěnou v magnetu při vyšetření PN v této oblasti), vypodložení a fixace vyšetřované části těla za účelem eliminace pohybových artefaktů a v neposlední řadě zkrácení vyšetřovacího času využitím vícekanálových cívek a paralelních akvizičních technik (snížení rizika pohybových artefaktů) [1].
Konkrétní typ použité sekvence a její nastavení záleží hlavně na síle použitého magnetického pole a na výrobci MR systému. Pro DTT PN momentálně neexistuje standardní protokol a je vždy potřeba optimalizovat sekvence pro danou vyšetřovanou oblast. Při optimalizaci sekvence je žádoucí minimalizovat TE, aby byl max. potlačen negativní vliv T2 relaxace na pokles signálu. Při zpracování dat musíme počítat s tím, že hodnoty FA (FA 0,1 – 0,35) v PN jsou výrazně nižší než v traktech bílé hmoty mozkové. V některých případech může také selhávat koregistrace obrazů DTI a strukturálních obrazů.
Nejčastější důvod získání špatné kvality dat DTI v našem souboru představovaly pohybové artefakty, ať už volní (vyšetřovaným ovlivnitelné), dané pohybem vyšetřované části těla, tak mimovolní (vyšetřovaným neovlivnitelné), způsobené např. respiračními pohyby, pulzací srdce a velkých cév. Některé tyto technické problémy se nám podařilo eliminovat využitím adekvátních povrchových cívek, optimalizací zobrazovacích protokolů s jejich zkrácením a metodikou následného zpracování dat.
Vzhledem k náchylnosti DTI sekvencí k artefaktům daným přítomností kovů (artefakty susceptibility) představuje zobrazení PN v blízkosti metalických implantátů výrazný problém [1].
K dosažení relevantních výsledků zobrazení pomocí techniky DTI je důležitá nejen kvalita naměřených dat, ale i následný postprocessing. V rámci zpracování dat hraje důležitou roli kromě optimalizace použité sekvence pro danou oblast zkušenost při výběru oblasti zájmu, anatomická znalost průběhu jednotlivých nervových svazků a nastavení kritérií jejich rekonstrukce. Teprve poté dochází k vlastní rekonstrukci průběhu nervových vláken v 3D prostoru – vyhotovení traktografie. Klíčové je též správné „odprahování“ struktur PN od okolních tkání (svalů, cév). Během zpracovávání dat se automaticky korigují i některé artefakty (např. distorze obrazu). Postprocessing je relativně časově náročný, v našem souboru zaujímal průměrně 60 min/ vyšetřeného jedince. PN byly rekonstruovány a vizuálně porovnávány s výsledky MR neurografie. Podstatným a vhodným doplňkem by byla kvantifikace difuzních indexů (FA, ADC, radiální difuzivita, axiální difuzivita nebo NQA) a jejich korelace např. s výsledky EMG. Z důvodu malého nehomogenního souboru pacientů s různou lokalizací postižení PN nebyla tato kvantifikace v našem souboru provedena.
Pokud se blíže zaměříme na náš soubor vyšetřených pacientů pomocí metody DTI, můžeme ho rozdělit na dva jedince s tumorem PN, sedm jedinců s afekcí BP (4× TOS, 3× poranění BP) a šest subjektů s postižením LSP (3× extralaterální výhřez disku, 3× poranění LSP). U jednoho pacienta s tumorem proximálního n. ischiadicus se nám nepodařilo získat dostatečně kvalitní data DTI, u druhého pacienta s tumorem n. ulnaris na distální paži jsme zobrazili téměř rovnoměrné rozprostření fasciklů na povrchu tumoru (obr. 2). U skupiny pacientů s pracovní diagnózou TOS jsme v jednom případě nezískali kvalitní data, v jednom případě zachytili oslabení intenzity signálu DTT v oblasti kostoklavikulárního trianglu a u zbývajících dvou pacientů získali symetrický nález v oblasti obou BP. Vysvětlením oboustranně symetrického nálezu může být, že se v obou případech jednalo o suspektní atypický (disputed) TOS, tedy diagnózu diskutabilní, ke které zpravidla dospějeme až vyloučením ostatních možných příčin potíží pacienta, a protože se nejedná o pokročilý útlak BP se zánikovými příznaky, pravděpodobně nemusí být patrný ani grafický korelát na DTI. U třech pacientů s posttraumatickou lézí BP jsme ve dvou případech pomocí DTI získali odpovídající grafický obraz klinickému nálezu při vyšetření a nálezu na standardizovaných zobrazovacích metodách – CT perimyelografii, MR myelografii (1× kompletní léze BP s čtyřkořenovou avulzí, 1× avulze kořene C7 a C8) (obr. 4), v jednom případě byla data znehodnocena artefakty. Všichni tři jedinci s extralaterální hernií disku trpěli klinicky zřejmým iritačním kořenovým syndromem a prokázali jsme u nich odpovídající výhřez ploténky cestou konvenční MR. V jednom případě jsme pomocí DTI zobrazili útlum signálu kořene L3 v místě jeho výstupu z intervertebrálního foramina (obr. 6, kde případ ilustrujeme vč. odpovídajícího nálezu na MR neurografii), ve dvou zbylých případech jsme získali symetrický nález v oblasti LSP bilaterálně. V obou případech se jednalo o pacienty s čistým iritačním syndromem kořene L4 v etáži L4/ 5, bez zánikových příznaků. Je tedy možné, že k útlumu signálu na DTI by došlo až v případě pokročilejší/ těžší nervové komprese. Tři pacienti s poraněním LSP byli vyšetřováni až s několikaměsíčním odstupem od poranění, kdy již docházelo ke známkám regenerace struktur LSP dle kliniky i EMG. Tím můžeme vysvětlit symetrický nález na DTI u dvou těchto pacientů, u třetího se nám bohužel nepodařilo získat validní data. Výše uvedené úvahy nemohou jistě vyloučit falešnou negativitu zobrazení pomocí DTI u některých pacientů. Tento faktor budeme dále zkoumat při vyšetřování dalších pacientů.
V současné fázi vývoje metodiky s hledáním nejoptimálnějšího hardwarového zajištění (nejlépe vyhovující cívky a jejich adekvátní umístění, optimalizace zobrazovacích sekvencí) i softwarového zpracování dat (korekce distorzí, diferenciace měkkých tkání) neovlivňovaly získané výsledky zobrazení PN pomocí DTI a DTT rozhodovací proces týkající se léčebného postupu u naší skupiny pacientů. V této fázi implementace metody poskytovaly jen doplňující informace k výsledkům ostatních standardně zavedených vyšetření. Přesto hodnotíme získaná data pomocí DTI jako povzbudivá s vysokým potenciálem pro budoucí klinické uplatnění.
Závěr
Metody DTI a MR traktografie umožňují 3D zobrazení a kvantitativní hodnocení funkční integrity PN. Zaznamenají i mikrostrukturální změny u řady patologií PN. Poskytují tak nové, pro klinickou praxi mnohdy klíčové informace o průběhu a funkci nervových svazků, jejichž získání konvenční kvalitativní metody MR neumožňují. Dle výsledků dostupné literatury i dle našich zkušeností představuje metoda DTI velmi slibnou neinvazivní vyšetřovací techniku využitelnou u mnohých afekcí PN s potenciálem ovlivnit následný terapeutický postup. V současném stadiu vývoje se jedná zejména o pomocnou výzkumnou metodu. V blízké budoucnosti, v souvislosti s technologickým pokrokem ve vývoji hardwarových i softwarových možností MR, lze však očekávat její postupné zavádění do klinické praxe a širší využití, což může přinést zkvalitnění péče a zlepšení výsledků léčby u vybraných pacientů s postižením PN.
Tato práce byla podpořena grantem AZV MZ ČR č. 17-28587A.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 7. 3. 2018
Přijato do tisku: 24. 5. 2018
MUDr. Ivan Humhej
Neurochirurgická klinika FZS UJEP
Krajská zdravotní, a. s.
Masarykova nemocnice
v Ústí nad Labem o.z.
Sociální péče 3316/12
Ústí nad Labem
e-mail: ivan.humhej@kzcr.eu
Sources
1. Jeon T, Fung MM, Koch KM et al. Peripheral nerve diffusion tensor imaging: overview, pitfalls, and future directions. J Magn Reson Imaging 2017; 47(5): 1171 – 1189. doi: 10.1002/ jmri.25876.
2. Basser PJ, Mattiello J, LeBihan D. MR diffusion tensor spectroscopy and imaging. Biophys J 1994; 66(1): 259 – 267. doi: 10.1016/ S0006-3495(94)80775-1.
3. Keřkovský M, Šprláková-Puková A, Kašpárek T et al.Diffusion tensor imaging – současné možnosti MRzobrazení bílé hmoty mozku. Cesk Slov Neurol N 2010; 73/ 106(2): 136 – 142.
4. Ibrahim I, Tintěra J. Teoretické základy pokročilých metod magnetické rezonance na poli neurověd. Ces Radiol 2013; 67(1): 9 – 19.
5. Mori S, Crain BJ, Chacko VP et al. Three - dimensional tracking of axonal projections in the brain by magnetic resonance imaging. Ann Neurol 1999; 45(2): 265 – 269.
6. Berman J. Diffusion MR tractography as a tool for surgical planning. Magn Reson Imaging Clin N Am 2009; 17(2): 205 – 214. doi: 10.1016/ j.mric.2009.02.002.
7. Zolal A, Sameš M, Vachata P et al. Použití DTI traktografie v neuronavigaci při operacích mozkových nádorů: kazuistiky. Cesk Slov Neurol N 2008; 71/ 104(3): 352 – 357.
8. Takagi T, Nakamura M, Yamada M et al. Visualization of peripheral nerve degeneration and regeneration: monitoring with diffusion tensor tractography. Neuroimage 2009; 44(3): 884 – 892. doi: 10.1016/ j.neuroimage.2008.09.022.
9. Lehmann HC, Zhang J, Mori S et al. Diffusion tensor imaging to assess axonal regeneration in peripheral nerves. Exp Neurol 2010; 223(1): 238 – 244. doi: 10.1016/ j.expneurol.2009.10.012.
10. Morisaki S, Kawai Y, Umeda M et al. In vivo assessment of peripheral nerve regeneration by diffusion tensor imaging. J Magn Reson Imaging 2011; 33(3): 535 – 542. doi: 10.1002/ jmri.22442.
11. Boyer RB, Kelm ND, Riley DC et al. 4.7-T diffusion tensor imaging of acute traumatic peripheral nerve injury. Neurosurg Focus 2015; 39(3): E9. doi: 10.3171/ 2015.6.FOCUS1590.
12. Jambawalikar S, Baum J, Button T et al. Diffusion tensor imaging of peripheral nerves. Skeletal Radiol 2010; 39(11): 1073 – 1079. doi: 10.1007/ s00256-010-0974-5.
13. Hiltunen J, Suortti T, Arvela S et al. Diffusion tensor imaging and tractography of distal peripheral nerves at 3 T. Clin Neurophysiol 2005; 116(10): 2315 – 2323. doi: 10.1016/ j.clinph.2005.05.014.
14. Zhou Y, Kumaravel M, Patel VS et al. Diffusion tensor imaging of forearm nerves in humans. J Magn Reson Imaging 2012; 36(4): 920 – 927. doi: 10.1002/ jmri.23709.
15. Skorpil M, Engström M, Nordell A. Diffusion-direction-dependent imaging: a novel MRI approach for peripheral nerve imaging. Magn Reson Imaging 2007; 25(3): 406 – 411. doi: 10.1016/ j.mri.2006.09.017.
16. Simon NG, Lagopoulos J, Gallagher T et al. Peripheral nerve diffusion tensor imaging is reliable and reproducible. J Magn Reson Imaging 2016; 43(4): 962 – 969. doi: 10.1002/ jmri.25056.
17. Chenevert TL, Brunberg JA, Pipe JG. Anistropic diffusion in human white matter: demonstration with MR techniques in vivo. Radiology 1990; 177(2): 401 – 405.
18. Bammer R, Fazekas F, Augustin M et al. Diffusion-weighted MR imaging of the spinal cord. AJNR Am J Neuroradiol 2000; 21(3): 587 – 591.
19. Song T, Chen WJ, Yang B et al. Diffusion tensor imaging in the cervical spinal cord. Eur Spine J 2011; 20(3): 422 – 428. doi: 10.1007/ s00586-010-1587-3.
20. Skorpil M, Karlsson M, Nordell A. Peripheral nerve diffusion tensor imaging. Magn Reson Imaging 2004; 22(5): 743 – 745. doi: 10.1016/ j.mri.2004.01.073.
21. Kwon BC, Koh SH, Hwang SY. Optimal parameters and location for diffusion-tensor imaging in the diagnosis of carpal tunnel syndrome: a prospective matched case-control study. AJR Am J Roentgenol 2015; 204(6): 1248 – 1254. doi: 10.2214/ AJR.14.13371.
22. Guggenberger R, Markovic D, Eppenberger P et al. Assessment of median nerve with MR neurography by using diffusion-tensor imaging: normative and pathologic diffusion values. Radiology 2012; 265(1): 194 – 203. doi: 10.1148/ radiol.12111403.
23. Naraghi A, da Gama Lobo L, Menezes R et al. Diffusion tensor imaging of the median nerve before and after carpal tunnel release in patients with carpal tunnel syndrome: feasibility study. Skeletal Radiol2013; 42(10): 1403 – 1412. doi: 10.1007/ s00256-013-1670-z.
24. Hiltunen J, Kirveskari E, Numminen J et al. Pre - and post-operative diffusion tensor imaging of the median nerve in carpal tunnel syndrome. Eur Radiol 2012; 22(6): 1310 – 1319. doi: 10.1007/ s00330-012-2381-x.
25. Breitenseher JB, Kranz G, Hold A et al. MR neurography of ulnar nerve entrapment at the cubital tunnel: a diffusion tensor imaging study. Eur Radiol 2015; 25(7): 1911 – 1918. doi: 10.1007/ s00330-015-3613-7.
26. Iba K, Wada T, Tamakawa M et al. Diffusion-weighted magnetic resonance imaging of the ulnar nerve in cubital tunnel syndrome. Hand Surg 2010; 15(1): 11 – 15. doi: 10.1142/ S021881041000445X.
27. Magill ST, Brus-Ramer M, Weinstein PR et al. Neurogenic thoracic outlet syndrome: current diagnostic criteria and advances in MRI diagnostics. Neurosurg Focus 2015; 39(3): E7. doi: 10.3171/ 2015.6.FOCUS15219.
28. Gallagher TA, Simon NG, Kliot M. Diffusion tensor imaging to visualize axons in the setting of nerve injury and recovery. Neurosurg Focus 2015; 39(3): E10. doi: 10.3171/ 2015.6.FOCUS15211.
29. Gasparotti R, Lodoli G, Meoded A et al. Feasibility of diffusion tensor tractography of brachial plexus injuries at 1.5 T. Invest Radiol 2013; 48(2): 104 – 112. doi: 10.1097/ RLI.0b013e3182775267.
30. Ho MJ, Manoliu A, Kuhn FP et al. Evaluation of reproducibility of diffusion tensor imaging in the brachial plexus at 3.0 T. Invest Radiol 2017; 52(8): 482 – 487. doi: 10.1097/ RLI.0000000000000363.
31. Tagliafico A, Calabrese M, Puntoni M et al. Brachial plexus MR imaging: accuracy and reproducibility of DTI-derived measurements and fibre tractography at 3.0-T. Eur Radiol 2011; 21(8): 1764 – 1771. doi: 10.1007/ s00330-011-2100-z.
32. Budzik JF, Verclytte S, Lefebvre G et al. Assessment of reduced field of view in diffusion tensor imaging of the lumbar nerve roots at 3 T. Eur Radiol 2013; 23(5): 1361 – 1366. doi: 10.1007/ s00330-012-2710-0.
33. van der Jagt PK, Dik P, Froeling M et al. Architectural configuration and microstructural properties of the sacral plexus: a diffusion tensor MRI and fiber tractography study. Neuroimage 2012; 62(3): 1792 – 1799. doi: 10.1016/ j.neuroimage.2012.06.001.
34. Shi Y, Zong M, Xu X et al. Diffusion tensor imaging with quantitative evaluation and fiber tractography of lumbar nerve roots in sciatica. Eur J Radiol 2015; 84(4): 690 – 695. doi: 10.1016/ j.ejrad.2015.01.006.
35. Kanamoto H, Eguchi Y, Oikawa Y et al. Visualization of lumbar nerves using reduced field of view diffusion tensor imaging in healthy volunteers and patients with degenerative lumbar disorders. Br J Radiol 2017; 90(1080): 20160929. doi: 10.1259/ bjr.20160929.
36. Schmidt M, Kasprian G, Amann G et al. Diffusion tensor tractography for the surgical management of peripheral nerve sheath tumors. Neurosurg Focus 2015; 39(3): E17. doi: 10.3171/ 2015.6.FOCUS15228.
37. Cage TA, Yuh EL, Hou SW et al. Visualization of nerve fibers and their relationship to peripheral nerve tumors by diffusion tensor imaging. Neurosurg Focus 2015; 39(3): E16. doi: 10.3171/ 2015.6.FOCUS15235.
38. Chhabra A, Thakkar RS, Andreisek G et al. Anatomic MR imaging and functional diffusion tensor imaging of peripheral nerve tumors and tumorlike conditions. AJNR Am J Neuroradiol 2013; 34(4): 802 – 807. doi: 10.3174/ ajnr.A3316.
39. Heckel A, Weiler M, Xia A et al. peripheral nerve diffusion tensor imaging: assessment of axon and myelin sheath integrity. PLoS One 2015; 10(6): e0130833. doi: 10.1371/ journal.pone.0130833.
40. Kronlage M, Pitarokoili K, Schwarz D et al. Diffusion tensor imaging in chronic inflammatory demyelinating polyneuropathy: diagnostic accuracy and correlation with electrophysiology. Invest Radiol 2017; 52(11): 701 – 707. doi: 10.1097/ RLI.0000000000000394.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2018 Issue 4-
All articles in this issue
- Detection of unstable carotid plaque in ischemic stroke prevention
- Aggressive treatment of intracerebral hemorrhage with lowering of blood pressure and indication of surgery - YES
- Aggressive treatment of intracerebral hemorrhage with lowering of blood pressure and indication of surgery - NO
- Aggressive treatment of intracerebral hemorrhage with lowering of blood pressure and indication of surgery - COMMENT
- Treatment targeted for B lymphocytes – significant progress in the treatment of multiple sclerosis
- Possibilities of regulation of neuroimmune and neuroendocrine processes using physiotherapy
- Parietal atrophy score on magnetic resonance imaging of the brain in normally aging people
- Imaging of peripheral nerves using diffusion tensor imaging and MR tractography
- The differences in clinical, radiological and treatment modalities of cervical intramedullary arachnoid cysts and cervical syringomyelia – report of 12 cases
- The relationship between tinnitus intensity and the degree of sensorineural hearing loss from the aspect of contribution of hyperbaric oxygen therapy
- Antiplatelet and anticoagulant therapy in carotid endarterectomies
- A comparison of efficacy of subcutaneous interferon β-1a 44 μg, dimethyl fumarate and fingolimod in the real-life clinical practise – a multicenter observational study
- A set of pictures with the opposite difficulty of naming
- Pharyngo-cervico-brachial variant of Guillain-Barré syndroma
- Bilateral abducens nerve palsy after head and cervical spinal injury
- Late-onset Huntington’s disease – an overlooked diagnosis
- Early postoperative complications after elective degenerative lumbar spine surgery in elderly patients
- Orolingual bradykinin angioedema after tissue plasminogen activator in acute stroke – treatment with or without C1-esterase inhibitor
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Antiplatelet and anticoagulant therapy in carotid endarterectomies
- Bilateral abducens nerve palsy after head and cervical spinal injury
- Imaging of peripheral nerves using diffusion tensor imaging and MR tractography
- Late-onset Huntington’s disease – an overlooked diagnosis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

