-
Medical journals
- Career
Neuropatologické post mortem vyšetření mozku a míchy v deseti bodech – co může neurolog od neuropatologa očekávat při verifikaci klinické diagnózy neurodegenerativního onemocnění?
Authors: Z. Rohan 1,2; R. Rusina 3,4; R. Matěj 1,2
Authors‘ workplace: Oddělení patologie a národní referenční laboratoř TSE-CJN, Thomayerova nemocnice, Praha 1; Ústav patologie, 1. LF UK a VFN v Praze 2; Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN v Praze 3; Oddělení neurologie, Thomayerova nemocnice, Praha 4
Published in: Cesk Slov Neurol N 2018; 81(1): 109-114
Category: Neuropathological window
doi: https://doi.org/10.14735/amcsnn2018109Overview
Standardizované neuropatologické vyšetření mozku a míchy je zásadní formou zpětné vazby pro ošetřující lékaře u neurodegenerativních onemocnění. Klinicky lze diagnózu tohoto typu onemocnění po splnění diagnostických kritérií určit v úrovni „možné“ a „pravděpodobné“. Autoptické vyšetření je až na výjimky jedinou možností, jak stanovit definitivní diagnózu u onemocnění, která se projevují jako demence, poruchy chování či různě vyjádřené poruchy hybnosti. Tím se nejen stává zcela zásadní modalitou pro vlastní diagnostiku, ale hraje klíčovou úlohu v hodnocení potenciálních změn asociovaných s terapií a při analýze nových potenciálních biomarkerů. Pitva mozku a míchy probíhá podle standardizovaného protokolu založeného na odběru přesně definovaných struktur, které jsou následně vyšetřeny pomocí standardních i speciálních histologických a histochemických barvení a zejména sady definovaných imunohistochemických metod umožňujících přesné zařazení neurodegenerativních entit. Účelem tohoto sdělení je v 10 bodech informativně seznámit klinické neurology se základními aspekty neuropatologického vyšetření pacienta s klinickou diagnózou neurodegenerativního onemocnění, co lze od pitvy očekávat, co požadovat po vyšetřujícím patologovi a jak se orientovat v pitevním výsledkovém protokolu
Klíčová slova:
demence – neurodegenerativní onemocnění – pitva mozku – biopsie mozkuÚvod
Neuropatologické vyšetření mozku je zlatý standard morfologické diagnózy onemocnění centrální nervové soustavy (CNS). Mozková autopsie je jediná metoda umožňující definitivní diagnózu většiny neurodegenerativních onemocnění a dalších lézí CNS, jejichž etiologie nebyla za života pacienta objasněna.
Podobně jako v jiných oblastech medicíny je i na poli neuropatologickém mezioborová spolupráce základem účinné zpětné vazby a zdrojem poučení pro klinika i pro neuropatologa.
V následujícím textu shrnujeme deset hlavních významů neuropatologického post mortem vyšetření.
1. V čem je hlavní přínos autopsie mozku pro neurologa?
Pitva mozku je žádoucí u každého pacienta s klinickými projevy kognitivního deficitu nebo poruchy hybnosti, včetně pacientů s klinicky „jistou“ diagnózou neurodegenerativního onemocnění, na léčbě levodopou či kognitivy.
Klinická diagnostika neurodegenerací se v posledních letech dramaticky zlepšila díky pokrokům na poli neurověd a dostupností různých biomarkerů (specifické proteiny detekovatelné v séru a v mozkomíšním moku, MR volumometrie, PET/ SPECT s využitím receptorových nebo proteinových ligandů, včetně možností in vivo detekce beta amyloidu a tau proteinu, aj.).
Celosvětově používaná diagnostická kritéria pro jednotlivé nozologické jednotky umožňují v klinické praxi dosáhnout míry pravděpodobnosti jen na úrovni „možné/ possible“ nebo „pravděpodobné/ probable“; definitivní diagnózu potvrdí právě až specializované neuropatologické vyšetření mozku.
Pitva mozku je velmi důležitá i u pacientů zařazených do klinických, genetických a biomarkerových studií, protože jen tak je zajištěno stanovení definitivní diagnózy pacienta, což následně umožní validovat reálný přínos těchto studií pro rutinní praxi.
2. Jak častá je shoda mezi klinickou diagnózou a neuropatologickými nálezy aneb dokáže neuropatolog překvapit klinika?
Analýzy větších souborů neurodegenerativních onemocnění ze špičkových pracovišť nacházejí klinicko-neuropatologický nesoulad až v 15 – 20 % případů. Tedy u každého pátého pacienta nachází neuropatolog jiné onemocnění, než odpovídalo klinické diagnóze [1,2]!
Výjimkou jsou geneticky potvrzené případy dědičných onemocnění (např. Huntingtonovy nemoci nebo spinocerebelární ataxie), za určitých okolností také amyotrofická laterální skleróza, pokud jsou splněna EMG kritéria El Escorial/ Awaji-shima pro klinicky jistou amyotrofickou laterální sklerózu [3 – 5].
3.Může být mozek postižen i více neurodegenerativními onemocněními současně?
V poslední době se ukazuje, že neurodegenerace se mohou vzájemně kombinovat: buď komorbidity v podobě dvou „čistých“ onemocnění (např. plně rozvinutá Alzheimerova nemoc i plně rozvinutá demence s Lewyho tělísky u téhož pacienta současně), nebo jako souběh jednoho neurodegenerativního onemocnění a dalších specifických proteinových depozit (např. Alzheimerova nemoc zároveň s depozity TDP-43 proteinu, která ale nesplňují neuropatologická kritéria pro rozvinutou frontotemporální lobární degeneraci).
U pacientů vyššího věku (arbitrárně nad 65 let) přibývá smíšených patologií – většinou kombinace vaskulárních a primárních neurodegenerativních změn [6].
V těchto případech je klinický obraz často kombinovaný, atypický, a míra jistoty klinické diagnózy se většinou snižuje. Právě klinicko-patologická korelace tak objasní atypické projevy nemocnění, příčinu neúspěchu podávané léčby či abnormálních biochemických nálezů v mozkomíšním moku nebo na zobrazovacích metodách [7 – 9].
4.Je nutné u neurodegenerací počkat až na provedení pitvy, nestačila by biopsie?
Na rozdíl od tumorů, některých zánětů a epilepsií, kde se biopsie (otevřená a/ nebo stereotaktická) rutinně provádí, je u neurodegenerativních onemocnění indikována jen zcela výjimečně.
Senzitivita otevřené mozkové biopsie u rychle progredující demence bez nálezu expanzivního procesu na MR nepřesahuje 35 %, nejčastějším bioptickým nálezem bývají Creutzfeldtova-Jakobova nemoc a amyloidová angiopatie [10].
Medicínský přínos mozkové biopsie u demencí s negativním MR nálezem je tedy jen omezený a s přihlédnutím k riziku iatrogenního přenosu prionového onemocnění by měla být indikována pouze, pokud existuje jasná diferenciální diagnostická hypotéza léčitelného onemocnění (vaskulitida, lymfom, encefalitida).
5.Jaké jsou právní aspekty autopsií? Existují případy, kdy je pitva mozku ze zákona povinná?
Pokud má klinik zájem o provedení pitvy mozku (typicky pro diagnosticko-výzkumné účely, se souhlasem pacienta, jeho právního zástupce nebo osoby blízké), měl by tento požadavek zapsat do dokumentace pacienta. Je tak lépe zajištěno, aby pacienti zemřelí na pracovištích následné péče byli lékařem, který vyplňuje List o prohlídce zemřelého, indikováni k „pitvě mozku se zaměřením na vyšetření neurodegenerativních onemocnění“. Právním aspektům a formulaci souhlasu s pitvou bude věnován samostatný příspěvek v této rubrice.
V ČR, podobně jako v některých dalších státech, je autopsie mozku povinná v souladu s metodickým pokynem Ministerstva zdravotnictví ČR u všech podezření na prionové onemocnění [11].
6.Je nutné pitvat celé tělo, nebo stačí vyjmout pouze mozek?
U pacientů s pokročilou demencí je možné omezit vyšetření na odběr mozkové tkáně (tzv. parciální pitva), což plně dostačuje k potvrzení nejčastějších neurodegenerativních diagnóz: Alzheimerovy nemoci, Parkinsonovy nemoci nebo demence s Lewyho tělísky.
V případě atypických klinických projevů nebo diagnostických rozpaků je nezbytnou součástí patologicko-anatomické pitvy vyšetření všech dalších orgánů, jejichž patologie může mít vliv na stav mozku. Typickým příkladem je nález nádorového onemocnění (zejména u malobuněčného karcinomu plic, kde tumor může mít překvapivě malé rozměry a nemusí být zjištěn při vyšetření zobrazovacími metodami), které může vyvolat paraneoplastické neurologické projevy – limbickou encefalitidu nebo paraneoplastickou mozečkovou degeneraci, často s přítomností paraneoplastických protilátek v séru (např. anti-Yo, anti-Hu).
U pacientů s projevy onemocnění motorického neuronu jsou odebírány vzorky ze svalů končetin (bérec, předloktí), bránice, mezižeberních svalů a z jazyka pro zdokumentování přítomnosti a míry neurogenní atrofie. Na tomto místě je však třeba zdůraznit, že se jedná o velmi orientační vyšetření stavu svalu a v žádném případě nenahrazuje svalovou biopsii.
7.Co se provádí s odebraným mozkem?
Během patologicko-anatomické pitvy je mozek vyjmut z lebky, zvážen a makroskopicky popsán.
Ještě před jeho uložením do nádoby s fixačním roztokem je vhodné odebrat několik vzorků mozkové tkáně k přímému zmražení (do – 20 °C nebo – 80 °C) pro účely diagnostické (provádí se vždy při podezření na prionová onemocnění) a výzkumné.
Ke kryoprezervaci se rutinně odebírá také část parenchymového orgánu (např. slezina, kostní dřeň). Z tohoto materiálu je totiž možné dodatečně doplnit molekulárně-genetické vyšetření, pokud výsledek autopsie ukáže, že by se mohlo jednat o dědičně podmíněné onemocnění (z tkáně mozku a míchy totiž spolehlivou genetickou analýzu nelze provádět).
Mozek se následně fixuje v 10% neutrálním pufrovaném formolu po dobu 2–6 týdnů (optimálně 3 týdny), aby se ve fixací zpevněné tkáni bylo možné dokonale neuroanatomicky orientovat a odebrat vzorky z jednotlivých struktur. To je v nativním mozku krajně obtížné až nemožné. Vyšetření fixovaného mozku začíná detailním makroskopickým popisem, včetně popisu přilehlých cév a obalů. Kmen s mozečkem je oddělen řezem na úrovni mezencefala (v místě odstupu n. III.); mozeček je pak spolu s kmenem nakrájen řezy v axiální rovině (nebo může být vyšetřen zvlášť po jeho odloučení kmene řezem přes pedunkuly). Z koncového mozku s diencefalem a kraniálním úsekem mezencefala jsou v koronární rovině vyhotoveny řezy 5 – 10 mm silné.
Následně jsou detailně vyšetřovány neuroanatomicky a mikroskopicky přesně definované struktury podle standardizovaných mezinárodně uznávaných protokolů (obr. 1, tab. 1) a pro diferenciální diagnostiku a kombinaci neurodegenerací, viz tab. 2 [12].
Image 1. Schéma základního odběru při pitvě mozku. 1 – segment C1; 2 – bulbus; 3 – prodloužená mícha; 4 – pons na úrovni locus coeruleus; 5 – mezencefalon na úrovni odstupu n. III. se substantia nigra; 6 – hemisféra mozečku; 7 – vermis; 8 – frontální kortex (střední frontální závit); 9 – gyrus cinguli; 10 – bazální ganglia – striatum; 11 – somatomotorický kortex; 12 – horní temporální závit (T1); 13 – střední a dolní temporální závit (T2, 3); 14 – přední hipokampus; 15 – zadní hipokampus; 16 – primární zraková kůra Fig. 1. Basic brain areas sampled during autopsy. 1 – C1 segment; 2 – bulbus; 3 – medulla oblongata; 4 – pons at the level of the locus coeruleus; 5 – midbrain at the level of the oculomotor nerve with substantia nigra; 6 – cerebellar hemisphere; 7 – vermis cerebelli; 8 – frontal cortex (middle frontal gyrus); 9 – cingular gyrus; 10 – basal ganglia – striatum; 11 – somatomotor cortex; 12 – superior temporal gyrus (T1); 13 – middle and inferior temporal gyrus (T2, 3); 14 – anterior hippocampus; 15 – posterior hippocampus; 16 – primary visual cortex 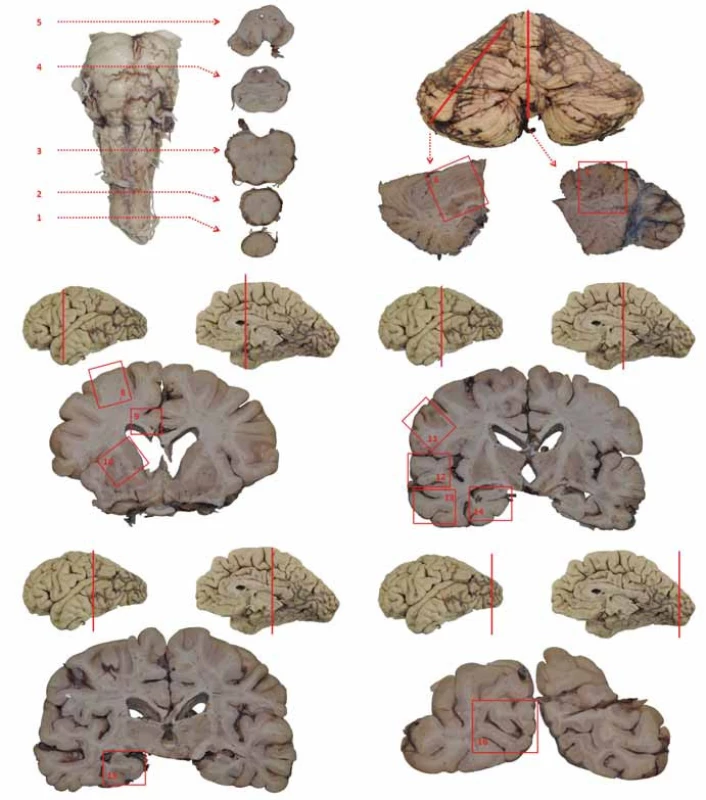
Neuropatolog může podle klinických informací odběr rozšířit, samozřejmě je detailně studována jakákoliv makroskopicky abnormální léze.
Výhodné je pořizování fotodokumentace, která zlepší interpretaci neuropatologického nálezu a umožní korelaci mezi neuropatologickým, neuroradiologickým a klinickým nálezem.
8.Má smysl pitvat i míchu?
Společná pitva mozku a míchy se provádí při klinické diagnóze onemocnění motorického neuronu, roztroušené sklerózy, nejasných neuroinfekcí, polyradikuloneuritidy, spinocerebelárních ataxií nebo dalších vzácných jednotek a metabolických vad (leukodystrofie, lysozomální [střádavá] onemocnění), a rovněž při podezření na hypovitaminózu B1, B9 či B12 (při selektivním deficitu nebo generalizované malnutrici).
Odběr míchy je důležitý i v případech zjevné přidružené autonomní dysfunkce (typicky u mnohočetné systémové atrofie) nebo u frontotemporální demence, která může být provázena klinicky více či méně nápadným postižením motorického neuronu.
Mícha se odebírá ventrálním přístupem z páteřního kanálu od úrovně kaudy až do poloviny krční páteře; kraniální segmenty míchy se vyjímají spolu s mozkem.
V nativním stavu se mícha nijak dále nevyšetřuje, ale vloží se spolu s mozkem do nádoby s fixativem a po dvou až čtyřech týdnech je provedena její pitva spolu s mozkem v jedné době.
Řezy míchou jsou následně barveny metodami pro průkaz myelinu (nejčastěji luxolová modř). Standardem je imunohistochemické znázornění myelinu i neurofilament a potvrzení neuronálních či gliálních inkluzí.
9.Jak se proměnila neuropatologická diagnostika za posledních 30 let?
V minulosti byla neuropatologická diagnostika založena na makroskopickém popisu mozku a použití standardních barvících metod: mozkový parenchym se obarvil hematoxylinem-eosinem. Provádělo se barvení na myelin (luxolová modř) a běžně se používala impregnace stříbrem nebo barvení konžskou červení ke „skríningovému“ záchytu depozit amyloidu a neurofibrilárních klubek v rámci diagnózy a stagingu Alzheimerovy nemoci.
Současná neuropatologická diagnostika je postavena na širokém panelu imunohistochemických protilátek namířených proti specifickým proteinům, které jsou pro danou neurodegeneraci definující [12–14]. Přehled charakteristických proteinů a inkluzí u jednotlivých neurodegenerací shrnuje tab. 3.
Rutinně se používají protilátky rozeznávající nespecifické součásti inkluzí (např. molekuly zapojené do procesu degradace proteinů: ubikvitin, p62) a protilátky detekující specifické proteinové komponenty inkluzí a depozit (tau protein, beta-amyloid, alfa-synuklein, protein TDP-43, prionový protein, huntingtin aj.).
Neuropatologická diagnostika je časově náročná a doba od pitvy po stanovení definitivní diagnózy neurodegenerativního onemocnění může trvat i 3 měsíce. Relativně dlouhá časová náročnost je daná užitím speciálních metodik, kterými je podmíněna vysoká diagnostická přesnost, jíž nelze, kromě jednotlivých a přesně definovaných případů, v současné době dosáhnout jinak (obr. 2).
Image 2. Vztah mezi přesností diagnózy a intervalem od provedení pitvy. Nejméně diagnosticky přínosné je makroskopické zhodnocení mozku ať už v nativním stavu či po jeho fixaci. K dosažení přesné finální diagnózy je třeba fixovaný mozek vyšetřit mikroskopicky za užití standardních barvení a speciálních imunohistochemických metod. Zvláštní postavení má detekce patologické formy prionového proteinu metodou western blot, která může poskytnout výsledek do druhého dne po pitvě pacienta. Molekulárně genetické vyšetření (vpravo) lze využít ke stanovení vlastní diagnózy (např. Huntingtonovy nemoci) nebo k detekci familiárních forem neurodegenerativních onemocnění a může trvat, podle počtu a spektra testovaných genů, i několik měsíců. Fig. 2. Relationship between diagnostic accuracy and time from autopsy. Macroscopic examination of either the native or fixated brain has the lowest diagnostic accuracy. For achieving the highest possible accuracy, the brain has to be examined under the microscope using both standard and special immunohistochemical staining techniques. Western blot detection of proteinase-resistant prion protein can, however, provide results already on the next day after the autopsy. Genetic analysis (right) can, in selected neurodegenerative diseases (e.g. Huntington’s disease), be diagnostic or can be used to assess the presence of heritable pathological mutations in selected genes associated with neurodegenerative diseases. This may take several months depending on what and how many genes are tested and by which method. 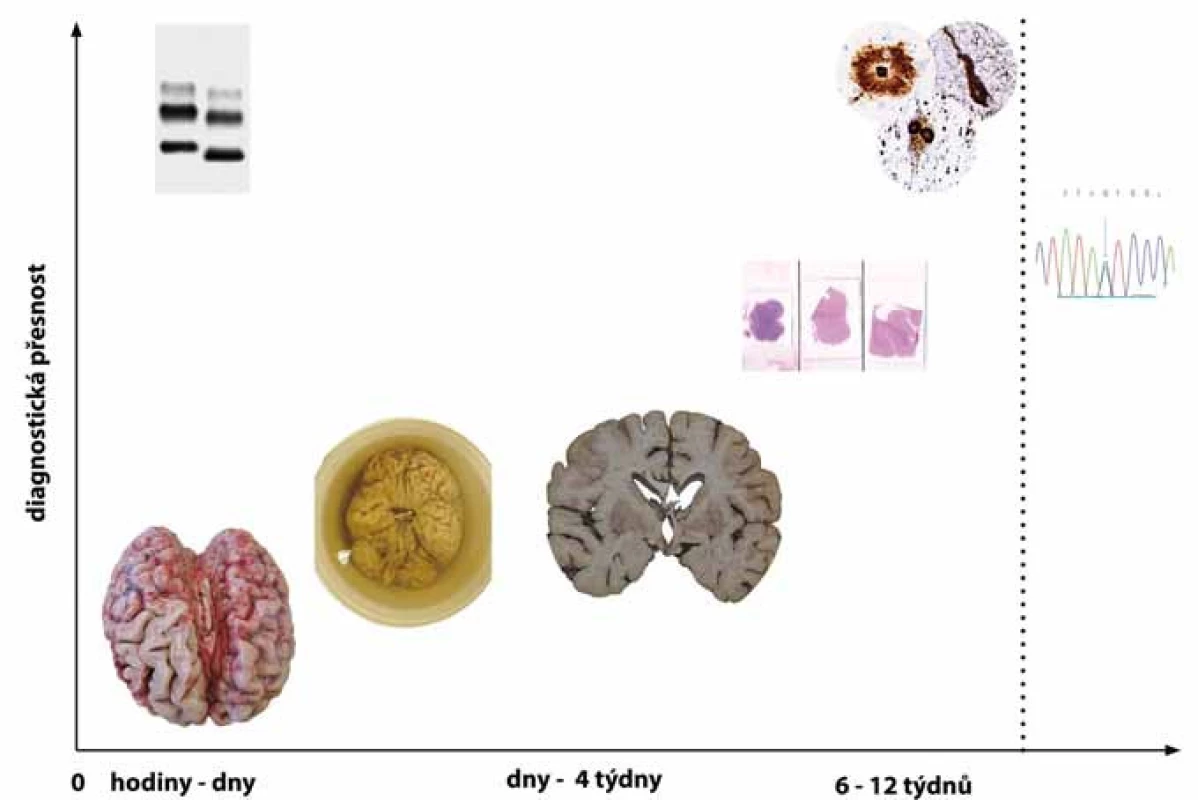
10.Může neuropatologické post mortem vyšetření mozku a míchy provádět každé pracoviště patologie?
Neuropatologické vyšetření probíhá podle standardizovaného protokolu a během diagnostického procesu je využito širokého panelu imunohistochemických protilátek a provádí se vyšetření molekulárně-patologická i imunologická.
Tyto metody jsou většinou dostupné jen na specializovaných pracovištích, kam lze převézt tělo zemřelého po dohodě s poskytovateli pohřebních služeb.
Pokud převoz těla zemřelého není možný, je možné provést patologicko-anatomickou pitvu na jakémkoliv oddělení patologie – v tomto případě je třeba pitvající patology explicitně požádat, aby odebrali mozek a míchu, oba orgány uložili vcelku do fixačního roztoku a následně odeslali do specializovaného pracoviště.
Závěr
Pitva mozku a míchy je důležitou součástí autoptického vyšetření pacientů s kognitivním postižením či poruchou motoriky.
Současná neuropatologická diagnostika je postavena na širokém panelu imunohistochemických protilátek, dodatečně lze doplnit i molekulárně genetická vyšetření ze zmražené tkáně kostní dřeně nebo sleziny (v indikovaných případech podle nálezu při autopsii).
Až u každého pátého pacienta s neurodegenerativním onemocněním může neuropatolog odhalit jiné onemocnění, než odpovídalo klinické diagnóze. Řada atypicky probíhajících případů může být podmíněna kombinací neurodegenerací nebo smíšenou patologií (vaskulární postižení).
Pitva mozku je tak u vybraných případů zcela zásadní formou zpětné vazby pro klinické lékaře ať už na úrovni základní zdravotní péče, či z hlediska vědecko-výzkumných analýz.
Práce byla podpořena MZ ČR projektem RVO-VFN 64165, Univerzitou Karlovou (projekty Progres Q27 a Q28/LF1) a OPPK projektem CZ.2.16/3.1.00/24509)
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 4. 8. 2017
Přijato do tisku: 8. 1. 2018
doc. MUDr. Radoslav Matěj, Ph.D.
Oddělení patologie a národní referenční laboratoř TSE-CJN
Thomayerova nemocnice
Vídeňská 800
14059 Praha 4 – Krč
e-mail: radoslav.matej@ftn.cz
Sources
1. Veress B, Alafuzoff I. A retrospective analysis of clinical diagnoses and autopsy findings in 3,042 cases during two different time periods. Hum Pathol 1994; 25(2): 140 – 145.
2. Rohan Z, Matej R, Rusina R. Překrývání neurodegenerativních demencí. Cesk Slov Neurol N 2015; 78/ 111(6): 641 – 648. doi: 10.14735/ amcsnn2015641.
3. de Carvalho M, Dengler R, Eisen A et al. Electrodiagnostic criteria for diagnosis of ALS. Clin Neurophysiol 2008; 119(3): 497 – 503. doi: 10.1016/ j.clinph.2007.09.143.
4. Costa J, Swash M, de Carvalho M. Awaji criteria for the diagnosis of amyotrophic lateral sclerosis:a systematic review. Arch Neurol 2012; 69(11): 1410 – 1416. doi: 10.1001/ archneurol.2012.254.
5. Reilmann R, Leavitt BR, Ross CA. Diagnostic criteria for Huntington‘s disease based on natural history. Mov Disord 2014; 29(11): 1335 – 1341. doi: 10.1002/ mds. 26011.
6. Kovacs GG, Milenkovic I, Wohrer A et al. Non-Alzheimer neurodegenerative pathologies and their combinations are more frequent than commonly believed in the elderly brain: a community-based autopsy series. Acta Neuropathol 2013; 126(3): 365 – 384. doi: 10.1007/ s00401-013-1157-y.
7. Toledo JB, Brettschneider J, Grossman M et al. CSF biomarkers cutoffs: the importance of coincident neuropathological diseases. Acta Neuropathol 2012; 124(1): 23 – 35. doi: 10.1007/ s00401-012-0983-7.
8. Murray ME, Graff-Radford NR, Ross OA et al. Neuropathologically defined subtypes of Alzheimer‘s disease with distinct clinical characteristics: a retrospective study. Lancet Neurol 2011; 10(9): 785 – 796. doi: 10.1016/ s1474-4422(11)70156-9.
9. Janocko NJ, Brodersen KA, Soto-Ortolaza AI et al. Neuropathologically defined subtypes of Alzheimer‘s disease differ significantly from neurofibrillary tangle-predominant dementia. Acta Neuropathol 2012; 124(5): 681 – 692. doi: 10.1007/ s00401-012-1044-y.
10. Schuette AJ, Taub JS, Hadjipanayis CG et al. Open biopsy in patients with acute progressive neurologic decline and absence of mass lesion. Neurology 2010; 75(5): 419 – 424. doi: 10.1212/ WNL.0b013e3181eb5889.
11. Metodický list TSE/ CJN, surveillance, diagnóza a terapie transmisivních spongiformních encefalopatií a Creutzfeldt-Jakobovy nemoci. 2000.
12. Rohan Z, Matej R. Pitva mozku a míchy při diagnóze neurodegenerativního onemocnění – praktický postup pro optimalizaci vyšetření. Cesk Patol 2015; 51(4): 199 – 204.
13. Matej R, Rusina R. Neurodegenerativní onemocnění: přehled současné klasifikace a diagnostických neuropatologických kritérií. Cesk Patol 2012; 48(2): 83 – 90.
14. Rohan Z, Matej R. Current concepts in the classification and diagnosis of frontotemporal lobar degenerations: a practical approach. Arch Pathol Lab Med 2014; 138(1): 132 – 138. doi: 10.5858/ arpa.2012-0510-RS.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2018 Issue 1-
All articles in this issue
- Traumata jako příčina extrapyramidových syndromů
- Traumy ako príčina extrapyramídových syndrómov
- Komentár ku kontroverziám Traumy ako príčina extrapyramídových syndrómov
- Olfaktoriální meningiomy – chirurgická léčba, její rizika a možnosti zachování čichu
- Neuropaliativní a rehabilitační péče u pacientů v pokročilé fázi progresivních neurologických onemocnění
- Ochranné faktory kognitivního deficitu u roztroušené sklerózy
- Měření kognitivních funkcí pomocí krátkých opakovatelných neuropsychologických baterií
- Test gest (TEGEST) k rychlému vyšetření epizodické paměti u mírné kognitivní poruchy
- Význam morfologických a klinických klasifikací stenózy bederní páteře v předoperační rozvaze
- Parosmie a fantosmie u pacientů s poruchou čichu
- Syndróm Dravetovej s mutáciou v SCN1A géne, genetické aspekty a klinické skúsenosti
- Porozumenie viet u slovensky hovoriacich pacientov s Parkinsonovou chorobou
- Pilotní studie efektu ambulantní funkční peroneální stimulace
- Spondylodiscitida z pohledu neurologa
- Statiny a jejich vliv na periferní nervový systém
- Trombóza kavernózního splavu – stále aktuální komplikace rinosinusitidy
- Radikulopatie Th1 na podkladě masivního výhřezu disku Th1/ 2
- Neuropatologické post mortem vyšetření mozku a míchy v deseti bodech – co může neurolog od neuropatologa očekávat při verifikaci klinické diagnózy neurodegenerativního onemocnění?
- Dlouhodobé sledování pacienta s primárním meningeálním melanocytomem krční míchy
- Neurochirurgické předatestační vzdělávání v ČR
- Alternativní formy pro české verze Paměťového testu učení, Reyovy-Osterriethovy komplexní figury a testu Verbální fluence
- Leiomyom dlaně
- Gigantický kavernózní hemangiom zadní jámy nasedající na duru napodobující hemangiopericytom
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Spondylodiscitida z pohledu neurologa
- Parosmie a fantosmie u pacientů s poruchou čichu
- Měření kognitivních funkcí pomocí krátkých opakovatelných neuropsychologických baterií
- Trombóza kavernózního splavu – stále aktuální komplikace rinosinusitidy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career




