-
Medical journals
- Career
Spondylodiscitida z pohledu neurologa
: T. Andrašinová 1; B. Adamová 1; R. Chaloupka 2; T. Andrašina 3
: Neurologická klinika LF MU a FN Brno 1; Ortopedická klinika LF MU a FN Brno 2; Klinika radiologie a nukleární medicíny LF MU a FN Brno 3
: Cesk Slov Neurol N 2018; 81(1): 86-92
: Short Communication
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amcsnn201786Spondylodiscitida je termín, který se používá pro označení infekce meziobratlového disku a osteomyelitidy sousedních obratlů. V rozvinutých zemích se jedná o relativně vzácné onemocnění představující 3 – 5 % ze všech skeletálních infektů. Nejčastěji je zánět lokalizován v bederní páteři. Neurologický deficit bývá přítomen u 30 – 50 % pacientů se spondylodiscitidou. Diagnostika je často komplikovaná a zpožděná z důvodu častého výskytu chronických bolestí zad v běžné populaci a dále v důsledku negativity rentgenového vyšetření v časnějších stádiích onemocnění. Konzervativní léčebný postup spočívá v antibiotické terapii zkrácené dle nových poznatků na 6 týdnů při nekomplikovaném průběhu. Indikací pro chirurgickou intervenci je komprese nervových struktur s neurologickým deficitem, spinální instabilita a selhání konzervativní léčby. V našem sdělení prezentujeme soubor 11 pacientů se spondylodiscitidou, z nichž jsme vybrali 3 zajímavé kazuistiky, na kterých demonstrujeme různý průběh onemocnění. Klíčová slova: spondylodiscitida – páteř – zánět – magnetická rezonance
Úvod
Spondylodiscitida (SD) je termín označující infekci meziobratlového disku (discitida) a sousedních obratlových těl (vertebrální osteomyelitida).
Incidence SD je uváděna v rozsahu 0,2 – 3,7/ 100 000 za rok [1,2] a představuje 3 – 5 % ze všech kostních infekcí [3,4]. V literatuře je uváděna bimodální věková distribuce s prvním vrcholem pod 20 let a dalším v 50 – 70 letech věku, i když mohou být postiženy všechny věkové kategorie. Toto onemocnění postihuje častěji muže než ženy, v poměru 1,5 – 2 : 1. K predisponujícím faktorům kromě pohlaví řadíme vyšší věk, diabetes mellitus, imunosupresi, nádorové onemocnění, malnutrici, renální selhání, jaterní cirhózu, onemocnění srdce, abúzus alkoholu, intravenózní užívání léků či drog, HIV infekci, operační výkon na páteři a bakteriémii. K dalším rizikovým faktorům patří anamnéza nedávného traumatu (i nepenetrujícího poranění) nebo nedávného invazivního (ev. chirurgického) výkonu spojeného především s implantací protetického materiálu [4].
SD je stále život ohrožující onemocnění. V současné době je mortalita uváděna menší než 5 % [2]. SD postihuje nejčastěji lumbální úsek páteře (45 – 50 %), následně hrudní úsek (35 %) a nejméně často krční úsek (3 – 20 %) [3,5].
Na vzniku SD se mohou uplatňovat tři základní mechanizmy – hematogenní šíření infekce, přímé zanesení infekce nebo šíření infekce z okolních tkání. Hematogenní šíření infekce představuje nejčastější způsob nákazy. Vzhledem k tomu, že terminální cévy spinálních arterií jsou v dospělosti zakončeny v obratlových tělech, tak septické emboly způsobují rozsáhlé kostní infarkty vedoucí ke vzniku kostních dutin a následně kompresivních fraktur s rozvojem instability páteře. Následně se infekce šíří na sousední disky. Z osteonekrotických ložisek se infekce dále může šířit i do paravertebrálních měkkých tkání a do epidurálního prostoru páteřního kanálu, důsledkem je rozvoj abscesů přispívajících dále k biomechanické nestabilitě a neurologickému deficitu asi v 1/ 3 – 1/ 2 všech případů SD [4,6]. Zřídka se můžeme setkat i s venózním šířením infekce např. při nárůstu nitrobřišního tlaku a následném retrográdním šíření krevního toku z pánevního žilního plexu do paravertebrálního žilního plexu. S přímým zanesením infekce se můžeme setkat asi u 25 – 30 % případů SD. Nejčastější je iatrogenní jako následek operačního výkonu na páteři, lumbální punkce (LP) či zákroku v epidurálním prostoru. Šíření infekce z okolních tkání je vzácné.
Na základě etiologie je možné dělení SD do tří skupin – pyogenní, granulomatózní (tuberkulózní, brucelární a fungální) a parazitická.
Pyogenní SD je primárně monomikrobiální infekce. Nejčastějším etiologickým agens je Staphylococcus aureus, který je původcem asi poloviny (udává se rozpětí 20 – 84 %) netuberkulózních SD. Narůstajícím problémem posledních 20 let je infekce methicillin rezistentním Staphylococcus aureus (MRSA), která je nejčastěji spjata s nozokomiální nákazou a spojena s velmi špatnými klinickými výsledky. Na druhé místo jsou řazeni původci ze skupiny enterobakterií (7 – 33 %), především Escherichia coli, Proteus, Klebsiella a Enterobacter spp. S ostatními agens se setkáváme velmi zřídka [4].
Častou zoonózu v endemickém prostředí Středozemního moře a středovýchodu představuje brucelóza (21 – 48 %). Tuberkulózní SD je nejčastější forma SD celosvětově a v rozvinutých zemích představuje 9 – 46 % případů ze všech SD. Postižení skeletu u tuberkulózní infekce však není příliš časté [7]. Můžeme se setkat i s fungální SD (0,5 – 1,6 %), její výskyt je silně asociován s imunosupresí [4,8].
K hlavním klinickým příznakům SD patří celkové známky infektu doprovázené zvýšenou teplotou až febriliemi a intenzivní bolesti zad, zvláště klidovou špatně reagující na analgetika (tyto příznaky patří mezi tzv. červené praporky). Může dojít k rozvoji neurologického deficitu (myelopatie, radikulopatie) v důsledku komprese nervových struktur v páteřním kanále při epidurálním abscesu či destrukci obratlových těl.
Na našem pracovišti bylo vyšetřeno mezi lety 2015 – 2016 celkem 11 pacientů, u kterých byla diagnóza SD potvrzena zobrazovacím vyšetřením (magnetická rezonance; MR). Soubor tvořilo 6 mužů a 5 žen, průměrný věk byl 72 let (tab. 1). Z tohoto souboru jsme vybrali tři zajímavé případy, které uvádíme podrobněji v následujících kazuistikách a které demonstrují rozdílný průběh a terapii onemocnění. Cílem tohoto sdělení je dále shrnout novější poznatky o diagnóze SD, jejím dělení a terapii.
Kazuistiky
První kazuistika uvádí případ 75leté ženy dlouhodobě léčené pro fibrilaci síní na antikoagulační terapii, diabetes mellitus 2. typu a arteriální hypertenzi (tab. 1). Pacientka byla asi 6 měsíců před přijetím na naše pracoviště došetřována na spádovém interním oddělení pro bolesti břicha, průjmy a nespecifikované otoky. Příčinu potíží se nepodařilo objasnit. Pacientka byla vyšetřena nejprve ambulantně pro týden trvající bolesti celé páteře, byl proveden RTG snímek celé páteře bez průkazu závažné patologie. V průběhu následujících 3 dnů došlo u pacientky k rozvoji hypoaktivního deliria s nárůstem C-reaktivního proteinu (CRP) na 265 mg/ l, neurotopický nález neprokazoval parézy, pacientka byla afebrilní a byla přijata na neurologickou kliniku. Origo infektu nebylo při přijetí základním skríningem (RTG plic, kultivace moči) objasněno a vyšetření mozkomíšního moku se opakovaně nezdařilo (z důvodu dodatečně zjištěného rozsáhlého epidurálního abscesu v lokalizaci prováděné LP). Pro anamnézu krátce trvajících bolestí páteře byla den po přijetí provedena MR celé páteře s nálezem obrazu SD v etáži L4/ 5 s osteolýzou těla L5, epidurálním abscesem v celém hrudním a bederním úseku. Byla zahájena terapie kombinací antibiotik cefotaxim a ampicilin. Již 3. den hospitalizace došlo u pacientky v průběhu několika hodin k prohloubení poruchy vědomí do kómatu a rozvinul se septický šok s multiorgánovým selháním a rozvojem diseminované intravaskulární koagulopatie s nutností umělé plicní ventilace. Sedmý den od přijetí do nemocnice pacientka zemřela. U pacientky se nepodařilo objasnit origo infektu. Etiologickým agens byl pravděpodobně Staphyloccocus aureus, který byl vykultivován z hemokultury. Pitva nebyla provedena na přání rodiny.
Druhá kazuistika popisuje případ 78letého muže (tab. 1) dlouhodobě léčeného s fibrilací síní na antikoagulační terapii, arteriální hypertenzí, diabetem mellitem 2. typu a s chronickou obstrukční plicní nemocí. V květnu 2015 prodělal pacient urosepsi s prokázaným etiologickým agens Citrobacter koseri (z hemokultury) a infekce byla přeléčena antibiotiky dle citlivosti. V návaznosti na urosepsi se mírně zhoršily chronické bolesti bederní páteře, objektivní neurologický nález byl v normě. Byl proveden RTG bederní páteře s nálezem pokročilé spondylartrózy. V laboratorních parametrech došlo pozvolna k nárůstu CRP až na 136 mg/ l, avšak prokalcitonin byl negativní. Byl proveden základní skríning možného origa infektu s nálezem drobné subkapsulární kolekce pravé ledviny zobrazující se na CT intravenózní vylučovací urografii. Dle ultrazvukového vyšetření se jednalo o infikovaný hematom (při antikoagulační terapii). Byla provedena punkce pod CT kontrolou s pozitivitou polymerázové řetězové reakce Citrobacter/ Klebsiella. V průběhu června 2015 se v klinickém obrazu rozvinulo lehké vícekořenové postižení dolních končetin s levostrannou převahou (areflexie L2 – S2 oboustranně, hypestézie v dermatomu L5 vlevo, bez radikulární parézy). Byla provedena MR bederní páteře s nálezem rozvinuté SD L4/ 5 s abscesovou formací v předním epidurálním prostoru (obr. 1A – C). Byly nasazeny gentamicin a cefotaxim i.v. dle citlivosti, po poklesu CRP na 28 mg/ l byla po třech týdnech intravenózní terapie převedena na perorální antibiotikum – doxycyklin. Vzhledem k tomu, že neurologický nález se dále nezhoršoval a antibiotická terapie byla úspěšná, nebyla operační terapie indikována.
1. MR vyšetření bederní páteře u pacienta se spondylodiscitidou v etáži L 4/5 (pacient č. 2). Obr. 1A) STIR sekvence, sagitální rovina. Obrázek ukazuje hyperintenzní meziobratlovou ploténku L4/5, nerovnosti krycích ploten a abnormální hyperintenzitu – edém obratlových těl L4 a L5 v návaznosti na meziobratlový prostor. Obr. 1B) T1 vážený obraz, sagitální rovina. Snížený signál obratlových těl koresponduje s edémem sledovatelným v sekvenci STIR. Patologicky zvýšený signál ve ventrálním epidurálním prostoru – absces (šipka). Obr. 1C) T1 vážený obraz, postkontrastně, axiální rovina. Patologické sycení při obvodu intervertebrálního disku L4/5, epidurálního prostoru a přilehlých obratlových těl s usuracemi krycích ploten. Abscesová kolekce za tělem L5 paramediálně vlevo šíře až 10 mm (šipka). Fig. 1. MRI examination of the lumbar spine in a patient with spondylodiscitis at the L4/5 level (patient No. 2). Obr. 1A) STIR sequence, sagittal orientation. Image reveals a markedly hyperintense intervertebral disc L4/5, irregularities of the endplates and abnormal hyperintensity – edema of vertebral bodies L4 and L5 contiguous with the intervertebral space. Obr. 1B) T1-weighted image, sagittal orientation. The marked hypointensity of the vertebral bodies corresponds with edema fi nding in the STIR sequence. The pathological increase of the signal in ventral epidural space – abscess (arrow). Obr. 1C) Contrast-enhanced T1-weighted image, axial orientation. Peripheral pathological enhancement of the intervertebral disc L4/5, enhancement of epidural space and adjacent vertebral 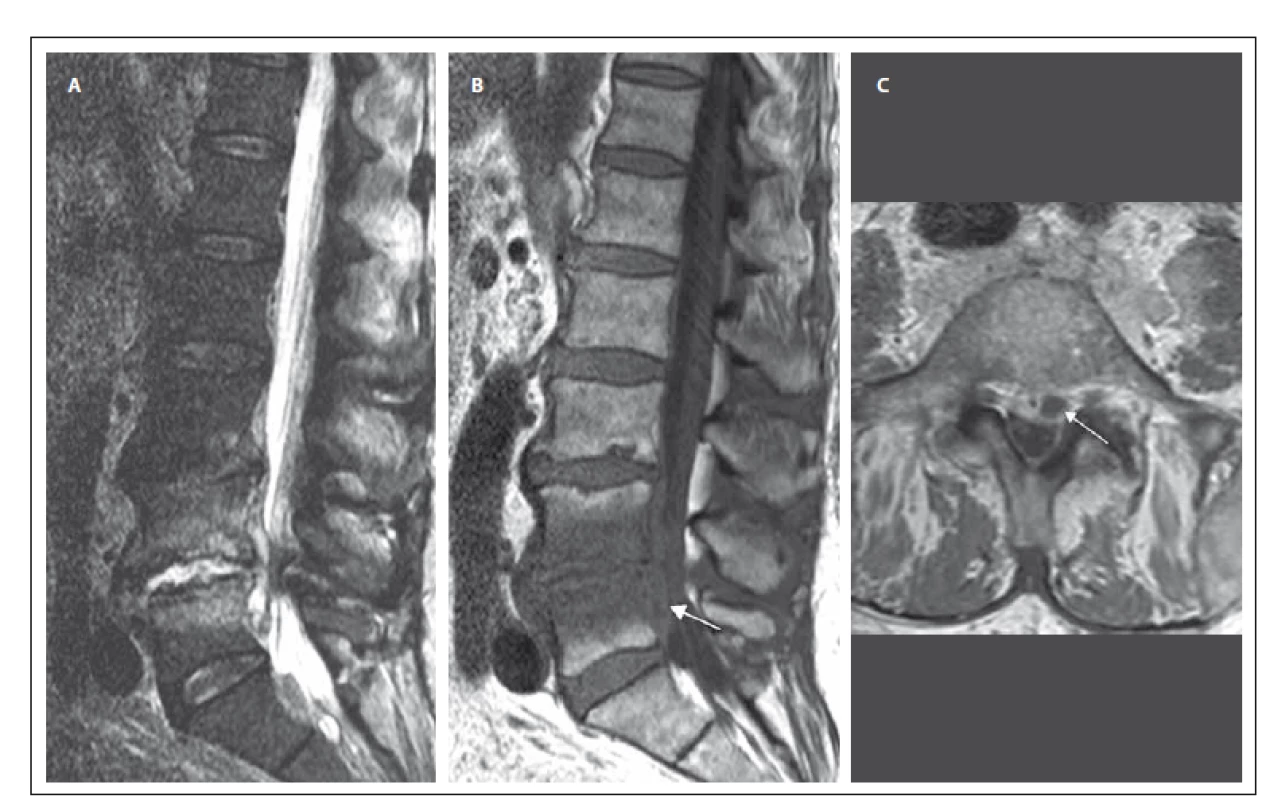
Třetí kazuistika uvádí případ 68letého muže s revmatoidní artritidou a hepatopatií toxonutritivní etiologie při abúzu alkoholu (tab. 1). Pacient prodělal v červnu 2015 frakturu pravého humeru, která byla řešena operačně, avšak vzhledem k malpozici titanové dlahy byla v plánu reoperace. Od srpna 2015 se u pacienta objevily silné bolesti hrudní páteře nereagující na analgetika a od září 2015 se rozvinula centrální paraparéza dolních končetin středně těžkého stupně s hranicí poruchy čití od Th9. Byl proveden RTG hrudní páteře, kde byl popsán vymizelý intervertebrální prostor Th8/ 9, CRP bylo 17 mg/ l, pacient byl afebrilní. Byla doplněna MR hrudní páteře s nálezem SD Th8/ 9 se zánětlivými změnami i epidurálně a v přilehlých měkkých tkáních (obr. 2A – B). Byly nasazeny cefotaxim a gentamicin i.v. a byla provedena operace ze zadního přístupu. Operační výkon zahrnoval posterolaterální dekompresi s laminektomií Th8/ 9, kostotransverzektomii zleva dle Capenera, posterolaterální fúzi a transpedikulární fixaci Th6/ 7 – Th10/ 11 a proplachovou drenáž. Pooperačně došlo pozvolna ke zlepšení klinického nálezu do paraparézy lehkého stupně. Zánětlivé parametry zůstávaly po celou dobu hospitalizace nízké, etiologické agens se nepodařilo kultivačně objasnit. Intravenózní antibiotická terapie byla převedena po dvou týdnech na perorální formu (rifampicin a trimetoprim + sulfametoxazol) a po 6 týdnech byla antibiotika vysazena.
2. MR vyšetření hrudní páteře u pacienta se spondylodiscitidou v etáži Th8/9 (pacient č. 3). Obr. 2A) STIR sekvence, sagitální rovina. Obraz částečného kolapsu obratlových těl Th8 a Th9 s téměř vymizelým meziobratlovým prostorem, edém obratlů. Obr. 2B) T1 vážený obraz, sagitální rovina. Korespondující obraz postkontrastně, nehomogenní sycení destruovaných obratlových těl, kostní fragmenty a zánětlivé hmoty prominují dorzálně až 6 mm a komprimují durální vak. Významná sekundární spinální stenóza s útlakem míchy (šipka). Fig. 2. MRI examination of the thoracic spine in a patient with spondylodiscitis at the T8/9 level (patient No. 3). Obr. 2A) STIR sequence, sagittal orientation. Image shows partial collapse of vertebral bodies T8 and T9 with reduction of intervertebral space; edema of vertebral bodies. Obr. 2B) T1-weighted image, sagittal orientation. The corresponding post-contrast image shows heterogenous enhancement of the damaged vertebral bodies, bone fragments and infl ammatory masses extending posteriorly up to 6 mm and compressing the dural sac. Signifi cant secondary spinal stenosis with compression of the spinal cord (arrow). 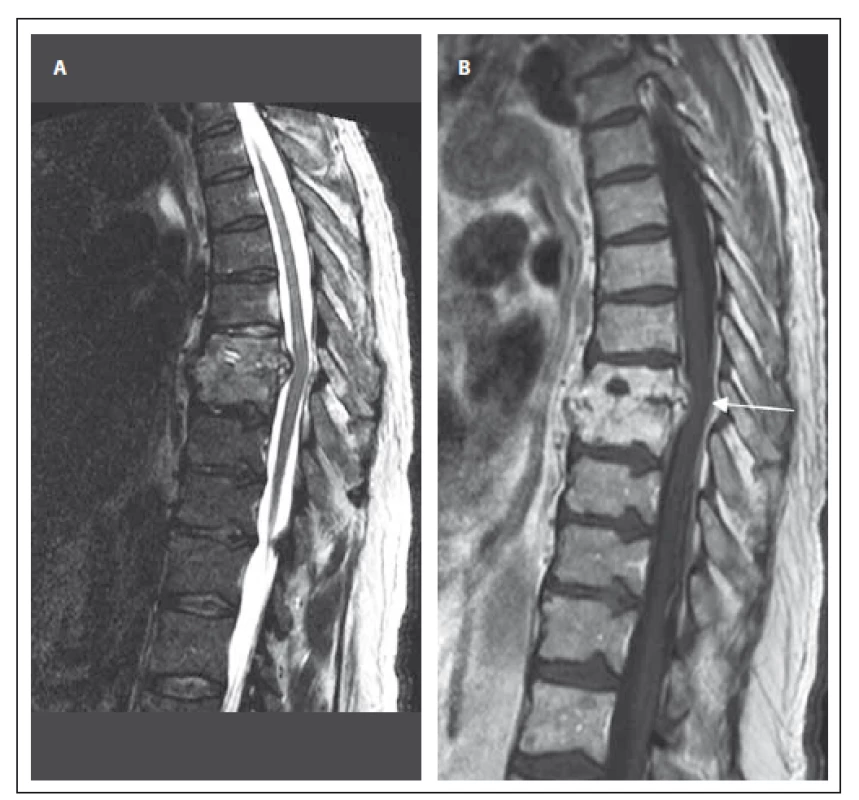
Diskuze
Uvedené kazuistiky pacientů se SD poukazují na variabilní průběh toho onemocnění a různou volbu terapie (konzervativní vs. operační).
SD je sice vzácná příčina bolestí páteře ve srovnání s primárně vertebrogenní etiologií na podkladě funkčních a degenerativních změn páteře, nicméně její incidence v posledních 20 letech v Evropě stále narůstá [6]. Za stoupajícím výskytem SD stojí prodlužující se délka života, změna bakteriálního spektra způsobujícího infekci, narůstající lékové rezistence, nárůst množství imunosuprimovaných pacientů, mladých intravenózních uživatelů drog. Odhalení SD napomáhá zdokonalení zobrazovacích metod [1,3].
Pečlivá anamnéza nám často umožní zjistit možný zdroj infekce. Vždy pátráme po nedávné intervenci jako jsou LP, epidurální injekce nebo katetrizace, vertebroplastika a kyfoplastika, recentní operace páteře nebo implantace osteosyntetických materiálů. Zvažujeme-li přestup infekce z okolních tkání, pátráme po známkách infekce měkkých tkání v okolí páteře či recentní operaci terminální části trávicího nebo horní části urogenitálního traktu. Můžeme se také setkat s přímým přestupem infekce z infikovaného aortálního stentu, při ruptuře jícnu či při retrofaryngeálním abscesu [4]. Cíleně musíme vyloučit infekci urogenitálního traktu, přítomnost infikovaných intravenózních katetrů, endokarditidu, divertikulitidu, zubní fokus. Všichni pacienti v našem souboru byli vyššího věku (61 – 85 let), což se shoduje s druhým věkovým vrcholem výskytu SD. U 5 z 11 pacientů se podařilo zjistit origo infektu, tedy zdroj SD. Zdrojem infektu byly: implantovaná titanová dlaha po fraktuře humeru, urosepse a infikovaný hematom ledviny, aortobifemorální protéza, infikovaný periferní žilní katetr, sakrální dekubitus. S imunosupresí jako rizikovým faktorem jsme se setkali u čtyř pacientů v souboru, dva pacienti prodělali před rozvojem SD závažnější trauma (frakturu), tři pacienti trpěli diabetem, jeden pacient chronickou renální insuficiencí a jeden pacient měl v anamnéze abúzus alkoholu.
Čas mezi počátkem symptomů a stanovením diagnózy SD bývá v různých studiích uváděný mezi 2 dny až 12 měsíci s průměrnou dobou 4,3 měsíce [1,3,5]. Pozdní stanovení diagnózy je spojeno s nepříznivým klinickým výsledkem pacientů léčených konzervativně [9].
Klinické symptomy SD bývají nezřídka nespecifické. K hlavním klinickým příznakům SD patří zvýšená teplota a bolest zad. Bolesti bývají často noční, klidové, nereagující na běžná analgetika, což se potvrdilo ve všech prezentovaných případech. V literatuře se udává, že až 15 % pacientů bolesti páteře nemá a až 50 % pacientů nemá febrilie. Z dalších symptomů se setkáváme s profuzním pocením, celkovou slabostí, nechutenstvím a váhovým úbytkem. V případě postižení krční páteře se můžeme setkat s krční rigiditou, dysfagií, tortikolis. Z laboratorních známek si všímáme leukocytózy, elevace CRP a zvýšené sedimentace [3]. Důležité je rovněž provést mikrobiologické kultivační vyšetření krve (hemokultura), která nám může pomoci objasnit etiologické agens SD. Etiologické agens se podařilo v našem souboru 11 pacientů objasnit u 8 pacientů (73 %). Celkem 6 pacientů mělo pozitivní kultivace z hemokultury (4× Staphyloccocus aureus, 1× Salmonella enterica a 1× Citrobacter koseri) a 2 pacienti měli pozitivní kultivace z operační rány (1× Staphyloccocus aureus a 1× Streptococcus gallolyticus). V literatuře se udává pozitivní výsledek hemokultury u 40 – 60 % pacientů se SD [4]. Ve shodě s literaturou byl nejčastějším etiologickým agens Staphylococcus aureus. Zajímavým zjištěním byla normální hladina prokalcitoninu u většiny pacientů léčených na našem pracovišti. V případě pooperačního rozvoje SD se setkáváme s tzv. tichým klinickým obdobím po operaci trvajícím průměrně 21 dní.
MR je diagnostická metoda první volby při podezření na SD. MR nám pomůže zároveň odlišit SD od degenerativních, traumatických či neoplastických změn. V časnějších stadiích onemocnění (2 – 8 týdnů od nástupu příznaků) má nativní RTG nízkou pozitivní prediktivní hodnotu v důsledku nepřítomnosti destrukce kostní hmoty. Radionuklidové metody jsou naopak vysoce senzitivní, avšak málo specifické. CT je velmi užitečné pro zacílení punkce s aspirací [4]. Výskyt neurologické symptomatiky je uváděn asi v 1/ 3 až 1/ 2 případů výskytu SD, a to od lehké formy provázené mírným senzitivním postižením až po těžkou slabost v důsledku radikulopatie nebo myelopatie a sfinkterovou dysfunkci [2]. Neurologická symptomatika je častěji asociována s epidurálním abscesem, destrukcí obratle, opožděným stanovením diagnózy, s postižením krčního úseku a s tuberkulózní SD. V našem souboru mělo neurologický deficit 55 % pacientů.
Homagk et al vytvořili klasifikaci SD na základě rozsáhlé studie, do které bylo zařazeno celkem 296 pacientů [3]. Rozdělili SD do tří stupňů dle závažnosti a každému stupni pak přidělili specifická léčebná doporučení. Stupeň závažnosti je daný klinickými příznaky (numerical rating scale; NRS), laboratorními parametry (CRP), morfologickým obrazem na zobrazovacích vyšetřeních (MR) a neurologickým stavem. Zjednodušeně můžeme říci, že stupeň III představuje SD s neurologickým deficitem, stupeň II SD bez neurologického deficitu (ale s destrukcí kosti) a ostatní případy SD (bez kostní destrukce, bez neurologického deficitu) zařazujeme ke stupni I. Podobné dělení SD uvádějí ve své práci také Pola et al, kteří rozdělili SD na typy A, B a C, které zhruba korelují se stupni I – III [6]. Částečně se odlišuje pouze typ C, u kterého je přítomen buď neurologický deficit nebo epidurální absces. Terapie se řídí příslušným stupněm závažnosti. Společným doporučením pro úspěšnou léčbu všech stupňů je imobilizace postižené části páteře a cílená antibiotická léčba. Délka imobilizace se řídí dle bolesti, klinického stavu a vývoje zánětlivých parametrů. Konzervativní postup je volbou pro SD I. stupně a pro pacienty polymorbidní s vysokým operačním rizikem. Chirurgický postup je doporučován v případě, kdy dojde ke kostní destrukci a k rozvoji spinální nestability, k neurologickému postižení, k rozvoji abscesu či sepse. Cílem operace je zajistit stabilitu páteře (stabilizace), zabránit kompresi nervových struktur (dekomprese) a odstranit zánětlivý fokus (debridement) s možností současné biopsie. Historicky byl za zlatý standard operační léčby SD považován přední debridement kombinovaný se zadní stabilizací [1]. Volba chirurgického přístupu je však stále otázkou diskuzí. V literatuře se můžeme setkat s různými návrhy doporučených postupů, avšak míra těchto doporučení je většinou nízká a není dosud založena na datech získaných z prospektivních randomizovaných studií. Jako metodu volby u SD II. stupně volí Homagk et al zadní stabilizaci. Ta však nemusí být vždy dostatečná a v některých případech je nutno ji doplnit v druhé době o přední stabilizaci. Samostatná přední stabilizace nebyla doporučena vzhledem k vyšší invazivitě operace (s výjimkou krční páteře). Homagk et al uvádí možnost řešit operačně i SD I. stupně, výhody jsou spatřovány v možnosti identifikovat agens peroperační biopsií (při neúspěšné konzervativní terapii), v imobilizaci postiženého segmentu, a tedy v možnosti okamžité mobility pacienta bez korzetu. U SD III. stupně je doporučována časná dekomprese a zadní stabilizace doplněná o časnou přední stabilizaci v závislosti na výši postiženého segmentu [3]. Lindhardt et al a Si et al [10,11] ve svých pracích uvádějí jako metodu volby s lepšími výsledky a lepším klinickým výstupem naopak izolovaný přední přístup. Jednalo se o práce hodnocené kvalitou důkazů jako střední s vysokou mírou doporučení, avšak obě studie zahrnovaly relativně málo pacientů. Nově jsou u SD zkoušeny i méně invazivní postupy, jako perkutánní zadní stabilizace, které by mohly mít přínos zejména u pacientů v celkově špatném stavu [1].
Terapeutický přístup k našim pacientům byl individuální s ohledem na neurologické postižení, přítomnost nestability páteře (při kostní destrukci), avšak důraz byl kladen i na celkový stav a morbiditu pacienta a očekávaný profit invazivního výkonu. V našem souboru byli operováni celkem 3 pacienti, jeden pacient z předního přístupu (lokalizace SD v krční páteři) a 2 pacienti ze zadního přístupu.
U pacienta se SD se vždy snažíme odhalit etiologické agens, abychom mohli podávat antibiotickou léčbu cíleně. Pokud se nepodaří etiologické agens zjistit z hemokultury či sérologickými testy, tak je doporučováno provedení perkutánní aspirační biopsie pod radiologickou kontrolou, což je poměrně bezpečný a levný diagnostický nástroj. Za situace, kdy se nepodaří vykultivovat žádné bakteriální agens, je nutné uvažovat i o jiných patogenech, jako jsou mykobakterie, brucella či fungální patogeny a provést odpovídající mikrobiologické vyšetření. Pokud v úvodu neznáme etiologické agens SD a zahajujeme léčbu empiricky nasazenými antibiotiky, tak je třeba zvolit antibiotika účinná na Staphylococcus aureus, včetně methicillin rezistentního, na streptokoky a na gramnegativní bakterie. Dle doporučení Americké společnosti pro infekční nemoci (Infectious Diseases Society of America – IDSA) jsou to antibiotika ze skupiny glykopeptidů (vankomycin) v kombinaci s antibiotiky ze skupiny cefalosporinů III. – IV. generace nebo s karbapenemy. Alternativní režimy v případě alergie nebo intolerance mohou zahrnovat kombinaci daptomycinu a chinolonu. Dle výsledků kultivace se pak pokračuje v terapii antibiotiky cíleně. Léčba pacientů se SD způsobenou mykobakterií, brucellou či fungálními patogeny je specifická a přesahuje rozsah tohoto sdělení. U pacientů s hemodynamickou nestabilitou, sepsí, septickým šokem nebo příznaky progresivních neurologických příznaků se doporučuje zahájit empirickou antimikrobiální terapii ihned, současně s pokusem o stanovení mikrobiologické diagnózy. U ostatních, nerizikových pacientů, se doporučuje s nasazením antimikrobiální terapie vyčkat a nasadit terapii až po stanovení mikrobiologické diagnózy, síla tohoto doporučení je však nízká [12].
Bernard et al se ve své práci zabývali možností zkrácení antibiotické terapie u pacientů s pyogenní SD z původně doporučených 12 týdnů na 6 týdnů, přičemž se ukázalo, že toto zkrácení nemá nežádoucí vliv na riziko relapsu onemocnění, selhání léčby či mortalitu. U nekomplikované SD (bez epidurálního abscesu, kostní destrukce a bez neurologického deficitu) může být terapie dle této studie bezpečně zkrácena na 6 týdnů (2 týdny intravenózně, 4 týdny perorálně) [13]. Je doporučeno antibiotickou terapii zahájit intravenózním podáním antibiotik a poté, co dojde ke zlepšení klinického stavu a signifikantnímu poklesu zánětlivých parametrů (CRP, leukocyty), je možno pokračovat v perorálním podání [1,2].
Závěr
SD je stále závažné život ohrožující onemocnění, jehož incidence mírně narůstá. Na toto onemocnění je nutné myslet v diferenciální diagnostice bolestí páteře zejména při výskytu intenzivních klidových bolestí a celkových známek zánětu. Diagnostika bývá obtížná zejména v počátečních stadiích onemocnění, kdy radiologický nález zejména na prostých RTG snímcích bývá často negativní, metodou volby ze zobrazovacích vyšetření je MR páteře. Je možno rozlišit tři stupně závažnosti SD dané morfologickým obrazem na zobrazovacích vyšetřeních a neurologickým statem. Dle stupně závažnosti se řídí terapeutický postup (konzervativní či operační). U nekomplikované pyogenní SD je možné na základě současných poznatků antibiotickou terapii bezpečně zkrátit na 6 týdnů.
Práce byla podpořena projektem institucionální podpory FN Brno MZ ČR – RVO (FNBr – 65269705) a z prostředků LF MU pro juniorského výzkumníka Tomáše Andrašinu.
Dále byla práce podpořena projektem specifického výzkumu MUNI/A/1028/2016 z programu podpory studentských projektů na Masarykově univerzitě
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 30. 8. 2017
Přijato do tisku: 24. 11. 2017
MUDr. Tereza Andrašinová
Neurologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: andrasinova.tereza@fnbrno.cz
Sources
1. Rutges JP, Kempen DH, van Dijk M et al. Outcome of conservative and surgical treatment of pyogenic spondylodiscitis: a systematic literature review. Eur Spine J 2016; 25(4): 983 – 999. doi: 10.1007/ s00586-015-4318-y.
2. Sur A, Tsang K, Brown M et al. Management of adult spontaneous spondylodiscitis and its rising incidence. Ann R Coll Surg Engl 2015; 97(6): 451 – 455. doi: 10.1186/ s13256-016-1125-y.
3. Homagk L, Homagk N, Klauss JR et al. Spondylodiscitis severity code: scoring system for the classification and treatment of non-specific spondylodiscitis. Eur Spine J 2016; 25(4): 1012 – 1020. doi: 10.1007/ s00586-015-3936-8.
4. Gouliouris T, Aliyu SH, Brown NM et al. Spondylodiscitis: update on diagnosis and management. J Antimicrob Chemother 2010; 65(3): 11 – 24. doi: 10.1093/ jac/ dkq303.
5. Saez-Arenillas Martín A, Cerebrián Parra JL, Urda Martínez-Aedo AL et al. Management of infectious discitis. Outcome in one hundred and eight patients in a University Hospital. Int Orthop 2012; 36(2): 239 – 244. doi: 10.1007/ s00264-011-1445-x.
6. Pola E, Autore G, Formica VM et al. New classification for the treatment of pyogenic spondylodiscitis: validation study on a population of 250 patients with a follow-up of 2 years. Eur Spine J 2017; 26 (Suppl 4): 479 – 488. doi: 10.1007/ s00586-017-5043-5.
7. Trecarichi EM, Di Meco E, Mazzotta V et al. Tuberculous spondylodiscitis: epidemiology, clinical features, treatment, and outcome. Eur Rev Med Pharmacol Sci 2012; 16(2): 58 – 72. doi: 10.1016/ j.spinee.2012.07.015.
8. Ramos A, Huddleston P, Patel R et al. Vertebral osteomyelitis due to candida species: a cohort study and review of the literature. Open J Orthop 2013; 3(2): 81 – 89. doi: 10.4236/ ojo.2013.32016.
9. Ascione T, Balato G, Di Donato SL et al. Clinical and microbiological outcomes in haematogenous spondylodiscitis treated conservatively. Eur Spine J 2017; 26 (Suppl 4): 489 – 495. doi: 10.1007/ s00586-017-5036-4.
10. Linhardt O, Matussek J, Refior HJ et al. Long-term results of ventro-dorsal versus ventral instrumentation fusion in the treatment of spondylitis. Int Orthop 2007; 31(1): 113 – 119. doi: 10.1007/ s00264-006-0140-9.
11. Si M, Yang ZP, Li ZF et al. Anterior versus posterior fixation for the treatment of lumbar pyogenic vertebral osteomyelitis. Orthopedics 2013; 36(6): 831 – 836. doi: 10.3928/ 01477447-20130523-33.
12. Berbari EF, Kanj SS, Kowalski TJ et al. Infectious Diseases Society of America. 2015 Infectious Diseases Society of America (IDSA) Clinical Practice Guidelines for the Diagnosis and Treatment of Native Vertebral Osteomyelitis in Adults. Clin Infect Dis 2015; 61(6): 26 – 46. doi: 10.1093/ cid/ civ482.
13. Bernard L, Dinh A, Ghout I et al. Antibiotic treatment for 6 weeks versus 12 weeks in patients with pyogenic vertebral osteomyelitis: an open-label, non-inferiority, randomised, controlled trial. Lancet 2014; 385(9971): 875–882. doi: 10.1016/S0140-6736(14)61233-2.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2018 Issue 1-
All articles in this issue
- Injury as a cause of extrapyramidal syndrome
- Injury as a cause of extrapyramidal syndromes
- Injury as a cause of extrapyramidal syndromes Comment on controversies
- Olfactory groove meningiomas – surgical treatment, surgical risks and sense of smell preservation
- Neuropalliative and rehabilitative care in patients with an advanced stage of progressive neurological diseases
- Protective factors for cognitive impairment in multiple sclerosis
- Assessment of cognitive functions using short repeatable neuropsychological batteries
- Test of gestures (TEGEST) for a brief examination of episodic memory in mild cognitive impairment
- The importance of morphological and clinical classifications of lumbar spine stenosis in the preoperative planning
- Parosmia and phantosmia in patients with olfactory dysfunction
- SCN1A mutation positive Dravet syndrome, genetic aspects and clinical experiences
- Sentence comprehension in Slovak-speaking patients with Parkinson disease
- The pilot study of effect of outpatient functional electrical stimulation of peroneal nerve
- A neurological view on spondylodiscitis
- Statins and their effects on the peripheral nervous system
- Cavernous sinus thrombosis – still occurring complication of rhinosinusitis
- T1 radiculopathy due to massive disc herniation at T1/2
- Neuropathological post-mortem examination of the brain and the spinal cord in ten key points – What can a neurologist expect from the neuropathologist’s confirmation of the clinical diagnosis in neurodegenerative diseases?
- Long-term follow up of a patient with primary cervical spinal cord meningeal melanocytoma
- Neurosurgical resident training in the Czech Republic
- Alternative forms parallel to the Czech versions of Rey Auditory Verbal Learning Test, Complex Figure Test and Verbal Fluency
- Leiomyoma of the palm
- Dural-based posterior fossa giant cavernous hemangioma masquerading as hemangiopericytoma
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- A neurological view on spondylodiscitis
- Parosmia and phantosmia in patients with olfactory dysfunction
- Assessment of cognitive functions using short repeatable neuropsychological batteries
- Cavernous sinus thrombosis – still occurring complication of rhinosinusitis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


