-
Medical journals
- Career
Prediktivní testování u nemalobuněčného karcinomu plic
Authors: P. Dundr 1; R.- Matěj 1 3; K. Němejcová 1; M. Bártů 1; I. Stružinská 1
Authors‘ workplace: Ústav patologie, 1. LF UK a VFN v Praze 1; Ústav patologie, 2. LF UK a FN Královské Vinohrady 2; Ústav patologie a molekulární medicíny, 2. LF UK a FTN Praha 3
Published in: Klin Onkol 2021; 34(Supplementum 1): 29-34
Category: Review
doi: https://doi.org/10.48095/ccko2021S29Overview
Východiska: Prediktivní testování je u nemalobuněčného karcinomu plic (NSCLC) zásadní součástí celého diagnostického procesu a nezbytným předpokladem správné léčby. Možnosti testování a spektrum vyšetřovaných markerů se však v souvislosti s rozvojem diagnostických a terapeutických možností mění a v praxi je tedy nutná pravidelná aktualizace stávajících guidelines. Cíl: Podat přehled aktuální problematiky prediktivního testování u NSCLC na molekulární úrovni i s ohledem na hodnocení exprese PD-L1 vycházející z mezinárodních a národních guidelines. Shrnutí stávající situace prediktivního testování u NSCLC v ČR. Závěr: Prediktivní testování u NSCLC je součástí rutinní diagnostické praxe, zaznamenává však významný rozvoj související s rozšiřováním diagnostických i terapeutických možností. Dosavadní převažující způsob sekvenčního testování jednotlivých markerů se stává vzhledem k narůstajícímu počtu potenciálních prediktorů nevýhodným a jako vhodnější se ukazuje komplexní molekulární testování metodou sekvenování nové generace. Nezbytnou součástí prediktivního testování NSCLC je také imunohistochemické hodnocení exprese PD-L1.
Klíčová slova:
prediktivní testování – nemalobuněčný karcinom plic – řídící mutace – PD-L1
Úvod
Karcinom plic je celosvětově nejčastější příčinou úmrtí na nádorová onemocnění a jeho 5leté přežití nedosahuje 20 % [1]. I přes špatnou prognózu se jedná o onemocnění, u něhož dochází v souvislosti s novými terapeutickými možnostmi k zásadnímu zvýšení odpovědi na léčbu i prodloužení celkového přežití [2–5]. Pro správné využití nových léčebných modalit tzv. cílené léčby je však nutné komplexní prediktivní testování, které umožní výběr vhodné léčby. Toto prediktivní testování zahrnuje detekci řídicích („driver“) mutací či fúzí a v souvislosti s imunoterapií i stanovení exprese PD-L1. Skupina tzv. nemalobuněčných karcinomů plic (non-small cell lung cancer – NSCLC) je heterogenní a zahrnuje z definice všechny jiné histologické typy nádorů než malobuněčný karcinom plic, problematika prediktivního testování je však do určité míry mezi různými typy NSCLC odlišná. Prediktivní testování u NSCLC je v současné době standardní součástí diagnostických postupů. Cílem následujícího sdělení je podat souhrn problematiky prediktivního testování u NSCLC na úrovni molekulárních změn i s ohledem na expresi tzv. programmed death-ligand 1 (PD-L1).
Molekulární testování u karcinomu plic
Standardem molekulárního testování by měla být detekce molekulárních aberací, pro které je dostupná schválená léčba, tedy zejména mutací receptoru epidermálního růstového faktoru (epidermal growth factor receptor – EGFR) a přestaveb genů ALK a ROS1. V některých zemích je však dostupná i léčba cílící na jiné aberace, ať už standardně, nebo v rámci klinických studií – tyto aberace zahrnují zejména mutace BRAF, KRASG12C, MET (skipping mutace exonu 14) či přestavby NTRK a RET. Problémem je však detekce těchto aberací v rutinní praxi. Prediktivní testování u karcinomu plic vychází z doporučení Kolegia amerických patologů (CAP), Mezinárodní asociace pro výzkum rakoviny plic (IASLC) a Asociace molekulární patologie (AMP), které s mírnými modifikacemi přijala Americká společnost pro klinickou onkologii (ASCO). Toto doporučení je původně z roku 2013, v současné době je platné po revizi z roku 2018 [6–10].
Základní principy testování podle CAP-IASLC-AMP guidelines
Typ nádoru: jakýkoliv karcinom s komponentou adenokarcinomu, „neskvamózní“ NSCLC (v malých vzorcích tedy např. i nemalobuněčný blíže nespecifikovaný karcinom), jakýkoliv NSCLC (tedy i skvamózní) s klinickými charakteristikami svědčícími pro vyšší pravděpodobnost řídicí mutace (věk < 50 let, nekuřák či mírný kuřák atd.).
Charakter materiálu: bioptický materiál (resekční výkon, endoskopický vzorek), cytologický materiál (cytoblok, nátěr), cfDNA při primodiagnóze pouze v případě, že není dostupná tkáň; cfDNA u detekce rezistentní mutace EGFR T790M (pokud je výsledek negativní, doporučuje se testování z tkáně). Cirkulující nádorové buňky se nedoporučují v žádné indikaci.
Spektrum vyšetřovaných molekulárních markerů: definovány jsou 3 skupiny.
Nepodkročitelné minimum: EGFR, ALK a ROS1 (podle modifikace ASCO i BRAF, to však v ČR neplatí).
Markery zahrnuté v případě negativního výsledku EGFR, ALK, ROS1 a BRAF nebo primárně u multigenového testování – sekvenování nové generace (new generation sequencing – NGS): RET, MET, KRAS, HER2.
Další markery: na všechny markery nad rámec uvedeného je dle tohoto guideline nahlíženo jako na výzkumné.
Metodika: jakákoliv molekulární metoda schopná detekovat nádorové buňky v zastoupení alespoň 20 % (pro detekci mutace EGFR T790M je to 5 %). Preferovány jsou multigenové NGS panely. U ALK se imunohistochemické (IHC) vyšetření pokládá za alternativu vyšetření metodou fluorescenční in situ hybridizace (FISH), u hraničních nálezů je však nutné ověření metodou FISH.
Testování exprese PD-L1
Testování exprese PD-L1 je v současné době standardní součástí prediktivní diagnostiky karcinomu plic a je doporučováno u všech subtypů pokročilých NSCLC (stadium III a IV). Podle guidelines Národní onkologické sítě (NCCN) a Evropské společnosti pro klinickou onkologii (ESMO) by mělo být vyšetření provedeno před nasazením 1. linie léčby u pacientů s metastatickým NSCLC s negativním či neznámým výsledkem testování EGFR, ALK a ROS1 [11–13]. S ohledem na přesný algoritmus a indikaci testování se v praxi přístup v jednotlivých zemích může lišit a jednoznačná závazná pravidla v mezinárodních guidelines aktuálně nejsou definována. V některých zemích (vč. ČR) je však problematika řešena na úrovni národních guidelines, či jsou tyto guidelines, jako v případě CAP, v přípravě [14]. Technické a další aspekty testování PD-L1 jsou v literatuře široce diskutovány s ohledem na všechny fáze procesu zahrnující typ materiálu, fixaci, klon testující protilátky, užití detekčního systému a srovnání mezi jednotlivými klony, minimální množství nádorových elementů, způsob hodnocení, interpretaci a externí kontrolu kvality. Problematika je s ohledem na zmíněné aspekty široká, nad rámec sdělení a recentně je shrnuta v přehledu publikovaném Komisí pro patologii při IASLC [15].
Základní aspekty testování PD-L1
Požadavky na pracoviště provádějící testování: podle mezinárodních doporučení se musí jednat o pracoviště akreditované podle normy ISO: 15198 se standardizovanou procedurou testování PD-L1 a zavedeným systémem interní i externí kontroly kvality. S ohledem na to, že vyšetřování exprese PD-L1 je metodicky poměrně náročné, je za zásadní a nutnou součást diagnostiky pokládána participace v mezinárodních programech externí kontroly kvality. V ČR je stejně jako molekulární testování i testování exprese PD-L1 prováděno v síti tzv. referenčních laboratoří pro prediktivní diagnostiku fungujících v rámci pracovišť patologie zařazených do této sítě.
Testování je možné z malých bioptických vzorků, resekátů a s určitými omezeními i z cytologických materiálů, je-li k dispozici cytoblok. V případě malých vzorků a resekátů je doporučováno dodržet minimální dobu fixace 6, resp. 24 hodin a maximální dobu fixace 48–72 hodin. Dle dostupných údajů prodloužená doba fixace nicméně neovlivňuje expresi PD-L1. Důležité je správné fixativum, za které lze pokládat hlavně 10% pufrovaný formalin, i když u SP263 je alternativně udáván i zinkový formalin. Při fixaci v alkoholových fixativech dochází ke ztrátě exprese PD-L1 a tato fixativa nelze využít, což může být problematické zejména u některých typů cytologických vzorků fixovaných v alkoholu. Pro testování lze použít i archivní materiál, na obecné úrovni se však nedoporučuje použití vzorků tkáně fixovaných formalinem a zalitých do parafinu, které jsou starší než 3 roky. V případě cytologických vzorků je testování exprese PD-L1 na obecné úrovni možné u materiálu z cytobloku i z cytospinu, nutná je však důkladná validace a uvědomění si limitů tohoto testování (v rámci registračních studií nebylo testování z cytologických vzorků validováno) [16]. Jako minimální množství je u všech vzorků pro stanovení skóre nádorového podílu (tumor proportion score – TPS) doporučováno 100 nádorových buněk, při stanovení TC/IC pomocí protilátky SP142 pak 50 nádorových buněk.
Imunohistochemické protilátky: jako optimální je udáváno použití klinicky validovaných kitů PD-L1 IHC 22C3 PharmDx assay (Agilent Technologies, USA) pro pembrolizumab, PD-L1 IHC 28-8 PharmDx assay (Agilent Technologies, USA) pro nivolumab, VENTANA PD-L1 (SP263) assay (Roche Diagnostics, USA) pro pembrolizumab, nivolumab a durvalumab a VENTANA PD-L1 (SP142) (Roche Diagnostics, USA) pro atezolizumab. Tyto kity jsou však ve srovnání s testy vyvinutými v laboratoři (laboratory developed test – LDT) nákladné a v reálné praxi je jejich využití v mnoha zemích limitované, zejména s ohledem na dostupné úhradové mechanizmy. V praxi lze tedy při důkladné validaci použít i LDT. Na podkladě četných studií se ukázalo, že protilátky 22C3, 28-8 a SP263 jsou srovnatelné a tyto klony lze při stanovení TPS využít zaměnitelně. Naopak SP142 má s ohledem na TPS nižší senzitivitu a měla by být omezena na testování týkající se predikce odpovědi na léčbu atezolizumabem.
Hranice pozitivity: s ohledem na rozdílné hranice pozitivity („cut-offs“) a způsob hodnocení pro různé preparáty a linie léčby by mělo hodnocení exprese PD-L1 pokrývat všechny klinické potřeby vycházející zejména z možností aktuálně dostupné léčby. Obecně platí, že v rámci registračních studií bylo prováděno hodnocení TPS (nebo TC a IC) s klinicky relevantními cut-offs pro pembrolizumab ≥ 1 % (pozitivní) a ≥ 50 % (vysoce pozitivní) (kit 22C3) a < 1 %, ≥ 1 %, ≥ 5 % a ≥ 10 % (nivolumab, kit 28-8). U kitu SP263 (který má v Evropě CE-IVD pro durvalumab, pembrolizumab a nivolumab) jsou cut-offs dle příslušného léku < 1 %, ≥ 1 %, ≥ 5 %, ≥ 10 %, ≥ 25 % a ≥ 50 %. U kitu SP142 je hranice pozitivity u NSCLC TC3 (≥ 50 %), pokud není přítomna, tak se hodnotí IC (hranice pozitivity je IC3, tj. ≥ 10 %).
Reportování nálezu: v každém nálezu by měla být kromě způsobu hodnocení (TPS, TC/IC) a výsledku s uvedením procentuální pozitivity se zohledněním klinicky relevantních cut-offs uvedena i použitá protilátka (případně typ stanovení) a okomentována reprezentativnost vzorku s ohledem na splnění kvantitativního limitu a dalších aspektů.
Prediktivní testování u nemalobuněčného karcinomu plic v ČR
V ČR je prediktivní testování obecně realizováno v síti tzv. referenčních laboratoří, které fungují v rámci vybraných pracovišť patologie (tab. 1). Celkově se jedná o 11 laboratoří, jejichž aktuální seznam a spektrum jimi vyšetřovaných markerů jsou dostupné i např. na webových stránkách Společnosti českých patologů (SČP) České lékařské společnosti Jana Evangelisty Purkyně (ČLS JEP) [17], České onkologické společnosti (ČOS) ČLS JEP [18] a v Modré knize [19]. Algoritmy testování a spektrum analyzovaných markerů jsou pravidelně aktualizovány na jednání mezi plátci a zástupci SČP a ČOS ČLS JEP (schéma 1) [20]. Poslední aktualizace je z 5. 3. 2020 [21]. Souhrnně je aktuálně platný algoritmus prediktivního testování u NSCLC v ČR následující:
Table 1. Seznam referenčních laboratoří pro vyšetřování prediktivních markerů. 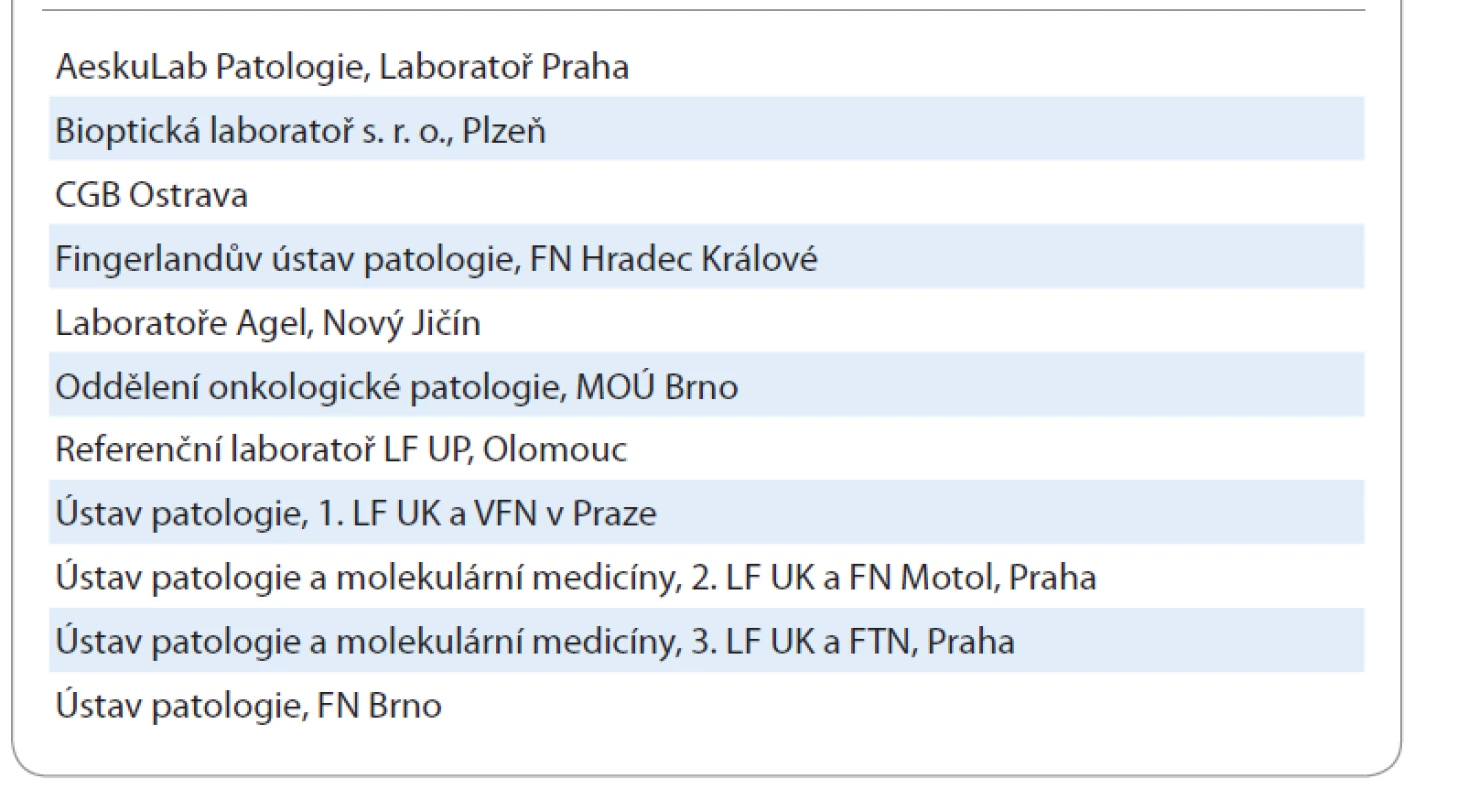
Schéma 1. Algoritmus prediktivního testování u nemalobuněčného karcinomu plic v ČR. 
EGFR – receptor pro epidermální růstový faktor, NOS – jinak nespecifikováno, NSCLC – nemalobuněčný karcinom plic, PD-L1 – programmed death ligand 1 EGFR – u morfologicky definovaných subtypů (adenokarcinom či jeho komponenta, NSCLC spíše adenokarcinom, NSCLC NOS) z malých bioptických vzorků automaticky (reflexně) v době stanovení diagnózy, u jiných histologických typů či u resekátu na žádost onkologa.
ALK – u morfologicky definovaných subtypů (stejných jako u EGFR) automaticky v době stanovení diagnózy. Vyšetření se provádí imunohistochemicky, případy hodnocené jako 3+ jsou pozitivní a neověřují se metodou FISH. Případy hodnocené jako 0 jsou negativní a neověřují se metodou FISH, ostatní případy (1+, 2+) jsou nejisté a ověřují se metodou FISH.
ROS1 – u morfologicky definovaných subtypů (stejných jako u EGFR) automaticky v době stanovení diagnózy. Vyšetření se provádí imunohistochemicky, případy hodnocené jako 0 jsou negativní a neověřují se metodou FISH, všechny ostatní případy (1+, 2+, 3+) je nutné ověřit metodou FISH na žádost onkologa před nasazením cílené léčby.
PD-L1 – vyšetření se provádí automaticky v době diagnózy u všech subtypů NSCLC.
K dispozici jsou i pravidelně aktualizované národní guidelines (Nádory plic – doporučený postup pro bioptické vyšetření), které se zaměřují na problematiku bioptické diagnostiky nádorů plic komplexně a jejichž součástí je i algoritmus prediktivního testování. Tyto guidelines jsou volně dostupné na webových stránkách SČP [22].
Diskuze
Prediktivní testování je u NSCLC standardní a zcela nezbytnou součástí diagnostického procesu. Postupy, které se algoritmům a indikacím tohoto testování věnují, jsou dostupné a měly by být všeobecně známé [6,9]. Implementace těchto postupů do praxe je naprosto zásadní, naráží však na nejrůznější problémy. Zajímavé jsou výsledky recentní dotazníkové studie IASCL, do které se zapojilo 2 537 respondentů ze 102 zemí. Na obecné úrovni je podle tohoto přehledu celkově prediktivní testování provedeno u méně než 50 % pacientů s NSCLC, u kterých by provedeno být mělo. Nespokojenost s prediktivním testováním vyjádřilo množství respondentů mezi žadateli o testování, ale i mezi těmi, kdo testy provádějí a interpretují. Stížnosti zahrnovaly zejména nesrozumitelnost výsledku (37 % respondentů), kvalitu vzorků (23 % respondentů mělo více než 10 % vzorků nevhodných na prediktivní testování), dlouhou dobu odezvy a další [23]. Jako největší překážky v testování byly vnímány náklady na testování (jeho úhrada), kvalita materiálu a testů (nedostatečný počet nádorových buněk, špatná kvalita tkáně, nedostatečná senzitivita či selhání testu, nízká kvalita laboratoře), dostupnost testování, znalost o možnostech testování (třetina respondentů si nebyla vědoma existence recentních guidelines!) a doba odezvy. S ohledem na překážky v testování se jako nejvíce problematické jevily náklady na testování, kdy celosvětově nejčastějším způsobem úhrady byla přímá platba pacientem (63 %), následovaná úhradou z veřejné (státní) podpory (kam lze zařadit i veřejné zdravotní pojištění) (40 %), podporou farmaceutických společností (29 %) a soukromým zdravotním pojištěním (16 %). Celkově je však tato data obtížné aplikovat na konkrétní zemi, jednalo se o opravdu široký přehled, ve kterém dominovali respondenti z Asie (52 %), následovala Evropa (19 %), Latinská Amerika (11 %), USA a Kanada (11 %) a zbylé oblasti (7 %). S ohledem na další potenciální zdroje jsou data týkající se aspektů testování v jednotlivých zemích dostupná pouze částečně. Zajímavé jsou souhrnné údaje týkající se testování v reálné praxi – v nedávném přehledu je krátce diskutován počet testovaných pacientů v USA s ohledem na jednotlivé markery a vývoj v čase (EGFR: 2010 – 18 %, 2013 – 22 %, 2016 – 61 %, 2018 – 87 %; ALK: 2011 – 32 %, 2018 – 67–69 %), nicméně jak autoři zmiňují, data jsou limitovaná a obtížně dostupná [24].
Vzhledem k rozšiřujícímu se spektru molekulárních aberací je sekvenční testování jednotlivých genů v případě NSCLC problematické ve více aspektech, zejména těch, které se týkají nákladů (ve finále je sekvenční testování pro plátce dražší než komplexní vyšetření metodou NGS) a často limitního množství nádorové tkáně. Úhradové mechanizmy týkající se vyšetření metodou NGS v jednotlivých zemích jsou nad rámec tohoto sdělení, např. v USA je ale u NSCLC testování z prostředků zdravotního pojištění dostupné a recentní doporučení ESMO týkající se využití NGS v rutinní praxi zařadilo právě NSCLC jako jediný nádor, u kterého by mělo být toto vyšetření děláno rutinně standardně i mimo akademická centra [24,25]. V ČR proběhla v roce 2020 konsenzuální jednání na úrovni odborných společností (SČP a ČOS), na kterých byly definovány možnosti komplexního prediktivního testování metodou NGS v praxi se zohledněním indikací a očekávaných počtů vyšetření. Výsledkem těchto jednání byl mj. i panel genů, které by měly být u NSCLC testovány. Testování metodou NGS by však aktuálně nemělo nahradit stávající algoritmy testování, ale mělo by být provedeno na základě požadavku onkologa u vybraných pacientů, ať už v rámci primární diagnózy, nebo v průběhu onemocnění, v závislosti na stavu pacienta a pokročilosti nádorové léze. Seznam předpokládaných testovaných molekulárních markerů je v tab. 2. Výhodou tohoto testování je snadná možnost rozšíření panelu prediktorů o další klinicky relevantní markery. Ohledně možnosti využití metody NGS v rutinní prediktivní diagnostice u onkologicky nemocných pacientů probíhají jednání s plátci, která by měla být finalizována v průběhu roku 2021.
Table 2. Seznam navrhovaných markerů pro komplexní molekulární testování u nemalobuněčného karcinomu plic. 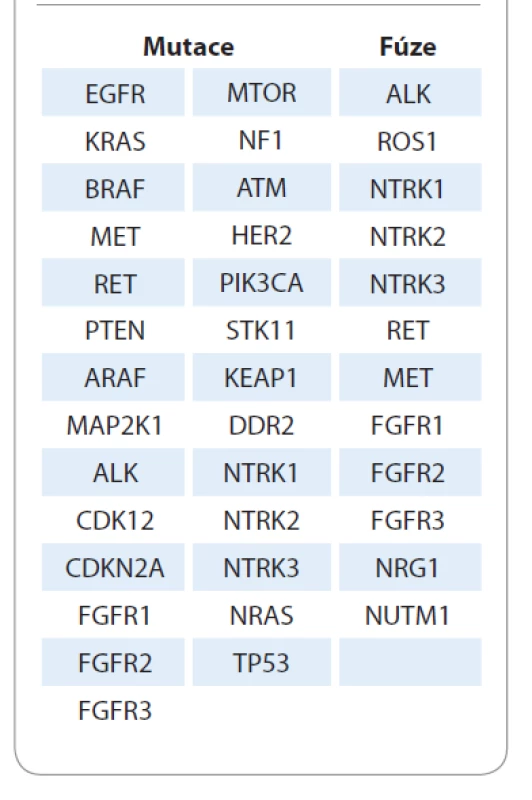
Závěr
Prediktivní testování je nezbytnou součástí diagnostiky, bez které není správná léčba pacientů s karcinomem plic možná. V ČR je testování ze strany odborných společností i plátců věnována značná pozornost a testování probíhá v souladu s mezinárodními i národními doporučeními. Na národní úrovni je testování zajišťováno v síti tzv. referenčních laboratoří v rámci vybraných pracovišť patologie. Kromě prediktivního testování zaměřeného na konkrétní geny (ať už na úrovni DNA a RNA, nebo na úrovni exprese příslušných proteinů detekovatelných imunohistochemicky) je poměrně recentně součástí prediktivního testování i testování exprese PD-L1, které je metodicky relativně komplikované a od vyšetřující laboratoře vyžaduje přesnou validaci metody, pravidelnou účast v programech externí kontroly kvality a na úrovni odborných společností kontinuální jednání zaměřená na implementaci nových poznatků a indikací do praxe. I přes vše výše uvedené nadále zůstává skupina pacientů, u kterých nejsou všechna potřebná vyšetření provedena. Důvodů je celá řada, jejich podrobný rozbor je nad rámec tohoto sdělení. U části pacientů je k dispozici tkáň, která umožní stanovení diagnózy, pro prediktivní vyšetření je však nedostatečná (ať už kvůli kvantitativnímu limitu, nízké kvalitě DNA/RNA či charakteru odběru – to se týká zejména cytologických nátěrů, u kterých není současně dostupný materiál na cytoblok). S ohledem na budoucí vývoj lze očekávat rozšíření prediktivního testování o další markery a širší využití metody NGS v rutinní praxi, to je však teprve předmětem jednání s plátci.
Práce byla podpořena MZ ČR (RVO 64165) a Univerzitou Karlovou (projekt Progress Q28/ LF1).
This work was supported by the Ministry of Health of the Czech Republic (RVO 64165) and by Charles University (project Progress Q28/LF1).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
prof. MUDr. Pavel Dundr, Ph.D.
Ústav patologie, 1. LF UK
a VFN v Praze
Studničkova 2
128 00 Praha 2
e-mail: pavel.dundr@vfn.cz
Přijato/Accepted: 15. 1. 2021
Sources
1. Barta JA, Powell CA, Wisnivesky JP. Global epidemiology of lung cancer. Ann Glob Health 2019; 85 (1): 8. doi: 10.5334/aogh.2419.
2. Yang P. Epidemiology of lung cancer prognosis: quantity and quality of life. Methods Mol Biol 2009; 471 : 469–486. doi: 10.1007/978-1-59745-416-2_24.
3. Antonicelli A, Cafarotti S, Indini A et al. EGFR-targeted therapy for non-small cell lung cancer: focus on EGFR oncogenic mutation. Int J Med Sci 2013; 10 (3): 320–330. doi: 10.7150/ijms.4609.
4. Blackhall FH, Peters S, Bubendorf L et al. Prevalence and clinical outcomes for patients with alk-positive resected stage I to III adenocarcinoma: results from the European Thoracic Oncology Platform lungscape project. J Clin Oncol 2014; 32 (25): 2780–2787. doi: 10.1200/JCO.2013.54.5921.
5. Kerr KM, Thunnissen E, Dafni U et al. A retrospective cohort study of PD-l1 prevalence, molecular associations and clinical outcomes in patients with NSCLC: results from the European Thoracic Oncology Platform (ETOP) lungscape project. Lung Cancer 2019; 131 : 95–103. doi: 10.1016/j.lungcan.2019.03.012.
6. Kalemkerian GP, Narula N, Kennedy EB. Molecular testing guideline for the selection of lung cancer patients for treatment with targeted tyrosine kinase inhibitors: American Society of Clinical Oncology endorsement summary of the College of American Pathologists/International Association for the Study of Lung Cancer/Association for Molecular Pathology clinical practice guideline update. J Oncol Pract 2018; 14 (5): 323–327. doi: 10.1200/JOP.18.00035.
7. Lindeman NI, Cagle PT, Aisner DL et al. Updated molecular testing guideline for the selection of lung cancer patients for treatment with targeted tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J Thorac Oncol 2018; 13 (3): 323–358. doi: 10.5858/arpa.2017 - 0388-CP.
8. Lindeman NI, Cagle PT, Beasley MB et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J Thorac Oncol 2013; 8 (7): 823–859. doi: 10.1097/JTO.0b013e318290868f.
9. Lindeman NI, Cagle PT, Beasley MB et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. Arch Pathol Lab Med 2013; 137 (6): 828–860. doi: 10.5858/arpa.2012-0720-OA.
10. Lindeman NI, Cagle PT, Beasley MB et al. Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J Mol Diagn 2013; 15 (4): 415–453. doi: 10.1016/j.jmoldx.2013.03.001.
11. Gubens MA, Davies M. NCCN guidelines updates: new immunotherapy strategies for improving outcomes in non-small cell lung cancer. J Natl Compr Canc Netw 2019; 17 (5.5): 574–578. doi: 10.6004/jnccn.2019. 5005.
12. Planchard D, Popat S, Kerr K et al. Metastatic non - -small cell lung cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol 2018; 29 (Suppl 4): iv192–iv237. doi: 10.1093/annonc/mdy275.
13. www.nccn.org.
14. https: //www.cap.org/protocols-and-guidelines/upcoming-cap-guidelines/pd-l1-testing-of-patients-with-lung-cancer-for-immunooncology-therapies
15. Lantuejoul S, Sound-Tsao M, Cooper WA et al. PD-11 testing for lung cancer in 2019: perspective from the IASLC Pathology Committee. J Thorac Oncol 2020; 15 (4): 499–519. doi: 10.1016/j.jtho.2019.12.107.
16. Skov BG, Skov T. Paired comparison of PD-l1 expression on cytologic and histologic specimens from malignancies in the lung assessed with PD-l1 IHC 28-8pharmDx and PD-11 IHC 22c3pharmDx. Appl Immunohistochem Mol Morphol 2017; 25 (7): 453–459. doi: 10.1097/PAI.0000000000000 540.
17. http: //patologie.info/standardy/39.
18. https: //www.linkos.cz/lekar-a-multidisciplinarni-tym/personalizovana-onkologie/prediktivni-markery/informace-o-siti-referencnich-laboratori-pro-vysetrovani-prediktivnich-markeru/.
19. https: //www.linkos.cz/lekar-a-multidisciplinarni-tym/diagnostika-a-lecba/modra-kniha-cos/aktualni-vydani-modre-knihy/26-36-prediktivni-vysetreni-solidnich-nadoru/
20. Matej R, Rohan Z, Nemejcova K et al. Molecular pathology of lung cancer in routine diagnostic practice: 2017 update. Cesk Patol 53 (4): 159–166.
21. http: //patologie.info/standardy/41.
22. http: //patologie.info/standardy/40.
23. Smeltzer MP, Wynes MW, Lantuejoul S et al. The international association for the study of lung cancer global survey on molecular testing in lung cancer. J Thorac Oncol 2020; 15 (9): 1434-1448.
24. Pennell NA, Arcila ME, Gandara DR et al. Biomarker testing for patients with advanced non-small cell lung cancer: real-world issues and tough choices. Am Soc Clin Oncol Educ Book 2019; 39 : 531–542. doi: 10.1200/EDBK_237863.
25. Mosele F, Remon J, Mateo J et al. Recommendations for the use of next-generation sequencing (NGS) for patients with metastatic cancers: a report from the ESMO precision medicine working group. Ann Oncol 2020; 31 (11): 1491–1505. doi: 10.1016/j.annonc.2020.07.014.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2021 Issue Supplementum 1-
All articles in this issue
- Karcinom plic – diagnostika a časný záchyt
- Role multidisciplinárního týmu a molekulárního tumor boardu v léčbě pacienta s karcinomem plic
- Prediktivní testování u nemalobuněčného karcinomu plic
- Chirurgická léčba karcinomu plic
- Nové možnosti léčby časného a lokálně pokročilého nemalobuněčného karcinomu plic
- Cílená terapie nemalobuněčného plicního karcinomu
- Imunoterapie v léčbě nemalobuněčného karcinomu plic
- Pokroky v léčbě malobuněčného karcinomu plic
- Editorial
- Budoucnost léčby karcinomu plic
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Karcinom plic – diagnostika a časný záchyt
- Chirurgická léčba karcinomu plic
- Pokroky v léčbě malobuněčného karcinomu plic
- Budoucnost léčby karcinomu plic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

