-
Medical journals
- Career
Karcinom plic – diagnostika a časný záchyt
Authors: J. Skřičková 1; T. Nebeský 2; B. Kadlec 1; K. Hejduk 3; O. Májek 3; M. Vašáková 4; I. Čierná Peterová 5
Authors‘ workplace: Klinika nemocí plicních a TBC LF MU a FN Brno 1; Klinika radiologie a nukleární medicíny LF MU a FN Brno 2; Národní screeningové centrum, ÚZIS ČR Praha a Institut bio statistiky a analýz, LF MU Brno 3; Pneumologická klinika 1. LF a FTN Praha 4; Plicní ambulance, Brandýs n. L. 5
Published in: Klin Onkol 2021; 34(Supplementum 1): 6-19
Category: Review
doi: https://doi.org/10.48095/ccko2021S6Overview
Rozhodování o léčbě nemocného s karcinomem plic se odvíjí od klinického stadia onemocnění, morfologické diagnózy, vyšetření prediktivních markerů a celkového klinického stavu; přihlížet se musí i k přání dobře informovaného pacienta. Přesně provedená diagnostika má zásadní význam pro další osud nemocného s karcinomem plic. Epidemiologie karcinomu plic souvisí se spotřebou cigaret. Riziko onemocnění se zvyšuje s množstvím vykouřených cigaret. Relativní riziko u kuřáků je 22,4, u velmi silných kuřáků s náloží větší než 25 balíčkoroků může dosahovat hodnoty až 50. Většina případů karcinomu plic se zachytí ve fázi pokročilého onemocnění, kdy již není možná operace a někdy ani jiné aktivní způsoby léčby. Zásadní význam pro snížení úmrtnosti na karcinom plic má vyhledávání karcinomu plic v rizikových skupinách, což vede k záchytu tohoto onemocnění v nízkém stadiu, kdy je nádor operabilní.
Klíčová slova:
karcinom plic – diagnostika karcinomu plic – screening karcinomu plic
Úvod
Rozhodování o léčbě nemocného s karcinomem plic se odvíjí od klinického stadia onemocnění, morfologické diagnózy, vyšetření prediktivních markerů, celkového klinického stavu a přihlížet se musí i k přání dobře informovaného pacienta. Přesně provedená diagnostika má zásadní význam pro další osud nemocného s karcinomem plic.
Příznaky lokálně pokročilého karcinomu plic
Vzhledem k tomu, že plicní tkáň má málo senzitivních zakončení a plíce mají velkou kompenzační schopnost, přichází většina nemocných poprvé k lékaři s příznaky. A pokud jsou přítomny příznaky, jedná se o pokročilé onemocnění. Přesto jsou nemocní často odesíláni s příznaky karcinomu na nejrůznější vyšetření, než je indikován skiagram hrudníku. Znalost příznaků karcinomu plic vede k tomu, že potřebná další vyšetření jsou zahájena dříve [1].
Bolesti na hrudníku
Bolesti na hrudníku vznikají při invazi nádoru do parietální pleury, svalstva, žeber nebo kůže. Bolest na hrudníku zjistíme při správně odebrané anamnéze u 40 % nemocných. Je neurčitého charakteru, často je vázána na kašel a nádech.
Zvláštní lokalizaci představuje plicní hrot – zde přistupuje k výše jmenovaným strukturám ještě plexus brachialis, jehož postižení prorůstajícím nádorem nebo infiltrovanými uzlinami může nemocnému způsobit kruté bolesti horní končetiny, a krční sympatická pleteň. Pacienti s tímto typem plicního karcinomu zvaným Pancoastův tumor jsou někdy zpočátku vyšetřováni a léčeni ortopedicky nebo neurologicky. Pancoastův tumor může mít ještě další projevy – Hornerův (Claude Bernardův-Hornerův) syndrom (mióza – ptóza – enoftalmus) z postižení krční sympatické pleteně a syndrom horní duté žíly [1–4].
Chrapot
Chrapot je jedním z nejčastějších symptomů spojených s lokálním šířením karcinomu. Nervus laryngeus recurrens ovládající levou hlasivku vychází z krční míchy, obtáčí velké cévy a vrací se k hlasivkám; ve svém mediastinálním úseku tedy může být ohrožen rostoucím nádorem nebo i zvětšenými uzlinami. Chrapot způsobený útlakem rekurentu a parézou hlasivky není doprovázen známkami infekce horních cest dýchacích ani bolestí v krku [1–4].
Syndrom horní duté žíly
Na opačné straně hrudníku probíhá v. cava superior drénující hlavu a horní končetiny. Dojde-li k invazi tumoru na pravou stranu krku nebo zvětšení tamních uzlin, může dojít k syndromu horní duté žíly, jenž se projevuje nejprve distenzí krčních žil a později otokem obličeje a krku (Stokesův límec) s cyanózou (obr. 1) [1–4].
Image 1. Syndrom horní duté žíly. 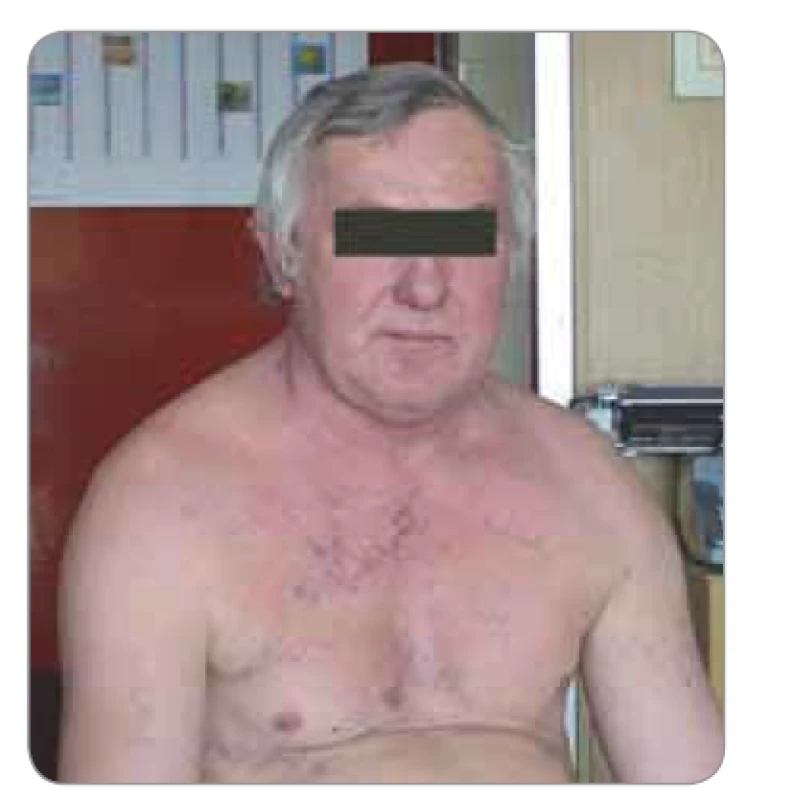
Polykací obtíže
Polykací obtíže vznikají v rámci regionální progrese nádoru při zúžení jícnu [1–4].
Dušnost
Dušnost bývá přítomna u 30 % nemocných s karcinomem plic, především starších. Může být podmíněna růstem samotného nádoru a/nebo vznikem pleurálního výpotku, který je takového rozsahu, že utlačuje plicní parenchym. Dušnost může být i důsledkem sekundární anemie [1–4].
Mimoplicní příznaky karcinomu plic
I když bronchogenní karcinom může metastazovat do kteréhokoli orgánu, nejnápadnější projevy vyvolávají metastázy do CNS (neurologické či psychické poruchy), do skeletu (bolesti, patologické fraktury) a do kostní dřeně (anemie). Naproti tomu metastázy do jater, jež bývají časté i četné, mohou dlouho zůstávat klinicky němé. Někdy se metastázy do jater mohou projevit ikterem a další hepatobiliární symptomatologií [1–4].
Fyzikální nález
Fyzikální nález na hrudníku bývá často normální. Někdy se však můžeme setkat s oslabeným až vymizelým dýcháním, zkráceným poklepem, trubicovým dýcháním, přízvučnými chrůpky. Vymizelé dýchání a zkrácený poklep svědčí o přítomnosti pleurálního výpotku. Nálezem nepříliš vzácným jsou i pískoty a vrzoty, které mohou být slyšitelné nad jednou nebo oběma plícemi. Cíleně musíme vyšetřovat i lymfatické uzliny, především nadklíčkové, za kývači a v podpažních jamkách. Na základě nálezu zvětšených jater, někdy s nerovným okrajem, můžeme usuzovat na metastatické postižení. Symptomatologie pak odpovídá rozsahu a propagaci nádoru [1,4].
Diferenciální diagnostika
Podobný klinický obraz jako bronchogenní karcinom mohou mít také některé další plicní nádory, některé formy nespecifických plicních zánětů, některé formy tuberkulózy; tuberkulóza plic se výjimečně může vyskytovat společně s bronchogenním karcinomem.
Obecně platí, že v případě, kdy se dostupnými vyšetřovacími metodami nepodařilo určit, o jaké postižení plic jde a trvá naléhavé podezření na bronchogenní karcinom, je indikována torakotomie. Samozřejmě jen v případě, že nález po zhodnocení lokoregionálního rozsahu a přítomnosti vzdálených metastáz je operabilní a nemocný je z hlediska plicních funkcí schopen resekčního zákroku na plicích. Pro nemocného je totiž menším rizikem chirurgické odstranění rezidua po bronchopneumonii než ztrácet čas sledováním neověřeného bronchogenního karcinomu [1,4].
Zobrazovací metody v diagnostice karcinomu plic
Moderní zobrazovací metody ve srovnání s klasickými, kam řadíme skiagrafii, mají vyšší prostorové a časové rozlišení. Mezi moderní zobrazovací metody dnes řazené do diagnostických algoritmů počítáme ultrazvuk (UZ) a především výpočetní tomografii (computed tomography – CT) doplněnou o vyšetření s vysokým rozlišením (high resolution computed tomography – HRCT). Pro své vysoké měkkotkáňové rozlišení nachází využití v diagnostice bronchogenního karcinomu i magnetická rezonance (MR), i když jen ve specifických indikacích. Dále sem řadíme pozitronovou emisní tomografii (PET), která je využívána jako součást hybridních zobrazovacích metod (PET/CT nebo PET/MR). Biopsie navigovaná pod CT kontrolou je rutinní součástí vyšetřovacích metod [4].
Projevy karcinomu plic v zobrazovacích metodách
Primární plicní karcinom je obvykle solitární, nicméně jej relativně často můžeme zachytit až ve stadiu metastatické diseminace. Z pohledu zobrazení se karcinomy plic dělí na tumory periferní a centrální. Za periferní nádory považujeme ty, které vznikají periferně od plicního hilu, centrální tumory vznikají v oblasti hilu či v jeho těsné blízkosti.
Přibližně 40 % plicních nádorů se nachází periferně, vznikají za úrovní segmentárních bronchů. Jedinou jejich známkou je pak zastínění ložiskového charakteru na snímku plic. Karcinomy o velikosti < 1 cm jsou na snímku plic zřídka zastiženy. Multidetektorová výpočetní tomografie umožňuje detekci i menších ložisek. Zásadní zobrazovací známkou u centrálních nádorů je zvětšení hilu a kolaps či konsolidace plicní tkáně periferně od tumoru [4,5].
Skiagrafie (skiagram hrudníku)
Sumační zobrazení trojrozměrného objektu je dostupné, levné a opakovatelné, s nízkou radiační zátěží. Je časově nenáročné. Jeho nevýhodou je poměrně malé prostorové rozlišení, které je podmíněno mimo jiné již zmíněnou sumací. Tu částečně odstraňujeme dvěma projekcemi na sebe kolmými a tvrdou snímkovací technikou. Díky digitalizaci má dnes hodnotící lékař a klinický pracovník vše v elektronické podobě.
Bronchogenní karcinom se tak může zobrazit jako různě veliké, různě syté zastínění kdekoliv v plicích. Existují charakteristiky, které napomáhají při diferenciální diagnostice zastínění v plicích. Mezi ně řadíme např. tvar, ohraničení, sytost a homogenitu zastínění. Samotné nádorové ložisko způsobuje nejčastěji středně syté zastínění okrouhlého či oválného tvaru, které v případě nekrotického rozpadu vykazuje projasnění až dutinového charakteru (Joresova kaverna). Kontury jsou obvykle lobulární, nepravidelné, vzácněji špatně definovatelné. Pro maligní formaci často svědčí spikulace, tzv. corona radiata. Vedle samotného zastínění, které nádor způsobuje, můžeme pomocí snímku plic odhalit výpotek, patologicky zvětšené uzliny (projevující se rozšířením mediastina a zvětšením plicních hilů), sekundární patologické postobstrukční stavy, jakými jsou atelektáza, bronchopneumonie a patologické postavení mediastina a bránice. Tyto změny jsou často patrné u centrálních nádorů. Skiagrafie umožňuje i posouzení skeletu hrudníku, jeho strukturální a tvarové změny, nejčastěji pak změny související s metastatickou hematogenní diseminací či destrukcí skeletu přímo se šířící nádorovou tkání (obr. 2) [4].
Image 2. Destrukce žebra prorůstajícím nádorem. 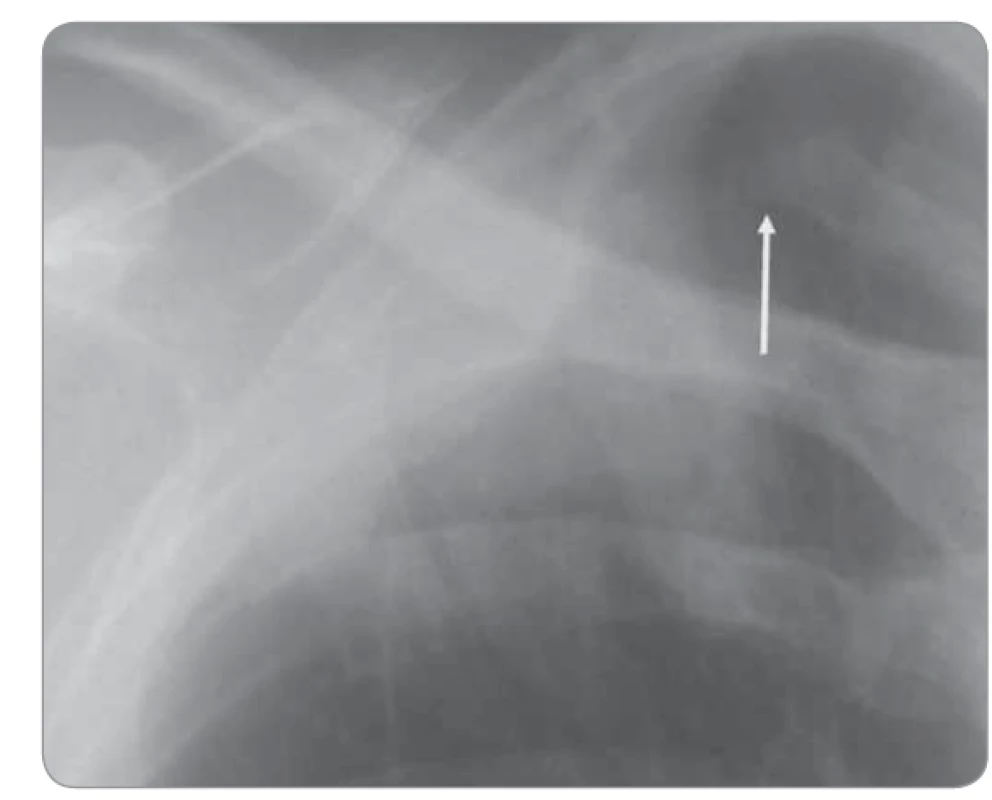
Obtížná je diferenciace malých nádorů, nádorů endobronchiálně rostoucích, navíc sumujících se do jiných struktur hrudníku. To jsou nejčastější důvody falešně negativních nálezů.
Výpočetní tomografie/multidetektorová výpočetní tomografie (CT/MDCT)
MDCT (spirální, helikální) umožňuje vyšší prostorové rozlišení. Díky submilimetrové vrstvě při náběru dat lze využít následně izotropie k zobrazení jakéhokoliv orgánu, tedy i plic, v různých rovinách. Díky softwarovému vybavení přístrojů lze dnes vytvářet derivované obrazy známé pod zkratkou MIP (maximum intensity projection), např. pro zobrazení cév, a MinIP (minimum intensity projection), které jsou vhodné pro zobrazení horních cest dýchacích. Můžeme provádět angiografická vyšetření i virtuální bronchoskopie [4,5].
Vyšetření se provádí podle standardizovaného protokolu. Nejprve se provádí náběr dat v nativním módu a následně po aplikaci kontrastní látky intravenózně. Vyšetření se provádí standardně od nadklíčků po dolní pól jater, vč. zobrazení nadledvin, jelikož játra a nadledviny jsou častou lokalizací metastatického postižení [4,5].
Stejně jako na rentgenovém snímku je i na MDCT typickým obrazem nádoru solitární plicní uzel. Plicní uzel bývá velikosti v maximálním rozměru do 3 cm a je obklopen plicní tkání. Jeho tvar, kontury a ohraničení vykazují podobné charakteristiky jako při zobrazení na prostém rentgenovém snímku plic. Velice dobře je na CT/HRCT diferencovatelná spikulace (obr. 3). Ložisko o velikosti > 3 cm v max. rozměru vytváří obraz solidní nádorové infiltrace. U těchto větších infiltrací pak lze častěji očekávat infiltraci parietální pleury, mediastina a centrálních hilových struktur [4,5].
Image 3. Výpočetní tomografie – sken karcinomu plic. 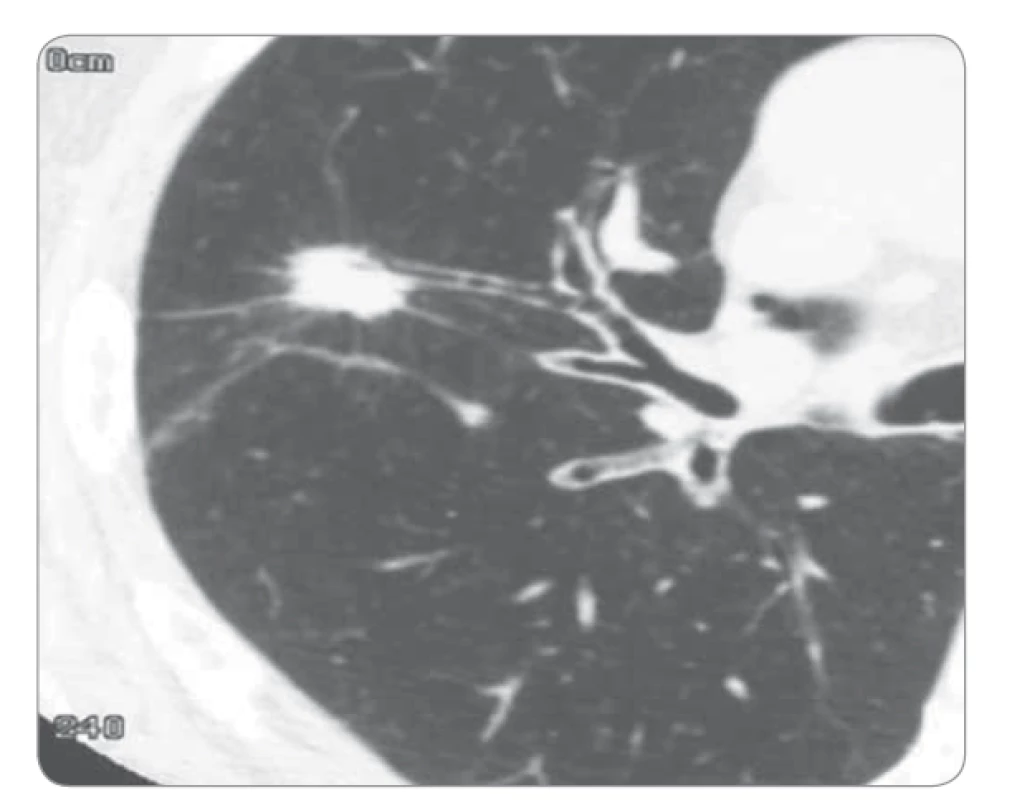
Často lze v CT obraze diferencovat postobstrukční změny, jako jsou atelektáza či pneumonitida. To je nejčastěji podmíněno endobronchiálním růstem nádoru. Rozsah postobstrukčních změn závisí na lokalizaci nádoru, zda obturuje hlavní, lobární či segmentární bronchus. Současně je možné pozorovat zmenšení hemitoraxu, přesun mediastina na stranu nádoru, elevaci bránice, podobně jako na skiagrafii. Hranici vlastní nádorové infiltrace je velmi obtížné odlišit od výše popsaných postobstrukčních změn a ani aplikace kontrastní látky intravenózně není často nápomocná. U postobstrukční pneumonitidy na rozdíl od zánětlivé bronchopneumonie nemusí být přítomný vzduch v bronších (air bronchogram). V HRCT obraze lze dobře odhalit šíření nádoru lymfatickými a perilymfatickými prostorami – karcinomatózní lymfangiopatii [4,5].
Lepidický (dříve bronchioloalveolární, někdy též tapetující) karcinom imituje zánětlivé postižení projevující se alveolárními opacitami. Ty je možno pozorovat jako fokální patologické denzity nebo ve formě difuzního postižení v rozsahu segmentu, laloku či celého křídla plicního. Diferenciace od zánětlivé infiltrace v CT obraze není s jistotou možná [4,5].
Další formou plicní infiltrace nádorové etiologie je Pancoastův tumor, který se nachází v typické apikální lokalizaci, infiltruje stěnu hrudní vč. skeletu, u pokročilých forem pak dosahuje k brachiálnímu plexu. Nádor může prorůstat do jícnu, trachey, obratlových těl. Pacienti obvykle strádají bolestmi vystřelujícími do horní končetiny (obr. 4) [4,5].
Image 4. Karcinom plic v oblasti vrcholu pravé plíce. 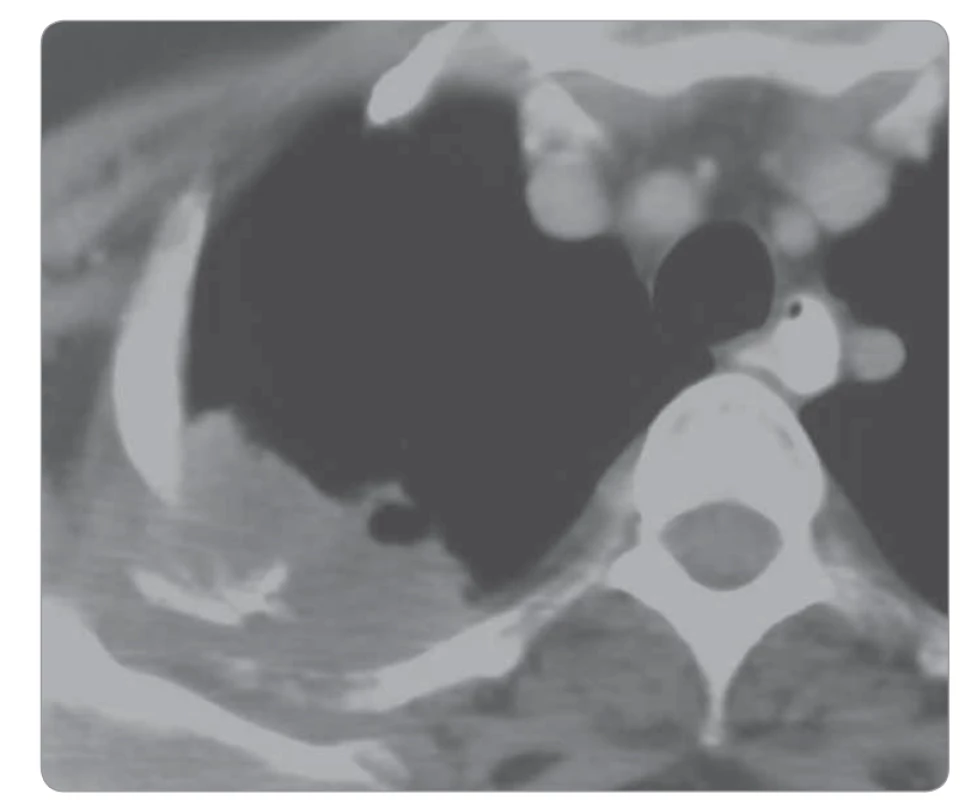
Při popisu CT vyšetření může být zachycen pleurální anebo perikardiální výpotek. CT oproti skiagramu hrudníku přesněji odhadne množství tekutiny. Součástí popisu CT vyšetření je zhodnocení hilových a mediastinálních uzlin. Nejjednodušší rozdělení uzlin je pak do skupin N1–N3, kdy N1 představuje uzliny bronchopulmonální (hilové), N2 uzliny mediastinální na stejné straně a N3 uzliny mediastinální kontralaterálně. Ke skupině N3 řadíme dále ipsi - či kontralaterální uzliny supraklavikulární a skalenové [4,5].
Magnetická rezonance (MR) hrudníku
Díky většímu měkkotkáňovému rozlišení umožňuje MR lépe diferencovat infiltraci především mediastina a jeho struktur vč. velkých cév, infiltraci stěny hrudní, bránice, perikardu. Poskytuje lepší informaci o rozsahu tumoru, je-li kontraindikováno podání kontrastní látky při CT vyšetření. Vyšetření vyžaduje spolupráci nemocných, neboť doba trvání vyšetření je ve srovnání s CT nepoměrně delší. Toto vyšetření je vhodné ke stanovení rozsahu nádoru lokalizovaného v plicním hrotě (Pancoastův tumor). Vyšetření se provádí rovněž při prorůstání tumorózní infiltrace do páteře a páteřního kanálu [6–8].
Pozitronová emisní tomografie/ /výpočetní tomografie (PET/CT)
V 90. letech byl prokázán význam této metody (využití fluordeoxyglukózy – FDG-PET) v onkologické diagnostice. Dnes má tato metoda, která využívá vysoké akumulace a vysokého metabolizmu FDG u maligních onemocnění, zásadní význam při odlišení benigních a maligních změn. Prostorové rozlišení FDG-PET často neumožňuje diagnostikovat malá plicní ložiska, která jsou detekovatelná na CT vyšetření. Nicméně vysoká akumulace FDG v nádorové tkáni, metastaticky postižených lymfatických uzlinách a ve vzdálených metastázách umožňuje zhodnotit rozsah postižení (obr. 5). Ne všechny maligní plicní nádory vykazují vysokou akumulaci a metabolizmus FDG. Patří sem např. adenokarcinom s lepidickým typem růstu, karcinoid a rovněž i nekrotické nádory. PET/CT má vysokou senzitivitu pro detekci maligních plicních lézí. Ložisko lze při negativním FDG-PET/CT označit za benigní při velikosti > 10 mm (neplatí u non-solidních lézí). Nejčastější příčinou falešně pozitivních nálezů jsou granulomatózní onemocnění, poradiační pneumonitida a čerstvé jizvy. Pacient by měl mít alespoň 14denní odstup od chemoterapie a 3měsíční odstup od radioterapie, pokud jde o vyhodnocení ozářené oblasti. U pacienta s diabetem je nutno před vyšetřením kompenzovat glykemii; je-li hladina glukózy > 7 mmol/l, klesá senzitivita vyšetření, při hladině > 10 mmol/l již nelze vyšetření provést [4,9].
Image 5. Pozitronová emisní tomografie/výpočetní tomografie. 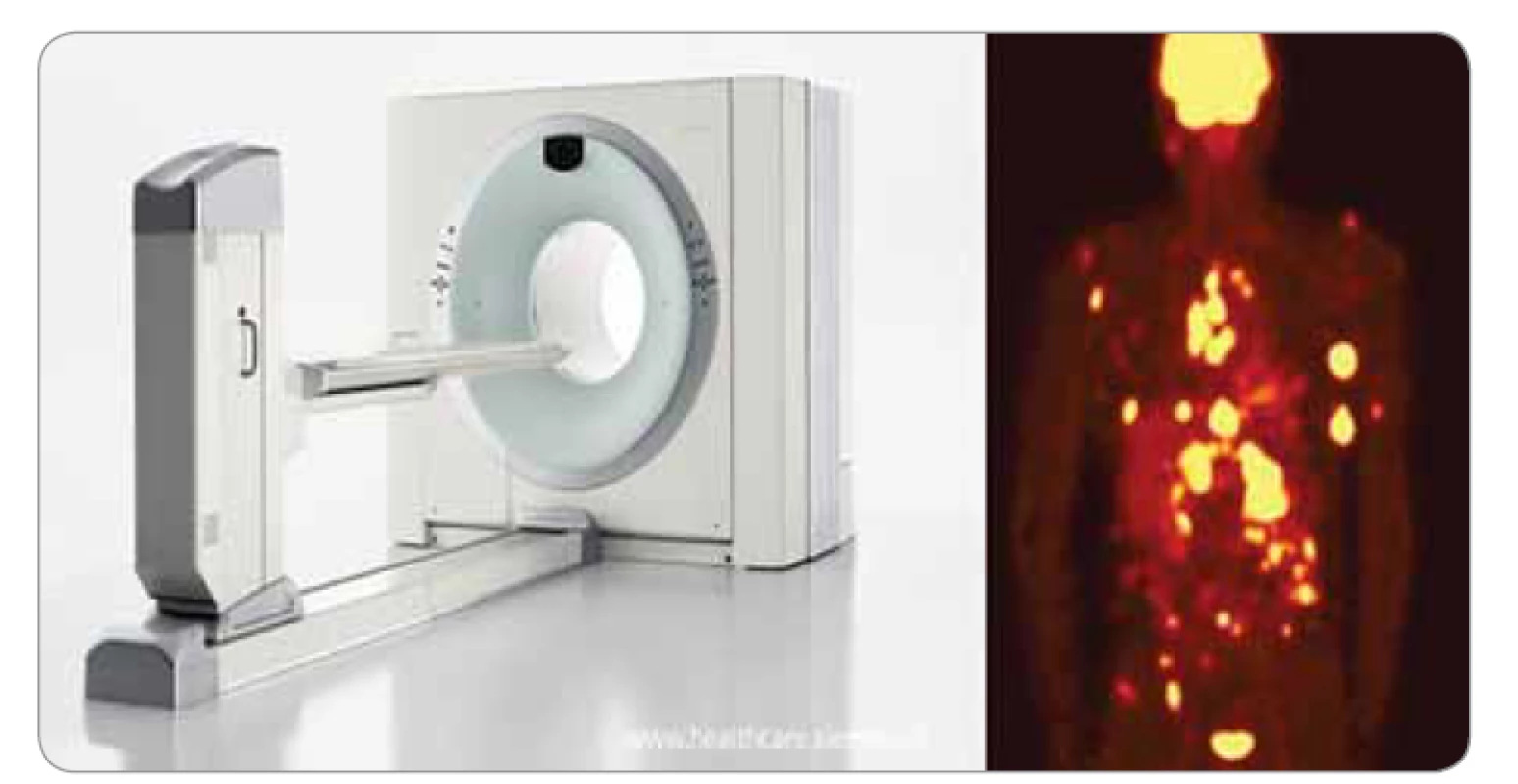
Pozitronová emisní tomografie/magnetická rezonance (PET/MR)
Další hybridní zobrazovací metodou je kombinace vyšetření MR se zobrazením metabolické aktivity pomocí FDG-PET. Možnosti využití i dosahované výsledky jsou obdobné jako u PET/CT. Díky použití MR vyšetření se snižuje radiační zátěž, která je v tomto případě podmíněna pouze podaným radiofarmakem. Nevýhodou je delší čas vyšetření, které tím klade vyšší nároky na pacienta a vyžaduje jeho spolupráci (obr. 6) [4].
Image 6. Pozitronová emisní tomografie/magnetická rezonance. 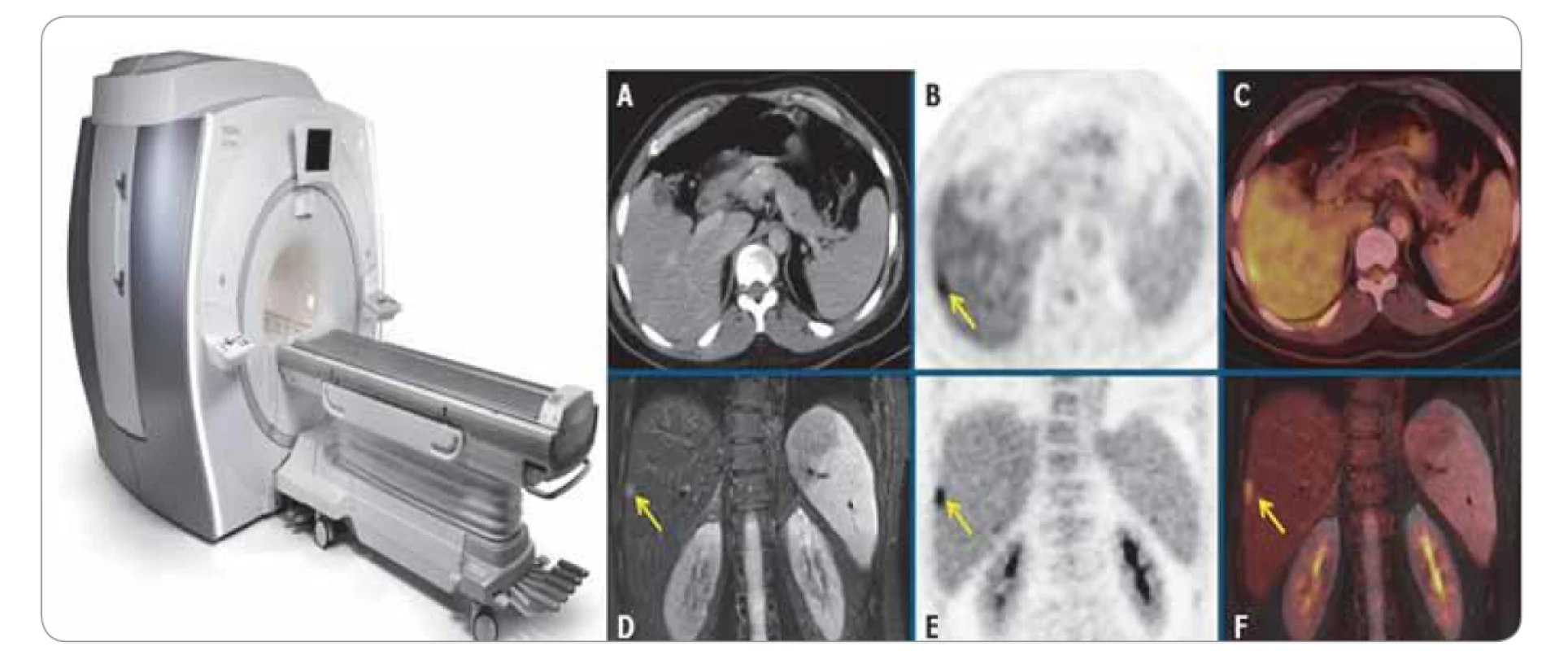
Využití zobrazovacích metod při stanovení klinického stadia
Zlatým standardem při hodnocení rozsahu nádoru (T) je MDCT, někdy může být doplněna vyšetřením MR, zvláště při podezření na infiltraci stěny hrudní, mediastina, při posouzení vztahu nádoru k velkým cévám. FDG-PET pak může pomoci odlišit benigní onemocnění od maligního. Obě uvedené metody mohou lépe než samotné CT odlišit nádor od postobstrukčních změn a posoudit tak jeho velikost. Pomocí PET/CT můžeme kromě samotného nádoru detekovat další metabolicky aktivní ložiska, jež mohou být synchronními nádory či metastázami. Z radiologického hlediska nejdůležitějším ukazatelem pro prognózu onemocnění karcinomem plic omezeným jen na hrudník je přítomnost či absence metastáz v mediastinálních uzlinách. Primární tumor o velikosti > 3 cm (T2) má vyšší incidenci postižení uzlin než tumory menší. Rovněž nádory centrálněji uložené vykazují vyšší incidenci postižení uzlin metastázami v době primární diagnózy [6–8].
Hodnocení postižení uzlin (N) je možno provádět pomocí MDCT. Měřítkem postižení uzlin metastázami je jejich velikost, která se stanoví měřením průměru uzliny v krátké ose. Velikost > 10 mm je již považována za horní hranici normy. Z podstaty věci je však zřejmé, že malé uzliny s mikrometastázami jsou nejčastějším zdrojem falešně negativních nálezů a opačně zánětlivě postižené uzliny větších rozměrů jsou zdrojem falešně pozitivních nálezů. Hodnocení uzlin v rámci stagingu je přesnější pomocí FGD-PET. Mikrometastázy v mízních uzlinách nelze ale ani tímto vyšetřením spolehlivě vyloučit. Při hodnocení nádorového postižení uzlin se udává senzitivita 74–79 %, specificita 91–96 % [7,8].
Vzdálené metastázy šířící se především hematogenní cestou lze odhalit pomocí MDCT, PET/CT nebo PET/MR. Nejčastějším cílovým orgánem jsou nadledviny, játra, skelet, CNS a plíce. Nesporný je význam PET/CT ve stagingu metastáz (M), odhalí větší množství vzdálených metastáz než pouhé CT vyšetření. Proto tedy není možno plánovat kurativní léčbu u pacientů bez vyloučení okultních metastáz PET/CT vyšetřením. MR vyšetření má význam v posouzení případné metastatické infiltrace mozku, u malobuněčných nádorů je součástí stagingu, u nemalobuněčných nádorů se zatím provádí v případě klinického podezření. Stejné metody využíváme u pacientů během léčby či po léčbě k hodnocení nádorové odpovědi, k posouzení rezidua či recidivy onemocnění [5].
Bronchologická diagnostika
Na základě anamnézy, klinického vyšetření a zobrazovacích metod můžeme vyslovit pouze podezření na karcinom plic, ale definitivní diagnóza je diagnóza morfologická (výsledek histologického a/nebo cytologického vyšetření) a vyšetření prediktivních markerů. Bronchoskopické vyšetření je první vyšetření k zisku materiálu z nádorové tkáně, které má být provedeno [4,10–12].
Bronchoskopie má stále větší význam v diagnostice nádorů plic. Uplatňuje se také v léčbě centrálních nádorů ohrožujících průsvit velkých dýchacích cest. V kombinaci s novými navigačními technikami je významná při diagnostice endoskopicky přímo neviditelných periferních ložiskových lézí a peribronchiálně uložených uzlin, čímž zásadně přispívá k posouzení stadia nemoci.
Indikace diagnostické bronchoskopie při podezření na karcinom plic
Při podezření na nádor představují indikaci k bronchoskopii symptomy jako kašel, hemoptýza, dušnost, chrapot nebo stridor, dále komplex symptomů u syndromu horní duté žíly nebo u Pancoastova tumoru. Z nevysvětlených rentgenových nálezů je to obraz ložiskové léze, atelektázy, fluidotoraxu, pneumotoraxu, parézy bránice, stenózy průdušnice nebo bronchu, obraz retikulonodulace, zvětšení mediastina a další jakýkoliv nález podezřelý z možnosti nádoru. V případě nádoru pomáhá bronchoskopie určit rozsah, přispívá k rozhodnutí o operabilitě. Z odebraných vzorků se stanovuje morfologická diagnóza a jsou v nich vyšetřovány prediktivní markery. Dále se pak provádí kontrola po léčbě [4].
Rizika, komplikace a kontraindikace bronchoskopie
Flexibilní bronchoskopie je poměrně bezpečná metoda zatížená velmi nízkou morbiditou i mortalitou. Komplikace různé závažnosti se vyskytují při rutinní bronchoskopii s frekvencí desetin procenta a mortalita se pohybuje v řádech setin procenta. Komplikací akutní bronchoskopie může být progrese preexistujícího respiračního selhávání podmíněná zhoršením ventilace a podáním sedativních léků před vyšetřením. Ze závažných komplikací jde především o možnost arytmií, těžké hypotenze a srdeční zástavy, může dojít k významné hypoxemii, bronchospazmu, vzácně k pneumotoraxu. Velmi obávanou komplikací je masivní krvácení vzniklé většinou při odběru vzorku. Po transbronchiální biopsii může dojít asi u 4 % nemocných k pneumotoraxu [4,10–12].
Jako absolutní kontraindikace flexibilní bronchoskopie bývá uváděn nespolupracující pacient nesouhlasící s vyšetřením a nezkušený lékař provádějící výkon. Dále je to těžká oběhová nestabilita, stav po srdečním infarktu do 48 hodin, život ohrožující arytmie a těžká hypoxemie. Rizikový je výkon u pacienta s trombocytopenií pod 20×109/l nebo se závažnou poruchou koagulace (při protrombinovém času > 2,5 INR). Relativní kontraindikací je těžká oxygenační dysfunkce s nutností podávání vysokých frakcí O2 (PaO2/FiO2 < 300 mmHg, tj. 40 kPa), život ohrožující arytmie, výrazná hemodynamická nestabilita a všechny situace, kde potenciální přínos vyšetření nepřevažuje rizika jeho provedení. Rizika bronchoskopie v celkové anestezii posuzuje anesteziolog. Výkony mají být prováděny jen na pracovištích, která jsou díky přístrojovému, personálnímu a prostorovému vybavení schopna zvládat základní komplikace. Komplikacím během bronchoskopie lze předejít důkladným vyšetřením a správnou přípravou pacienta. Výkon se obecně provádí nalačno (6 hodin po jídle) a 2 hodiny po posledním příjmu tekutin. Doporučuje se monitorace pomocí pulzní oxymetrie [4,10–12].
Příprava pacienta k bronchoskopii
Vyšetření před plánovaným výkonem zahrnuje anamnézu zaměřenou na přidružené respirační, kardiální, neurologické a jiné nemoci. Je třeba znát výskyt alergií a projevy krvácivosti, zvláště při předchozích operacích. Důležitá je anamnéza užívání léků. Je-li plánována celková anestezie, je třeba zjistit, zda se u pacienta v minulosti nevyskytly problémy s obtížnou intubací, popř. jiné komplikace v souvislosti s narkózou. Mezi základní vyšetření před bronchoskopií patří skiagram hrudníku (zadopřední a bočná projekce), optimálně i CT, EKG a s výhodou i spirometrie [4,10,11].
Vyšetření krevní koagulace má smysl především u pacientů, u kterých je podle anamnézy podezření na koagulopatii. Vyšetření krevního obrazu (hlavně trombocytů), INR a aktivovaný částečný tromboplastinový čas je třeba zvažovat dle charakteru výkonu. Větší pozornost je třeba věnovat pacientovi při indikaci transbronchiální biopsie plic. U pacientů s bronchiálním astmatem a CHOPN se doporučuje aplikace inhalačních bronchodilatancií před výkonem jako prevence manifestní bronchokonstrikce a zhoršení plicních funkcí po bronchoskopii. Léky lze podat spolu s kortikosteroidy i během výkonu a po něm. Jako premedikace se doporučuje podat atropin ke snížení sekrece bronchiální sliznice. V poslední době však studie ukazují, že tento postup není nutný [4].
Anestezie při bronchoskopii
Nejčastěji se bronchoskopie provádí v lokální anestezii. Před bronchoskopií se používají obvykle amidová topická anestetika v různých formách a koncentracích (0,5–4 %) v inhalační formě, ve spreji, ve formě gelu. Při známé alergii na trimekainovou řadu lze podat bupivakain (MARCAINE). O složení medikace při bronchoskopii v analgosedaci a v celkové anestezii rozhoduje anesteziolog. Cílem analgosedace je, aby byl pacient adekvátně utlumen se zachovanou spontánní ventilací a hemodynamickou stabilitou [4,10,11].
Při celkové anestezii lze dýchací cesty zajistit pomocí endotracheální trubičky po orotracheální intubaci nebo s použitím laryngeální masky. Při rigidní bronchoskopii se anestezie provádí tak, že okruh ventilátoru se napojí na jeden z bočních portů operačního bronchoskopu. Ventilace se podporuje dýchacím vakem, s výhodou lze použít ventilaci tryskovou [4,11].
Používané bronchoskopické metody
Z obecného pohledu se podle používaných přístrojů využívají dvě základní techniky – flexibilní a rigidní bronchoskopie.
Flexibilní bronchoskopie je endoskopie ohebným přístrojem, který se začal používat od roku 1964 díky vynálezu Shigeta Ikedy. Poprvé byla tehdy v bronchologii použita technika fibroskopu se systémem ohebných vláken. Přístroje mají pracovní kanál, který slouží k odsávání sekretu z dýchacích cest a zavádění různých nástrojů, osvětlení dolní ohebné sekce a vlastní systém optických vláken, pomocí nichž se skládá obraz, který se zvětšuje systémem čoček a pozoruje v okuláru bronchoskopu nebo pomocí přídavné kamery na televizním monitoru. V poslední době již převažují videobronchoskopy s videočipem na distálním konci přístroje a ovládací hlavou na horním konci přístroje, který je kabely spojen s modulem procesoru a monitoru. Tento systém umožňuje kvalitnější obraz a větší komfort vyšetřování. Flexibilní bronchoskopie se může provádět vleže nebo vsedě, většinou v místním znecitlivění. Nejčastější vnější průměr ohebné sekce je 3,5–6,5 mm [4,11,12].
Rigidní bronchoskopie je tradičnější, ale v současnosti méně užívanou technikou. Poprvé byla použita Gustavem Killianem v roce 1897 z terapeutických důvodů, ale velmi rychle se začala používat i diagnosticky. K jejímu časnému rozvoji přispěla další inovace, kterou se zabýval především Chevalier Jackson. Do dýchacích cest se zavádí kovový tubus, kterým se zasouvají rigidní optiky a různé nástroje. Tubusy mají průměry 6–16 mm. Rigidní bronchoskopie je pro pacienta náročnější a v současné době se provádí zpravidla v celkové anestezii. Její výhodou je možnost použití větších nástrojů, lepší kontrola krvácení a jiných komplikací, razantnější možnost punkcí uzlin a přilehlých struktur a možnost lepšího odsávání. Ventilace přes rigidní tubus minimalizuje obstrukci průdušek. Nevýhodou je někdy obtížný přístup do dolních dýchacích cest, možné anatomické limity při nutném záklonu hlavy. Při neustálé miniaturizaci endoskopie se mnohé výhody rigidní bronchoskopie při diagnostice vytrácejí, její význam je především ve specifických terapeutických možnostech [4,11,12].
Dalším důležitým aspektem jsou pomocné navigační systémy, které pomáhají zpřesňovat bronchoskopické vyšetření. Patří sem skiaskopie (C rameno nebo složitější digitalizované systémy), která umožňuje kontrolu pozice bronchoskopu v reálném čase v několika rovinách pohledu. Rozvíjí se také navigace pomocí CT nebo elektromagnetická navigace, která je již spjata se speciální endoskopickou technikou [4,11,12].
Bronchoskopie v bílém světle
Zlepšení diagnostiky umožňuje několik inovovaných nebo zcela nových technologií. Kontinuální inovací je vlastně neustálé zkvalitňování flexibilních bronchoskopů. Fibroskopy jsou postupně vytlačovány videobronchoskopy (viz výše), které při stejných mechanických vlastnostech, jako je ohyb, vnější rozměry, úhel pohledu nebo průměr pracovního kanálu (0,8–3,2 mm), dávají mnohem kvalitnější obraz. Křemíková vlákna nahrazuje CCD kamera umožňující obraz kvality high resolution (min. 0,4 Mpx). Někdy se využívá hybridní systém vláken i kamery. Ultratenké flexibilní bronchoskopy (babyscope) mají průměr 1,8 mm a pomocí CT rekonstrukce mohou být navigovány do nejmenších bronchů k periferním lézím. Obraz lze zdokonalit mnohonásobným zvětšením (high magnification bronchoscopy). Zvětšuje se úhel pohledu i ohyb (120° a 180°). Pomocí bateriových zdrojů lze bronchoskop využívat při „bed-side“ vyšetření [4,11,12].
Autofluorescenční bronchoskopie
Autofluorescenční bronchoskopie se používá k detekci časných maligních a premaligních lézí na podkladě změněné aktivity chromoforů, které jsou obsaženy zejména v submukóze. Tím, že systém odfiltruje 90 % odraženého modrého světla a ponechá jen tolik, aby bylo možné rozpoznat struktury bronchu, umožní registraci slabého zeleného autofluorescenčního signálu. V současnosti se používá několik systémů. Premaligní a maligní léze se změněným obsahem chromoforů mění pozorované světlo na tmavě červené (obr. 7). Zpřístupnění vyšetřování pomocí autofluorescence je dáno možností použít jeden bronchoskop s průběžným přepínáním z režimu bílého světla do režimu autofluorescenčního světla během jednoho vyšetření. Tím je možná stálá konfrontace posuzování drobných změn. Některé počínající nádorové změny bronchiální sliznice jsou v bílém světle neodlišitelné od okolní zdravé tkáně. Při využití jen určité vlnové délky světla se však tyto změny zobrazí jinou barvou než zdravá tkáň. Nevýhodou je určitá nespecifičnost nálezů dysplazie, těžké dysplazie nebo karcinomu in situ a také různé chování jednotlivých lézí. Asi u 16 % pacientů se zánětlivě změněným epitelem dochází k metaplazii, až u 30 % se z hyperplazie nebo metaplazie vyvíjí mírná nebo střední dysplazie, asi u 37 % se vyvine z těžké dysplazie karcinom in situ. U 55–80 % karcinomů in situ dojde k zvratu v invazivní karcinom [4,11,12].
Image 7. Autofluorescenční bronchoskopie. 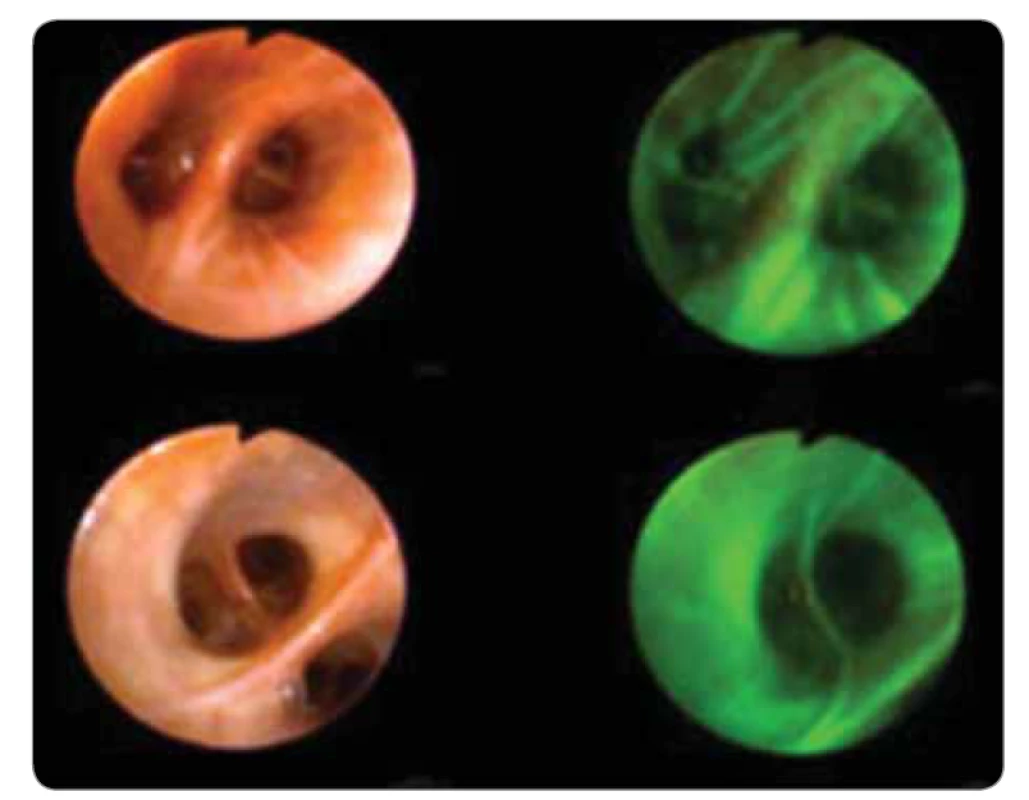
Vyšetřování úzkým svazkem světla
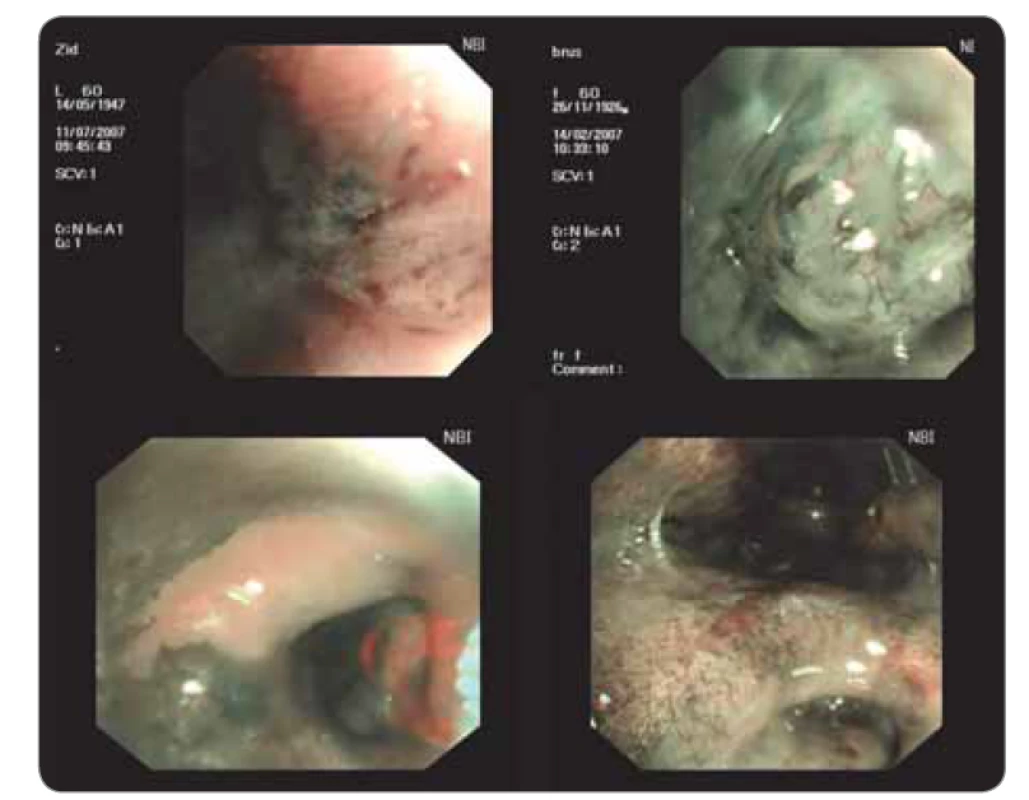
Novější metodou je bronchoskopické vyšetřování úzkým svazkem světla (narrow band imaging – NBI). Metoda využívá tři definované vlnové délky světla (modrá, zelená, červená) a získává odraz z různých vrstev sliznice. Modré světlo se odráží od vrchních vrstev sliznice, červené proniká hlouběji do submukózy. Zvýrazněné jsou hlavně cévy vzhledem k dobré absorpci světla hemoglobinem. Vyšetření dává možnost hodnocení přirozené a patologické vaskularizace sliznice a podle některých japonských prací pak lze v kombinaci se zvětšením obrazu posuzovat časná stadia karcinomu bronchu. Dobře lze odlišovat i nekrotická místa bez cévního zásobení, která nejsou vhodná k biopsii (obr. 8) [4,11,12].
Endobronchiální sonografie
Rychlý rozvoj zaznamenala endobronchiální sonografie (EBUS). V současnosti existují dva používané systémy. První využívá radiální sondu (20 MHz), která se zavádí pracovním kanálem bronchoskopu především k periferním lézím. Druhý systém využívá lineární sondu (7,5 MHz) umístěnou na konci videobronchoskopu tak, že lze připojeným pracovním kanálem provádět punkce uzlin v reálném čase a provádět hlavně staging karcinomu plic (obr. 9). Lze zobrazit uzliny o průměru 2–3 mm. Punkce jednotlivých etáží (stanic) uzlin se provádí speciální jehlou postupně podle toku lymfatické drenáže. Metodu lze kombinovat s ezofageálním ultrazvukem (EUS), což umožňuje velmi přesné posouzení stavu uzlin v mediastinu, srovnatelné s podstatně náročnější mediastinoskopií. Metoda EBUS se stala jednou ze široce používaných technik [4,11,12].
Image 9. Endobronchiální ultrazvuk. 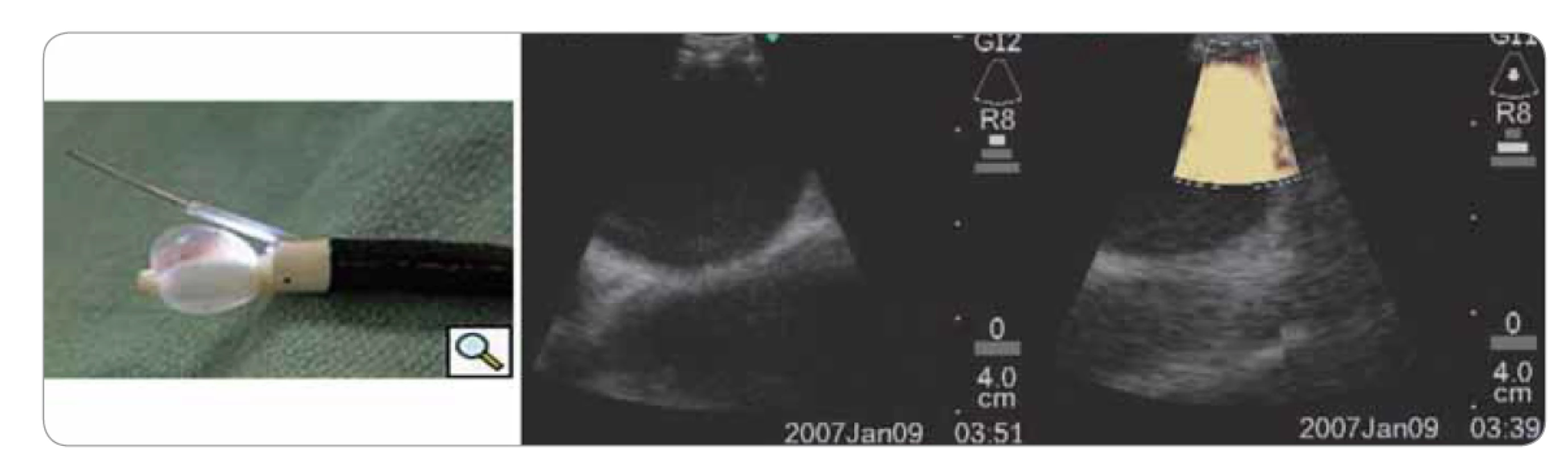
Bronchoskopie navigovaná pomocí elektromagnetického pole
Elektromagneticky navigovaná bronchoskopie je založena na propojení dat virtuální bronchoskopie (3D HRCT zobrazení) a vlastní bronchoskopie prováděné endoskopem. Metoda využívá nízkofrekvenčního elektromagnetického pole, v němž se pohybuje řiditelná sonda umístěná na konci flexibilního vodiče, který se zavádí kanálem videobronchoskopu. Podobně jako EBUS i tato metoda má dvě softwarové varianty k detekci periferních lézí a nitrohrudních uzlin. V současnosti jsou již k dispozici tři generace přístrojů. Novější generace zkracuje vyšetřovací dobu, využívá přímou navigaci pomocí CT bez složitého plánování výkonu a dále zpřesňuje diagnostiku i velmi malých periferních lézí.
Řiditelná sonda se senzorem je na konci flexibilního kovového vodiče. Ve chvíli, kdy je tato sonda umístěna v elektromagnetickém poli, její pozice v systému souřadnic X, Y a Z, stejně jako její orientace (vybočení, rotace či propnutí) jsou zachyceny systémem ve vztahu k cílové lézi. Tyto informace jsou pak v reálném čase přenášeny na monitor. Samotný cíl však zůstává zobrazen virtuálně. Vodič sondy umožňuje rotaci distálního konce v 360°, a tak umožňuje jeho ovládání při postupu v průduškovém stromu. Dle studií se úspěšnost pohybuje podle velikosti vyšetřovaných lézí od 70 do 90 % [4,11,12].
Konfokální fluorescenční endomikroskopie
Nejdále lze do periferie dýchacích cest dohlédnout pomocí konfokální fluorescenční endomikroskopie. Jde zatím o spíše výzkumnou metodu, která po zavedení flexibilní sondy o průměru 14 mm poskytuje obraz struktury intersticia a pohybu buněk v alveolech (alveoloskopie). V alveolech se pozorují charakteristické změny při emfyzému nebo intersticiálních plicních procesech, celulizaci lze specifikovat v kombinaci s fluorescenčními technikami. Metoda je perspektivní i pro diagnostiku periferních nádorů [4].
Odebírání vzorků sekretů a tkání při bronchoskopii
Při bronchoskopii využíváme možnost odběrů sekretu z dýchacích cest (aspirace katétrem), bioptických odběrů k cytologickému či histologickému vyšetření (odběry kartáčkem, kleštěmi, jehlou, výplachy) nebo vyšetření periferních oblastí plic (nejmenších dýchacích cest a plicních sklípků) pomocí bronchoalveolární laváže.
Akcesoria pro bronchoskopii
Aspirační katétry jsou plastové hadičky, které se zavádějí pracovním kanálem bronchoskopu a používají se k aspiraci či minilaváži, materiál se odesílá k cytologickému a mikrobiologickému vyšetření [4,11,12].
Kartáčky (brush) jsou zasunuté v plastové kanyle a zavádějí se pracovním kanálem bronchoskopu, poté jsou vysunuty (obr. 10). Předozadním a rotačním pohybem se získává materiál, který je zpracováván cytologicky nebo mikrobiologicky. Zvláštní chráněné kartáčky jsou umístěny ve dvou kanylách a používají se k mikrobiologickému vyšetření sekretů ve snaze minimalizovat jejich kontaminaci mikroby z horních cest dýchacích [4,11,12].
Image 10. Konec flexibilního bronchoskopua vysunutý kartáček. 
Punkční jehly se používají k perbronchiální nebo pertracheální punkční biopsii a také k punkci nádorů endobronchiálně rostoucích. Existuje řada nově vyvíjených jehel různé délky, tloušťky a zakončení. Jehly jsou pro cytologické, ale i histologické zpracování tkáně, některé mají postranní otvor v distální části. Jsou vysunovatelné z ochranného obalu a při jejich užití je třeba dbát především na bezpečnost práce vzhledem k pracovnímu kanálu bronchoskopu [4,11,12].
Bioptické klíšťky existují v mnoha variantách. V současnosti je možno využít mnoha typů bioptických klíštěk. Jsou to klíšťky s pevnou či výkyvnou hlavou, s oválnou nebo i okrouhlou bioptickou částí, popř. s okénkem, s hladkým nebo vroubkovaným okrajem (aligator jaw), s centrálním bodcem nebo bez něj, s háčky na konci (rat teeth). Klíšťky se volí dle lokalizace nálezu, typu biopsie a dle velikosti bioptického kanálu. Nejčastěji jsou využívány k odběrům tkáně z nádorů, které rostou endobronchiálně (obr. 11,12) [4,11,12].
Image 11. Flexibilní bronchoskop a vysunuté bioptické kleštičky. 
Image 12. Endobronchiálně rostoucí nádor. 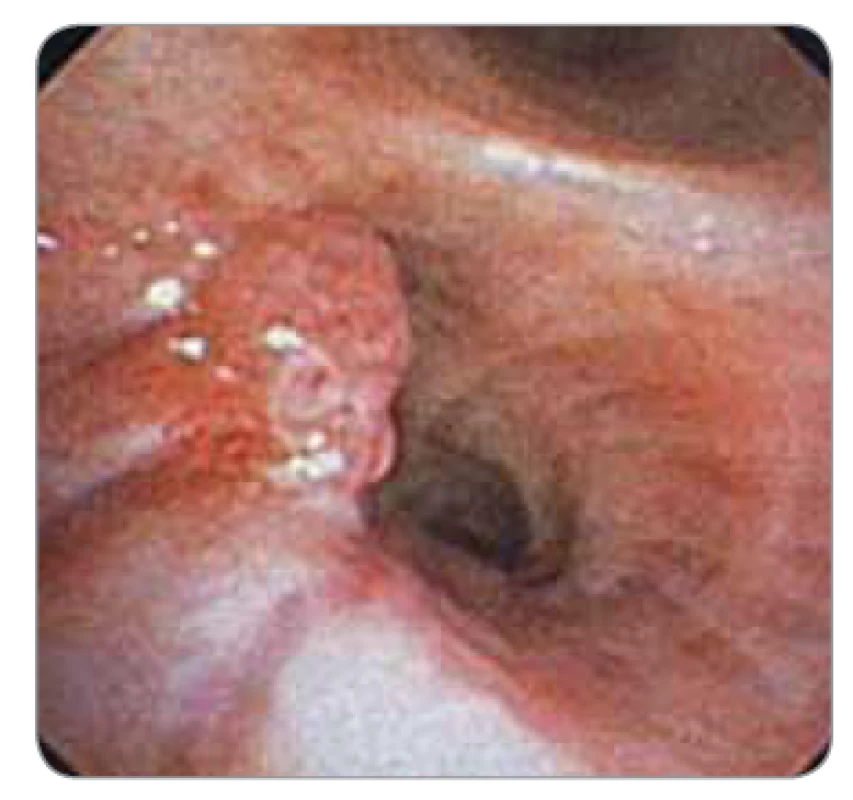
Endobronchiální kryobiopsie umožňuje namrazením získat vzorky nádoru větších rozměrů, než jsou vzorky odebrané klíšťkami (obr. 13). Uplatňuje se především v diagnostice nádorů rostoucích endobronchiálně.
Image 13. Vzorky nádorové tkáně získané kryoexcizí. 
Transbronchiální biopsie je odběr tkáně z periferie. Jedná se o odběr plicního parenchymu. V diagnostice nádorů se uplatňuje především při podezření na karcinom s lepidickým růstem. Její hlavní využití je však v diagnostice intersticiálních plicních procesů. Transbronchiální kryobiopsie umožňuje získat namrazením větší vzorek tkáně z periferie [4,11,12].
Bronchoalveolární laváž (BAL). Při BAL se bronchoskopicky aplikuje do periferních částí plic určité množství fyziologického roztoku (optimálně 150 ml), následně se podtlakem aspiruje bronchoalveolární lavážní tekutina zpět do stříkačky a odesílá na různá vyšetření (cytologie, mikrobiologie, imunologie). K provedení BAL se používají stříkačky o objemu 20 nebo 50 ml k aplikaci fyziologického roztoku ohřátého na tělesnou teplotu, hadička mezi stříkačku a ventil pracovního kanálu bronchoskopu a plastové kontejnery ke kolekci lavážní tekutiny. Tako metoda má uplatnění i v onkologické diagnostice u difuzních procesů a procesů uložených periferně [4,11,12].
Perspektivy diagnostické bronchologie
Diagnostická bronchoskopie a ostatní endoskopické techniky jsou perspektivní metody, které směřují ke stále přesnější a časnější diagnostice. Jejich invazivita klesá, pomocí nových postupů v anesteziologii se omezují kontraindikace i při delších časech vyšetření potřebných při některých sofistikovaných technologiích. I při obrovském nárůstu zobrazovacích metod bude místo bronchoskopie v pneumologické diagnostice nezastupitelné, protože umožňuje selektivní odběr tkáně a vlastní morfologickou diagnostiku patologického procesu a také stanovení prediktivních markerů. Ekonomická náročnost nových endoskopických technologií je velká. To vede k tomu, že kvalitní bronchoskopická diagnostika plicních nádorů s využitím moderních metod je možná jen v dobře organizovaných větších centrech s dostatečným personálním i prostorovým zázemím [4].
Další diagnostické možnosti využívané v diagnostice karcinomu plic
Sonografické vyšetření břicha je vyšetřením k detekci metastáz v orgánech břišní dutiny, především jater a orgánů retroperitonea.
Scintigrafie skeletu slouží ke stanovení kostních metastáz. Indikace záleží na typu bronchogenního karcinomu. U malobuněčného karcinomu je součástí základního stagingu. U nemalobuněčného karcinomu se provádí u pacientů s podezřením na metastázy. Kostní metastázy však mohou být patrny i na prostém skiagramu.
CT a MR mozku. CT nebo MR mozku jsou u malobuněčného karcinomu součástí základního stagingu. U nemalobuněčného karcinomu je vyšetření mozku indikováno až tehdy, jsou-li přítomny klinické známky poškození mozku (závratě, nevolnost, zvracení, parézy a jiné). V poslední době je CT vyšetření mozku nahrazeno MR. Vzhledem k tomu, že mozkové metastázy bývají často asymptomatické, je vhodné provést vyšetření mozku v době stanovení diagnózy.
Sternální punkce, trepanobiopsie. Indikace je zvažována u pacientů s limitovanou formou malobuněčného bronchogenního karcinomu v případě, že byla vyloučena diseminace v jiných orgánech. Kromě nemocných zařazených do klinických studií by vyšetření kostní dřeně mělo být prováděno jen v případě zjištěných závažných poruch krevního obrazu.
Lumbální punkce s cytologickým vyšetřením mozkomíšního moku je indikována při podezření na leptomeningeální metastázy.
Cílená transparietální biopsie se provádí nejčastěji pod kontrolou CT. Dříve šlo o odběry cytologické, rozvoj instrumentária však nyní umožňuje získat histologicky hodnotitelný vzorek. Umožňuje diagnostikovat především periferně uložené infiltráty.
Cytologické vyšetření sputa. Vzhledem k nízké výtěžnosti pozbyla nyní tato metoda na významu, uplatnění snad může najít u nemocných neschopných podstoupit náročnější diagnostické výkony. V tom případě obvykle odebíráme několik (3–5) vzorků. Tato metoda se často využívá u starších nemocných, především v rámci diferenciální diagnostiky [1,2,4].
Nádorové markery v diagnostice a léčbě karcinomu plic
V běžné klinické praxi vyšetřujeme u malobuněčného i nemalobuněčného karcinomu plic hladinu karcinoembryonálního antigenu, u malobuněčného karcinomu může být zvýšena neuron-specifická enoláza (NSE), nově vyšetřujeme hladinu progastrin uvolňujícího peptidu. U nemalobuněčného karcinomu se můžeme setkat se zvýšením nádorových markerů CYFRA-21, tkáňový polypeptidový antigen, antigen karcinomu ze skvamózních buněk a u některých nemocných i NSE. Vyšetření nádorových markerů má význam především v průběhu dalšího sledování a zaměřuje se hlavně na sledování jejich dynamiky. Vzhledem k výše uvedenému vyšetřujeme nádorové markery až těsně před zahájením léčby, posléze v jejím průběhu a pak při pravidelných kontrolách po jejím ukončení [4].
Určení klinického stadia karcinomu plic
Rozsah nádorového onemocnění se hodnotí prostřednictvím systému TNM (v současnosti 8. vydání). Tento systém hodnotí rozsah primárního nádoru (T), přítomnost a rozsah metastáz v regionálních mízních uzlinách (N) a přítomnost vzdálených metastáz (M). Na základě těchto komponent se zhoubné nádory dělí do čtyř skupin vyjadřujících pokročilost onemocnění, tj. klinických stadií I–IV. Klasifikace dle klinických stadií pomáhá při plánování léčby, poskytuje údaje o prognóze a napomáhá při hodnocení léčebných výsledků [13,14].
Původní TNM systém odvozený pro plicní karcinomy v roce 1970 byl založen na databázi 2 155 pacientů z University of Texas MD Anderson Cancer Center v Houstonu. Tato klasifikace byla revidována v roce 1997 a rozšířena na 5 319 údajů, stále však z původní databáze jedné instituce [13].
V současné době se používá 8. vydání TNM klasifikace zveřejněné v roce 2016. Tato revize je založena na údajích z databáze International Association for the Study of Lung Cancer (IASLC), která v současné době obsahuje informace > 94 708 pacientů s rakovinou plic diagnostikovaných v letech 1999–2010 a vzhledem k podrobnosti umožňuje zlepšenou analýzu jednotlivých deskriptorů. Největší slabinou celé klasifikace TNM nadále zůstává, že je postavena hlavně na anatomii a neobsahuje důležité genetické či klinické faktory, které bude v příštích revizích nutné zohlednit [14].
Nejrozsáhlejší změny v 8. vydání se týkají klasifikace T, zejména s důrazem na velikost nádoru. Každý centimetr nádoru navíc má nyní svůj vlastní deskriptor (T1a, T1b, T1c, T2a, T2b). Nádor veliký 5–7 cm je zařazen do kategorie T3 a nádor větší než 7 cm pak do kategorie T4 v souladu s prognózou. Pro částečnou atelektázu plíce (dříve T2) a kompletní atelektázu (dříve T3) byla zjištěna podobná prognóza, a proto byly obě překlasifikovány do kategorie T2. Šíření nádoru do bránice (dříve T3) bylo překlasifikováno na T4 vzhledem k horší prognóze s tím spojené. Endobronchiální nádory, které byly dříve hodnoceny na základě vzdálenosti od hlavní kariny (T2 a T3) jsou vzhledem k podobné prognóze nyní sloučeny do kategorie T2 bez ohledu na vzdálenost od hlavní kariny. Šíření nádoru do hlavní kariny zůstává hodnoceno jako T4. Invaze do mediastinální pleury (dříve T3) je popisována velmi vzácně, a proto bylo rozhodnuto o jejím vypuštění z klasifikace [14–16].
Co se týká hodnocení uzlin, to zůstává v 8. revizi nezměněno, pouze byly navrženy nové N kategorie pro prospektivní testování a validaci. Návrhy rozdělují patologickou pN1 do dvou podkategorií založených na postižení jediné (pN1a) a více (pN1b) uzlinových skupin. Návrh dále dělí pN2 do tří kategorií:
- pN2a1 s jedinou postiženou mediastinální uzlinou pN2 a současně bez přítomnosti pN1 onemocnění, tento deskriptor tedy popisuje „skip“ metastázu a představuje lepší prognózu než tradiční pN2;
- pN2a2 pak popisuje klasické postižení jedné skupiny pN2 při současném postižení pN1;
- pN2b popisuje postižení více skupin mediastinálních uzlin známé jako „bulky“ postižení [14–16].
Též v hodnocení metastatického postižení došlo k přidání třetí kategorie M1c. Kategorie M1a tedy zahrnuje nadále pacienty s metastatickým postižením pleury, maligním pleurálním nebo perikardiálním výpotkem nebo metastázami v kontralaterální plíci. Nově se mění kategorie M1b, která uznává oligometastatické onemocnění jako samostatnou kategorii, např. u izolované mozkové metastázy, kde může být využita neurochirurgie nebo radiochirurgie, nebo izolované adrenální metastázy u pacientů, kteří mohou podstoupit adrenalektomii. Pacienti s jedinou metastázou jednoho orgánu jsou nově označeni jako M1b a pacienti s vícečetnými metastázami buď v jednom, nebo více orgánech jsou nyní nově zařazeni do kategorie M1c. V důsledku změn jednotlivých deskriptorů TNM dochází k drobným změnám v hodnocení klinického stadia [14–16].
Stadium IA nadále označuje nádory menší než 3 cm bez postižení uzlin a je dále rozděleno do tří podskupin – IA1, IA2 a IA3 pro každý centimetr velikosti nádoru; stadium IB nyní obsahuje pouze nádory do velikosti 4 cm [14–16].
Stadium IIA zahrnuje nádory do velikosti 4–5 cm a stadium IIB popisuje nádory větší než 5 cm a zároveň menší než 7 cm nebo menší nádory s postižením lymfatických uzlin skupin N1 [14–16].
Stadium IIIA zahrnuje nádory větší než 7 cm bez uzlinového postižení s výjimkou těch, které prorůstají do bránice, mezihrudí, srdce nebo velkých cév, průdušnice nebo hlavní kariny, jícnu nebo obratlů. Dále zahrnuje nádory T3–4 N1 a nádory T1a–T2b N2. Stadium IIIB označuje nádory T3–4 N2 a T1a–T2b N3 a nově vzniklá kategorie IIIC popisuje nádory T3–4 N3 [14–16].
Stadium IV zůstává nadále rozděleno do podskupin IVA a IVB. Zatímco IVA zahrnuje nádory jakékoliv velikosti s postižením lymfatických uzlin a přítomností metastáz kategorie M1a nebo M1b, tak stadium IVB je vyčleněno pro pacienty s více než jednou metastázou v jednom orgánu nebo ve více vzdálených orgánech [14–16].
Je povzbudivé vidět nepřetržitý vývoj TNM klasifikace za pomoci přístupů založených na důkazech, které umožňují přesnější stratifikaci rakoviny plic podle prognózy. Do budoucnosti pak bude důležité začlenit i údaje týkající se nádorové genomiky, vč. přítomnosti řídících mutací a imunologických znaků, které mají též podstatný vliv na prognózu onemocnění.
Pro malobuněčný karcinom plic se v klinické praxi používá zjednodušená klasifikace, i když i zde princip TNM klasifikace zůstává stejný. Malobuněčný karcinom je dělen do dvou skupin podle Veterans Administration Lung Cancer Study Group (VALG):
1.limitované stadium (limited disease) je definováno jako onemocnění ohraničené na jedno plicní křídlo s postižením nebo bez postižení ipsilaterálních nebo kontralaterálních uzlin mediastinálních nebo supraklavikulárních a se stejnostranným pleurálním výpotkem nebo bez stejnostranného pleurálního výpotku, které může být ozářeno v rámci jednoho ozařovacího pole;
2.extenzivní stadium (extensive disease) zahrnuje všechny ostatní formy onemocnění.
Přesné určení klinického stadia je nezbytné pro volbu adekvátní léčby a tím pro ovlivnění celkové prognózy. V posledních letech se užívají různé techniky sloužící k posouzení rozsahu nádorového onemocnění. Stěžejní úlohu v tomto směru představuje určení rozsahu nádoru v oblasti mediastina. Pro úvodní stanovení postižení mediastina by i v případě PET pozitivních mediastinálních lézí mělo být provedeno jejich histologické nebo cytologické ověření. EBUS je endoskopická technika umožňující lepší posouzení struktur mediastina, zvláště využitím řízené punkce mediastinálních struktur. Tato metoda má vysokou specifitu, ale nízkou negativní prediktivní hodnotu, proto je při negativním výsledku a nejednoznačném rentgenovém nálezu indikováno chirurgické ověření chirurgickou cestou (mediastinoskopie, videoasistovaná torakoskopie, otevřená plicní biopsie) (tab. 1) [4].
Table 1. Klasifikace mediastinálních uzlin a možnost biopsie. 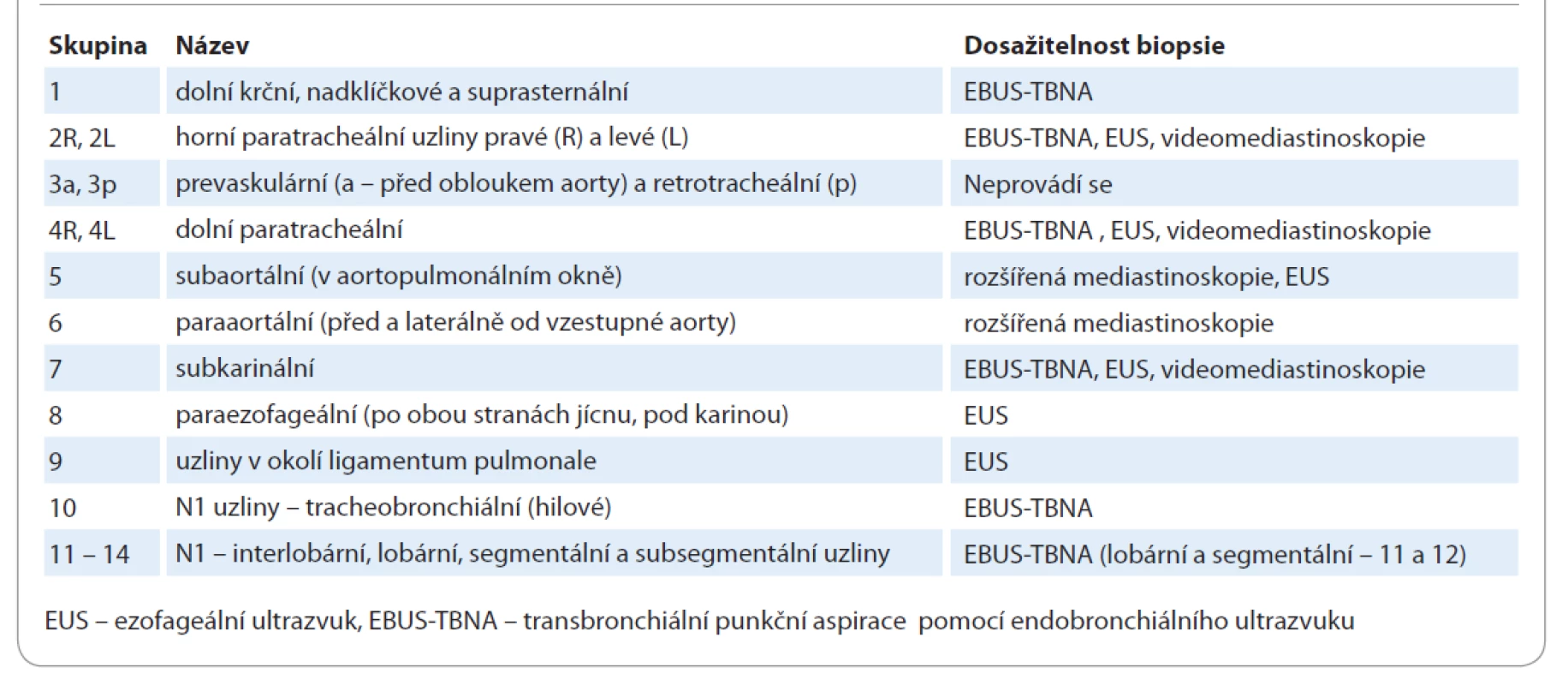
Morfologická diagnostika karcinomu plic
Morfologie je stále základním kamenem diagnostiky karcinomů plic. Postupem času byly začleněny do diagnostického procesu další metody, které rozšířily diagnostiku o přesnější určení prognostických a prediktivních faktorů karcinomu plic. Této problematice je věnován samostatný článek tohoto supplementa.
Časná diagnostika karcinomu plic
Výskyt i mortalita karcinomu plic stoupají. Vztah s kouřením je velmi úzký, až 90–95 % nemocných tvoří kuřáci. Epidemiologie karcinomu plic souvisí se spotřebou cigaret. Riziko onemocnění se zvyšuje s množstvím vykouřených cigaret. Relativní riziko u kuřáků je 22,4, u velmi silných kuřáků s náloží > 25 balíčkoroků může dosahovat až 50. Výskyt karcinomu plic je u této populace asi 0,4–2,7 %. Většina případů karcinomu plic se zachytí ve fázi pokročilého onemocnění, kdy již není možná operace a někdy ani jiné aktivní způsoby léčby [17,18].
Již mnoho let trvají snahy o zlepšení časné diagnostiky této zákeřné nemoci. Programy časné diagnostiky karcinomu plic navazují na řadu studií, které byly prováděny v různých státech od 60. let minulého století a v poslední době byly inovovány s použitím modernější techniky. Největší byly publikovány v 80. letech a patří mezi ně i tzv. Kolínská studie a tři rozsáhlé studie amerických center (John Hopkins, Memorial Sloan Kettering a Mayo Clinic), které používaly skiagram hrudníku a cytologii sputa jako screeningové testy. V tehdejších poměrech se prokázalo zvýšení počtu operovaných, ale v dlouhodobém sledování se neprokázalo zlepšení přežívání aktivně sledovaných nemocných. Studie byly kritizovány z pohledu metodiky, protože určité screeningové přístupy byly použity v obou ramenech, jen 30 % úmrtí bylo doloženo sekčně a nebyly hodnoceny komplikace léčby. Velmi pozitivně dopadly japonské kontrolované studie na rozsáhlé populaci, kdy čtyři z pěti těchto studií měly pozitivní výsledky. Studie publikované v letech 1999–2001 ukázaly snížení relativního rizika úmrtí na karcinom plic od 0,40 do 0,72 při použití skiagramu hrudníku [4,19].
V japonských, amerických a německých studiích ze začátku nového tisíciletí byly použity nízkoradiační CT (low-dose CT – LDCT) přístroje. Tyto studie neprokázaly „cost-benefit“ efekt, i když dosáhly snížení pokročilých forem onemocnění v době diagnostiky, zvýšení operability a prodloužení přežívání v krátkodobém přežívání. To, že tyto studie neprokázaly jednoznačný „cost-benefit“, je s největší pravděpodobností způsobeno tím, že ekonomická rozvaha byla dělána na chemoterapeutické režimy, které jsou levnější než ty, které jsou užívány v současnosti [4].
Rozsáhlá randomizovaná anglicko-americká studie PLCO (prostate, lung, colorectal and ovaria) Trial, která hodnotila význam ročního provádění skiagramu hrudníku při současném screeningu karcinomu prostaty, kolorekta a ovaria, také neprokázala snížení mortality na karcinom plic [20].
Jednou ze zásadních studií je Studie NLST (National Lung Screening Trial, USA). Byla ukončena v roce 2011, účastnilo se jí celkem 53 456 účastníků, kteří byli aktivní nebo bývalí těžcí kuřáci a jejichž věk spadal do rozmezí 55–74 let. Byla srovnávána efektivita screeningového vyšetření s využitím rentgenového snímku (kontrola) a LDCT. Lepších výsledků dosahuje detekce karcinomu pomocí LDCT, kdy dochází k odhalení nádorových ložisek v raném stadiu mnohem častěji ve srovnání s rentgenovým snímkem. Účastníci podrobení screeningu s využitím LDCT měli o 20 % nižší riziko úmrtí v důsledku karcinomu plic než účastníci, kteří podstoupili rentgenové vyšetření hrudníku [21].
Významnou evropskou studií časné detekce karcinomu plic je evropská studie NELSON, jejíž mortalitní výsledky byly zveřejněny v Torontu 25. září 2018. Do programu bylo zahrnuto celkem 15 792 osob. Jednalo se o asymptomatické pacienty s vysokým rizikem karcinomu plic. Pacienti byli rozděleni do dvou ramen v poměru 1 : 1. Pacienti z prvního ramene podstoupili vyšetření CT při zařazení do studie, následně po 1, 3 a 5,5 letech. Účastníci ve studijním ramenu podstoupili screening na začátku a pak 1, 3 a 5 let po randomizaci. Byli ve většině případů sledováni po dobu 10 let. Studie ukázala snížení úmrtnosti na rakovinu plic, a to zejména u mužů, o 26 % (95% interval spolehlivosti 9–41 %) [22,23].
V současné době je připravován program vyhledávání karcinomu plic v rizikových skupinách i v ČR. Na základě výše uvedených studií NLST a NELSON představují nejvhodnější cílovou populaci kuřáci (současní či bývalí), jejichž kuřácká minulost čítá alespoň 20–30 balíčkoroků a jsou ve věku 55–75 let. Na podkladech studií NLST a NELSON, které jsou aktuálně v oblasti ověřování účinnosti screeningu karcinomu plic nejvýznamnější, se jeví jako vhodné screeningové vyšetření k detekci karcinomu plic LDCT. Jedná se o metodu výpočetní tomografie, která využívá snížené dávky záření, a představuje tedy sníženou radiační zátěž pro pacienta.
Primárním cílem programu časného záchytu karcinomu plic je časná a přesná diagnóza daného onemocnění, která v kombinaci s vhodnou navazující léčbou povede ke snížení mortality v důsledku tohoto onemocnění. ČR je v současné době výrazně zatížena tímto onemocněním a většina pacientů má v době diagnózy pokročilé stadium nemoci a nádor již není operovatelný. Navzdory významnému vývoji v onkologické léčbě přežití těchto pacientů zůstává nízké a 5 let od stanovení diagnózy se dožije dle literatury přibližně 5 % nemocných (5leté přežití se s ohledem na zdroj mírně liší, pohybuje se však okolo zmíněných 5 %). Z aktuálně dostupných údajů Ústavu zdravotnických informací a statistiky je celkové 5leté přežití pacientů s bronchogenním karcinomem v ČR o něco vyšší a dosahuje > 10 %, i přesto patří bronchogenní karcinom mezi diagnózy se špatnou prognózou [17].
Časná a přesná diagnóza bronchogenního karcinomu je nezbytná zejména pro zahájení léčby v rané fázi onemocnění, kdy nádor ještě nemetastazoval do okolních tkání a pacient může podstoupit chirurgický zákrok. Pokud je onemocnění odhaleno v raném stadiu (stadium I), přibližně 60 % pacientů se dožije 5 let od stanovení diagnózy, ve stadiu II je toto procento nižší (30 %) a u pozdních stadií dosahuje přežití řádově jednotek procent. Přínos časné diagnostiky je tedy zcela zásadní a může významně prodloužit život pacientů a v některých případech také vede k vyléčení onemocnění [4,17].
Určitým rizikem programu je radiační zátěž, která odpovídá přibližně 1,5 mSv na jedno vyšetření, což je ale dávka nízká, v podstatě zanedbatelná. Je nicméně skutečností, že u pacienta může dojít k „overdiagnosis“, tedy detekci onemocnění, která by zdraví pacienta nijak neovlivnila (pacient by před klinickou manifestací pravděpodobně zemřel z jiné příčiny). Takového pacienta tedy vystavujeme zbytečnému vyšetřování a léčbě, které ho mohou poškodit, proto je třeba, aby každý pacient vstupující do screeningového procesu byl o tomto riziku řádně poučen a zároveň aby diagnostický proces riziko „overtreatmentu“ co nejvíce minimalizoval [24].
V ČR představují cílovou populaci navrženého populačního pilotního programu kuřáci (současní či bývalí), jejichž kuřácká minulost čítá alespoň 20 balíčkoroků a jsou ve věku 55–74 let. Velikost populace ČR v dané věkové kategorii je dle dat Českého statistického úřadu přibližně 2,6 mil. osob a podmínku kuřáctví splňuje dle přiložených rozvah založených na demografických datech a výběrových šetřeních přibližně 500 000 vysoce rizikových osob [24].
Ještě před zahájením programu časného záchytu onemocnění je zapotřebí, aby byl představen laické i odborné veřejnosti. Do procesu pilotního programu časného záchytu karcinomu plic jsou zapojeni praktičtí lékaři pro dospělé, ambulantní pneumologové a radiologická pracoviště komplexních onkologických center (KOC), kde bude probíhat návazná pneumoonkochirurgická péče dle stávajících standardů. Vyhledávání karcinomu plic bude spojeno i s osvětovou kampaní, jejímž cílem bude zvýšení povědomí v populaci jednak o riziku vzniku karcinomu plic na základě kouření a pozitivním efektu ukončení kouření a jednak o vlastním programu časného záchytu za účelem zvýšit účast cílové populace [24].
Místem primárního kontaktu budou praktiční lékaři pro dospělé, kteří budou vyhledávat rizikové osoby (věk, kuřáctví v anamnéze) a cíleným rozhovorem ověří zátěž (20 balíčkoroků). Praktičtí lékaři odešlou osoby splňující kritéria k ambulantnímu pneumologovi. Ambulantní pneumologové provedou cílené plicní vyšetření, vyloučí jiné závažné onemocnění, příp. doplní vhodnou diagnostiku dle stávajících pravidel. Ambulantní pneumolog provede základní intervenci k zanechání kouření a zhodnotí vhodnost účasti klienta k léčbě v centru pro odvykání kouření. Vhodné osoby pro pokračování vyšetřovacího algoritmu odešlou do radiodiagnostického centra v KOC. Radiodiagnostické vyšetření LDCT bude provedeno dle metodiky Národního radiologického standardu na radiologickém pracovišti pomocí CT přístroje splňujícího kritéria pro časný záchyt karcinomu plic. Odborný lékař-radiolog zhodnotí a popíše snímek. Výsledky vyšetření předá radiologické pracoviště ambulantnímu pneumologovi nebo praktickému lékaři v situacích, kdy tento pacienta na vyšetření odeslal [24].
Ambulantní pneumolog získá výsledek LDCT z radiologického pracoviště a dále bude koordinovat proces časného záchytu. V případě negativního výsledku bude pacient referován na následující LDCT, v doporučeném schématu screeningového vyšetření v dalším roce a poté po 2 letech. Při nejistém výsledku bude pacient referován na opakované LDCT v kratším intervalu. Při pozitivním výsledku bude pacient referován na pneumoonkochirurgické pracoviště k odbornému konziliu a dalším vyšetřením. Odborná pneumoonkochirurgická péče dle stávajících standardů bude probíhat beze změny [24].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
prof. MUDr. Jana Skřičková, CSc.
Klinika nemocí plicních a TBC
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: skrickova.jana@fnbrno.cz
Přijato/Accepted: 15. 2. 2021
Sources
1. Adam Z, Vorlíček J. Diagnostické a léčebné postupy u maligních chorob. Praha: Grada Publishing 2004.
2. Ginsberg RJ. Lung Cancer. London: BC Decker Hamilton 2002.
3. Pešek M et al. Bronchogenní karcinom. Praha: Galén 2002.
4. Skřičková J, Kolek V et al. Základy moderní pneumoonkologie. 2. rozšířené vyd. Praha: Maxdorf 2017 : 561.
5. Lababede O. Imaging in lung cancer staging. [online]. Available from: https: //emedicine.medscape.com/article/362919-overview.
6. Hochhegger B, Marchiori F, Sedlaczek O et al. MRI in lung cancer: a pictorial essay. Br J Radiol 2011; 84 (1003): 661–668. doi: 10.1259/bjr/24661484.
7. Huellner MW, de Galiza Barbosa F, Husmann L et al. TNM staging of nn-small cell lung cancer: comparison of PET/MR and PET/CT. J Nucl Med 2016; 57 (1): 21–26. doi: 10.2967/jnumed.115.162040.
8. Lee SM, Goo JM, Park CM et al. Preoperative staging of non-small cell lung cancer: prospective comparison of PET/MR and PET/CT. Eur Radiol 2016; 26 (11): 3850–3857. doi: 10.1007/s00330-016-4255-0.
9. Lin EC, Alavai A. PET and PET/CT – a clinical guide. Stuttgart: Gerog Thieme Verlag 2009.
10. Kolek V, Kašák V, Vašáková M et al. Pneumologie. 3. vyd. Praha: Maxdorf 2017.
11. Vašáková M, Kolek V, Pohounek P et al. Bronchologie a pneumologická cytodiagnostika. Praha: Maxdorf 2017.
12. Votruba J, Šimovič J. Plicní endoskopie. Praha: Mladá fronta 2017.
13. Goldstraw P, Crowley JJ. The International Association for the Study of Lung Cancer. International staging project on lung cancer. J Thorac Oncol 2006; 1 : 281–6.
14. Goldstraw P, Chansky K, Crowley J et al. The IASLC lung cancer staging project: proposals for revision of the TNM stage groupings in the forthcoming (eighth) edition of the TNM classification for lung cancer. J Thorac Oncol 2016; 11 (1): 39–51. doi: 10.1016/j.jtho.2015.09.009.
15. Lim W, Ridge CA, Nicholson AG et al. The 8th lung cancer TNM classification and clinical staging system: review of the changes and clinical implications. Quant Imaging Med Surg 2018; 8 (7): 709–718. doi: 10.21037/qims.2018.08.02.
16. Brierley JD, Gospodarowitz MK, Wittekind C et al. TNM classification of malignant tumours, 8th ed. Hoboken: Wiley-Blackwell Publishing 2017.
17. Dušek L, Malúšková D, Mužík J et al. Epidemiologie zhoubných nádorů plic, průdušnice a průdušek v České republice. Onkologická Revue 2016; 8 : 7–11.
18. Blandin Knight PA, Crosbie H, Balata J et al. Progress and prospects of early detection in lung cancer. Open Biol 2017; 7 (9), 170070. doi: 10.1098/rsob.170070.
19. Kubík A, Polák J. Lung cancer detection. Results of the randomized prospective study in Czechoslovakia. Cancer 1986; 57 : 2428–2437.
20. Oken MM, Hocking WG, Kvale PA et al. Screening by chest radiograph and lung cancer mortality. the prostate, lung, colorectal, and ovaria (PLCO) randomized trial. JAMA 2011; 306 (17): 1865–1873. doi.10.1001/jama.1591.
21. Aberle DR, Berg CD, Black WC et al. The national lung screening trial: overview and study design. Radiology 2011; 258 (1): 243–253. doi: 10.1148/radiol.10091808.
22. Horeweg N, Scholten ET, de Jong PA et al. Detection of lung cancer through low-dose CT screening (NELSON): a prespecified analysis of screening test performance and interval cancers. Lancet Oncol 2014; 15 (12): 1342–1350. doi: 10.1016/S1470-2045 (14) 70387-0.
23. de Koning HJ, Carlijn M, van der Aalst CM et al. Reduced lung-cancer mortality with volume CT screening in a randomized trial. N Engl J Med 2020; 382 (6): 503–513. doi: 10.1056/NEJMoa1911793.
24. https: //www.mzcr.cz/metodika-realizace-populacniho-pilotniho-programu-casneho-zachytu-karcinomu-plic/.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2021 Issue Supplementum 1-
All articles in this issue
- Lung cancer – dia nosis and early detection
- The role of multidisciplinary team and molecular tumor board in the treatment of a patient with lung cancer
- Predictive testing in non-small cell lung carcinoma
- Surgical treatment of lung cancer
- New treatment modalities in the early stage and locally advanced non-small cell lung cancer
- Targeted therapy of non-small cell lung cancer
- Immunotherapy in the treatment of non-small cell lung cancer
- Pokroky v léčbě malobuněčného karcinomu plic
- Editorial
- Future of lung cancer treatment
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lung cancer – dia nosis and early detection
- Surgical treatment of lung cancer
- Pokroky v léčbě malobuněčného karcinomu plic
- Future of lung cancer treatment
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career