-
Medical journals
- Career
Glykoproteiny v sérech onkologických pacientů
Authors: L. Hernychová; L. Uhrík; R. Nenutil; M. V. Novotný
Authors‘ workplace: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Published in: Klin Onkol 2019; 32(Supplementum 3): 39-45
Category: Review
doi: https://doi.org/10.14735/amko20193SOverview
Východiska: Glykosylace je posttranslační modifikace, která je zapojena do mnoha biologických procesů a významně zasahuje i do dějů spojených s nádorovou progresí. Změny glykanových struktur na povrchu nádorových buněk způsobené alterujícími hladinami exprese glykosyltransferáz a glykosidáz ovlivňují proliferaci, adhezi, migraci i buněčnou signalizaci. Přítomnost neobvyklých glykanových struktur a glykokonjugátů v sérech byla popsána u mnohých onkologických onemocnění a řada glykoproteinů byla schválena Úřadem pro kontrolu potravin a léčiv v USA jako nádorové biomarkery pro klinická vyšetření. V současnosti se pozornost při hledání nových glykomarkerů zaměřuje na detekci proteinů s aberantní glykosylací nebo zvýšenou koncentrací v sérech nebo exozomech, a to z důvodu jejich aktivní sekrece nebo uvolňování z nádorových buněk do extracelulárního prostoru.
Cíl: Cílem článku bylo popsat strukturu glykanů, glykoproteinů i glykokonjugátů a přiblížit jejich funkci ve vývoji a progresi nádorů. Dalším cílem bylo čtenáře seznámit s vybranými klinicky schválenými glykoproteiny využívanými k diagnostice onkologických onemocnění (AFP, PSA, CA 125, HE4). Pozornost byla zaměřena na změny v glykanové struktuře uvedených proteinů, jejich funkce, koncentrace v sérech a jejich využití v klinice a diagnostice onkologických onemocnění.
Klíčová slova:
glykoproteiny – sérum – biomarkery – nádor
Struktura a funkce glykanů ve vývoji a progresi nádorů
Glykany jsou sacharidové jednotky (oligosacharidy a polysacharidy) vyskytující se volně nebo kovalentně vázané na biomolekuly (protein či lipid, nazývané pak glykokonjugáty). Glykanová složka může ovlivnit funkci glykokonjugátů přímo, a to bezprostřední účastí na interakcích s ostatními biomolekulami, nebo nepřímo zapojením do mechanizmů kontrolujících konformaci, stabilitu a životnost proteinu [1 – 3]. Přehled glykanů a glykokonjugátů zapojených do nádorové progrese je uveden na obr. 1.
Image 1. Struktury glykanů a glykokonjugátů zapojených do nádorové progrese. 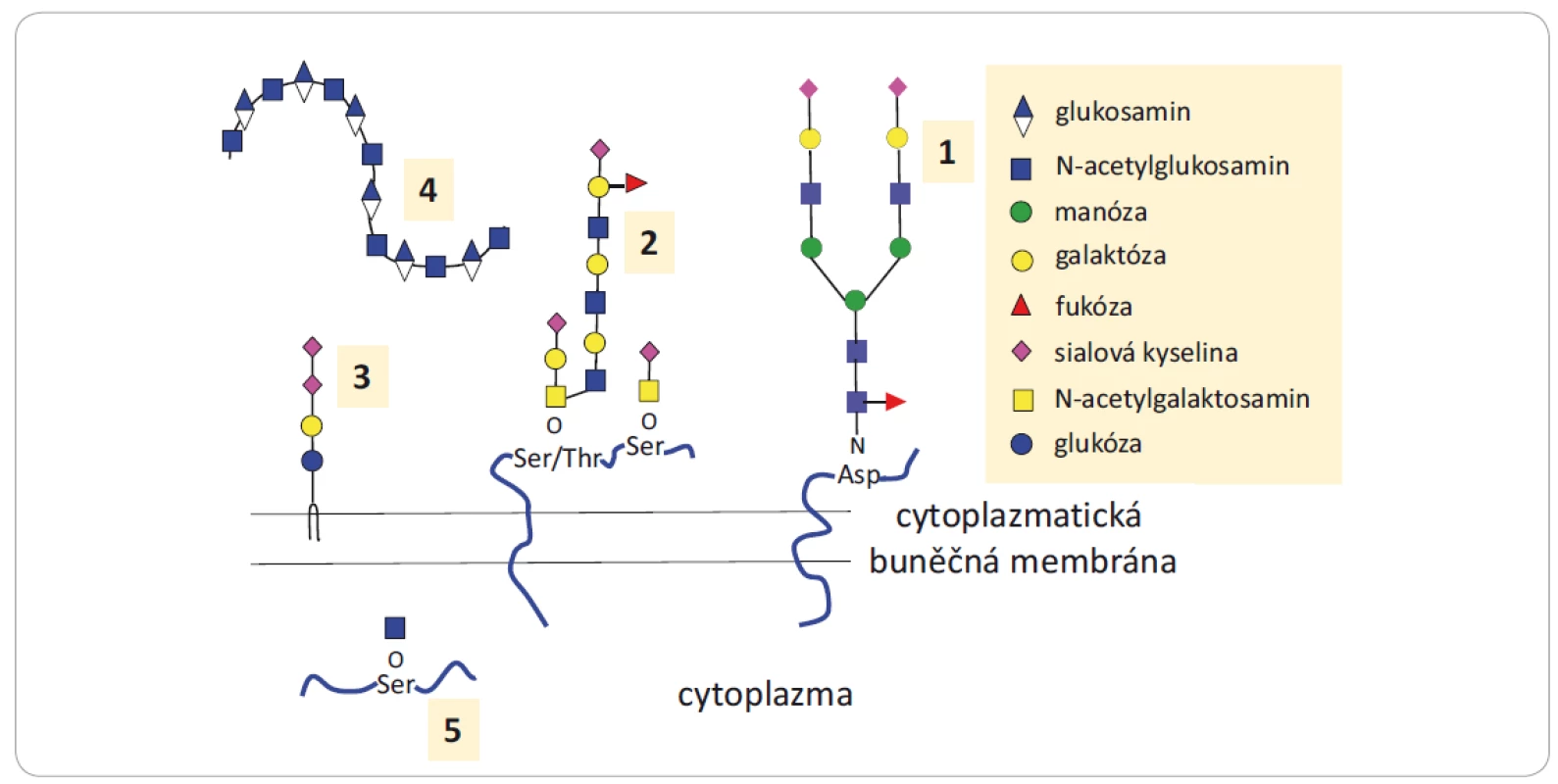
1) N‐glykoproteiny nesou kovalentně navázané glykanové struktury prostřednictvím glykosidické vazby na Asp; 2) O‐glykoproteiny nesou glykany kovalentně navázané prostřednictvím hydroxylové skupiny Ser nebo Thr, v glykanovém řetězci jsou přítomny N‐acetylgalaktosaminy, další jednotky sacharidů, fukóz a sialových kyselin; 3) glykosfi ngolipidy obsahují lipidový ceramid s navázaným jedním nebo více sacharidy; 4) hyaluronany se vyskytují jako volné řetězce glukosaminoglykanů nebo mohou být kovalentně navázány na proteoglykany; 5) proteiny s navázaným N‐acetylglukosaminem prostřednictvím O‐vazby se vyskytují v cytoplazmě nebo jádře buňky. Převzato a upraveno z [1].
Asp – asparagin, Ser – serin, Thr – treoninFunkce N-glykoproteinů závisí na počtu a složení glykanových částí navázaných na polypeptidový řetězec a na větvení glykanové části, přičemž abnormální struktury ovlivňují vývoj a progresi nádorů (obr. 2). Bylo publikováno mnoho prací zabývajících se N-glykanovým profilováním sér, tkání, ascitových tekutin nebo moče pacientů s nádorovým onemocněním. Výsledky upozornily na komplexní nebo naopak na velmi jednoduché (paucinomanózní) [4] glykanové struktury, typické pro dané onemocnění či molekulární podskupinu nádoru, jejichž výskyt koreloval s odpovědí na léčbu [5 – 9]. Mezi O-glykoproteiny patří muciny, které se vyskytují ve větším množství na povrchu nádorových buněk a podílejí se na adhezi buněk podobně jako proteoglykany. Ty se dále účastní aktivace růstových faktorů. Výskyt glykosfingolipidů zase koreluje s růstem nádorů. Glykokonjugáty a glykany se kromě povrchu buněk vyskytují také intracelulárně anebo naopak extracelulárně jako sekretované molekuly, které jsou součástí extracelulární matrix. Odlišně lokalizované glykany plní různé funkce, např. ovlivňují buněčnou signalizaci, účastní se zánětlivých procesů, deregulují buněčný cyklus, podporují proliferaci, migraci nebo se aktivně účastní mezibuněčných interakcí [1,10,11]. Jsou tedy důležitou součástí mnoha biologických procesů, a proto je řada z nich považována za biomarkery [12].
Image 2. Funkce glykanů ve vývoji a progresi nádorů. 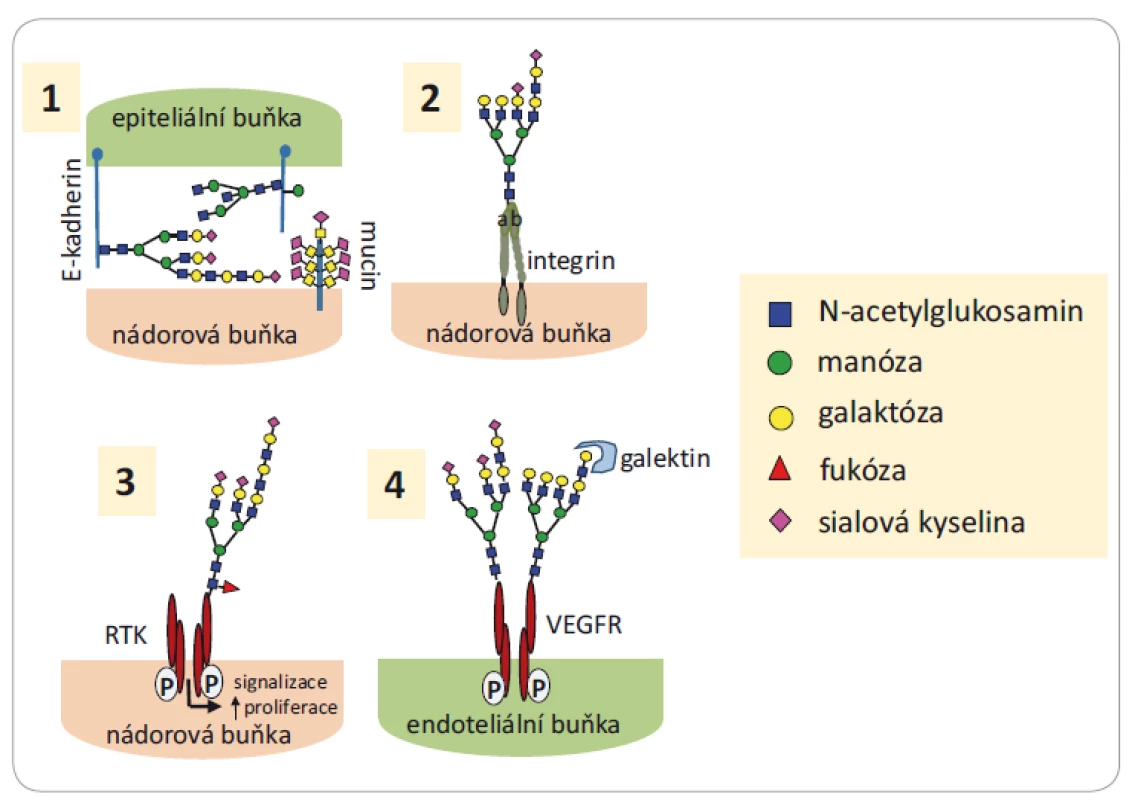
1) Změna glykanového profi lu na E-kadherinu na povrchu nádorových buněk poškozuje buněčnou adhezi a podněcuje invazi nádorových buněk; 2) sialylace rozvětvených glykanů na integrinech zvyšuje migraci a invazivitu nádorových buněk; 3) změna glykosylace RTK na povrchu nádorových buněk moduluje jejich signalizaci a proliferaci; 4) změna glykosylace VEGFR na povrchu nádorové buňky je asociována s nádorovou angiogenezí. Převzato a upraveno z [10].
RTK – tyrozinkinázové růstové receptory, VEGFR – receptor vaskulárního endoteliálního růstového faktoruNěkteré typy glykanů vyskytující se na povrchu nádorových buněk mohou zasahovat i do procesů spojených s nádorovou progresí (obr. 2). Přítomnost glykoproteinů společně s dalšími látkami (proteiny, lipidy, enzymy atd.) byla také zaznamenána v exozomech (extracelulárních váčcích nesoucích transferinový receptor) produkovaných ve větším množství nádorovými buňkami než buňkami normálními [13]. Exozomy zajišťují výměnu informací a látek mezi buňkami, mohou modifikovat lokální i vzdálené mikroprostředí, ovlivňují vývoj metastáz i vývoj imunitní odpovědi. Látky přítomné v exozomech jsou velmi lákavým cílem pro využití v diagnostice, prognostice i léčbě onkologických onemocnění [13,14], např. u karcinomu slinivky břišní [15] nebo u epiteliálního karcinomu vaječníků [16].
Diagnostický potenciál glykosyltransferáz
Glykosyltransferázy jsou enzymy zajišťující přenos a vazbu monosacharidu na glykan prostřednictvím různých typů glykosidických vazeb (např. galaktoglykosyltransferáza přenáší galaktózu). Glykosidázy naopak tyto vazby štěpí. U onkologických onemocnění byly zaznamenány snížené i zvýšené koncentrace přirozeně se vyskytujících sacharidů nebo byly detekovány sacharidy nové. Tyto změny jsou způsobeny právě změněnými hladinami glykosyltransferáz v Golgiho aparátu nádorových buněk [17] a vedou k modifikacím glykanových částí N - a O-glykoproteinů. Jednu z nejčastějších změn představuje netypické větvení N-glykanů i nárůst velikosti glykanové části způsobené zvýšenou produkcí sialyltransferáz, které připojují terminální molekuly sialových kyselin, nebo fukosyltransferáz způsobujících fukosylaci glykanů v jejich různých částech (obr. 3A) [18]. Sialové kyseliny mohou být přítomny ve vazbě alfa (2,3) nebo alfa (2,6), a tím vytvořit dva izomery, které mají naprosto rozdílnou biologickou aktivitu [19]. Tyto jevy obecně korelují s vývojem nádoru, pokročilým stadiem rakoviny a metastazováním. Objevují se však také u chronických zánětů, které s výskytem nádoru souvisejí [8]. Profilování genové exprese 210 glykosyltransferáz v 1 893 vzorcích pacientů se šesti typy karcinomů (prsu, vaječníků, glioblastomu, ledvin, plic a tlustého střeva) bylo použito k vývoji klasifikace karcinomů i jejich rozdělení do podskupin. Aplikací biostatistických metod na kvantitativní hodnoty exprese genů kódujících glykosyltransferázy bylo možné identifikovat jednotlivé typy karcinomů a provést jejich subtypovou klasifikaci [12].
Image 3. Aberantní větvení N-glykanů a nárůst velikosti glykanové části. 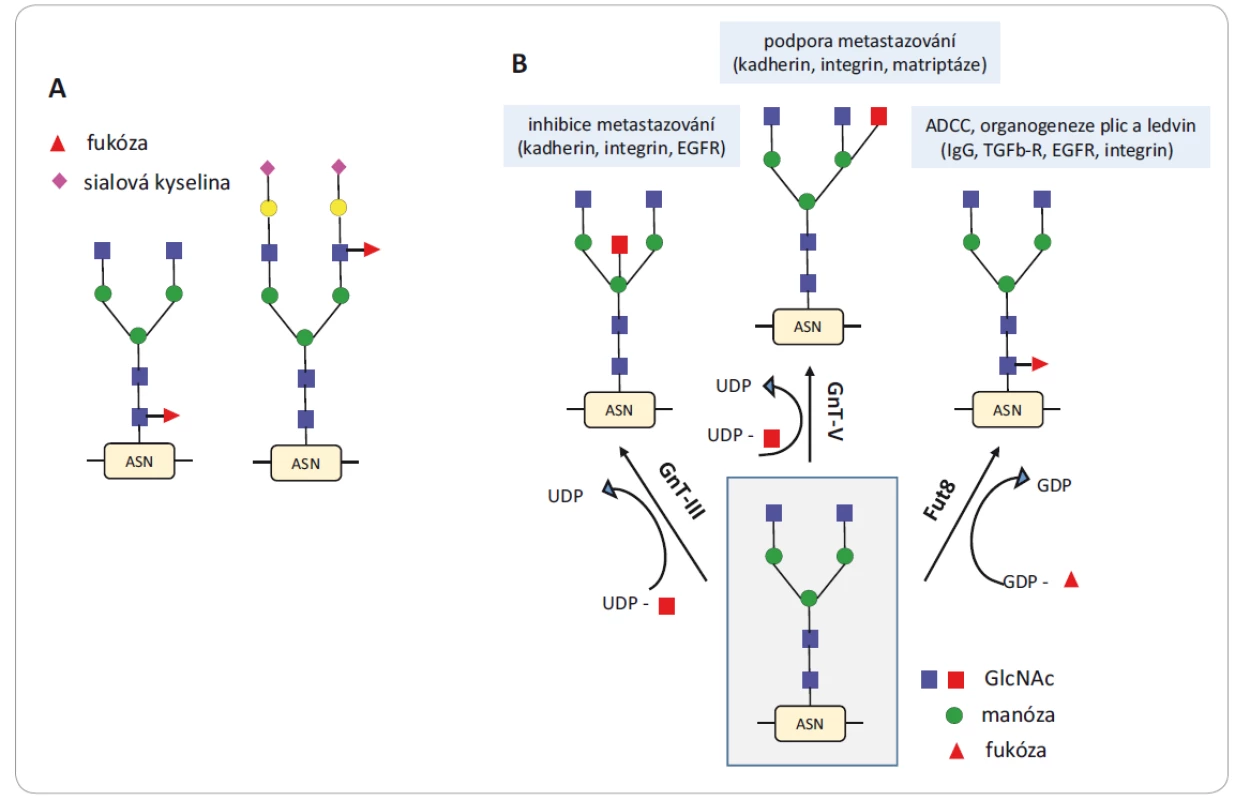
A) Glykanové struktury s připojenou fukózou v různých částech glykanu (v jádře a na anténě) a připojení terminálních sialových kyselin na anténách. B) Glykosylace je katalyzována glykosyltransferázami, které ovlivňují biologické funkce glykokonjugátů. Převzato a upraveno z [20].
ASN – aminokyselina asparagin, EGFR – receptor epidermálního růstového faktoru, ADCC – buněčná cytotoxicita závislá na protilátkách, IgG – imunoglobulin G, TGFβ-R – transformující růstový faktor β, UDP – glukuronosyltransferáza, GDP – guanosin difosfát, GlcNAc – N-acetylglukosamin, GnT-III – β1,4-N-acetylglukosaminyl transferáza, GnT-V – β1,6-N-acetylglukosaminyl transferázaK progresi nádoru přispívají též glykosyltransferázy, které jsou zodpovědné za změny struktury N-glykanů, a tím i jejich funkce (obr. 3B) [20]. Jedná se o β1,4-N-acetylglukosaminyl transferázu (GnT-III), β1,6-N-acetylglukosaminyl transferázu (GnT-V) a α1,6-fukosyl transferázu (FUT8). GnT-III dává vznik bisektinové vazbě, při níž se objevuje třetí větev v terminální části glykanu. Tato struktura zabraňuje dalšímu procesu glykosylace, protože ztrácí vlastnosti substrátu pro další glykosyltransferázy. GnT-III je považována za enzym nezbytný v biosyntetické dráze N-glykanů, který inhibuje metastazování [21]. Naopak GnT-V je zodpovědná za vznik rozvětvených glykanových struktur a její zvýšená exprese se projevuje sníženou buněčnou adhezí a zvýšenou invazivitou buněk metastazujících karcinomů tlustého střeva, mozku a prsu [21 – 24]. Glykany nesoucí β1,6-N-acetylglukosamin jsou považovány za biomarkery progrese karcinomu tlustého střeva a prsu. FUT8 zajišťuje transfer fukózy na první N-acetylglukosamin (GlcNAc) u glykosidické vazby na asparagin (popisovaná jako fukosylace na jádře glykanu). Zvýšená exprese FUT8 přímo koreluje s velikostí nádoru [25] a naopak odstranění fukosylace na jádře glykanu přítomného v molekule IgG1 zvyšuje až 100krát buněčnou cytotoxicitu závislou na protilátkách [26].
Klinicky schválené biomarkery
Glykoproteiny a glykany jsou specifickými biomarkery onkologických onemocnění. Lze je nalézt v tkáních, séru, exozomech, moči nebo jiných tělních tekutinách, nejčastěji se však setkáváme s detekcí glykoproteinů nebo glykanů přítomných v sérech. Přehled vybraných glykoproteinů přítomných v sérech schválených Úřadem pro kontrolu potravin a léčiv v USA a používaných jako nádorové biomarkery je uveden v tab. 1.
Table 1. Glykoproteiny přítomné v sérech onkologických pacientů schválených FDA jako nádorové markery. Převzato z [27,28]. ![Glykoproteiny přítomné v sérech onkologických pacientů schválených FDA jako nádorové markery. Převzato z [27,28].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/7ee102f9acc68b2efe5bbaca390d3799.png)
1 Slinivka břišní, tlusté střevo, vaječníky, žlučové cesty, žaludek, vzdálené metastázy.
2 Zažívací trakt, tlusté střevo, plíce, prsa, močový měchýř, ledviny, prostata, slinivka břišní.
* Fyziologická hodnota se mění v závislosti na věku.
** Fyziologická hodnota se mění – pro premenopauzální ženy 50 pmol/l a pro postmenopauzální ženy 80 pmol/l.
FDA – americký Úřad pro kontrolu potravin a léčivBiomarkery detekovatelné v sérech jsou sloučeniny jinak přítomné v nádorech nebo jimi produkované a uvolněné do krevního řečiště, které slouží k odlišení patologických změn organizmu od fyziologických. I když je v současnosti známo mnoho nádorových biomarkerů, vzhledem k vysoké heterogenitě a širokému spektru nádorů zatím neexistuje univerzální marker, který by byl schopen jasně určit dané onkologické onemocnění, jeho prognózu nebo předpovědět úspěšnost léčby. Fyziologické koncentrace nádorových markerů se mohou vyskytnout i u maligních onemocnění, a proto je mnoho vědeckých pracovišť zaměřeno na výzkum úlohy glykosylace v nádorové patogenezi a pochopení dějů při vývoji a progresi nádorů. Zde uvádíme popis vybraných biomarkerů, další jsou popsány v dokumentu Valíka et al [27].
α-fetoprotein
Přítomnost onkofetálního α-fetoproteinu (AFP) v séru lidského plodu byla poprvé zmíněna v roce 1956 [28], jeho hladina je standardně vysoká v embryonálním žloutkovém vaku a fetálních játrech. Syntéza AFP významně klesá po porodu a v dospělých játrech se tvoří jen ve stopovém množství. V séru dospělých zdravých jedinců se koncentrace volného sérového AFP pohybuje pod 10 μg/ l a zvýšená koncentrace AFP v séru je charakteristická pro většinu hepatocelulárních karcinomů, hepatoblastomů, karcinom slinivky břišní a gastrointestinálního traktu nebo karcinom mozku [30]. AFP je protein s jedním N-glykanem s komplexní dvouantenární strukturou, alterující terminální sialylací a fukosylací v jádře a jeho velikost je přibližně 70 kDa (obr. 4) [29,31]. Zvýšená fukosylace AFP může korelovat s progresí hepatocelulárního karcinomu [32].
Image 4. N-glykany přítomné na α-fetoproteinu vyskytující se u pacientů s hepatocelulárním karcinomem. Většina z nich je fukosylována na jádře glykanu a sialylována na anténách. Převzato a upraveno z [31]. ![N-glykany přítomné na α-fetoproteinu vyskytující se u pacientů s hepatocelulárním
karcinomem. Většina z nich je fukosylována na jádře glykanu a sialylována na
anténách. Převzato a upraveno z [31].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/c1f0c1587a12bad9e88aea359e25f1bd.png)
ASN – aminokyselina asparagin Prostatický specifický antigen
Prostatický specifický antigen (PSA) je biomarker využívaný pro detekci karcinomu prostaty u mužů. Vyskytuje se v perianálních a periuretrálních žlázách a močovém měchýři. Jedná se o serinovou proteázu syntetizovanou epitelem acinů a výstelkou duktů prostaty. Koncentrace volné i vázané formy PSA se u zdravého jedince pohybuje pod 4 μg/ l. Zvýšená koncentrace PSA v krevním oběhu indikuje porušení mikrostruktury prostaty a průnik z acinů a duktů do kapilár. Rostoucí koncentrace PSA v séru koreluje s velikostí a stage tumoru, přičemž koncentrace nad 30 μg/ l indikuje přítomnost vzdálených metastáz [33]. PSA je glykoprotein s jednou N-glykanovou strukturou (jeho velikost je 28,4 kDa), který je dále dělen do glykosylovaných a neglykosylovaných podskupin [34]. Glykanová část se vyskytuje v různých alterujících strukturách (fukosylace a/ nebo sialylace), které jsou charakteristické pro pacienty s karcinomem prostaty [35 – 37].
Nádorový antigen CA 125
CA 125 (MUC 16) byl poprvé popsán jako biomarker detekovaný monoklonální protilátkou vyvinutou proti buněčné linii OVCA 433 odvozené od karcinomu vaječníků [38]. Koncentrace CA 125 v séru pohybující se nad 35 kU/ l může indikovat přítomnost karcinomu vaječníků, dělohy, endometria, slinivky břišní, trávicího ústrojí nebo prsu. Vyšetření hladiny CA 125 se však využívá hlavně pro diagnostiku karcinomu vaječníků a je vždy vhodné jej doplnit např. stanovením hladiny karcinoembryonálního antigenu a tkáňového polypeptidického antigenu. CA 125 patří do skupiny mucinózních glykoproteinů lokalizovaných na vnější membráně buněk, je tvořen opakujícími se peptidovými epitopy mucinu MUC 16 [39,40] s přítomností O - i N-glykosylace. Jeho molekulová hmotnost v nativním stavu je vyšší než 2 miliony Da. CA 125 urychluje proliferaci nádorových buněk a potlačuje protinádorovou imunitní odpověď [41,42].
Zvýšená hladina CA 125 nad fyziologickou hodnotu (35 kU/ l) může indikovat přítomnost peritoneálních metastáz karcinomu vaječníků [43].
Lidský epididymální protein 4
Lidský epidydimální protein 4 (HE4) se nachází v epiteliálních buňkách epididymis a ženském reprodukčním traktu. Fyziologické hodnoty HE4 v séru se pohybují v rozmezí 50 – 80 pmol/ l, a to v závislosti na stáří ženy (před a po menopauze). Funkce proteinu doposud nebyla popsána. Bylo však zjištěno, že jeho nadprodukce, a tedy zvýšená koncentrace v sérech pacientek se objevuje jednak v přítomnosti serózních a endometroidních nádorů vaječníků [44], dále pak u adenokarcinomů plic a endometria [45,46]. HE4 je označován za sérový biomarker epiteliálního karcinomu vaječníků a vykazuje jako jeden z mála biomarkerů vysokou specificitu v časných stadiích tohoto onemocnění (stadium I/ II). Ve srovnání s CA 125 poskytuje větší specificitu v rozlišení benigních a maligních karcinomů. Doporučuje se též použít hodnoty koncentrací obou markerů (HE4 a CA 125) k výpočtu ROMA (risk of ovarian malignancy algorithm) skóre, které udává pravděpodobnost přítomnosti epitelového karcinomu vaječníků, pokud je pomocí zobrazovací metody nalezena abnormalita v oblasti vaječníků. Úspěšnost správné klasifikace rizika epiteliálního karcinomu vaječníků byla tímto přístupem stanovena na 93,8 % [47]. HE4 je sekretovaný nízkomolekulární N-glykoprotein [44], avšak jeho glykanová struktura zatím nebyla podrobně popsána.
Závěr
Dosavadní klinicky používané nádorové biomarkery [27] fungují velmi dobře u pacientů s rozvinutým onkologickým onemocněním. Je však třeba nalézt sady dalších biomarkerů, které by byly: 1) dostatečně senzitivní (schopné rozpoznat dané onemocnění); 2) charakteristické pro časná stadia onemocnění; 3) specifické (dostatečně odlišující onkologicky nemocného člověka od zdravého nebo trpícího jinými zdravotními problémy). V poslední době se objevilo mnoho prací popisujících moderní a efektivní metodické přístupy umožňující detekci glykosylačních změn na glykoproteinech přítomných v sérech. Glykoproteiny tedy představují atraktivní cíle při hledání biomarkerů v séru či exozomech z důvodu jejich aktivní sekrece, úniku nebo transportu ve vezikulách z nádorových buněk do extracelulárního prostoru [13,14,28]. Cílem přístupů je analyzovat nejenom glykoproteiny vyskytující se ve vysokých koncentracích (nad 1 g/ l), ale také ty se střední a nízkou koncentrací (pod 1 g/ l), které mohou představovat nové biomarkery. Mezi takové patří lektinová afinitní chromatografie [48], ELISA využívající vazbu lektinů [49,50] nebo rychle se rozvíjející hmotnostně spektrometrické techniky společně s bioinformatickými nástroji [51 – 53]. To vše vede nejen k detekci změn koncentrací glykoproteinů i jejich glykoforem přítomných v sérech v nízkých koncentracích, ale také k detailnímu popisu změn glykanových částí, které se mění v závislosti na vzniku a progresi nádorů [54].
Práce byla podpořena projekty MŠMT – NPU I – LO1413, MZ ČR – RVO (MOÚ, 00209805) a GAČR 16-04496S.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
prof. Ing. Lenka Hernychová, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: lenka.hernychova@mou.cz
Obdrženo/Submitted: 17. 6. 2019
Přijato/Accepted: 19. 8. 2019
Sources
ST et al. Comprehensive analytical approach toward glycomic characterization and profiling in urinary exosomes. Anal Chem 2017; 89(10): 5364 – 5372. doi: 10.1021/ acs.analchem.7b00062.
10. Pinho SS, Reis CA. Glycosylation in cancer: mechanisms and clinical implications. Nat Rev Cancer 2015; 15(9): 540 – 555. doi: 10.1038/ nrc3982.
11. Kailemia MJ, Park D, Lebrilla CB. Glycans and glycoproteins as specific biomarkers for cancer. Anal Bioanal Chem 2017; 409(2): 395 – 410. doi: 10.1007/ s00216-016-9880-6.
12. Ashkani J, Naidoo KJ. Glycosyltransferase gene expression profiles classify cancer types and propose prognostic subtypes. Sci Rep 2016; 20(6): 26451. doi: 10.1038/ srep26451.
13. Zhang L, Yu D. Exosomes in cancer development, metastasis, and immunity. Biochim Biophys Acta Rev Cancer 2019; 1871(2): 455 – 468. doi: 10.1016/ j.bbcan.2019.04.004.
14. Li I, Nabet BY. Exosomes in the tumor microenvironment as mediators of cancer therapy resistance. Mol Cancer 2019; 18(1): 32. doi: 10.1186/ s12943-019-0975-5.
15. Wu H, Chen X, Ji J et al. Progress of exosomes in the diagnosis and treatment of pancreatic cancer. Genet Test Mol Biomarkers 2019; 23(3): 215 – 222. doi: 10.1089/ gtmb.2018.0235.
16. Zhang W, Ou X, Wu X. Proteomics profiling of plasma exosomes in epithelial ovarian cancer: a potential role in the coagulation cascade, diagnosis and prognosis. Int J Oncol 2019; 54(5): 1719 – 1733. doi: 10.3892/ ijo.2019.4742.
17. Dube DH, Bertozzi CR. Glycans in cancer and inflammation – potential for therapeutics and diagnostics. Nat Rev Drug Discov 2005; 4(6): 477 – 488. doi: 10.1038/ nrd1751.
18. Mann BF, Goetz JA, House MG et al. Glycomic and proteomic profiling of pancreatic cyst fluids identifies hyperfucosylated lactosamines on the N-linked glycans of overexpressed glycoproteins. Mol Cell Proteomics 2012; 11(7): M111.015792. doi: 10.1074/ mcp.M111.015792.
19. Lu J, Gu J. Significance of β-galactoside α2,6 sialyltranferase 1 in cancers. Molecules 2015; 20(5): 7509 – 7527. doi: 10.3390/ molecules20057509.
20. Cummings RD, Trowbridge IS, Kornfeld S. A mouse lymphoma cell line resistant to the leukoagglutinating lectin from Phaseolus vulgaris is deficient in UDP-GlcNAc: alpha-Dmannoside beta 1,6 N-acetylglucosaminyltransferase. J Biol Chem 1982; 257(22): 13421−13427.
21. Zhao Y, Sato Y, Isaji T et al. Branched N-glycans regulate the biological functions of integrins and cadherins. FEBS J 2008; 275(9): 1939−1948. doi: 10.1111/ j.1742-4658.2008.06346.x.
22. Demetriou M, Nabi IR, Coppolino M et al. Reduced contact-inhibition and substratum adhesion in epithelial cells expressing GlcNAc-transferase V. J Cell Biol 1995; 130(2): 383−392. doi: 10.1083/ jcb.130.2.383.
23. Yamamoto H, Swoger J, Greene S et al. Beta1,6-Nacetylglucosamine-bearing N-glycans in human gliomas: implications for a role in regulating invasivity. Cancer Res 2000; 60(1): 134−142.
24. Yamamoto H, Oviedo A, Sweeley C et al. Alpha2,6-sialylation of cell-surface N-glycans inhibits glioma formation in vivo. Cancer Res 2001; 61(18): 6822−6829.
25. Ito Y, Miyauchi A, Yoshida H et al. Expression of alpha1,6-fucosyltransferase (FUT8) in papillary carcinoma of the thyroid: its linkage to biological aggressiveness and anaplastic transformation. Cancer Lett 2003; 200(2): 167−172. doi: 10.1016/ s0304-3835(03)00383-5.
26. Shinkawa T, Nakamura K, Yamane N et al. The absence of fucose but not the presence of galactose or bisecting N-acetylglucosamine of human IgG1 complex-type oligosaccharides shows the critical role of enhancing antibody-dependent cellular cytotoxicity. J Biol Chem 2003; 278(5): 3466−3473. doi: 10.1074/ jbc.M210665200.
27. Valík D, Nekulová M, Zdražilová Dubská L et al. Doporučení k využití nádorových markerů v klinické praxi. Klin Biochem Metab 2014; 22(43): 22 – 39.
28. Bergstrand CG and Czar B. Demonstration of a new protein fraction in serum from the human fetus. Scand J Clin Lab Invest 1956; 8(2): 174. doi: 10.3109/ 00365515609049266.
29. Kirwan A, Utratna M, O’Dwyer ME, et al. Glycosylation-based serum biomarkers for cancer diagnostics and prognostics. Biomed Res Int 2015; 2015 : 490531. doi: 10.1155/ 2015/ 490531.
30. Saito S, Ojima H, Ichikawa H et al. Molecular background of α-fetoprotein in liver cancer cells as revealed by global RNA expression analysis. Cancer Science 2008; 99(12): 2402 – 2409. doi: 10.1111/ j.1349-7006.2008.00973.x.
31. Johnson PJ, Poon TCW, Hjelm NM et al. Structures of disease-specific serum alpha-fetoprotein isoforms. Br J Cancer 2000; 83(10): 1330 – 1337. doi: 10.1054/ bjoc.2000.1441.
32. Kobayashi M, Kuroiwa T, Suda T et al. Fucosylated fraction of alpha-fetoprotein, L3, as a useful prognostic factor in patients with hepatocellular carcinoma with special reference to low concentrations of serum alpha-fetoprotein. Hepatol Res 2007; 37(11): 914 – 922. doi: 10.1111/ j.1872-034X.2007.00147.x.
33. Pešl M, Zámečník L, Soukup V et al. Prostatický specifický antigen a odvozené parametry. In: Urologie pro praxi 2004. [online]. Dostupné z: https:/ / www.urologiepropraxi.cz/ pdfs/ uro/ 2004/ 02/ 05.pdf.
34. Isono T, Tanaka T, Kageyama S et al. Structural diversity of cancer-related and non-cancer-related prostatespecific antigen. Clin Chem 2002; 48(12): 2187 – 2194.
35. Kyselova Z, Mechref Y, Al Bataineh MM et al. Alterations in the serum glycome due to metastatic prostate cancer. J Prot Res 2007; 6(5): 1822 – 1832. doi: 10.1021/ pr060664t.
36. Peracaula R, Barrabés S, Sarrats A et al. Altered glycosylation in tumours focused to cancer diagnosis. Dis Markers 2008; 25(4 – 5): 207 – 218. doi: 10.1155/ 2008/ 797629.
37. Leymarie N, Griffin PJ, Jonscher K et al. Interlaboratory study on differential analysis of protein glycosylation by mass spectrometry: the ABRF glycoprotein research multi-institutional study 2012. Mol Cell Proteomics 2013; 12(10): 2935 – 2951. doi: 10.1074/ mcp.M113.030643.
38. Bast RC Jr, Feeney M, Lazarus H et al. Reactivity of a monoclonal antibody with human ovarian carcinoma. J Clin Invest 1981; 68(5): 1331 – 1337. doi: 10.1172/ jci110380.
39. O’Brien TJ, Beard JB, Underwood LJ et al. The CA 125 gene: an extracellular superstructure dominated by repeat sequences. Tumour Biol 2001; 22(6): 348 – 366. doi: 10.1159/ 000050638.
40. Yin BW, Lloyd KO. Molecular cloning of the CA125 ovarian cancer antigen: identification as a new mucin, MUC16. J Biol Chem 2001; 276(29): 27371 – 27375. doi: 10.1074/ jbc.M103554200.
41. Rump A, Morikawa Y, Tanaka M et al. Binding of ovarian cancer antigen CA125/ MUC16 to mesothelin mediates cell adhesion. J Biol Chem 2004; 279(10): 9190 – 9198. doi: 10.1074/ jbc.M312372200.
42. Hattrup CL, Gendler SJ. Structure and function of the cell surface (tethered) mucins. Annu Rev Physiol 2007; 70 : 431 – 457. doi: 10.1146/ annurev.physiol.70.113006.100659.
43. Tang Z, Qian M, Ho M. The role of mesothelin in tumor progression and targeted therapy. Anticancer Agents Med Chem 2013; 13(2): 276 – 280.
44. Drapkin R, von Horsten HH, Lin Y et al. Human epididymis protein 4 (HE4) is a secreted glycoprotein that is overexpressed by serous and endometrioid ovarian carcinomas. Cancer Res 2005; 65(6): 2162 – 2169. doi: 10.1158/ 0008-5472.CAN-04-3924.
45. Moore RG, Brown AK, Miller MC et al. Utility of a novel serum tumour biomarker HE4 in patients with endometrioid adenocarcinoma of the uterus. Gynecol Oncol 2008; 110(2): 196 – 201. doi: 10.1016/ j.ygyno.2008.04.002.
46. Escudero JM, Auge JM, Filella X et al. The utility of serum human epididymis protein 4 (HE4) in patients with malignant and nonmalignant diseases: comparison with CA125. Clin Chem 2011; 57(11): 1534 – 1544. doi: 10.1373/ clinchem.2010.157073.
47. Moore RG, McMeekin DS, Brown AK et al. A novel multiple marker bioassay utilizing HE4 and CA125 for the prediction of ovarian cancer in patients with a pelvic mass.Gynecol Oncol 2009; 112(1): 40 – 46. doi: 10.1016/ j.ygyno.2008.08.031.
48. O’Connor BF, Monaghan D, Cawley J et al. Lectin affinity chromatography (LAC). Methods Mol Biol 2017; 1485 : 411 – 420. doi: 10.1007/ 978-1-4939-6412-3_23.
49. Wu J, Xie X, Nie S et al. Altered expression of sialylated glycoproteins in ovarian cancer sera using lectin-based ELISA assay and quantitative glycoproteomics analysis. J Proteome Res 2013; 12(7): 3342−3352. doi: 10.1021/ pr400169n.
50. Ito H, Hoshi K, Honda T et al. Lectin-based assay for glycoform-specific detection of α2,6-sialylated transferrin and carcinoembryonic antigen in tissue and body fluid. Molecules 2018; 23(6): 1314. doi: 10.3390/ molecules23061314.
51. Hayashi M, Matsuo K, Tanabe K et al. Comprehensive serum glycopeptide spectra analysis (CSGSA): a potential new tool for early detection of ovarian cancer. Cancers (Basel) 2019; 11(5): 591. doi: 10.3390/ cancers11050591.
52. Qiu F, Chen F, Liu D et al. LC-MS/ MS-based screening of new protein biomarkers for cervical precancerous lesions and cervical cancer Nan Fang Yi Ke Da Xue Xue Bao 2019; 39(1): 13 – 22. doi: 10.12122/ j.issn.1673-4254.2019.01.03.
53. Gaunitz S, Nagy G, Pohl NL et al. Recent advances in the analysis of complex glycoproteins. Anal Chem 2017; 89(1): 389 – 413. doi: 10.1021/ acs.analchem.6b04343.
54. Reily C, Stewart TJ, Renfrow MB et al. Glycosylation in health and disease. Nat Rev Nephrol 2019; 15(6): 346 – 366. doi: 10.1038/ s41581-019-0129-4.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2019 Issue Supplementum 3-
All articles in this issue
- Méně časté mutace EGFR v kontextu léčby nemalobuněčného karcinomu plic
- CRISPR-Cas9 jako nástroj v terapii nádorových onemocnění
- Syntetická letalita – její současné využití a potenciál v onkologické léčbě
- Pokroky ve využití organokovových sloučenin při vývoji protinádorových léčiv
- Souhrn aktuálních poznatků o úloze estrogenového receptoru α v nádorové buněčné signalizaci
- Glykoproteiny v sérech onkologických pacientů
- Glykozylácia ako dôležitý regulátor funkcie protilátok
- Výskum ubikvitinácie proteínov v onkológii
- Dlouhé nekódující RNA – současné možnosti detekce a využití v klinické praxi
- Interakce onkogenních virových proteinů s proteiny rodiny p53
- Editorial 2019
- Kooperace genomických, transkriptomických a proteomických metod v detekci mutovaných proteinů
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Výskum ubikvitinácie proteínov v onkológii
- CRISPR-Cas9 jako nástroj v terapii nádorových onemocnění
- Glykozylácia ako dôležitý regulátor funkcie protilátok
- Méně časté mutace EGFR v kontextu léčby nemalobuněčného karcinomu plic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

