-
Medical journals
- Career
Role mikroRNA v patofyziologii neuroblastomu a možnosti jejich využití pro diagnostiku, odhad prognózy a terapii
Authors: J. Vinklárek 1; J. Novák 1,2; J. Bienertová-Vašků 1,3,4; J. Štěrba 3; O. Slabý 4
Authors‘ workplace: Ústav patologické fyziologie, LF MU, Brno 1; Fyziologický ústav, LF MU, Brno 2; Klinika dětské onkologie LF MU a FN Brno 3; Molekulární onkologie II, CEITEC – Středoevropský technologický institut, MU, Brno 4
Published in: Klin Onkol 2014; 27(5): 331-339
Category: Reviews
doi: https://doi.org/10.14735/amko2014331Overview
Neuroblastom (NB) je typický solidní nádor dětského věku vznikající z prekurzorových buněk sympatické nervové tkáně, který u dětských pacientů představuje přibližně 7 % z celkového množství maligních onemocnění a který zodpovídá za přibližně 15 % dětských úmrtí v souvislosti s malignitou. MikroRNA (miRNA) jsou malé jednovláknové molekuly RNA, které se podílejí na posttranskripční regulaci genové exprese, přičemž v patogenezi neuroblastomu se uplatňuje jak nadměrná exprese protoonkogenních miRNA, tak downregulace molekul miRNA s tumor-supresorickými účinky. Zdá se, že srovnání expresních profilů miRNA u jednotlivých podtypů neuroblastomu může být užitečným nástrojem při klasifikaci subtypů onemocnění a že stanovení hladin konkrétních miRNA může mít svůj význam pro odhad citlivosti vůči léčbě či pro odhad prognózy onemocnění. Tato práce poskytuje přehled základních studií týkajících se úlohy miRNA v patogenezi neuroblastomu a zároveň poskytuje přehled o současném/ možném zapojení do diagnostiky, terapie či pro odhad prognózy pacienta trpícího tímto onemocněním.
Klíčová slova:
neuroblastom – mikroRNA – diagnostika – terapie – prognózaÚvod
Neuroblastom (NB) je typický solidní nádor dětského věku vznikající z prekurzorových buněk sympatické nervové tkáně [1]. U dětských pacientů představuje přibližně 7 % z celkového množství maligních onemocnění a zodpovídá přibližně za 15 % dětských úmrtí v souvislosti s malignitou. Neuroblastom má velmi rozmanité klinické chování [2], v některých případech může spontánně regredovat, v jiných dochází k rychlé progresi či k rychlému rozvoji rezistence k užívané terapii [3]. Rozdílné klinické chování souvisí s řadou proměnných, mezi něž patří např. věk, přítomnost genetických abnormalit v nádoru a s nimi související narušení regulačních pochodů.
MikroRNA (miRNA) jsou malé jednovláknové molekuly RNA, které se podílejí na posttranskripční regulaci genové exprese. Jejich regulační vliv byl prokázán u více než poloviny lidských genů a nebylo nikde dosud uvedeno, že by samotná molekula miRNA kódovala protein. Cílem miRNA je 3‘UTR (untranslated region – nepřekládaná oblast na 3‘ konci) cílové mRNA, přičemž vazbou miRNA do 3‘ UTR dojde k inhibici translace mRNA do proteinu nebo přímo k degradaci cílové mRNA. Druhá uvedená možnost je dle Guoa přednostně využívána u savců [1,3].
Biogeneze miRNA je velice sofistikovaný a precizně regulovaný proces, během kterého dochází k řadě postupných úprav nezralých forem pri-miRNA a pre-miRNA do formy konečné, tj. plně funkční, zralé miRNA. U nádorem nepostižených buněk je tento systém velice efektivní a v buňce se nachází více molekul zralé miRNA než molekul prekurzorových (pri - a pre-miRNA) [4]. U nádorových tkání, kde jsou geny pro miRNA transkribovány, avšak transkripty nejsou nadále upravovány, vzrůstá poměr nezralých forem miRNA ke zralým formám [5], což má za následek odlišné biologické chování buněk postižených nádorem.
Jednotlivé miRNA jsou kódovány v genech, které jsou za účasti RNA polymerázy II transkribovány do nezralé formy pri-miRNA (primární miRNA) [6 – 8]. Molekula pri-miRNA může být zdrojem pro více různých miRNA a je nadále upravována pomocí enzymů Pasha a Drosha na pre-miRNA s typickou vlásenkovou strukturou. Pre-miRNA je následně exportována do cytoplazmy pomocí exportinu 5 [9], kde je zpracována RNAsou III (Dicerem) na zralou miRNA [10]. Zralá miRNA je v posledním kroku zabudována do tzv. RISC komplexu (RNA-induced silencing complex, tj. RNA indukovaný inhibiční komplex) spolu s Argonautovými (Ago) proteiny. RISC se na podkladě komplementarity bází mezi miRNA a cílovou mRNA páruje, což vede k již výše uvedeným procesům destabilizace mRNA nebo inhibici translace. V dnešní době je známo více než 1 000 různých zástupců miRNA a je zcela jisté, že se jejich počet s prohlubujícím se poznáním bude nadále zvyšovat, což nám do budoucna umožní lépe porozumět nádorové biologii a potenciálně povede i k vytvoření účinnější a na míru šité terapie.
MikroRNA v molekulární patologii neuroblastomu
MikroRNA jako onkogeny a nádorové supresory
Molekuly miRNA se u nádorových onemocnění včetně neuroblastomu chovají jako molekuly onkogenní nebo tumor-supresorické. Zdá se, že u neroblastomu je významnější skupina onkogenních klastrů. Příkladem může být zvýšená exprese miRNA z klastru miR-17 - 92, která je potencována N-myc, onkogenem amplifikovaným u velké části neuroblastomů [11,12]. Uvedený klastr obsahuje šest koexprimovaných miRNA: miR-17, miR-18a, miR-19a, miR-19b, miR-20a a miR-92. Obecně může tento klastr usnadňovat rozvoj neuroblastomu a řady dalších nádorových onemocnění působením na 3‘UTR mRNA různých známých tumor-supresorických genů, což vede ke snížení hladin těchto proteinů. Mezi známé cíle miRNA z klastru miR-17 - 92 patří inhibitory angiogeneze, trombospondin 1 (Tsp1), connective tissue growth factor (CTGF) [13], E2F transkripční faktor 2 [14] či Dickkopf-3 (DKK3) [3]. Specifické chování vykazuje miR-18a, rovněž člen klastru miR-17 - 92, jejíž nadměrná exprese vede překvapivě k nárůstu hladiny DKK3.
Další významnou miRNA u neuroblastomu je miR-34a, která má tumor-supresorický efekt a jejíž hladiny jsou u neuroblastomu sníženy. V genu pro miR-34a nebyly zjištěny žádné mutace, které by mohly být za její snížení zodpovědné [15], usuzuje se tak na vliv epigenetických faktorů. Možným vysvětlením pro snížení hladin miR-34a je potlačení vlivu transkripčního faktoru p53 u neuroblastomových buněk, přičemž p53 je za normální situace zodpovědný za upregulaci miR-34a [16 – 19]. Je zajímavé, že p53 je mutován přibližně v 50 % všech lidských nádorových onemocnění, avšak u primárních neuroblastomů je mutován zřídka [20]. Pro vysvětlení vztahu mezi p53 a miR4 - 34a je tedy nutno zapojit onkogen N-myc, který nejspíše nepřímým vlivem na gen MDM2 působí antagonisticky na p53, což vede k snížení exprese miR-34a (regulační okruh: ↑ N-myc → ↓ p53 → ↓ miR-34a).
MikroRNA a amplifikace N-myc
Výše zmíněný protoonkogen N-myc je v patogenezi neuroblastomu velmi vděčným tématem k diskuzi a vědeckému bádání (obr. 1). Na jeho amplifikaci narazíme u cca 20 % neuroblastomů [21], přičemž za normálních okolností je hojně exprimován v nervovém systému a mezenchymální tkáni v průběhu embryogeneze [22]. Gen pro N-myc leží na chromozomu 2p24 a kóduje protein N-myc sloužící jako transkripční faktor a ovlivňující geny zapojené do buněčného cyklu, diferenciace a apoptózy [23,24]. Dnes je znám i jeho modulační vliv na miRNA [24].
Image 1. Vztah mezi N-MYC proteinem a miRNA u neuroblastomu. 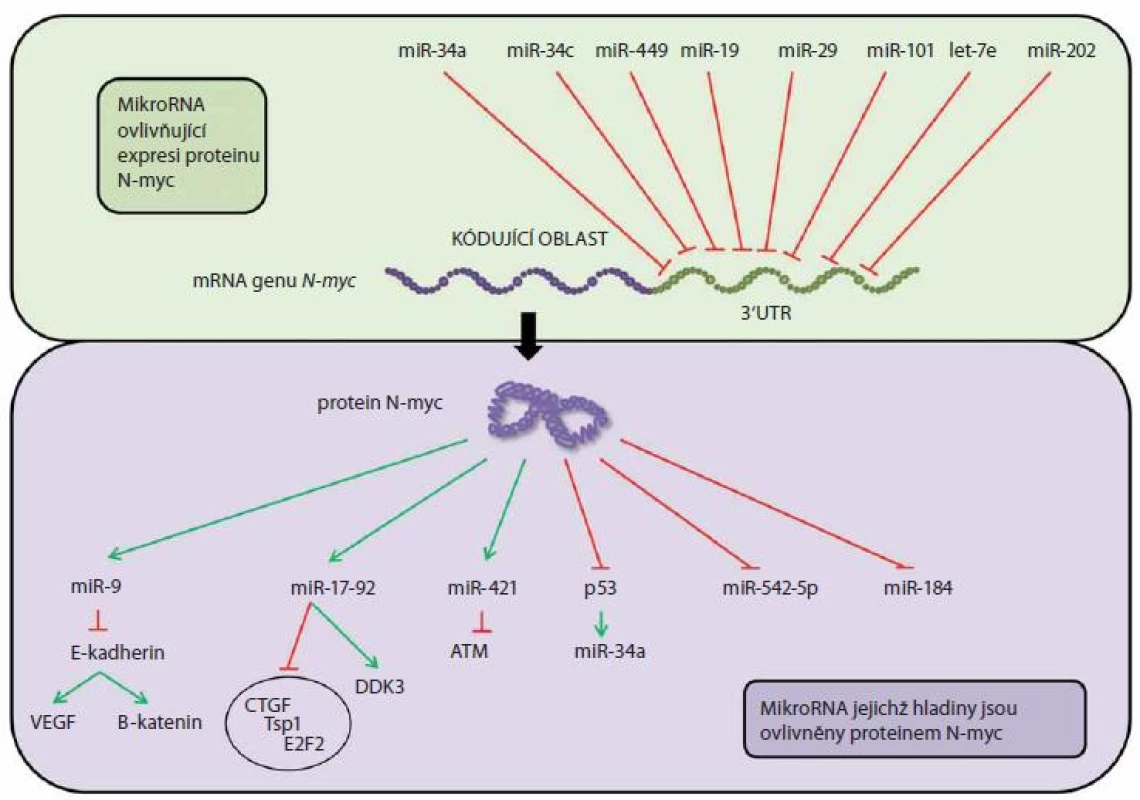
První studie potvrzující souvislosti mezi N-myc a miRNA u neuroblastomu publikovali Chen a Stallings [1] a Schulte et al [11]. Z výsledků těchto studií byla zřejmá rozdílná exprese miRNA u neuroblastomů s amplifikací N-myc (MNA) a bez N-myc amplifikace. Jak již bylo uvedeno, protoonkogen N-myc má potenciační vliv na expresi onkomiRNA z klastru miR-17 - 92. Další souvislosti mezi miRNA a N-myc byly nalezeny u miR-9, tkáňově specifické miRNA pro mozek a nervovou tkáň, která moduluje proliferaci a migraci progenitorových buněk [25].
MiR-184 ve studii Chena a Stallingse byla sníženě exprimována u neuroblastomu s amplifikací N-myc a knockdown N-myc proonkogenu způsobil naopak její upregulaci. Zvýšená hladina miR-184 snižuje u buněk neuroblastomu viabilitu zastavením buněčného cyklu a inicializací apoptózy [1]. V dalších studiích byl prokázán vliv N-myc na downregulaci tumor-supresorické miR-542 - 5p [27 – 30]. Zajímavou hypotézu představili Lin et al [31] ve své práci, kde uvedli, že za snížení exprese miRNA u high-risk tumorů, často typu MNA, je zodpovědná deregulace miRNA-zpracovávajících enzymů Dicer and Drosha. Hladiny těchto enzymů byly nejvíce sníženy u tumorů stage 4.
Proonkogen N-myc nemusí mít pouze vliv na expresi miRNA, ale je i sám těmito molekulami hojně ovlivňován. 3‘UTR oblast N-myc genu je dostatečně dlouhá, což ještě více poukazuje na možné zapojení miRNA do regulace jeho exprese. N-myc byl popsán jako jeden z cílů miR-34a, lokalizované na chromozomu 1p36, často ztrátového u neuroblastomu s amplifikací N-myc [2,15,32]. Zvýšená míra exprese miR-34a vede u neuroblastomu k indukci apoptózy a inhibici proliferace. U neuroblastomů s amplifikací N-myc vede nadměrná exprese dalších miRNA, let-7e a miR-101, taktéž k útlumu proliferace, který koreluje se sníženými hladinami N-myc proteinu, přičemž tumor-supresorická funkce let-7 byla pozorována i při diferenciaci buněk neuroblastomu [33 – 36]. Množství jednotlivých validovaných miRNA cílících 3‘UTR oblast N-myc dnes stále narůstá, validovány jsou např. již miR-34c, miR-449, miR-19, miR-29, miR-202 [37] a mnohé další miRNA jistě čeká validace v brzké budoucnosti.
MikroRNA a ztráta 11q
V patogenezi neuroblastomu se může významně uplatnit ztráta dlouhého raménka 11. chromozomu (11q-). Neuroblastomy s delecí 11q lze rozdělit na dvě podskupiny s rozdílným klinickým chováním a s rozdílnými expresními profily miRNA [26]. Například u miR-572, která je upregulována u nádorů s delecí 11q, se předpokládá cílení na geny, které jsou u tohoto nádoru dle studie od Vermeulena et al [38] downregulovány (např. DCC, PTPRF, PIK3R1, PRKCZ) [26]. Downregulace těchto genů může být jedním z faktorů přispívajících k nepříznivé prognóze postižených pacientů (obr. 2).
Image 2. MiRNA v patofyziologii neuroblastomu. 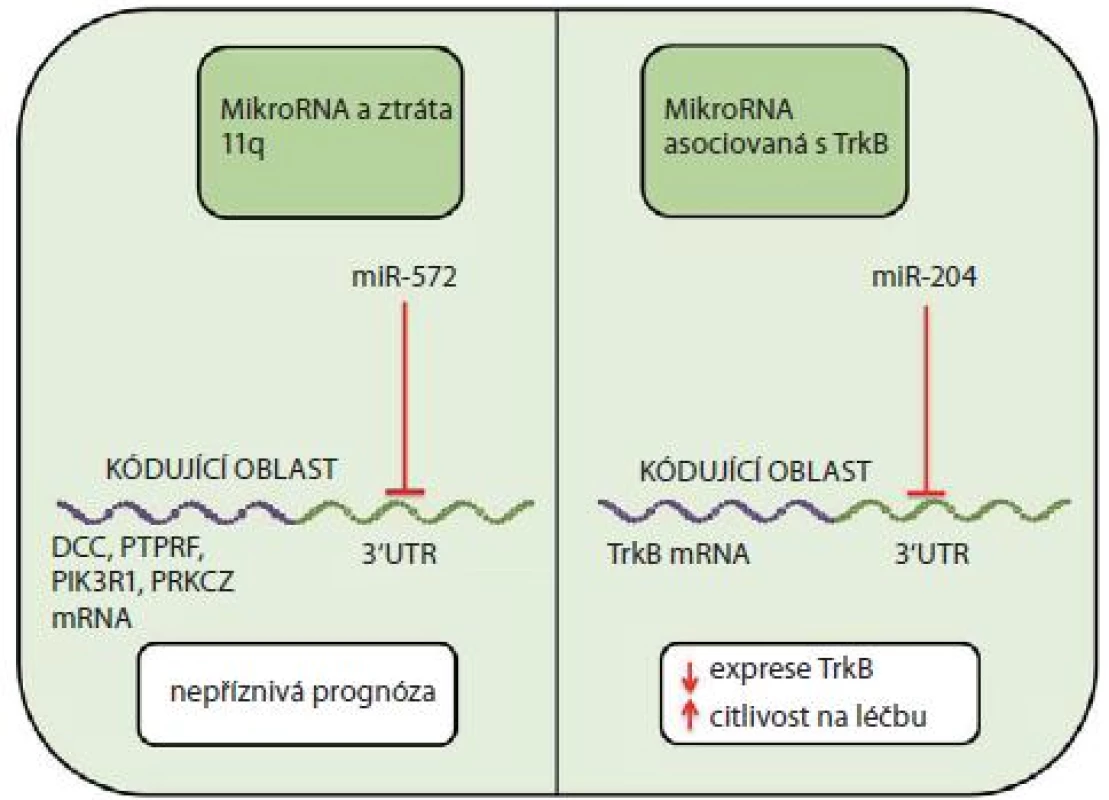
MikroRNA a neurotrofní receptory
Nesporně významnou pozici v patogenezi neuroblastomu zaujímá rodina neurotrofních receptorů TRK. Celkem existují tři tyto receptory – TrkA, TrkB a TrkC, z nichž každý hraje v patogenezi neuroblastomu odlišnou roli.
Zdá se, že významnou roli hraje exprese TrkA, typická pro biologicky příznivé neuroblastomy, které jsou dobře diferencované a často spontánně regredují. Zvýšená exprese TrkA slouží jako silný prognostický marker značící dobrou prognózu onemocnění [39 – 42]. Úroveň exprese TrkA navíc dle studie od Nakagawary et al [39] inverzně koreluje s hladinou N-myc u neuroblastomů s amplifikací N-myc. Ve studii, kterou publikoval Schulte et al [30], byly nalezeny tři miRNA (miR-9, miR-9* a miR-92), jejichž hladiny negativně korelovaly s expresí TrkA. Naopak exprese miR-542 - 5p byla významně zvýšena u TrkA exprimujících neuroblastomů a snížena u pacientů s relapsem onemocnění nebo neuroblastomů s amplifikací N-myc. Podobně popisuje zvýšenou expresi miR-542 - 5p Bray et al [27] u pacientů s příznivou prognózou.
Opačnou molekulárně biologickou roli vůči TrkA hraje TrkB, jehož zvýšené hladiny jsou typické pro velmi agresivní nádory, často s amplifikací N-myc [43]. Tyto nádory také exprimují ligand Trb, brain derived neurotrophic factor (BDNF), a přes PI3K/ AKT signální dráhu se u nich snadno rozvíjí léková rezistence [43 – 46]. Studie od Ryana et al [44] uvádí působení miR-204 na 3‘UTR oblast TrkB s následným utlumením jeho exprese a zvýšením citlivosti na cytostatickou léčbu.
Neurotrofní receptor TrkC je v patogenezi neuroblastomu spojen s biologicky příznivějším chováním, přičemž studie od Yamashira et al poukázala na jeho expresi u 25 % primárních neuroblastomů [47], tvořících tak v podstatě podskupinu nádorů exprimujících TrkC charakteristicky spojených s nižším stagingem a věkem, u nichž navíc chybí amplifikace N-myc [47,48]. V roce 2010 byla publikována studie od Guidiho et al [49] popisující novou možnou roli nervově specifické miR-128, která potlačuje expresi zkrácené izoformy TrkC.
MikroRNA a regulace diferenciace neuroblastových buněk
Vzhledem k lepší prognóze pacientů s diferencovaným typem neuroblastomu oproti méně diferencovanému nebo nediferencovanému typu [50] se pozornost rovněž zaměřuje na 13-cis-retinovou kyselinu (ATRA) a její možný vliv na expresní profily miRNA [1,51,52]. ATRA je derivát vitaminu A, retinolu, pod jehož vlivem dochází k diferenciaci nervových buněk a jehož hladiny jsou přísně regulovány v embryogenezi nervové tkáně [53,54]. Bylo popsáno několik miRNA, jejichž hladiny souvisejí s ATRA (tab. 1). Příkladem přímého působení ATRA na expresi miRNA je miR-10a [35], nepřímo pak působí ATRA na expresi miRNA přes snížení onkogenu N-myc [55] – v tomto případě jsou ovlivněny hladiny N-myc-regulovaných miRNA [11,27,56]. Skupina Laneva et al popsala miRNA (miR-9, miR-125a, miR-125b), jejichž exprese byla u neuroblastomových buněk (SK-N-BE) zvýšena po léčbě ATRA [57] a transfekce SK-N-BE buněk těmito miRNA způsobila pokles jejich proliferace. Navíc, nejspíše nepřímým efektem, došlo i ke snížení hladiny N-myc, který korespondoval s ATRA terapií [55,58].
Table 1. Vliv ATRA na vybrané mikroRNA. 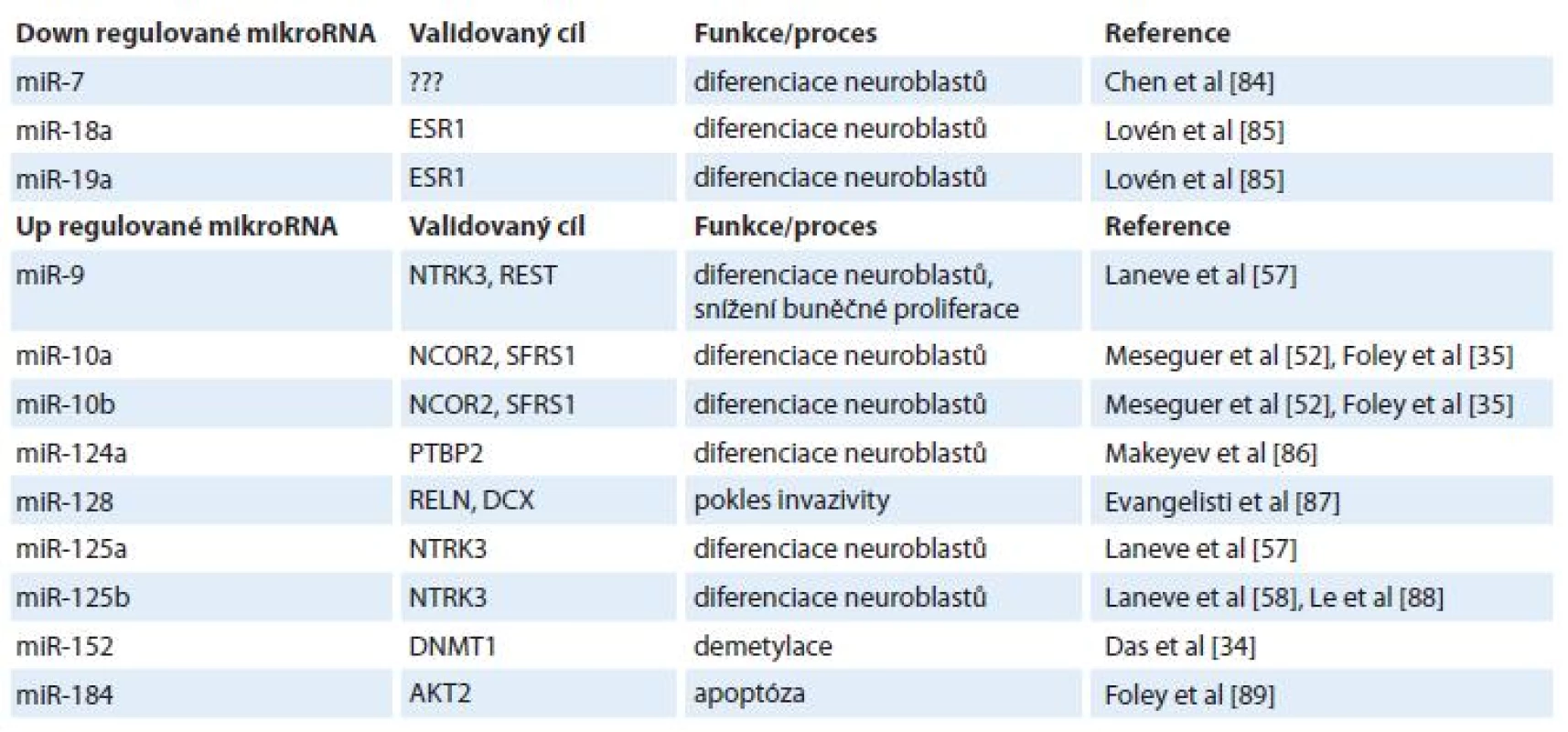
MikroRNA v kontextu současných prognostických systémů a jako nezávislé prognostické biomarkery u neuroblastomu
Dle standardní klasifikace Children‘s Oncology Group je neuroblastom klasifikován do tří skupin: low-risk, intermediate-risk a high-risk. Konkrétní zařazení pacienta do této klasifikace závisí na jeho věku v době diagnózy, na stagingu nemoci dle International Neuroblastoma Staging System (INSS), histopatologii nádoru, statutu N-myc, DNA indexu a posouzení stavu chromozomů [20,59].
Udává se, že u pacientů s nízkým rizikem (low-risk), je 95% pravděpodobnost přežití; je pro ně typický stage 1 nebo 2A/ 2B, nepřítomnost N-myc amplifikace a úspěšnost resekce nádorové masy nad 50 %. Do této skupiny jsou dále zahrnováni i pacienti se stage 4(S), příznivou histopatologií, bez N-myc amplifikace a s DNA indexem vyšším než 1.
Pro pacienty středního rizika (intermediate-risk) je charakteristické celkové přežití až 90 %, věk 0 – 12 let, stage 2A/ 2B, nepřítomnost N-myc amplifikace a úspěšnost resekce tumorové masy pod 50 %. Do skupiny dále patří pacienti ve věku 0 – 1,5 roku se stage 3, bez N-myc amplifikace; pacienti ve věku 1,5 – 12 let se stage 3, bez N-myc amplifikace, s příznivou histologií a dále pak pacienti ve věku 1 – 1,5 roku se stage 4, bez N-myc amplifikace, s příznivou histologií a DNA indexem větším než 1. Děti se stage 4(S), jejichž histologie je nepříznivá nebo DNA index roven 1, pro své relativně dobré výsledky rovněž spadají do skupiny se středním rizikem.
Skupinu s vysokým rizikem (high-risk), pro kterou je charakteristické celkové přežití pouze ve 40 % případů, charakterizuje věk více než 1,5 roku a stage 4nebo se jedná o pacienty jakéhokoliv věku se stage 1 a N-myc amplifikací, pacienty starší 1,5 roku se stage 3a nepříznivou histopatologií anebo o pacienty ve věku 1 – 1,5 roku se stage 4 a DNA indexem rovným 1 či nepříznivou histopatologií [59,60].
Neuroblastom představuje onemocnění s extrémně variabilním klinickým průběhem se třemi hlavními genetickými subtypy: hyperdiploidní/ blízce triploidní nádory (HYP), nádory s amplifikací N-myc (MNA nádory) a hemizigotní tumory se ztrátou materiálu na 11. chromozomu. Z hlediska klinických výsledků se jednotlivé subtypy liší svým vývojem a prognózou, přičemž neuroblastomy s delecí 11q a amplifikací N-myc mají obvykle špatnou prognózou [61,62]. Zajímavé a logické je i nalezení odlišných expresních profilů miRNA u různých subtypů tohoto onemocnění [1]. Například míra exprese onkogenního klastru miR-17 - 92 a rodiny miR-181 byla ve studii od Schulteho et al [28] zvýšena u prognosticky nepříznivých neuroblastomů, naopak předpokládané tumor-supresorické miRNA (miR-542 - 5p a miR-628) byly hojně exprimovány u prognosticky příznivějších tumorů. V jiné studii [30] bylo popsáno 37 mikroRNA, které korelovaly s expresí TrkA, již výše zmíněného markeru dobré prognózy. Exprese nejvýznamnější miRNA spojené s TrkA, miR-542 - 5p, pak i negativně korelovala s expresí N-myc onkogenu. Další diagnosticky a prognosticky cenné informace popisují převážně opačné expresní charakteristiky miRNA u MNA tumorů oproti jiným typům [1]. MiRNA jsou zde výrazně downregulovány (tab. 2).
Table 2. Rozdíly v expresi vybraných miRNA u neuroblastomu s amplifi kací N-myc oproti hyperdiploidnímu (HYP) a 11q-. 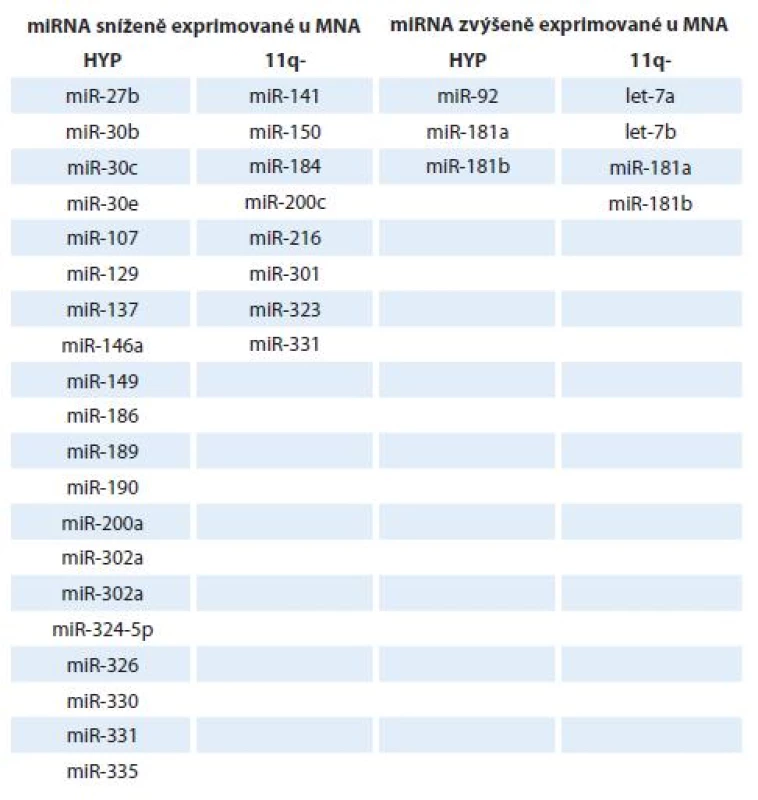
Bylo také popsáno, že některé miRNA charakterizují různé subtypy neuroblastomu (miR-92, miR-107, miR-181a, miR-181b) a hrají též roli v rozvoji jiných nádorových onemocnění [63,64]. U nádorů s delecí 11q byla popsána zvýšená exprese miR-216 a miR-150 oproti neuroblastomu s amplifikací N-myc. Oba dva tyto neuroblastomové subtypy se nepříliš liší svými nepříznivými klinickými výsledky, avšak tato „nepříznivost“ je podložena různými expresními profily miRNA [62]. Právě do těchto specifických rozdílů charakteristických pro jednotlivé subtypy neuroblastomů je vkládána velká důvěra vzhledem k potenciálnímu využití v diagnostice, pro stanovení prognózy a vytvoření terapie šité na míru.
MikroRNA jako terapeutické cíle u neuroblastomu
Zapojení miRNA do různých buněčných procesů je dnes již považováno za potvrzenou skutečnost a čím jsou naše znalosti o jejich roli v různých regulačních okruzích hlubší a detailnější, tím více nadějí se vkládá do možnosti rozvoje nových terapeutických postupů u celé škály onemocnění, nevyjímaje problematiku onkologickou. Snaha o nápravu deregulovaných hladin miRNA u neuroblastomu může výrazně posunout efektivitu léčby a potenciál miRNA ovlivnit řadu genů hrajících roli v jedné molekulární dráze je předurčuje k tomu, aby se staly vhodnými kandidáty pro cílenou protinádorovou terapii [65]. V onkologické terapii (obr. 3) lze užít tzv. antagonisty miRNA (inhibiční strategie; anti-miR/ antago-miR), a to v případě, že chceme snížit hladiny proonkogenní miRNA [66,67]. Příkladem mohou být miRNA, které jsou ve vyšší míře exprimovány u neuroblastomů s amplifikací N-myc, např. miR-380-5p ovlivňující expresi tumor-supresorického p53, a tak proliferaci buněk neuroblastomu. Její zvýšená exprese vede u myší k rozvoji neuroblastomu; pokud je však inhibována, rozbíhá se apoptóza nádorových buněk právě cestou dříve potlačovaného p53. Vpravení antagonisty miR-380 - 5p v studii od Swarbricka et al vedlo in vivo k redukci velikosti tumoru [68]. Další možný způsob terapie pomocí miRNA je využití tzv. miRNA mimics (substituční strategie) [69,70]. Tento způsob léčby je s ohledem na skutečnost, že u většiny nádorů dochází ke globálnímu snížení hladin miRNA, velmi zajímavý [65]. Potenciální využití různých miRNA v cílené léčbě neuroblastomu shrnuje tab. 3.
Image 3. Terapeutické možnosti u neuroblastomu pomocí miRNA. 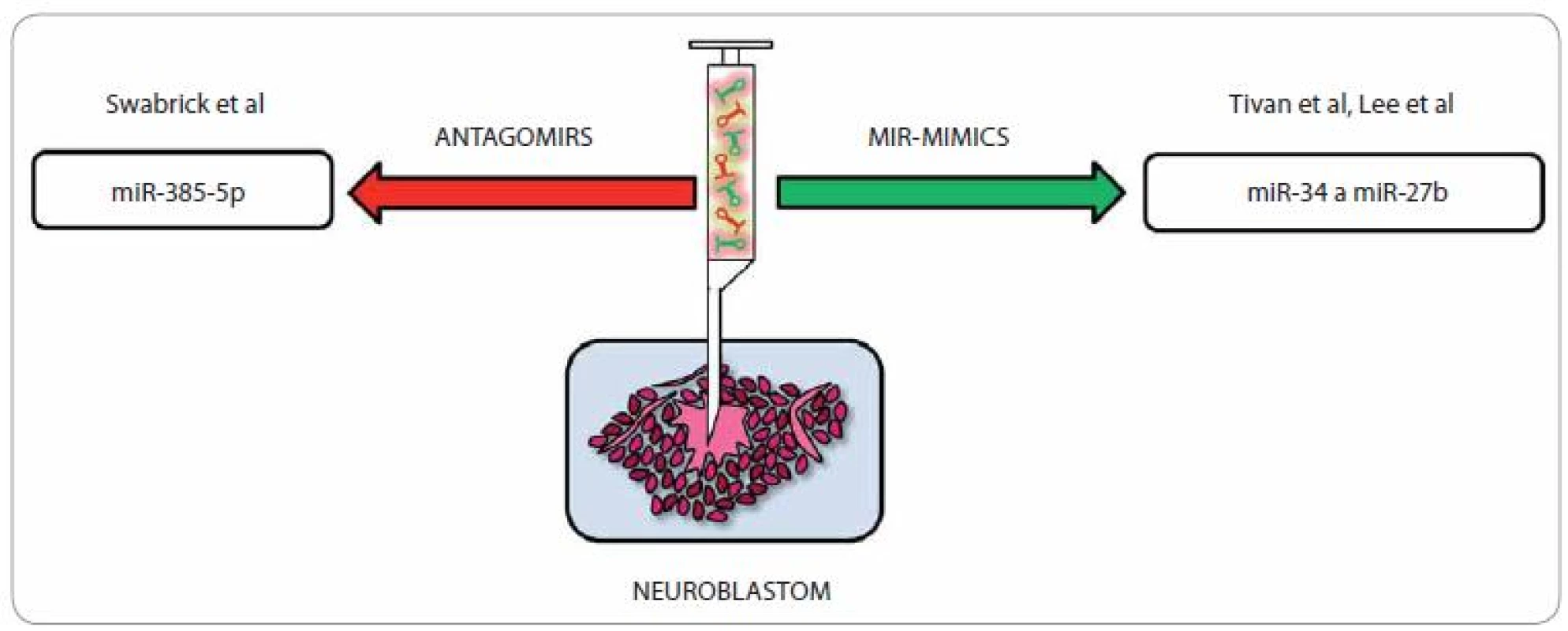
Table 3. MiRNA jako možné cíle terapie neuroblastomu (převzato z Verissimo CS et al 2011). 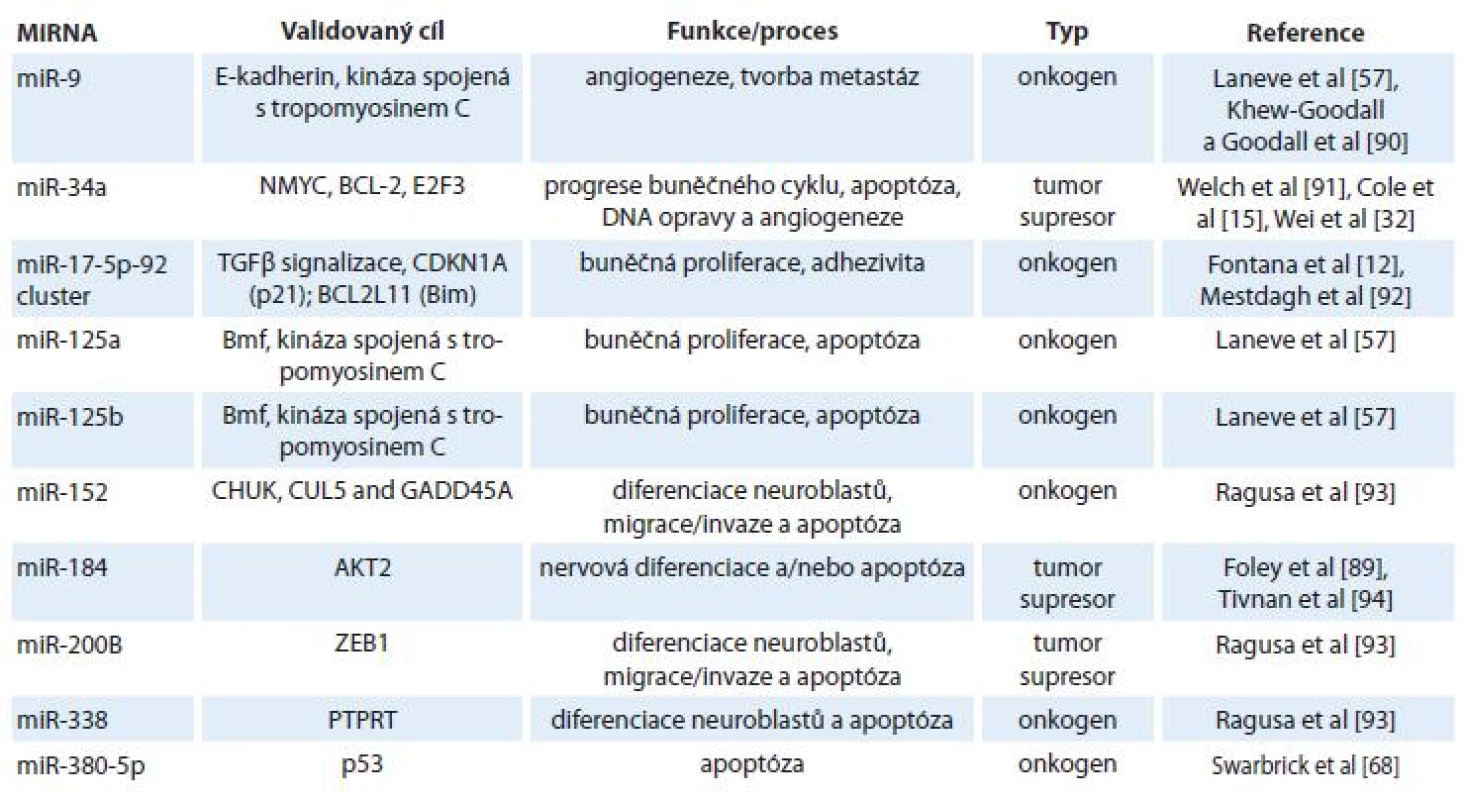
Vzhledem k tomu, že miRNA, které jsou identické s miRNA downregulovanými u neuroblastomu, jejichž hladiny bychom si přáli terapeuticky ovlivnit, se hojně vyskytují i v různých zdravých tkáních, kde plní své rozmanité fyziologické role, je samotné vpravení miRNA antagonistů/ mimik do lidského organizmu za terapeutickým účelem značně problematické. Zdá se, že možným východiskem by mohlo být využití tumor-specifických membránových receptorů, jež by umožnily specifickou vazbu podaného léčiva. U neuroblastomu a několika dalších tumorů je na povrchu nádorových buněk hojně vystavován disialogangliosidový antigen GD2 [71,72], na který je cíleno v nádorově specifické terapii [73 – 76]. S využitím vhodné miRNA, nosiče a protilátky cílené proti GD2 by mohlo být možné tohoto antigenu využít k terapii, jak již bylo potvrzeno studií od Tivnana et al. V této studii byla použita tumor-supresorická a proapoptotická miR-34a, která byla zabalena v nanočástici a konjugována s GD2 protilátkou, přičemž výsledný terapeutický efekt byl velmi příznivý. Tento způsob podání miRNA je vysoce specifický a cílí výhradně na samotné nádorové buňky, neboť nepostižené orgány nebyly dle dosažených výsledků s terapeutickými částicemi vůbec konfrontovány [77]. Zajímavé bylo i zjištění, že chyběly typické symptomy spojené s využitím anti-GD2 imunoterapie, např. neuropatické bolesti [78], přičemž tento rozdíl by se dal vysvětlit rozdílnou (menší) dávkou anti-GD2 oproti dávce používané při klasické imunoterapii [77]. Příkladem dalšího terapeutického uplatnění miRNA u pacientů s neuroblastomem je studie od Leea et al [79]. Jejich tým popsal účinky miR-27b, člena miR-27 rodiny (miR-27a, miR-27b), cílícího přímo na PPARγ (peroxisome proliferators-activated receptor). U neuroblastomových buněk je tato miRNA vysoce specifická a její nadměrná exprese působí tumor-supresoricky inhibicí buněčného růstu neuroblastomu in vitro i in vivo právě vlivem na PPARγ. Navíc zastavení buněčného růstu přes PPARγ je spojeno se sníženou expresí pH regulátoru NHE1 a NF-κB, který je spojován se zánětlivou odezvou u nádorových onemocnění [79 – 83].
Závěr
V poslední době došlo k zásadnímu pokroku na poli chápání vývojové i patogenetické úlohy miRNA u nádorových onemocnění včetně neuroblastomu – dokladem toho je i klinická studie využívající miR-34a v terapii nádorů jater, která v roce 2013 vstoupila do své první fáze (NCT01829971). I přes tento pokrok však zůstává stále velké množství nezodpovězených otázek týkajících se účinnosti i bezpečnosti využití miRNA v terapii. Kvůli velké propojenosti a návaznosti miRNA na nespočet signálních drah však cílená terapie neuroblastomu na bázi miRNA ani nemůže být nekomplikovaná. Problematika miRNA každopádně dává naději do budoucna a tyto malé molekuly nám snad již v brzké době pomohou v diagnostice a stanovení prognózy u pacientů s neuroblastomem, a jednoho dne se možná stanou součástí terapie šité na míru konkrétnímu pacientovi.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Jan Vinklárek
Ústav patologické fyziologie
LF MU
Kamenice 5
625 00 Brno
e-mail: jfcvinklarek@gmail.com
Obdrženo: 15. 10. 2013
Přijato: 1. 9. 2014
Sources
1. Chen Y, Stallings RL. Differential patterns of microRNA expression in neuroblastoma are correlated with prognosis, differentiation, and apoptosis. Cancer Res 2007; 67(3): 976 – 983.
2. Maris JM, Hogarty MD, Bagatell R et al. Neuroblastoma. Lancet 2007; 369(9579): 2106 – 2120.
3. Haug BH, Henriksen JR, Buechner J et al. MYCN-regulated miRNA-92 inhibits secretion of the tumor suppressor DICKKOPF-3 (DKK3) in neuroblastoma. Carcinogenesis 2011; 32(7): 1005 – 1012. doi: 10.1093/ carcin/ bgr073.
4. Hulf T, Sibbritt T, Wiklund ED et al. Discovery pipeline for epigenetically deregulated miRNAs in cancer: integration of primary miRNA transcription. BMC Genomics 2011; 12 : 54. doi: 10.1186/ 1471-2164-12-54.
5. Lee EJ, Baek M, Gusev Y et al. Systematic evaluation of microRNA processing patterns in tissues, cell lines, and tumors. RNA 2008; 14(1): 35 – 42.
6. Lee Y, Kim M, Han J et al. MicroRNA genes are transcribed by RNA polymerase II. EMBO J 2004; 23(20): 4051 – 4060.
7. Zhou X, Ruan J, Wang G et al. Characterization and identification of microRNA core promoters in four model species. PLoS Comput Biol 2007; 3(3): e37.
8. Siomi H, Siomi MC. Posttranscriptional regulation of microRNA biogenesis in animals. Mol Cell 2010; 38(3): 323 – 332. doi: 10.1016/ j.molcel.2010.03.013.
9. Murchison EP, Hannon GJ. MiRNAs on the move: miRNA biogenesis and the RNAi machinery. Curr Opin Cell Biol 2004; 16(3): 223 – 229.
10. Lund E, Dahlberg JE. Substrate selectivity of exportin 5and Dicer in the biogenesis of microRNAs. Cold Spring Harb Symp Quant Biol 2006; 71 : 59 – 66.
11. Schulte JH, Horn S, Otto T et al. MYCN regulates oncogenic MicroRNAs in neuroblastoma. Int J Cancer 2008; 122(3): 699 – 704.
12. Fontana L, Fiori ME, Albini S et al. Antagomir-17 - 5p abolishes the growth of therapy-resistant neuroblastoma through p21 and BIM. PLoS One 2008; 3(5): e2236. doi: 10.1371/ journal.pone.0002236.
13. Dews M, Homayouni A, Yu D et al. Augmentation of tumor angiogenesis by a Myc-activated microRNA cluster. Nat Genet 2006; 38(9): 1060 – 1065.
14. O‘Donnell KA, Wentzel EA, Zeller KI et al. c-Myc-regulated microRNAs modulate E2F1 expression. Nature 2005; 435(7043): 839 – 843.
15. Cole KA, Attiyeh EF, Mosse YP et al. A functional screen identifies miR-34a as a candidate neuroblastoma tumor suppressor gene. Mol Cancer Res 2008; 6(5): 735 – 742. doi: 10.1158/ 1541-7786.MCR-07-2102.
16. Chang TC, Wentzel EA, Kent OA et al. Transactivation of miR-34a by p53 broadly influences gene expression and promotes apoptosis. Mol Cell 2007; 26(5): 745 – 752.
17. He L, He X, Lim LP et al. A microRNA component of the p53 tumour suppressor network. Nature 2007; 447(7148): 1130 – 1134.
18. Raver-Shapira N, Marciano E, Meiri E et al. Transcriptional activation of miR-34a contributes to p53 - mediated apoptosis. Mol Cell 2007; 26(5): 731 – 743.
19. Tarasov V, Jung P, Verdoodt B et al. Differential regulation of microRNAs by p53 revealed by massively parallel sequencing: miR-34a is a p53 target that induces apoptosis and G1 - arrest. Cell Cycle 2007; 6(13): 1586 – 1593.
20. Hosoi G, Hara J, Okamura T et al. Low frequency of the p53 gene mutations in neuroblastoma. Cancer 1994; 73(12): 3087 – 3093.
21. Deyell RJ, Attiyeh EF. Advances in the understanding of constitutional and somatic genomic alterations in neuroblastoma. Cancer Genet 2011; 204(3): 113 – 121. doi: 10.1016/ j.cancergen.2011.03.001.
22. Stanton BR, Perkins AS, Tessarollo L et al. Loss of N-myc function results in embryonic lethality and failure of the epithelial component of the embryo to develop. Genes Dev 1992; 6(12A): 2235 – 2247.
23. Meyer N, Penn LZ. Reflecting on 25 years with MYC. Nat Rev Cancer 2008; 8(12): 976 – 990. doi: 10.1038/ nrc2231.
24. Buechner J, Einvik C. N-myc and noncoding RNAs in neuroblastoma. Mol Cancer Res 2012; 10(10): 1243 – 1253. doi: 10.1158/ 1541-7786.MCR-12-0244.
25. Delaloy C, Liu L, Lee JA et al. MicroRNA-9 coordinates proliferation and migration of human embryonic stem cell-derived neural progenitors. Cell Stem Cell 2010; 6(4): 323 – 335. doi: 10.1016/ j.stem.2010.02.015.
26. Buckley PG, Alcock L, Bryan K et al. Chromosomal and microRNA expression patterns reveal biologically distinct subgroups of 11q - neuroblastoma. Clin Cancer Res 2010; 16(11): 2971–2978. doi: 10.1158/1078-0432.CCR-09-3215.
27. Bray I, Bryan K, Prenter S et al. Widespread dysregulation of MiRNAs by MYCN amplification and chromosomal imbalances in neuroblastoma: association of miRNA expression with survival. PLoS One 2009; 4(11): e7850. doi: 10.1371/ journal.pone.0007850.
28. Schulte JH, Marschall T, Martin M et al. Deep sequencing reveals differential expression of microRNAs in favorable versus unfavorable neuroblastoma. Nucleic Acids Res 2010; 38(17): 5919 – 5928. doi: 10.1093/ nar/ gkq342.
29. Bray I, Tivnan A, Bryan K et al. MicroRNA-542 - 5p as a novel tumor suppressor in neuroblastoma. Cancer Lett 2011; 303(1): 56 – 64. doi: 10.1016/ j.canlet.2011.01.016.
30. Schulte JH, Schowe B, Mestdagh P et al. Accurate prediction of neuroblastoma outcome based on miRNA expression profiles. Int J Cancer 2010; 127(10): 2374 – 2385. doi: 10.1002/ ijc.25436.
31. Lin RJ, Lin YC, Chen J et al. microRNA signature and expression of Dicer and Drosha can predict prognosis and delineate risk groups in neuroblastoma. Cancer Res 2010; 70(20): 7841 – 7850. doi: 10.1158/ 0008-5472.CAN-10-0970.
32. Wei JS, Song YK, Durinck S et al. The MYCN oncogene is a direct target of miR-34a. Oncogene 2008; 27(39): 5204 – 5213. doi: 10.1038/ onc.2008.154.
33. Buechner J, Henriksen JR, Haug BH et al. Inhibition of mir-21, which is up-regulated during MYCN knockdown-mediated differentiation, does not prevent differentiation of neuroblastoma cells. Differentiation 2011; 81(1): 25 – 34. doi: 10.1016/ j.diff.2010.09.184.
34. Das S, Foley N, Bryan K et al. MicroRNA mediates DNA demethylation events triggered by retinoic acid during neuroblastoma cell differentiation. Cancer Res 2010; 70(20): 7874 – 7881. doi: 10.1158/ 0008-5472.CAN-10-1534.
35. Foley NH, Bray I, Watters KM et al. MicroRNAs 10a and 10b are potent inducers of neuroblastoma cell differentiation through targeting of nuclear receptor corepressor 2. Cell Death Differ 2011; 18(7): 1089 – 1098. doi: 10.1038/ cdd.2010.172.
36. Fukuda Y, Kawasaki H, Taira K. Exploration of human miRNA target genes in neuronal differentiation. Nucleic Acids Symp Ser (Oxf) 2005; 49 : 341 – 342.
37. Buechner J, Tomte E, Haug BH et al. Tumour-suppressor microRNAs let-7 and mir-101 target the proto-oncogene MYCN and inhibit cell proliferation in MYCN-amplified neuroblastoma. Br J Cancer 2011; 105(2): 296 – 303. doi: 10.1038/ bjc.2011.220.
38. Vermeulen J, De Preter K, Naranjo A et al. Predicting outcomes for children with neuroblastoma using a multigene-expression signature: a retrospective SIOPEN/ COG/ GPOH study. Lancet Oncol 2009; 10(7): 663 – 671. doi: 10.1016/ S1470-2045(09)70154-8.
39. Nakagawara A, Arima M, Azar CG et al. Inverse relationship between trk expression and N-myc amplification in human neuroblastomas. Cancer Res 1992; 52(5): 1364 – 1368.
40. Nakagawara A, Arima-Nakagawara M, Scavarda NJ et al.Association between high levels of expression of the TRK gene and favorable outcome in human neuroblastoma. N Engl J Med 1993; 328(12): 847 – 854.
41. Kogner P, Barbany G, Dominici C et al. Coexpression of messenger RNA for TRK protooncogene and low affinity nerve growth factor receptor in neuroblastoma with favorable prognosis. Cancer Res 1993; 53(9): 2044 – 2050.
42. Suzuki T, Bogenmann E, Shimada H et al. Lack of high-affinity nerve growth factor receptors in aggressive neuroblastomas. J Natl Cancer Inst 1993; 85(5): 377 – 384.
43. Nakagawara A, Azar CG, Scavarda NJ et al. Expression and function of TRK-B and BDNF in human neuroblastomas. Mol Cell Biol 1994; 14(1): 759 – 767.
44. Ryan J, Tivnan A, Fay J et al. MicroRNA-204 increases sensitivity of neuroblastoma cells to cisplatin and is associated with a favourable clinical outcome. Br J Cancer 2012; 107(6): 967 – 976. doi: 10.1038/ bjc.2012.356.
45. Ho R, Eggert A, Hishiki T et al. Resistance to chemotherapy mediated by TrkB in neuroblastomas. Cancer Res 2002; 62(22): 6462 – 6466.
46. Jaboin J, Hong A, Kim CJ et al. Cisplatin-induced cytotoxicity is blocked by brain-derived neurotrophic factor activation of TrkB signal transduction path in neuroblastoma. Cancer Lett 2003; 193(1): 109 – 114.
47. Yamashiro DJ, Nakagawara A, Ikegaki N et al. Expression of TrkC in favorable human neuroblastomas. Oncogene 1996; 12(1): 37 – 41.
48. Ryden M, Sehgal R, Dominici C et al. Expression of mRNA for the neurotrophin receptor trkC in neuroblastomas with favourable tumour stage and good prognosis. Br J Cancer 1996; 74(5): 773 – 779.
49. Guidi M, Muinos-Gimeno M, Kagerbauer B et al. Overexpression of miR-128 specifically inhibits the truncated isoform of NTRK3 and upregulates BCL2 in SH-SY5Y neuroblastoma cells. BMC Mol Biol 2010; 11 : 95. doi: 10.1186/ 1471-2199-11-95.
50. Shimada H, Umehara S, Monobe Y et al. International neuroblastoma pathology classification for prognostic evaluation of patients with peripheral neuroblastic tumors: a report from the Children‘s Cancer Group. Cancer 2001; 92(9): 2451 – 2461.
51. Beveridge NJ, Tooney PA, Carroll AP et al. Down-regulation of miR-17 family expression in response to retinoic acid induced neuronal differentiation. Cell Signal 2009; 21(12): 1837 – 1845. doi: 10.1016/ j.cellsig.2009.07.019.
52. Meseguer S, Mudduluru G, Escamilla JM et al. MicroRNAs-10a and - 10b contribute to retinoic acid-induced differentiation of neuroblastoma cells and target the alternative splicing regulatory factor SFRS1 (SF2/ ASF). J Biol Chem 2011; 286(6): 4150 – 4164. doi: 10.1074/ jbc.M110.167817.
53. Noy N. Between death and survival: retinoic acid in regulation of apoptosis. Annu Rev Nutr 2010; 30 : 201 – 217. doi: 10.1146/ annurev.nutr.28.061807.155509.
54. Abemayor E, Sidell N. Human neuroblastoma cell lines as models for the in vitro study of neoplastic and neuronal cell differentiation. Environ Health Perspect 1989; 80 : 3 – 15.
55. Thiele CJ, Reynolds CP, Israel MA. Decreased expression of N-myc precedes retinoic acid-induced morphological differentiation of human neuroblastoma. Nature 1985; 313(6001): 404 – 406.
56. Mestdagh P, Fredlund E, Pattyn F et al. MYCN/ c-MYC-induced microRNAs repress coding gene networks associated with poor outcome in MYCN/ c-MYC-activated tumors. Oncogene 2010; 29(9): 1394 – 1404. doi: 10.1038/ onc.2009.429.
57. Laneve P, Di Marcotullio L, Gioia U et al. The interplay between microRNAs and the neurotrophin receptor tropomyosin-related kinase C controls proliferation of human neuroblastoma cells. Proc Natl Acad Sci U S A 2007; 104(19): 7957 – 7962.
58. Thiele CJ, Israel MA. Regulation of N-myc expression is a critical event controlling the ability of human neuroblasts to differentiate. Exp Cell Biol 1988; 56(6): 321 – 333.
59. Childrensoncologygroup.org [homepage on the Internet]. Children’s Oncology Group. Available from: http:/ / www.childrensoncologygroup.org/ index.php/ neuroblastoma/ 197.
60. Davidoff AM. Neuroblastoma. Semin Pediatr Surg 2012; 21(1): 2 – 14. doi: 10.1053/ j.sempedsurg.2011.10.009.
61. Brodeur GM, Seeger RC, Schwab M et al. Amplification of N-myc in untreated human neuroblastomas correlates with advanced disease stage. Science 1984; 224(4653): 1121 – 1124.
62. Attiyeh EF, London WB, Mosse YP et al. Chromosome 1p and 11q deletions and outcome in neuroblastoma. N Engl J Med 2005; 353(21): 2243 – 2253.
63. Volinia S, Calin GA, Liu CG et al. A microRNA expression signature of human solid tumors defines cancer gene targets. Proc Natl Acad Sci U S A 2006; 103(7): 2257 – 2261.
64. Ciafre SA, Galardi S, Mangiola A et al. Extensive modulation of a set of microRNAs in primary glioblastoma. Biochem Biophys Res Commun 2005; 334(4): 1351 – 1358.
65. Slabý O, Svoboda M (eds). MikroRNA v onkologii. 1. vyd. Praha: Galén 2012.
66. Calin GA, Croce CM. Chromosomal rearrangements and microRNAs: a new cancer link with clinical implications. J Clin Invest 2007; 117(8): 2059 – 2066.
67. Stenvang J, Silahtaroglu AN, Lindow M et al. The utility of LNA in microRNA-based cancer diagnostics and therapeutics. Semin Cancer Biol 2008; 18(2): 89 – 102. doi: 10.1016/ j.semcancer.2008.01.004.
68. Swarbrick A, Woods SL, Shaw A et al. miR-380 - 5p represses p53 to control cellular survival and is associated with poor outcome in MYCN-amplified neuroblastoma. Nat Med 2010; 16(10): 1134 – 1140. doi: 10.1038/ nm.2227.
69. Garzon R, Marcucci G, Croce CM. Targeting microRNAs in cancer: rationale, strategies and challenges. Nat Rev Drug Discov 2010; 9(10): 775 – 789. doi: 10.1038/ nrd3179.
70. Bader AG, Brown D, Stoudemire J et al. Developing therapeutic microRNAs for cancer. Gene Ther 2011; 18(12): 1121 – 1126. doi: 10.1038/ gt.2011.79.
71. Ritter G, Livingston PO. Ganglioside antigens expressed by human cancer cells. Semin Cancer Biol 1991; 2(6): 401 – 409.
72. Wu ZL, Schwartz E, Seeger R et al. Expression of GD2 ganglioside by untreated primary human neuroblastomas. Cancer Res 1986; 46(1): 440 – 443.
73. Handgretinger R, Anderson K, Lang P et al. A phase I study of human/ mouse chimeric antiganglioside GD2 antibody ch14.18 in patients with neuroblastoma. Eur J Cancer 1995; 31A(2): 261 – 267.
74. Yu AL, Uttenreuther-Fischer MM, Huang CS et al. Phase Itrial of a human-mouse chimeric anti-disialoganglioside monoclonal antibody ch14.18 in patients with refractory neuroblastoma and osteosarcoma. J Clin Oncol 1998; 16(6): 2169 – 2180.
75. Zeytin HE, Tripathi PK, Bhattacharya-Chatterjee M et al. Construction and characterization of DNA vaccines encoding the single-chain variable fragment of the anti-idiotype antibody 1A7 mimicking the tumor-associated antigen disialoganglioside GD2. Cancer Gene Ther 2000; 7(11): 1426 – 1436.
76. Lode HN, Xiang R, Varki NM et al. Targeted interleukin-2 therapy for spontaneous neuroblastoma metastases to bone marrow. J Natl Cancer Inst 1997; 89(21): 1586 – 1594.
77. Tivnan A, Orr WS, Gubala V et al. Inhibition of neuroblastoma tumor growth by targeted delivery of microRNA-34a using anti-disialoganglioside GD2 coated nanoparticles. PLoS One 2012; 7(5): e38129. doi: 10.1371/ journal.pone.0038129.
78. Wallace MS, Lee J, Sorkin L et al. Intravenous lidocaine: effects on controlling pain after anti-GD2 antibody therapy in children with neuroblastoma – a report of a series. Anesth Analg 1997; 85(4): 794 – 796.
79. Lee JJ, Drakaki A, Iliopoulos D et al. MiR-27b targets PPARgamma to inhibit growth, tumor progression and the inflammatory response in neuroblastoma cells. Oncogene 2012; 31(33): 3818 – 3825. doi: 10.1038/ onc.2011.543.
80. Chung SW, Kang BY, Kim SH et al. Oxidized low density lipoprotein inhibits interleukin-12 production in lipopolysaccharide-activated mouse macrophages via direct interactions between peroxisome proliferator-activated receptor-gamma and nuclear factor-kappa B. J Biol Chem 2000; 275(42): 32681 – 32687.
81. Balkwill F, Mantovani A. Inflammation and cancer: back to Virchow? Lancet 2001; 357(9255): 539 – 545.
82. Karin M. Nuclear factor-kappaB in cancer development and progression. Nature 2006; 441(7092): 431 – 436.
83. Naugler WE, Karin M. NF-kappaB and cancer-identifying targets and mechanisms. Curr Opin Genet Dev 2008; 18(1): 19 – 26. doi: 10.1016/ j.gde.2008.01.020.
84. Chen H, Shalom-Feuerstein R, Riley J et al. miR-7 and miR-214 are specifically expressed during neuroblastoma differentiation, cortical development and embryonic stem cells differentiation, and control neurite outgrowth in vitro. Biochem Biophys Res Commun 2010; 394(4): 921 – 927. doi: 10.1016/ j.bbrc.2010.03.076.
85. Lovén J, Zinin N, Wahlstrom T et al. MYCN-regulated microRNAs repress estrogen receptor-alpha (ESR1) expression and neuronal differentiation in human neuroblastoma. Proc Natl Acad Sci U S A 2010; 107(4): 1553 – 1558. doi: 10.1073/ pnas.0913517107.
86. Makeyev EV, Zhang J, Carrasco MA et al. The MicroRNA miR-124 promotes neuronal differentiation by triggering brain-specific alternative pre-mRNA splicing. Mol Cell 2007; 27(3): 435 – 448.
87. Evangelisti C, Florian MC, Massimi I et al. MiR-128 up-regulation inhibits Reelin and DCX expression and reduces neuroblastoma cell motility and invasiveness. FASEB J 2009; 23(12): 4276 – 4287. doi: 10.1096/ fj.09-134965.
88. Le MT, Xie H, Zhou B et al. MicroRNA-125b promotes neuronal differentiation in human cells by repressing multiple targets. Mol Cell Biol 2009; 29(19): 5290 – 5305. doi: 10.1128/ MCB.01694-08.
89. Foley NH, Bray IM, Tivnan A et al. MicroRNA-184 inhibits neuroblastoma cell survival through targeting the serine/ threonine kinase AKT2. Mol Cancer 2010; 9 : 83. doi: 10.1186/ 1476-4598-9-83.
90. Khew-Goodall Y, Goodall GJ. Myc-modulated miR-9 makes more metastases. Nat Cell Biol 2010; 12(3): 209 – 211. doi: 10.1038/ ncb0310-209.
91. Welch C, Chen Y, Stallings RL. MicroRNA-34a functions as a potential tumor suppressor by inducing apoptosis in neuroblastoma cells. Oncogene 2007; 26(34): 5017 – 5022.
92. Mestdagh P, Bostrom AK, Impens F et al. The miR-17-92 microRNA cluster regulates multiple components of the TGF-beta pathway in neuroblastoma. Mol Cell 2010; 40(5): 762 – 773. doi: 10.1016/ j.molcel.2010.11.038.
93. Ragusa M, Majorana A, Banelli B et al. MIR152, MIR200B, and MIR338, human positional and functional neuroblastoma candidates, are involved in neuroblast differentiation and apoptosis. J Mol Med (Berl) 2010; 88(10): 1041 – 1053. doi: 10.1007/ s00109-010-0643-0.
94. Tivnan A, Foley NH, Tracey L et al. MicroRNA-184 - mediated inhibition of tumour growth in an orthotopic murine model of neuroblastoma. Anticancer Res 2010; 30(11): 4391 – 4395.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2014 Issue 5-
All articles in this issue
- Pomalidomid v liečbe relabujúceho a refraktérneho mnohopočetného myelómu
- Cereblon – nový terapeutický cieľ v liečbe mnohopočetného myelómu
- Role mikroRNA v patofyziologii neuroblastomu a možnosti jejich využití pro diagnostiku, odhad prognózy a terapii
- Úloha CDK12 v iniciaci a rozvoji nádorů a její klinické konsekvence
- Prognostické markery pokročilého nemalobunkového karcinómu pľúc – hodnotenie významu onkomarkerov pomocou data-miningovej metódy RPA
- Spokojenost onkologických pacientek s okamžitou dvoudobou aloplastickou rekonstrukcí prsu
- Vliv předoperační chemoradioterapie na změnu exprese receptoru pro epidermální růstový faktor u pacientů léčených předoperační chemoradioterapií pro lokálně pokročilý karcinom rekta
- Těm, které by to mohlo zajímat – fotodiagnostika a fotodynamická léčba
- Neobvyklá nádorová infiltrace ušního lalůčku
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prognostické markery pokročilého nemalobunkového karcinómu pľúc – hodnotenie významu onkomarkerov pomocou data-miningovej metódy RPA
- Spokojenost onkologických pacientek s okamžitou dvoudobou aloplastickou rekonstrukcí prsu
- Cereblon – nový terapeutický cieľ v liečbe mnohopočetného myelómu
- Pomalidomid v liečbe relabujúceho a refraktérneho mnohopočetného myelómu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

