-
Medical journals
- Career
Úloha CDK12 v iniciaci a rozvoji nádorů a její klinické konsekvence
: D. Vrábel 1; M. Svoboda 2,3; J. Navrátil 2; J. Kohoutek 1
: Oddělení chemie a toxikologie, Výzkumný ústav veterinárního lékařství, v. v. i., Brno 1; Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 2; Oddělení epidemiologie a genetiky nádorů, Masarykův onkologický ústav, Brno 3
: Klin Onkol 2014; 27(5): 340-346
: Reviews
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2014340Cyklin-dependentní kinázy (CDKs) se účastní celé řady buněčných procesů a zcela zásadní roli zastávají v regulaci buněčného dělení a transkripce. V nedávné době se podařilo identifikovat CDK12 jako důležitý faktor v regulaci transkripce genů BRCA1, ATM, ATR, FANCI a FANCD2 zapojených do odpovědi buňky na poškození DNA. Porucha funkce těchto genů vede ke vzniku genomové nestability, což je jeden z klíčových stavů v procesu kancerogeneze. Z uvedeného postavení CDK12 vyplývají i možné klinické konsekvence, které jsou postupně dokazovány. Jedná se především o zjištění, že v řadě nádorů (např. karcinomy vaječníků, prsu, prostaty, tlustého střeva) dochází v důsledku mutace k poškození funkce nebo snížení exprese CDK12, což může zvýšit citlivost nádoru k cytostatikům způsobujícím poškození DNA (např. platinové deriváty, alkylační látky) a k inhibitorům oprav DNA (např. PARP inhibitory). Tato skutečnost již byla potvrzena na modelu serózního ovariálního karcinomu. CDK12 se tak stává potenciálním terapeutickým cílem léčiv, jejichž úkolem je navodit v nádorových buňkách syntetickou letalitu. Náš přehledový článek přináší poslední informace o významu CDK12 v kancerogenezi a o potenciálních možnostech využití CDK12 pro klinickou praxi.
Klíčová slova:
cyklin-dependentní kináza 12 – mutace – opravy DNA – PARP inhibitor – platinová cytostatikaÚvod
Z pohledu dnešních znalostí již nepohlížíme na nádor jako na prostou masu nekontrolovaně se dělících buněk, ale spíše jej považujeme za unikátní druh tkáně, kde vzájemně interagují různorodé populace nádorových a normálních buněk, jež jsou od počátku součástí mikroprostředí nádoru a postupně utvářejí jeho stroma, a tyto interakce významně ovlivňují celý průběh kancerogeneze a v kauzálním důsledku i chování nádoru k jeho okolí [1 – 3].
Maligní onemocnění představuje složitý komplex celé řady procesů uplatňujících se v průběhu kancerogenze, které ze své podstaty vycházejí z fyziologických buněčných dějů a nádor si je přizpůsobuje k vlastnímu prospěchu. Hanahan a Weinberg jich v roce 2000 popsali šest: soběstačnost v růstových faktorech, rezistence na inhibitory růstu, deregulace a inhibice apoptózy, neomezené buněčné dělení (buněčný cyklus), podpora a udržování angiogeneze a tkáňová invazivita a metastazování [4]. S přibývajícími znalostmi, po více než jednom desetiletí, ti samí autoři rozšířili výše zmíněné procesy o další děje, které jsou v nádorech specificky deregulovány: narušení metabolické rovnováhy v buňce, únik nádorových buněk před specifickou imunitní odpovědí, nádor iniciující zánětlivé procesy a v neposlední řadě mutace a genomová nestabilita [4].
Bylo by velmi odvážné tvrdit, že lze všechny tyto děje seřadit podle důležitosti nebo že jejich výčet je již konečný. Zásadní je, že byly poznány a mohou být využity v prevenci i léčbě nádorů. Náš přehledový článek se zaměřuje na představení nových poznatků, které se dotýkají dvou z těchto dějů, a to procesu neomezeného buněčného dělení a genové nestability, jež v určité fázi využívají stejný typ regulačních proteinů a těmi jsou cyklin-dependentní kinázy (cyclin-dependent kinases – CDKs).
Buněčné dělení a cyklin-dependentní kinázy
Cyklin-dependentní kinázy (CDKs) obecně patří do skupiny proteinkináz, což jsou enzymy uskutečňující přenos fosfátové skupiny z donorové molekuly ATP na konkrétní substrát v procesu označovaném jako fosforylace. Aktivita a specificita CDK je závislá především na jejich přímé asociaci se specifickým vazebným partnerem – cyklinem [5]. V současnosti je v literatuře experimentálně popsáno 21 odlišných CDK, které se podílejí na různých fyziologických procesech v buňce, z nichž dva nejvýznamnější jsou právě proces kontroly buněčného dělení a regulace transkripce. Do první skupiny CDK regulující buněčné dělení lze zahrnout CDK 1, 2, 4, 6 a 7, do druhé skupiny patří CDK 7, 8, 9, 11, 12 a 13 [6 – 9].
Naším cílem je seznámit čtenáře s nedávno objevenou CDK12, která se účastní regulace buněčné transkripce a u které se prokázala zřejmá spojitost s procesem maligní transformace a kancerogeneze [10,11]. Dříve než budeme detailněji diskutovat aspekty funkce CDK12 v procesu kancerogeneze, je vhodné zmínit skutečnost, že transkripční CDK kinázy byly již dříve spojovány s biologií nádoru, z toho CDK9 zaujímá zcela výsadní pozici. Tato CDK, která byla z počátku studována zejm. v souvislosti s regulací replikace viru HIV způsobujícího onemocnění AIDS [12 – 14], byla později identifikována jako zcela klíčový transkripční faktor nezbytný pro aktivitu řady dalších transkripčních faktorů a bona fide onkogenů (NFκB, C-MYC, estrogenový receptor, glukokortikoidový receptor a další), jejichž funkce v procesu kancerogeneze již byla detailně popsána [15 – 18]. Způsob, jakým CDK9 pozitivně reguluje podřízené molekuly, spočívá v její vazbě na daný faktor/ onkogen a následné fosforylaci tzv. C-terminální domény (CTD) RNA polymerázy II (RNAPII), což má za následek efektivnější produkci onkogen-dependentních genů a iniciaci transformace.
I když se mohlo dlouhá léta zdát, že oblast nádorové biologie a transkripčních kináz je již podrobně zmapovaná a nepřinese nové výraznější objevy, v roce 2010 a 2011 vyšly dvě zásadní publikace, které kromě objevu cyklinu K jako nového vazebného partnera CDK12 a CDK13 kináz přesvědčivě prokázaly, že CDK12 je klíčovým faktorem v procesu udržování genomové stability [11,19].
Cyklin-dependentní kináza 12 (CDK12)
CDK12 byla poprvé v literatuře popsaná pod zkratkou CrkRS, která označuje Cdc2 - příbuznou kinázu s oblastmi bohatými na arginin/ serin (RS motivy). Toto označení navrhli Ko et al v roku 2001 na základě její příbuznosti s CDK1, původně známou pod označením Cdc2 [20]. Později byla přejmenována na Cdc2 - příbuznou protein kinázu 7 (CRK7) a poté na CDK12 [21]. Původně se rovněž předpokládalo, že její regulační podjednotkou je cyklin L1, teprve až recentní objev přímé interakce CDK12 s cyklinem K (CycK) u octomilky (Drosophila m.) a člověka vedl k jejímu definitivnímu označení CDK12 [11,19].
Struktura a vlastnosti CDK12
Lidská CDK12 se skládá z 1 490 aminokyselin a její molekulová hmotnost je 164 kDa. Oproti ostatním CDK, jejichž struktura je převážně tvořena dvěma funkčními oblastmi, struktuře CDK12 dominují tři funkční oblasti, a to katalytická nebo také kinázová doména ohraničená N - a C-rameny. Kinázová doména se nachází v centrální části proteinu, je tvořena přibližně 300 aminokyselinami a je zodpovědná za fosforylaci daného substrátu (obr. 1A). Kinázová doména obsahuje v místě PSTAIRE helixu, známého u CDK1 a ostatních příbuzných CDK, PITAIRE sekvenci. Podobně jak je tomu u CDK1, má i ATP vazební doména CDK12 na svém počátku charakteristické treoninové a tyrosinové aminokyselinové zbytky důležité pro její regulaci, ať už pozitivní, či negativní [20]. Druhým dominantním rysem struktury CDK12 jsou dvě ramena ohraničující kinázovou doménu. V nich je možné rozpoznat několik funkčně odlišných oblastí: 1. oblasti bohaté na arginin a serin, tzv. RS motivy, které hrají důležitou roli v sestavování proteinových komplexů a jsou běžné u proteinů potřebných pro sestřih (splicing) pre-mRNA a alternativní sestřih [22 – 24]. Většina – 21 z 22 RS motivů – se nachází na N-ramenu v prvních 400 aminokyselinách (obr. 1A) a jen jeden RS motiv ve zbývající části proteinu [20]; 2. dalšími funkčně významnými strukturními oblastmi jsou tzv. PRM domény, které jsou bohaté na proliny (obr. 1A). Tyto PRM domény mají význam především v protein-proteinové interakci odehrávající se při tvorbě multiproteinových signálních komplexů, a to díky jejich specifické interakci s SH3, WW nebo prolinovými doménami v jiných proteinech [25,26]. (Této skutečnosti bude jistě možné využít při hledání cílených nízkomolekulárních léčiv.) Protein CDK12 je exprimován ve všech tkáních, z toho zvýšená hladina je detekována ve vaječníku, varlatech, plících, štítné žláze a slezině [27].
1. 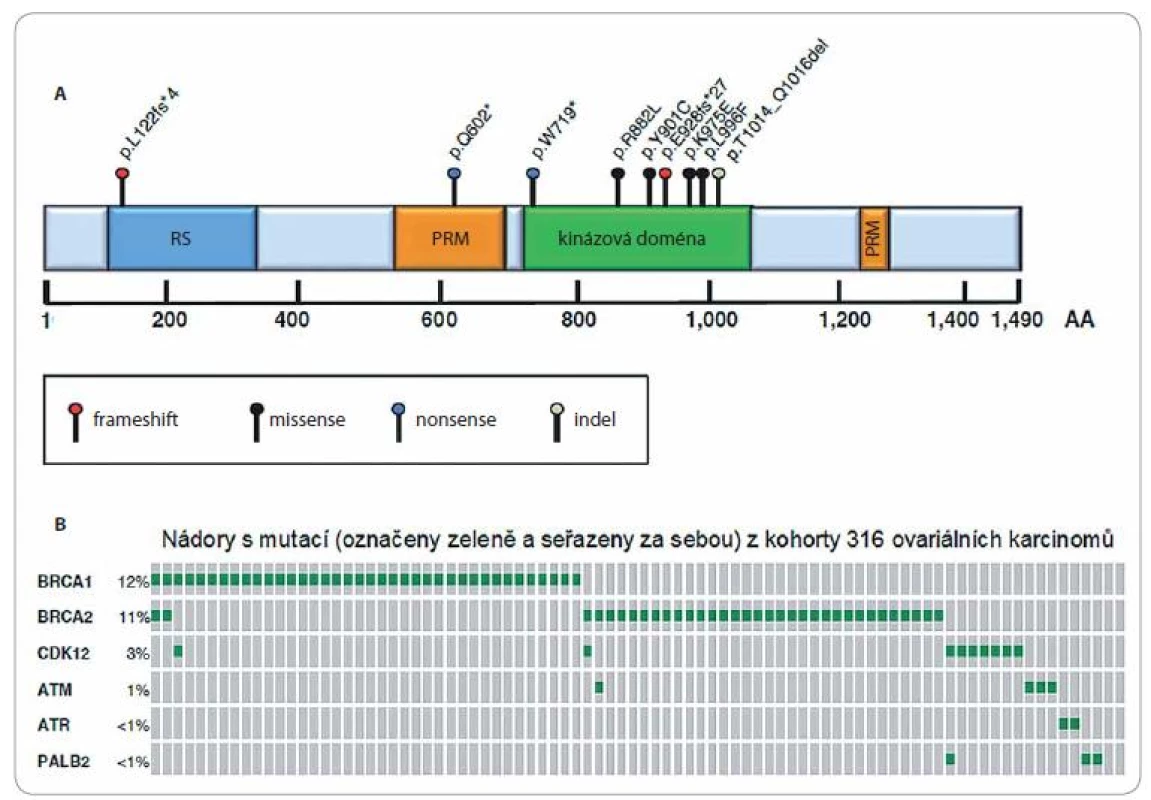
A. Schematická struktura CDK12. RS motiv – oblast bohatá na arginin/serin (RS, modrý obdélník); PRM – oblast bohatá na prolin (PRM, oranžový obdélník); kinázová doména (zelený obdélník). Čísla udávají pozici aminokyselin (AA) vůči zobrazené struktuře. Nad doménami jsou znázorněny alterace vznikající v proteinu CDK12 na základě různých typů mutací identifikovaných v nádorových buňkách high-grade serózního ovariálního karcinomu. Typy mutací jsou uvedeny pod strukturou CDK12. B. Grafické znázornění výskytu mutací v genech BRCA1, BRCA2, CDK12, ATM, ATR a PALB2 v jednotlivých nádorech (šedé proužky se zeleným středem) získaných od pacientek s high-grade serózním ovariálním karcinomem. Analýza byla provedena celkem u 316 nádorů v rámci projektu The Cancer Genome Atlas (TCGA), znázorněny jsou pouze ty případy, ve kterých byla detekována mutace (BRCA1 – 38 případů/12 %; BRCA2 – 34 případů/11 %; CDK12 – 9 případů/3 %; ATM – 4 případy/1 %; ATR – 2 případy/< 1 %; PALB2 – 3 případy/< 1 %). Převzato z [10]. K úpravě a překladu dále viz upozornění na konci článku/see note at the end of the article regarding of translation and picture modification. Funkce CDK12
Jak již bylo uvedeno, CDK12 se podílí na regulaci transkripce. Vlastní proces transkripce je velmi komplexní a přísně regulovaný děj vycházející z fyziologických potřeb organizmu. Sestává se z mnoha dílčích fází, které je možné pro potřeby přehledového článku rozdělit na iniciaci, elongaci a terminaci [28,29]. Každá z výše zmiňovaných fází současně slouží jako kontrolní bod v regulaci transkripce zprostředkované aktivitou RNAPII.
Pro savčí RNAPII je typická přítomnost tzv. CTD domény, která obsahuje 52krát opakující se heptapeptidový motiv Y1S2P3T4S5P6S7 [30,31]. V průběhu transkripce dochází k sekvenční fosforylaci jednotlivých serinů, treoninů a tyrozinů nacházejících se v CTD doméně, což funkčně koreluje s příslušnou fází transkripce nebo s přechodem mezi jednotlivými fázemi [32,33]. A právě CDK12 specificky fosforyluje v CTD doméně RNAPII serin v pozici 2 (Y1S2P3T4S5P6S7) a tím umožňuje přechod transkripce z iniciační do elongační fáze [11,19].
Zajímavou skutečností je ovšem fakt, že CDK12 se nechová jako globální regulátor transkripce, podobně jako je tomu v případě CDK9, která v CTD doméně RNAPII fosforyluje stejné místo. Jak dokazují provedené experimenty, inhibice aktivity CDK12 má za následek snížení exprese pouze malé skupiny genů bez výrazného efektu na transkripci jako celek [11,19,32,34,35]. Z pohledu kancerogeneze je velmi důležitým zjištění, že onou specifickou skupinou CDK12 regulovaných genů jsou právě geny účastnící se, kromě jiného, odpovědi buňky na poškození DNA (damage response/ repair pathway – DDR): BRCA1, ATM, ATR, FANCI a FANCD2. U všech těchto genů bylo prokázáno, že porucha jejich funkce vede ke vzniku genové nestability a tímto způsobem se uplatňují v procesu vzniku a rozvoje nádorů (obr. 2) [7,36].
2. Vliv deregulace CDK12 na proces iniciace a rozvoje nádoru. 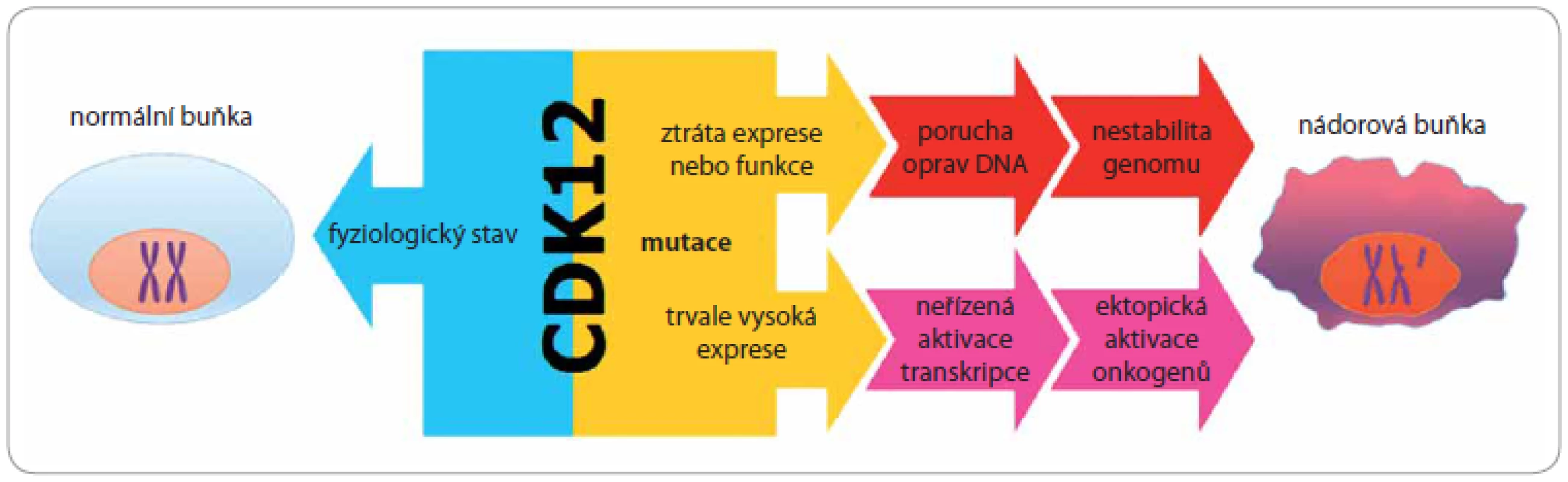
Je-li fyziologická aktivita CDK12 narušena vlivem de novo mutací, může na straně jedné dojít ke snížení její exprese nebo ke ztrátě funkce, což má za následek narušení transkripce genů zapojených v procesu odpovědi buňky na poškození DNA (DNA damage response – DDR). Na straně druhé může nastat i neřízené zvýšení exprese CDK12, které způsobí nespecifické spuštění elongační fáze transkripce, což v konečném důsledku vede k aktivaci genů obecně nezbytných pro rozvoj nádorů, včetně protonkogenů. Tento mechanizmus však dosud nebyl potvrzen. Mimo již popsané aktivity v procesu odpovědi buňky na poškození DNA reguluje CDK12, podobně jako CDK9, přechod z iniciační do elongační fáze transkripce. Právě kontrola přechodu mezi iniciační a elongační fází transkripce je v nádorech často narušena, a to nejen zvýšenou aktivitou elongační fáze, jako je tomu např. u různých typů leukemií, ale především ektopickou aktivací protoonkogenů a bona fide onkogenů, jakými jsou JUN, TIF1γ, c-FOS [37 – 44]. Zcela bezprecedentní ukázkou, jak významnou roli hraje elongační fáze v rozvoji nádoru, je mechanizmus účinku onkogenu c-MYC. Hladina různých forem onkogenu MYC je významně zvýšena u celé řady nádorových onemocnění, přitom detailní analýzy jednoznačně nevedly k identifikaci c-MYC-dependentních genů, které jsou klíčové pro další vývoj nádoru. Richard Young a jeho tým zjistili, že zvýšení hladiny c-MYC proteinu ve většině nádorů má za následek nespecifické spuštění elongační fáze transkripce, což v konečném důsledku vede k aktivaci genů obecně nezbytných pro rozvoj nádorů, ovšem v případě konkrétního nádoru se vždy jedná o geny specifické výhradně pro tento nádor [45]. Podobně jako c-MYC, také CDK12 reguluje přechod z iniciační fáze do fáze elongační, a proto je odůvodněné se domnívat, že deregulace aktivity CDK12 může mít dramatický dopad na transkripci genů, které se přímo podílejí na iniciaci a rozvoji konkrétního nádoru (obr. 2). Tato hypotéza však dosud nebyla experimentálně potvrzena. V případě, že se tak v budoucnu stane, mohla by CDK12 v závislosti na dalších molekulárních změnách nabývat v kontextu jednotlivých nádorů funkce nejen primárně nádorového supresoru, ale i protoonkogenu.
Klinické aspekty CDK12
Výsledky výzkumu z posledních let ukazují, že poškození funkce CDK12 může významně narušit proces oprav DNA formou homologní rekombinace, a tím i udržování genomové stability. Primárně se tak děje v důsledku bodových nebo frameshift mutací či nukleotidových záměn, které jsou nejčastěji lokalizovány v kinázové doméně (2/ 3 mutací) a ve většině případů vedou ke ztrátě kinázové aktivity CDK12 a ke snížení exprese genů, které se procesu homologní rekombinace přímo účastní, jako např. BRCA1 a BRCA2 (nepublikovaná data, obr. 1B) [46]. Kromě těchto mutací může ke ztrátě kinázové aktivity CDK12 dojít i při vzniku fúzního proteinu CDK12 - ERBB2 (CDK12 - HER2), který byl popsán u karcinomů prsu a žaludku nesoucích amplifikaci HER2/ neu genu. Oba geny se nacházejí na chromozomu 17 [41,42,47] a při strukturálních změnách na tomto chromozomu může dojít k deleci části exonu 13CDK12 a k jeho přiřazení k intronu 4HER2/ neu genu. Mutace, které vznikají v RS nebo PRM motivech (1/ 3 mutací), se v kancerogenezi uplatňují spíše odlišným způsobem, a to zejm. narušením procesu sestřihu pre-mRNA/ /mRNA [22 – 24]. Následný chybný sestřih změní poměry jednotlivých mRNA postižených genů, což napomáhá v rozvoji daného onemocnění [48]. Kromě toho bylo prokázáno, že snížená hladina CDK12 v buňkách vede k nesprávnému sestavení subjaderných rekombinačních komplexů obsahujících RAD51, a tím opět k problémům s homologní rekombinací [46].
Z klinické praxe již máme důkazy o tom, že je-li v nádorové buňce nefunkční proces oprav DNA, lze toho terapeuticky dobře využít. Porucha funkce genů BRCA1 a BRCA2, ať již navozená mutací, nebo epigenetickými změnami, predikuje u pacientek s karcinomem prsu nebo ovarií zvýšenou pravděpodobnost odpovědi nádoru na deriváty platiny a inhibitory poly(ADP-riboso)polymerázy (PARP inhibitory) [49,50]. Cytostatika na bázi platiny poškozují DNA alkylací, přitom vznikají vnitro - a meziřetězcové kovalentní spoje vedoucí k zásadní změně konformace molekuly DNA, v důsledku které dochází k zástavě replikace i transkripce. Oprava takto poškozených míst probíhá procesem excize nukleotidů (nucleotide excision repair – NER). PARP1 je enzym uplatňující se v procesu oprav jednořetězcových zlomů DNA (single-strand breaks – SSB) mechanizmem excize bází (base excision repair – BER). Pokud jsou výše popsané opravné mechanizmy zablokovány, dochází ke kumulaci SSB a v případě, že buňka vstoupí do buněčného cyklu, není schopna replikace DNA a v místě SSB vznikají dvouřetězcové zlomy (double-strand break – DSB). Je-li současně nefunkční BRCA1 nebo BRCA2, nelze DSB efektivně opravit, buněčný genom se stává nestabilním a v důsledku těchto závažných poruch se spouští apoptóza nádorové buňky [51].
V kontextu těchto informací se jeví jako velmi zajímavá zjištění o CDK12 kináze publikovaná v roce 2014. Dva autorské týmy nezávisle na sobě potvrdily relativně vysoký výskyt somatických mutací v high-grade serózních ovariálních karcinomech a výrazně zvýšenou citlivost těchto nádorů k cisplatině, melfalanu a k dvěma PARP inhibitorům veliparibu a olaparibu [46]. Z uvedených prací rovněž plyne, že v případě ovariálního karcinomu, u kterého je porucha homologní rekombinace identifikována až u 50 % případů, přičemž pouze 20 % případů lze vysvětlit přítomností patogenní mutace v BRCA genech, může být další významnou příčinou tohoto stavu právě mutace v CDK12 [46]. Bajrami et al naproti tomu vycházeli z genomové analýzy 316 high-grade serózních ovariálních karcinomů, která byla provedena v rámci projektu „The Cancer Genome Atlas“ (TCGA), a zjistili výskyt mutace v BRCA1 genu ve 12 %, BRCA2 genu v 11 %, CDK12 ve 3 %, ATR, ATM a PALB1 v 1 % případů (obr. 1B) [10]. Přitom mutace CDK12 téměř exkluzivně vylučovala současný nález mutace v BRCA1 nebo BRCA2 genech. Provedli proto dodatečnou analýzu exprese CDK12 (mRNA) ve vzorcích uvedených nádorů, jež pocházely od pacientek léčených chemoterapií s platinovým derivátem, a potvrdili téměř dvojnásobné celkové přežití (overall survival – OS) u těch, jejichž tumory měly nízkou expresi CDK12 (HR = 0,55, p = 0,0076) (graf 1A). Při experimentech s xenografty high-grade serózních ovariálních karcinomů vedla uměle navozená ztráta exprese CDK12 ke zvýšené citlivosti těchto nádorů vůči PARP inhibitoru olaparibu (graf 1B). CDK12 se tak jeví jako slibný prediktor odpovědi na léčbu platinovými deriváty a PARP inhibitory [46].
1. CDK12 a in vivo odpověď na léčbu. 
A. Kaplan-Meierova křivka závislosti celkového přežití (overall survival – OS) na nádorové expresi CDK12 mRNA (nízká/low vs vysoká/high) u 316 pacientek s high-grade ovariálním karcinomem II.–IV. klinického stadia, které byly léčené chemoterapií s platinovým cytostatikem (p = 0,0076, log-rank test). Analýza byla provedena celkem u 316 nádorů zařazených do projektu The Cancer Genome Atlas (TCGA). B. Grafické znázornění vývoje velikosti tumoru u pokusných myší v jednotlivých dnech od zahájení experimentu. Myším byly implantovány xenografty nádorové linie serózního ovariálního karcinomu OV90, ve kterých byla pomocí CDK12 shRNA (shCDK12) zcela vyblokována exprese CDK12. Byly vytvořeny dvě skupiny myší (po 10), první byla aplikována kontrolní látka (shCDK12 vehicle), druhé PARP-inhibitor olaparib (shCDK12 olaparib). V jednotlivých dnech experimentu byla měřena velikost nádoru a poměr aktuální velikosti a počáteční velikosti a směrodatné odchylky pro všechny experimenty jsou vyneseny do grafu. Výsledná křivka znázorňuje vývoj tohoto poměru v závislosti na léčbě a čase. Ztráta exprese CDK12 způsobovala citlivost nádorů k olaparibu. Převzato z [10]. K úpravě a překladu dále viz upozornění na konci článku/see note at the end of the article regarding of translation and picture modification. Závěr
Na základě dosavadních poznatků je tedy možné na CDK12 primárně pohlížet jako na potenciální tumorový supresor, jehož poškození může vést k poruchám replikace DNA a transkripce RNA a tím přispět k procesu kancerogeneze. Stanovení mutačního stavu nebo exprese CDK12 genu může mít v klinické praxi zcela zásadní význam, neboť snížení exprese nebo poškození funkce CDK12 predikuje zvýšenou citlivost k protinádorové léčbě způsobující ve svém důsledku poškození DNA (např. platinové deriváty, alkylační látky, PARP inhibitory). Zvýšená exprese funkčního proteinu může mít za specifických podmínek účinek právě opačný. S ohledem na svoji funkci se CDK12 stává rovněž významným terapeutickým cílem léčiv způsobujících v nádorových buňkách syntetickou letalitu. Vzhledem k tomu, že CDK12 reguluje expresi hned několika genů účastnících se oprav poškozené DNA, lze předpokládat, že anti-CDK12 cílená léčba může být efektivnější, než je tomu např. u PARP inhibitorů. Nicméně výzkum v této oblasti je teprve na počátku.
Poznámka k převzatým obrázkům / Comment on translation and picture modification
Převzaté obrázky pro tento článek byly pozměněny, včetně překladu nadpisů a komentářů. Za tyto změny nakladatel časopisu Cancer Research, společnost AACR, nenese zodpovědnost.
Translations of any AACR materials into languages other than English are intended solely as a convenience to the non-English-reading public. Translation accuracy is neither guaranteed nor implied. If any questions arise related to the accuracy of the information contained in the translation, please refer to the English version of the AACR journal that is the Cancer Res 2014; 74(1): 287 – 297.
Práce byla podpořena grantem IGA MZ ČR č. NT14599-3, rozvojovým projektem organizace MZe č. MZE-00027162/02 : 2 a prostředky institucionální podpory výzkumné organizace MOÚ poskytnuté MZ ČR v roce 2014 č. MOÚ, 00209805.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Jiří Kohoutek, Ph.D.
Oddělení chemie a toxikologie
Výzkumný ústav veterinárního lékařství, v.v.i.
Hudcova 296/70
621 00 Brno
e-mail: kohoutek@vri.cz
Obdrženo: 15. 9. 2014
Přijato: 25. 9. 2014
Sources
1. Albini A, Sporn MB. The tumour microenvironment as a target for chemoprevention. Nat Rev Cancer 2007; 7(2): 139 – 147.
2. Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 2011; 144(5): 646 – 674. doi: 10.1016/ j.cell.2011.02.013.
3. Swartz MA, Iida N, Roberts EW et al. Tumor microenvironment complexity: emerging roles in cancer therapy. Cancer Res 2012; 72(10): 2473 – 2480. doi: 10.1158/ 0008-5472.CAN-12-0122.
4. Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100(1): 57 – 70.
5. Malumbres M, Harlow E, Hunt T et al. Cyclin-dependent kinases: a family portrait. Nat Cell Biol 2009; 11(11): 1275 – 1276. doi: 10.1038/ ncb1109-1275.
6. Buratowski S. Progression through the RNA polymerase IICTD cycle. Mol Cell 2009; 36(4): 541 – 546. doi: 10.1016/ j.molcel.2009.10.019.
7. Kohoutek J, Blazek D. Cyclin K goes with Cdk12 and Cdk13. Cell Div 2012; 7 : 12. doi: 10.1186/ 1747-1028-7-12.
8. Loyer P, Trembley JH, Katona R et al. Role of CDK/ cyclin complexes in transcription and RNA splicing. Cell Signal 2005; 17(9): 1033 – 1051.
9. Satyanarayana A, Kaldis P. Mammalian cell-cycle regulation: several Cdks, numerous cyclins and diverse compensatory mechanisms. Oncogene 2009; 28(33): 2925 – 2939. doi: 10.1038/ onc.2009.170.
10. Bajrami I, Frankum JR, Konde A et al. Genome-wide profiling of genetic synthetic lethality identifies CDK12 as a novel determinant of PARP1/ 2 inhibitor sensitivity. Cancer Res 2014; 74(1): 287 – 297. doi: 10.1158/ 0008-5472.CAN-13-2541.
11. Blazek D, Kohoutek J, Bartholomeeusen K et al. The Cyclin K/ Cdk12 complex maintains genomic stability via regulation of expression of DNA damage response genes. Genes Dev 2011; 25(20): 2158 – 2172.
12. Ott M, Geyer M, Zhou Q. The control of HIV transcription: keeping RNA polymerase II on track. Cell Host Microbe 2011; 10(5): 426 – 435. doi: 10.1016/ j.chom.2011.11.002.
13. Wang S, Fischer PM. Cyclin-dependent kinase 9: a key transcriptional regulator and potential drug target in oncology, virology and cardiology. Trends Pharmacol Sci 2008; 29(6): 302 – 313. doi: 10.1016/ j.tips.2008.03.003.
14. Zhou Q, Yik JH. The Yin and Yang of P-TEFb regulation: implications for human immunodeficiency virus gene expression and global control of cell growth and differentiation. Microbiol Mol Biol Rev 2006; 70(3): 646 – 659.
15. Barboric M, Nissen RM, Kanazawa S et al. NF-kappaB binds P-TEFb to stimulate transcriptional elongation by RNA polymerase II. Mol Cell 2001; 8(2): 327 – 337.
16. Kanazawa S, Soucek L, Evan G et al. c-Myc recruits P-TEFb for transcription, cellular proliferation and apoptosis. Oncogene 2003; 22(36): 5707 – 5711.
17. Wittmann BM, Fujinaga K, Deng H et al. The breast cell growth inhibitor, estrogen down regulated gene 1, modulates a novel functional interaction between estrogen receptor alpha and transcriptional elongation factor cyclin T1. Oncogene 2005; 24(36): 5576 – 5588.
18. Zhu R, Lu X, Pradhan M et al. A kinase-independent activity of Cdk9 modulates glucocorticoid receptor-mediated gene induction. Biochemistry 2014; 53(11): 1753 – 1767. doi: 10.1021/ bi5000178.
19. Bartkowiak B, Liu P, Phatnani HP et al. CDK12 is a transcription elongation-associated CTD kinase, the metazoan ortholog of yeast Ctk1. Genes Dev 2010; 24(20): 2303 – 2316. doi: 10.1101/ gad.1968210.
20. Ko TK, Kelly E, Pines J. CrkRS: a novel conserved Cdc2-related protein kinase that colocalises with SC35 speckles. J Cell Sci 2001; 114(14): 2591 – 2603.
21. Iorns E, Martens-de Kemp SR, Lord CJ et al. CRK7 modifies the MAPK pathway and influences the response to endocrine therapy. Carcinogenesis 2009; 30(10): 1696 – 1701. doi: 10.1093/ carcin/ bgp187.
22. Hertel KJ, Graveley BR. RS domains contact the pre-mRNA throughout spliceosome assembly. Trends Biochem Sci 2005; 30(3): 115 – 118.
23. Long JC, Caceres JF. The SR protein family of splicing factors: master regulators of gene expression. Biochem J 2009; 417(1): 15 – 27. doi: 10.1042/ BJ20081501.
24. Valcarcel J, Green MR. The SR protein family: pleiotropic functions in pre-mRNA splicing. Trends Biochem Sci 1996; 21(8): 296 – 301.
25. Zarrinpar A, Bhattacharyya RP, Lim WA. The structure and function of proline recognition domains. Sci STKE 2003; 2003(179): RE8.
26. Ball LJ, Kuhne R, Schneider-Mergener J et al. Recognition of proline-rich motifs by protein-protein-interaction domains. Angew Chem Int Ed Engl 2005; 44(19): 2852 – 2869.
27. Uhlen M, Oksvold P, Fagerberg L et al. Towards a knowledge-based Human Protein Atlas. Nat Biotechnol 2010; 28(12): 1248 – 1250. doi: 10.1038/ nbt1210-1248.
28. Fuda NJ, Ardehali MB, Lis JT. Defining mechanisms that regulate RNA polymerase II transcription in vivo. Nature 2009; 461(7261): 186 – 192. doi: 10.1038/ nature08449.
29. Sims RJ 3rd, Belotserkovskaya R, Reinberg D. Elongation by RNA polymerase II: the short and long of it. Genes De 2004; 18(20): 2437 – 2468.
30. Egloff S, Murphy S. Cracking the RNA polymerase IICTD code. Trends Genet 2008; 24(6): 280 – 288. doi: 10.1016/ j.tig.2008.03.008.
31. Phatnani HP, Greenleaf AL. Phosphorylation and functions of the RNA polymerase II CTD. Genes Dev 2006; 20(21): 2922 – 2936.
32. Kohoutek J. P-TEFb - the final frontier. Cell Div 2009; 4 : 19. doi: 10.1186/ 1747-1028-4-19.
33. Peterlin BM, Price DH. Controlling the elongation phase of transcription with P-TEFb. Mol Cell 2006; 23(3): 297 – 305.
34. Chao SH, Price DH. Flavopiridol inactivates P-TEFb and blocks most RNA polymerase II transcription in vivo. J Biol Chem 2001; 276(34): 31793 – 31799.
35. Wang Q, Young TM, Mathews MB et al. Developmental regulators containing the I-mfa domain interact with T cyclins and Tat and modulate transcription. J Mol Biol 2007; 367(3): 630 – 646.
36. Blazek D. The cyclin K/ Cdk12 complex: an emerging new player in the maintenance of genome stability. Cell Cycle 2012; 11(6): 1049 – 1050. doi: 10.4161/ cc.11.6.19678.
37. Bai X, Trowbridge JJ, Riley E, et al. TiF1 – gamma plays an essential role in murine hematopoiesis and regulates transcriptional elongation of erythroid genes. Dev Biol 2013; 373(2): 422 – 430. doi: 10.1016/ j.ydbio.2012.10.008.
38. Emanuel PD. Juvenile myelomonocytic leukemia and chronic myelomonocytic leukemia. Leukemia 2008; 22(7): 1335 – 1342. doi: 10.1038/ leu.2008.162.
39. Fort P, Rech J, Vie A et al. Regulation of c-fos gene expression in hamster fibroblasts: initiation and elongation of transcription and mRNA degradation. Nucleic Acids Res 1987; 15(14): 5657 – 5667.
40. Krumm A, Meulia T, Brunvand M et al. The block to transcriptional elongation within the human c-myc gene is determined in the promoter-proximal region. Genes Dev 1992; 6(11): 2201 – 2213.
41. Lin C, Smith ER, Takahashi H et al. AFF4, a component of the ELL/ P-TEFb elongation complex and a shared subunit of MLL chimeras, can link transcription elongation to leukemia. Mol Cell 2010; 37(3): 429 – 437. doi: 10.1016/ j.molcel.2010.01.026.
42. Mohan M, Lin C, Guest E et al. Licensed to elongate: a molecular mechanism for MLL-based leukaemogenesis. Nat Rev Cancer 2010; 10(10): 721 – 728. doi: 10.1038/ nrc2915.
43. Rougvie AE, Lis JT. The RNA polymerase II molecule at the 5‘ end of the uninduced hsp70 gene of D. melanogaster is transcriptionally engaged. Cell 1988; 54(6): 795 – 804.
44. Shilatifard A, Conaway RC, Conaway JW. The RNA polymerase II elongation complex. Annu Rev Biochem 2003; 72 : 693 – 715.
45. Rahl PB, Lin CY, Seila AC et al. c-Myc regulates transcriptional pause release. Cell 2010; 141(3): 432 – 445. doi: 10.1016/ j.cell.2010.03.030.
46. Joshi PM, Sutor SL, Huntoon CJ et al. Ovarian cancer-associated mutations disable catalytic activity of CDK12, a kinase that promotes homologous recombination repair and resistance to cisplatin and poly(ADP-ribose) polymerase inhibitors. J Biol Chem 2014; 289(13): 9247 – 9253. doi: 10.1074/ jbc.M114.551143.
47. Zang ZJ, Ong CK, Cutcutache I et al. Genetic and structural variation in the gastric cancer kinome revealed through targeted deep sequencing. Cancer Res 2011; 71(1): 29 – 39. doi: 10.1158/ 0008-5472.CAN-10 - 1749.
48. Nissim-Rafinia M, Kerem B. Splicing regulation as a potential genetic modifier. Trends Genet 2002; 18(3): 123 – 127.
49. Ledermann J, Harter P, Gourley C et al. Olaparib maintenance therapy in patients with platinum-sensitive relapsed serous ovarian cancer: a preplanned retrospective analysis of outcomes by BRCA status in a randomised phase 2 trial. Lancet Oncol 2014; 15(8): 852 – 861. doi: 10.1016/ S1470-2045(14)70228-1.
50. Silver DP, Richardson AL, Eklund AC et al. Efficacy of neoadjuvant Cisplatin in triple-negative breast cancer. J Clin Oncol 2010; 28(7): 1145 – 1153. doi: 10.1200/ JCO.2009.22.4725.
51. Svoboda M, Slabý O, Foretová L. Molekulární genetika a individualizovaný přístup v onkoloii. In: Foretová L, Svoboda M, Slabý O (eds). Molekulární genetika v onkologii. 1. vyd. Mladá fronta. In press 2014.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2014 Issue 5-
All articles in this issue
- Pomalidomide in the Treatment of Relapsed and Refractory Multiple Myeloma
- Cereblon – a New Target of Therapy in the Treatment of Multiple Myeloma
- The Role of MicroRNAs in the Pathophysiology of Neuroblastoma and Their Possible Use in Diagnosis, Prognosis and Therapy
- Function of CDK12 in Tumor Initiation and Progression and Its Clinical Consequences
- Prognostic Markers of Advanced Non-small Cell Lung Carcinoma – Assessing the Significance of Oncomarkers Using Data-mining Techiques RPA
- Breast Cancer Patient Satisfaction with Immediate Two-stage Implant-based Breast Reconstruction
- Influence of Preoperative Chemoradiotherapy on Changes of Epidermal Growth Factor Receptor Expression in Patients Treated by Preoperative Chemoradiotherapy for Local Advanced Rectal Carcinoma
- To Whom it May Concern – Photodiagnosis and Photodynamic Therapy
- A Rare Neoplastic Growth on the Ear Lobe
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prognostic Markers of Advanced Non-small Cell Lung Carcinoma – Assessing the Significance of Oncomarkers Using Data-mining Techiques RPA
- Breast Cancer Patient Satisfaction with Immediate Two-stage Implant-based Breast Reconstruction
- Cereblon – a New Target of Therapy in the Treatment of Multiple Myeloma
- Pomalidomide in the Treatment of Relapsed and Refractory Multiple Myeloma
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

