-
Medical journals
- Career
Cereblon – nový terapeutický cieľ v liečbe mnohopočetného myelómu
: M. Staňková 1; L. Bešše 1,2; L. Sedlaříková 1,2; D. Vrábel 1; R. Hájek 1,2; S. Ševčíková 1,2
: Babákova myelomová skupina, Ústav patologické fyziologie, LF MU, Brno 1; Oddělení klinické hematologie, FN Brno 2
: Klin Onkol 2014; 27(5): 326-330
: Reviews
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amko2014326Liečba mnohopočetného myelómu (multiple myeloma – MM), v súčasnosti nevyliečiteľného ochorenia, sa zameriava na dosiahnutie kompletnej remisie. Jednou skupinou liekov, ktorá je v tomto ohľade pomerne efektívna, sú imunomodulačné lieky (immunomodulatory drugs – IMiDs) ako napr. talidomid. Mechanizmus ich účinku však nie je doposiaľ úplne jasný. Posledné výskumy naznačujú, že dôležitú úlohu v sprostredkovaní protinádorových účinkov IMiDs zohráva proteín cereblon (CRBN), na ktorý sa v tomto prehľadovom článku zameriavame. Tento proteín má funkciu substrátového receptoru v Cul4 - E3 ubikvitín-proteín ligázovom komplexe, a teda rozpoznáva proteíny určené k degradácií. Väzbou CRBN a IMiDs sa inhibuje funkcia celého ubikvitín-proteazómového komplexu, čo vysvetľuje ich protinádorové účinky. Okrem toho bola potvrdená aj korelácia medzi expresiou génu CRBN a efektivitou liečby u MM pacientov liečených IMiDs. Tieto poznatky naznačujú, že expresia CRBN by mohla slúžiť ako biomarker pre predikciu odpovedi na liečbu pomocou IMiDs u pacientov s MM.
Kľúčové slová:
cereblon – mnohopočetný myelóm – imunomodulačné liekyÚvod
Mnohopočetný myelóm (multiple myeloma – MM) je nádorové ochorenie plazmatických buniek (PB), ktoré svetová zdravotnícka organizácia (WHO) radí medzi B lymfoproliferatívne neoplazmy [1]. Vyznačuje sa proliferáciou malígnych PB a produkciou monoklonálneho imunoglobulínu (M-Ig) zapríčiňujúceho klinickú manifestáciu ochorenia [2]. Ide o druhé najčastejšie zhubné hematologické ochorenie, ktoré je zatiaľ nevyliečiteľné. So zavedením moderných liečebných postupov a zlepšením včasnej diagnostiky sa však výrazne zvýšila doba prežitia pacientov trpiacich týmto ochorením. Cieľom liečby je dosiahnutie kompletnej remisie a eliminácia klinických príznakov. U väčšiny pacientov stále dochádza k relapsu ochorenia [3].
V súčasnosti sú jednou z možností efektívnej liečby imunomodulačné lieky (immunomodulatory drugs – IMiDs), kde patrí talidomid a jeho deriváty – lenalidomid a pomalidomid. Tieto lieky dokázali svoj účinok nielen priamo proti nádorovým bunkám indukciou apoptózy, ale aj nepriamo, kedy ovplyvňujú interakcie myelómových buniek s mikroprostredím kostnej drene, účinkujú proti novotvorbe ciev, proti zápalu a podporujú účinnosť imunitného systému (zhrnuté v [4]).
Pre možnosť vytvorenia čo najefektívnejších a cielených liekov je nutné pochopiť presný mechanizmus ich účinku v bunke. Prielomom bolo identifikovanie cereblonu (CRBN) ako primárneho cieľa IMiDs v myelómových bunkách [5]. Po tomto objave sa CRBN stal záujmom mnohých štúdií kvôli objasneniu protimyelómovej aktivity IMiDs.
CRBN sa okrem iného vyskytuje v bunke ako súčasť ubikvitinizačného komplexu, ktorý má za úlohu označovať proteíny určené k degradácii polyubikvitínovým reťazcom [6,7]. Pri bližších štúdiách CRBN bola zistená výrazná korelácia medzi hladinou expresie génu CRBN a odpoveďou nádorových pacientov na liečbu IMiDs [8 – 10]. Pre sprostredkovanie protimyelómovej aktivity IMiDs je nutná väzba na CRBN. Toto zistenie posunulo CRBN na pozíciu možného farmakodynamického biomarkeru, ktorý by v budúcnosti mohol slúžiť ako prediktívny marker pre úspešnosť liečby MM.
Cereblon
CRBN je proteín o veľkosti 55 kDa, ktorý je kódovaný génom CRBN [11]. U človeka je gén CRBN lokalizovaný na chromozóme 3 (3p26.2) [12], obsahuje 11 predikovaných exónov a kóduje 442 aminokyselín (AMK), pričom pre väzbu talidomidu na CRBN sú nevyhnuté aminokyselinové zvyšky – tyrozín na pozícii 384 a tryptofán na pozícii 386 (obr. 1) [5]. CRBN obsahuje N-terminálnu časť (237 AMK 81 – 317) ATP - dependentnej Lon proteázovej domény, ktorá hrá úlohu v proteín-proteínových interakciách, ale nemá proteázovú ani ATP-ázovú aktivitu [13].
1. Štruktúra proteínu CRBN. 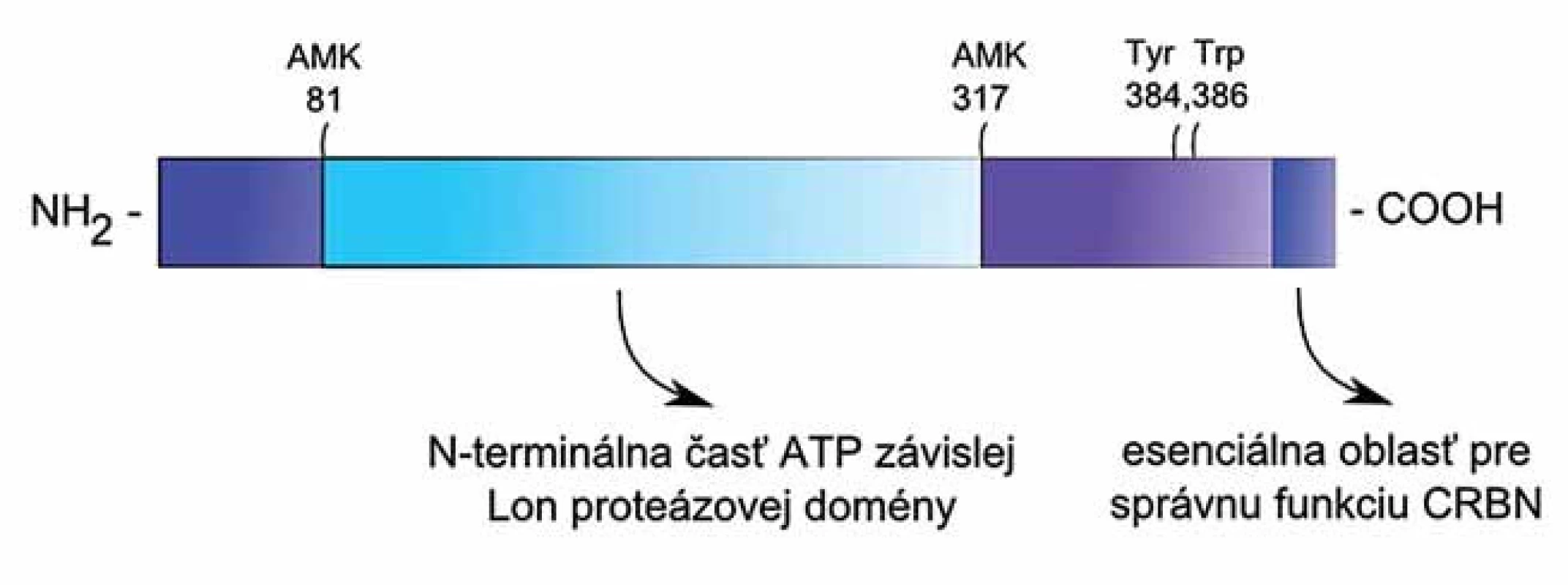
Proteín CRBN tvorí 442 aminokyselín, pričom pre väzbu talidomidu na CRBN sú nevyhnuté tyrozín na pozícii 384 a tryptofán na pozícii 386. CRBN navyše obsahuje N-terminálnu časť ATP-dependentnej Lon proteázovej domény. Fyziologicky je CRBN vysoko exprimovaný v semenníkoch, slezine, prostate, pečeni, podžalúdkovej žľaze, placente, obličkách, pľúcach, kostrových svaloch, vaječníkoch, tenkom čreve, periférnych leukocytoch, hrubom čreve, mozgu a sietnici [11,14 – 17]. V bunke je lokalizovaný v cytoplazme, jadre a bunkovej membráne [5,11,15 – 18]. Po prvýkrát bol CRBN opísaný v roku 2004 v súvislosti s mentálnou retardáciou [13]. Neskoršie experimenty ukázali, že CRBN má v organizme viacero funkcií. Viaže sa na cytosolický C-terminálny koniec napäťovo-vrátkovaných chloridových kanálov – CIC-1 a CIC-2 a na α-podjednotku C-terminálneho konca draslíkového kanálu, ktorý je aktivovaný vápenatými iónmi (BKCa) [11,16]. Ďalej interaguje s α1 podjednotkou AMP-aktivovanej proteín kinázy a zabraňuje tak sformovaniu funkčného holoenzýmu [19]. Jednou z najvýznamnejších funkcií, z terapeutického hľadiska, je schopnosť CRBN viazať IMiDs a sprostredkovať ich protinádorový efekt [5].
Súčasné dáta naznačujú, že CRBN spoločne s DDB1 (DNA-damage binding protein 1) sú podjednotkami Cul4 - E3 ubikvitín-ligázového komplexu. Tento proteínový komplex je zložený z DDB1, Cul4 (Cul4a a Cul4b), Roc1 a substrátového receptoru [6,7]. E3 ubikvitín-ligázový komplex slúži k degradácii proteínov, ktoré sú označené polyubikvitínovým reťazcom a sú určené k odstráneniu. Samotná ubikvitinizácia prebieha v troch krokoch, ktoré sú katalyzované aktivačným enzýmom E1,konjugačným enzýmom E2 a ligázou E3 [20]. Roc1 a Cul4 tvoria katalytické jadro a interagujú s E2 konjugačným enzýmom. DDB1 umožňuje spojenie medzi Cul4 a substrátovým receptorom.
Štúdia Ito et al (2010) potvrdzuje, že CRBN je podjednotkou Cul4 - E3 ubikvitín-ligázového komplexu a súťaží s DDB2 (DNA - damage binding protein 2) o väzbu na DDB1. Okrem toho sa zistilo, že komplex vykazuje autoubikvitinizačnú aktivitu. Predpokladá sa, že CRBN funguje ako substrátový receptor, a teda práve CRBN rozpoznáva proteíny, ktoré majú byť v bunke degradované. Súčasťou štúdie bolo aj zistenie, že autoubikvitinizačná aktivita bola inhibovaná po pridaní talidomidu in vitro, čo naznačuje, že talidomid pôsobí ako inhibítor na E3 ubikvitín-ligázový komplex (obr. 2) [5].
2. Talidomid inhibuje aktivitu CRBN E3 ubikvitínového komplexu, to môže spôsobiť až teratogenézu. 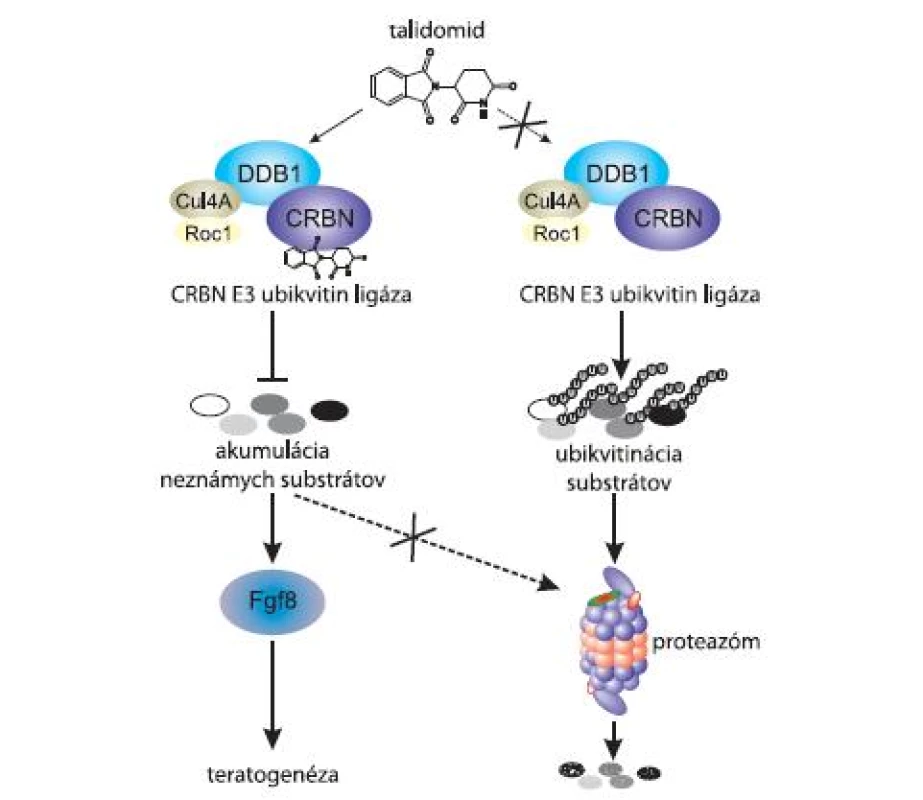
Cereblon a mnohopočetný myelóm
Pôsobenie talidomidu bolo skúmané viac ako pol storočia, pričom bolo vyslovených viac ako 30 možných hypotéz. Úplný mechanizmus pôsobenia nie je popísaný dodnes, avšak prielomom bolo identifikovanie molekuly viažucej talidomid.
Ito et al (2010) pomocou magnetickej separácie a afinitnej purifikácie izolovali proteíny viažuce sa na talidomid z rôznych bunkových extraktov. Naviazané proteíny boli uvoľnené voľným talidomidom a analyzované elektroforézou. Výsledkom bola identifikácia dvoch proteínov. Jeden bol CRBN a druhý DDB1. Následné pokusy in vitro ukázali, že CRBN sa na talidomid viaže priamo, zatiaľ čo DDB1 sa viaže na CRBN a interaguje s talidomidom nepriamo. V tejto práci sa tiež potvrdilo, že CRBN je proteín, ktorý je cieľovou molekulou talidomidu a sprostredkováva jeho aktivitu in vivo [5].
Odhalenie priamej väzby talidomidu na CRBN upriamila pozornosť práve na tento proteín, nakoľko sa zdá, že práve CRBN hrá kľúčovú úlohu v efektivite protinádorových účinkov talidomidu a jeho derivátov pri liečbe MM.
Schuster et al (2014) analyzovali hladiny expresie CRBN v kohorte MM pacientov s rovnakou liečbou s cieľom zistiť vzťah medzi expresiou CRBN a klinickými výsledkami liečby MM IMiDs. Zistili, že expresia CRBN je vyššia u bunkových línií pochádzajúcich z hematologických malignít (zahŕňajúc MM) v porovnaní so solídnymi nádormi. Navyše zistili, že normálne B lymfocyty a indolentné B lymfoidné nádory majú podobnú hladinu CRBN ako bunky MM. Pri porovnávaní hladiny expresie CRBN medzi normálnymi plazmatickými bunkami, MGUS, SMM a MM neboli detegované rozdiely [10].
Pri analýze genetických podtypov MM bola u hyperdiploidnej skupiny zistená vyššia hladina expresie CRBN ako u non-hyperdiploidnej. Tento výsledok okrem iného naznačuje, že hladina expresie CRBN je úmerná počtu kópií chromozómu 3, na ktorom je tento gén lokalizovaný. Rozdiel v expresii CRBN medzi hyperdiploidnou a non-hyperdiploidnou skupinou bol zistený aj pri nezahrnutí pacientov s trizómiou chromozómu 3.Súčasne pri translokácii t(4;14) bola zistená nižšia hladina expresie [10].
Pri štúdii závislosti hladiny expresie CRBN na klinickej odpovedi na liečbu pomalidomidom a dexametazónom bolo 53 pacientov rozdelených do troch skupín podľa mediánu expresie CRBN. Zo získaných dát vyplýva trend lepšej odpovedi na liečbu u pacientov zo skupiny s vyššou hladinou expresie CRBN [10].
Bedewy a EL-Maghraby (2014) si dali za cieľ svojej štúdie na 46 novodiagnostikovaných MM pacientoch posúdiť hladiny expresie CRBN a génu pre receptor interleukínu-6 (IL-6R) a ich dopad na účinnosť liečby MM dexametazónom a talidomidom. Zistili, že medián expresie CRBN a IL-6R bol u onkologických pacientov vyšší ako u kontroly. Lepšia odpoveď na liečbu bola u pacientov spojená súhrnne s nižšou hladinou β2 mikroglobulínu a nižšou expresiou IL-6R a vyššou hladinou sérového albumínu a vyššou expresiou CRBN [21].
K rovnakým záverom dospela aj štúdia Heintel et al (2013), ktorá ukazovala na výraznú koreláciu medzi hladinou expresie CRBN a odpoveďou na liečbu pomalidomidom [8]. Broyl et al (2013) pozorovali jasnú spojitosť medzi vyššou hladinou expresie CRBN a dlhšou dobou prežitia bez progresie ochorenia počas liečby talidomidom [9].
Zhu et al (2011) zistili, že pre MM bunky je zníženie expresie CRBN toxické. Pri vnesení CRBN shRNA do MM buniek došlo k výraznej redukcii expresie CRBN a taktiež k zníženiu životaschopnosti MM buniek (o 65 – 78 %) v porovnaní s kontrolnými MM bunkami. Bunky, ktoré zníženie expresie CRBN prežijú, sa stávajú vysoko rezistentné voči lenalidomidu aj pomalidomidu, ale voči liekom ako bortezomib, dexametazón a melfalan ostávajú senzitívne. Získaná delécia CRBN bola identifikovaná ako primárna genetická zmena odlišujúca senzitívnu bunkovú líniu MM1.S na liečbu lenalidomidom a pomalidomidom od rezistentnej [22].
Z uvedených štúdií vyplýva, že vyššia hladina expresie CRBN je spojená s lepšou odpoveďou na liečbu pomocou IMiDs. Nakoľko pri nízkej expresii CRBN dochádza u pacientov ku vzniku rezistencie na liečbu, expresia CRBN sa javí ako nutná súčasť efektívnej liečby IMiDs. Na základe hladiny expresie CRBN by sa dalo určiť, ktorí pacienti budú a ktorí nebudú z liečby profitovať [22].
Budúce využitie CRBN v klinickej praxi však závisí od technických metód používaných k detekcii a zvážení všetkých faktorov a dejov (napr. rôzne varianty zostrihu mRNA CRBN), ktoré sa v bunke odohrávajú a môžu ovplyvňovať efektivitu odpovede na liečbu MM [23].
V dostupnej literatúre zatiaľ nie je veľké množstvo výsledkov, ktoré by poukazovali na spojitosť medzi mutáciami v CRBN a efektivitou liečby [24]. Egan et al (2013) po prvýkrát popísali získanú mutáciu skracujúcu proteín (Q99*) a bodovú mutáciu (R283K) v CRBN ako príčinu rezistencie MM buniek k liečbe u 37 - ročného IgG-κ pacienta [25]. V ďalšej štúdii bola detegovaná mutácia v bunkovej línii ANBL-6, ktorá vykazovala rezistenciu k lenalidomidu. Na druhej strane, v štúdii Thakurta et al (2014) pri analýzach troch odlišných bunkových línií rezistentných na liečbu, neboli zistené žiadne mutácie CRBN. Výskyt mutácií v CRBN a DDB1 sa tu javil ako vzácny a ako by mal iba obmedzený dopad na vznik rezistencie MM buniek voči liečbe IMiDs. Tieto zistenia naznačujú, že príčina rezistencie MM buniek nemusí byť závislá na mutáciách v CRBN. Je však pravdepodobné, že epigenetické, transkripčné a posttranskripčné mechanizmy hrajú dôležitejšiu úlohu ako samotné mutácie v CRBN pri vzniku rezistencie MM buniek [24].
Ako bolo spomínané vyššie, jedny z prvých objavených účinkov IMiDs u MM bola ich imunomodulačná aktivita, ktorá zahàňala kostimuláciu T buniek a ovplyvňovanie produkcie cytokinov (zhrnuté v [4]). Následné skúmanie aktivity IMiDs odhalilo ich vysoko pleiotropný efekt pri modulácii imunitného systému, ktorý je využívaný pri liečbe MM.
Po indentifikácii CRBN ako cieľovej molekuly IMiDs, sa CRBN javil ako sprostredkovateľ ich teratogénnych a antiproliferačných účinkov. Zaujímavým zistením bolo, že väzba pomalidomidu a lenalidomidu na CRBN má za následok aj moduláciu imunitného systému a to konkrétne kostimuláciu T buniek. Mechanizmus spočíva vo väzbe lenalidomidu a pomalidomidu na CRBN, po ktorej dochádza k degradácii transkripčných faktorov Ikaros a Aiolos [26]. Ikaros a Aiolos slúžia v T bunkách ako negatívne regulátory, resp. represory expresie IL-2 [27].
Gandhi et al (2013) zistili, že väzba pomalidomidu a lenalidomidu na CRBN umožní naviazanie Ikarosu a Aiolosu na ubikvitín-ligázový komplex CRL4CRBN, čo vedie k ich ubikvitinizácii a následnej degradácii v proteazóme (obr. 3). Degradácia represorov Ikarosu a Aiolosu má za následok zvýšenie expresie IL-2, čo v závere znamená stimuláciu T buniek imunitného systému. Schopnosť IMiDs zvyšovať hladinu IL-2 v T bunkách prostredníctvom degradácie Aiolosu a Ikarosu sú teda závislé na prítomnosti CRBN [26].
3. Model účinku kostimulácie T buniek lenalidomidom a pomalidomidom. 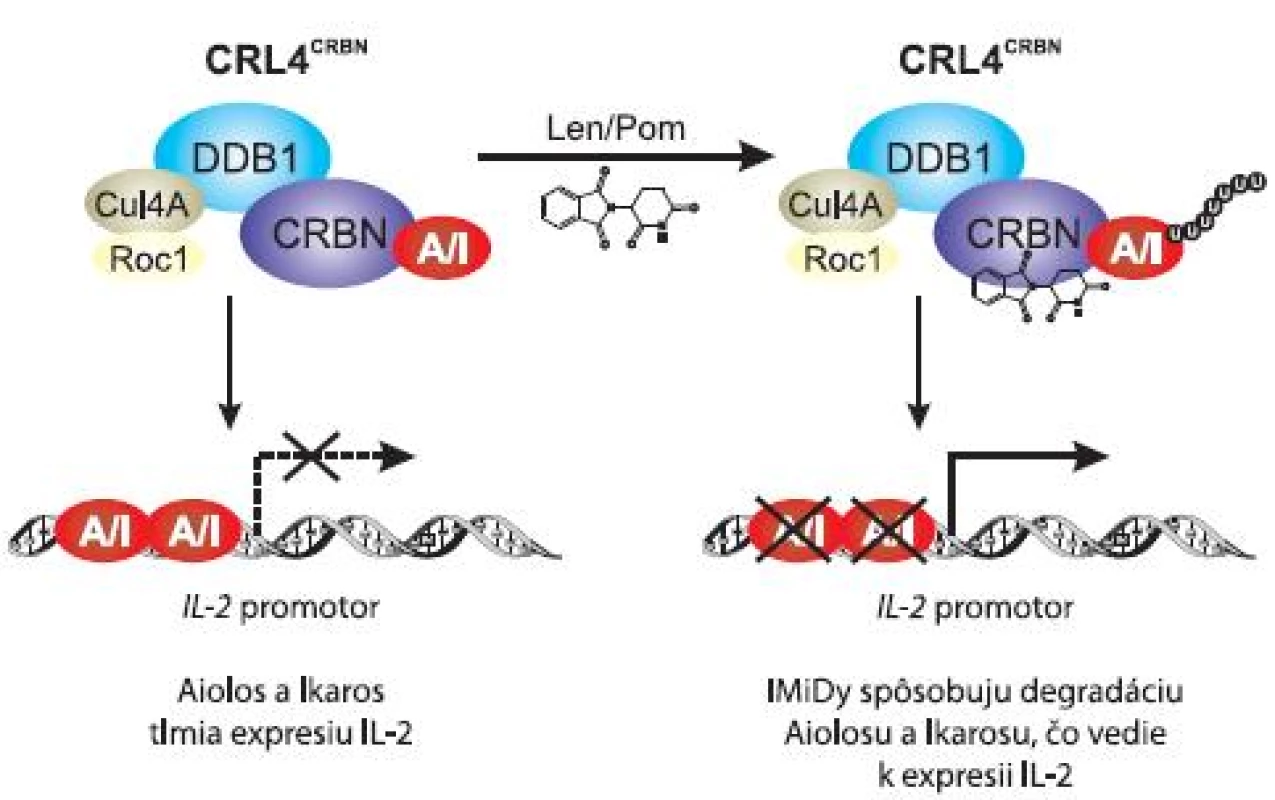
Väzba pomalidomidu a lenalidomidu na CRBN umožní degradácii Ikarosu a Aiolosu v proteazóme. To má za následok zvýšenie expresie IL-2 a stimuláciu T buniek imunitného systému. Pre úplné pochopenie mechanizmu účinku IMiDs, prípadne pre možnosť identifikácie čo najefektívnejších liečiv, je nutné objasnenie celého princípu aktivity IMiDs viažucich CRBN, kde s určitosťou patrí identifikácia cieľových molekúl CRBN a následných signalizačných dráh prebiehajúcich v MM bunkách.
V štúdii Zhu et al (2011) bola porovnaná expresia génov bunkovej línie liečenej lenalidomidom s rovnakou bunkovou líniou so zníženou expresiou CRBN za použitia CRBN shRNA. Celkovo bolo identifikovaných 123 génov, u ktorých došlo k zmenám v expresii medzi porovnávanými bunkovými líniami. Medzi tieto gény patrili napr. MYC, SP1 a TP53, avšak najvýraznejšou pozorovanou zmenou v expresii bolo zníženie expresie IRF4. Zaujímavým zistením bolo, že u MM buniek, ktoré prežili zníženie expresie CRBN, postupne dochádzalo k opätovnému navýšeniu hladiny proteínu IRF4 do normálu [22]. IRF4 bol identifikovaný ako kritický faktor pre prežitie MM buniek [28] a zároveň ako jedna z cieľových molekúl CRBN po väzbe IMiDs [22]. Záverom jednej z ďalších štúdií bolo, že k indukcii expresie P21waf1 a inhibícii expresie IRF4 po liečbe IMiDs nedochádza pri absencii expresie CRBN [29]. P21waf1 aj IRF4 sú zapojené do signalizačnej dráhy NF-κB, čo naznačuje, že inaktivácia tejto dráhy po pôsobení IMiDs sa môže ďalej odraziť na ich regulácií.
Všetky tieto poznatky, pomáhajú v pochopení procesov odohrávajúcich sa na úrovni MM buniek, no v budúcnosti bude potrebné vykonať ďalšie výskumy, ktoré by dokázali popísať presný mechanizmus signálnych dráh prebiehajúcich v MM bunkách po naviazaní IMiDs na CRBN.
Záver
CRBN je podjednotka Cul4- E3 ubikvitín-proteín ligázového komplexu. Tento proteínový komplex je okrem CRBN, predstavujúceho substrátový receptor, ďalej zložený z DDB1, Cul4 (Cul4a a Cul4b) a Roc1. Jeho funkciou je pripájať na proteíny určené k degradácii polyubikvitínový reťazec [6,7]. Takto označené proteíny sú následne degradované v proteazóme. Po naviazaní talidomidu však dochádza k inhibícii aktivity Cul4 - E3 ubikvitín - proteín ligázového komplexu, čo má za následok hromadenie proteínov v bunke. Tento mechanizmus vysvetľuje teratogénne účinky talidomidu, avšak aj účinky protinádorové [5].
Pri bližších štúdiách CRBN bola zistená korelácia medzi hladinami expresie CRBN a efektivitou liečby MM IMiDs. Vysoké hladiny expresie CRBN sú spájané s lepšou odpoveďou na liečbu a naopak nízka expresia je spájaná so slabou odpoveďou na liečbu, až rezistenciou myelómových buniek voči IMiDs [8 – 10]. Cielené zníženie expresie CRBN pomocou molekulárnych metód je pre myelómové bunky cytotoxické, avšak bunky, ktoré toto vyradenie CRBN prežijú sa stávajú vysoko rezistentnými na liečbu [22].
Doterajšie závery rôznych štúdií stavajú CRBN do pozornosti ďalších výskumov, nakoľko predstavuje zaujímavý farmakodynamický cieľ. Na základe dostupnej literatúry by CRBN v budúcnosti mohol slúžiť ako prediktívny biomarker pre určenie efektivity liečby MM, prípadne iných hematologických ochorení prostredníctvom IMiDs. Zavedenie do klinickej praxe si však vyžaduje ďalšie skúmanie celkového mechanizmu pôsobenia a komplexných signálnych dráh prebiehajúcich v MM bunkách.
Práce byla podpořena granty IGA MZ ČR NT14575 a NT12130.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
RNDr. Sabina Ševčíková, Ph.D.
Babákova myelomová skupina
Ústav patologické fyziologie
LF MU
Kamenice 5, A3
625 00 Brno
e-mail: sevcik@med.muni.cz
Obdrženo: 12. 5. 2014
Přijato: 19. 5. 2014
Sources
1. Harris NL, Jaffe ES, Diebold J et al. The World Health Organization classification of neoplastic diseases of the hematopoietic and lymphoid tissues. Report of the Clinical Advisory Committee meeting, Airlie House, Virginia, November, 1997. Ann Oncol 1999; 10(12): 1419–1432.
2. International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Br J Haematol 2003; 121(5): 749–757.
3. Hájek R, Adam Z, Ščudla V et al. Diagnostika a léčba mnohočetného myelomu. Tranfuze a hematologie dnes 2012; 18 (Suppl 1): 1–89.
4. Sedlaříková L, Kubiczková L, Ševčíková S et al. Mechanism of immunomodulatory drugs in multiple myeloma. Leuk Res 2012; 36(10): 1218–1224. doi: 10.1016/j.leukres.2012.05.010.
5. Ito T, Ando H, Suzuki T et al. Identification of a primary target of thalidomide teratogenicity. Science 2010; 327(5971): 1345–1350. doi: 10.1126/science.1177319.
6. Ohta T, Michel JJ, Schottelius AJ et al. ROC1, a homolog of APC11, represents a family of cullin partners with an associated ubiquitin ligase activity. Mol Cell 1999; 3(4): 535–541.
7. Shiyanov P, Nag A, Raychaudhuri P. Cullin 4A associates with the UV ‑ damaged DNA‑binding Protein DDB. J Biol Chem 1999; 274(50): 35309–35312.
8. Heintel D, Rocci A, Ludwig H et al. High expression of cereblon (CRBN) is associated with improved clinical response in patients with multiple myeloma treated with lenalidomide and dexamethasone. Br J Haematol 2013; 161(5): 695–700. doi: 10.1111/bjh.12338.
9. Broyl A, Kuiper R, van Duin M et al. High cereblon expression is associated with better survival in patients with newly diagnosed multiple myeloma treated with thalidomide maintenance. Blood 2013; 121(4): 624–627. doi: 10.1182/blood‑2012‑06‑438101.
10. Schuster SR, Kortuem KM, Zhu YX et al. The clinical significance of cereblon expression in multiple myeloma. Leuk Res 2014; 38(1): 23–28. doi: 10.1016/j.leukres.2013.08.015.
11. Jo S, Lee KH, Song S et al. Identification and functional characterization of cereblon as a binding protein for large‑conductance calcium‑activated potassium channel in rat brain. J Neurochem 2005; 94(5): 1212–1224.
12. Higgins JJ, Rosen DR, Loveless JM et al. A gene for nonsyndromic mental retardation maps to chromosome 3p25 - pter. Neurology 2000; 55(3): 335–340.
13. Higgins JJ, Pucilowska J, Lombardi RQ et al. A mutation in a novel ATP‑dependent Lon protease gene in a kindred with mild mental retardation. Neurology 2004; 63(10): 1927–1931.
14. Aizawa M, Abe Y, Ito T et al. mRNA distribution of the thalidomide binding protein cereblon in adult mouse brain. Neurosci Res 2011; 69(4): 343–347. doi: 10.1016/j.neures.2010.12.019.
15. Higgins JJ, Tal AL, Sun X et al. Temporal and spatial mouse brain expression of cereblon, an ionic channel regulator involved in human intelligence. J Neurogenet 2010; 24(1): 18–26. doi: 10.3109/01677060903567849.
16. Hohberger B, Enz R. Cereblon is expressed in the retina and binds to voltage‑gated chloride channels. FEBS Lett 2009; 583(4): 633–637. doi: 10.1016/j.febslet.2009.01.018.
17. Xin W, Xiaohua N, Peilin C et al. Primary function analysis of human mental retardation related gene CRBN. Mol Biol Rep 2008; 35(2): 251–256.
18. Lee KM, Jo S, Kim H et al. Functional modulation of AMP‑activated protein kinase by cereblon. Biochim Biophys Acta 2011; 1813(3): 448–455. doi: 10.1016/j.bbamcr.2011.01.005.
19. Lee KM, Lee J, Park CS. Cereblon inhibits proteasome activity by binding to the 20S core proteasome subunit beta type 4. Biochem Biophys Res Commun 2012; 427(3): 618–622. doi: 10.1016/j.bbrc.2012.09.108.
20. Hershko A, Heller H, Elias S et al. Components of ubiquitin‑protein ligase system. Resolution, affinity purification, and role in protein breakdown. J Biol Chem 1983; 258(13): 8206–8214.
21. Bedewy AM, EL ‑ Maghraby SM. Do baseline Cereblon gene expression and IL‑6 receptor expression determine the response to thalidomide‑dexamethasone treatment in multiple myeloma patients? Eur J Haematol 2014; 92(1): 13–18. doi: 10.1111/ejh.12207.
22. Zhu YX, Braggio E, Shi CX et al. Cereblon expression is required for the antimyeloma activity of lenalidomide and pomalidomide. Blood 2011; 118(18): 4771–4779. doi: 10.1182/blood‑2011‑05‑356063.
23. Gandhi AK, Mendy D, Waldman M et al. Measuring cereblon as a biomarker of response or resistance to lenalidomide and pomalidomide requires use of standardized reagents and understanding of gene complexity. Br J Haematol 2014; 164(2): 233–244. doi: 10.1111/bjh.12622.
24. Thakurta A, Gandhi AK, Waldman MF et al. Absence of mutations in cereblon (CRBN) and DNA damage‑binding protein 1 (DDB1) genes and significance for IMiD therapy. Leukemia 2014; 28(5): 1129–1131. doi: 10.1038/leu.2013.315.
25. Egan JB, Kortuem KM, Kurdoglu A et al. Extramedullary myeloma whole genome sequencing reveals novel mutations in Cereblon, proteasome subunit G2 and the glucocorticoid receptor in multi drug resistant disease. Br J Haematol 2013; 161(5): 748–751. doi: 10.1111/bjh.12291.
26. Gandhi AK, Kang J, Havens CG et al. Immunomodulatory agents lenalidomide and pomalidomide co ‑ stimulate T cells by inducing degradation of T cell repressors Ikaros and Aiolos via modulation of the E3 ubiquitin ligase complex CRL4 (CRBN). Br J Haematol 2014; 164(6): 811–821. doi: 10.1111/bjh.12708.
27. Bandyopadhyay S, Duré M, Paroder M et al. Interleukin 2gene transcription is regulated by Ikaros‑induced changes in histone acetylation in anergic T cells. Blood 2007; 109(7): 2878–2886.
28. Shaffer AL, Emre NC, Lamy L et al. IRF4 addiction in multiple myeloma. Nature 2008; 454(7201): 226–231. doi: 10.1038/nature07064.
29. Lopez ‑ Girona A, Mendy D, Ito T et al. Cereblon is a direct protein target for immunomodulatory and antiproliferative activities of lenalidomide and pomalidomide. Leukemia 2012; 26(11): 2326–2335. doi: 10.1038/leu.2012.119.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2014 Issue 5-
All articles in this issue
- Pomalidomide in the Treatment of Relapsed and Refractory Multiple Myeloma
- Cereblon – a New Target of Therapy in the Treatment of Multiple Myeloma
- The Role of MicroRNAs in the Pathophysiology of Neuroblastoma and Their Possible Use in Diagnosis, Prognosis and Therapy
- Function of CDK12 in Tumor Initiation and Progression and Its Clinical Consequences
- Prognostic Markers of Advanced Non-small Cell Lung Carcinoma – Assessing the Significance of Oncomarkers Using Data-mining Techiques RPA
- Breast Cancer Patient Satisfaction with Immediate Two-stage Implant-based Breast Reconstruction
- Influence of Preoperative Chemoradiotherapy on Changes of Epidermal Growth Factor Receptor Expression in Patients Treated by Preoperative Chemoradiotherapy for Local Advanced Rectal Carcinoma
- To Whom it May Concern – Photodiagnosis and Photodynamic Therapy
- A Rare Neoplastic Growth on the Ear Lobe
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prognostic Markers of Advanced Non-small Cell Lung Carcinoma – Assessing the Significance of Oncomarkers Using Data-mining Techiques RPA
- Breast Cancer Patient Satisfaction with Immediate Two-stage Implant-based Breast Reconstruction
- Cereblon – a New Target of Therapy in the Treatment of Multiple Myeloma
- Pomalidomide in the Treatment of Relapsed and Refractory Multiple Myeloma
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

