-
Medical journals
- Career
Pacient s B-CLL s anamnézou darování krvetvorných buněk nepříbuznému pacientovi – retrospektivní sledování vývoje nemoci a důsledky pro příjemc
Authors: P. Jindra 1; L. Žejšková 2; S. Peková 2; J. Navrátilová 1; M. Schutzova 1; S. Vokurka 1; V. Koza 1
Authors‘ workplace: Hematologicko-onkologické oddělení, FN Plzeň 1; Laboratoř molekulární diagnostiky, Praha 2
Published in: Klin Onkol 2012; 25(3): 212-215
Category: Case Reports
Overview
Východiska:
Leukemie z dárcovských buněk (DCL) jsou relativně vzácnou, ale již dobře dokumentovanou komplikací transplantace krvetvorných buněk. Publikovány byly většinou situace, kdy DCL vzniká de novo u příjemce krvetvorných buněk.Pozorování:
Popisujeme případ, kdy u dobrovolného nepříbuzného dárce Českého národního registru dárců dřeně (ČNRDD) došlo s několikaletou latencí po darování k rozvoji chronické lymfocytární leukemie (B-CLL). Z archivní DNA izolované krátce před darováním krvetvorných buněk bylo následně retrospektivně zjištěno, že subklinický klon CLL byl přítomný již v době darování, nicméně s ohledem na úmrtí nemocné krátce po transplantaci nemohlo dojít k případnému rozvoji DCL. Případ dobře dokumentuje dlouhou dobu od vzniku klonu B-CLL do plného rozvoje klinicko-laboratorní symptomatologie. Jsou diskutovány medicínské i etické otázky, které přináší izolovaná detekce hematologické malignity, ať již pouze u dárce, či pouze u příjemce.Závěr:
Případ dokumentuje rostoucí riziko rozvoje nejrůznějších forem DCL, a tím dokládá nezbytnost dlouhodobého sledování dárců krvetvorných buněk nejen z hlediska zdraví dárce, ale i z hlediska potenciálního rizika pro příjemce.Klíčová slova:
leukemie z dárcovských buněk – chronická lymfatická leukemie – transplantáty – dárciÚvod
Leukemie z dárcovských buněk (donor cell leukemia – DCL) je sice relativně vzácnou, ale dobře popsanou komplikací transplantace krvetvorných buněk (TKB). Poprvé byla dokumentována již v roce 1971 [1] a do současnosti bylo popsáno více než 50 případů [2–4]. Většina publikovaných případů popisuje vznik DCL de novo u příjemce krvetvorných buněk. Náš případ ale popisuje situaci, kdy u dobrovolného nepříbuzného dárce Českého národního registru dárců dřeně (ČNRDD) došlo s několikaletou latencí po darování k rozvoji chronické lymfocytární leukemie (B-CLL). Z archivní DNA bylo následně retrospektivně zjištěno, že subklinický klon CLL byl přítomný již v době darování, nicméně vzhledem k úmrtí příjemce časně po transplantaci nemohlo dojít k případnému rozvoji DCL. Případ dokumentuje jak dlouhou dobu od vzniku klonu B-CLL do plného klinicko-laboratorního obrazu, tak nezbytnost dlouhodobého sledování dárců krvetvorných buněk nejen z hlediska zdraví dárce, ale i z hlediska potenciálního rizika pro příjemce.
Popis případu
46letý muž, dlouholetý dárce krve, byl v roce 2006 odeslán transfuzním oddělením na Hematologicko-onkologické oddělení FN Plzeň pro opakovaně zachycenou leukocytózu s lymfocytózou (KO: leukocyty 15,1 × 109/L, Hb 135 g/l, trombo 182 × 109/l. Diferenciální obraz: neutrofily 0,21; lymfocyty 0,76; monocyty 0,03; ojediněle Gumprechtovy stíny). Byla stanovena diagnóza B-CLL, st. I dle Raie s pakety uzlin v retroperitoneu a s nemutovanou sekvencí IgVH genů, čili šlo o prognosticky nepříznivou CLL. Od prosince 2006 bylo podáno celkem 5 cyklů chemoimunoterapie v kombinaci R-FC (rituximab, fludarabin, cyklofosfamid), kterou bylo dosaženo kompletní remise trvající až do roku 2010. Již vstupně však bylo anamnesticky zjištěno, že nemocný byl od roku 1992 registrován jako dobrovolný nepříbuzný dárce kostní dřeně v Českém národním registru dárců dřeně (ČNRDD) v Plzni. O onemocnění dárce byl proto obratem informován ČNRDD, protože v září 2000, tedy 6 let před stanovením diagnózy CLL, byla dárci po lékařském vyšetření a stanovení jeho způsobilosti k odběru podle platných právních norem ČR [5] a mezinárodních doporučení [6,7] odebrána kostní dřeň, jež byla transplantována nepříbuznému příjemci, 50leté pacientce s diagnózou B akutní lymfoblastické leukemie. Pacientka však 18 měsíců po transplantaci zemřela v kompletní remisi na potransplantační komplikace, přičemž kontrolní vyšetření kostní dřeně 15 měsíců po transplantaci neprokázalo žádnou signifikantní patologii; archivní DNA z tohoto vzorku nebyla již bohužel k dispozici. Bylo zjištěno, že odběr kostní dřeně proběhl bez komplikací, dárce byl po darování dle tehdejších standardů Registru sledován 1 rok ve svém spádovém dárcovském centru a nebyla zjištěna žádná patologie. Následně jako dárce krve opět pravidelně daroval krev, přičemž ani zde nebyly do roku 2006 detekovány žádné klinické ani laboratorní patologie. Vzhledem k tomu, že u dárce byla k dispozici archivní DNA izolovaná z periferní krve v době odběru kostní dřeně, pokusili jsme se retrospektivně stanovit, nebyl-li klon B-CLL přítomen již v době darování. Analýza byla provedena dle již dříve publikované metodiky [8]. Stručně řečeno, byly navrženy klon-specifické primery amplifikující oblast FWR1 až CDR3 a tato oblast byla molekulárně vyklonována pro přípravu kvantifikačního standardu. Pro RQ-PCR detekci byla použita LNA-modifikovaná sonda pro rodinu VH3. Pomocí RQ-PCR byla na cDNA z období diagnózy a z období dárcovství štěpu amplifikována hledaná klonální sekvence. Jako kontrolní gen byl použit ABL. Pro výpočet relativní exprese IgVH byl použit vztah 2-DDCt. Z doby záchytu onemocnění však byla k dispozici pouze RNA, kterou není možné přímo kvantitativně srovnávat s archivní DNA pacienta (dárce) v době odběru. Proto bylo provedeno jen přímé srovnání archivní DNA dárce s DNA kostní dřeně již po chemoterapii, tedy z doby, kdy byl dle flowcytometrické analýzy přítomen již pouze 10% klon B-CLL. Výsledek (obr. 1) však přesto jasně prokázal, že u pacienta byl v periferní krvi již v době darování, tedy 6 let před klinickým rozvojem, jasně přítomen klon B-CLL.
Image 1. Relativní kvantifikace klonu B-CLL u dárce. 1. DNA izolovaná v době darování kostní dřeně – rok 2000, tj. 6 let před klinickou dg. B-CLL 2. DNA z roku 2007, tj. 2 roky po klinické dg. B-CLL se zbytkovou nemocí ve dřeni. Jasně prokázána přítomnost klonu 6 let před klinickým rozvojem B-CLL. 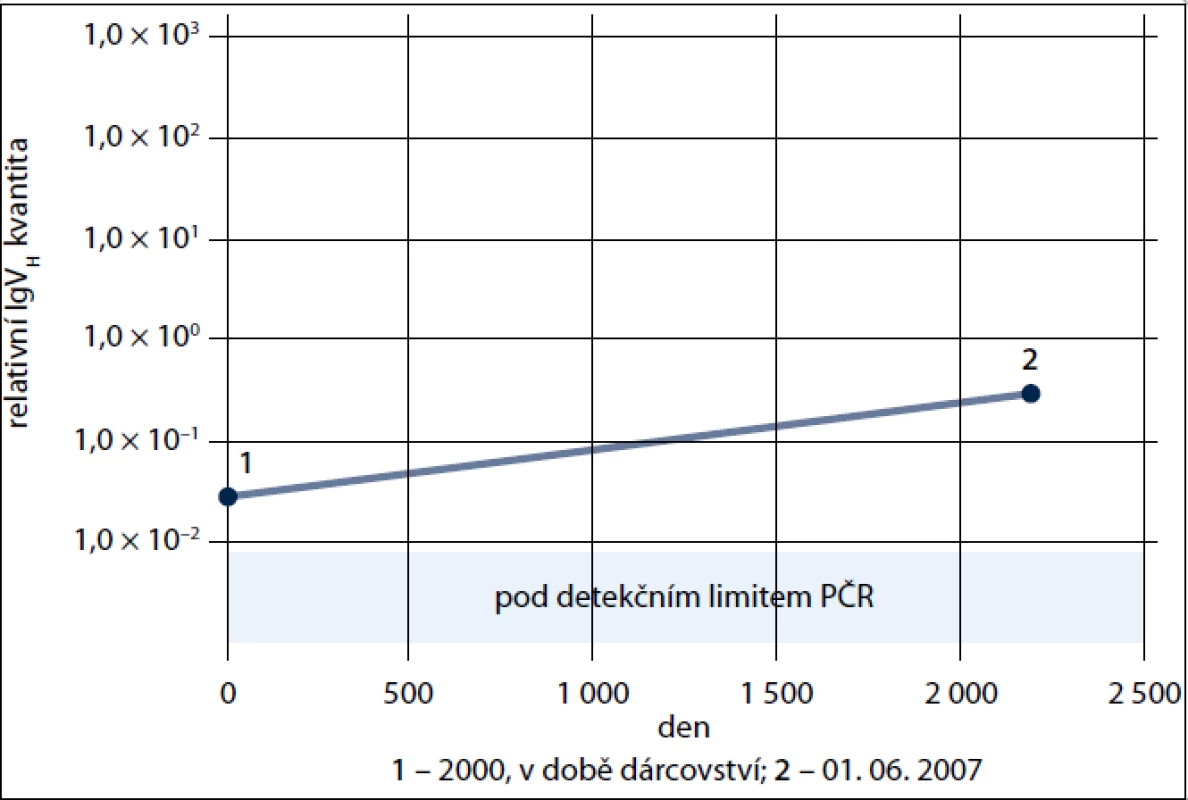
Diskuze
Rozvoj leukemie po TKB obvykle představuje relaps původního onemocnění. Nicméně vzácně se může leukemie rozvinout i de novo z transplantovaných krvetvorných buněk dárce a pak hovoříme o tzv. leukemii z dárcovských buněk (DCL). S rozvojem molekulárních technik umožňujících jednoznačně stanovit původ leukemie bylo v posledních letech publikováno poměrně velké množství případů DCL a některé práce uvádějí až 5% incidenci [9]. V poslední době tato problematika vzbuzuje ještě větší pozornost, a to ze dvou důvodů. Jednak se alogenní TKB staly standardní procedurou i u pacientů starších 50 let, přičemž v případě příbuzenských transplantací jsou pak logicky starší i dárci (sourozenci). Jelikož incidence většiny hematologických malignit roste s věkem, tak by přirozeně mělo stoupat i riziko rozvoje DCL, ať již kvůli věku příbuzného dárce, či vlivem věku příjemce. Je-li podpůrným faktorem přirozeně snížená protinádorová imunita u starších příjemců a/nebo dárců, je však v tuto chvíli pouhou hypotézou a neexistují žádná publikovaná data podporující tuto teorii. Druhým faktorem je častější používání růstových faktorů granulopoézy (filgrastim, G-CSF) jako mobilizačního prostředku před odběry periferních krvetvorných buněk. V souvislosti s jeho podáváním se spekuluje o zvýšeném riziku rozvoje hematologických malignit [10,11]. Nicméně v rozsáhlých analýzách evropských či amerických registrů nebyla u dárců vystavených G-CSF potvrzena vyšší incidence hematologických malignit ve srovnání s běžnou populací [12,13]. V současnosti tedy nejsou žádné jednoznačné důkazy o možném zvýšeném výskytu malignit u dárců vystavených G-CSF, a tudíž ani neexistují data o případné vyšší incidenci DCL jako důsledku transplantace krvetvorných buněk dárce vystavených G-CSF. V našem případě však dárce daroval kostní dřeň, a nebyl tedy vystaven účinku G-CSF.
DCL je v zásadě možno rozdělit na 2 hlavní skupiny:
- případy, kdy je malignita aktivně přímo transplantována od dárce;
- případy, kdy se malignita rozvine až po transplantaci, a to pouze u příjemce [14].
V první skupině je maligní klon u dárce přítomen již v době darování, DCL u příjemce vzniká relativně krátce po transplantaci a tatáž malignita se dříve či později rozvíjí i u dárce. Typicky se jedná o indolentní lymfoidní malignity [14], což je pochopitelné, neboť ty mají obvykle delší dobu od detekce klonu k plnému klinicko-laboratornímu obrazu, a tudíž nejsou během předtransplantačního vyšetření dárce zjištěny. Ve druhé skupině k rozvoji malignity u dárce z nejrůznějších důvodů obvykle nikdy nedojde a ani maligní klon není zpravidla detekován, neboť v etiopatogenezi malignity hraje klíčovou roli alterované mikroprostředí kostní dřeně imunosuprimovaného příjemce. U těchto případů je typická delší doba od transplantace k detekci DCL, přičemž je zajímavé, že tento typ DCL představují takřka výhradně myeloidní hematologické malignity (AML, CML, MDS) a je spíše asociovaný s mladšími dárci [3,14].
U našeho případu nedošlo pro relativně časné úmrtí příjemce na potransplantační komplikace k rozvoji B-CLL u příjemce, nicméně, jak dokládá přítomnost klonu v době darování (obr. 1), v případě jejího vzniku by se jednalo jednoznačně o přímý přenos malignity. Případné srovnání jednotlivých dynamik rozvoje B-CLL u příjemce a dárce by bylo nesporně zajímavé a mohlo by přispět k poznání mechanizmu transformace (pre)maligních buněk dárce v rozdílném imunitním a genetickém prostředí příjemce [3].
Sala-Torra et al v souboru 12 případů DCL [14] popisují celkem 3 případy dokumentovaného přenosu CLL nepříbuzným dárcem. V jednom případě byla u dárce klinicky diagnostikována CLL již 2 roky po TKB, a přestože molekulární přítomnost CLL byla u příjemce zjištěna krátce po TKB, ke klinickému rozvoji došlo až po 12 letech. Naopak u druhého pacienta byla situace opačná – CLL se dříve rozvinula u příjemce. U posledního pacienta byl pouze detekován klon a další sledování nebylo pro časné úmrtí možné. Dva publikované případy přenosu CLL u sourozeneckých TKB nepodporují hypotézu vlivu rozdílného genetického prostředí a imunitního systému, neboť klinický průběh byl vždy podobný u příjemce i dárce, v jednom případě indolentní [15] a podruhé agresivní [16].
Detekce malignity u dárce či malignity z dárcovských buněk u příjemce přináší některé další závažné etické problémy týkající se nejen dárce, ale i příjemce. Primárně je na místě otázka, jak hluboce vyšetřovat dárce před vlastním darováním krvetvorných buněk. U příbuzných dárců pro pacienty s CLL či s rodinnou anamnézou CLL je doporučován systematický screening neinvazivními citlivými metodami, jako je např. flowcytometrie lymfocytů periferní krve [16]. V případě zdravých nepříbuzných dárců však tento postup nelze univerzálně aplikovat a měl by být aplikován individuálně pouze u starších dárců s průkaznou rodinnou zátěží CLL. Ještě složitější je otázka informování a dalšího sledování dárce v případě, že se u příjemce jeho buněk rozvinula DCL. Z dosavadních dat je zřejmé, že ne u všech dárců vznikne stejná DCL jako u jejich příjemce [2,14], zvláště je-li dárcovskou leukemií u příjemce myeloidní malignita. I s ohledem na relativní vzácnost případů je logické, že univerzálně platná doporučení neexistují, obecně je na místě vždy přísně individuální přístup k informování dárce a pečlivé sledování s příslušnými fyzikálními i laboratorními vyšetřeními. Analogický postup by měl být zvolen i v případě příjemce, u jehož dárce je následně diagnostikována hematologická malignita.
Lze shrnout, že náš případ v souladu s literárními daty dokládá rostoucí frekvenci detekce nejrůznějších forem DCL. To jen podtrhuje nezbytnost dlouhodobého (několikaletého) prospektivního a jasně definovaného aktivního sledování dárců krvetvorných buněk, tak jak je vyžadováno českou legislativou [5] i doporučeními mezinárodních autorit [6,7]. V souvislosti s tím je potěšující, že od roku 2005 je politika sledování nepříbuzných dárců ČNRDD a příbuzných dárců prostřednictvím HOO FN Plzeň v plném souladu s těmito požadavky [17,18].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Pavel Jindra
Hematologicko-onkologické oddělení FN Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: jindra@fnplzen.cz
Obdrženo: 13. 9. 2011
Přijato: 7. 11. 2011
Sources
1. Fialkow PJ, Thomas ED, Bryant JI et al. Leukaemic transformation of engrafted human marrow cells in vivo. Lancet 1971; 1(7693): 251–255.
2. Hertenstein B, Hambach L, Bacigalupo A et al. Development of leukemia in donor cells after allogeneic stem cell transplantation – a survey of the European Group for Blood and Marrow Transplantation (EBMT). Haematologica 2005; 90(7): 969–975.
3. Flynn CM, Kaufman DS. Donor cell leukemia: insight into cancer stem cells and the stem cell niche. Blood 2007; 109(7): 2688–2692.
4. Igarashi N, Chou T, Hirose T et al. Donor cell-derived acute lymphocytic leukemia after allogeneic stem cell transplantation for multiple myeloma. Int J Hematol 2009; 90(3): 378–382.
5. Nařízení vlády, kterým se provádí zákon č. 285/2002 Sb., o darování, odběrech a transplantacích tkání a orgánů a o změně některých zákonů (transplantační zákon), č. 436/2002 Sb. a Vyhláška Ministerstva zdravotnictví, kterou se stanoví bližší podmínky posuzování zdravotní způsobilosti a rozsah vyšetření žijícího nebo zemřelého dárce tkání nebo orgánů pro účely transplantací (vyhláška o zdravotní způsobilosti dárce tkání a orgánů pro účely transplantací), č. 437/2002 Sb.
6. Worldmarrow.org [online], The World Marrow Donor Association (WMDA). Last update: 2011 June 06, cited 2011 June 23. Available from: http://www.worldmarrow.org/.
7. Jacie.org [online], The Joint Accreditation Committee--ISCT (Europe) & EBMT (JACIE-EBMT). Last update: 2011 June 22, cited 2011 June 25. Available from: http://www.jacie.org/.
8. Peková S, Bezdíčková L, Smolej L et al. Quantitation of minimal residual disease in patients with chronic lymphocytic leukemia using locked nucleic acid-modified, fluorescently labeled hybridization probes and real-time PCR technology. Mol Diagn Ther 2007; 11(5): 325–335.
9. Boyd CN, Ramberg RC, Thomas ED. The incidence of recurrence of leukemia in donor cells after allogeneic bone marrow transplantation. Leuk Res 1982; 6(6): 833–837.
10. Nagler A, Korenstein-Ilan A, Amiel A et al. Granulocyte colony-stimulating factor generates epigenetic and genetic alterations in lymphocytes of normal volunteer donors of stem cells. Exp Hematol 2004; 32(1): 122–130.
11. Bennett CL, Evens AM, Andritsos LA et al. Haematological malignancies developing in previously healthy individuals who received haematopoietic growth factors: report from the Research on Adverse Drug Events and Reports (RADAR) project. Br J Haematol 2006; 135(5): 642–650.
12. Halter J, Kodera Y, Ispizua AU et al. Severe events in donors after allogeneic hematopoietic stem cell donation. Haematologica 2009; 94(1): 94–101.
13. Confer DL, Miller JP. Long-term safety of filgrastim (rhG-CSF) administration. Br J Haematol 2007; 137(1): 77–78.
14. Sala-Torra O, Hanna C, Loken MR et al. Evidence of donor-derived hematologic malignancies after hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 2006; 12(5): 511–517.
15. Perz JB, Ritgen M, Moos M et al. Occurence of donor--derived CLL 8 years after sibling donor SCT for CML. Bone Marrow Transplant 2008; 42(10): 687–688.
16. Flandrin-Gresta P, Callanan M, Nadal N et al. Transmission of leukemic donor cells by allogeneic stem cell transplantation in a context of familial CLL: should we screen donors for MBL? Blood 2010; 116(23): 5077–5078.
17. Kostnidren.cz [online], Český Národní Registr Dárců Dřeně (ČNRDD). Last update: 2011 August 31, cited 2011 September 3. Dostupné z: http://www.kostnidren.cz/registr.
18. Vokurka S, Koza V, Jungová A et al. Výskyt malignit a dispenzarizace dárců krvetvorných buněk – výsledky sledování Hematologicko-onkologického oddělení FN Plzeň a Českého národního registru dárců dřeně. Klin Onkol 2012; 25(1): 42–46.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2012 Issue 3-
All articles in this issue
- Nové a klinicky využívané onkomarkery karcinómu močového mechúra
- Reprodukční funkce u onkologických pacientek
- Genetické pozadí ototoxicity cisplatiny
- Triple-negativní karcinom prsu: analýza souboru pacientek diagnostikovaných a/nebo léčených v Masarykově onkologickém ústavu v letech 2004 až 2009
- Angioimunoblastický T-lymfom (AITL) jako velmi nepříznivá malignita – zkušenost centra
- Pacient s B-CLL s anamnézou darování krvetvorných buněk nepříbuznému pacientovi – retrospektivní sledování vývoje nemoci a důsledky pro příjemc
- Výhody jednotlivých zobrazovacích metod pro diagnostiku a sledování aktivity mnohočetného myelomu
- Pozitronová emisní tomografie a klinické prediktory přežití u primárních extragonadálních germinálních nádorů
- Faktor stimulující kolonie granulocytů (G-CSF) zrychluje hojení vlhké deskvamace kůže vyvolané radiací
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Angioimunoblastický T-lymfom (AITL) jako velmi nepříznivá malignita – zkušenost centra
- Triple-negativní karcinom prsu: analýza souboru pacientek diagnostikovaných a/nebo léčených v Masarykově onkologickém ústavu v letech 2004 až 2009
- Nové a klinicky využívané onkomarkery karcinómu močového mechúra
- Faktor stimulující kolonie granulocytů (G-CSF) zrychluje hojení vlhké deskvamace kůže vyvolané radiací
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

