-
Medical journals
- Career
Angioimunoblastický T-lymfom (AITL) jako velmi nepříznivá malignita – zkušenost centra
Authors: S. Vokurka 1; V. Koza 1; V. Vozobulová 1; P. Jindra 1; K. Steinerová 1; M. Schutzova 1; L. Boudová 2
Authors‘ workplace: Hematologicko-onkologické oddělení, FN Plzeň 1; Patologicko-anatomický ústav, FN Plzeň 2
Published in: Klin Onkol 2012; 25(3): 206-211
Category: Original Articles
Overview
Východiska:
Angioimunoblastický T-lymfom (AITL) je nepříznivá malignita. Pro relativně vzácný výskyt a nedostatek literárních údajů v českém písemnictví jsme zpracovali naše zkušenosti. Soubor a metody: Retrospektivní analýza pacientů s nově diagnostikovaným AITL a léčených na našem pracovišti v 1/2000–12/2010.Výsledky:
Analyzováno 12 pacientů s mediánem věku 64 (43–82) let. Dva pacienti ve věku nad 80 let byli léčeni kortikoterapií. Deset pacientů bylo léčeno chemoterapií 6× CHOP-21 a bylo dosaženo stavu: stabilní nemoc 2/10 (20 %), parciální remise 5/10 (50 %), kompletní remise 3/10 (30 %). Medián EFS a OS pacientů léčených chemoterapií byl 8 a 10 měsíců. EFS a OS byl signifikantně delší při dosažení stavu CR v rámci 1. linie léčby po 6× CHOP nebo po doplnění autologní transplantace krvetvorných buněk: 43 vs 6 (p = 0,0052) a 46 vs 6 měsíců (p = 0,0023). U 4/7 (57 %) pacientů s potřebou další minimalizace nemoci po indukci nebylo možné realizovat autologní transplantaci pro nepříznivý stav nebo časnou progresi lymfomu a úmrtí na záchrannou chemoterapii.Závěr:
AITL je nepříznivá malignita s rizikem velmi časné progrese po indukci CHOP-21. Je-li pacient únosný, je třeba doplnit autologní transplantaci krvetvorných buněk obratem po indukci a již v době indukce mít informace o dostupnosti dárce krvetvorných buněk v rodině, eventuálně registrech.Klíčová slova:
lymfom – chemoterapie – transplantaceÚvod
Angioimunoblastický T-lymfom (AITL) představuje specifickou malignitu definovanou v rámci lymfoidních T-buněčných neoplazií, respektive periferních T-lymfomů aktuální WHO klasifikace [1]. Původně byl tento typ lymfomu označován v 70. letech jako angioimunoblastická nebo imunoblastická lymfadenopatie [2,3], dále jako lymfogranulomatóza X [4], imunoblastický T-lymfom [5] a od roku 1994 v rámci REAL klasifikace již jako angioimunoblastický lymfom [6].
AITL patří mezi relativně vzácné lymfomy. V období 1999–2006 bylo v rámci registru Kooperativní lymfomové skupiny ČR evidováno 3 518 pacientů a z toho 16 (0,5 %) s AITL [7]. V registrech International Lymphoma Study Group (ILSG) pak AITL zastupuje 1,2 % lymfomů [8].
Svým původem je AITL řazen jako malignita vycházející z CD4 pozitivních folikulárních T-helper lymfocytů. Imunofenotyp nádorových buněk charakterizuje pozitivita CD2, CD3, CD5, CD4, CD10, PD1, bcl6 a CXCL13. U 90 % případů bývá prokazována klonalita T-cell receptoru (TCR), nicméně v 10–20 % případů se vyskytuje i klonální přestavba genu pro těžký řetězec imunoglobulinu (IgH) [1]. Imunomorfologický nález mívá v plně vyvinutých případech typický vzhled, v němž dominují výrazně zmnožené a větvené drobné cévy a extrafolikulární proliferace folikulárních dendritických buněk. Nádorové buňky se vyskytují v různém počtu, mají typicky světlou cytoplazmu (tzv. „clear cells“) a různě vyjádřené atypie. Bývá přítomen polymorfní infiltrát tvořený především lymfocyty, eozinofily, plazmatickými buňkami, dendritickými elementy a histiocyty. Součástí bývají i velké B-blasty, často s pozitivitou EBV, které mohou mít vzhled Reedové-Sternbergových buněk. V případech s méně výraznými imunomorfologickými rysy je patologická diagnóza velmi těžká a někdy vyžaduje opakovanou biopsii a klinickopatologické korelace [24].
AITL postihuje většinou starší pacienty s mediánem věku okolo 60 let. V klinickém obrazu dominují převážně pokročilá stadia nemoci doprovázená celkovými příznaky (horečka, hubnutí, noční pocení), téměř vždy generalizovanou lymfadenopatií a často hepato-splenomegalií. Téměř u poloviny případů se objevují doprovodné kožní projevy v podobě exantémů, purpury, svědění nebo urtiky. Symptomatologii mohou doplňovat kloubní obtíže (artritida, artralgie), otoky, ascites. Průběh je většinou akutní a může připomínat systémová nebo infekční onemocnění nebo jiné lymfoproliferace. Transformace v lymfom vysoké agresivity nebývají časté. Laboratorně bývá přítomna většinou anémie, která může být hemolytická s průkazem pozitivity Coombsova testu, dále trombocytopenie, eozinofilie nebo pozitivita autoprotilátek, jako jsou např. revmatoidní faktor a anti-nukleární faktor [9].
V léčbě se uplatňuje především standardní protokol chemoterapie CHOP [9]. Průběh onemocnění je variantní, nicméně ve většině případů je prognóza nepříznivá, s mediánem přežívání méně než 3 roky i v případě zajištění intenzivní léčby a šance na dlouhodobé přežívání je do 30 % [10,11]. Obecně se zdá, že dosažení kompletní remise je zásadním prognostickým faktorem [9].
S ohledem na relativně vzácné postavení AITL a prakticky chybějící literární údaje v českém písemnictví jsme se rozhodli naše zkušenosti s léčbou tohoto lymfomu zpracovat.
Soubor a metodika
Retrospektivní analýza se týká pacientů s nově diagnostikovaným AITL a hospitalizovaných na našem pracovišti v období 1/2000–12/2010. Diagnóza AITL byla stanovena podle kritérií REAL, respektive WHO klasifikace. U všech pacientů bylo zajištěno histologické a imunohistochemické vyšetření uzlin a současně bylo doplněno i molekulárně-genetické vyšetření na přítomnost klonální přestavby receptoru TCR gama. Biopsie byly odečteny zkušenými patology naší fakultní nemocnice – konzultanty Kooperativní lymfomové skupiny [7,21–23].
Chemoterapie
CHOP-21: cyklofosfamid 750 mg/m2 i.v. 1. den, doxorubicin 50 mg/m2 i.v. 1. den, vinkristin 2 mg i.v., prednison 60 mg/m2 p.o. 1.–5. den.
DHAP: cisplatinum 100 mg/m2 i.v. 1. den, cytarabin 4 000 mg/m2 i.v. 2. den, dexamethason 40 mg/den p.o. 1.–4. den.
BEAM s autologní transplantací periferních krvetvorných buněk: BiCNU 300 mg/m2 i.v. jedenkrát denně v den –6, etoposid 100 mg/m2 i.v. dvakrát denně v den –5 až –2, cytosin-arabinosid 200 mg/m2 i.v. dvakrát denně v den –5 až –2, melphalan 140 mg/m2 i.v. v den –1, transplantace autologního štěpu periferních krvetvorných buněk za 24 hod po aplikaci posledního cytostatika přípravy. Leukaferézy štěpu autologních periferních krvetvorných buněk byly realizovány po přípravě s vysokodávkovaným cyklofosfamidem (3 g/m2 i.v. 1. den) s následnou aplikací filgrastimu 10 µg/kg/den do dne sklizně.
FLU/MEL s alogenní transplantací periferních krvetvorných buněk: fludarabin 30 mg/m2 i.v. jedenkrát denně 4 dny, melfalan 140 mg/m2 i.v. jedenkrát denně den před transplantací alogenního štěpu periferních krvetvorných buněk.
Léčebná odpověď
Léčebná odpověď byla hodnocena podle kritérií National Cancer Institute (NCI). Doba celkového přežití (overall survival – OS) byla stanovena jako počet měsíců od stanovení diagnózy do úmrtí. Doba přežití do události (event-free survival – EFS) byla stanovena jako počet měsíců od stanovení diagnózy do první progrese, relapsu nebo úmrtí.
Statistická analýza
Statistické analýzy byly provedeny s využitím programu GraphPad InStat (GraphPad Software). Byly doplněny Kaplan-Maierovy křivky přežití a log rang test, přičemž významnost sledovaných rozdílů byla stanovena na hladině významnosti 5 % (p = 0,05).
Výsledky
Do analýzy bylo zařazeno celkem 12 (1,9 %) pacientů s nově diagnostikovaným AITL ze souboru celkem 631 pacientů s nově diagnostikovaným non-hodgkinským lymfomem (NHL) a hospitalizovaných na našem pracovišti v období 1/2000–12/2010.
Medián věku pacientů byl 64 (43––82) let. Uzlinové postižení bylo přítomno u všech pacientů (100 %), dále se vyskytovala hepatomegalie (50 %), splenomegalie (33 %), ascites a/nebo hydrothorax (25 %) a infiltrace kostní dřeně (25 %), autoimunitní hemolytická anémie (25 %). Klinické „B“ příznaky (noční pocení, horečky, hubnutí) se vyskytovaly u 66 % pacientů. Bližší charakteristiky souboru jsou uvedeny samostatně v tab. 1.
Table 1. Charakteristiky souboru pacientů s nově diagnostikovaným angioimunoblastickým T-lymfomem (AITL) v období 1/2000–12/2010. 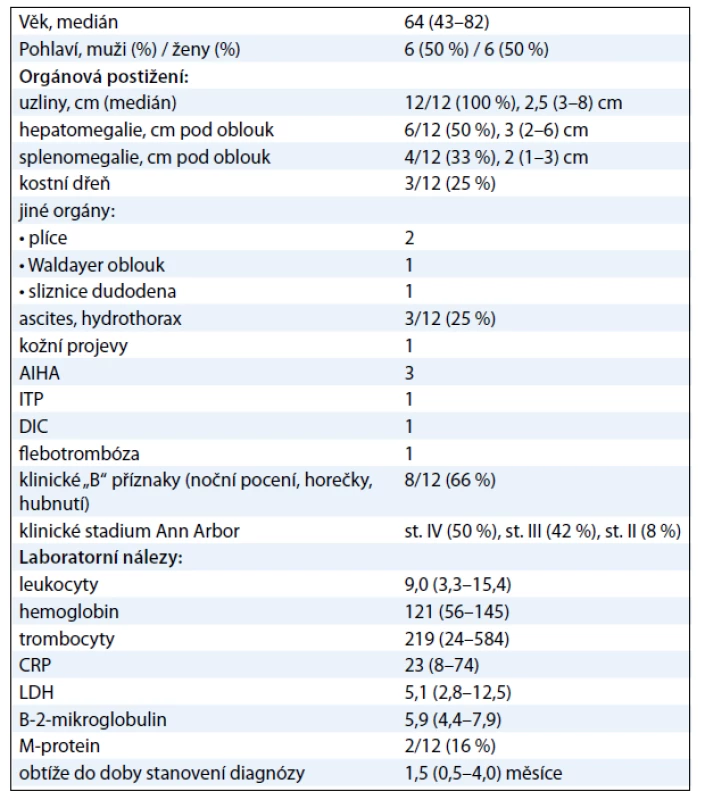
U 2 pacientů s řadou dalších onemocnění a ve věku 81 a 82 let byla zahájena kortikoterapie s prednizonem v úvodní dávce 1 mg/kg/den po dobu 5 dní a dále s redukcí na 10–20 mg/den denně po dobu efektu. Kortikoterapie vedla jen k částečné a přechodné regresi uzlinového postižení nebo klinických „B“ příznaků v trvání do 6 měsíců. Další léčba pacientů pak byla již čistě symptomatická.
Celkem 10 pacientů ve věku 43–72 let podstoupilo indukční chemoterapii se šesti cykly CHOP-21. Po zahájení léčby došlo u všech k ústupu celkových „B“ příznaků a po ukončení indukční série bylo dosaženo následné léčebné odpovědi: stabilní nemoc 2/10 (20 %), parciální remise 5/10 (50 %), kompletní remise 3/10 (30 %).
U všech 3 pacientů v kompletní remisi (CR) po indukci CHOP nebyla dále doplněna žádná další terapie v rámci první linie. U pacientky v původním věku 54 let nadále trvá první kompletní remise 151 měsíců od ukončení indukce. U jednoho pacienta ve věku 64 let byla vysokodávkovaná chemoterapie BEAM s autologní transplantací kontraindikována pro celkově nepříznivý stav s dalšími onemocněními a tento pacient zrelaboval za 3 měsíce po ukončení indukce. U třetího pacienta ve věku 51 let došlo k relapsu za 30 měsíců po ukončení indukce a byla pak doplněna 2. série CHOP, ale již v době přijetí k plánované autologní transplantaci u něj docházelo k novému incipientnímu relapsu AITL, a po autologní transplantaci byla tedy doplněna následně ještě transplantace nepříbuzenská alogenní, přičemž tento pacient zemřel v den +102 po alogenní transplantaci na sepsi s multiorgánovým selháním.
U celkem 5 pacientů v parciální remisi (PR) po indukci CHOP byla vysokodávkovaná chemoterapie BEAM s autologní transplantací doplněna pouze u 2 pacientek s tím, že bylo u obou následně dosaženo stavu CR. U jedné pacientky ve věku 43 let trvala CR 5 měsíců a pacientka zemřela na progresi lymfomu při zdravotní neúnosnosti k intenzivní chemoterapii a druhá pacientka ve věku 67 pak zemřela ve stavu trvající CR za 33 měsíců na sekundární AML. U zbylých 3 pacientů ve věku 53, 63 a 69 let nebyla intenzifikace s autologní transplantací realizována pro floridní a časný relaps lymfomu za 1–2 měsíce po ukončení indukce, přičemž všichni pacienti zemřeli na fulminantní infekční komplikace (2× pneumonie, 1× sepse) prakticky v úvodu zahájené záchranné chemoterapie DHAP.
U 2 pacientů bylo dosaženo pouze stabilizace nemoci (SD), přičemž u pacienta ve věku 72 let byla z důvodu celkového nepříznivého stavu a dalších onemocnění indikována dále již jen symptomatická léčba. U pacientky ve věku 60 let byla obratem doplněna vysokodávkovaná chemoterapie BEAM s autologní transplantací krvetvorných buněk, po které bylo dosaženo stavu PR, a následně pak byla za 1,5 měsíce provedena příbuzenská alogenní transplantace krvetvorných buněk s redukovanou intenzitou přípravy (protokol Flu/Mel), která však již byla realizována v době počínající progrese lymfomu, a pacientka zemřela v den +7 po transplantaci na toxické komplikace a sepsi.
Alogenní transplantace krvetvorných buněk byla tedy provedena u 2 již výše uvedených pacientů. Jinak nebyla provedena a ani plánována s ohledem na vysoký věk a další onemocnění u 4/10 (40 %) chemoterapií léčených pacientů, pro úmrtí během záchranné chemoterapie u 2/10 a pro trvající CR u 2/10 pacientů.
Medián OS chemoterapií léčených pacientů byl 10 měsíců, přičemž přežití bylo statisticky signifikantně delší při dosažení stavu CR, a to buď v rámci 1. linie léčby po 6× CHOP, nebo po doplnění vysokodávkované léčby BEAM s autologní transplantací: 46 vs 6 měsíců (p = 0,0023). Medián EFS byl 8 měsíců, přičemž lepších výsledků bylo statisticky signifikantně dosaženo rovněž u pacientů s dosažením CR v rámci 1. linie léčby: 43 vs 6 měsíců (p = 0,0052), viz grafy 1, 2.
Graph 1. Pravděpodobnost přežití do události – relaps, progrese, úmrtí (EFS) v měsících u pacientů s AITL léčených chemoterapií (n = 10) a s ohledem na dosaženou (CR) nebo nedosaženou kompletní remisi (non-CR) v rámci první linie léčby. 
Graph 2. Pravděpodobnost celkového přežití (OS) u pacientů s AITL léčených chemoterapií (n = 10) a s ohledem na dosaženou (CR) nebo nedosaženou kompletní remisi (non-CR) v rámci první linie léčby. 
Diskuze
Angioimunoblastický T-lymfom (AITL) je relativně vzácná a obecně prognosticky nepříznivá malignita. V předkládané analýze jsme se snažili shrnout naše poznatky a zkušenosti s léčbou pacientů s tímto onemocněním. Limitací práce je její retrospektivní charakter a současně malý soubor pacientů jednoho pracoviště, což je nutné mít na paměti při hodnocení výsledků. Na druhé straně jde ale o poměrně homogenní skupinu pacientů s jasně definovanou indukční léčbou a s výsledky, které svým charakterem bezpochyby ukazují na rizikovost této malignity. Navíc s výjimkou učebnic je problematika AITL v českém písemnictví prakticky nepublikovaná.
Četnost výskytu AITL 1,9 % v našem souboru pacientů s NHL je srovnatelná s údaji z velkých registrů, kde byla udávána v rozmezí 0,5–1,2 % [7,8]. Lymfom v naší skupině charakteristicky postihoval spíše starší pacienty s mediánem věku 64 (43–82) let, vždy bylo přítomno postižení lymfatických uzlin, často hepatosplenomegalie, a celkově tak dominovala (92 %) klinická stadia III–IV doprovázená u dvou třetin pacientů také celkovými příznaky (noční pocení, horečky, hubnutí). Další doprovodné symptomy nebo poruchy nebyly vzácné a zahrnovaly vedle výskytu hydrothoraxu nebo ascitu především autoimunitní hemolytickou anémii (AIHA), trombocytopenii (ITP), výsev exantému, poruchy koagulace (DIC a flebotrombóza) a výskyt monoklonální gamapatie.
Medián období od prvních příznaků onemocnění (např. povšimnutí si zvětšených uzlin, rozvoje celkových příznaků nebo jiných problémů) byl 1,5 měsíce s maximem do 4 měsíců. Tendence k pozdějšímu diagnostickému závěru byla u pacientů s menším uzlinovým postižením, kdy jiné projevy AITL imponovaly spíše jako možné systémové zánětlivé onemocnění nebo infekce. U 3/12 (25 %) pacientů byla také nutná opakovaná excize a vyšetření uzliny při přetrvávání nebo zhoršování obtíží při původně odečteném nespecifickém histologickém nálezu lymfadenitidy. Finální diagnóza však byla u našich pacientů nakonec vždy potvrzena histologicky, imunohistochemicky a současně byla prokazována molekulárně-geneticky také přítomnost klonální přestavby receptoru TCR gama. Po stanovení diagnózy pak byli pacienti referováni ke zvážení léčby prakticky obratem.
Jako iniciální léčba byla u většiny pacientů (n = 10) zajištěna chemoterapie CHOP-21 a pouze u dvou pacientů ve věku nad 80 let kortikoterapie. Chemoterapie CHOP byla dobře tolerována a rychle vedla k ústupu projevů lymfomu. Bylo dosaženo také 30 % kompletních remisí, což je ve srovnání s efektem u jiných lymfomů málo, ale na druhé straně intenzivnější protokol ESHAP dosahoval ve studiích stavu kompletní remise také jen 33% úspěšnosti [12].
Naši pacienti, kteří dosáhli po CHOP-21 kompletní remise, měli vyšší pravděpodobnost delšího EFS. U ostatních pacientů (n = 7) s dosaženou pouze parciální remisí nebo jen stabilizací nemoci však byla další prognóza krajně nepříznivá, kdy buď s ohledem na celkový stav nebylo možné zajistit další intenzifikaci (1/7), nebo nebylo možné zajistit realizaci odběru periferních krvetvorných buněk pro novou, velmi časnou progresi nemoci (3/7) následovanou většinou pokusem o záchrannou léčbu DHAP a úmrtím. Tedy pouze u 3/7 (43 %) pacientů s potřebou další minimalizace nemoci po indukci bylo možné zajistit a realizovat vysokodávkovanou chemoterapii BEAM s autologní transplantací s tím, že dosažení stavu CR opět zvýšilo pravděpodobnost delšího EFS. Z pohledu absolutních hodnot lze však hodnoty EFS i OS u pacientů s dosažením CR považovat rovněž za prognosticky nepříznivé (hodnota mediánu EFS a OS: 46 a 43 měsíců).
Naše zkušenosti s intenzifikací v podobě vysokodávkované chemoterapie BEAM s autologní transplantací krvetvorných buněk nebo s alogenní transplantací krvetvorných buněk po přípravě Flu/Mel jsou tedy omezené, a to především z důvodu nemožnosti je vůbec realizovat pro nepříznivý stav pacienta, jeho věk či progresi nemoci a úmrtí během záchranné léčby. Lze spekulovat, do jaké míry by případně jiný postup u konkrétního pacienta mohl vést k lepšímu efektu léčby.
V léčbě se jako standardní uplatňuje nadále protokol chemoterapie CHOP, i když částečný efekt mohou mít i některé jiné léky, jako např. fludarabin, interferon alfa, kortikoidy [9]. Využití intenzivnějších protokolů v indukční léčbě, jako jsou např. ESHAP, ACVBP, CHOP, nepříznivou prognózu pacientů zásadněji neovlivnilo [12–15]. Významný vliv na zlepšení přežívání pacientů nebyl pozorován ani při zajištění konsolidace s autologní transplantací krvetvorných buněk [11,16], nicméně z výsledků retrospektivní analýzy EBMT [17] u 146 pacientů přeci jenom vyplývá, že doba přežití bez progrese po 4 letech byla 56 % u pacientů autologně transplantovaných v kompletní remisi a 23 % u pacientů s chemorefrakterní nemocí. Lepší výsledky po autologní transplantaci u selektovaných pacientů v kompletní remisi udávají i Reimer et al [18] s celkovým přežitím 71 % ve 3 letech. Zkušenosti s alogenní transplantací jsou omezené a u mladých pacientů přinesla tato léčba efekt v podobě OS 64 % ve 3 letech [17,19,20].
Na základě našich zkušeností a údajů z dostupné literatury se domníváme, že u pacientů ve věku do 60 let nebo starších v dobré kondici by bylo vhodné při sebemenším podezření na omezený efekt úvodní chemoterapie CHOP-21 zajistit obratem intenzifikaci léčby a zvažovat podání jednoho až dvou cyklů DHAP se současným pokusem o odběr autologních krvetvorných buněk. U pacientů s velmi dobrou léčebnou odpovědí a dosažením kompletní remise po indukci lze uvažovat o možnosti dlouhodobější remise, nicméně se domníváme, že obratem by měl být rovněž doplněn odběr periferních krvetvorných buněk a následně by bez zbytečné prodlevy měla proběhnout konsolidace s vysokodávkovanou chemoterapií BEAM s autologní transplantací. Současně by mělo být vždy se stanovením diagnózy AITL ihned zahájeno vyhledávání dárce krvetvorných buněk v rodině a pátrání po dostupnosti dárců v registrech pro případ potřeby alogenní transplantace při neuspokojivém léčebném průběhu (nedosažení kompletní remise) nebo pro případ relapsu nemoci. I tak je však nutné mít na vědomí, že průběh onemocnění je velmi variabilní a ve většině případů je prognóza krajně nepříznivá s mediánem přežívání méně než 3 roky i v případě zajištění intenzivní léčby
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Samuel Vokurka, Ph.D.
Hematologicko-onkologické oddělení
FN Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: vokurka@fnplzen.cz
Obdrženo: 17. 5. 2011
Přijato: 24. 8. 2011
Sources
1. Swerdlow SH, Campo E, Harris NL et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th ed. Lyon: World Health Organization 2008.
2. Frizzera G, Moran EM, Rappaport H. Angio-immunoblastic lymphadenopathy with dysproteinaemia. Lancet 1974; 1(7866): 1070–1073.
3. Lukes RJ, Tindle BH. Immunoblastic lymphadenopathy. A hyperimmune entity resembling Hodgkin’s disease. N Engl J Med 1975; 292(1): 1–8.
4. Lennert K. Nature, prognosis and nomenclature of angioimmunoblastic (lymphadenopathy, lymphogranulomatosis X or T-zone lymphoma). Dtsch Med Wochenschr 1979; 104(35): 1246–1247.
5. Shimoyama M, Minato K. Clinical, cytological and immunological analysis of T-cell type lymphoid malignancies: a classification of T-cell type lymphoid malignancy (author’s transl). Rinsho Ketsueki 1979; 20(9): 1056–1069.
6. Harris NL, Jaffe ES, Stein H et al. A revised European--American classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group. Blood 1994; 84(5): 1361–1392.
7. Trněný M, Vášová I, Pytlík R et al. Distribuce podtypů non-hodgkinského lymfomu v České republice a jejich přežití. Klin Onkol 2007; 20(5): 341–348.
8. The Non-Hodgkin’s Lymphoma Classification Project. A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin’s lymphoma. Blood 1997; 89(11): 3909–3918.
9. de Leval L, Gisselbrecht C, Gaulard P. Advances in the understanding and management of angioimmunoblastic T-cell lymphoma. Br J Haematol 2010; 148(5): 673–689.
10. Armitage J, Vose J, Weisenburger D. Internatitonal T-Cell Lymphoma Project. International peripheral T-cell and natural killer/T-cell lymphoma study: pathology findings and clinical outcomes. J Clin Oncol 2008; 26(25): 4124–4130.
11. Mourad N, Mounier N, Brière J et al. Clinical, biologic, and pathologic features in 157 patients with angioimmunoblastic T-cell lymphoma treated within the Groupe d‘Etude des Lymphomes de l‘Adulte (GELA) trials. Blood 2008; 111(9): 4463–4470.
12. Delmer A, Fitoussi O, Gaulard P et al. A phase II study of bortezomib in combination with intensified CHOP-like regimen (ACVBP) in patients with previously untreated T-cell lymphoma: Results of the GELA LNH05–1T trial. J Clin Oncol 2009; 27 (Suppl 15): 8554.
13. Escalón MP, Liu NS, Yang Y et al. Prognostic factors and treatment of patients with T-cell non-Hodgkin lymphoma: the M. D. Anderson Cancer Center experience. Cancer 2005; 103(10): 2091–2098.
14. Tilly H, Lepage E, Coiffier B et al. Intensive conventional chemotherapy (ACVBP regimen) compared with standard CHOP for poor-prognosis aggressive non-Hodgkin lymphoma. Blood 2003; 102(13): 4284–4289.
15. Karakas T, Bergmann L, Stutte HJ et al. Peripheral T-cell lymphomas respond well to vincristine, adriamycin, cyclophosphamide, prednisone and etoposide (VACPE) and have a similar outcome as high-grade B-cell lymphomas. Leuk Lymphoma 1996; 24(1–2): 121–129.
16. Mounier N, Gisselbrecht C, Brière J et al. All aggressive lymphoma subtypes do not share similar outcome after front-line autotransplantation: a matched-control analysis by the Groupe d’Etude des Lymphomes de l’Adulte (GELA). Ann Oncol 2004; 15(12): 1790–1797.
17. Kyriakou C, Canals C, Goldstone A et al. High-dose therapy and autologous stem-cell transplantation in angioimmunoblastic lymphoma: complete remission at transplantation is the major determinant of Outcome-Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2008; 26(2): 218–224.
18. Reimer P, Rüdiger T, Geissinger E et al. Autologous stem-cell transplantation as first-line therapy in peripheral T-cell lymphomas: results of a prospective multicenter study. J Clin Oncol 2009; 27(1): 106–113.
19. Le Gouill S, Milpied N, Buzyn A et al. Graft-versus-lymphoma effect for aggressive T-cell lymphomas in adults: a study by the Société Francaise de Greffe de Moëlle et de Thérapie Cellulaire. J Clin Oncol 2008; 26(14): 2264–2271.
20. Corradini P, Dodero A, Zallio F et al. Graft-versus-lymphoma effect in relapsed peripheral T-cell non--Hodgkin’s lymphomas after reduced-intensity conditioning followed by allogeneic transplantation of hematopoietic cells. J Clin Oncol 2004; 22(11): 2172–2176.
21. Vášová I, Boudová L, Trněný M et al. Primární testikulární lymfom, klinickopatologická multicentrická retrospektivní studie a data registru Kooperativní lymfomové skupiny (KLS). Klin Onkol 2007; 20(5): 302–306.
22. Boudová L, Kazakov D, Jindra P et al. Primární kožní velkobuněčný anaplastický T-lymfom s koexpresí CD30 a CD56, bohatý na neutrofily a histiocyty. Popis raritního případu s přehledem literatury. Klin Onkol 2007; 20(3): 260–263.
23. Fabian P, Boudová L. Poznámky ke 4. vydání klasifikace lymfomů WHO. Klin Onkol 2009; 22(3): 121–122.
24. Quintanilla-Martinez L, Ott G. Angioimmunoblastic T-cell lymphoma. In: Jaffé ES, Harris NL, Vardiman JW et al (eds). Hematopathology. Philadelphia: Elsevier 2011.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2012 Issue 3-
All articles in this issue
- Nové a klinicky využívané onkomarkery karcinómu močového mechúra
- Reprodukční funkce u onkologických pacientek
- Genetické pozadí ototoxicity cisplatiny
- Triple-negativní karcinom prsu: analýza souboru pacientek diagnostikovaných a/nebo léčených v Masarykově onkologickém ústavu v letech 2004 až 2009
- Angioimunoblastický T-lymfom (AITL) jako velmi nepříznivá malignita – zkušenost centra
- Pacient s B-CLL s anamnézou darování krvetvorných buněk nepříbuznému pacientovi – retrospektivní sledování vývoje nemoci a důsledky pro příjemc
- Výhody jednotlivých zobrazovacích metod pro diagnostiku a sledování aktivity mnohočetného myelomu
- Pozitronová emisní tomografie a klinické prediktory přežití u primárních extragonadálních germinálních nádorů
- Faktor stimulující kolonie granulocytů (G-CSF) zrychluje hojení vlhké deskvamace kůže vyvolané radiací
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Angioimunoblastický T-lymfom (AITL) jako velmi nepříznivá malignita – zkušenost centra
- Triple-negativní karcinom prsu: analýza souboru pacientek diagnostikovaných a/nebo léčených v Masarykově onkologickém ústavu v letech 2004 až 2009
- Nové a klinicky využívané onkomarkery karcinómu močového mechúra
- Faktor stimulující kolonie granulocytů (G-CSF) zrychluje hojení vlhké deskvamace kůže vyvolané radiací
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

