-
Medical journals
- Career
Harmonizace v klinické laboratoři a charakter externího hodnocení kvality v blízké budoucnosti
Authors: B. Friedecký 1; J. Kratochvíla 2; A. Jabor 3
Authors‘ workplace: ÚKBD FN Hradec Králové 1; SEKK spol. s r. o., Pardubice 2; OKB, PLM, IKEM Praha 3
Published in: Klin. Biochem. Metab., 30, 2022, No. 2, p. 32-36
Overview
Předmětem sdělení jsou předpokládané změny v charakteru a metodice programů externího hodnocení kvality, korespondující s jeho dvěma hlavními trendy pro blízkou budoucnost: s harmonizací měřících postupů a s inovovanými normami a požadavky na in vitro diagnostika, jak jsou shrnuty v materiálu IVDR (in vitro device diagnostics requirements). Konkrétně jde o důslednou standardizaci a harmonizaci výsledků měření opírající se o metrologickou návaznost kalibrace a hrající roli nástroje dozoru nad kvalitou nejen pro klinické laboratoře, ale i pro výrobce souprav a zařízení IVD. Komutabilita kontrolních materiálů, omezenost postupů při použití kontrolních materiálů nekomutabilních, způsoby stanovení a pravidla aplikace specifikací kvality analytických metod (hodnot APS) k tomu patří. Výhody, možnosti a meze použití biologických variabilit jsou dalším důležitým faktorem harmonizačního potenciálů EHK. V době digitalizace klinických laboratoří nemůže být v programech EHK opomíjena preanalytická a postanalytická fáze měření. Nutnost kontinuálních změn EHK je jasná a odpovídá soudobému trendu vývoje. Je třeba provádět potřebné změny kontinuálně, evolučně a vhodným tempem tak, aby bylo dosahováno pokroku maximálně možného v odpovídajícím čase.
Klíčová slova:
Externí hodnocení kvality – harmonizace – metrologická návaznost – IVDR 746 – komutabilita kontrolních materiálů – APS
Úvod
Programy EHK jsou důležitou součástí zajišťování (assurance) kvality laboratorní činnosti. Jsou určeny:
• pro účastníky programů EHK
• pro výrobce testovacích souprav, přístrojových platforem a prověřování a analytických metod
• pro komunitu zdravotnických pracovníků v klinických laboratořích
Jen náležitá úroveň EHK poskytuje relevantní informace, přesahující významem pouhý nezbytný úřední dokument.
Jako zásadní je třeba zdůraznit:
• Účastníci programů EHK musí být orientování o výsledcích měření a jejich hodnocení hlouběji, než jen jako prostředek zisku certifikátu nebo potvrzení účasti.
• Výrobci by měli používat výsledků EHK i jinak, než jen jako nástroj “public relation”.
• Programy EHK by měly být nastaveny pro potřeby zdravotní péče, a ne pro potřeby úřední garance činnosti.
Zažíváme přelomovou dobu, kdy se ukazuje, že je čas uskutečnit řadu změn k dosažení uvedeného cíle. Hlavní motivace ke změnám souvisí s procesy harmonizace výsledků zdravotnických laboratoří.
Princip a cíl EHK
Obecný princip EHK by měl být v úplnosti založen zejména na:
• srovnání výsledků měření (či hodnocení) účastníka s ostatními
• srovnání výsledků účastníka se správnými/pravdivými hodnotami výsledků měření
• srovnání výsledků účastníka s požadavky klinických a analytických Doporučení
• vyhodnocení správnosti/pravdivosti výsledků výrobců různých IVD diagnostik (In vitro medical devices)
• porovnání detekce, kvantifikace i srovnání kvalitativních měření a vysvětlení systematických bias a přesnosti.
Hlavním cílem EHK je, být jedním z nezbytných nástrojů harmonizace postupů a metod měření: Činnost programů EHK u nás i ve světě se bohužel doposud zabývá harmonizací výsledků měření spíše jen okrajově.
Harmonizace a její klíčové zdroje
V roce 2020 byly publikovány dvě základní mezinárodní normy (ISO), definující metrologickou návaznost měření a harmonizační protokoly v klinických laboratořích [1, 2] a to:
• ISO 17511 : 2020 (https://csnonline.agentura-cas. cz/default.aspx)
• Popisuje metrologickou návaznost kalibrace a výsledků měření u standardizovaných metod měření.
• ISO 21151 : 2020 (https://csnonline.agentura-cas. cz/default.aspx)
• Popisuje harmonizační protokoly měření u analytů, parametrů a metod bez existence referenčních systémů.
Tyto normy jsou přelomové pro in vitro diagnostika (IVD), pro jejich výrobce a následně i pro podobu programů EHK.
Podmiňují přechod od staré direktivy IVD MD 98/79 k nové IVDR 2017-746 (In Vitro diagnostics regulation) [3, 4]. Tento přechod má být z rozhodující části realizovaný do konce roku 2025 a do té doby by měla být provedena i úprava programů EHK.
Z mezinárodních institucí, o které se opírá program harmonizace, metrologické návaznosti a následně i žádoucí podoba programů EHK, je třeba uvést především IFCC (International Federation of Clinical Chemistry and Laboratory Medicine) a JCTLM (Joint Committee on Traceability in Laboratory Medicine) a zejména pak aktuálními daty a konkrétními, aktualizovanými informacemi bohatou ICHCLR (International Consortium for Harmonization of Laboratory Results), na kterém se podílí řada organizací z oblasti laboratorní medicíny AACC, IFCC, EQALM a další (www.harmonization.net). Její data by měla patřit k zásadním materiálům supervize výsledků hodnocení programů EHK včetně programů SEKK.
Preanalytická EHK
Programy EHK byly vytvořeny původně k hodnocení analytických procesů, ale logicky by měly zahrnovat celkový proces měření a jeho užití, tedy preanalytický (část získání, přípravy a identifikace analytického vzorku) a rovněž postanalytický (jak bylo s výsledkem měření naloženo po jeho dodání žadateli) aspekt.
Preanalytický aspekt EQA je instruktivně popsán ve skandinávské práci [5].
Jeho strukturu lze charakterizovat následovně:
• Dotazníky na téma kritérií odmítnutí vzorků a reakce klinických pracovišť
• Vzorky k hodnocení interference (sérové indexy)
• Průběžná kvantitativní hodnocení indikátorů kvality.
Dotazníky na téma kritérií odmítnutí vzorků mohou vycházet z existujícího doporučení ČSKB (Česká společnost klinické biochemie). Vzorky a testování a hodnocení interference jsou nově již realizované (i v programu SEKK) hodnocením sérových indexů (lipemie, ikterita, hemolýza). Kvantitativní analýza preanalytických indikátorů kvality by měla být samozřejmou součástí programů EHK, například posouzení a celkové vyhodnocení výročních dat jednotlivých účastníků. Tady by bylo možné představit si úzkou spolupráci poskytovatelů EHK s akreditačními a autorizačními orgány.
Analytická EHK
Klíčovými problémy programů EHK jsou:
• Kontrolní materiály a jejich vlastnosti
• Vztažné/cílové hodnoty
• Kritéria hodnocení účastníků - APS (analytical performance specifications)
Komutabilní kontrolní materiály
Komutabilita je vlastností RM a kontrolního materiálu a je definovaná přiměřeností matrice a těsností shody projevující se ekvivalencí matematických vztahů mezi výsledky různých postupů měření u RM a u reprezentativních typů vzorků, které mají být měřeny. Komutabilita referenčních a kontrolních materiálů se testuje podle postupů, publikovaných pracovní skupinou IFCC pro komutabilitu jako míra shody (bias) kontrolního (referenčního) materiálu se souborem nativních lidských biologických vzorků s dostatečným rozsahem hodnot obsahu/koncentrací [6]. Komutabilita má být verifikovaná, ne pouze proklamovaná (ISO 17511 : 2020). Aplikace komutabilního materiálu v programu EHK přináší řadu významných výhod. Dovoluje:
• simultánní hodnocení bias jak účastníků, tak i metod a testovacích souprav a přístrojových platforem výrobců
• možnost agregace výsledků různých programů EHK a různých poskytovatelů EHK
• možnost odvození APS a RCV (kritická referenční změna) z biologických variabilit, uvedených v databázi EFLM (European Federation of Clinical Chemistry and Laboratory Medicine; dostupné na: https:// biologicalvariation.eu).
Nově plánovaná agregace výsledků EQALM-HALMA je popsána zatím na případu sérového kreatininu, hodnoceného v pěti zemích komutabilními kontrolními materiály [7]. Program EQALM-HALMA (European Committee for External Quality Assessment in Laboratory Medicine – Harmonization of Measurands in Laboratory Medicine through Data Aggregation) plánuje agregaci výsledků různých programů EHK postupně pro všechny standardizované analyty a parametry. Zdroje poznatků EQALM-HALMA by měly mít později klíčový význam v hodnocení výsledků EHK. Stejně tak Program Eur-HbA1c (2021-2022) pro stanovení glykovaného hemoglobinu HbA1c (proběhl již třetí cyklus za účasti více než 5000 účastníků a 32 poskytovatelů EHK z 30 zemí (HbA1c trial EQA organisers).
V Tabulce 1 je uvedeno několik významných mezinárodních referenčních systémů měření, sloužících jako opory harmonizace řady klíčových analytů. V Tabulce 2 je uveden seznam kontrolních programů CAP (College of American Pathologists) používajících k provádění EHK komutabilních kontrolních materiálů s metrologickou návazností kalibrace, možných klasifikovat nejen úspěšnost laboratoře, ale i verifikovat použité metody měření.
Table 1. Reference systems-scientific base of harmonization measurement and EQA of laboratories and methods 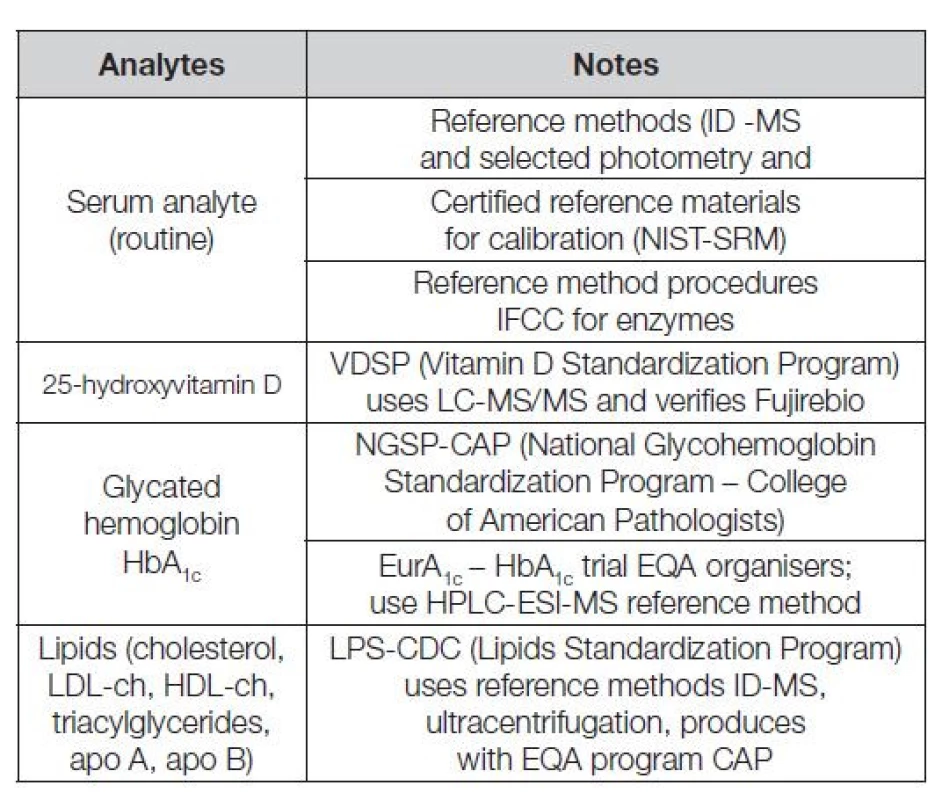
Table 2. EQA program CAP based on commutable materials and standardized methods with accuracy programs 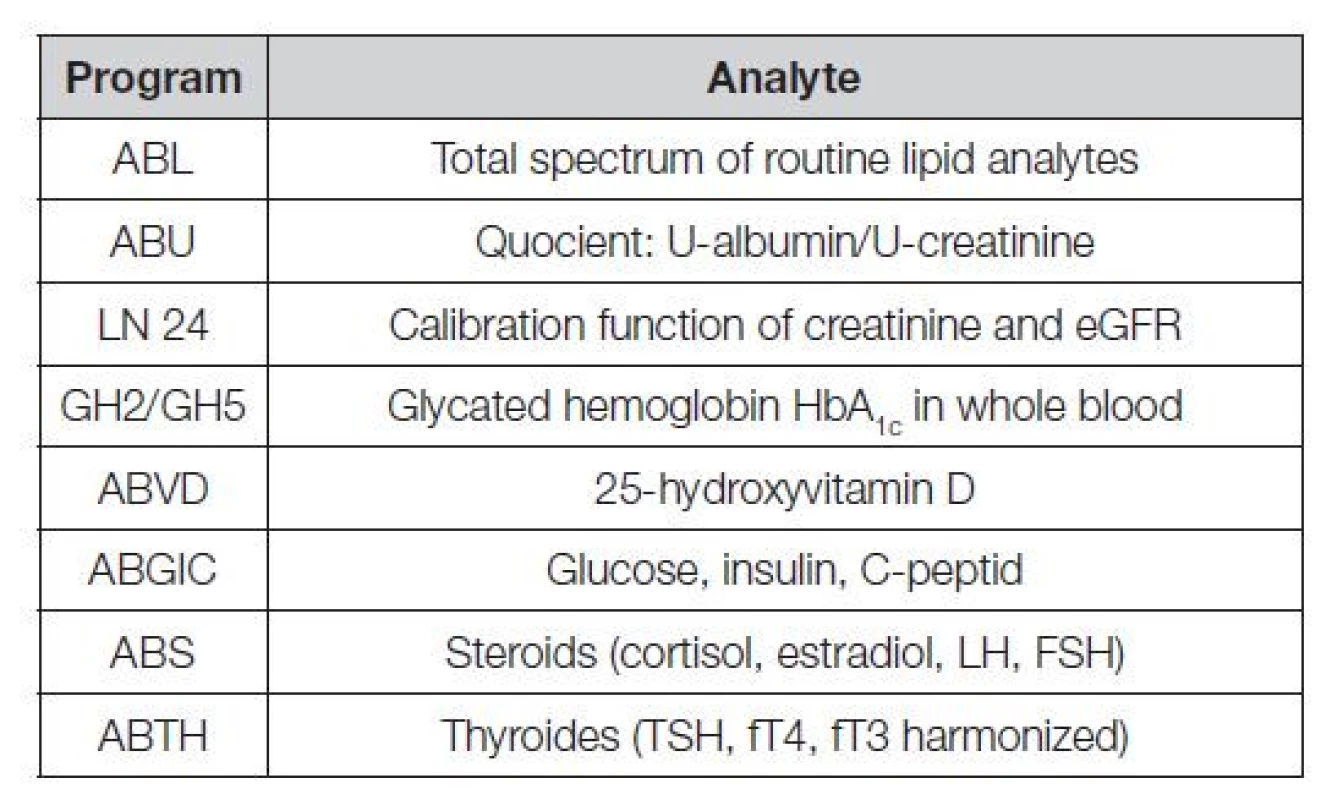
Nekomutabilní kontrolní materiály
Jsou sice obecně výhodnější z hlediska přístupnosti, stability a logistiky, ovšem za cenu mnoha problémů. Velkým problémem jsou někdy vztažné hodnoty, odvozované na bázi středních hodnot metodických skupin (peer-groups). Definice skupin (per group values) jsou často naprosto vágní a běžně dochází k jejich ustanovování téměř “Ad libitum”, obvykle v zájmu výrobců a nadměrné blahosklonnosti k účastníkům. Nedostatek a nepřístupnost komutabilních kontrolních materiálů v postačujícím množství podmiňuje nutnost používání nekomutabilních kontrolních materiálů přes jejich uvedené nevýhody i v budoucnosti. Jako potřebné se v tomto případě zdají některé doposud nepraktikované zásady:
• upřesnit a redukovat počet a druh peer groups skupin na odůvodněné minimum
• komentovat při hodnocení EHK příčiny rozdílů mezi skupinami, jejich trendy v čase a možné následky v interpretaci.
V Tabulce 3 jsou stručně shrnuty rozdíly mezi komutabilními a nekomutabilními kontrolními materiály. Vývoji analytických technologií v nových oborech laboratorní medicíny (metabolomika, sekvenace, genomika), by se neměl funkční program EHK vyhýbat. Lze předpokládat, že v této oblasti bude hodnocení výsledků založeno na krátkých expertízách, propojujících analytické výsledky s postanalytickou fází, jak to již vidíme v programech EHK hodnotících analyty DNA, RNA (zejména cfDNA a ctDNA).
Table 3. Commutable vs non commutable control materials 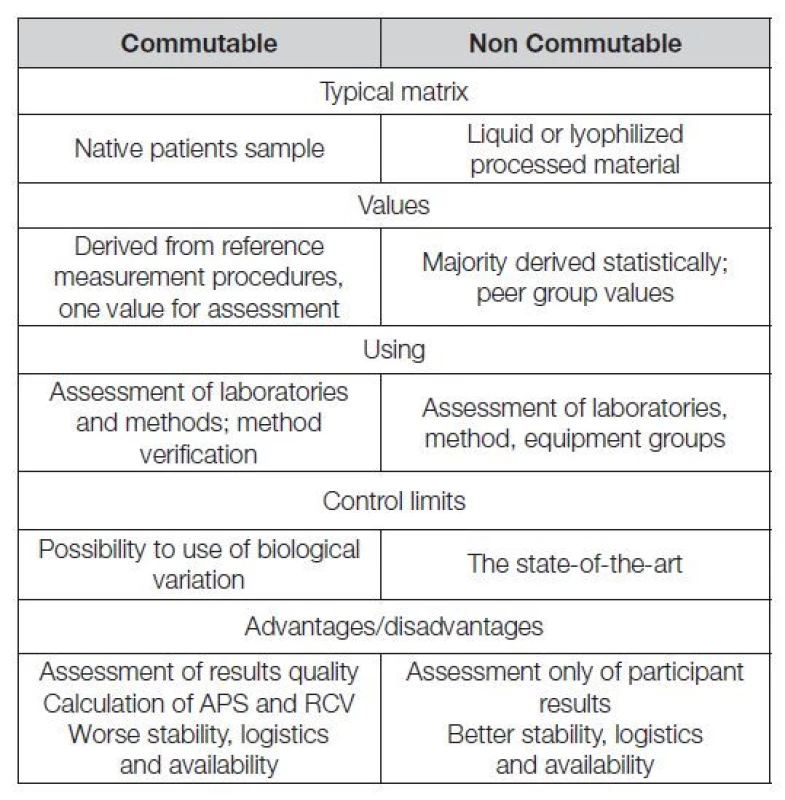
Vztažné hodnoty a specifikace analytické kvality (hodnoty APS) v programech EHK
Podle milánského protokolu 2014, vypracovaného na 2. strategické konferenci IFCC roce 2014 jsou hodnoty APS odvozeny z [8]:
• klinických požadavků
• biologické variability
• state-of-the-art.
Použití vztažných hodnot, odvozených z biologických variabilit umožňuje někde již dostatečně bohatá a stále aktualizovaná databáze-EuBIVAS (European biological variation study; [9]). Je s ní počítáno v plánovaných agregačních studiích EQALM – HALMA a je velmi vhodné pracovat s ní edukačně i v programech EHK.
Vztažné hodnoty odvozené z biologických variabilit by měly být využívané (minimálně k edukačním účelům) v programech EHK především u hodnocení analytů a parametrů s ohledem na požadavky mezinárodních Doporučení. Sem patří zejména i česká Doporučení a doporučení ČSKB pro diagnostiku diabetu, chronické ledvinové choroby, dyslipidémie, poruchy kostního metabolismu, akutní koronární syndromy, poruchy funkcí štítné žlázy a další. Také sem patří vztažné hodnoty, související s poznatky, výsledky a požadavky některých mezinárodních referenčních systémů. Glykovaný hemoglobin HbA1c (systémy EurA1c, NGPS) nebo vitamin D (systém VDSP). Propojení EHK a databáze EuBIVAS lze realizovat kalkulátorem hodnot APS a RCV (reference change value), kterým je tato databáze vybavena. Tabulka 4 demonstruje několik příkladů možného použití u vybraných standardizovaných měření analytů. Zatímco hodnoty APS jsou nezávislé na preciznosti v konkrétní laboratoři, hodnoty RCV jsou na ní závislé významně (v Tabulce 4 je to zřejmé z několika příkladů, kdy jsou použity dvojí hodnoty analytické preciznosti).
Table 4. APS and RCV values of standardized analytes from database EuBIVAS for 95% confidence interval 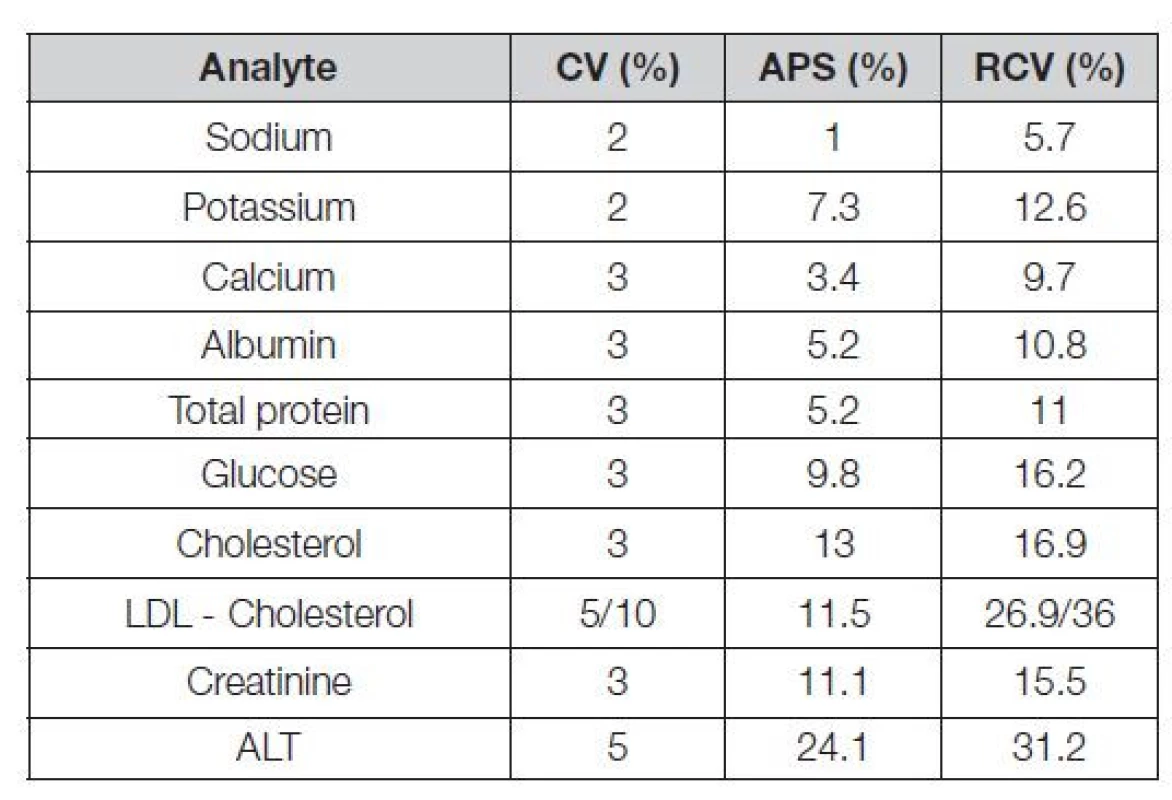

Comment:
• CV – coefficient of variation
• APS – analytical performance specifications
• RCV – reference change value
• Italica - values obtained by Roche testkits;
• for some analytes and two determined CV, two different RCV values are givenKlíčový význam si i nadále podrží vztažné hodnoty typu state-of-the-art. V programu SEKK jsou to často i hodnoty Dmax (pokud neexistuje reference). Pro jejich aplikaci platí zásady, vyslovené již v odstavci o “peer group” metodických skupinách v nekomutabilních kontrolních materiálech. Měla by zde platit zásada, že přednost má možnost redukce vztažných hodnot na co nejnižší počet, ideálně na jedinou (např. CRV, RoM aj.). Ta je v případě existence metrologické návaznosti a komutability realizovaná referenčním metodickým postupem RMP (reference method procedure). V případě, že plnohodnotný referenční systém dosud neexistuje, je popsán střední hodnotou (robustním průměrem souboru).
Dosavadní přístup řady zahraničních programů (i programu SEKK) pomocí hodnot Dmax nelze považovat za univerzální a dostačující nástroj hodnocení. Dmax je jen jedno z kritérií a zdaleka není všespasitelné. Je nutné upozorňovat na situace, kdy laboratoř sice splní Dmax, ale podle APS odvozených z modelů hierarchie (včetně biologické variability) laboratoř kritéria neplní a stimulovat ji tak ve snaze najít lepší řešení (úprava, analytická metoda, přístrojová platforma aj.)
Postanalytická EHK
Informace o dopadech a reakcích lékařů a klinických oddělení na laboratorní výsledky, zejména v oblastech aplikace mezinárodních Doporučení, je zatím řešena jen sporadicky a okrajově, přes její extrémní důležitost. Rešerše literatury napovídá, že jde o slabé místo procesu EHK v celosvětovém měřítku. Inspirativní ukázkou dlouhodobého hodnocení postanalytické fáze jsou studie CARMAGUE (kardiální markery).
Uvažovaná spolupráce s NASKL (Národní autorizační středisko pro klinické laboratoře), jejímž předmětem by mělo být posuzování kvality elektronického přenosu dat, se zdá být velmi žádoucí.
Praktické aspekty [10, 11]
• pojmout a rekonstruovat programy EHK jako nástroje harmonizace výsledků
• akceptovat normy metrologické návaznosti a harmonizační protokoly
• uplatňovat zvýšený důraz na pre a post-analytické procesy
• strukturalizovat a aktualizovat komentáře supervizorů tak, aby sledovaly soudobé trendy v oblasti měření, klinické interpretace a stavu metrologické návaznosti
• používat komutabilní kontrolní materiály všude, kde je to možné
• aktivně přistupovat k formulaci vztažných hodnot a komentářům výsledků u nekomutabilních kontrolních materiálů.
Komerční programy EHK
Organizované řadou globálních výrobců používají většinou nekomutabilní kontrolní materiály (vhodné vždy pro EHK organizujícího výrobce) a s velmi volně formulovanými vztažnými hodnotami, v naprosté většině typu “peer group“. Jsou vytvářeny a prováděny tak, aby umožnily co nejvyšší způsobilost účastníků a co nejnižším úsilím aby pro výrobce vyprodukovaly zpětně využitelná big data, získaná takto zdarma. Citelně jim chybí princip „třetí strany“, základní předpoklad objektivity.
Autoři prohlašují, že nejsou ve střetu zájmů
Do redakce došlo 21. 3. 2022
Adresa pro korespondenci
RNDr. Bedřich Friedecký, Ph.D.
Střelničná 1680
182 00 Praha 8
e-mail: friedecky@sekk.cz
Sources
1. ČSN EN ISO 17511 : 2020 In vitro diagnostics medical devices. Requirements for establishing metrological traceability of values assigned to calibrators, trueness control materials and human samples.
2. ČSN ISO 21151 : 2021 IVD MD Measurement of quantities in samples of biological origin. Requirements for international harmonisation protocols establishing metrological traceability of values assigned to calibrators and human samples.
3. Regulation (EU) 2017/746 of the European Parliament and of the Council of 5. April 2017 on in vitro diagnostic medical devices and repealing Directive 98/79/EC and Commission Decision 2010/227/EU. Official Journal of the European Union 2017; May 5.: L 117/L 176.
4. Myers, G. L., Pierson-Perry, J., Beastell, G. H. The European Union In Vitro Diagnostic Medical Device Regulation 2017/746 (IVDR): overview and implications for the future of laboratory medicine. eNews-IFCC, 2019, 1, s. 20-24.
5. Kristensen, G. B., Aakre, K. M., Kristoffersen, A. H., Sandberg, S. How to conduct external quality assessment schemes for the pre-analytical phase? Biochem. Med., 2014, 24(1), s. 114-122.
6. Nilsson, G., Budd, J. R., Greenberg, N., Delatour, V., Rej, R. et al. IFCC working group for assessing commutability. Part 2: Using the Difference in Bias Between a Reference Material and Clinical Samples. Clin. Chem., 2018, 64(3), s. 455-464.
7. van der Hagen, E. A. E., Weykamp, C., Sandberg, S., Stavelin, A. V., MacKenzie, F. Feasibility for aggregation of commutable external quality assessment results to evaluate metrological traceability and agreement among results. Clin. Chem. Lab. Med., 2021, 59, s. 117-125.
8. Sandberg, S., Fraser, C. G., Horvath, A. R., Jansen, R., Jones, G. Et al. Defining analytical performance specifications consensus statement from the 1st strategic conference of the European federation of clinical chemistry and laboratory medicine. Clin. Chem. Lab. Med., 2015, 53, s. 833-835.
9. Carobene, A., Aarsand, A. K., Barlett, W. A., Coskun, A., Diaz-Garzon, J. et al. The European biological variation study (EuBIVAS): a summary report. Clin. Cherm. Lab. Med., 2021, https://doi.org/10.1515/cclm - 2021-0370.
10. Badrick, T., Miller, G. W., Panteghini, M., Delatour, V., Berhall, H., MacKenzie, F. et al. Interpreting EQA - -Understandaing Why Commutability of Materials Matter. Clin. Chem., 2022, doi: 10.1093/clinchem/hvac002.
11. Jones, G. R. D., Delatour, V., Badrick, T. Metrological traceability and clinical traceability of laboratory results - the role of commutability in external quaity assurance. Clin. Chem. Lab. Med., 2022, https://doi.org/10.1515/ cclm-2022-0038.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2022 Issue 2
Most read in this issue- Srovnatelnost výsledků vyšetření – možné postupy
- Abstrakta přednášek
- Sborník 50. celostátního sjezdu biochemických laborantů České společnosti klinické biochemie ČLS JEP
- Abstrakta posterů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

