-
Medical journals
- Career
Vitamíny u kriticky nemocných
Authors: H. Brodská; A. Kazda
Authors‘ workplace: ÚLBLD, 1. LFUK a VFN, U Nemocnice, 128 08 Praha 2
Published in: Klin. Biochem. Metab., 24, 2016, No. 3, p. 147-152
Overview
Problematika mikronutrientů u pacientů v kritických stavech je stále diskutována. A to jak samotný význam jednotlivých vitamínů a stopových prvků, tak nutnost a míra substituce, často velmi odlišná od doporučených dávek pro parenterální i enterální příjem dle aktuálních guidelines (evropské a americké společnosti pro parenterální a enterální výživu - ESPEN, ASPEN). V recentních pracích jsou často uváděny pro kriticky nemocné v sepsi dávky řádově daleko vyšší (například u selenu, vitamínu D, či u vitamínu C). Současně s tím se zvyšují nároky na monitoraci jednotlivých mikronutrientů. Rozvoj analytických metod nám sice poskytuje jisté možnosti stanovení, ale časová dostupnost je stále pro aktuální monitoraci nevyhovující. Zásadní otázkou však je, nakolik nám plazmatické hladiny dávají přiléhavou odpověď na reálný stav zásob daného mikronutrientu v těle, zda pokles hladin většiny mikronutrientů, který zjišťujeme u kriticky nemocných, je výrazem reálného deficitu, a pak je třeba je substituovat, anebo zda tento pokles reflektuje jejich redistribuci do jiných kompartmentů a je jen výrazem tíže stavu. Na problematiku stopových prvků jsme se zaměřili ve dvou článcích publikovaných v předchozích číslech Klinické biochemie a metabolismu. V tomto sdělení se budeme věnovat vitamínům, které jsou nejvíce diskutovány v kritických stavech. Tedy na vitamín D, B1, C, E a K.
Klíčová slova:
mikronutrienty, vitamíny, kriticky nemocní, oxidační stres.Úvod
Hlavní funkcí vitamínů je jejich katalytické působení v enzymových systémech, ať již jako kofaktory nebo jako součást metaloenzymů. Umožňují tak modulaci enzymových aktivit, které v intermediálním metabolismu ovlivňují využití aminokyselin, lipidů a sacharidů (vitamín C, vitamíny skupiny B). Tak například nedostatek thiaminu (vit. B1) sníží aktivitu pyruvátdehydrogenázového komplexu (PDK), ztíží se tak metabolizace pyruvátu cestou Krebsova cyklu a stav rezultuje v laktátovou acidózu. Druhou funkcí vitamínů je antioxidační aktivita, schopnost neutralizovat volné radikály (reactive oxygen, nitrogen species, ROS, RNS). Organismus má vytvořenou stratifikovanou obranu proti oxidantům. Na systému antioxidační ochrany se podílí jednak pasivní scavengery vitamín C, E, albumin, bilirubin, kyselina močová, dále enzymy podílející se na přeměně radikálů na H2O, tedy superoxidismutáza, glutathionperoxidáza (SOD, GPx) a jejich kofaktory Cu, Zn, Mn, Se. Nedostatek antioxidační ochrany vede k zrušení rovnováhy oxidantů a antioxidantů a vzniku oxidačního stresu.
U kriticky nemocných se zvyšuje výrazně energetický metabolismus, eskaluje produkce volných radikálů, a tak se enormně zvyšují nároky na obě funkce vitamínů. Logickým důsledkem je pokles většiny z nich. Snížení plazmatických hladin vitamínů se ještě prohlubuje tíží stavu. V systémovém zánětu totiž dochází pod vlivem cytokinů ke zvýšení kapilárního leaku a přesunu vitamínů do jiných kompartmentů. Jak tedy hodnotit snížené hladiny? Ne u všech nám plazmatická koncentrace vitamínů dává přiléhavou informaci o stavu aktuálního množství a zásob. Složitost celé patofyziologie není ještě zcela objasněna. Správná interpretace je proto velice obtížná. Nedostatek většiny vitamínů je však spojen s horší prognózou pacienta, a v tom případě vyžaduje adekvátní substituci. Nové poznatky, respektive patofyziologické konotace u jednotlivých vitamínů, si pravděpodobně vynutí nové guidelines pro jejich substituci jak enterální, tak i parenterální cestou. A to zejména u skupiny pacientů kriticky nemocných. Speciální problematiku tvoří stavy při výrazných ztrátách mikronutrientů, tedy těžké popáleniny, rozsáhlé střevní píštěle, opakované dialyzační techniky. Zde je přístup k substituci modifikován. Jak uvádí M. Berger [1] opakované dialýzy vedou k významným ztrátám a negativním bilancím Se, Cu a thiaminu. Déle trvající CRRT povede k deplecím uvedených mikronutrientů při běžné suplementaci. U popálenin je kombinace zvýšeného oxidačního stresu a zvýšených ztrát popálenou plochou, dochází k výrazným ztrátám vitamínů B1, C, D, E, Zn, Cu, Se. Stejně tak byly prokázány extrémní ztráty vitamínů C, A, E, Zn, Fe a Cu u velkoplošných ran (open abdomen). Nové guidelines ESPEN 2013 zohledňuje tyto poznatky [2].
Dalším důvodem nízkých hladin je nevhodný způsob podání mikronutrientů, a to v rámci enterální výživy. Je třeba si uvědomit kompetici jednotlivých mikronutrientů při enterálním vstřebávání. Je-li například podáván v nadbytku vitamín C, je významně sníženo vstřebávání selenu, stejný mechanizmus platí při enterálním vstřebávání mezi zinkem, železem a mědí. U pacientů v SIRS není střevo schopno kvalitně vstřebat požadovaný objem (odpady, průjmy), reálně vstřebané množství je tedy minimální a deficit se prohlubuje.
Vitamín D (25-OH vit D, 1,25 (OH)2 vit D)
V posledních letech velice diskutovaný mikronutrient v širokém kontextu medicínských oborů. U kriticky nemocných se mimo jeho hlavní funkce (udržení homeostázy Ca, mineralizace kostí, nervosvalový přenos a účast na hemokoagulaci) prokázaly další zásadní funkce. A to schopnost modifikovat zánětlivou odpověď, imunomodulační, kardioprotektivní efekt a potenciálně antimikrobiální efekt. Na animálním modelu bylo prokázáno, že terapie vitamínem D zlepšuje koagulační parametry při DIC, snižuje aktivitu nukleárního faktoru kappa B, a tím produkci TNF alfa, IL-6. Reguluje diferenciaci imunokompetentních buněk, stimuluje makrofágy k produkci látek s antimikrobiálním efektem (cathelicidinu a beta defenzinu) v tzv. bariérových tkáních-GIT, dýchacích cestách, urogenitálním traktu. Při nedostatku vitamínu D se popisuje výskyt reninové hypertenze, srdeční hypertrofie [3].
Higgins prokázal, že až u 82 % JIP pacientů byla diagnostikována snížená hladina vitamínu D. Nízké hladiny při přijetí a dále se snižující 3.-10. den jsou spojeny s delší dobou hospitalizace, vyšším počtem infekcí, tendencí zvýšení orgánových selhání [4]. V další studii s chirurgickými kriticky nemocnými byla prokázána deficitní hladina vitamínu D u 75 % pacientů, signifikantně souvisela s délkou pobytu na JIP, ale nesouvisela s mortalitou [5]. V dalších pracech [6-8] byl prokázán vztah mezi nízkou hladinou vitamínu D a mortalitou a nízkou hladinou vitamínu D a akutním renálním selháním. V další studii [9] se spojení nízké hladiny vitamínu D a mortalitou nepotvrdilo, prokázalo se však, že nedostatek vit. D je spojen s delší dobou pobytu na ICU. Ve studii s dětskou populací, kde bylo z 511 pacientů JIP 40 % deficitních, byla zjištěna negativní korelace hladin vitamínu D s tíží stavu vyjádřenou klinickým skórovacím schématem [10]. Zásadní byla výše hladiny před přijetím na dětský JIP (užívání enterální výživy s definovaným obsahem vitamínu D bylo silně protektivní, oproti tomu školní věk, tmavá pleť, snížený přívod vitamínu D. Signifikantní spojení nízkých hladin vitamínu D s mortalitou se nepotvrdilo [11]. Ve všech uvedených pracích je zkoumán dopad snížené hladiny vitamínu D na klinický stav a jeho prognostický efekt. Závěry recentních studií ukazují, že vitamín D může hrát důležitou roli u kriticky nemocných a může být spojen s prognózou. Arnson Y et al [8] navrhuje sledovat hladinu vitamínu D pro jeho těsné spojení s tíží stavu jako prognostický marker pro kriticky nemocné.
Pro hodnocení hladiny vitamínu D bylo navrženo sledování hladiny 25-OH-vit. D jako velmi dobrý funkční indikátor deficitu, pro hodnocení nedostatku tato kritéria: hladiny 25-OH-vit. D >60 µg/l suficientní, <20-30 µg/l deficitní, mezi 30-60 µg/l insuficientní [12]. Převodní koeficient na u nás používané µmol/l je 2.5 x µg/l = nmol/l. Před zahájením substituce se nabízí otázka, zda není snížení vitamínu D jen projevem tíže stavu a jasná korelace s horší prognózou a mortalitou je jen toho výrazem? Má vitamín D nějakou další biologickou funkci, je tedy třeba substituce a v jaké výši? Dávky vitamínu D zlepšují prognózu, myšleno standardní dávky - závěr z Cochrane database systematic review 2011. Toto zjištění se však netýkalo kohorty JIP pacientů, šlo o geriatrické pacienty a lepší prognóza spíše odrážela lepší hojení a menší počet pádů. Standardní substituce vitamínu D je dle Doporučení ASPEN,ESPEN 200 IU i.v./den, pro kriticky nemocné se však v recentních pracích uvádějí dávky daleko vyšší. Van den Berghe [13] porovnává skupiny s vyšší a nižší substitucí 200 IUx500 IU i.v. Dávka 200 IU, ani 500 IU nekoriguje nízkou hladinu 25-OH vit. D, vyšší dávka však snižuje CRP a IL6. Ingels [14] podává Cholecalciferol 200 IU jako základ + 200 IU jako bolus a 600IU deset dní oproti placebu, ve studijní skupině zjišťuje rychlý vzestup 25(OH)D i cathelicidinu LL37 (tendence). Amreim [15] 540 000 IU do sondy jednorázově, pak 90 000 IU enterálně každý měsíc bez efektu na mortalitu i délku pobytu v nemocnici. Rychlá normalizace sérové hladiny 25-OH vitamínu D, u žádného pacienta nebyla hyperkalcémie ani hyperkalciurie.
Deficit hladiny vitamínu D je spojen s řadou onemocnění. U kriticky nemocných je spojován s vyšší mortalitou a horší prognózou. Současná doporučená dávka 200 IU i.v. je pro deficitní pacienty v kritickém stavu nedostatečná. Velikost dávky, způsob podání a dostatečná hladina vitamínu D je předmětem dalších studií. Suplementace vitamínu D je levná a bezpečná s širokým terapeutickým oknem. Oproti ostatním mikronutrientům je dostupnost stanovení plazmatické hladiny 24 hodin.
Substituce se provádí podáním multivitamínových preparátů (Cernevit, Vitalipid-N) viz. tabulka,fortifikace monoterapií Calciferolem forte 300 000 IU/1 ml i.m.
Thiamin vitamín B1
Vitamín B1 patří do skupiny vitamínu ve vodě rozpustných a je pro člověka esenciální. Jako kofaktor má zásadní postavení v buněčném metabolismu (součástí tří mitochondriálních komplexů při oxidativní dekarboxylaci, též hraje roli v obraně před oxidativním stresem). Jeho deficit je velice častý. U hospitalizovaných pacientů je incidence 20 %, u kriticky nemocných až 71 % a u dalších pacientů se ještě může rozvinout během pobytu na JIP [16]. Deficit bývá spojen s nízkým příjmem, sníženou gastrointestinální absorbcí, zvýšenými renálními ztrátami a nebo zvýšenými metabolickými nároky. Klinické projevy deficitu mohou být různé, nejčastěji jsou popisovány projevy kardiovaskulární, periferní neuropatie a poruchy chování. V laboratorním obraze, zejména u kriticky nemocných, dominuje laktátová acidóza. Ta vzniká jako přímý dopad snížené funkce pyruvátdehydrogenázového komplexu, jehož součástí je thiamin pyrofosfát (obr. 1). Stejný typ laktátové acidózy je popsán u refeeding syndromu. Na etiologii tohoto typu laktátové acidózy se u kriticky nemocných pravděpodobně podílí kombinace zvýšených nároků na tento koenzym a současně jeho zvýšené ztráty, eventuálně přítomný deficit.
Fig. 1. Metabolic way of pyruvate and lactate during insufficiency of activity of pyruvatdehydrogenase-complex 
Doporučená dávka pro parenterální podání je 3 mg/den, 0,4 mg/1000 kcal, ale i při těchto dávkách je popsána těžká laktátová acidóza. U pacientů, kde je podezření z malnutrice, či jiného důvodu možného deficitu thiaminu je doporučeno podat 100-300 mg/den první tři dny na JIP [17].
Plazmatická hladina thiaminu není adekvátním obrazem zásob thiaminu v těle. K přesnému vyjádření hodnotíme aktivitu transketolázy v plné krvi, respektive v erytrocytech. Průkaz deficitu thiaminu signalizuje zvýšení transketolázy po podání thiaminu o 30 %.
Stanovení plazmatické hladiny thiaminu, ani stanovení aktivity transketolázy se běžně neprovádí. Substituce thiaminu se provádí v rámci polyvitamínových přípravků (Cernevit, Soluvit) a fortifikace při monoterapii thiaminem v dávce 100 mg/amp.
Vitamín C
Vitamín C (kys. askorbová) je důležitou složkou redoxní rovnováhy. Vedle albuminu, kyseliny močové a bilirubinu se chová jako přirozený scavenger, redukuje radikálové formy vitamínu E (tokoferolu), glutathion, hydroxylový radikál, superoxid a cytoplazmatické i mitochondriální radikály. Vitamín C je zásadní při syntéze kolagenu, karnitinu a norepinefrinu. Byl popsán pozitivní efekt při podávání vitamínu C při ARDS, při SIRS. Vitamín C je kofaktorem při syntéze noradrenalinu, jeho vysoké dávky v SIRS mohou zlepšit hemodynamiku a snížit výskyt orgánových dysfunkcí [18]. Při vysokých dávkách má pozitivní efekt na hojení ran, respirační selhání, u popálených a pacientů po traumatu. V takových situacích může mít však kontroverzní postavení antioxidant-prooxidant. Vitamín C ovlivňuje zánětlivou odpověď-snižuje aktivitu nukleárního faktoru kappa B, a tím produkci prozánětlivých cytokinů, zejména IL1, IL6.
Prudký pokles v plazmě koreluje se špatnou prognózou. Až 10x vyšší koncentrace je v tkáních a buňkách, kde je více reaktivních forem kyslíku (ROS). Obnovit fyziologickou hladinu supranormálními dávkami (3 g) je nezbytné [19]. Vzhledem k limitované enterální absorbci je k normalizaci hladin nutné i.v. podání [20]. V rozsáhlé studii REDOX [21] byl posuzován efekt podání kombinace mikronutrientů, podání 1500 mg vitamínu C bylo bez efektu oproti placebu. Vitamín C byl však podán enterální cestou a dosažené plazmatické hladiny nebyly zjišťovány. Ve studií 595 chirurgických JIP pacientů podání kombinace vitamínu C (1 g/8 hod. i.v.) a E (1000 IU/8 h p.o.) vede k redukci incidence orgánového selhání a zkrácení délky hospitalizace na ICU. V další studii [22] intravenózně podaná dávka 4 g (1. skupina), respektive 16 g (2. skupina) za den pacientům v těžké sepsi vedla k rychlé normalizaci nízkých hladin vitamínu C v obou skupinách kriticky nemocných oproti placebo skupině. Dále měla pozitivní vliv na rozvoj multiorgánové dysfunkce, vedla k poklesu SOFA, CRP, PCT a byla bezpečně tolerována [23]. Doporučená dávka dle ESPEN 2012 je 200 mg parenterálně. U kriticky nemocných tato dávka ale nezabezpečí udržení plazmatické hladiny vitamínu C. V recentních pracích je popisován přínos vysokých dávek zejména u pacientů po traumatu, u popálených a v sepsi. Vyšší dávky vitamínu C by se neměly podávat u pacientů s vyšší hladinou železa a u pacientů s rizikem vzniku litiázy.
Substituce vitamínu C je možná podáním multivitamínového preparátu (Cernevit, Soluvit n), fortifikace monopreparátem Celaskon 500 mg/1 amp i.v., i.m.
Vitamín E (tokoferol)
Vitamín E je součástí antioxidační ochrany před peroxidací vícenenasycených mastných kyselin (PUFA) v membránových lipidech a lipoproteinech plazmy. Uplatňuje se zejména při akutním poškození plic (ALI), kdy neutrofily a makrofágy uvolňují kyslíkové radikály a napadají řetězce PUFA. Dochází tak ke ztrátě integrity buněčné bariéry plicního endotelu. Vitamín E má též regulační efekt na buňky, zvyšuje humorální i buněčnou imunitu.
Dávky nad 150 IU vit. E zvyšují středně i dlouhodobou mortalitu [24]. V dalších metaanalýzách [21, 25] byly s vyššími dávkami vitamínu E nejednoznačné výsledky.
Doporučená dávka (ESPEN 2009) 10 IU pareterálně se zdá být dostatečná. I přes zvýšené požadavky na vitamín E u kriticky nemocných se jeho vyšší dávkování zatím nepovažuje za vhodné.
Substituce se provádí podáním multivitamínového preparátu (Cernevit, Vitalipid N) (Tabulka 1), anebo monoterapií Erevitem 30-300 IU/1amp i.m.
Table 1. Recomended doses per day (RDD) of vitamines for parenteral use (ASPEN and ESPEN 2009 and supplement 2013) and contains of vitamins in multivitamins medicaments. 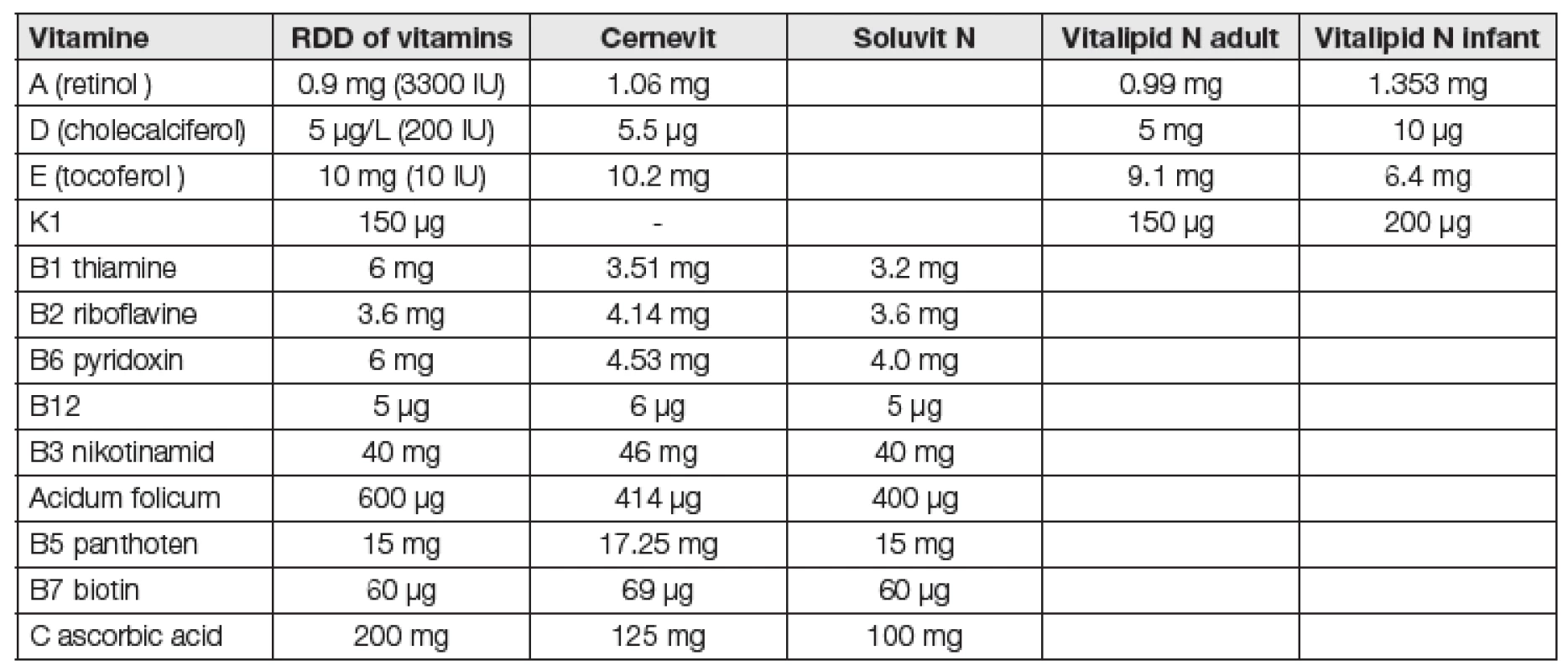
Vitamín K
Vitamín K (phytomenadionum) v játrech zajišťuje syntézu speciální aminokyseliny karboxyglutamové jako kofaktor. Tato kyselina je esenciální součastí čtyř koagulačních faktorů - II-protrombinu, VII, IX, X a antikoagulačně působících proteinů C a S. Deficit tohoto vitamínu (resp. obou variant K1 a K2) způsobuje poruchy koagulace, nejčastěji krvácivé stavy. I přesto se zatím problematika rutinní parenterální suplementace jeví jako nejednoznačná.
Možnosti monitorace vitamínů
Ze všech uvedených vitamínů je nejčastěji indikován, a tedy se nejčastěji stanovuje, celkový vitamín D, a to v obou formách (25-OH vit D, 1,25(OH)2 vit D), kyselina listová a dále vitamín B12. Tato stanovení lze provést v běžném provozu s časovou odezvou do 24 hodin. Další vitamíny skupiny B (thiamin, pyridoxin) jsou indikovány zřídka a jejich stanovení je u nás méně dostupné. Vitamíny C, E a A jsou celkem rutinně, ale méně často indikovány a analyzovány pomocí HPLC. Tomu odpovídá i větší časová odezva. Vyšetření plazmatických hladin zmíněných vitamínů je nejčastěji indikováno u pacientů na umělé výživě, s malabsorbcí, u onkologických pacientů a u pacientů v kritickém stavu.
Diskuse
V posledních letech se v intenzivní medicíně objevila řada nových poznatků stran patofyziologie SIRS a sepse. Významná úloha je připisována mikronutrientům, tedy vitamínům a stopovým prvkům. Ať se jedná o jejich antioxidační vlastnosti, nebo o jejich bohaté zastoupení jako kofaktorů v intermediarním metabolismu. Vzhledem k podmínkám, které vznikají samotnou podstatou kritického stavu, zjišťujeme u většiny mikronutrientů snížené plazmatické hladiny. Základní otázkou je, zda se jedná o reálný deficit a je třeba vitamíny hradit, anebo zda jejich pokles pouze dokumentuje tíži stavu a jejich substituce se na celkovém stavu, eventuálně na mortalitě neodrazí, nebo je dokonce škodlivá. Od poslední dekády 20. století jsou používány produkty nutriční podpory pro nemocné v náročných metabolických stavech. Vedle receptur A-I-O systémů makronutrientů jsou běžně indikovány mixtury stopových prvků a vitamínů. Zastoupení jednotlivých komponent, jejich poměry a koncentrace byly stanoveny v 80. letech 20. století a vycházely z poznatků té doby. S rozvojem problematiky nutriční podpory kriticky nemocných a patofyziologie kriticky nemocných se pohled na některé potřeby mikronutrientů změnil. Aktuální doporučení evropské a americké společnosti pro parenterální a enterální výživu (ESPEN a ASPEN) [2,17,30] zohledňují nové poznatky, zapracovávají výsledky nových studií a respektují speciální požadavky pro děti a pro definované klinické stavy - popáleniny, sepse, SIRS, pacienty s nutností opakovaných dialýz, pacienty na domácí parenterální výživě atd. Přesto však registrujeme, zejména u kriticky nemocných, v doporučení řádově menší dávkování vitamínů D, C a selenu, než je přínosné jak vyplývá z recentních studií. Pro úpravu guidelines je zapotřebí více studií s jednoznačným závěrem, což vzhledem k heterogenitě kriticky nemocných je dost obtížné. A tak jsou vydávány doplňky k doporučení, týkající se jen definované skupiny pacientů (SIRS, chronicky dialyzovaní, popálení).
Tak byla například aktualizována před dvěma lety doporučení pro pacienty v systémovém zánětu a popálené Se 1000-1600 µg/den i.v. jako bolus, dále 10-14 dní kombinace enterální nebo parenterální koktejl vitamínu C 1500 mg, E 500 mg, beta-karotenu 10 mg, Zn 20 mg, Se 300 µg [26]. Uváděná kombinace je bezpečná a měla by zlepšit klinickou prognózu SIRS pacientů. Zvýšit dávky vitamínů B1, C, E, Se, Cu, Zn u popálených kriticky nemocných. Včasná substituce snižuje možnost lipidové peroxidace, zvýší antioxidační ochranu a sníží délku hospitalizace [27]. Příjem vitamínu B1 normalizuje laktáto-pyruvátový metabolismus. Byl prokázán klinický benefit redukce oxidačního stresu a lepší hojení ran při podávání vyšších dávek vitamínu C a E 1,5 až 3x vyšších než doporučená denní dávka u popálených dětí i dospělých [2]. Potřeby vitamínu C po dobu akutní fáze zůstávají zvýšené (0,5 až 1 g/den) [28]. Přehled současně dostupných preparátů s mikronutrienty pro parenterální podání je uvedeno v Tabulce 1 a v naší předchozí stati [29].
Závěr
Obecně se v kritických stavech doporučuje suplementace multivitamínovými přípravky. Podání vitamínů jako prostředků antioxidační léčby se považuje za účelné, jen není stále konsenzus o optimální dávce a způsobu podání, zejména v uvedených definovaných stavech. Každá receptura parenterální výživy by měla obsahovat denní doporučenou dávku multivitamínů a stopových prvků [30]. Při podávání enterální cestou v rámci enterální nutrice je třeba zohlednit limitace objemu i schopnosti střeva danou složku vstřebat.
Podávání mikronutrientů v kombinaci snižuje požadavky na jednotlivé z nich. Vitamíny ze skupiny B, kromě zmíněných indikací pro Thiamin, jsou dostatečně zastoupeny v multivitamínových preparátech pro parenterální podání, stejně tak vitamíny A, E. Případné vyšší dávky vitamínu D a C je třeba řešit podáním monoterapie příslušnými preparáty.
Použité zkratky
AIO All-in-one systém (systém více složkových vaků pro parenterální výživu)
ALI Acute lung injury - akutní poškození plic
ARDS Akutní respirační distress syndrom
CRRT Continuous Renal Replacement Therapy (kontinuální dialyzační techniky)
DIC diseminovaná intravaskulární koagulopatie
GIT gastrointestinální trakt
ICU intensive care unit (jednotka intenzivní péče)
SIRS Systemic inflammatory response syndrome (systémová zánětlivá odpověď)
SOFA Sequential Organ Failure Assessment (klinický skórovací systém)
Do redakce došlo 23. 3. 2016
Adresa pro korespondenci:
MUDr. Helena Brodská, Ph.D.
ÚLBLD, 1. LF-UK a VFN
U Nemocnice 2,
128 08 Praha 2
e-mail: brodska@vfn.cz
Sources
1. Berger, M., Shenkin, A., Revlly J.-P. Copper, selenium, zinc, and thiamine balances during continuous venovenous hemofiltration in critically ill patients. Am.J. Clin.nutr. 80 (2), (2003), p. 410-416
2. Rousseau, A.-F., Losser, M.-R., Ichai, C., Berger, M. ESPEN endorsed recommendations: Nutritional therapy in major burns. DOI: 10.1016/j.clnu.2013.02.012. ISBN 10.1016/j.clnu.2013.02.012.
3. Watkins, R., Yamshchikov, a. Y., Lemonovich, t. L., Salata, r. T. The role of vitamin D deficiency in sepsis and potential therapeutic implications. DOI: 10.1016/j.jinf.2011.07.002. ISBN 10.1016/j.jinf.2011.07.002
4. Higgins, D. M., Wischmeyer, P.E., Queensland, K.M., Sillau, S.H., Sufit, A.J., Heyland, D. K.. Relationship of Vitamin D Deficiency to Clinical Outcomes in Critically Ill Patients. DOI: 10.1177/0148607112444449. ISBN 10.1177/0148607112444449
5. Alizadeh, N., Khalili, H., Mohammadi, M., Abdollahi, A. Serum Vitamin D levels at admission predict the length of intensive care unit stay but not in-hospital mortality of critically ill surgical patients. DOI: 10.4103/2279-042X.167051. ISBN 10.4103/2279-042X.167051
6. Braun, A.B., Gibbons, F.K., Litonjua, A.A., Giovannucci, E., Christopher, K.B. Low serum 25-hydroxyvitamin D at critical care initiation is associated with increased mortality. DOI: 10.1097/CCM.0b013e31822d74f3. ISBN 10.1097/CCM.0b013e31822d74f3,
7. Moromizato, T., Litonjua, A.A., Braun, A.B., Gibbons, F.K., Giovannucci, E., Christopher, K.B. Association of Low Serum 25-Hydroxyvitamin D Levels and Sepsis in the Critically Ill. DOI: 10.1097/CCM.0b013e31829eb7af. ISBN 10.1097/CCM.0b013e31829eb7af.
8. Arnson, Y., Gringauz, I., Itzhaky, D., Amital, H. Vitamin D deficiency is associated with poor outcomes and increased mortality in severely ill patients. DOI: 10.1093/qjmed/hcs014. ISBN 10.1093/qjmed/hcs014
9. Nair, P., Lee, P., Reynolds, C., Nguyen, D., Myburgh, J., Eisman, J. A., Center, R. C. Significant perturbation of vitamin D–parathyroid–calcium axis and adverse clinical outcomes in critically ill patients. DOI: 10.1007/s00134-012-2713-y. ISBN 10.1007/s00134-012-2713-y
10. Madden, K., Feldman. H. A., Smith, E. M., Gordon, C. M., Keisling, S. M., Sullivan, R. M., Hollis, B. W., Agan, A. A., Randolph, A. G. Vitamin D Deficiency in Critically Ill Children. DOI: 10.1542/peds.2011-3328. ISBN 10.1542/peds.2011-3328.
11. McNally, J. D., Menon, K., Chakraborty, P. L., Fisher, K. A., Williams, O. Y., Al-Dirbashi, O. Y., Doherty, D. R. The Association of Vitamin D Status With Pediatric Critical Illness. DOI: 10.1542/peds.2011-3059. ISBN 10.1542/peds.2011-3059.
12. Boucher, B. J. The 2010 recommendations of the American Institute of Medicine for daily intakes of vitamin D. DOI: 10.1017/S136898001100022X. ISBN 10.1017/S136898001100022X
13. Vanhove, P., Van Roosbroeck, D., Wouters, P., De Pourcq, L., Bouillon, R., Van Den Berghe, G. Bone turnover in prolonged critical illness: effect of vitamin D. DOI: 10.1186/cc1897. ISBN 10.1186/cc1897.
14. Ingels, C. M., Van Cromphaut, S. J., Wouters, P. J., Moller, H. J., Van Herck, E., Jans, I., Bouillon, R., Van Den Berghe, G. Effect of restoration of 25OHD3 status in prolonged critical illness on serum innate immunity parameters LL-37 and sCD163. DOI: 10.1186/cc8822. ISBN 10.1186/cc8822.
15. Amrein, K., Sourij, H., Wagner, G., Holl, A., Pieber, T., Smolle, K. H., Stojakovic, T., Schnedl, C., Dobing, H. Short-term effects of high-dose oral vitamin D3 in critically ill vitamin D deficient patients: a randomized, double-blind, placebo-controlled pilot study. DOI: 10.1186/cc10120. ISBN 10.1186/cc10120.
16. Costa, N. A., Gut, A. L., De Souza Dorna, M., Pimentel, J. A. C., Cozzolino, S. M. F., Azevedo, P. S., Fernandes, A. A. H., Zornoffm L. A. M., De Paiva, S. A. R. et al. Serum thiamine concentration and oxidative stress as predictors of mortality in patients with septic shock. DOI: 10.1016/j.jcrc.2013.12.004. ISBN 10.1016/j.jcrc.2013.12.004
17. Singer, P., Berger, M. M., Van Den Berghe, G. et al. ESPEN Guidelines on Parenteral Nutrition: Intensive care. DOI: 10.1016/j.clnu.2009.04.024. ISBN 10.1016/j.clnu.2009.04.024.
18. Fisher, B. J., Kraskauskas, D., Martin, E. J., Farkas, D., Wegelin, J. A., Brophy, D., Ward, K. R., Voelkel, N. F., Fowler, A. A., et al. Mechanisms of attenuation of abdominal sepsis induced acute lung injury by ascorbic acid. DOI: 10.1152/ajplung.00300.2011. ISBN 10.1152/ajplung.00300.2011.
19. Long, C. L., Maull, K. I., Krishnan, R. S. et al. Ascorbic acid dynamics in the seriously ill and injured. DOI: 10.1016/S0022-4804(02)00083-5. ISBN 10.1016/S0022-4804(02)00083-5.
20. Padayatty, S. J. Vitamin C Pharmacokinetics: Implications for Oral and Intravenous Use. DOI: 10.7326/0003-4819-140-7-200404060-00010. ISBN 10.7326/0003-4819-140-7-200404060-00010.
21. Heyland, D. K., Dhaliwal, R. Role of Glutamine Supplementation in Critical Illness Given the Results of the REDOXS Study. DOI: 10.1177/0148607113488421. ISBN 10.1177/0148607113488421.
22. Nathens, A. B., Neff, M. J., Jurkovich, G. J. et al. Randomized, Prospective Trial of Antioxidant Supplementation in Critically Ill Surgical Patients. DOI: 10.1097/00000658-200212000-00014. ISBN 10.1097/00000658-200212000-00014
23. Fowler, A. A., Syed, A. A., Knowlson, S., Sculthorpe, R., Farfthing, D., Dewilde, C., Farthing, C. A., Larus, T. L., Martin, E. et al. Phase I safety trial of intravenous ascorbic acid in patients with severe sepsis. DOI: 10.1186/1479-5876-12-32. ISBN 10.1186/1479-5876-12-32.
24. Miller, E. R. Meta-Analysis: High-Dosage Vitamin E Supplementation May Increase All-Cause Mortality. DOI: 10.7326/0003-4819-142-1-200501040-00110. ISBN 10.7326/0003-4819-142-1-200501040-00110.
25. Manzanares, W., Dhaliwal, R., Jiang, X., Murch, L., Heyland D. K. Antioxidant micronutrients in the critically ill: a systematic review and meta-analysis. DOI: 10.1186/cc11316. ISBN 10.1186/cc11316.
26. Manzanares, W., Heyland D. K. Pharmaconutrition with antioxidant micronutrients in the critically ill: The time has come!. DOI: 10.1016/j.nut.2012.05.014. ISBN 10.1016/j.nut.2012.05.014.
27. Berger, M. M., Eggimann, P., Heyland D. K., Chioléro, R. L., Revelly, J.-P., Day, A., Raffoul, W., Shenkin, A. Reduction of nosocomial pneumonia after major burns by trace element supplementation: aggregation of two randomised trials. DOI: 10.1186/cc5084. ISBN 10.1186/cc5084.
28. Berger, M. M., Shenkin, A. Vitamins and trace elements: Practical aspects of supplementation. DOI: 10.1016/j.nut.2006.06.004. ISBN 10.1016/j.nut.2006.06.004.
29. Brodská, H., Kazda, A., Valenta, J. Stopové prvky v kritických stavech. Část 2: měď a selen. Klin.Bioch.Metab. 21(42), 2013, No. 4, p. 203-207.
30. Vanek, V. W., Borum, P., Buchman, A. et al. A.S.P.E.N. Position Paper: Recommendations for Changes in Commercially Available Parenteral Multivitamin and Multi-Trace Element Products. DOI: 10.1177/0884533612446706. ISBN 10.1177/0884533612446706.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2016 Issue 3-
All articles in this issue
- Pokroky v imunoanalýzách s luminiscenční a elektrochemickou detekcí
- Nová diagnostická kritéria mnohočetného myelomu
- Vztah hladin molekul BAFF a APRIL k vybraným ukazatelům mnohočetného myelomu
- Výsledky léčby nemocných s mnohočetným myelomem a současným renálním postižením
- Analýza parametrů signálních drah myelomové kostní nemoci u mnohočetného myelomu
- Detekce oligoklonálních IgM pásů v likvoru
- Vitamíny u kriticky nemocných
- Stanovení ftalátů a bisfenolu A a jejich metabolitů v různých typech materiálů
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Detekce oligoklonálních IgM pásů v likvoru
- Vitamíny u kriticky nemocných
- Pokroky v imunoanalýzách s luminiscenční a elektrochemickou detekcí
- Nová diagnostická kritéria mnohočetného myelomu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

