-
Medical journals
- Career
Čipy a kapilární elektroforéza v imunoanalýze
Authors: P. Štern
Authors‘ workplace: Mimoňská 637/16, 19000 Praha 9
Published in: Klin. Biochem. Metab., 24, 2016, No. 2, p. 57-62
Overview
Edukační publikace se zabývá v první části využitím čipů v imunochemii pro mikroanalýzu. Je uveden přehled podkladových materiálů a značek, jakož i senzitivita jednotlivých technologií. Vysvětluje se možnost imobilizace a detekce proteinů pomocí planárního vlnovodu. Ukazuje se používání čipů při paralelní kompetitivní imunoanalýze, sendvičové imunoanalýze a fluorescenční imunoanalýze na mikrokuličkách. Druhá část je věnována kapilární elektroforéze a jejímu využití k separaci po kompetitivní a nekompetitivní homogenní imunoanalýze, a heterogenní imunoanalýze. Diskutují se možnosti detekce analytu jako laserem indukovaná fluorescence, enzymové značky, chemiluminiscence, ampérometrie, UV/VIS absorbance, hmotnostní spektrometrie a povrchová plazmonová rezonance.
Klíčová slova:
čip, paralelní kompetitivní imunoanalýza, sendvičová imunoanalýza, homogenní CE imunoanalýza, heterogenní CE imunoanalýzaImunoanalytické čipy
Provedení mikroanalýz v imunochemii je mnohem složitější než mikroanalýza DNA vzhledem k mnohem větší rozmanitosti proteinů [1]. Mikroanalýza protilátek (Abs) má dosud omezenou úspěšnost, protože vyžaduje vysoce citlivý detekční systém a důmyslný způsob imobilizace. Nicméně je ekonomicky velmi výhodná, protože vyžaduje jen velmi malá množství reaktantů.
Reakční kinetika mikroteček proteinů neprobíhá zcela podle teorie, neboť kinetika Ab velmi závisí na proudění hmoty k reakčnímu bodu. To zahrnuje nejen pohyb antigenu (Ag) roztokem, ale také po povrchu pevné fáze. Komplikace u přípravy čipů způsobují: rozdílné biofyzikální a chemické vlastnosti proteinů, omezená chemická stabilita proteinů a jejich nepředvídatelné vlastnosti po imobilizaci. Pro přípravu čipů je k dispozici mnoho technologii, které používají epoxysilan [2], aldehydsilan, aminosilan, poly-L-lysin, polyakrylamid [3, 4], hydrogely [5, 6], nebo různé potažené membrány [3, 4, 7] či malé příčně propojené skleněné destičky [2]. Jako značky se převážně používají cyaniny (Cy3 a Cy5 – číslice označují počet methioninových článků mezi dvěma substituovaným indoly) [8] nebo hapteny se streptavidin-biotinovou kotvou [9].
Významného pokroku bylo dosaženo při imobilizaci proteinů a jejich detekci s využitím planárního vlnovodu. Plně automatizovaný systém mikroanalýzy proteinů (na formátu klasické mikrotitrační destičky) umožňuje detekci excitovaných molekul jen v bezprostředním okolí povrchu, a tím se zvýší intenzita signálu stonásobně [10]. K imobilizaci se používá speciální monomolekulární vrstva, zvláště odolná vůči adsorpci. Tak lze detekovat koncentrace 1 – 10 ng/l. Princip technologie je následující [10]: laserové světlo dopadá na mřížku tvořenou filmem o tloušťce 150 nm z vysoce reflexního materiálu (Ta2O5), fixovaného na průhledné skleněné podložce. Ve směru šíření světla vlnovodem se vytvoří na povrchu silné nestálé pole, které má omezenou hloubku průniku na 200 nm vůči přiléhajícímu prostředí. Všechny molekuly, které jsou na ploše jedné mikroanalýzy umístěny uvnitř tohoto nestálého pole, jsou excitovány současně (např. na ploše 35 mm2) a vizualizovány CCD (charge-coupled device, tj. zařízení s vázanými náboji) kamerou. Pouze fluorofory na povrchu jsou excitovány při 635, 532 nebo 492 nm (a emitují fluorescenci), zatímco ve zbytku média se excitace neprojeví.
Při rozvoji Ab mikroanalýzy se objevily některé překážky [1]. Všechny povrchy poskytují srovnatelný signál při vysoké koncentraci teček a inkubaci 30 min, přičemž optimální koncentrace pro nanášení je 400 mg Ag/l nebo i méně. Je-li inkubace prodloužena na 2,5 h, jsou ale výsledky rozdílné. Nejvyšší citlivosti bylo dosaženo na epoxysilanových destičkách, kdy byl detekční limit 10 amol Ab/bod. Senzitivitu analýzy ovlivňují [11]: inkubační doba, velikost tečky, hustota vazebných míst, účinnost míchání, geometrie inkubační komůrky a objem vzorku. K dosažení termodynamické rovnováhy při všech koncentracích analytů je zapotřebí 100 – 400 h, takže při typickém provedení mikroanalýzy s krátkou inkubací a bez míchání se zmenšuje intenzita signálu 300x. I při optimální inkubaci Ab (s průměrnou afinitou) může klesnout reakční rychlost ve srovnání s ideálními podmínkami až 160x, ale účinné míchání může zvednout reakční rychlost až 40x. Snížení signálu vlivem uspořádání mikroanalýzy může být 100 až 10000x ve srovnání s ideálním provedením. Adsorpce Ab závisí na elektrostatických a Van der Waalsových silách, vodíkových můstcích a hydrofobních vazbách.
Senzitivita může být definována buď jako míra změny odezvy na malou změnu podnětu [12] a předpokládá se, že metody s větší strmostí odezvy, nebo vyšší přesností jsou při určité koncentraci citlivější, než ty, které detekují nižší množství analytu; nebo jako nejmenší kvantita podnětu, která může být rozlišena s daným stupněm spolehlivosti [13] a neuvažuje se přesnost měření, ale pouze detekční limit (LOD). LOD je definován pro určitou matrici jako dvojnásobek výšky signálu proti šumu vzhledem k nulové linii. Při mikroanalýzách se obvykle používá posledně uvedená definice.
Výběr vhodného povrchu pro mikroanalýzy Abs je komplikován tím, že se neuvažují všechny fyzikálně-chemické aspekty imobilizace [1]. Většina publikací uvádí LOD jako nejmenší množství zjištěného Ag nebo Ab (Tabulka 1.).
Table 1. Development of different surface chemistries for antibody microarray purposes. 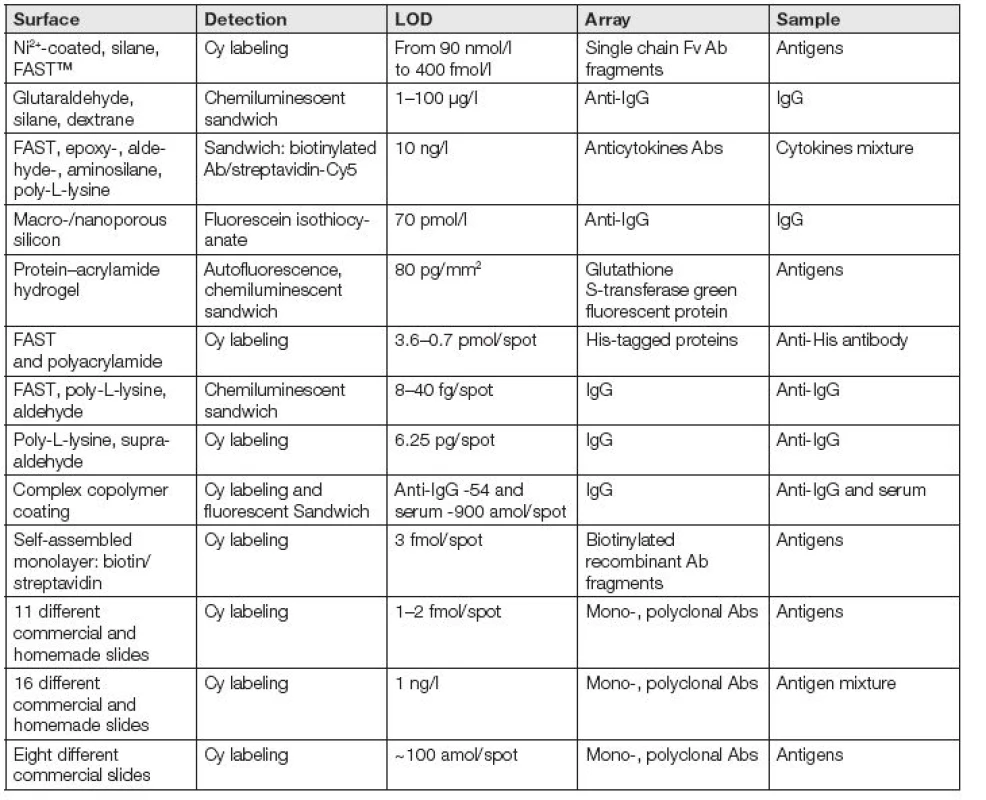
Při vysoké nebo nízké koncentraci Ab v reakčním poli jsou velmi rozdílné: stabilita Ab, dostupnost vazebných míst a počet molekul specifické Ab. Při nízké koncentraci Ab je kinetický mechanismus vzniku signálu výrazně ovlivněn dvourozměrnou difuzí.
Množství detekovaných molekul je přímo úměrné kvadrátu průměru reakčního místa, např. při průměru 30 µm je 100x nižší než při průměru 300 µm. Relativní odezva na velmi nízké koncentrace může být vyšší, než relativní intenzita signálu při vysoké koncentraci analytu. Mimoto nespecifická adsorpce proteinů mění reakční kinetiku. V současnosti se nejvíce používají hydrogelové destičky.
Trojrozměrné imobilizační postupy nejsou při mikroanalýze tak výhodné, jak se předpokládalo. Při tomto způsobu imobilizace Ag se brání difuzi Ab [14], takže dostupná povrchová koncentrace je nízká (~100 mg/l) a získaný signál je 100x slabší. Difuze je také hlavním problémem, proč i při poloměru mikrotečky 10 µm a možnosti skeneru detekovat 0,05-0,5 cyaninových molekul na µm2 nejsou výsledky tak dobré, jak byly dle teorie vypočteny (tj. detekce 10-16 – 10-19 mol) – v laboratorní praxi jsou o 2 – 3 řády horší.
Čipy se mohou využívat pro paralelní kompetitivní analýzu [15], a to buď s přímým značením, nebo se měření provádí nepřímo (obr. 1). Pro přímé značení se používají indokarbocyaninová značka Cy3 (excitace 550 nm, emise 570 nm) nebo indokarbodicyaninová značka Cy5 (excitace 650 nm, emise 670 nm). Pro nepřímé měření se používají jako značky např. biotin a digoxigenin, na které se pak přes Ab naváží fluoreskující cyaniny Cy3, resp. Cy5. Hlavní předností paralelní kompetitivní analýzy je to, že pro každé detekční pole lze použít stovky Abs; měření má lineární odezvu a dynamický rozsah [16]. Paralelní detekce umožňuje současné měření neznámého a referenčního vzorku, a tím se eliminují rozdíly ve schopnosti záchytu Ab mezi jednotlivými mikrotečkami. Nevýhodou tohoto postupu je nižší specifita a senzitivita a také možnost ovlivnění interakce Ab s Ag značkou.
Fig. 1. Antibody microassay format 
Při sendvičové imunoanalýze [15] ukotvená Ab váže neznačený Ag a k detekci se používá jiná Ab, která je označená (obr. 2). Kromě běžné zesílené luminiscence se mohou použít i jiné metody jako amplifikace otáčivou kružnicí, rozptyl světla rezonancí, nebo amplifikace tyramidového signálu či biotin-streptavidinová kotva s navázaným fluoroforem Cy3.
Fig. 2. Antibody microassay format 
Dvojbarevná izotermní amplifikace otáčivou kružnicí [17] se používá k detekci méně častých proteinů a dosahuje citlivosti řádově fmol. K zesílení signálu se na druhou Ab naváže oligonukleotidový primer obsahující fluorofory a na něj se hybridizuje kružnice DNA. Při otáčení kružnice dochází v přítomnosti DNA-polymerázy a nukleotidů k replikaci fluoroforu do kružnice DNA, a tím k zesílení signálu.
K rozptylu světla rezonancí [18] dochází na extrémně zářivých částečkách koloidního zlata (průměr 78 nm), které jsou potaženy Ab vůči biotinu.
Amplifikace tyramidového signálu [19] probíhá při ELISA uspořádání tak, že druhá Ab je biotinylovaná a reaguje se streptavidinem, který má jako značku křenovou peroxidázu (HRP). Následně dochází k amplifikaci biotinu pomocí biotinyltyramidu. Přitom dochází k navázání biotinu na všechna místa, kde se nachází protein druhé Ab (tyramid se váže s proteinovým tyrosinem). V poslední fázi se naváže streptavidin s fluoroforem Cy3 a provede se detekce vertikálním fluorimetrem.
Specifita je v sendvičovém uspořádání vyšší, protože každý Ag může být detekován dvěma epitopy, a také se dosahuje vyšší senzitivity, neboť vliv pozadí je omezen. V každém políčku může být detekován jen jeden vzorek (nelze použít referenci) a vzhledem ke vzájemné interakci Abs je jejich počet omezen na 30 až 50. Odezva signálu při měření je sigmoidální a nikoliv lineární – kalibrační křivka je nutná.
Fluorescenční imunoanalýza na mikrokuličkách (FMIA) je technika, která používá spektroskopicky rozlišitelné fluoreskující polystyrenové mikrokuličky k paralelní analýze až 100 látek (obvykle jen 10) z jednoho vzorku [20]. Každá mikrokulička je konjugována s unikátním Ag nebo Ab, naváže se na vzorek, a na čipu umožňuje detekci v místě imunoreakce [21], tj. v jamce mikrotitrační destičky. Detekce se provádí průtokovým cytometrem. Mikrokuličky jsou označeny barvivy fluoreskujícími červeně a oranžově [22]. Poměr těchto barviv je identifikátorem množství analytu imobilizovaného na povrchu mikrokuličky. Další detektor měří zelenou fluorescenci, která odpovídá celkovému množství přítomného analytu [23]. Dosahovaná senzitivita je v ng/l, ale tento postup vyžaduje dlouhý inkubační čas (2 h a více).
Dalším postupem je imunoanalýza na čipu s postupným nástřikem k činidlu, resp. vzorku. To se provádí tak, že magnetické kuličky jsou na počátku postupně nastříknuté na čip k činidlům a vzorku, kde jsou imobilizovány permanentním magnetem [24]. Magnetické kuličky zabraňují možné agregaci při imunoreakci.
Kapilární elektroforéza (CE)
Při tomto postupu se pracuje s malým množstvím vzorku a kombinuje se účinnost a rychlost CE se selektivitou Ab jako vazebného činidla – tato skupina metod se označuje také jako afinitní kapilární elektroforéza. Většina imunoanalýz v minulosti používala homogenní uspořádání s možností buď kompetitivního, nebo nekompetitivního vytvoření vazby. Při těchto postupech jsou používány roztoky Ag i Ab. Nejběžnější značkou byl fluorofor, ale aplikoval se také enzym. Později se začalo používat i heterogenní uspořádání, kdy byla imobilizována Ab nebo Ag na podložce. K selektivní izolaci analytu dochází ještě před CE. K detekci lze použít různé principy [25] jako fluorescence, absorbance v ultrafialové (UV) nebo viditelné (VIS) oblasti, chemiluminiscence, elektrochemické detekce, hmotnostní spektrometrie (MS) nebo povrchové plazmonové rezonance.
CE imunoanalýzy mají vůči konvenčním imunoanalýzam dvě výhody, a to snadnou automatizaci a relativně rychlou separaci Ab, Ag nebo komplexů Ag-Ab [26]. Navíc je zapotřebí jen velmi malé [27] nebo stopové množství vzorku (< 0,1 µl). CE umožňuje také paralelní stanovení více analytů. Nevýhodou je, že imunoreakce probíhá volně v roztoku, a tak je průchodnost systémem pomalejší než u metod ELISA. Další nevýhodou je vyšší mez detekce, protože při reakci v roztoku nemůže docházet k lokálnímu zahuštění reaktantu, k jakému dochází na pevné fázi v postupu ELISA.
Homogenní kompetitivní CE imunoanalýzy [25] mají první krok postupu společný s konvenčními imunoanalýzami, tj. značený a neznačený Ag soutěží o omezený počet vazebných míst Ab. Pak dochází k separaci CE (obr. 3), a značený Ag se detekuje buď jako volný (signál je přímo úměrný koncentraci stanovovaného Ag), anebo vázaný v imunokomplexu (signál je nepřímo úměrný koncentraci stanovovaného Ag). Tento postup je v současnosti nejpoužívanější CE imunoanalýzou. LOD závisí hlavně na třech faktorech [28]: koncentraci vazebných míst Ab, koncentraci značeného Ag a na afinitě Ab k Ag. Optimální poměr Ab ke značenému Ag je 1 : 2. Pochopitelně Ab s vysokou rovnovážnou asociační konstantou (např. 1012 mol-1) je účinnější, než Ab s nižší afinitou. Za výhodu se považuje, jsou-li srovnatelné velikosti vazebných konstant Ab ke stanovovanému Ag a Ab ke značenému Ag. Matrice vzorku by neměla mít nepříznivý vliv na detekci značky. Separace volného a vázaného značeného Ag je v kompetitivním uspořádání snadnější, než v konfiguraci nekompetitivní, zejména když se jedná o hapten. Značení Ag je také snadnější než u Ab. Nekompetitivní uspořádání má ale také své výhody, např. nižší LOD, širší dynamický rozsah měření, a snadnější rozlišení interferujících látek.
Fig. 3. Use CE to separate and detect bound vs. non-bound labeled Ag 
Nekompetitivní CE imunoanalýzy (CE s afinitní sondou) [25] jsou zahájeny imunoreakcí mezi přebytkem značené Ab nebo Fab fragmentu a stanovovaným Ag. Následně proběhne CE separace volné značené Ab, resp. značeného Fab fragmentu, a jejich imunokomplexu s Ag (obr. 4) na základě rozdílné elektroforetické mobility. Dosažený LOD je 1 pmol/l pro CA 125 [29]. Separace CE proběhne za 4 min, včetně detekce zábleskovou chemiluminiscencí, ale zahajovací imunoreakce až za 2 h. Použití velkého přebytku značené Ab sice urychlí imunoreakci, ale současně zvýší pravděpodobnost nespecifické interakce (zvyšuje LOD) a také nepříznivě ovlivní cenu analýzy. LOD závisí na specifitě Ab, odezvě detektoru na použitou značku a zejména na vazebné konstantě Ag-Ab (mimoto značka nesmí být blízko vazebného místa imunoreaktantů). Postup nelze použít při nedostatečném rozdílu ve velikosti a náboji mezi značenou Ab a imunokomplexem, protože separace CE není efektivní.
Fig. 4. Use CE to separate and detect bound vs. non-bound labeled Ab 
Nekompetitivní CE imunoanalýzu lze modifikovat ke stanovení Ab nebo Fab fragmentu jestliže zahajovací imunoreakce proběhne s přebytkem značeného Ag. Následná CE separace pak oddělí značený Ag od imunokomplexu.
Ztrátu aktivity Ab při vazbě značky lze minimalizovat použitím afinitní chromatografie k ochraně paratopu [30]. Přebytek Ag se ukotví na podložku a přidá se cílová Ab. Ve třetím kroku se naváže přebytek značky (např. Cy5), přičemž je paratop Ab stericky chráněn. Nakonec se elučním pufrem přeruší vazba mezi Ag a značenou Ab a provede se její izolace (obr. 5). Značená Ab je pak k dispozici pro nekompetitivní CE imunoanalýzu.
Fig. 5. Affinity protection chromatography 
Při nekompetitivní CE imunoanalýze je žádoucí, aby měl volný reaktant (podle uspořádání značená Ab nebo značený Ag) homogenní elektroforetickou mobilitu a migroval jako jediný úzký pík při separaci CE. Tím by se snadno odlišil od píku imunokomplexu. Tak se nechovají polyklonální Ab, a proto je výhodnější použít monoklonální Ab, nebo ještě lépe jen jeden řetězec variabilního fragmentu. Použitá značka musí poskytovat signál při jiné vlnové délce než reaktanty a tento signál nesmí být zesilován ani zeslabován matricí vzorku.
Heterogenní imunoanalýzy jsou hybridní techniky, kdy se kombinuje afinitní nebo imunoafinitní chromatografie s CE nebo elektrochromatografií.
Pro stanovení strukturně podobných antigenů lze použít postup, kdy jsou antigeny navázány na odpovídající Abs (nesmí mít vysokou afinitu), imobilizované na pevné fázi (např. jednoúčelovém disku ze skleněných vláken). V následném kroku jsou antigeny uvolněny a separovány CE. Ab může být také zakotvena v kapiláře a vazba cílového Ag s následujícím uvolněním a separací CE může být provedena až 25x [31], bez ztráty aktivity Ab. Optimální přebytek Ab vůči Ag je 15 : 1.
Při stanovení Ag se po imunoreakci s přebytkem značené Ab provede ukotvení volné značené Ab na pevnou fázi, potaženou Ag a imunokomplex se separuje CE (obr. 6). Metoda je užitečná zejména pro stanovení haptenů, kdy je rozdíl mezi elektroforetickou mobilitou imunokomplexu a volné Ab malý [25]. V některých případech musí být zakotvený Ag derivatizován, aby byl dostatečně reaktivní pro záchyt Ab. Hapteny musí být někdy upevněné na podložce přes distanční ramínko, aby k nim měla Ab vyhovující přístup. Proces imobilizace nesmí interferovat při reakci Ag s Ab. Imobilizovaný Ag musí být vůči Ab v dostatečném přebytku.
Fig. 6. Heterogeneous method of separating 
Fluorescenční detekce má řadu variant. Jednou z nejběžnějších metod je laserem indukovaná fluorescence (LIF). Tímto postupem lze v některých případech detekovat i jednotlivé molekuly (10-24 mol) [25]. Značka může být vázána jak na Ag, tak na Ab. Nevýhodou LIF (a obecně všech ultracitlivých metod) je velký šum pozadí (Rayleighův a Ramanův rozptyl) a fluoreskující nečistoty z rozpouštědel.
Fluorofory jsou nejvíce používané značky v CE imunoanalýze. Tyto značky musí poskytovat vysoký kvantový výtěžek, jejich konjugace s cílovou molekulou probíhá za mírných podmínek, výsledný konjugát je stabilní a schopný následné imunoreakce.
Nejběžnějším fluorochromem je fluorescein a jeho deriváty, ale používá se také Cy5 nebo tetramethylrhodamin a jiné [25]. Důvodem pro široké použití fluores-ceinu je jeho excitační vlnová délka 488 – 495 nm, která se kryje s emisní vlnovou délkou argonového laseru 488 nm. To je výhodné pro LIF. Fluorescein má za ideálních podmínek kvantový výtěžek až 0,75; ale roztok s pH < 7 zhasíná polovinu uvedené fluorescence. Barvivo Cy5 má relativně nízký šum pozadí jak v excitačním (600 – 900 nm), tak v emisním spektru (blízká IR oblast). Nevýhodou je nízký kvantový výtěžek a tendence k agregaci ve vodném roztoku, což snižuje fluorescenci. Tetramethylrhodamin umožňuje použít pro LIF jak argonový (488 nm), tak He-Ne laser (546 nm); ale v druhém případě je problémem úzký Stokesův posun 21 nm.
Enzymové značky se rovněž často používají v CE imunoanalýze. Při výběru značky se volí enzym s vysokým číslem přeměny. Substrát pro enzymovou reakci by měl být relativně stálý a snadno převeditelný na produkt umožňující maximální citlivost metody. Enzym by měl být stabilní během analytické reakce, snadno detekovatelný, a jeho výskyt ve zkoumaném vzorku by měl být zanedbatelný. Ideální je čistý enzym dostupný za nízkou cenu v homogenní formě.
Většinu těchto požadavků splňuje křenová peroxidáza (HRP), která se nejvíce používá jako značka v CE imunoanalýze [25]. Obvykle se měří absorbance reakčního produktu, ale k detekci lze použít i chemiluminiscence nebo ampérometrie. V menším rozsahu se jako značky používají mikroperoxidázy, a to jak mikroperoxidáza-8, tak mikroperoxidáza-11. Obě mikroperoxidázy se získávají hydrolýzou cytochromu c, a katalyzují reakce, při kterých se uplatňuje oxidace peroxidem vodíku.
Chemiluminiscence má několik výhod: chemiluminiscenční reakce je rychlá, má nízký LOD (10-21 mol) [32] a nízký šum pozadí. Největším omezením použití této metody je nutnost připojení iniciačního reaktoru chemiluminiscence za CE. Kromě toho je potřebná optimalizace koncentrace chemiluminiscenčních reaktantů. Běžně se používá reakce luminolu s HRP značkou a signál ve VIS oblasti může být zesilovačem (např. 4-jódfenol) znásoben tak, že se LOD sníží až 1000x. K chemiluminiscenci lze použít také reakci izoluminol izothiokyanátu s mikroperoxidázou [25].
Elektrochemická detekce má několik předností vůči ostatním technikám, používaným při CE imunoanalýze. Tento postup se snadno kombinuje s CE, je levný, selektivní a citlivý. Elektrochemická detekce vyžaduje značku, která se snadno oxiduje nebo redukuje. Měří se změna proudu při konstantním napětí. Selektivita se dosahuje nastavením optimálního potenciálu. Další zvýšení selektivity se dosáhne při použití chemicky modifikované elektrody [33], nebo několika různých elektrod. Jako oxidující značka se používá např. HRP pro substrát tetramethylbenzidin, a produkt je pak redukován na uhlíkové elektrodě.
UV/VIS absorbance je běžná nedestruktivní metoda při CE. Její nevýhodou je poměrně nízká senzitivita ve srovnání s LIF. Stanovovaný analyt nebo značka musí obsahovat chromofor s dostatečně vysokou molární absorptivitou při monitorované vlnové délce.
Hmotnostní spektrometrie vyžaduje takovou úpravu CE imunoanalýzy, kdy se použije pufr s nejnižší možnou koncentrací solí, aby se nemohly usazovat ve spektrometru, např. v trysce při elektrospreji. Limitované množství vzorku, které se při MS používá, nedovoluje dosáhnout nízký LOD, nicméně lze takto jednoznačně určit analyt. MS detekce je výhodná při stanovení látek s podobnou elektroforetickou mobilitou, např. deriváty kodeinu v moči [34]. Jednotlivé antigeny lze stanovit z poměru hmotnosti a náboje (m/z) jim odpovídajících iontů.
Povrchová plazmonová rezonance je technika, při které se sleduje změna indexu lomu v čase na kovovém povrchu (Au) při adsorpci velkých molekul po CE (např. LOD pro IgG je 2 fmol) [35]. Nevýhodou metody je značná závislost indexu lomu na teplotě vodného roztoku (změna indexu lomu je 10-4/1 °C). Při dobré termoregulaci lze metodu použít, když se v imunoreakci před CE používá Ab s vysokou afinitou vůči stanovovanému Ag, aby po CE docházelo ke skokovým změnám detekovaného indexu lomu.
Autor oceňuje pomoc Ing. Jaroslavy Vávrové, Ph.D. při grafické úpravě ilustrací.
Do redakce došlo 2. 3. 2016
Adresa pro korespondenci
Doc. RNDr. Petr Štern, CSc.
Mimoňská 637/16
190 00 Praha 9
e-mail: petr.stern@atlas.cz
Sources
1. Kusnezow, W., Syagailo,Y. V., Goychuk, I., Hoheisel, J. D., Wild, D. G. Antibody microarrays: the crucial impact of mass transport on assay kinetics and sensitivity. Expert Rev. Mol. Diagn., 2006, 6(1), p. 111–124.
2. Kusnezow, W., Jacob, A., Walijew, A., Diehl, F., Hoheisel, J. D. Antibody microarrays: an evaluation of production parameters. Proteomics, 2003, 3(3), p. 254–264.
3. Angenendt, P., Glokler, J., Sobek. J., Lehrach, H., Cahill, D. J. Next generation of protein microarray support materials: evaluation for protein and antibody microarray applications. J. Chromatogr. A, 2003, 1009(1–2), p. 97–104.
4. Angenendt, P., Glokler, J., Murphy, D., Lehrach, H., Cahill, D. J. Toward optimized antibody microarrays: a comparison of current microarray support materials. Anal. Biochem., 2002, 309(2), p. 253–260.
5. Brueggemeier, S. B., Kron, S. J., Palecek, S. Use of protein-acrylamide co-polymer hydrogels for measuring protein concentration and activity. Anal. Biochem., 2004, 329(2), p. 180–189.
6. Miller, J. C., Zhou, H., Kwekel, J., et al. Antibody microarray profiling of human prostate cancer sera: antibody screening and identification of potential biomarkers. Proteomics, 2003, 3(1), 56–63.
7. Stillman, B. A., Tonkinson, J. L. FAST slides: a novel surface for microarrays. Biotechniques, 2000, 29(3), p. 630–635.
8. Haab, B. B., Dunham, M. J., Brown, P. O. Protein microarrays for highly parallel detection and quantitation of specific proteins and antibodies in complex solutions. Genome Biol., 2001, 2(2), RESEARCH0004.
9. Haab, B. B. Antibody arrays in cancer research. Mol. Cell. Proteomics, 2005, 4(4), p. 377–383.
10. Pawlak, M., Schick, E., Bopp, M. A., Schneider, M. J., Oroszlan, P., Ehrat, M. Zeptosens’ protein microarrays: a novel high performance microarray platform for low abundance protein analysis. Proteomics, 2002, 2(4), p. 383–393.
11. Kusnezow, W., Syagailo, Y. V., Rueffer, S. et al. Kinetics of antigen binding to antibody microarray: strong limitation by mass transport to the surface. Proteomics, 2006, 6(3), p. 794–803.
12. Pardue, H. L. The inseparable triad: analytical sensitivity, measurement uncertainty, and quantitative resolution. Clin. Chem., 1997, 43(10), p. 1831–1837.
13. Ekins, R., Edwards, P. On the meaning of ‘sensitivity’. Clin. Chem., 1997, 43(10), p. 1824–1831.
14. Brueggemeier, S. B., Kron, S. J., Palecek, S. Use of protein-acrylamide co-polymer hydrogels for measuring protein concentration and activity. Anal. Biochem., 2004, 329(2), p. 180–189.
15. Haab, B. B. Antibody arrays in cancer research Molecular & Cellular Proteomics, 2005, 4(4), p. 377–383.
16. Barry, R., Diggle, T., Terrett, J., Soloviev, M. Competitive assay formats for high-throughput affinity arrays. J. Biomol. Screen., 2003, 8, p. 257–263.
17. Schweitzer, B., Roberts, S., Grimwade, B., et al. Multiplexed protein profiling on microarrays by rolling-circle amplification. Nat. Biotechnol., 2002, 20(4), p. 359–365.
18. Saviranta, P., Okon, R., Brinker, A., Warashina, M., Eppinger, J., Geierstanger, B. H. Evaluating sandwich immunoassays in microarray format in terms of the ambient analyte regime. Clin. Chem., 2004, 50(10), p. 1907–1920.
19. Woodbury, R. L., Varnum, S. M., Zangar, R. C. Elevated HGF levels in sera from breast cancer patients detected using a protein microarray ELISA. J. Proteome Res., 2002, 1(3), p. 233–237.
20. Woolley, Ch., F., Hayes, M., A. Recent developments in emerging microimmunoassays. Bioanalysis, 2013, 5(2), p. 245–264.
21. Langenhorst, R. J., Lawson, S., Kittawornrat, A. Development of a fluorescent microsphere immunoassay for detection of antibodies against porcine reproductive and respiratory syndrome virus using oral fluid samples as an alternative to serum-based assays. Clin. Vacc. Immunol., 2011, 19, p. 180–189.
22. Vignali, D. A. A. Multiplexed particle-based flow cytometric assays. J. Immunol. Methods, 2000, 243(1-2), p. 243–255.
23. Clavijo, A., Hole, K., Li, M., Collignon, B. Simulta-neous detection of antibodies to foot-and-mouth disease non-structural proteins 3ABC, 3D, 3A and 3B by a multiplexed Luminex assay to differentiate infected from vaccinated cattle. Vaccine, 2006, 24(10), p. 1693–1704.
24. Soh, N., Tanaka, M., Hirakawa, K., et al. Sequential injection immunoassay for environmental measurements. Anal. Sci., 2011, 27(11), p. 1069–1076.
25. Moser, A. C., Hage, D. S. Capillary electrophoresis-based immunoassays: principles & quantitative applications. Electrophoresis, 2008, 29(16), p. 3279–3295.
26. German, I., Kennedy, R. T. Rapid simultaneous determination of glucagon and insulin by capillary electrophoresis immunoassays. J. Chromatogr. B Biomed. Sci. Appl., 2000, 742(2), p. 353–62.
27. Phillips, T. M., Wellner, E. F. Analysis of inflammatory biomarkers from tissue biopsies by chip-based immunoaffinity CE. Electrophoresis, 2007, 28(17), p. 3041–8.
28. Taylor, J., Picelli, G., Harrison, D. J. An evaluation of the detection limits possible for competitive capillary electrophoretic immunoassays. Electrophoresis, 2001, 22(17), p. 3699–3708.
29. Wang, J., Ren, J. A sensitive and rapid immunoassay for quantification of CA125 in human sera by capillary electrophoresis with enhanced chemiluminescence detection. Electrophoresis, 2005, 26(12), p. 2402–2408.
30. Attiya, S., Dickinson-Laing, T., Cesarz, J., et al. Affinity protection chromatography for efficient labeling of antibodies for use in affinity capillary electrophoresis. Electrophoresis, 2002, 23(5), p. 750–758.
31. Phillips, T. M., Wellner, E. Measurement of neuropeptides in clinical samples using chip-based immunoaffinity capillary electrophoresis J. Chromatogr. A., 2006, 1111(1), p. 106–111.
32. Wang, J., Huang, W., Liu, Y., Cheng, J., Yang. J. Ca-pillary electrophoresis immunoassay chemiluminescence detection of zeptomoles of bone morphogenic protein-2 in rat vascular smooth muscle cells. Anal. Chem., 2004, 76(18), p. 5393–5398.
33. Vandaveer, W. R., Pasas, S. A., Martin, R. S., Lunte, S. M. Recent developments in amperometric detection for microchip capillary electrophoresis. Electrophoresis, 2002, 23(21), p. 3667–3677.
34. Wey, A. B., Caslavska, J., Thormann, W. Analysis of codeine, dihydrocodeine and their glucuronides in human urine by electrokinetic capillary immunoassays and capillary electrophoresis – ion trap mass spektrometry J. Chromatogr. A., 2000, 895(1-2), p. 133–146.
35. Whelan, R. J., Zare, R. N. Surface plasmon resonance detection for capillary electrophoresis separations. Anal. Chem., 2003, 75(6), p. 1542–1547.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapist
Article was published inClinical Biochemistry and Metabolism

2016 Issue 2-
All articles in this issue
- Čipy a kapilární elektroforéza v imunoanalýze
- Ověření použitelnosti poměru expresí genů NPHS2 a SYNPO při diagnostice fokální segmentální glomerulosklerózy a minimálních změn glomerulů
- Aktivita fosfomanomutázy 2 u pacientů s podezřením na dědičnou poruchu glykosylace
- Kvalita, kontrola a validace glukometrů a CGM systémů. Přehled stavu.
- Postanalytická fáze a interpretace laboratorního testu (post-postanalytická fáze)
- Changes in Paraoxonase 1 activity and concentration of conjugated dienes in connection with number of metabolic syndrome components
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kvalita, kontrola a validace glukometrů a CGM systémů. Přehled stavu.
- Postanalytická fáze a interpretace laboratorního testu (post-postanalytická fáze)
- Aktivita fosfomanomutázy 2 u pacientů s podezřením na dědičnou poruchu glykosylace
- Ověření použitelnosti poměru expresí genů NPHS2 a SYNPO při diagnostice fokální segmentální glomerulosklerózy a minimálních změn glomerulů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

