-
Medical journals
- Career
Patofyziologie kardiorenálního syndromu
Authors: F. Málek
Published in: Kardiol Rev Int Med 2012, 14(4): 233-236
Category:
Overview
Kardiorenální syndrom je definován jako stav, kdy dysfunkce jednoho z orgánů – srdce nebo ledvin – je schopná a odpovědná za zahájení poškození druhého orgánu prostřednictvím společných hemodynamických, neurohumorálních, imunologických a biochemických zpětných vazeb. V patofyziologii kardiorenálního syndromu se zřejmě uplatňuje hned několik faktorů: snížení srdečního výdeje spolu se zvýšením renálního žilního a intraabdominálního tlaku, nedostatečná blokáda systému renin-angiotenzin-aldosteron, aktivace nervových zakončení sympatiku v ledvinných tepnách, oxidativní stres, anemie a snížená produkce erytropoetinu a další.
Klíčová slova:
kardiorenální syndrom – srdeční selhání – renální dysfunkce – patofyziologieDefinice kardiorenálního syndromu
Kardiorenální syndrom (cardiorenal syndrome – CRS) byl v roce 2004 definován pracovní skupinou vědeckých pracovníků v ústavu National Heart, Lung and Blood Institute jako stav, při kterém je léčba zaměřená na odstranění příznaků srdečního selhání limitována zhoršením ledvinných funkcí. Tato definice byla některými autory kritizována, a tak vznikla patofyziologická definice kardiorenálního syndromu, která zdůrazňuje vzájemný a oboustranný vliv v interakci selhání srdce a ledvin.
Podle této definice dysfunkce jednoho z orgánů je schopná a odpovědná za zahájení poškození druhého orgánu prostřednictvím společných hemodynamických, neurohumorálních, imunologických a biochemických zpětných vazeb [1–3].
Tato nová definice vychází z poznatků o tom, že ledvinná nedostatečnost u srdečního selhání nevzniká pouze následkem poklesu průtoku ledvinami u pacientů se sníženou systolickou funkcí levé komory. Nové poznatky jsou podpořeny vědeckými důkazy o významu žilní kongesce, neurohumorální aktivace, anemie, oxidativního stresu a renální sympatické aktivity [1,4,5].
Epidemiologie kardiorenálního syndromu
Renální insuficience (RI) je u pacientů se srdečním selháním častá a má i negativní prognostický význam. Výskyt srdečního selhání a RI v populaci stoupá. Je to dáno za prvé stárnutím populace, kdy u starších jedinců je výskyt CHSS a RI vyšší, za druhé kvůli pokrokům v léčbě některých kardiovaskulárních onemocnění, akutních koronárních syndromů, hypertenze a v terapii nemocných s diabetes mellitus se stále více polymorbidních pacientů dostává do stadia pokročilých orgánových poškození.
U pacientů s akutním srdečním selháním má 30 % jedinců významné snížení ledvinných funkcí. U pacientů s chronickým srdečním selháním (CHSS) mělo podle některých autorů clearance kreatininu < 30 ml/min 39 % nemocných ve funkční třídě NYHA IV a 31 % jedinců ve třídě NYHA III. V současné době je zřejmé, že koexistence srdečního selhání a renální insuficience má velmi špatnou prognózu [1].
Dopad renálního onemocnění na prognózu pacientů se srdečním selháním
RI je významným a nezávislým rizikovým faktorem mortality u pacientů se srdečním selháním. Výskyt srdečního selhání je v korelaci se snížením glomerulární filtrace. RI se vyskytuje u pacientů s CHSS častěji než u nemocných s kardiovaskulárním onemocněním a normální srdeční funkcí [6].
Vztah mezi stupněm RI a rizikem úmrtí u pacientů s CHSS byl mezi prvními vědeckými pojednáními cílem studie Hillegeho a spolupracovníků. Studie zahrnovala 1 906 pacientů s pokročilým CHSS funkční klasifikace podle New York Heart Association (NYHA) III/IV, s významnou systolickou dysfunkcí levé komory s ejekční frakcí ≤ 35 %. Průměrný odhad glomerulární filtrace (eGFR = estimated glomerular filtration rate) souboru hodnocený podle rovnice Cockcroft-Gaulta byl 62,9 ml/min. Výchozí eGFR se ukázala být nejvýznamnějším predikátorem mortality, následovala funkční třída NYHA a používání inhibitorů angiotenzin konvertujícího enzymu (ACE-I). Pacienti v nejnižší kvartile eGFR (< 44 ml/min) měli téměř třikrát vyšší riziko úmrtí než jedinci v nejvyšší kvartile GFR (> 76 ml/min) – relativní riziko 2,85, p < 0,001. Prediktivní hodnota ejekční frakce levé komory (EF LK) nebyla statisticky významná (p = 0,053). Tato práce ukázala, že stupeň RI je silnějším prediktorem mortality než poškození srdeční funkce hodnocené ejekční frakcí levé komory a funkční třídou NYHA. Stupeň poškození renálních funkcí byl rovněž na EF LK nezávislý [7].
Onemocnění ledvin a kardiovaskulární riziko
Výskyt kardiovaskulárních onemocnění a kardiovaskulární mortalita je u pacientů, kteří se dostanou do konečného stadia renálního selhání (end-stage renal disease – ESRD), velmi vysoká. Více než 43 % ze všech úmrtí u pacientů v konečném stadiu renálního onemocnění je způsobeno kardiovaskulární příčinou. Úmrtí na vaskulární onemocnění je u pacientů s chronickou renální insuficiencí deset - až dvacetkrát častější než u obecné populace [8].
Velmi vysoká je i kardiovaskulární morbidita u pacientů s ESRD. Odhaduje se, že až 75 % nemocných s ESRD má srdeční hypertrofii a přibližně 40 % pacientů koronární nemoc. Riziko kardiovaskulární morbidity a mortality je však vysoké ve všech stadiích chronického onemocnění ledvin. Kromě tradičních rizikových faktorů, které jsou společné pro chronickou renální insuficienci a srdeční a cévní onemocnění, jako jsou hypertenze, diabetes mellitus a dyslipidemie, se na riziku vzniku kardiovaskulárních onemocnění zřejmě podílejí i faktory spojené s uremií: renální anemie a poruchy kalciofosfátového metabolizmu [9].
Je známo, že i mírný pokles renálních funkcí je spojen s významným vzestupem kardiovaskulárního rizika [10,11]. V současné době máme dostatečné množství důkazů pro to, že vzestup koncentrace kreatininu, mírný pokles glomerulární filtrace a přítomnost proteinurie jsou významnými a nezávislými rizikovými faktory vzniku kardiovaskulárních onemocnění [12]. Porucha renálních funkcí je negativním prognostickým faktorem u pacientů s akutními koronárními syndromy, u pacientů podstupujících perkutánní koronární intervenci a chirurgickou revaskularizaci myokardu [13–15].
Riziko kardiovaskulárních onemocnění vzniká ještě před dosažením stadia ESRD, a proto je nezbytná včasná a pravidelná kontrola rizikových faktorů. Hlavními faktory, které jsou spojené s rizikem akcelerované aterosklerózy odpovědné za vznik koronární nemoci a infarktu myokardu, tedy rizikem ischemické kardiopatie, jsou hypertenze, kouření cigaret a diabetes mellitus. Dále faktory specifické pro renální insuficienci, tedy anemie, volumové přetížení a poruchy kalciofosfátového metabolizmu. Faktory spojenými s rizikem uremické kardiopatie jsou: dyslipidemie, hyperhomocysteinemie, oxidativní stres. Ovlivnění těchto faktorů je hlavním principem kardioprotekce u pacientů již od časných stadií chronického onemocnění ledvin [16].
Nová hypotéza patofyziologie CRS
Hypotéza nízkého průtoku
Podle tradiční hypotézy byl za progresivní pokles renálních funkcí u srdečního selhání odpovědný nedostatečný průtok krve ledvinami při sníženém srdečním výdeji. Pokles průtoku krve ledvinami je opravdu odpovědný za nadměrnou aktivaci systému RAAS, která je zahájena velmi rychlým uvolněním reninu z juxtaglomerulárních buněk. Některé nedávno publikované práce však ukázaly, že neexistuje žádný vztah mezi ledvinnými funkcemi a srdečním výdejem, rovněž zvýšení srdečního výdeje léčbou nevedlo ke zlepšení renálních funkcí, ani k prevenci úmrtí či rehospitalizace. To ukázala například studie ESCAPE (Evaluation Study of Congestive Heart Failure and Pulmonary Artery Catheterization Effectiveness) u 433 pacientů přijatých pro akutní dekompenzaci chronického srdečního selhání s hemodynamickou monitorací pomocí plicnicového katetru. Tato práce potvrdila výsledky dalších prací, tedy že hemodynamicky řízená léčba akutního srdečního selhání, která vedla ke zvýšení srdečního výdeje a poklesu tlaku v plicnici v zaklínění, nevede k souběžnému zlepšení renálních parametrů [17,18].
Zvýšení centrálního žilního a intraabdominálního tlaku
Srdeční selhání je charakterizováno zvýšením centrálního žilního tlaku, které snižuje tlakový gradient na úrovni glomerulární kapilární sítě. Stoupá množství důkazů o tom, že zvýšení centrálního žilního tlaku, resp. renálního žilního tlaku a intraabdominálního tlaku (IAP) je spojeno s progresivním poklesem ledvinných funkcí u pacientů se srdečním selháním.
Experimentální práce prokázaly, že zvýšení renálního žilního tlaku nad 20 mmHg je spojeno se signifikantním poklesem diurézy a zástavou tvorby moči při tlaku nad 25 mmHg. Zvýšení renálního žilního tlaku mělo větší dopad na pokles diurézy než snížení arteriálního tlaku.
Podobný efekt byl prokázán pro vzestup intraabdominálního tlaku. Pokusy s břišní kompresí u zvířecích modelů prokázaly významný pokles glomerulární filtrace a průtoku krve ledvinami při vzestupu intraabdominálního tlaku nad 20 mmHg. Intraabdominální hypertenze je definována jako IAP ≥ 12 mmHg a zvýšení IAP jako ≥ 8 mmHg. Významné zvýšení IAP bylo v klinických studiích pacientů s akutní dekompenzací CHSS a EF LK < 20 % zjištěno u více než 50 % jedinců. Tito pacienti měli významně nižší GFR než pacienti s normálním IAP. Pokles IAP v průběhu léčby pak predikoval zlepšení renální funkce (obr. 1) [19,21].
Image 1. Patofyziologie kardiorenálního syndromu. 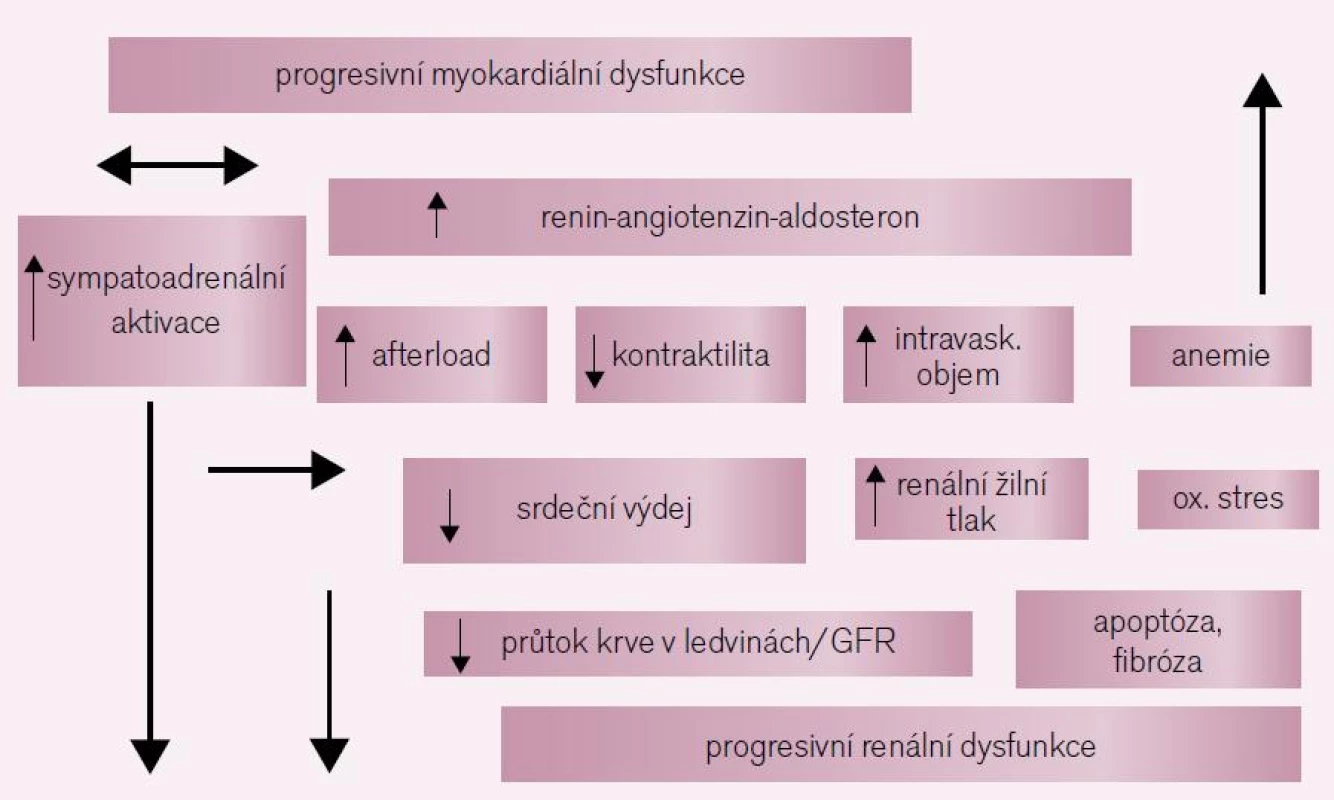
Sympatoadrenální hyperaktivace
Nežádoucí následky zvýšené aktivace sympatiku jsou dobře známy. Je to především snížení denzity receptorů beta-1. V poslední době je věnována pozornost systémovému efektu aktivace renálního sympatiku. Při progresivním srdečním selhání dochází k poklesu renálního průtoku a renální vazokonstrikci zprostředkované baroreceptory, k aktivaci nervových zakončení sympatiku v ledvinných tepnách a uvolnění katecholaminů do cirkulace. U pacientů se srdečním selháním a pokročilou ledvinnou dysfunkcí je situace zhoršena snížením vylučování katecholaminů ledvinami. V současné době se objevila řada důkazů pro to, že aktivace renálního sympatiku má přímé vaskulární systémové účinky. Studie s oboustrannou katetrovou ablací renálního sympatiku prokázaly snížení produkce noradrenalinu ledvinami, snížení plazmatické reninové aktivity a snížení krevního tlaku u pacientů s rezistentní arteriální hypertenzí [22,23].
Dalším nepřímým dokladem o úloze renálního sympatiku v patofyziologii kardiorenálního syndromu jsou práce o významu renálního obratu noradrenalinu („renal norepinephrine spillover“). Starší práce ukázaly při simultánním katetrizačním vyšetření srdce a ledvin se stanovením koncentrace endogenního a exogenního noradrenalinu (při kontinuální intravenózní infuzi s noradrenalinem) z krve odebrané z koronárního sinu a z koronární cirkulace a noradrenalinu z krve odebrané z renálních žil a tepen, že renální obrat noradrenalinu je u pacientů se srdečním selháním významně vyšší než kardiální a celkový „spillover“ (z odběru krve z periferní žíly a tepny) [24]. Studie Magnuse Peterssona pak prokázala, že renální obrat noradrenalinu je nejvýznamnějším ukazatelem rizika úmrtí anebo srdeční transplantace u nemocných s pokročilým chronickým srdečním selháním zařazených na čekací listinu kandidátů transplantace, a dokonce významnější prognostický ukazatel, než byly věk, glomerulární filtrace a ejekční frakce levé komory [25].
Význam renálního sympatiku má některé terapeutické implikace. Ablace renálního sympatiku u farmakorezistentní hypertenze byla spojena kromě poklesu krevního tlaku také se zlepšením systolické a diastolické funkce levé komory a regresí srdeční hypertrofie. Kromě toho renální denervace vedla ke snížení celkového (o 42 %) a renálního obratu noradrenalinu (48 % až 75 %) a ke snížení aktivity periferního svalového sympatiku (hodnocené mikroneurografií peroneálního nervu) [26,27].
Na základě těchto patofyziologických poznatků byly zahájeny studie s renální denervací u pacientů s chronickým srdečním selháním. Metoda renální denervace je však v současné době považována za metodu experimentální, a proto by měla být prováděna pouze v centrech s dostatečným technickým, odborným a organizačním zázemím [28–30].
Renální dysfunkce a osa renin-angiotenzin-aldosteron
Aktivace systému renin-angiotenzin-aldosteron (RAAS) je u srdečního selhání spojena s řadou nepříznivých dějů, naopak inhibice RAAS pomocí inhibitorů ACE a antagonistů aldosteronu vede k poklesu adrenergního tonu, k zlepšení endoteliální funkce a prevence myokardiální fibrózy. Málo je známo o dlouhodobém efektu RAAS inhibice na renální funkce pacientů s CHSS. Inhibitory ACE a antagonisté receptoru angiotenzinu II mají významný renoprotektivní efekt u pacientů s arteriální hypertenzí a nediabetickým onemocněním ledvin a u jedinců s diabetickou nefropatií. U pacientů se srdečním selháním dochází i při terapii blokátory RAAS k vzestupu koncentrací angiotenzinu II v cirkulaci i lokálně se všemi nepříznivými následky včetně poškození ledvin. Tento fenomén je označován jako únik angiotenzinu z ACE inhibice. Angiotenzin II přímo přispívá k poškození ledvinného parenchymu prostřednictvím aktivace cytokinů a stimulace fibroblastů s buněčným růstem, aktivací zánětu a rozvojem fibrózy [31].
Oxidativní stres a endoteliální dysfunkce
Stoupá množství důkazů pro význam oxidativního stresu jako hlavního spojovatele mezi progresivní kardiální a renální dysfunkcí u pacientů s CRS prostřednictvím volných kyslíkových radikálů. Při aktivaci RAAS dochází prostřednictvím angiotenzinu II k aktivaci oxidáz s nadprodukcí reaktivních forem kyslíku a inaktivaci oxidu dusného (NO). Práce na zvířecích modelech prokázaly, že experimentálně navozené srdeční selhání podvazem koronární arterie je spojeno s poklesem produkce NO v ledvinách [32].
Erytropoetin a anemie u kardiorenálního syndromu
Anemie se vyskytuje u pacientů se srdečním selháním a u nemocných s chronickým onemocněním ledvin často. Přítomnost anemie zvyšuje u pacientů se srdečním selháním mortalitu, prodlužuje dobu hospitalizace a zvyšuje riziko rehospitalizace. Stále není jasné, zda anemie je příčinou, nebo jen známkou progresivního srdečního a ledvinného poškození.
Nízké koncentrace erytropoetinu jsou typické pro pacienty s primárním renálním poškozením, u pacientů se srdečním selháním může být koncentrace erytropoetinu i zvýšená, ale následkem aktivace zánětu může být snížena citlivost tkání vůči erytropoetinu.
U pacientů s CRS je anemie spojená s nedostatečnou produkcí erytropoetinu, která může být přímo odpovědná za renální poškození u CRS: erytropoetin brání apoptóze buněk renálního parenchymu a snižuje i oxidativní stres.
Studie s léčebným podáním erytropoetinu u srdečního selhání zatím prokazují zlepšení hemodynamických parametrů, zlepšení tolerance zátěže a funkční symptomatologie, a to bez nepříznivého dopadu na renální funkce [33].
Další cíle renálního poškození
Arginin-vazopresin hraje významnou úlohu v regulaci soli a vody, jeho koncentrace jsou zvýšené u pokročilého srdečního selhání u pacientů s otoky a hyponatremií. Studie antagonistů receptoru vazopresinu (receptoru V1) prokázaly zvýšení diurézy, pokles hmotnosti a korekci hyponatremie, tyto účinky však nebyly spojeny se zlepšením ledvinných funkcí či dopadem na klinické výstupy.
Význam adenozinu v patofyziologii CRS nebyl rovněž dosud jednoznačně zhodnocen. Pilotní studie antagonistů A1 receptoru adenozinu ukázaly zvýšení GFR o 32 %, klinická studie s antagonistou adenozinu rolofyllinem však předchozí pozitivní výsledky nepotvrdila.
Naděje je vkládána do látek, které stimulací cGMP zlepšují průtok krve ledvinami a zvyšují diurézu [34,35].
Závěry
Výskyt renální dysfunkce v populaci pacientů s akutním a chronickým srdečním selháním je častý. Častý je i výskyt kardiorenálního syndromu, jehož incidence bude pravděpodobně rovněž stoupat. K rozvoji kardiorenálního syndromu přispívá řada faktorů, ukazuje se důležitost souběžného a vzájemného působení řady patofyziologických mechanizmů. Znalost patofyziologie kardiorenálního syndromu má terapeutické konsekvence. Ověřená i experimentální léčba srdečního selhání zatím nebrání progresivnímu renálnímu poškození. Hledají se nové cesty v oblasti farmakoterapie, testují se i nefarmakologické postupy, jako je renální sympatická denervace, jejíž efektivita je testována ve studiích pacientů s farmakologicky rezistentní esenciální arteriální hypertenzí.
Doručeno do redakce 16. 7. 2012
Přijato po recenzi 10. 8. 2012
doc. MUDr. Filip Málek, Ph.D., MBA
Ambulance srdečního selhání a hypertenze,
Kardiovaskulární centrum
Nemocnice Na Homolce, Praha
Filip.Malek@homolka.cz
Sources
1. Bock JS, Gottlieb SS. Cardiorenal Syndrome: New Perspectives. Circulation 2010; 121 : 2592–2660.
2. Ronco C, House AA, Haapio M. Cardiorenal syndrome: refining the definition of a complex symbiosis gone wrong. Intensive Care Med 2008; 34 : 957–962.
3. Dzau VJ. Renal and circulatory mechanisms in congestive heart failure. Kidney Int 1987; 31 : 1402–1415.
4. Bongartz LG, Cramer MJ, Doevendans PA et al. The severe cardiorenal syndrome: ‚Guyton revisited‘. Eur Heart J 2005; 26 : 11–17.
5. Shlipak MG, Massie BM. The clinical challenge of cardiorenal syndrom. Circulation 2004; 110 : 1514–1517.
6. McAlister FA, Ezekowitz J, Tonelli M et al. Renal insufficiency and heart failure: prognostic and therapeutic implications from a prospective cohort study. Circulation 2004; 109 : 1004–1009.
7. Hillege HL, Girbes AR, de Kam PJ et al. Renal function, neurohormonal activation, and survival in patients with chronic heart failure. Circulation 2000; 102 : 203–210.
8. Foley RN, Parfrey PS, Sarnak MJ. Epidemiology of cardiovascular disease in chronic renal disease. J Am Soc Nephrol 1998; 9 (Suppl 12): S16–S23.
9. Sarnak MJ. Cardiovascular complications in chronic kidney disease. Am J Kidney Dis 2003; 41 (5 Suppl): 11–17.
10. Henry RM, Kostense PJ, Bos G et al. Mild renal insufficiency is associated with increased cardiovascular mortality: The Hoorn Study. Kidney Int 2002; 62 : 1402–1407.
11. Fried LF, Shlipak MG, Crump C et al. Renal insufficiency as a predictor of cardiovascular outcomes and mortality in elderly individuals. J Am Coll Cardiol 2003; 41 : 1364–1372.
12. Sarnak MJ, Levey AS, Schoolwerth AC et al. American Heart Association Councils on Kidney in Cardiovascular Disease, High Blood Pressure Research, Clinical Cardiology, and Epidemiology and Prevention. Kidney disease as a risk factor for development of cardiovascular disease: a statement from the American Heart Association Councils on Kidney in Cardiovascular Disease, High Blood Pressure Research, Clinical Cardiology, and Epidemiology and Prevention. Circulation 2003; 108 : 2154–2169.
13. Best PJ, Lennon R, Ting HH et al. The impact of renal insufficiency on clinical outcomes in patients undergoing percutaneous coronary interventions. J Am Coll Cardiol 2002; 39 : 1113–1119.
14. Rao V, Weisel RD, Buth KJ et al. Coronary artery bypass grafting in patients with non-dialysis-dependent renal insufficiency. Circulation 1997; 96 (9 Suppl): II38–II45
15. Gibson CM, Pinto DS, Murphy SA et al. TIMI Study Group. Association of creatinine and creatinine clearance on presentation in acute myocardial infarction with subsequent mortality. J Am Coll Cardiol 2003; 42 : 1535–1543.
16. Jungers P, Qualim Z, Nguyen-Khoa T et al. Cardioprotection: an essential component for predialysis chronic renal failure treatment. Nephrologie 2003; 24 : 79–88.
17. Nohria A, Hasselblad V, Stebbins A et al. Cardiorenal interactions: insights frome the ESCAPE trial. J Am Coll Cardiol 2008; 51 : 1268–1274.
18. Weinfeld MS, Chertow GM, Stevenson LW. Aggravated renal dysfunction during intensive therapy for advanced chronic heart failure. Am Heart J 1999; 138 : 285–290.
19. Mullens W, Abrahams T, Skouri HN et al. Elevated intra-abdominal pressure in acute decomensated heart failure: a potential contributor to worsening renal function? J Am Coll Cardiol 2008; 51 : 300–306.
20. Mullens W, Abrahams Z, Francis GS et al. Importance of venous congestion for worsening renal function in advanced decompensated heart failure. J Am Coll Cardiol 2009; 53 : 589–296.
21. Malbrain ML, Cheatham ML, Kirkpatrick SM et al. Results from the International Conference of Experts on Intra-abdominal Hypertension and Abdominal Compartment Syndrome. I. Definitions. Intensive Care Med 2006; 32 : 1722–1732.
22. Krum H, Schlaich M, Whitbourn R et al. Catheter--based renal sympathetic denervation for resistant hypertension: a multicentre safety and proof-of-principle cohort study. Lancet 2009; 373 : 1275–1281.
23. McKelvie RS, Moe GW, Cheung A et al. The 2011 Canadian Cardiovascular Society Heart Failure Management Guidelines Update: Focus on Sleep Apnea, Renal Dysfunction, Mechanical Circulatory Support, and Paliative Care. Can J Cardiol 2011; 27 : 319–338.
24. Esler M, Jennings G, Korner P et al. Assessment of human sympathetic nervous system activity from measurments of norepinephrine turnover. Hypertension 1988; 11 : 3–20.
25. Petersson M, Friberg P, Eisenhofer G et al. Long--term outcome in relation to renal sympathetic activity in patients with chronic heart failure. Eur Heart J 2005; 26 : 906–913.
26. Schlaich MP, Sobotka PA, Krum H et al. Renal sympathetic-nerve ablation for uncontrolled hypertension. N Engl J Med 2009; 361 : 932–934.
27. Brandt MC, Mahfoud F, Reda S et al. Renal Sympathetic Denervation Reduces Left Ventricular Hypertrophy and Improves Cardiac Function in Patients With Resistant Hypertension. J Am Coll Cardiol 2012; 59 : 901–909.
28. Schmieder RE, Redon J, Grasso G et al. ESH Position Paper: Renal Denervation – an interventional therapy of resistant hypertension. J Hypertens 2012; 30 : 837–841.
29. Widimský P, Filipovský J, Widimský J Jr et al. Odborné stanovisko České kardiologické společnosti a České společnosti pro hypertenzi k provádění katetrizačních renálních denervací (RDN) v České republice. Cor Vasa 2012; 54 : 155–159.
30. Neužil P, Reddy VY, Schejbalová M et al. Katetrizační ablace renálního sympatiku u nemocných s rezistentní formou arteriální hypertenze. Interv Akut Kardiol 2012; 11 : 48–51.
31. Remuzzi G, Perico N, Mancia M et al. The role of the renin-angiotensin-aldosteron system in the progression of chronic kidney dinase. Kidney Int 2005; Suppl: S57–S65.
32. Tojo A, Onozato ML, Kobayashi N et al. Angiotensin II and oxidative stress in Dahl Salt-sensitive rat with heart failure. Hypertension 2002; 40 : 834–839.
33. Jie KE, Verhaar MC, Cramer MJ et al. Erythropoetin and the cardiorenal syndrome: cellular mechanisms on the cardiorenal conectors. Am J Physiol Renal Physiol 2006; 291: F932–944.
34. Kostam MA. Gheorghiade M, Burnett JC Jr et al. Efficacy of Vasopressin Antagonism in Heart Failure Outcome Study With Tolvaptan (EVEREST) Investigators. Effects of oral tolvaptan in patiens hospitalized for worsening heart failure: the EVEREST Otucome Trial. JAMA 2007; 297 : 1319–1331.
35. Funaya H, Kitakaze M, Node K et al. Plasma adenosine levels increase in patiens with chronic heart failure. Circulation 1997; 95 : 1348–1353.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2012 Issue 4-
All articles in this issue
- Kardiorenální syndrom – pohled nefrologa
- Kardiorenální syndrom u pacientů s akutním srdečním selháním
- Kardio-renálny syndróm u chronického srdcového zlyhávania – pohľad kardiológa
- Akutní selhání ledvin a kardiovaskulární komplikace
- Chronické renální selhání a kardiovaskulární příhody
- Candesartan v léčbě hypertenze a srdečního selhání
- Stenóza kmene levé věnčité tepny způsobená kompresí dilatovanou plicnicí
- Twiddlerův syndrom – neobvyklá příčina oversensingu vedoucí k inadekvátním výbojům implantabilního kardioverteru-defibrilátoru
- Ovlivní podávání redukované formy koenzymu Q10 statinovou myopatii?
- Patofyziologie kardiorenálního syndromu
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kardiorenální syndrom – pohled nefrologa
- Ovlivní podávání redukované formy koenzymu Q10 statinovou myopatii?
- Kardio-renálny syndróm u chronického srdcového zlyhávania – pohľad kardiológa
- Akutní selhání ledvin a kardiovaskulární komplikace
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

