-
Medical journals
- Career
Ovlivní podávání redukované formy koenzymu Q10 statinovou myopatii?
: L. Zlatohlávek; R. Češka
: Kardiol Rev Int Med 2012, 14(4): 273-276
:
Úvod:
Statiny signifikantně snižují kardiovaskulární mortalitu a morbiditu. V České republice užívá statiny cca 800 tisíc pacientů. Nicméně pro jejich nežádoucí účinek – statinovou myopatii – nemohou být podávány citlivým jedincům v adekvátní dávce nebo vůbec.Cíl:
Cílem projektu bylo zjistit, zda podávání redukované formy koenzymu Q10 sníží projevy statinové myopatie u pacientů.Soubor a metody:
Do sledování bylo zařazeno 28 pacientů (Ø 60,6 let, 18 žen) užívajících různé typy a dávky statinů. Svalová bolest a slabost byly sledovány pomocí bodové škály od jedné do deseti. Pacientům byla podávána redukovaná forma koenzymu Q10 v dávce dvakrát 30 mg po dobu šesti měsíců. Analýza výsledků byla provedena pomocí standardních statistických metod.Výsledky:
Svalová bolest klesla po šesti měsících užívání KQ10 o 53,88 % a svalová slabost o 44 %. Sérová koncentrace KQ10 stoupla o 194 %. Současně došlo k lepší kompenzaci dyslipidemie.Závěr:
Po šestiměsíčním podávání redukovaného KQ10 došlo ke zmírnění svalové bolesti a slabosti a současně ke zlepšení kompliance pacientů k léčbě statiny.Klíčová slova:
statiny – statinová myopatie – svalová bolest – svalová slabost – redukovaná forma koenzymu Q10Úvod
Statiny, inhibitory 3-hydroxy-3-methylglutarylkoenzym A reduktázy významně snižují kardiovaskulární morbiditu a mortalitu. Tento efekt je dán nejen hypolipidemickými účinky, zejména poklesem celkového a LDL-cholesterolu, ale i tzv. pleiotropními účinky.
Prakticky každý pacient se zvýšeným kardiovaskulárním (KV) rizikem profituje z terapie statiny. Překážkou jejich podávání mohou být nežádoucí účinky. Vzácné nežádoucí účinky jako gastrointestinální obtíže, padání vlasů, insomnie atd. nepředstavují zásadní klinický problém. Nejobávanější a také nejčastější nežádoucí reakcí na podání statinu je svalové poškození – myopatie. Jejich prevalence je velice rozdílná a pohybuje se od 1–5 % [1] dle randomizovaných studií až po 9–20 %, např. dle studie PRIMO (10,5 %) zabývající se právě statinovou myopatií [2]. Rozdílná prevalence může být vysvětlena dávkou a typem podávaného statinu, konkomitantní medikací a zejména designem studie [3]. Dále jsou studovány genetické polymorfizmy predisponující ke vzniku statinové myopatie [4].
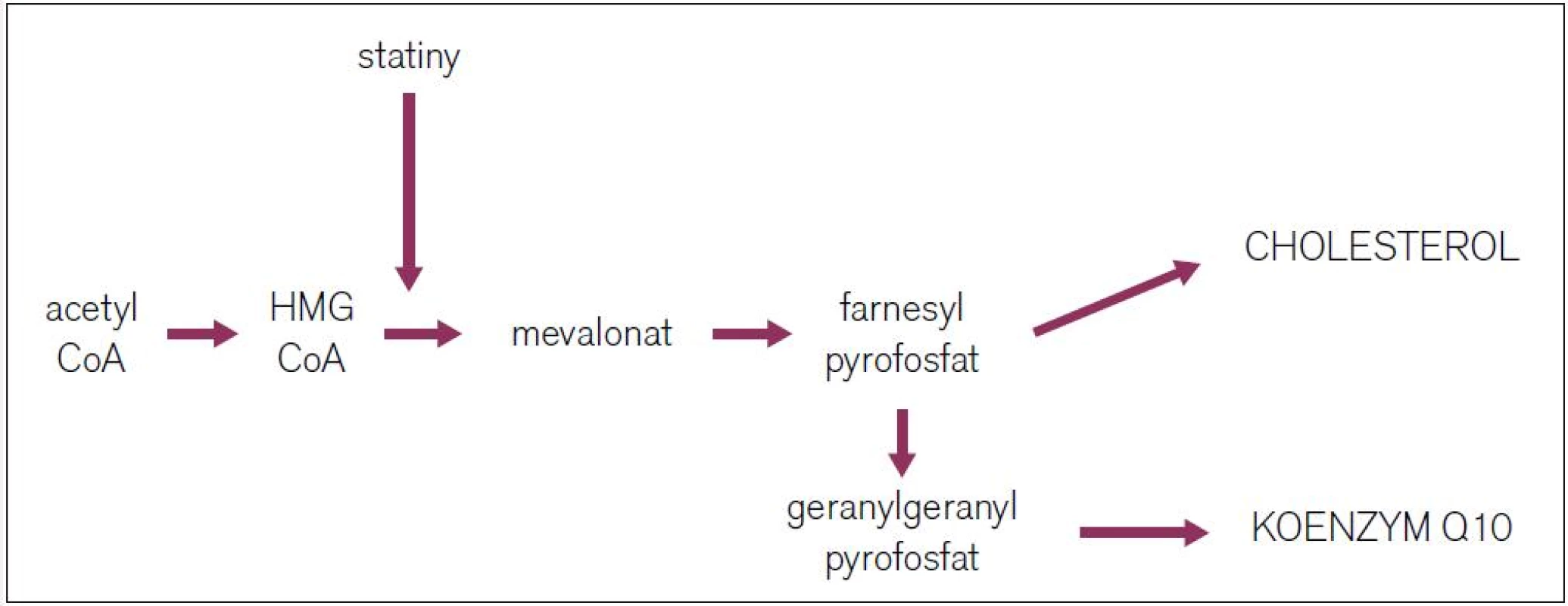
Etiopatogeneze statinové myopatie není zcela vyjasněna. Statiny inhibicí 3-hydroxy-3-methylglutarylkoenzym A reduktázy (obr. 1) zasahují nejen do syntézy cholesterolu, ale i do dalších metabolických produktů. Samotné snížení hladiny cholesterolu může přispět k jeho depleci při stavbě membrány myocytů a následně k její nestabilitě [5]. Další možný mechanizmus zahrnuje ovlivnění metabolických regulací zprostředkovaných izoprenoidy (farnesylpyrofosfátem a geranylgeranyl pyrofosfátem). Snížení jejich produkce vede k poklesu tvorby regulačních proteinů buňky, při jejichž nedostatku dochází k předčasné apoptóze. Současně poklesem syntézy výše popsaných meziproduktů dochází i k poklesu syntézy koenzymu Q10.
Koenzym Q10 (ubichinon, KQ10) je lipofilní, ve vodě nerozpustná látka, které má vliv na transport elektronů a tvorbu energie (ATP) v mitochondriích [6]. KQ10 působí antioxidačně v mitochondriích a buněčných membránách, chrání membránové lipidy před oxidací a tím stabilizuje biologické membrány [7]. Také inhibuje oxidaci LDL-cholesterolu. KQ10 je částečně přijímán potravou a zčásti syntetizován v organizmu, jeho hladiny se snižují s věkem [8]. V našem organizmu se vyskytuje v (biologicky) aktivní, redukované formě (ubichinol). V potravě (kukuřice, brokolice, sója, ořechy, hovězí maso, vepřové maso, sardinky, …) se vyskytuje v oxidované nebo smíšené formě. Absorpce KQ10 (ubichinonu) je nízká. Více než 60 % perorální dávky KQ10 je vylučováno stolicí. Navíc má absorpce KQ10 velkou variabilitu závisející nejen na příjmu potravy, ale také na množství tuků přítomných v potravě. Absorpce je menší nalačno a větší s jídlem obsahující tuky. V krvi se KQ10 distribuuje i v rámci lipoproteinových frakcí, včetně VLDL, LDL a HDL. K ustálení maximálních sérových koncentrací KQ10 dochází až přibližně po třech až čtyřech týdnech každodenního užívání. Poté, pokud se pokračuje v dávkování, se již udržuje hladina na úrovni plato. Hlavní eliminační cestou KQ10 je žluč [9].
Cílem našeho pilotního projektu bylo zjistit, zda pacienti se svalovými symptomy při podávání statinů profitují z podávání redukované formy koenzymu Q10.
Soubor a metody
Do sledování bylo zařazeno 30 pacientů s manifestní myopatií při terapii statinem. Jejich subjektivní obtíže byly klasifikovány jako středně významné (u 22 pacientů) až lehké (u osmi pacientů). Jeden pacient byl ze sledování pro nespolupráci vyřazen, druhý studii předčasně ukončil. Statisticky byla zpracována data od 28 pacientů (18 žen a 10 mužů) ve věku 60,6 ± 10,7 let. Devět pacientů užívalo atorvastatin v denní dávce (DD) 5, 10 a 20 mg (šest bylo na denní dávce 20 mg), sedm pacientů užívalo rosuvastatin v DD 5, 10, 20, 40 mg, šest pacientů užívalo simvastatin v DD 20 mg, tři pacienti fluvastatin v dávce 80 mg, dva pacienti lovastatin (jeden 40 mg a druhý 10 mg) a jeden pacient užíval pravastatin v DD 10 mg. V průměru byli pacienti na aktuální dávce statinů cca tři roky, přičemž celková délka terapie statiny byla9 ± 5 let. Během sledování nebyla měněna statinová ani ostatní konkomitantní medikace. Do studie nebyli zařazeni pacienti s renální insuficiencí, závažnou hepatopatií, manifestní hypotyreózou.
Pacienti podstoupili následující protokol: Čtyři návštěvy: 1. návštěva (–1. měsíc), 2. návštěva (0. měsíc), 3. návštěva (3. měsíc) a 4. návštěva (6. měsíc). Při každé návštěvě byla odebrána anamnéza, včetně farmakologické, pacienti byli fyzikálně vyšetřeni, byly provedeny biochemické odběry (jaterní testy, kreatinfosfokináza (CK), celkový, LDL-, HDL-cholesterol, apolipoprotein A a B) a odběry ke stanovení sérové koncentrace koenzymu Q10. Současně byla pacientům prezentována škála pro svalovou bolest a slabost, kde na stupnici od 1 do 10 označili míru svých obtíží.
Při porovnání sledovaných parametrů (svalová bolest, slabost, laboratorní parametry, fyzikální nálezy) mezi návštěvou 1 (screening) a návštěvou 2 (zahájení podávání KQ10) nebyl zjištěn žádný statistický rozdíl ani v jednom ze sledovaných parametrů, z čehož předpokládáme stabilizovaný stav pacientů.
Od návštěvy 2 do návštěvy 4, tedy po dobu šesti měsíců, byl pacientům podáván redukovaný koenzym Q10 v dávce 30 mg dvakrát denně (Q max Active, SVUS Pharma a. s.).
Statistická analýza byla provedena u veličin gaussovského rozložení pomocí Annova testu, T-testu, u veličin negaussovského rozložení pomocí Friedmanova testu.
Před vstupem do studie podepsali pacienti informovaný souhlas a studie byla provedena v souladu s pravidly správné klinické praxe.
Výsledky
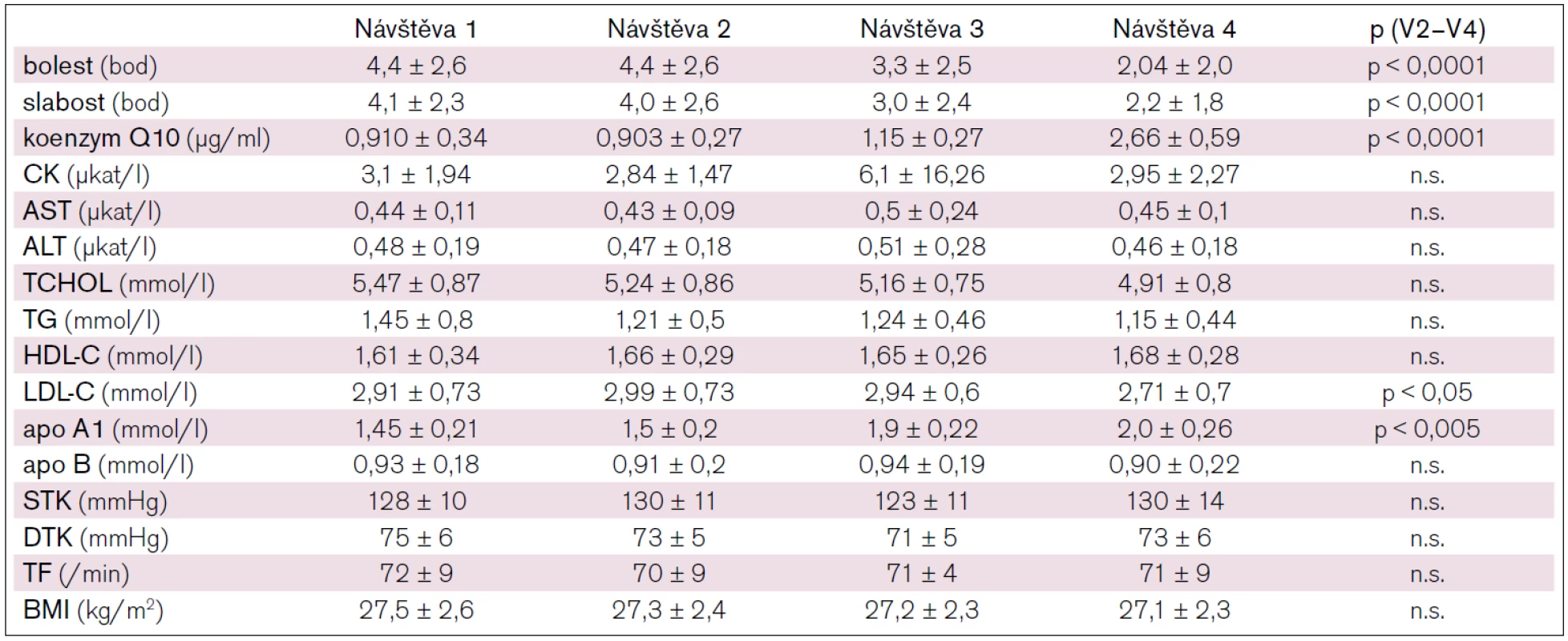
Efekt podávání redukovaného koenzymu Q10 na svalové obtíže (bolest a slabost) byl hodnocen pomocí výše popsané stupnice před podáváním KQ10, po třech a šesti měsících podávání KQ10. Po šestiměsíčním podávání redukovaného koenzymu Q10 došlo ke statisticky významnému poklesu jak subjektivně hodnocené svalové bolesti, tak slabosti. Bolestivost svalů poklesla v průměru o 53,8 % (p < 0,0001), svalová slabost o 44,4 % (p < 0,0001) (graf 1, 2).
1. Změny subjektivních pocitů. 
2. Změny subjektivních pocitů mezi prvním a posledním vyšetřením. 
U všech pacientů byla sledována hladina CK. Hladiny CK u jednotlivých návštěv nevykazovaly žádné statisticky významné rozdíly a měly výraznou interindividuální variabilitu. Průměrné hodnoty CK jsou uvedeny v tab. 1.
Dále byla sledována plazmatická hladina KQ10 u pacientů během sledování a to před podáním, při 3. a 4. návštěvě. Po tříměsíčním podávání redukovaného koenzymu Q10 došlo k navýšení průměrných plazmatických hladin KQ10 o 28 % (p < 0,02). Po šestiměsíčním podávání byl nárůst plazmatických hladin KQ10 v průměru o 194 % (z 0,903 μg/ml na 2,66 μg/ml; p < 0,0001) (tab. 1).
Současně byly jako vedlejší parametry sledovány biochemické ukazatele. Při šestiměsíčním podávání redukovaného KQ10 došlo k mírnému, ale statisticky významnému (p < 0,05) poklesu LDL-cholesterolu. Dále došlo ke statisticky významnému zvýšení hladiny Apo-A-I o 29 % (p < 0,0001). Kompletní hodnoty změn lipidogramu jsou uvedeny v tab. 1.
Pomocí systému SCORE [10] byly vypočteny hodnoty kardiovaskulárního rizika pacientů. Po šestiměsíčním podávání KQ10 došlo ke statisticky významnému snížení KV rizika (z 8,5 % ± 5,8 % na 4,7 ± 3,1 %; p < 0,0002).
Diskuze
Vzhledem k velkému nárůstu preskripce statinové terapie bohužel současně dochází i k vzestupu prevalence statinových myopatií [11]. V poslední době bylo publikováno několik prací zabývajících se vlivem KQ10 na statinovou myopatii. Výsledky daných studií jsou nejednoznačné a často rozporuplné.
Young et al [12] publikovali dvojitě slepou, placebem kontrolovanou studii, v níž k 10–40 mg simvastatinu podávali u 44 pacientů 200 mg KQ10/den. Ačkoli pozorovali zvýšené plazmatické hladiny KQ10, nezaznamenali subjektivní statisticky významné rozdíly mezi placebovou a léčenou větví. KQ10 podávali pouze 12 týdnů, což může být krátká doba k projevení se plného efektu. Oproti tomu Caso et al [13] podávali 32 pacientům s hypercholesterolemií a statinovou myopatií 100 mg KQ10 oproti 400 IU vitaminu E. Ve větvi léčené KQ10 došlo k poklesu bolestivosti svalů o 38 %, kdežto ve větvi léčené vitaminem E nebyl pozorován rozdíl. Konečně Mabuchi et al [14] podávali KQ10 pacientům léčeným 10 mg atorvastatinu s elevací CK, AST a ALT. Po 16týdenním podávání nedošlo k změně sledovaných parametrů. Efekt na svalovou myopatii nebyl popsán. Nicméně víme, že hodnota CK nekoreluje s mírou obtíží pacientů.
V naší studii byla hladina koenzymu Q10 měřena v séru. Dle některých prací [15] ale zcela nekoreluje plazmatická hladina koenzymu Q10 s nitrobuněčnou hladinou v myocytu. Jak dokumentují další práce [16], klesá při statinové myopatii právě svalová hladina koenzymu Q10. Naopak Paiva et al [17] tuto teorii svou prací vyvrací. U pacientů léčených vysokou dávkou atorvastatinu nepozorovali autoři změnu svalové hladiny koenzymu Q10 při svalové biopsii před a během podávání statinu.
Závěry našeho pilotního projektu nelze zobecňovat. Jsme si vědomi limitací projektu: Byl sledován soubor nemocných léčených heterogenní statinovou medikací, nebyla zařazena placebová větev a nepochybně také velikost našeho souboru není dostatečná.
KQ10 velice pravděpodobně přímo neovlivňuje lipidové spektrum. V našem sledování došlo ke kvalitativnímu zlepšení lipidogramu. Změny některých parametrů dosáhly statistické významnosti (LDL, apoA). Pozitivní změny lipidového spektra jsou velice pravděpodobně dány zmírněním obtíží pacientů s následným zlepšením jejich adherence k léčbě.
Přestože nelze uvedené výsledky generalizovat, podporují dříve publikovaná data o potenciálním přínosu suplementace koenzymu Q10 u nemocných se statiny indukovanou myopatií. Tuto hypotézu podporují i patofyziologické mechanizmy uplatňující se v přímém i zprostředkovaném působení statinů na buňky kosterního svalstva. Definitivní odpověď na otázku, zdali koenzym Q10 zabraňuje vzniku nebo alespoň zmírňuje klinické projevy svalové toxicity statinů, může přinést pouze velká, placebem kontrovaná klinická studie.
Práce byla podpořena grantem číslo NT 11307-5 IGA, MZ ČR.
Doručeno do redakce 11. 10. 2012
Přijato po recenzi 28. 11. 2012
MUDr. Lukáš Zlatohlávek, Ph.D.
prof. MUDr. Richard Češka, CSc.
3. interní klinika 1. LF UK a VFN, Praha
lukas.zlatohlavek@lf1.cuni.cz
Sources
1. Armitage J. The safety of statins in clinical practice. Lancet 2007; 370 : 1781 – 1790.
2. Bruckert E, Hayem G, Dejager S et al. Mild to moderate muscular symptoms with high-dosage statin therapy in hyperlipidemic patients-the PRIMO study. Cardiovasc Drugs Ther 2005; 19 : 403–414.
3. Harper CR, Jacobson TA. Evidence-based management of statin myopathy. Curr Atheroscler Rep 2010; 12 : 322–330.
4. Hubacek JA, Adamkova V, Zidkova K et al. Statin pharmacokinetics. Vnitr Lek 2008; 54 : 62–67.
5. Schaars CF, Stalenhoef AF. Effect of ubiquinone (coenzyme Q10) on myopathy in statin users. Curr Opin Lipidol 2008; 19 : 553–557.
6. Harper CR, Jacobson TA. The broad spectrum of statin myopathy: from myalgia to rhabdomyolysis. Curr Opin Lipidol 2007; 18 : 401–408.
7. De Pinieux G, Chariot P, Ammi-Saïd M et al. Lipid-lowering drugs and mitochondrial function: effects of HMG-CoA reductase inhibitors on serum ubiquinone and blood lactate/pyruvate ratio. Br J Clin Pharmacol 1996; 42 : 333–337.
8. Mabuchi H, Nohara A, Kobayashi J et al. Effects of CoQ10 supplementation on plasma lipoprotein lipid, CoQ10 and liver and muscle enzyme levels in hypercholesterolemic patients treated with atorvastatin: a randomized double-blind study. Atherosclerosis 2007; 195: e182–e189.
9. Young JM, Molyneux SL, Florkowski CM et al. Pharmacokinetic comparison of a generic coenzyme Q10 solubilizate and a formulation with soybean phytosterols. Phytother Res 2012; 26 : 1092–1096.
10. Vaverková H, Soška V, Rosolová H et al. Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, vypracované výborem České společnosti pro aterosklerózu. Vnitř Lék 2007; 53 : 181–197.
11. Thompson PD, Clarkson P, Karas RH. Statin-associated myopathy. JAMA 2003; 289 : 1681–1690.
12. Young JM, Florkowski CM, Molyneux SL et al. Effect of coenzyme Q(10) supplementation on simvastatin-induced myalgia. Am J Cardiol 2007; 100 : 1400–1403.
13. Caso G, Kelly P, McNurlan MA et al. Effect of coenzyme q10 on myopathic symptoms in patients treated with statins. Am J Cardiol 2007; 99 : 1409–1412.
14. Mabuchi H, Nohara A, Kobayashi J et al. Effects of CoQ10 supplementation on plasma lipoprotein lipid, CoQ10 and liver and muscle enzyme levels in hypercholesterolemic patients treated with atorvastatin: a randomized double-blind study. Atherosclerosis 2007; 195: e182–189.
15. Laaksonen R, Jokelainen K, Laakso J et al. The effect of simvastatin treatment on natural antioxidants in low-density lipoproteins and high-energy phosphates and ubiquinone in skeletal muscle. Am J Cardiol 1996; 77 : 851–854.
16. Laaksonen R, Jokelainen K, Sahi T et al. Decreases in serum ubiquinone concentrations do not result in reduced levels in muscle tissue during short-term simvastatin treatment in humans. Clin Pharmacol Ther 1995; 57 : 62–66.
17. Päivä H, Thelen KM, Van Coster R et al. High-dose statins and skeletal muscle metabolism in humans: a randomized, controlled trial. Clin Pharmacol Ther 2005; 78 : 60–68.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2012 Issue 4-
All articles in this issue
- Cardiorenal syndrome – from a nephrologist’s point of view
- Cardiorenal syndrome in patients with acute heart failure
- Cardiorenal syndrome with chronic heart failure – from a cardiologist‘s point of view
- Acute kidney failure and cardiovascular complication
- Chronic renal failure and cardiovascular events
- Candesartan in the treatment of hypertension and heart failure
- Stenosis of the left main coronary artery due to compression by a dilated pulmonary artery
- Twiddler’s syndrome – an unusual cause of oversensing leading to inadequate implantable-cardioverter discharges
- Affect statin myopathy reduced form of coenzyme Q10?
- Pathophysiology of cardiorenal syndrome
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cardiorenal syndrome – from a nephrologist’s point of view
- Affect statin myopathy reduced form of coenzyme Q10?
- Cardiorenal syndrome with chronic heart failure – from a cardiologist‘s point of view
- Acute kidney failure and cardiovascular complication
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career