-
Medical journals
- Career
Predikce odpovědi na podání tekutiny – tekutinová reaktivita
Authors: J. Beneš
Authors‘ workplace: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice a Lékařská fakulta v Plzni, Univerzita Karlova v Praze
Published in: Anest. intenziv. Med., 28, 2017, č. 1, s. 12-22
Category: Intensive Care Medicine - Review Article
Overview
Zhodnocení tekutinové reaktivity (anglicky fluid responsiveness) je jedním z důležitých postupů v rámci infuzní terapie u anestezovaných a kriticky nemocných. Pomocí řady testů lze zhodnotit případný efekt objemové expanze, cíleně vést infuzní terapii, a zabránit tak zbytečnému podání tekutin. Předkládaný článek je doprovodným textem elektronicky dostupné Smart Card zabývající se problematikou predikce tekutinové reaktivity.
Klíčová slova:
tekutinová reaktivita – infuzní terapie – objemová výzva – interakce srdce-plíce1 ÚVOD
Podání tekutin v rámci léčby kriticky nemocných je, jak bylo mnohokráte zmíněno, postupem potenciálně život zachraňujícím, zároveň ale spojeným s rizikem iatrogenního přetížení tekutinami a pozitivní kumulativní bilancí [1]. Ta byla v mnoha studiích prokazatelně spojena s nepříznivou prognózou [2–4]. Z těchto důvodů vznikl v posledních letech požadavek být v tekutinové terapii co „nejadresnější“, tedy podávat pouze správné množství (správného roztoku) ve správný okamžik (správnému pacientovi) tzv. patient-centered therapy. K tomu, aby mohla být tekutinová terapie takto „šita na míru“ jednotlivých pacientů, je ale nutné přesné definování cíle tekutinové léčby. Koncept funkčního hemodynamického monitorování s sebou přinesl snahu o oddělení jednotlivých determinant funkce kardiovaskulárního systému a jejich selektivní intervenci [5]. Podání tekutin je z tohoto pohledu indikováno pouze k modulaci srdečního preloadu – předtížení. Zhodnocení tekutinové reaktivity (angl. fluid responsiveness) by mělo v klinické praxi napomoci rozhodnutí, zda lze očekávat zlepšení kardiovaskulární výkonnosti infuzní terapií [6, 7]. Naopak, přítomnost známek tekutinové reaktivity není sama o sobě indikací k podání tekutin [8]. Okamžik správné indikace (tedy přítomnost známek klinicky významné centrální hypovolémie či orgánové malperfuze) byl již zmíněn v předchozí části [1], v tomto přehledovém článku se budeme šířeji zabývat právě problematikou tekutinové reaktivity.
2 PATOFYZIOLOGICKÉ POZNÁMKY K PROBLEMATICE TEKUTINOVÉ REAKTIVITY
2. 1 Žilní návrat a Frank-Starlingova křivka
Podle současných znalostí fyziologie je srdeční výdej určen jednak kontraktilní funkcí srdce a jeho dotížením a zároveň mírou žilního návratu. Grafickým znázorněním je potom průsečík různých poloh tzv. Guytonovy křivky závislosti žilního návratu na tlakovém gradientu v žilním řečišti a Frank-Starlingovy křivky závislosti srdečního výdeje na předtížení (obr. 1) [9]. Podání tekutiny vedoucí k nárůstu systémového plnícího tlaku (MCFP – mean circulatory filling pressure) posunuje křivku žilního návratu doprava (čárkované křivky na obrázku 1; pozn. MCFP je průsečíkem křivky žilního návratu s osou X). V případě pacienta operujícího na strmé části Frank-Starlingovy křivky vede zvýšení žilního návratu k významnému nárůstu srdečního výdeje (přesun z bodu 1 do bodu 2 na obrázku 1). Pacient je preload responzivní – reagující zvýšením výdaje na navýšení předtížení. Naopak u pacienta situovaného v ploché části křivky není navýšení předtížení spojeno s významným nárůstem srdečního výdeje, zato dojde k navýšení centrálního žilního tlaku (CVP – central venous pressure) (body 3 a 4 na obrázku 1) – pacient je preload neresponzivní. Hlavní podstatou testování tekutinové reaktivity je tedy modulovat (řízeně zvýšit nebo naopak snížit) žilní návrat do srdce a tím i jeho předtížení a odlišit nemocného preload responzivního od neresponzivního.
Image 1. Integrované znázornění Guytonova (čárkované křivky) a Frank-Starlingova (plné křivky) modelu 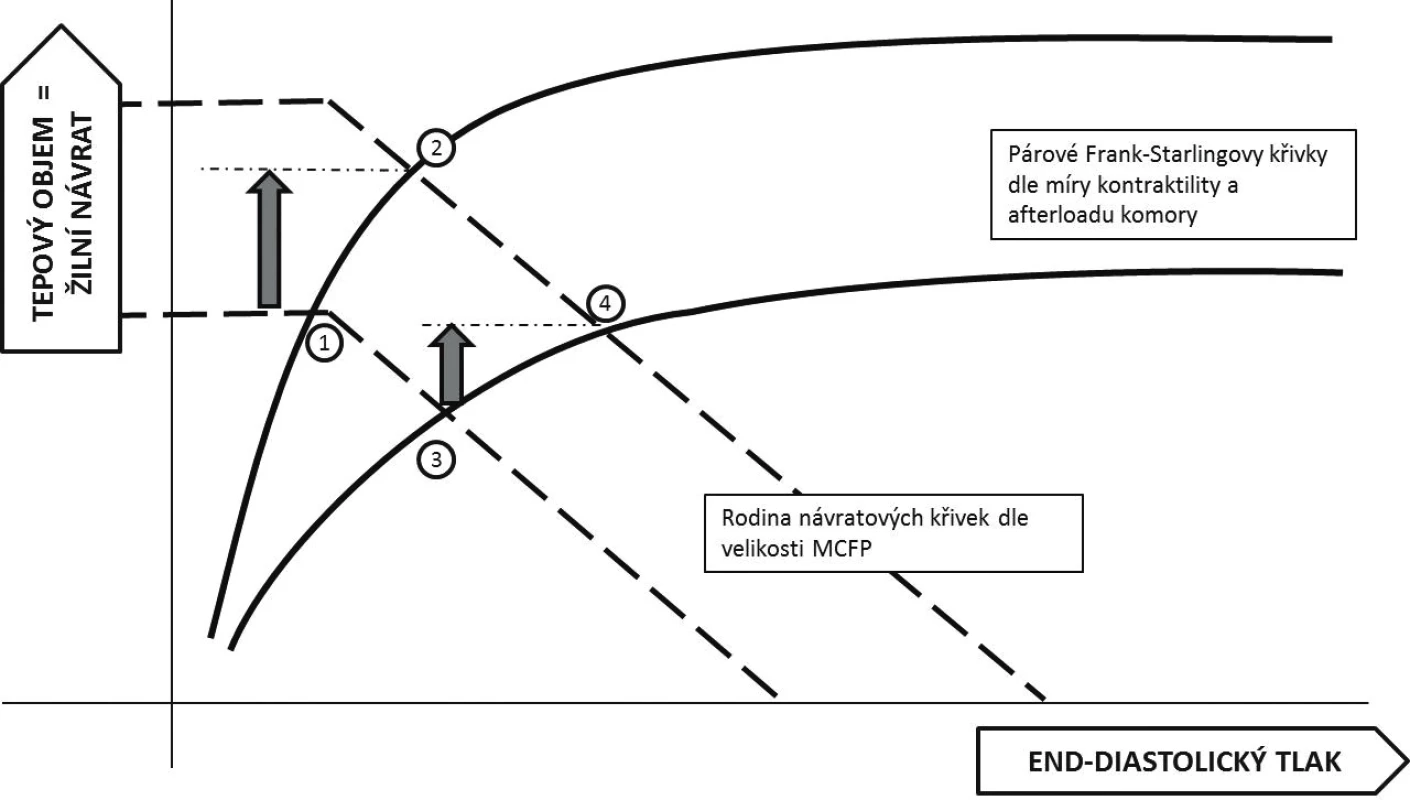
Body 1 a 3 znázorňují počáteční stav, body 2 a 4 (a příslušné šipky) znázorňují změny v hemodynamických parametrech po podání objemu u pacienta preload responzivního (2) a neresponzivního (4) – viz text článku. Tlakové parametry MCFP – průsečík osy X s křivkou žilního návratu, CVP – průsečík Frank-Starlingovy a Guytonovy Na obrázku 1 by měl být správně pro popis osy X používán end-diastolický objem, s ohledem na jeho relativně obtížné přesné stanovení je často nahrazován end-diastolickým tlakem (v praxi aproximováno hodnotou CVP). Zároveň je tím poukázáno na fakt, že plnění komory je dáno hlavně tlakovým gradientem mezi periferním žilním systémem a nitrokomorovým tlakem. Na druhou stranu přináší užití tlaku pro popis Frank-Starlingovy křivky nezanedbatelné zjednodušení. Plnění komory a tedy vztah mezi tlakem a objemem není lineární, ale je dán snižující se poddajností (lusitropií) srdeční stěny s rostoucím objemem. Poddajnost levé a pravé komory se navíc může významně lišit, hlavně v důsledku hypertrofie stěny levé komory. Využití snadno monitorovatelné hodnoty CVP jako indikátoru předtížení levé komory je tedy významně zavádějící.
Pro velikost žilního návratu je vedle vlastní náplně řečiště také stěžejní jeho přerozdělení do dvou hypotetických kompartmentů. Množství cirkulujícího objemu, které vyplňuje cévy (tedy potřebné k dosažení nulového transmurálního hydrostatického gradientu) je v anglické literatuře nazýváno jako tzv. unstressed volume (netlakovaný objem). Objem, který vytváří transmurální tlakový gradient a díky elasticitě je tedy hybnou silou žilního návratu, je nazýván stressed volume (tlakovaný objem) a jeho mírou je právě MCFP. Léky, které mění tonus žilního kapacitního řečiště, mohou změnit poměr mezi netlakovaným a tlakovaným objemem a tedy i gradient žilního návratu. Vedle toho může být žilní návrat ovlivněn i zevní limitací, tedy extramurálním tlakem v oblasti hrudníku (nitrohrudní tlak a tlak v osrdečníku). Při vyrovnání (případně překonání) intramurálního tlaku reprezentovaného plnícím tlakem pravé komory (respektive CVP) s extramurálním tlakem (nejčastěji nitrohrudní tlak) dochází k částečnému kolapsu příslušné části venózního řečiště a limitaci průtoku (plateau fáze křivky žilního návratu).
2. 2 Základní aspekty interakce srdce-plíce
Dynamické variace tepového objemu levé komory vzniklé v průběhu respiračního cyklu jsou jednou z meziorgánových interakcí s velikým klinickým přesahem. V současné době je považujeme za jeden z nejhodnotnějších parametrů schopných předpovědět reakci kardiovaskulárního systému na podání tekutiny [7]. Základem této interakce jsou cyklické změny v předtížení a dotížení obou srdečních komor vznikající vlivem cyklických změn nitrohrudního objemu a tlaku. Tyto změny jsou pozorovatelné za všech okolností, jejich vliv je výraznější vždy, když dochází ke zvětšení běžných transpulmonálních tlakových gradientů (astma, ventilace přetlakem, otevírací manévr), nebo je stav cirkulace hraničně kompenzován (hypovolémie, přetížení pravostranných srdečních oddílů). U spontánně ventilujících pacientů byl tento fenomén popsán již Adolfem Kussmaulem v roce 1873 a je znám jako tzv. pulsus paradoxus. V současnosti se s interakcí srdce-plíce setkáváme mnohem častěji díky užívání ventilace pozitivním tlakem, která změny v cirkulaci ovlivňuje výrazněji než fyziologické dýchání podtlakem. Z těchto důvodů je patofyziologie vzájemné interakce srdce a plic rozebrána z pohledu pozitivního tlaku v dýchacích cestách a nárůstu tlaku v inspiriu.
2. 2. 1 Vliv změny nitrohrudního tlaku na žilní návrat
Nárůst nitrohrudního tlaku se velmi snadno přenáší přes poddajnou stěnu nízkotlakých oddílů, což vede k nárůstu plnících tlaků pravé komory. Vzhledem k tomu, že plnící tlak pravé komory je určující pro velikost žilního návratu, při jeho zvýšení dochází k zadržení jistého množství krve v žilním kapacitním (extratorakálním) řečišti – tzv. efekt vodopádu (angl. waterfall effect). U hypovolemických nemocných nastává v důsledku nárůstu nitrohrudního tlaku zmenšení průsvitu nitrohrudní části velkých žil (a naopak distenze v extratorakálním úseku), které je pozorovatelné pomocí ultrasonografie. Změna preloadu pravé komory je ve většině případů nejvýznamnějším faktorem výsledné změny tepového objemu levé komory.
2. 2. 2 Změny v dotížení pravé komory
Dotížení pravé komory je při ventilaci pozitivním tlakem ovlivněno jak změnou nitrohrudního a intraalveolárního tlaku, tak změnou alveolárního objemu. Navýšení nitrohrudního tlaku vede ke snížení transmurálního tlaku komory v době systoly a potenciálně tedy i ke snížení afterloadu. Tento efekt je ale eliminován výrazně větším vlivem nárůstu nitrohrudního tlaku na plicní řečiště. V rámci plicní cirkulace vykazují odlišné chování drobné alveolární kapiláry a tepny plicního řečiště [10]. Změny intraluminálního tlaku kapilární sítě ve stěně alveolů v zásadě podléhají nikoli změnám nitrohrudního, ale intraalveolárního tlaku. Rozdělení do tří Westových zón ilustruje základní možné situace vznikající v rámci celkového kontinua vzájemných vztahů. Ten je možno také ilustrovat jako křivku závislosti plicní cévní rezistence na objemu (křivka B na obrázku 2). V oblastech, které odpovídají zóně 1 podle Westa, převládá hyperinflace a nárůst křivky je významnější, naopak v zóně 3 je nárůst pozvolnější, neboť změny intraalveolárního tlaku mají jen minimální vliv na průsvit kapiláry. Výslednice vlivu plicního objemu na plicní cévní rezistenci je potom dána zastoupením jednotlivých zón [11].
Image 2. Znázornění vlivu plicní náplně na vaskulární rezistenci 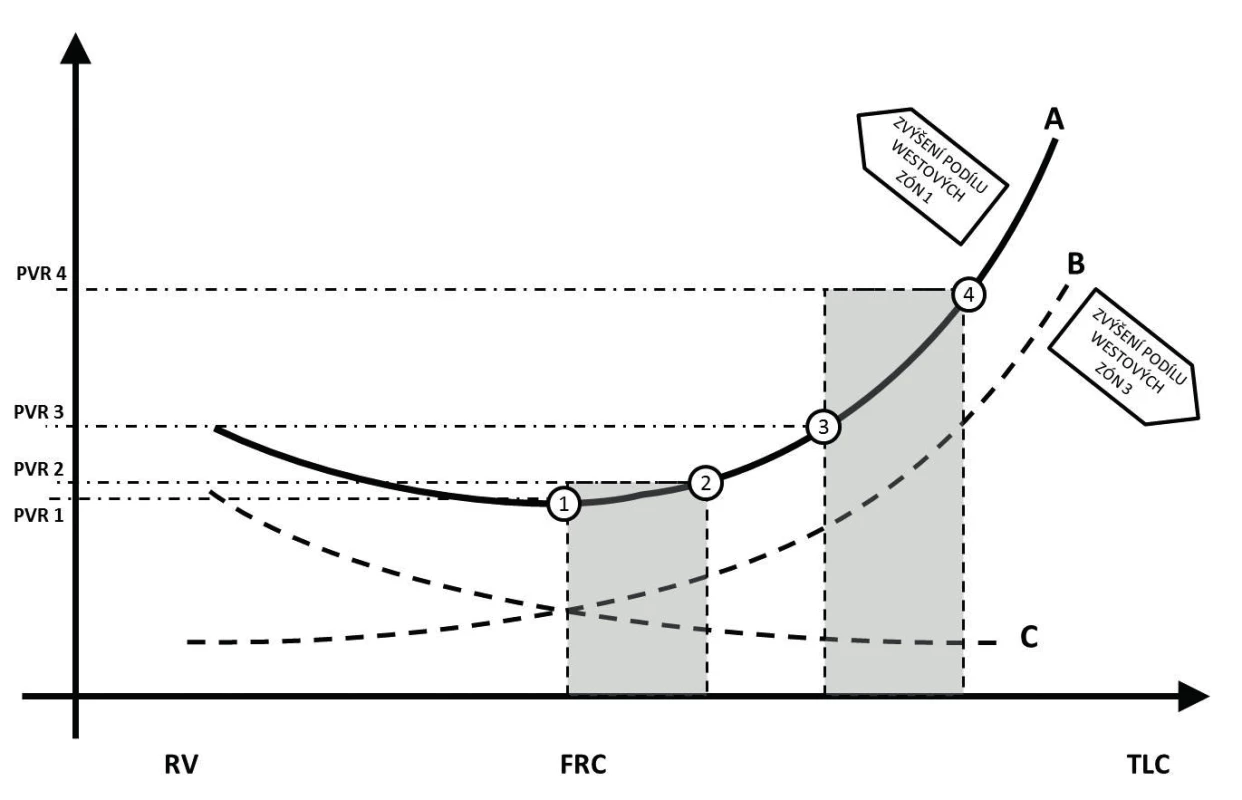
Body znázorňují exspirační (1/3) a inspirační (2/4) hodnoty plicní vaskulární rezistence při ventilaci na různých hladinách reziduálního plicního objemu. Vysvětlení v textu. Plicní arterie se fyziologicky podílejí na plicní systémové rezistenci mechanismem hypoxické plicní vazokonstrikce. Ta vede ke snížení průtoku krve méně ventilovanými (nebo neventilovanými) částmi plic s cílem optimalizace poměru ventilace-perfuze. V případě významného poklesu funkční reziduální kapacity (nárůst Westovy zóny 4) dochází k nárůstu dotížení pravé komory. Při zvýšení end-exspiračního plicního objemu (například zařazením kontinuálního přetlaku – CPAP, nebo pozitivního tlaku na konci výdechu – PEEP) dochází k otevření kolabovaných alveolů a následnému poklesu plicní vaskulární rezistence (křivka C na obrázku 2) [2]. Vliv na dotížení pravé komory je potom dán součtem jednotlivých vlivů, velikostí endexspiračního plicního objemu a změnou tlaku indukovaného dechovým objemem (křivka A na obrázku 2) [10].
Vliv na levou komoru
Všechny výše popsané změny preloadu a afterloadu pravé komory vedou k významnému poklesu tepového objemu pravé komory na vrcholu inspiria. To se projeví jako pokles preloadu levé komory s mírným zpožděním (obvykle je udáváno 2–5 stahů [13] daným cirkulačním časem malého oběhu (komponenta ∆down – obr. 3). Okamžik minimálního předtížení levé komory tedy časově odpovídá pozdnímu exspiriu. Naopak v okamžiku inspiria dochází v důsledku nárůstu plicního objemu ke zvýšení středního cirkulačního tlaku plicního řečiště a navýšení žilního návratu levé komory. Tento fenomén bývá někdy popisován jako tzv. komponenta ∆up. Ve skutečnosti tvoří jen jednu z jejích součástí. Druhou významnou součástí komponenty ∆up je významné snížení afterloadu levé komory navýšením nitrohrudního tlaku (a tedy snížením transmurálního tlaku). Na rozdíl od pravé komory, kde dochází ke vzájemnému vyrovnání vlivu navýšení nitrohrudního tlaku na komoru a na plicní cirkulaci, u levé komory, jejíž tepenný systém leží mimo hrudník, není tento vliv nijak oponován. U nemocného se selhávající a objemově přetíženou levou komorou má proto nasazení přetlaku v dýchacích cestách dvojitě pozitivní efekt – vede ke snížení preloadu obou komor a navíc ke snížení dotížení a tedy i práce levé komory.
Image 3. Znázornění změn křivky arteriálního tlaku při ventilaci pozitivním přetlakem a po vřazení krátké endexspirační pauzy 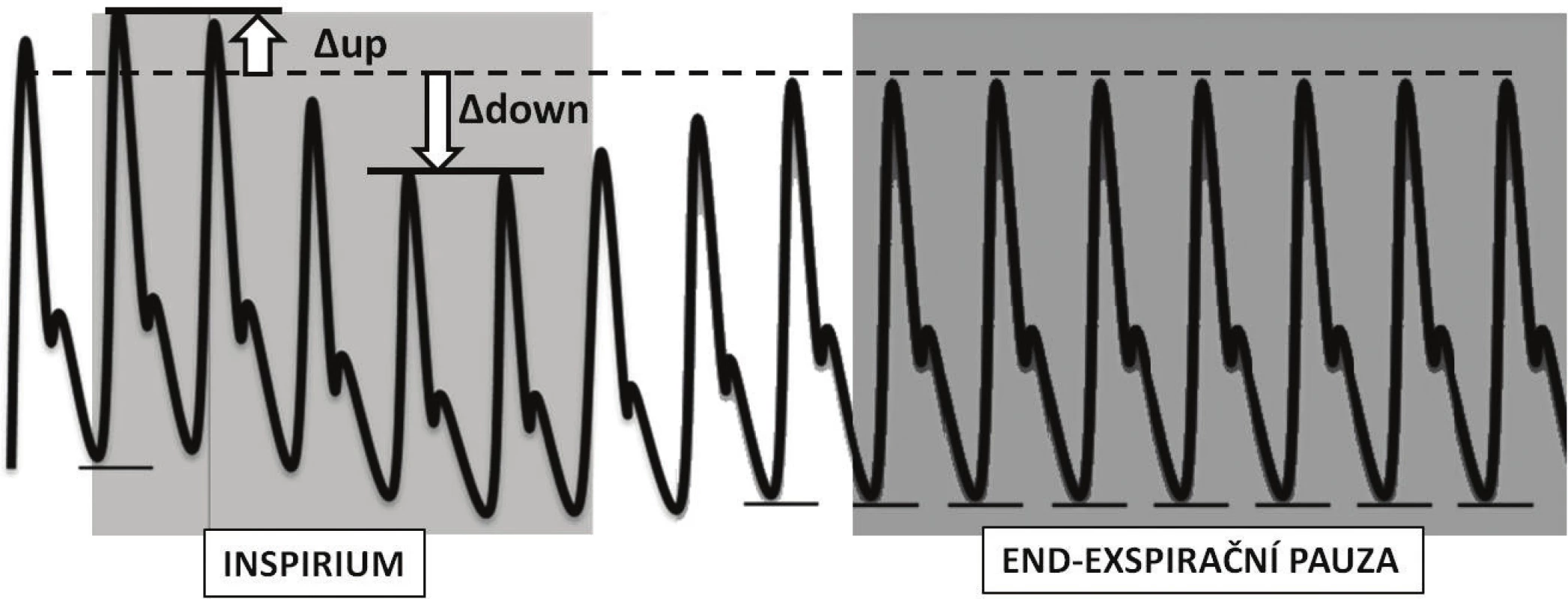
Výsledkem komplexního vlivu ventilace na preload a afterload obou komor je významné kolísání tepového objemu levé komory s maximem na vrcholu inspiria a minimem v exspirační fázi přetlakové ventilace. U spontánně ventilujícího subjektu je vliv většiny zmíněných faktorů opačný v důsledku prohloubení nitrohrudního podtlaku. Změny vyvolané interakcí srdce-plíce je možno kvantifikovat celou řadou vyšetřovacích postupů (viz dále), s ohledem na jejich komplexnost je ale nutno dbát na významné riziko chybné interpretace.
2. 3 Základní postup a rozvaha hodnocení tekutinové reaktivity
Základní myšlenkou testování tekutinové reaktivity je omezení množství podaných tekutin u pacienta v kritickém stavu. Proti většině ostatních látek ovlivňujících kardiovaskulární systém mají intravenózně podané tekutiny významnou nevýhodu: veliká část podaného množství záhy opouští cirkulaci do intersticiálního prostoru. Z části zbylé v intravaskulárním řečišti může být veliké množství přerozděleno v netlakovaném objemu (venodilatací splanchniku a ostatních poddajných žilních pletení) a tedy se fakticky nepodílet na efektivní cirkulaci. Navíc, možnosti těla zbavit se podaných tekutin jsou limitované funkcí ledvin. Přetížení tekutinami má celou řadu nežádoucích účinků a bylo opakovaně spojeno s nepříznivým klinickým výstupem. Z těchto důvodů by mělo být naší snahou podat vždy jen právě to množství, které je nutné k dosažení adekvátní perfuze orgánů.
Optimální test tekutinové reaktivity by byl schopen se 100% spolehlivostí a citlivostí dopředu (tedy před zahájením infuze) odhadnout, že podání tekutiny bude spojeno s nárůstem srdečního výdeje a tedy zlepšením orgánové perfuze. Žádný z testů, které máme aktuálně k dispozici, bohužel neposkytuje takto jisté vedení. Některé z testů vykazují poměrně vysokou citlivost i spolehlivost (tab. 1), jejich klinické užití je ale často limitováno na pacienty sedované, ventilované apod. Z těchto důvodů je často nutné provedení několika testů, zvlášť u nemocných, u kterých je vysoké riziko z podání tekutinové výzvy. Vždy bychom měli dobře zvážit, zda klinická situace je kompatibilní s užitím toho kterého testu, případně jak může měnit mezní hodnoty a predikční potenciál testu. Zároveň je vhodné vždy volit ten test, který je pro danou situaci nejvíce citlivý a spolehlivý (viz tab. 1).
Table 1. Přehled nejčastěji užívaných testů či parametrů tekutinové reaktivity testy 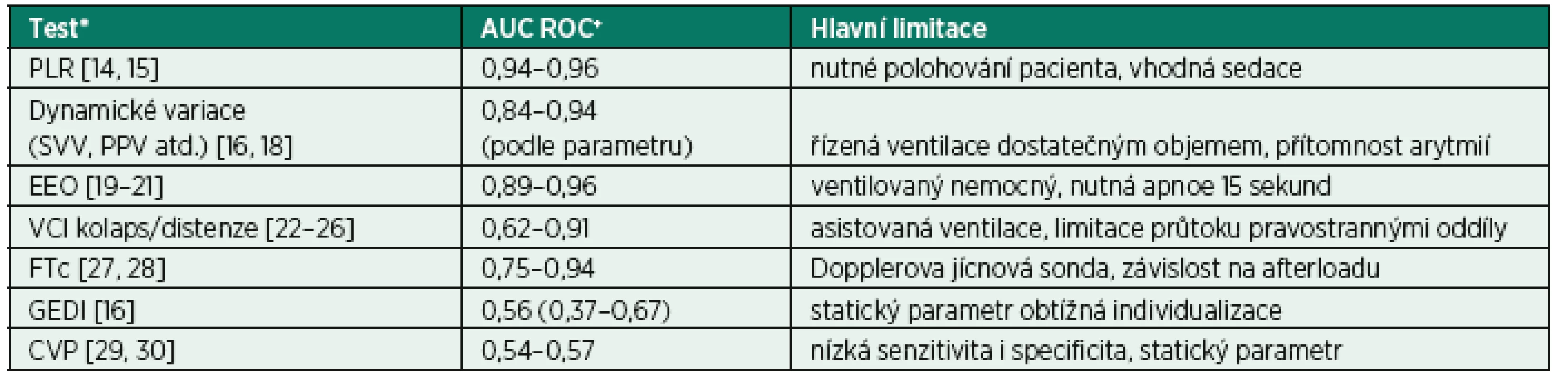
*Jednotlivé testy jsou vysvětleny v následujícím textu. +Plocha pod křivkou reciever operating characteristics (AUC ROC) – uváděno vždy rozpětí středních hodnot podle jednotlivých citací, případně včetně 95 konfidenčního intervalu, je-li dostupný jediný zdroj. Zkratky: PLR – test pasivního zvednutí nohou, SVV – dynamická variace tepového objemu, PPV – variace pulzního tlaku, EEO – endexspirační okluze, VCI – dolní dutá žíla, FTc – korigovaný průtokový čas, GEDI – index globálního end-diastolického objemu, CVP – centrální žilní tlak 2. 4 Statické parametry
Statické parametry (plnící tlaky obou komor, echokardiograficky stanovitelné parametry typu end-diastolická plocha levé komory nebo volumetrické indexy stanovitelné transpulmonální termodilucí) slouží v běžné klinické praxi často jako vodítko pro podání tekutiny. Tyto parametry byly v minulosti opakovaně užívány jako cíle tekutinové resuscitace a centrální žilní tlak je i nadále součástí mnoha doporučení k péči o pacienty v kritickém stavu, nevyjímaje doporučení Sepsis surviving campaign. To vše i přes opakovaná upozornění, že tyto parametry jsou mnohem méně citlivé a spolehlivé než dále zmiňované dynamické prediktory.
Centrální žilní tlak (CVP) je vůbec nejčastěji užívaným parametrem s ohledem na hodnocení preloadu u pacientů v kritickém stavu. Pravděpodobně největší nevýhodou CVP je fakt, že jeho prediktivní schopnost je shodná s testem „hozené mince“ [29]. Nízká prediktivní hodnota (hodnocena jako plocha pod ROC křivkou) byla pozorována i pro nízké a vysoké hodnoty CVP v rozsáhlé analýze 1 000 pacientů zařazených do několika studií [30]. Další významnou nevýhodou je, že CVP je parametr významně závislý na kvalitě měření. Již minimální odchylka v úrovni nulování, změny intratorakálního tlaku při ventilaci a v neposlední řadě nejistá volba odečítacího bodu na tlakové křivce (správně základna vlny c případně a) mohou významně ovlivnit hodnotu odečítaného tlaku [31]. Přesto nelze říci, že by bylo měření CVP pro kliniku bezvýznamné. Vysoké hodnoty CVP nebo jeho prudký nárůst mohou být použity jako tzv. limitní parametr, tedy informace o přílišném naplnění kapacitního řečiště vedoucí ke snížení tlakového gradientu žilního návratu a napomoci rozvoji extravazace a formování otoků [32].
Zhodnocení tlaku v zaklínění bylo z běžné klinické praxe téměř vytlačeno stejně jako zavádění plicnicových katétrů, navíc jeho predikční hodnota je jen o málo lepší než CVP. Jistou alternativou plnících tlaků je echokardiografické zhodnocení jednak průměru dolní duté žíly (odhad hodnoty CVP), případně kombinace vlny E transmitrálního toku a tkáňový doppler v úrovni mitrálního anulu – E´ (tzv. poměr E/E´ jako odhad tlaku v zaklínění). Oba tyto parametry jsou ale jen hrubým odhadem napomáhající „dichotomickému“ rozdělení nízký/vysoký s velikou šedou zónou.
Globální end-diastolický objem (případně jeho indexovaná hodnota – GEDI) je s ohledem na stále větší rozšíření transpulmonální termodiluce dalším často užívaným statickým parametrem preloadu. Predikční hodnota GEDI je o něco málo lepší než CVP. Při jeho hodnocení odpadá riziko spojené se špatnou kalibrací nulové hodnoty a je nezávislé na elasticitě myokardu. Naopak vyžaduje zavedení rozšířeného monitorování hemodynamiky s vazbou na dedikovaný termistorový arteriální katétr – je tedy ekonomicky náročnější a invazivnější než běžně užívané postupy. Správná indexace (aktuální hmotnost) není stále jistá, obdobně jako pro jiné parametry lze předpokládat i vliv výšky, pohlaví apod. Vzdálenost mezi místem aplikace (aplikace do povodí horní vs. dolní duté žíly) a zhodnocení (katétry v axilární nebo femorální tepně) také není bez vlivu na výslednou hodnotu. Vzhledem k tomu, že GEDI je parametr objemu všech srdečních oddílů, v případě dilatace pravostranných oddílů může vykazovat falešně normální hodnoty i při nízké náplni levé komory a naopak. Cílová hodnota GEDI se tedy pohybuje v poměrně širokém rozpětí s významnou inter-individuální variabilitou. Některé práce proto použily jiné (dynamické) parametry pro nalezení individuální optimální hodnoty GEDI a tu následně jako cíl pro intervence i v období, kdy již dynamické prediktory nebyly užitelné [33].
Korigovaný průtokový čas (FTc – Flow Time corrected) je hlavní parametr hodnocení preloadu při užití jícnového dopplera. V mnoha studiích prokázal lepší prediktivní hodnotu k předpovědi pozitivní odpovědi na podání tekutin než srovnávané tlakové či objemové parametry [27], nicméně jeho validita může být ovlivněna ve stavech s významně pozměněnou systémovou vaskulární rezistencí. Parametr je navíc závislý na věku nemocného. Technika je vázána na zavedení jícnové dopplerometrické sondy, která je pacienty v intenzivní péči relativně málo tolerována a může snadno dojít k její dislokaci.
2. 5 Dynamické parametry a testy tekutinové reaktivity
2. 5. 1 Dynamická variace tepového objemu a obdobné parametry
V současné době jsou za jedny z nejspolehlivějších parametrů predikce odpovědi na tekutinovou výzvu považovány tzv. dynamické variace (DV), ventilací pozitivním přetlakem indukované variace v tepovém objemu levé komory (SVV z angl. Stroke Volume Variation) [34]. Vzhledem k provázanosti tepového objemu s pulzním tlakem (definovaný jako rozdíl systolické a diastolické hodnoty) a velikostí systoly jsou tyto cyklické změny pozorovatelné i v tlakových parametrech (PPV – Pulse Pressure Variation, respektive SPV – Systolic Pressure Variation). V současné době již řada standardních anesteziologických monitorů provádí automatickou kalkulaci SPV nebo PPV, jakmile je prováděno přímé měření tlaku. Nové neinvazivní metody kontinuálního monitorování krevního tlaku (volume clamp nebo aplanometrie) umožňují stanovení těchto parametrů zcela bez potřeby invaze. Zcela neinvazivního zhodnocení je také možno dosáhnout echokardiograficky monitorováním variace velocity time integrálu (VTI) nebo špičkové rychlosti toku na aortální chlopni nebo ve výtokovém traktu, ale také kdekoli na velkých tepnách oběhu – např. a. carotis [35]. Pulzní oxymetr Masimo (Masimo Corp., Irvine, USA) stanovuje odvozený parametr variability amplitudy pletyzmografické křivky (PVI – Plethysmography Variability Index).
Základní myšlenka těchto parametrů je založena na experimentech Perela et al. [36], kteří sledovali významné změny v preloadu pravé komory v důsledku interakce plic a venózního návratu. Důkladné studium patofyziologických mechanismů interakce srdce-plíce umožňuje lépe interpretovat získané výsledky. Nejdůležitější je přitom odlišení vlivu přetlakové ventilace na afterload pravé a levé komory od omezení preloadu. Prostá automatická kalkulace poměru rozdílu maximální a minimální hodnoty proti průměrné totiž neumožňuje tyto dva odlišené vlivy oddělit:
V původních studiích bylo proto k vyloučení vlivu přechodného zvýšení preloadu levé komory v důsledku vytlačení krve z malého oběhu doporučováno stanovit referenční hodnotu tlaku v okamžiku end-exspirační pauzy a posuzovat pouze negativní odchylku systolického tlaku (tzv. Δdown komponentu – viz obr. 3). Ani sledování hodnoty Δdown komponenty ovšem neodstraní vliv změny afterloadu obou komor, naopak přírůstek preloadu levé komory daný inspiriem je možno považovat za součást objemové změny. Z těchto důvodů se v současné době používají k výpočtu hodnoty maximální a minimální výchylky příslušného parametru (pulzní tlak, tepový objem atd.) v průběhu ventilace.
Zásadním přínosem dynamických parametrů je možnost posouzení polohy aktuální hodnoty preloadu na Frank-Starlingově křivce, a to bez ohledu na to jaká je aktuální kontraktilní funkce komory. Vzhledem k tomu, že množství krve zadržené plicní cirkulací při konstantním dechovém objemu je stejné, vede tato změna v případě nemocného pohybujícího se na strmé části křivky k významným výkyvům v tepovém objemu. Naopak u nemocného na ploché části křivky jsou rozdíly v tepovém objemu měřeném v inspiriu a exspiriu minimální (viz obr. 4). Klinické využití dynamických parametrů bylo zkoumáno v mnoha studiích. V současné době existují minimálně 3 velké metaanalýzy hodnotící prediktivní potenciál parametrů SVV, PPV a PVI – všechny se shodují na vysoké prediktivní schopnosti parametrů při splnění základních podmínek [16–18].
Image 4. Znázornění vztahu změny tepového objemu indukované respiračním cyklem 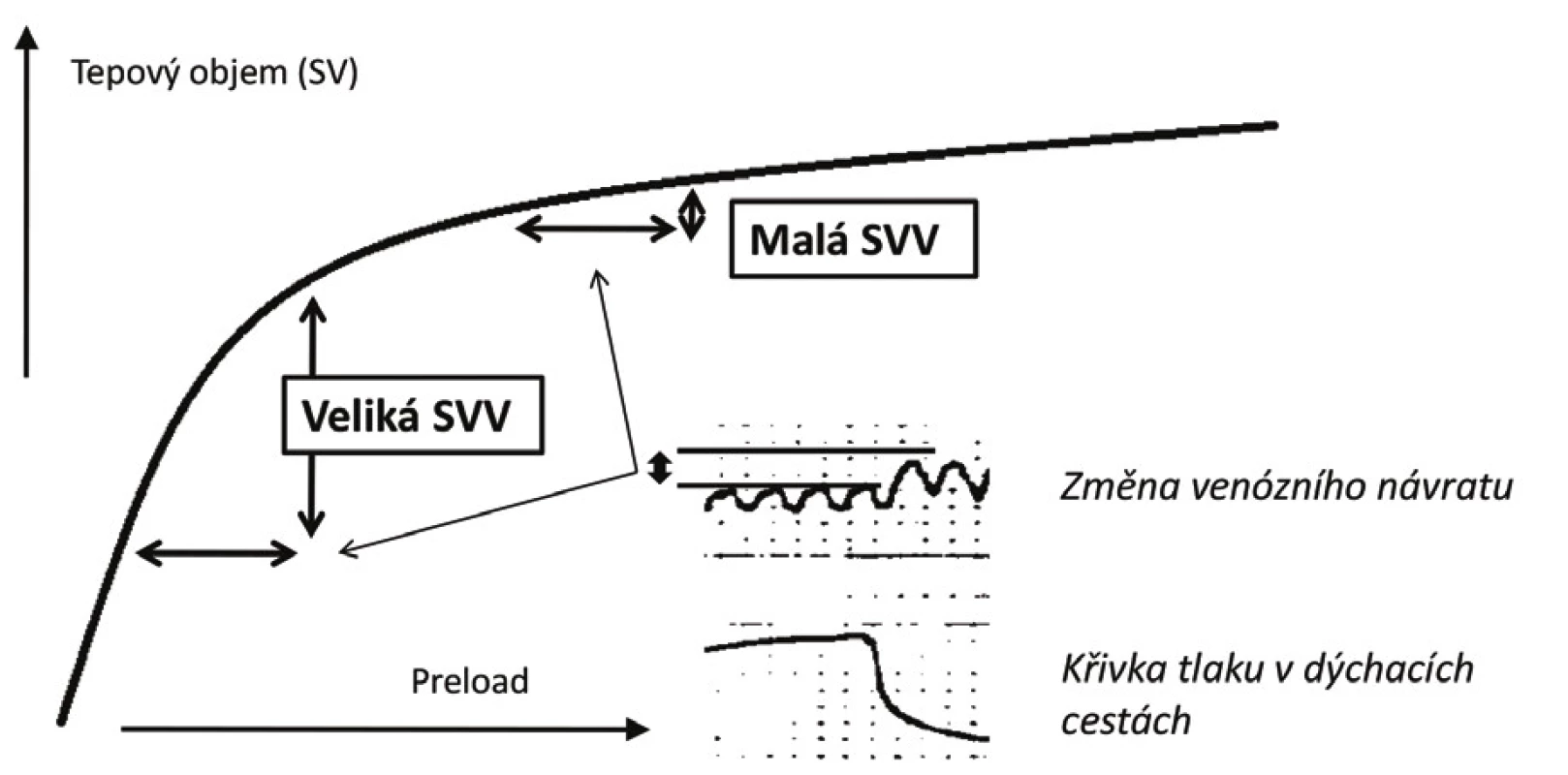
SVV – stroke volume variation Vzhledem k nejednotným diskriminačním hodnotám se uvažuje o existenci šedé zóny s nejistou schopností dostatečné predikce tekutinové reaktivity při hodnotách DV v rozmezí 10–15 %. Hodnot nalézajících se v této oblasti lze ovšem využít k individualizaci cíle objemové expanze – tzv. přístup „šedé zóny“ (z angl. grey zone approach) [37]: U nemocných, u nichž je vysoké riziko plynoucí z neadekvátního podání tekutin, je vhodnější zvolit diskriminační hodnotu poskytující vysokou specificitu (hodnoty DV kolem 13 %). Naopak u pacientů, u kterých je předpoklad dobré tolerance tekutinové nálože, je možno zvolit nižší hraničí hodnotu poskytující vysokou senzitivitu (DV kolem 9–10 %) [37].
Užití DV je ale možné pouze při splnění několika základních podmínek. Základní limitace shrnul Michard pod akronym „S-O-S“ [38]: setrvalé srdeční arytmie, otevřený hrudník a spontánní ventilace. Aby bylo možno automaticky stanovit hodnotu DV a správně ji interpretovat, musí být cyklické změny dechového objemu a nitrohrudního tlaku co nejstálejší. Podle některých prací je zároveň nutné, aby dechový objem dosahoval minimálně 8 ml/kg [39, 40]. Vedle toho lze předpokládat jistý vliv hladiny pozitivního tlaku na konci výdechu (PEEP). Obdobně zkreslující vliv jako variabilita dechového objemu může mít variabilita plnících časů komory a tedy srdeční frekvence. Ojedinělé extrasystoly jsou některá zařízení schopna v rámci automatického patentovaného algoritmu (SVV Xtra, Edwards Lifesciences Inc.) eliminovat a rekonstruovat hypotetickou pravidelnost [41]. Komplexnější porucha rytmu typu síňové fibrilace (variabilita srdeční frekvence nad 10 %) [42] nicméně užití dynamických variací zcela znehodnocuje. Frekvence vzájemné interakce dechového a srdečního cyklu (poměr srdeční k dechové frekvenci nižší než 3,6) byl v jedné studii také popsán jako potenciálně limitující faktor [43].
Hlavně u nemocných v intenzivní péči se můžeme setkat s dalšími limitujícími faktory, kdy jiné patofyziologické mechanismy převáží svým vlivem na hemodynamiku a vytváří obraz falešně pozitivní variace. U pacientů s pravostrannou srdeční dysfunkcí nebo plicní hypertenzí mohou změny v afterloadu pravé komory převážit změny preloadu [44, 45]. Například při vysoké katecholaminové podpoře nebo agresivní ventilaci přetlakem může ke zvýšení plicních tlaků docházet relativně často. Obdobně intraabdominální hypertenze může limitovat žilní návrat, ovlivnit intratorakální tlaky a tím i dotížení obou komor. K významnému ovlivnění jsou nicméně nutné výrazně vyšší intraabdominální tlaky odpovídající nitrobřišnímu kompartmentovému syndromu [46, 47]. Tlaky do 15 mm Hg běžně užívané v laparoskopické chirurgii by neměly ovlivňovat prediktivní schopnost dynamických prediktorů [48].
Dále je nutno brát v úvahu vliv vazopresorů na variaci pulzního nebo systolického tlaku, případně při užití pletyzmografie [49, 50]. Dalším problémem může být automatizované stanovení, přesnost užitých přístrojů a vliv dalších dosud ne zcela poznaných faktorů [51, 52]. V důsledku těchto kontraindikací je možné použít dynamické parametry preloadu přibližně u jedné třetiny nemocných v počáteční fázi onemocnění (kdy je veliká incidence sedace a řízené ventilace) [53], v běžné populaci pacientů v intenzivní péči je ale významně menší [54].
2. 5. 2 Parametry vznikající interakcí srdce-plíce nezávislé na ventilaci
Interakce srdce-plíce umožňuje dynamické stanovení reakce na podání tekutiny i u nemocných, kteří nesplňují podmínky pro užití dynamické variace tepového objemu a odvozených parametrů. Testy jsou většinou založeny na řízené změně intratorakálních tlaků, která vede k modulaci preloadu. Změna preloadu je většinou velmi krátkodobá a plně reverzibilní. Pro zhodnocení odpovědi je často nutné stanovení tepového objemu případně echokardiografická analýza VTI. Obraz změn preloadu v tlakových parametrech (pulzní tlak, hůře systolický tlak) jsou významně méně citlivé. Také v tomto případě vyžadují tzv. beat-to beat sledování.
Typickou formou preload modifikujícího manévru je test endexspirační okluze (end-expiratory occlusion – EEO). Náhlé přerušení umělé plicní ventilace vřazením end-exspirační okluze po dobu 15 sekund vede k odstranění vlivu zvýšení intratorakálního tlaku na preload i afterload pravé komory [55]. To ovlivní předtížení levé komory a vede u nemocného na vzestupné části Frank-Starlingovi křivky ke zvýšení tepového objemu. S ohledem na délku testu je možno sledovat vliv i u nemocných s arytmiemi nebo s mírnou spontánní ventilací. Ve studii Monneta et al. [21] byla hranice pro předpověď pozitivní reakce na tekutinu pomocí EEO dosažena již při 5% nárůstu hodnoty pulzního tlaku nebo srdečního indexu. Předřazením endinspirační okluze (EIO), která má na hemodynamiku opačný efekt, může být citlivost testu EEO významně zvýšena, ovšem data podporující tuto myšlenku zatím nebyla publikována.
Podobného výsledku jako při testu end-exspirační okluze může být dosaženo při náhlé změně PEEP. V zatím jediné studii [56] byl prokázán predikční potenciál poklesu středního tlaku o více než 8 % při navýšení PEEP z 10 na 20 cm H2O v průběhu endexspirační pauzy. V práci Messiny et al. byl pokles pulzního tlaku o 35 % při vřazení 4sekundového 35 cm H2O prodechu (sigh) spojen s pozitivní tekutinovou reaktivitou u pacientů při tlakové podpoře spontánní ventilace [57]. S ohledem na komplexnost kardio-pulmonarní interakce je ale nutno uvažovat, že na zmíněné výsledky mohou mít – vedle prosté změny preloadu – vliv i další faktory, hlavně změna v afterloadu obou komor. To může vést k významnému zkreslení výsledků. Je také nutné podotknout, že oproti jiným metodám (ventilací indukovaná změna tepového objemu, pasivní zvednutí nohou) jsou všechny výše popsané testy podpořeny významně menším počtem (často jedné či dvou) studií a při interpretaci jejich výsledků je vhodná jistá míra opatrnosti.
2. 5. 3 Sonografické zhodnocení žilního systému
Sonografické zobrazení dolní duté žíly (VCI – vena cava inferior) se v poslední době stalo jedním z nejoblíbenějších parametrů pro zhodnocení centrální volémie. Na rozdíl od většiny ostatních parametrů, které hodnotí míru volémie na podkladě velikosti srdečního výdeje, tyto postupy zhodnocují velikost žilního návratu a případně jeho dynamiku vyvolanou ventilačními změnami nitrohrudního tlaku. Základem je stanovení průměru VCI u pacienta ležícího na zádech přibližně 1 cm distálně od ústí hepatálních žil a její dynamické změny v průběhu dechového cyklu [22]. U nemocných na řízené ventilaci přetlakem dochází díky navýšení nitrohrudních tlaků k poklesu žilního návratu a tedy stagnaci krve v kompliantním žilním systému, což se projeví nárůstem průsvitu VCI. Distenzibilita VCI větší než 18–20 % je brána jako marker tekutinové reaktivity [22]. U pacientů plně spontánně ventilujících dochází vlivem snížení nitrohrudních tlaků naopak k nárůstu žilního návratu a tedy kolapsu VCI. Pokud je kolaps větší než 40–50 %, je test tekutinové reaktivity pozitivní [23], ačkoli novější práce tento nález jednoznačně nepotvrzují [26]. Obdobně jako dynamická variace tepového objemu je i posuzování změny VCI nepřesné za celé řady okolností. Via et al. identifikoval 10 faktorů, které mohou ovlivnit výsledky testu [58]. Řada z nich vychází z fyziologického předpokladu a nebyla klinicky testována formou řízených studií, je však důležité brát tyto mechanismy v potaz při hodnocení testu. K nejdůležitějším je možno zařadit ventilaci s proměnlivou velikostí nitrohrudního tlaku (nejčastěji asistované formy), plicní hyperinflaci, dále stavy s limitací návratu při patologii pravé komory nebo její tamponádě a nitrobřišní hypertenzi.
2. 5. 4 Preload modifikující manévry – test zvednutých nohou
Preload modifikující manévry můžeme považovat za specifickou adaptaci tekutinové výzvy. Základní myšlenkou je provedení manévru, který vede k náhlému zvýšení venózního návratu a tedy srdečního preloadu. Manévr je plně reverzibilní, tedy po jeho ukončení se systém vrací zpět do původního stavu náplně a případnou objemovou expanzi je nutno provést podáním infuzního roztoku.
Nejčastěji prováděným preload modifikujícím manévrem hlavně v intenzivní péči je test zvednutých nohou (passive leg raising – PLR). Přechodným uložením nohou nemocného do tzv. „autotransfuzní polohy“ dochází k mobilizaci cca 250 ml krve z kapacitního řečiště, což odpovídá velikosti malé objemové výzvy. Pokud je nemocný před testem uložen v polosedu a je spolu se zvednutím nohou položen trup, je mobilizováno množství odpovídající 400–500 ml. S malým časovým odstupem je hodnocena odezva obdobně jako v případě podání klasického bolusu tekutiny. Při provádění testu je nutné jeho správné provedení – detailní popis jednotlivých kroků byl excelentně popsán skupinou J. L. Teboul a X. Monnet [59]. Mezi hlavní nevýhody patří obtížnější provedení u bdělých (nebo hraničně sedovaných) pacientů, kdy náhlá změna polohy může vyvolat stresovou odpověď spojenou s hemodynamickou odezvou zkreslující výsledky testu. U pacientů s nitrobřišní hypertenzí a u nemocných s kompresními bandážemi dolních končetin může být test méně spolehlivý, zřejmě v důsledku mobilizace menšího množství tekutiny [60]. Podle nedávno publikované metaanalýzy [14] byl PLR způsobený nárůstem srdečního výdeje o 10 ± 2 % spojený s 85% senzitivitou a 91% specificitou (AUC ROC 0,95). Při nárůstu pulzního tlaku o více než 12 ± 4 % byla senzitivita pouze 56% a specificita 83% (AUC ROC 0,77).
2. 5. 5 Tekutinová mini-výzva a tekutinová výzva
Všechny výše zmíněné testy by měli umožnit rozpoznat tekutinovou reaktivitu před zahájením vlastní infuze. Za mnoha okolností ale nemusí být jejich výsledek zcela přesvědčivý, nebo může odporovat naší klinické představě. Finální možností je tedy vyzkoušet reakci organismu na faktické podání objemu. V případě, kdy je veliké riziko z přetížení tekutinou (nebo se jedná o opakované testování tekutinové reaktivity v průběhu krátké doby), je možné zmenšit množství podaného objemu cca na 50–100 ml a provést tzv. test tekutinové minivýzvy. Množství podané tekutiny je malé, proto je nutné podání maximální rychlostí (autorovi práce se osvědčuje co nejrychlejší podání 60 ml injekční stříkačkou) se souběžným zhodnocováním odpovědi. Vzhledem k malé změně preloadu je nutno použít poměrně přesné měření změny tepového objemu – v několika dosud publikovaných pracích bylo nejčastěji užito echokardiograficky sledované změny VTI případně tepového objemu nebo parametrů SVV a PPV získaných beat-to-beat analýzou [61–63].
Správnému provedení tekutinové výzvy jsme se již věnovali v předchozí práci. Důležitým aspektem je, aby bylo nemocnému podáno dostatečné množství tekutiny dostatečnou rychlostí a byly zhodnoceny relevantní parametry hemodynamiky před podáním a po něm. Jak ukázala nedávno publikovaná FENICE trial jsou postupy podání tekutinové výzvy poměrně značně heterogenní v celosvětovém měřítku [64]. S ohledem na podávání tekutinové výzvy nelze odhlédnout od běžných praktických aspektů podání. Pro zhodnocení odpovědi by bylo sice nejlepší aplikovat množství odpovídající např. 5 ml/kg, to s sebou ale přináší nepraktickou nutnost užití infuzní pumpy, jejíž rychlost je většinou limitována na 999–1 200 ml/h. Obvykle tedy pod pojmem tekutinová výzva rozumíme podání 500 ml (tedy běžně dostupný objem infuzních lahví). Rychlost podání se jistě podílí na efektu, kterého lze podáním tekutiny dosáhnout. Pokud je podání příliš pomalé (cca 30 minut a více), dojde již v průběhu infuze k přerozdělení do netlakovaného objemu a intersticia (hlavně při užití krystaloidů) [65]. Výsledný změřený efekt je potom významně menší, neboť není testována odpověď srdce ale celého kardiovaskulárního systému (včetně mikrocirkulace a tkání). Naopak při příliš rychlém podání hrozí podle některých autorů riziko akutně vzniklého přetížení srdečních oddílů s následným zvýšením produkce natriuretických faktorů, poškození glykokalyx a zvýšení extravazace [8]. Ve většině studií je podáván objem 500 ml v průběhu 5–20 minut. Optimálním sledovaným parametrem je změna tepového objemu nebo srdečního výdeje. Alternativně lze použít pulzní tlak, podle některých prací i změnu CO2 na konci výdechu či v případě volumetrické kapnometrie i VCO2 [66]. Standardní hemodynamické parametry (arteriální tlak, srdeční frekvence či CVP) nejsou dostatečně spolehlivé, jakkoli jsou v klinické rutině nejčastěji užívány.
3 ZÁVĚR
Zhodnocení tekutinové reaktivity je postup, který může při správném provedení napomoci správnému vedení tekutinové terapie. Volba příslušného testu by vždy měla záviset na klinických podmínkách (umělá plicní ventilace, polohovatelnost nemocného apod.), dostupnosti potřebného zařízení a také na osobních znalostech a zkušenostech. Platí přitom, že přítomnost známek tekutinové reaktivity per se není indikací k podání tekutin. Spíše naopak – absence známek tekutinové reaktivity by měla být jasným indikátorem nepokračovat v expanzi cirkulujícího objemu. Zároveň platí, že každá podaná tekutina je v určitém časovém horizontu redistribuována do netlakovaného objemu a do intersticia, čímž dojde k opětovnému poklesu žilního návratu a tedy i srdečního výdeje. Vzhledem k rizikům spojeným s kumulací tekutin u pacientů v kritickém stavu by mělo být provádění testů tekutinové reaktivity součástí každého rozhodnutí k podání infuze s cílem zvýšení cirkulujícího objemu. Samozřejmě s výjimkou stavů akutního ohrožení života v důsledku evidentní centrální hypovolémie.
Podpora
Text vznikl za podpory Programu rozvoje P36 PRVOUK Univerzity Karlovy.
Autor prohlašuje, že nemá střet zájmů.
Poznámka: Shrnutí zásad pro tekutinovou terapii najdete v aplikaci České společnosti intenzivní medicíny – CSIM Smart Cards (ke stažení v knihovně iTunes nebo Android).
Do redakce došlo dne 2. 8. 2016.
Do tisku přijato 28. 8. 2016.
Adresa pro korespondenci:
doc. MUDr. Jan Beneš, Ph.D.
KARIM FN Plzeň
Alej Svobody 80
304 60 Plzeň-Lochotín
e-mail: benesj@fnplzen.cz
Sources
1. Benes, J. Tekutinová terapie v intenzivní péči. Anest. Intenziv. Med., 2016, 27, 2, p. 107–115.
2. Neyra, J. A., Li, X., Canepa-Escaro, F., Adams-Huet, B., Toto, R. D., Yee, J. et al. Cumulative Fluid Balance and Mortality in Septic Patients With or Without Acute Kidney Injury and Chronic Kidney Disease. Crit. Care Med., 2016.
3. Wang, N., Jiang, L., Zhu, B., Wen, Y., Xi, X. M. Beijing Acute Kidney Injury Trial (BAKIT) Workgroup, et al. Fluid balance and mortality in critically ill patients with acute kidney injury: a multicenter prospective epidemiological study. Crit. Care, 2015, 19, p. 371.
4. Acheampong, A., Vincent, J. L. A positive fluid balance is an independent prognostic factor in patients with sepsis. Crit. Care, 2015, 19, p. 251.
5. Pinsky, M. R., Payen, D. Functional hemodynamic monitoring. Crit. Care, 2005, 9, 6, p. 566–572.
6. Benes, J., Kirov, M., Kuzkov, V., Lainscak, M., Molnar, Z., Voga, G. et al. Fluid Therapy: Double-Edged Sword during Critical Care? BioMed Research International, 2015, 2015, 2, p. 1–14.
7. Marik, P. E. Hemodynamic parameters to guide fluid therapy. Transfusion Alter Transfusion Med., 2010, 11, 3, p. 102–112.
8. Marik, P., Bellomo, R. A rational approach to fluid therapy in sepsis. Br. J. Anaesth., 2015.
9. Henderson, W. R., Griesdale, D. E. G., Walley, K. R., Sheel, A. W. Clinical review: Guyton – the role of mean circulatory filling pressure and right atrial pressure in controlling cardiac output. Harv. Mens Health. Watch, 2010, 14, 6, p. 243.
10. Simmons, D., Linde, L., Miller, J. H., O´Reilly, R. J. Relation between lung volume and pulmonary vascular resistance. Circ. Res., 1961, 9, 3, p. 465-471.
11. Peták, F., Albu, G., Lele, E., Hantos, Z., Morel, D. R., Fontao, F. et al. Lung mechanical and vascular changes during positive - and negative-pressure lung inflations: importance of reference pressures in the pulmonary vasculature. J. Appl. Physiol., 2009, 106, 3, p. 935–942.
12. Creamer, K. M., McCloud, L. L., Fisher, L. E., Ehrhart, I. C. Ventilation above closing volume reduces pulmonary vascular resistance hysteresis. Am. J. Respir. Crit. Care Med., 1998, 158, 4, p. 1114–1119.
13. Cannesson, M., Aboy, M., Hofer, C. K., Rehman, M. Pulse pressure variation: where are we today? J. Clin. Monit. Comput., 2011, 25, 1, p. 45–56.
14. Monnet, X., Marik, P., Teboul, J. L. Passive leg raising for predicting fluid responsiveness: a systematic review and meta-analysis. Int. Care Med., 2016.
15. Cherpanath, T. G. V., Hirsch, A., Geerts, B. F., Lagrand, W. K., Leeflang, M. M., Schultz, M. J. et al. Predicting Fluid Responsiveness by Passive Leg Raising: A Systematic Review and Meta-Analysis of 23 Clinical Trials. Crit. Care Med., 2016, 44, 5, p. 981–991.
16. Marik, P. E., Cavallazzi, R., Vasu, T., Hirani, A. Dynamic changes in arterial waveform derived variables and fluid responsiveness in mechanically ventilated patients: a systematic review of the literature. Crit. Care Med., 2009, 37, 9, p. 2642–2647.
17. Zhang, Z., Lu, B., Sheng, X., Jin, N. Accuracy of stroke volume variation in predicting fluid responsiveness: a systematic review and meta-analysis. J. Anesth., 2011, 25, 6, p. 904–916.
18. Sandroni, C., Cavallaro, F., Marano, C., Falcone, C., Santis, P., Antonelli, M. et al. Accuracy of plethysmographic indices as predictors of fluid responsiveness in mechanically ventilated adults: a systematic review and meta-analysis. Intensive Care Med., 2012, 38, 9, p. 1429–1437.
19. Silva, S., Jozwiak, M., Teboul, J. L., Persichini, R., Richard, C., Monnet, X. et al. End-expiratory occlusion test predicts preload responsiveness independently of positive end-expiratory pressure during acute respiratory distress syndrome. Crit. Care Med., 2013, 41, 7, p. 1692–1701.
20. Guinot, P. G., Godart, J., de Broca, B., Bernard, E., Lorne, E., Dupont, H. et al. End-expiratory occlusion manoeuvre does not accurately predict fluid responsiveness in the operating theatre. Br. J. Anaesth., 2014, 112, 6, p. 1050–1054.
21. Monnet, X., Osman, D., Ridel, C., Lamia, B., Richard, C., Teboul, J. L. et al. Predicting volume responsiveness by using the end-expiratory occlusion in mechanically ventilated intensive care unit patients. Crit. Care Med., 2009, 37, 3, p. 951–956.
22. Barbier, C., Loubières, Y., Schmit, C., Hayon, J., Ricôme, J. L., Jardin, F. et al. Respiratory changes in inferior vena cava diameter are helpful in predicting fluid responsiveness in ventilated septic patients. Intensive Care Med., 2004, 30, 9, p. 1740–1746.
23. Muller, L., Bobbia, X., Toumi, M., Louart, G., Molinari, N., Ragonnet, B. et al. Respiratory variations of inferior venacava diameter to predict fluid responsiveness in spontaneouslybreathing patients with acute circulatory failure: need for a cautious use. Crit. Care, 2012, 16, 5, p. R188.
24. Machare-Delgado, E., Decaro, M., Marik, P. E. Inferior vena cava variation compared to pulse contour analysis as predictors of fluid responsiveness: a prospective cohort study. J. Intensive Care Med., 2011, 26, 2, p. 116–124.
25. Lanspa, M. J., Grissom, C. K., Hirshberg, E. L., Jones, J. P., Brown, S. M. Applying dynamic parameters to predict hemodynamic response to volume expansion in spontaneously breathing patients with septic shock. Shock, 2013, 39, 2, p. 155–160.
26. Airapetian, N., Maizel, J., Alyamani, O., Mahjoub, Y., Lorne, E., Levrard, M. et al. Does inferior vena cava respiratory variability predict fluid responsiveness in spontaneously breathing patients? Crit. Care, 2015, 19, 1, p. 400.
27. Lee, J. H., Kim, J. T., Yoon, S. Z., Lim, Y. J., Jeon, Y., Bahk, J. H. et al. Evaluation of corrected flow time in oesophageal Doppler as a predictor of fluid responsiveness. Br. J. Anaesth., 2007, 99, 3, p. 343–348.
28. Monge García, M. I., Gil Cano, A., Gracia Romero, M., Monterroso Pintado, R., Pérez Madueño, V., Díaz Monrové, J. C. et al. Non-invasive assessment of fluid responsiveness by changes in partial end-tidal CO2 pressure during a passive leg-raising maneuver. Annals of intensive care, 2012, 2, p. 9.
29. Marik, P. E., Cavallazzi, R. Does the central venous pressure predict fluid responsiveness? An updated meta-analysis and a plea for some common sense. Crit. Care Med., 2013, 41, 7, p. 1774–1781.
30. Eskesen, T. G., Wetterslev, M., Perner, A. Systematic review including re-analyses of 1148 individual data sets of central venous pressure as a predictor of fluid responsiveness. Intensive Care Med., 2016, 42, 3, p. 324–332.
31. Magder, S. Central venous pressure: A useful but not so simple measurement. Crit. Care Med., 2006, 34, 8, p. 2224–2227.
32. Marik, P. E. Iatrogenic salt water drowning and the hazards of a high central venous pressure. Annals of intensive care, 2014, 4, p. 21.
33. Goepfert, M. S., Richter, H. P., Zu Eulenburg, C., Gruetzmacher, J., Rafflenbeul, E., Roeher, K. et al. Individually optimized hemodynamic therapy reduces complications and length of stay in the intensive care unit: a prospective, randomized controlled trial. Anesthesiology, 2013, 119, 4, p. 824–836.
34. Marik, P. E., Monnet, X., Teboul, J. L. Hemodynamic parameters to guide fluid therapy. Annals of intensive care, 2011, 1, 1, p. 1.
35. Marik, P. E., Levitov, A., Young, A., Andrews, L. The use of bioreactance and carotid Doppler to determine volume responsiveness and blood flow redistribution following passive leg raising in hemodynamically unstable patients. Chest, 2013, 143, 2, p. 364–370.
36. Perel, A., Pizov, R., Cotev, S. Systolic blood pressure variation is a sensitive indicator of hypovolemia in ventilated dogs subjected to graded hemorrhage. Anesthesiology, 1987, 67, 4, p. 498–502.
37. Cannesson, M., Le Manach, Y., Hofer, C., Goarin, J., Lehot, J., Vallet, B. et al. Assessing the diagnostic accuracy of pulse pressure variations for the prediction of fluid responsiveness: a „gray zone“ approach. Anesthesiology, 2011, 115, 2, p. 231–241.
38. Michard, F. Stroke volume variation: from applied physiology to improved outcomes. Crit. Care Med., 2011, 39, 2, p. 402–403.
39. Kubitz, J. C., Annecke, T., Kemming, G. I., Forkl, S., Kronas, N., Goetz, A. E. et al. The influence of positive end-expiratory pressure on stroke volume variation and central blood volume during open and closed chest conditions. Eur. J. Cardiothorac. Surg., 2006, 30, 1, p. 90–95.
40. Backer, D., Heenen, S., Piagnerelli, M., Koch, M., Vincent, J. L. Pulse pressure variations to predict fluid responsiveness: influence of tidal volume. Intensive Care Med., 2005, 31, 4, p. 517–523.
41. Cannesson, M., Tran, N. P., Cho, M., Hatib, F., Michard, F. Predicting fluid responsiveness with stroke volume variation despite multiple extrasystoles. Crit. Care Med., 2012, 40, 1, p. 193–198.
42. Umgelter, A., Reindl, W., Schmid, R. M., Huber, W. Is supra-ventricular arrhythmia a reason for the bad performance of the FlowTrac device? Crit. Care, 2007, 11, 1, p. 406, author reply 406.
43. De Backer, D., Taccone, F. S., Holsten, R., Ibrahimi, F., Vincent, J. L. Influence of respiratory rate on stroke volume variation in mechanically ventilated patients. Anesthesiology, 2009, 110, 5, p. 1092–1097.
44. Daudel, F., Tüller, D., Krähenbühl, S., Jakob, S. M., Takala, J. Pulse pressure variation and volume responsiveness during acutely increased pulmonary artery pressure: an experimental study. Crit. Care, 2010, 14, 3, p. R122.
45. Wyler von Ballmoos, M., Takala, J., Roeck, M., Porta, F., Tueller, D., Ganter, C. C. et al. Pulse-pressure variation and hemodynamic response in patients with elevated pulmonary artery pressure: a clinical study. Crit. Care, 2010, 14, 3, p. R111.
46. Duperret, S., Lhuillier, F., Piriou, V., Vivier, E., Metton, O., Branche, P. et al. Increased intra-abdominal pressure affects respiratory variations in arterial pressure in normovolaemic and hypovolaemic mechanically ventilated healthy pigs. Intensive Care Med., 2007, 33, 1, p. 163–171.
47. Renner, J., Gruenewald, M., Quaden, R., Hanss, R., Meybohm, P., Steinfath, M. et al. Influence of increased intra-abdominal pressure on fluid responsiveness predicted by pulse pressure variation and stroke volume variation in a porcine model. Crit. Care Med., 2009, 37, 2, p. 650–658.
48. Liu, X., Fu, Q., Mi, W., Liu, H., Zhang, H., Wang, P. et al. Pulse pressure variation and stroke volume variation predict fluid responsiveness in mechanically ventilated patients experiencing intra-abdominal hypertension. Bioscience trends, 2013, 7, 2, p. 101–108.
49. Kubitz, J. C., Forkl, S., Annecke, T., Kronas, N., Goetz, A. E., Reuter, D. A. et al. Systolic pressure variation and pulse pressure variation during modifications of arterial pressure. Intensive Care Med., 2008, 34, 8, p. 1520–1524.
50. Kubitz, J. C., Annecke, T., Forkl, S., Kemming, G. I., Kronas, N., Goetz, A. E. et al. Validation of pulse contour derived stroke volume variation during modifications of cardiac afterload. Br. J. Anaesth., 2007, 98, 5, p. 591–597.
51. Lahner, D., Kabon, B., Marschalek, C., Chiari, A., Pestel, G., Kaider, A. et al. Evaluation of stroke volume variation obtained by arterial pulse contour analysis to predict fluid responsiveness intraoperatively. Br. J. Anaesth., 2009, 103, 3, p. 346–351.
52. Perel, A. Automated assessment of fluid responsiveness in mechanically ventilated patients. Anesth. Analg., 2008, 106, 4, p. 1031–1033.
53. Benes, J., Zatloukal, J., Kletecka, J., Simanova, A., Haidingerova, L., Pradl, R. et al. Respiratory induced dynamic variations of stroke volume and its surrogates as predictors of fluid responsiveness: applicability in the early stages of specific critical states. J. Clin. Monit. Comput., 2014, 28, 3, p. 225–231.
54. Mahjoub, Y., Lejeune, V., Muller, L., Perbet, S., Zieleskiewicz, L., Bart, F. et al. Evaluation of pulse pressure variation validity criteria in critically ill patients: a prospective observational multicentre point-prevalence study. Br. J. Anaesth., 2014, 112, 4, p. 681–685.
55. Monnet, X., Rienzo, M., Osman, D., Anguel, N., Richard, C., Pinsky, M. R. et al. Passive leg raising predicts fluid responsiveness in the critically ill. Crit. Care Med., 2006, 34, 5, p. 1402–1407.
56. Wilkman, E., Kuitunen, A., Pettilä, V., Varpula, M. Fluid responsiveness predicted by elevation of PEEP in patients with septic shock. Acta Anaesthesiol. Scand., 2014, 58, 1, p. 27–35.
57. Messina, A., Colombo, D., Romagnoli, S., Bonicolini, E., De Mattei, G., Longhini, F. et al. The mini-sigh test: a new haemodynamic test of fluid responsiveness in ICU patients undergoing pressure support ventilation. Intens. Care Med. Exp., 2015, 3, Suppl. 1, p. A17.
58. Via, G., Tavazzi, G., Price, S. Ten situations where inferior vena cava ultrasound may fail to accurately predict fluid responsiveness: a physiologically based point of view. Intensive Care Med., 2016, 42, 7, p. 1164–1167.
59. Monnet, X., Teboul, J. L. Passive leg raising: five rules, not a drop of fluid! Crit. Care, 2015, 19, p. 18.
60. Malbrain, M. L. N. G., Reuter, D. A. Assessing fluid responsiveness with the passive leg raising maneuver in patients with increased intra-abdominal pressure: be aware that not all blood returns! Crit. Care Med., 2010, 38, 9, p. 1912–1915.
61. Muller, L., Toumi, M., Bousquet, P. J., Riu-Poulenc, B., Louart, G., Candela, D. et al. An increase in aortic blood flow after an infusion of 100 ml colloid over 1 minute can predict fluid responsiveness: the mini-fluid challenge study. Anesthesiology, 2011, 115, 3, p. 541–547.
62. Mallat, J., Meddour, M., Durville, E., Lemyze, M., Pepy, F., Temime, J. et al. Decrease in pulse pressure and stroke volume variations after mini-fluid challenge accurately predicts fluid responsiveness. Br. J. Anaesth., 2015, 115, 3, p. 449–456.
63. Guinot, P. G., Bernard, E., Deleporte, K., Petiot, S., Dupont, H., Lorne, E. et al. Mini-fluid challenge can predict arterial pressure response to volume expansion in spontaneously breathing patients under spinal anaesthesia. Anaesthesia, critical care & pain medicine, 2015, 34, 6, p. 333–337.
64. Cecconi, M., Hofer, C., Teboul, J. L., Pettila, V., Wilkman, E., Molnar, Z. et al. Fluid challenges in intensive care: the FENICE study: A global inception cohort study. Intensive Care Med., 2015, 41, 9, p. 1529–1537.
65. Hahn, R. G. Why are crystalloid and colloid fluid requirements similar during surgery and intensive care? Eur. J. Anaesthesiol., 2013, 30, 9, p. 515–518.
66. Young, A., Marik, P. E., Sibole, S., Grooms, D., Levitov, A. Changes in end-tidal carbon dioxide and volumetric carbon dioxide as predictors of volume responsiveness in hemodynamically unstable patients. J. Cardiothorac. Vasc. Anesth., 2013, 27, 4, p. 681–684.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2017 Issue 1
Most read in this issue- Nejčastější komplikace po celkové anestezii z pohledu pacienta: dotazníková srovnávací studie 2007/2014
- Akutní respirační selhání a echokardiografické vyšetření
- Predikce odpovědi na podání tekutiny – tekutinová reaktivita
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


