-
Medical journals
- Career
Akutní respirační selhání a echokardiografické vyšetření
: M. Balík
: Klinika anesteziologie, resuscitace a intenzivní medicíny, 1. LF UK a VFN, Praha
: Anest. intenziv. Med., 28, 2017, č. 1, s. 23-34
:
Akutní respirační selhání je jako jedna z nějčastějších příčin příjmu na oddělení intenzivní péče velmi často doprovázeno hemodynamickou nestabilitou. Zásadní otázkou je funkce levé komory srdeční, stanovení tlaku v levé síni a plnicích tlaků levého srdce. Prognóza a management respiračního selhání závisí také na funkci pravé komory a stavu plicní cirkulace. Důležité je systematické vyšetření podle echoprotokolu, které umožní správně rozhodnout léčebnou strategii zahrnující optimalizaci pacientova preload, kontraktility, srdeční frekvence a afterload. Monitorování plicního parenchymu a pleurálního prostoru umožňuje lékaři získat dodatečná data k echokardiografickému vyšetření, která mohou usnadnit rozhodování o ventilační strategii, potřebě bronchoskopie, pleurální drenáže a optimální poloze pacienta včetně rozhodnutí o semipronační a pronační poloze. Vhodnost a efekty aplikované terapie v akutním respiračním selhání mohou být monitorovány bedside echokardiografií a plicní sonografií s cílem optimalizovat plicní výměnu plynů bez hemodynamické alterace a také s cílem zlepšit pacientovu hemodynamickou stabilitu bez zbytečné zátěže pro respirační systém. Při odpovědi na terapii může echokardiografie pomoci s odvykáním a ukončením ventilační podpory. V případě kritického respiračního selhání rychlé vyšetření echokardiografií a hrudním ultrazvukem pomáhá v rozhodování o indikaci k mimotělní podpoře výměny plynů a/nebo cirkulace (ECLS) a její optimální konfiguraci. ECLS vyžaduje ultrazvukové modality pro správnou indikaci, monitorování terapie a odvykání od tohoto typu podpory. Echokardiografie je považována za nepostradatelnou u respiračního selhání a ultrazvukový přístroj by měl být standardní součástí vybavení jednotek intenzivní péče.
Klíčová slova:
akutní respirační selhání – echokardiografie – ultrasonografie – hrudní ultrasonografie – intenzivní péče – umělá plicní ventilace – extrakorporální mimotělní oxygenaceÚVOD
Význam hemodynamického vyšetření u respiračního selhání je dokumentován vztahem mezi cirkulační stabilitou respiračně selhávajícího pacienta, morbiditou a mortalitou. Akutní respirační selhání může mít vztah k nekardiálním příčinám s absencí zvýšených hydrostatických tlaků v plicním řečišti. Bez ohledu na primární příčinu respiračního selhání je většina pacientů hemodynamicky nestabilní. Zvážíme-li všechny stupně závažnosti ARDS, 9 z 10 pacientů má nějakou formu cirkulačního kompromisu při příjmu na oddělení bez ohledu na etiologii. Mortalita, incidence tracheostomie a prolongované ventilace v den 15. byla více než dvojnásobná u pacientů s hemodynamickou nestabilitou definovanou jako šokový stav v den 3. po intubaci [1]. Podobně u kohort pacientů s mírným až těžkým ARDS přispívá kardiovaskulární funkce k mortalitě [2]. Zvýšený hydrostatický tlak rezultující ze zvýšeného tlaku v levé síni (LAP) vedoucí k plicní kongesci musí být odlišen od nekardiálních příčin respiračního selhání. Etiologie a mechanismus vedoucí k respiračnímu selhání se také může v čase dynamicky měnit, příkladem je přechodný vzestup LAP v těžké sepsi související se septickou kardiomyopatií. Hemodynamické monitorování s využitím echokardiografie využívá široké spektrum dostupných 2D a dopplerovských parametrů rozšířených o parametry vycházející z hrudního ultrazvuku doplňujícího monitorování interakce srdce a plic. Echokardiografie je nepochybně nejefektivnější metoda funkčního hemodynamického monitorování [3], protože umožní zobrazit a studovat srdeční struktury během fází respiračního cyklu. Vedle určitých specifických indikací k TEE (umělé chlopně, sepse s nejasným zdrojem, srdeční tromby, dárci orgánů, aortální patologie atd.) může být většina pacientů s akutním respiračním selháním na JIP dostatečně vyšetřena s pomocí TTE. Obtížně vyšetřitelných s pomocí TTE je cca 5–6 % pacientů na IPPV (18–15 % před odečtením primárních indikací k TEE) [4].
FUNKCE LEVÉ KOMORY A PLNICÍ TLAKY
Přístup ke kriticky nemocnému s respiračním selháním začíná odhadem plnicích tlaků plicních kapilár, protože při jejich vzestupu může dojít ke zvýšenému přestupu plazmatické vody přes alveolokapilární membránu a k plicnímu edému. Tato patofyziologická entita hydrostatického nebo srdečního plicního edému asociuje se zvýšenými srdečními plnicími tlaky a musí být odlišena od plicního edému s nízkými srdečními plnicími tlaky, kdy plicní edém rezultuje z přímého poškození plicnicového řečiště a alveolokapilární membrány. Odhad levokomorového end-diastolického plnicího tlaku (LVEDP) u ARDS je proto kruciální pro diferenciaci plicního edému s možným původem v srdeční patologii [5]. Navíc odhad LVEDP je důležitý pro vedení terapie respiračního selhání ve smyslu korekce preload a infuzní strategie. Absence systolického selhání levé komory nevylučuje kardiální plicní edém v souvislosti s jinými možnými etiologiemi (diastolické selhání, arytmie, mitrální a aortální vady, tekutinové přetížení). Naopak chronický kardiak může respiračně selhat při absenci zvýšených plnicích tlaků a nesmí mu být upřena substituce preload v případě diagnózy objemové responzibility. Diagnóza a následná terapie se může také dynamicky měnit u primárního nekardiálního plicního edému (ARDS) s levokomorovou diastolicko-systolickou dysfunkcí rezultující ze sepse, která je dokumentovanou součástí septického šoku. 2D zobrazení může být užito jako metoda první volby k odhadu LVEDP (tab. 1). Přítomnost špatně plněné asynchronně se kontrahující hyperkinetické levé komory s malým průměrem a enddiastolickou plochou(< 5,5 cm2/BSA) v krátké ose má vysokou specificitu pro diagnózu nízkých plnicích tlaků. Nicméně představuje pokročilou známku hypovolémie s nízkou senzitivitou. End-diastolický rozměr levé komory musí být vyhodnocen s ohledem na pohlaví a věk. Horní limit pro mladého průměrně trénovaného muže (55 mm) může představovat dilatovanou levou komoru pro starší 60kg ženu (do 43 mm) [6]. Zatímco absolutní velikost LV špatně predikuje elevované plnicí tlaky, end-systolická velikost levé síně (LA, nad 45 mm) indikuje při nepřítomnosti signifikantní mitrální vady dlouho trvající vzestup LVEDP. Levá síň by měla být rutinně vyšetřována ve dvou rovinách, tj. apikálních – čtyřkomorové a dvoukomorové, s měřením objemu LA metodou disků podobnou metodě aplikující Simpsonovo metodu pro měření objemů LV. Objem LA nad35 ml/m2 BSA indikuje chronickou elevaci LVEDP [7]. Na druhou stranu, objem LA nemůže vyloučit normální plnicí tlaky nebo hypovolémii v akutní situaci. Interatriální (IA) septum se obvykle nachází ve střední pozici s midsystolic reversal do LA. Klenutí IA septa do pravé síně (RA) během srdečního cyklu může predikovat levosíňový tlak (LAP) nad 17 mm Hg s dobrou specificitou [8].
Kolaps dolní a horní duté žíly (IVC a SVC) je 2D parametr aplikovatelný při absenci spontánní dechové activity, i. e. mandatorní IPPV. Změna průměru IVC alespoň o 14–15 % během respiračního cyklu má 94% specificitu pro pozitivní odpověď na tekutinovou výzvu, i když nikterak nekoreluje s levostrannými plnicími tlaky. Podobný vztah byl potvrzen pro kolapsibilitu SVC [9].
Dynamická obstrukce nemusí pouze postihnout pacienty po kardiochirurgickém výkonu nebo s predispozicí v hypertrofické kardiomyopatii. Kombinace hypertrofie LV, nedostatečně korigovaný preload, frekventní a špatně řízené používání inotropních látek je často nacházeno mezi pacienty v intenzivní péči a rostoucí používání echokardiografie intenzivisty naznačuje, že rezultující dynamická obstrukce LVOT spojená se systolickodiastolickým selháním je významně poddiagnostikována. Vedle hypertrofie stěny LV jsou typickými predisponujícími nálezy úhel mezi dlouhou osou LV a LVOT větší než 60°, sinusoidní komorové septum a prominující papilární sval [10].
Plnicí tlaky levé komory mohou být stanoveny i pomocí různých dopplerovských modalit (viz tab. 1). Transmitrální doppler je snadno dosažitelné měřítko plnění LV, které je ovlivněno plnicími tlaky určujícími průtok přes mitrální ústí v diastole [11]. Interpretace závisí na volémii (preload), afterloadu a diastolické funkci levé komory, tj. aktivní relaxaci a pasivním plnění, funkci mitrální chlopně a levé síně. Plnění je ovlivněno též věkem. Systolická funkce LV musí být vyhodnocena paralelně, protože transmitrální doppler koreluje s LVEDP u pacientů se sníženou systolickou funkcí LV [12], u ostatních je vyžadován komplexnější přístup rozšířený o další parametry (viz tab. 1). Důležitým parametrem odrážejícím plnění LV je tkáňový doppler (TVI) stanovený v mitrálním prstenci s preferencí laterálně pro menší vliv patologií pravé komory srdeční ve srovnání s mediální částí mitrálního anulu [13]. V případě pochybností nad kardiální etiologií respiračního selhání je možno zapojit dopplerovské vyšetření plicních žil, preferenčně pomocí TEE, nebo vzácněji pomocí TTE u pacientů na umělé plicní ventilaci (viz tab. 1) [14, 15].
1. Indikátory zvýšeného tlaku v levé síni (LA) v akutním respiračním selhání 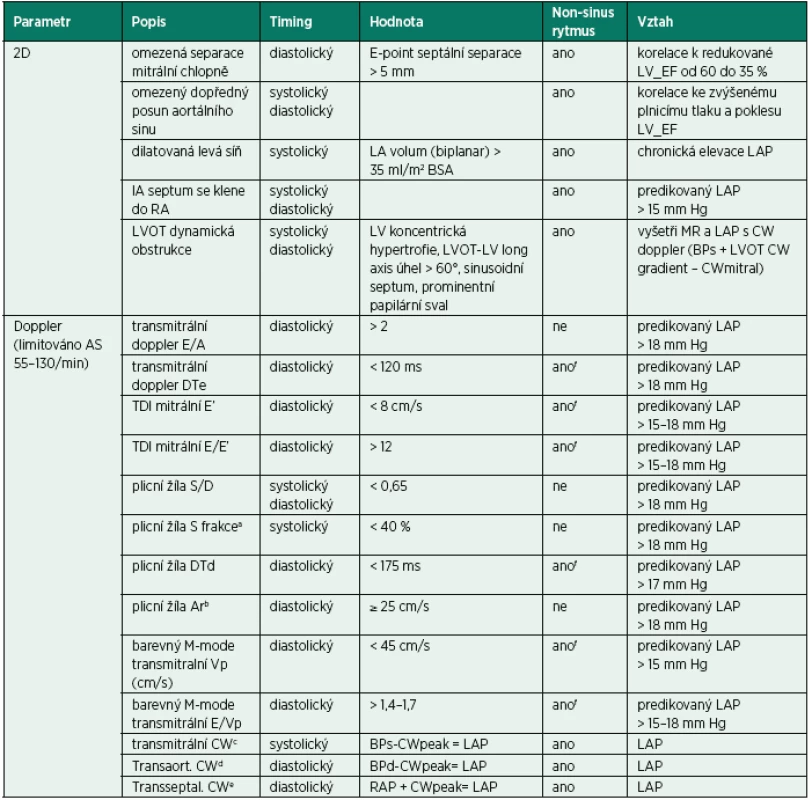
akalkulováno jako VTI syst vlny vůči VTI syst + diast vlny v % bpokud není snížená kontraktilita LA cu signifikantní mitrální regurgitace du signifikantní aortální regurgitace eu atriálního septálního defektu fu pravidelné komorové odpovědi a ppd do 10–15/min Všechna tato dopplerovská vyšetření transmitrálně a v plicních žilách mají omezenou senzitivitu a specificitu u jiného než sinusového rytmu (viz tab. 1), bradykardii pod 55/min a tachykardii nad 130/min. Například decelerační čas časného plnění LV (DTe) transmitrálně vykazuje zvýšenou specificitu u síňových arytmií s pravidelnou komorovou odpovědí a periferním pulzním deficitem do 10–15/min – ve srovnání s nepravidelnou a/nebo rychlou síňovou fibrilací, kdy prakticky nelze použít [16] (obr. 1, 2, 3). Přítomnost signifikatní chlopenní regurgitace nabízí šanci použít metodu měření špičkového gradientu pomocí kontinuálního dopplera v systole – v případě mitrální regurgitace (MR) – a v diastole v případě aortální regurgitace (AR). Tlak v levé síni je přibližně roven výsledku odečtu gradientu na MR od systolického tlaku v LV (= systolický systémový tlak při absenci aortální stenózy) – viz tabulka 1. Podobně je enddiastolický tlak v LV a tlak v LA dosažitelný odečtem end-diastolického gradientu od systémového diastolického tlaku u pacienta s významným AR (viz tab. 1, obr. 4). V případě defektu septa síní se zkratem je možné stanovit gradient pomocí kontinuálního dopplera a přičíst ho ke známému tlaku v pravé síni (= CVP), a získat tak tlak v LA.
1. Transmitrální doppler u pacienta s AF a periferním pulzním deficitem do 10/min, komorovou odpovědí 70/min 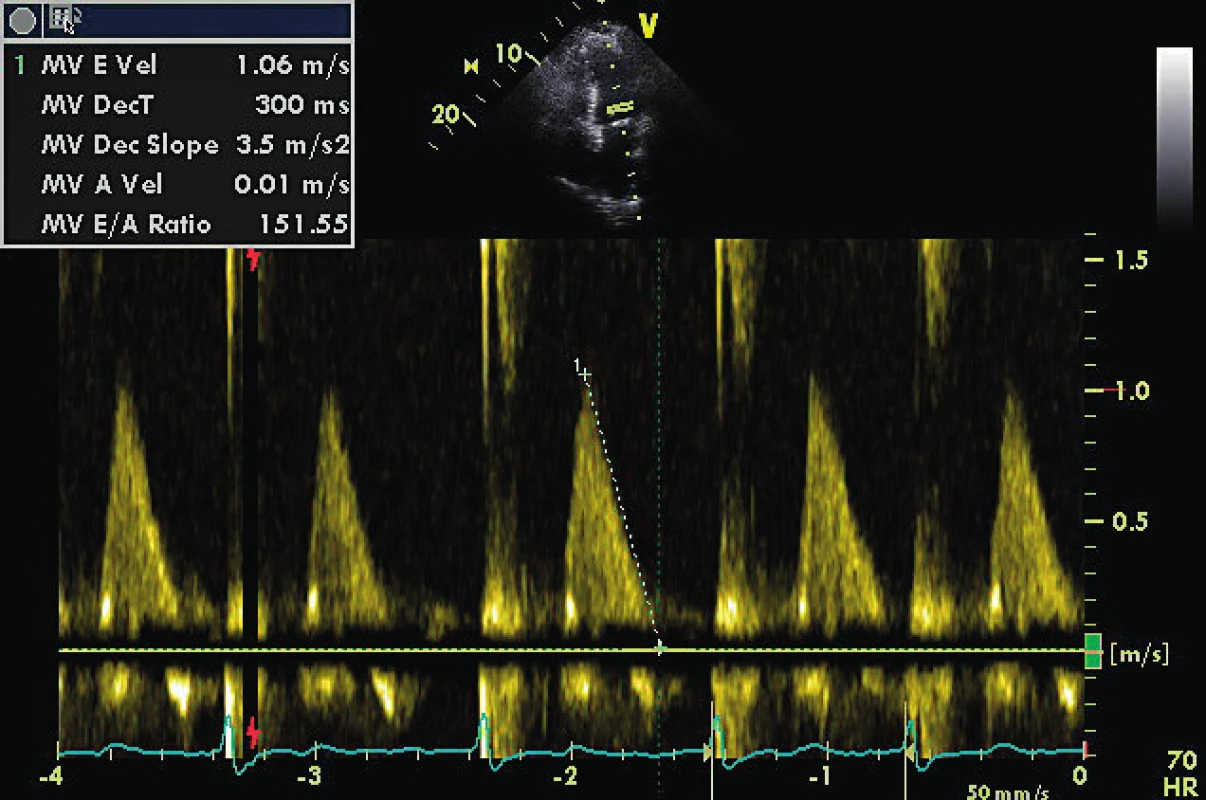
DTe 300 ms odpovídá nezvýšenému LVEDP (viz obr. 2) 2. TVI laterálního mitrálního prstence u pacienta z obrázku 1 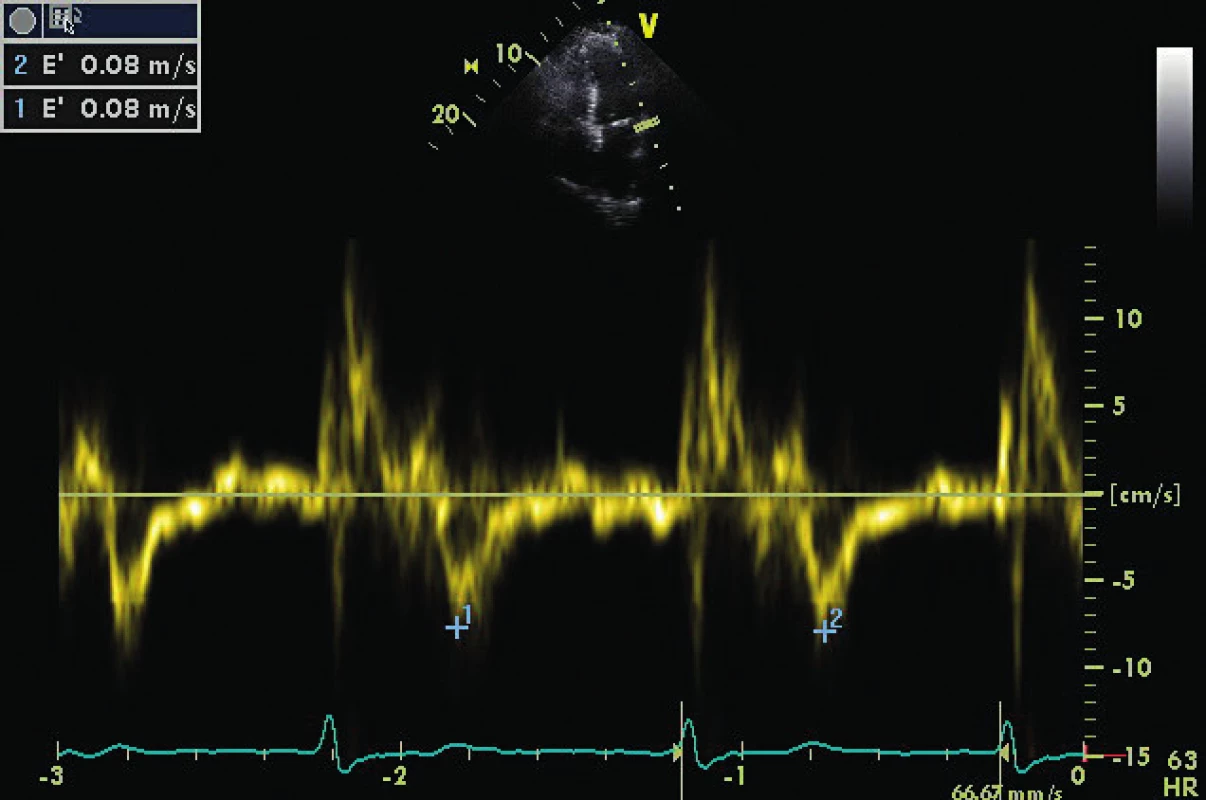
E/E´ je 12,5, což implikuje preload na horní hranici normálu. Stav vyžaduje dodatečná vyšetření v rámci echoprotokolu. 3. Stejný pacient z obrázku 2 a obrázku 1 
A4C ukazuje těžce dilatovanou levou síň v souvislosti s chronickou diastolickou dysfunkcí a chronickou fibrilací síní. 4. CW doppler v A5C u pacienta s těžkou AR (viz PHT 246 ms) 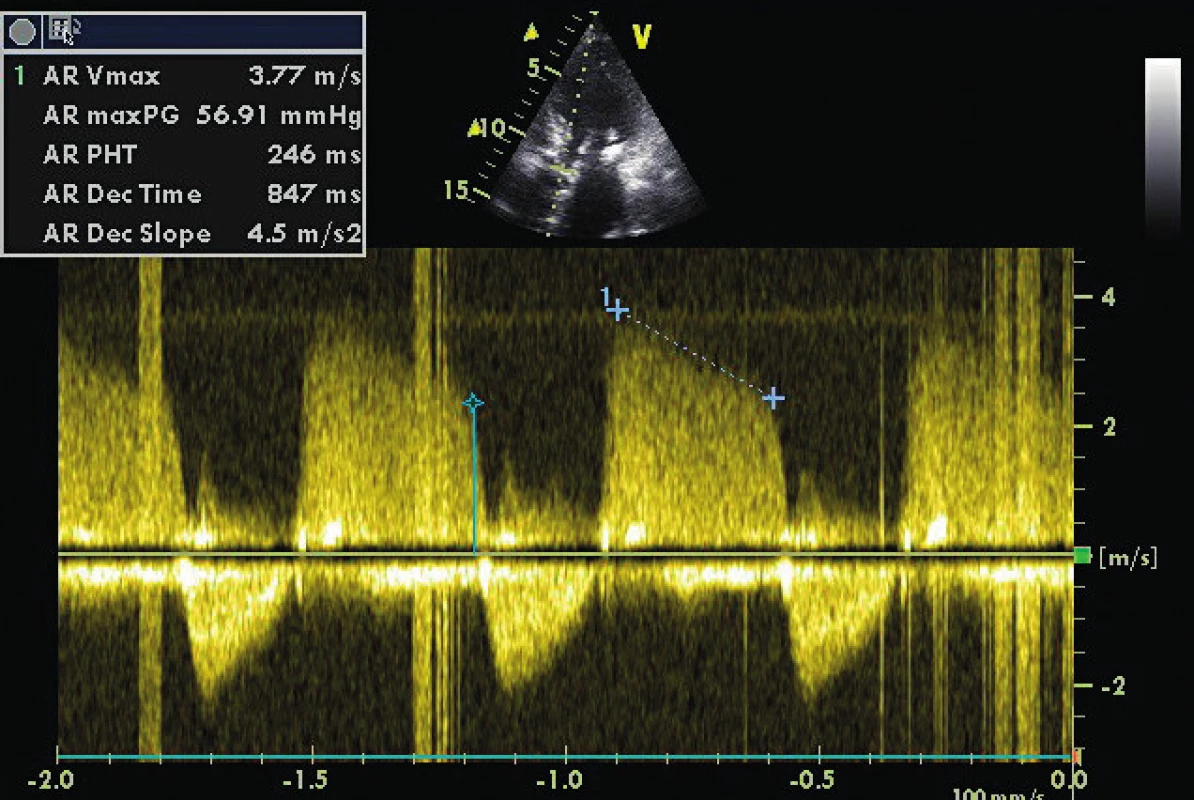
Modrá linie a křížek ukazují enddiastolický gradient 25 mm Hg u pacienta intubovaného v akutní respirační insufficienci a IBP 95/55 mm Hg. Odhadovaný LVEDP je 55–25 mm Hg = 30 mm Hg. Plnicí tlaky LV mohou být optimalizovány také se znalostí interakcí srdce-plíce a měřením tepového objemu (SV). SV může být stanoven buď ve výtokovém traktu LV, nebo RV. Respirační variace o více než 15 % predikuje odpověď na tekutinovou výzvu, ale neurčuje plnicí tlaky. Závadějící může být falešný dojem normálních až nízkých plnicích tlaků u tzv. d-Up efektu během inspiria s pozitivním přetlakem u pacientů se systolicko-diastolickým srdečním selháním. Tento tzv. reverzní pulsus paradoxus [17] by měl být vyloučen pomocí echokardiografie jako falešný indikátor k podání objemu, protože může zhoršit výměnu plynů v plicích a plicní městnání.
FUNKCE PRAVÉ KOMORY, VYŠETŘENÍ PRELOAD A AFTERLOAD RV
Různé plicní patologie vyúsťují v poškození alveolokapilárního řečiště. Plicní konsolidace, atelektázy nebo destrukce ve formě emfyzému vedou ke vzestupu intrakapilárního tlaku a plicní vaskulární hypertenzi (PH). PH může být akcelerována hypoxií a hyperkapnií. S progresí symptomů a zavedením ventilace pozitivním přetlakem (IPPV) se zvyšuje riziko dalšího zhoršení PH a zvýšení afterload RV. Prognóza ARDS pacientů na IPPV je v přímém vztahu k ejekční frakci RV (EF_RV), proto má klíčový význam výběr a správné nastavení režimu IPPV, které může být usnadněno echokardiografií [9, 18]. U predisponovaných pacientů může kombinace plicní patologie společně s IPPV přetížit funkční rezervu plicní cirkulace a vést ke známkám akutního cor pulmonale. Současná doporučení pro terapii ARDS pracují s omezením Vt pod 6 ml/kg a Pplat pod 30 mbar, vyvarování se dynamické hyperinflace, hyperkapnie a hypoxie [19]. U ostatních patologií, jako je např. COPD, existují podobná doporučení: omezit Pplat pod 27–30 mbar a vyvarovat se airtrapping.
Funkce pravého srdce by neměla být posuzována izolovaně, ale v rámci komplexního echoprotokolu (obr. 5). Známky alterace RV mohou být způsobeny také selháním LV. Klinické známky kongestivního srdečního selhání nebo hypervolémie vyžadují od lékaře pečujícího o pacienta v respiračním selhání vyšetření levostranných plnicích tlaků (viz obr. 5).
5. Flowchart echokardiographického vyšetření u akutní respirační nedostatečnosti 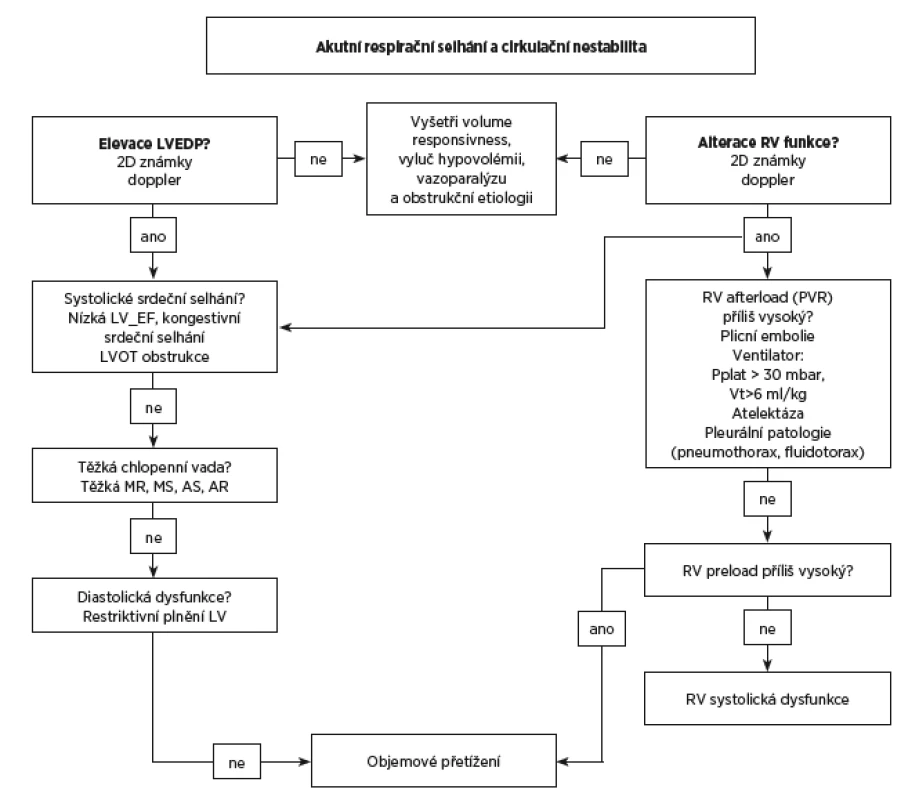
6. Závažně dilatovaná RV s diastolickým paradoxním pohybem septa do LV 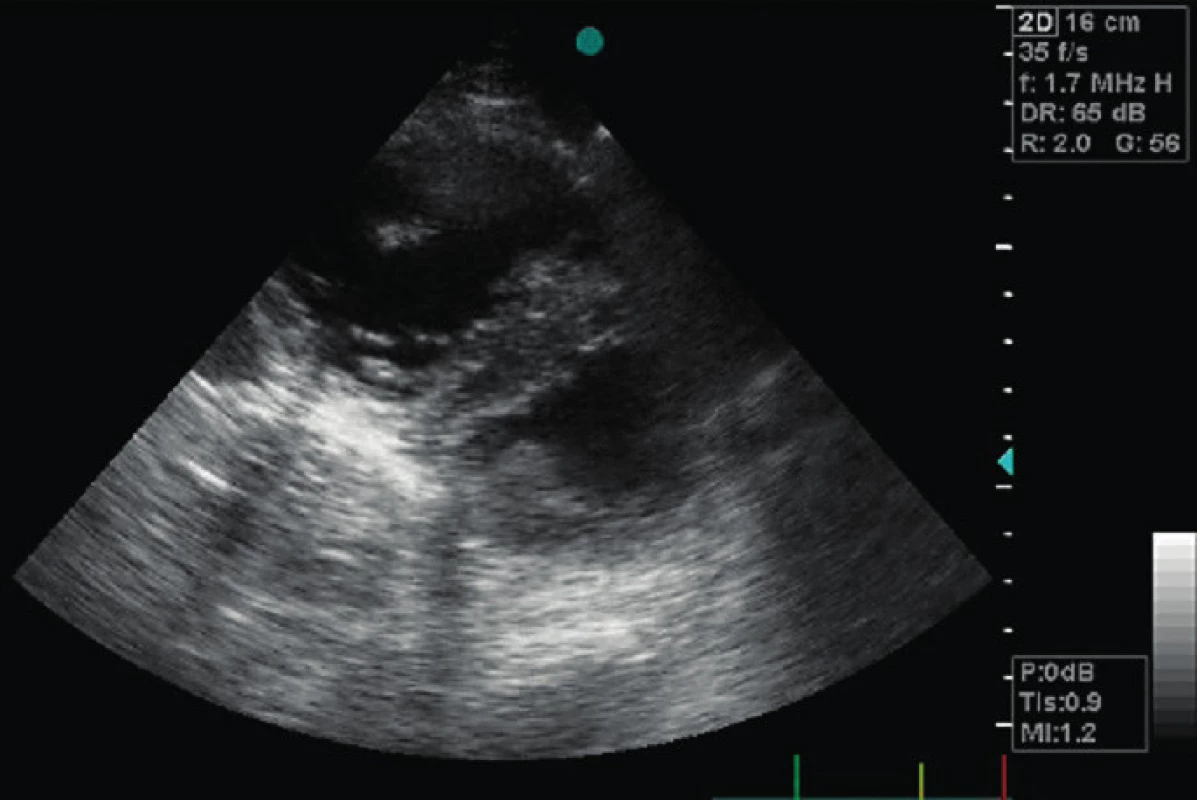
Má v PSAX tvar písmene D (“D shape LV”). 2D známky dysfunkce RV zahrnují velikost RV, frační změna plochy RV ve vztahu ke kontraktilitě volné stěny RV (FAC) a systolický posun trikuspidálního anulu (TAPSE) s limitacemi u pacientů po kardiochirurgickém výkonu [6, 20]. Mezikomorové septum se normálně pohybuje podle plnění LV, tj. směrem do RV v diastole. Nález enddiastolického paradoxního pohybu septa do LV je diagnostický pro objemové přetížení RV a akutní cor pulmonale (obr. 6). Přítomnost akutního cor pulmonale, tj. těžké dilatace RV plus paradoxního pohybu komorového septa zhoršuje prognózu pacienta, a to zvláště na IPPV (viz tab. 2). Fixovaná pozice interventrikulárního septa do LV , tj. „permanentní D shape“ LV je typická pro tlakově-objemové přetížení RV. U chronického přetížení dochází navíc k hypertrofii RV. 2D známky chronické pravostranné srdeční dysfunkce jsou rozšíření pravé síně (RA nad 22 mm/m2 BSA, objem nad 25ml/m2 BSA), síňové septum se klene do LA, plicnice je dilatovaná a je přítomna hypertrofie volné stěny RV. Tyto parametry mohou být přítomny bez ohledu na nastavení IPPV [6].
2. Indikátory pravokomorové dysfunkce u akutního respiračního selhání 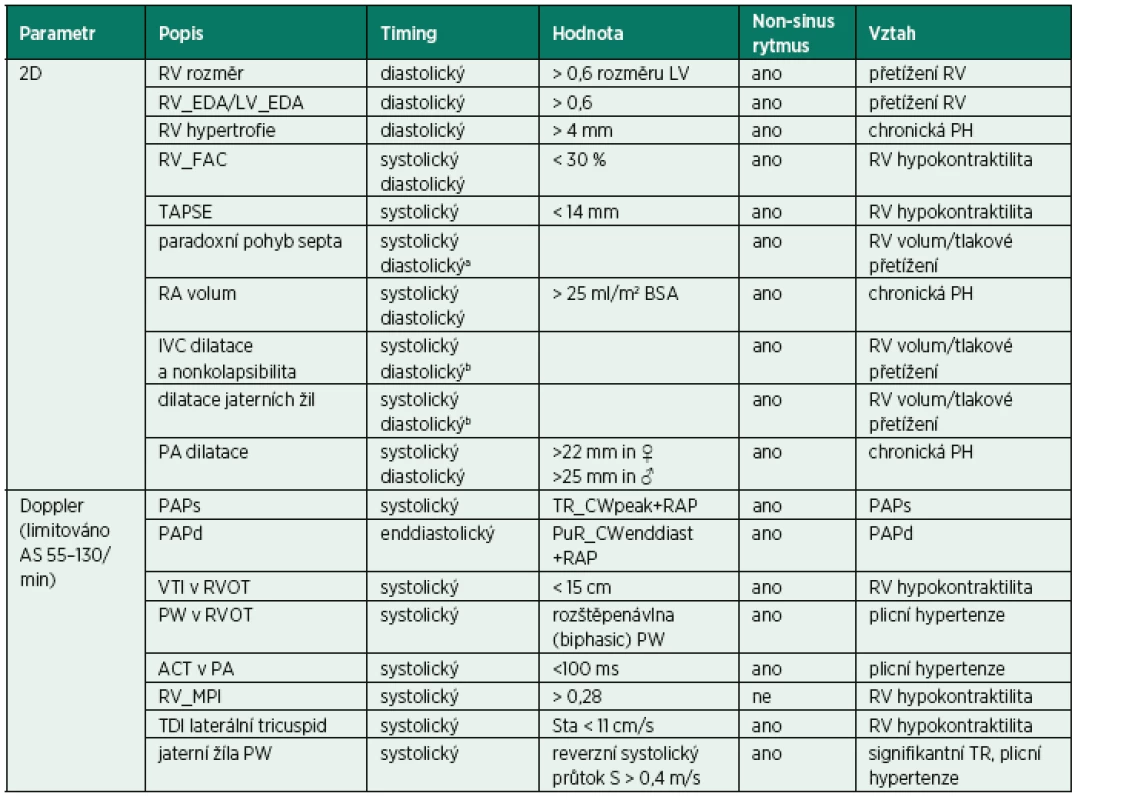
aenddiastolický u akutního RV přetížení, bbez ohledu na ventilační modalitu 2D vyšetření vtokového traktu pravé komory u pacientů v respiračním selhání zahrnuje IA septum, velikost RA, SVC/IVC a jaterní žíly [20]. IA septum normálně mění pozici mezi RA a LA během srdečního cyklu. Klene se permanentně do RA u zvýšeného tlaku v LA [8]. Naopak může být natlačeno do LA u akutního cor pulmonale nebo u chronických vzestupů pravostranných tlaků a objemů. Interatriální septum vyžaduje pečlivé vyšetření s použitím barevného dopplera a kontrastu, a to zvláště u pacientů s nejasnou hypoxií, kde je nutno vyloučit přítomnost pravolevého zkratu popisovaného zvláště u ventilovaných pacientů s ARDS [21]. Průměr a kolapsibilita velké žíly (IVC/SVC) mohou pomoci odhadnout tlaky v RA a eventuální odpověď na tekutinovou výzvu u mandatorního režimu IPPV. V kontrastu k tomu je absence kolapsibility u jakéhokoliv režimu ventilace včetně spontánního, která při vyloučení tamponády indikuje elevované pravostranné plnicí tlaky při tekutinovém přetížení, primárním selhání RV nebo kriticky zvýšeném afterload RV, jako například u agresivního režimu IPPV nebo plicní embolii (s přítomností akutního cor pulmonale). Nález dilatovaných jaterních žil dále podporuje diagnózu objemového/tlakového přetížení u případů obtížné vyšetřitelnosti IVC, jako např. po sternotomii nebo horní střední laparotomii.
Funkce pravého srdce může být dále vyšetřena s pomocí spektra dopplerovských parametrů. Prevalence trikuspidální regurgitace je nad 90 % uměle ventilovaných pacientů, což umožňuje měřit gradient mezi RV a RA s pomocí kontinuálního dopplera. Přidáme-li tento gradient k tlaku v RA (tj. CVP) získáme s přijatelnou přesností úroveň systolického tlaku v plicnici, který představuje RV afterload u pacientů s respiračním selháním. Vyšetření plicnicové chlopně v PSAX umožňuje vyšetření plicnicové regurgitace kontinuálním dopplerem. Enddiastolický gradient může být přičten ke známému tlaku v RA (CVP) a tím získáme odhad diastolického tlaku v plicnici, nicméně s menší přesností, než je měření systolického tlaku v plicnici popsané výše. Tlak v plicnici musí být vyhodnocen ve vztahu k systolické funkci RV a parametrům vtokového traktu RV. Plicní hypertenze (PH) může být vztažena ke zvýšenému afterload u plicní konsolidace a IPPV, zvláště u agresivního ventilačního režimu [19]. Mírná nebo žádná PH může být zapříčiněna respiračním selháním a současným výpadkem RV kontraktility s elevací CVP. Tento přístup může vést lékaře k hledání udržitelné ventilační modality, evakuaci významných pleurálních výpotků, polohování pacienta včetně semipronační a pronační polohy, indikaci k plicnicovým vazodilatátorům nebo ke zvážení částečné nebo totální mimotělní podpory cirkulace/respirace u akutního cor pulmonale a pravostranného selhání (ECCO2R nebo ECLS) [22]. Vhodný dopplerovský indikátor systolické funkce RV je tkáňový doppler laterálního trikuspidálního prstence. Pokles z normálu (14–15 cm/s) by měl být doplněn dalšími vyšetřeními k vyloučení ∆down efektu, tj. poklesu SV během inspiria IPPV jako falešného indikátoru k volumexpanzi [23].
Dopplerovské vyšetření RV inflow zahrnuje zvláště barevný a pulzní doppler v suprahepatických žilách. Signifikantní trikuspidální regurgitace se přenáší jako systolický reversal na barevném doppleru s doprovodnou systolickou reverzní vlnou na pulzním doppleru větší než 0,3–0,4 m/s. Tento nález podporuje diagnózu pravostranného tlakově/objemového přetížení, zvláště u pacientů na IPPV (obr. 7, 8).
7. PW doppler na dilatovaných jaterních žilách u pacienta na IPPV 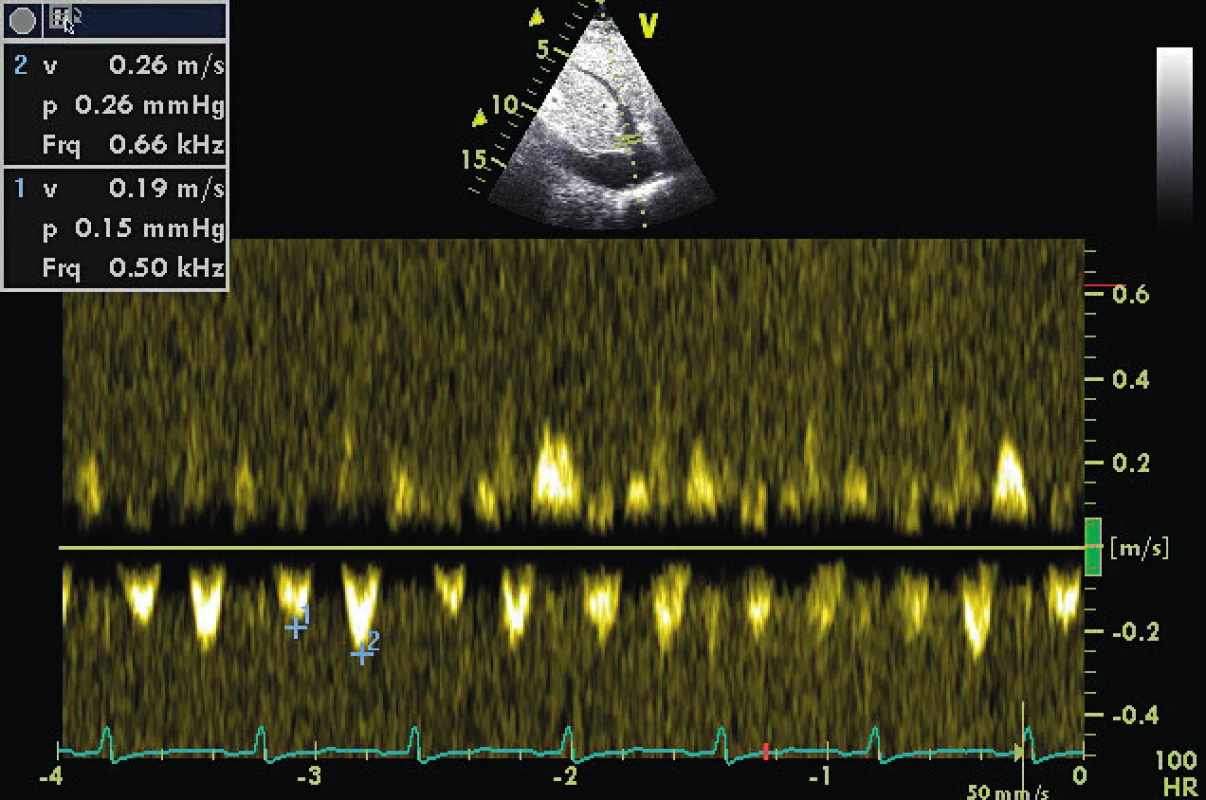
Průtoky neukazují významnou trikuspidálníá regurgitaci nebo selhání RV, viz také obrázek 8. 8. PW doppler na dilatovaných jaterních žilách u jiného pacienta na IPPV 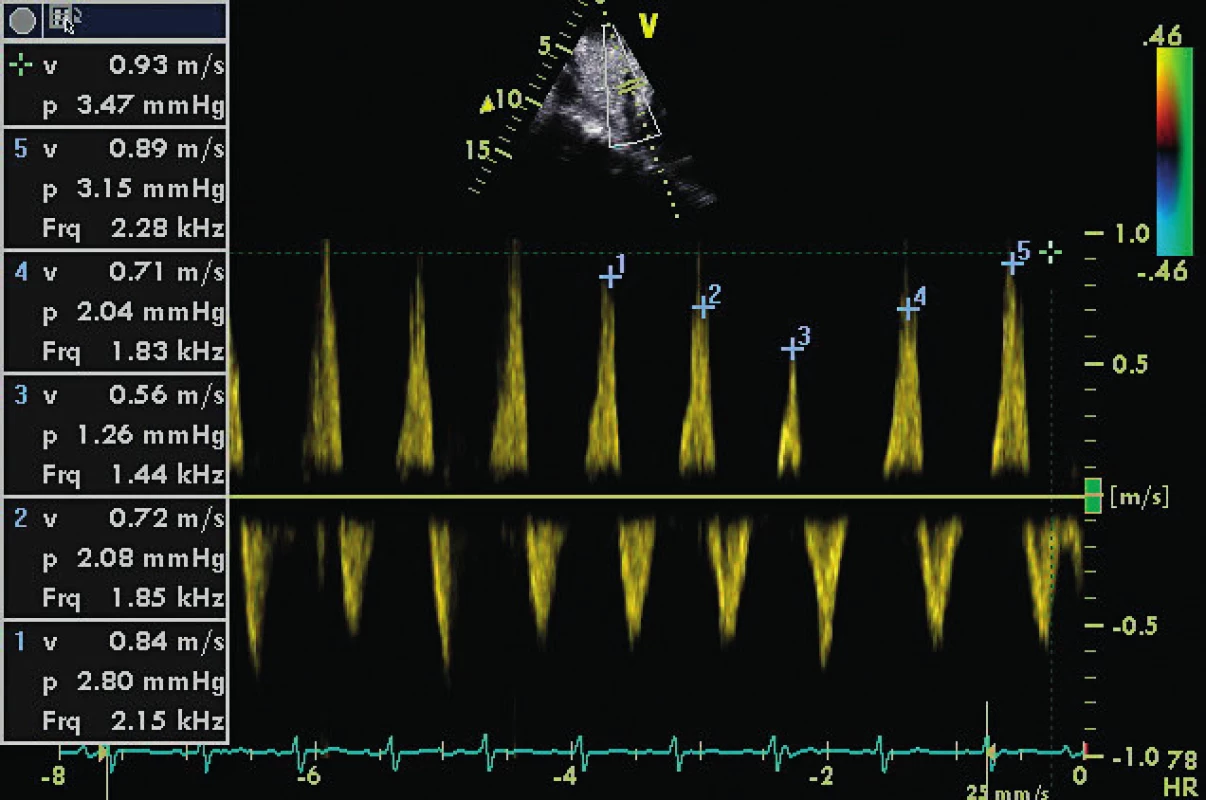
Je přítomen signifikantní reverzní průtok v systole (0,5–0,9 m/s) a reversal je méně výrazný v inspiriu na PSV (pressure support ventilation). Echokardiografie a ultrazvuk u lůžka pomahá s volbou polohy pacienta včetně pronační polohy, indikací k bronchoskopii a může pomoci i s indikací či kontraindikací plicního recruitment manévru. Pronační poloha umožňuje dorzální plicní recruitment, snižuje plicní hypertenzi, afterload pravé komory a má příznivý dopad na funkci pravé komory, dávky vazoaktivních látek a hemodynamickou stabilitu [24]. Pravokomorová dysfunkce je jedna z indikací k pronační poloze. Echokardiografie je velmi přínosná v diagnostice volumového přetížení a dilatace RV. Bezpečnostní limit pro nálož tekutin u fragilní RV není jasně stanoven a i těžce dilatovanou RV je možno opatrně zatížit infuzní léčbou při hypovolémii levé komory s tou podmínkou, že je tekutina přisunována pomalu a kontinuálně a není přítomen paradoxní pohyb komorového septa [25]. Echokardiografie je zásadní modalita pro indikaci a monitorování efektů plicnicových vazodilatátorů, jako je kysličník dusnatý nebo prostacyklin. Tyto látky mají efekt jak na výměnu plynů v plicích, tak i na hemodynamiku a tlaky v plicnici monitorované echokardiograficky. Komplexní přístup integrující echokardiografii a hrudní ultrazvuk v managementu respiračního selhání může dále pomoci snížit mortalitu ventilovaných pacientů s dysfunkcí pravé komory srdeční [19].
HRUDNÍ ULTRASONOGRAFIE JAKO SOUČÁST ECHOKARDIOGRAFIE U RESPIRAČNÍHO SELHÁNÍ
Plicní patologie u pacientů s akutním respiračním selháním mohou být vyšetřovány hrudní sonografií jako nejsnáze dostupnou zobrazovací metodou u lůžka pacienta. Koncept kombinace echokardiografie se základní nebo rozšířenou hrudní sonografií logicky vychází z funkčního propojení mezi plicními a srdečními patologiemi. Hrudní ultrazvuk může pomoci s volbou nejlepší terapeutické strategie.
Hrudní ultrazvukové parametry důležité pro hemodynamické vyšetření zahrnují pleurální patologie a plicní intersticiální syndromy. Pacienti na intenzivní péči mají vysokou prevalenci pleurální tekutiny, která je především ve vztahu k tlaku v plicnici a k trvání srdeční dekompenzace u pacientů se srdečním selháním. Kvantifikace a kvalitativní vyšetření s pomocí ultrazvuku je zásadní pro rozhodnutí o drenáži. Jednoduché měření maximální separace (Sep) pleurálních listů (mm) u supinního pacienta s mírnou elevací trupu (15 °) v transverzální rovině a její násobení 20 je přibližně rovno objemu pleurální tekutiny v ml (Sep (mm) krát 20 = ml). Se standardní odchylkou 150 ml získá lékař touto rychlou vyšetřovací metodou u lůžka pacienta informaci o objemu v přibližných krocích 0-250-500-750-1000 ml (obr. 9) [26]. Kvantitativně závažné množství pleurální tekutiny začíná na 350–400 ml, tj. separace pleurálních listů 17–20 mm a vyšší. Použití ultrazvuku pro drenáž je standardním postupem, zvláště u ventilovaných pacientů. Pneumothorax je emergentní situace a musí být agresivně léčen zvláště u pacientů na ventilaci pozitivním přetlakem. Může zvýšit afterload pravé komory, přidat obstruktivní komponentu k hemodynamické nestabilitě s další alterací stavu v souvislosti se změnami krevních plynů (hyperkapnie, hypoxie). Hrudní ultrazvuk s vysokou specificitou lung point (obr. 10) významně pomahá v diagnostice i drenáži [27]).
9. Hrudní ultrazvuk ukazující levostranný pleurální výpotek separující pleurální listy na 17 mm v transverzální rovině 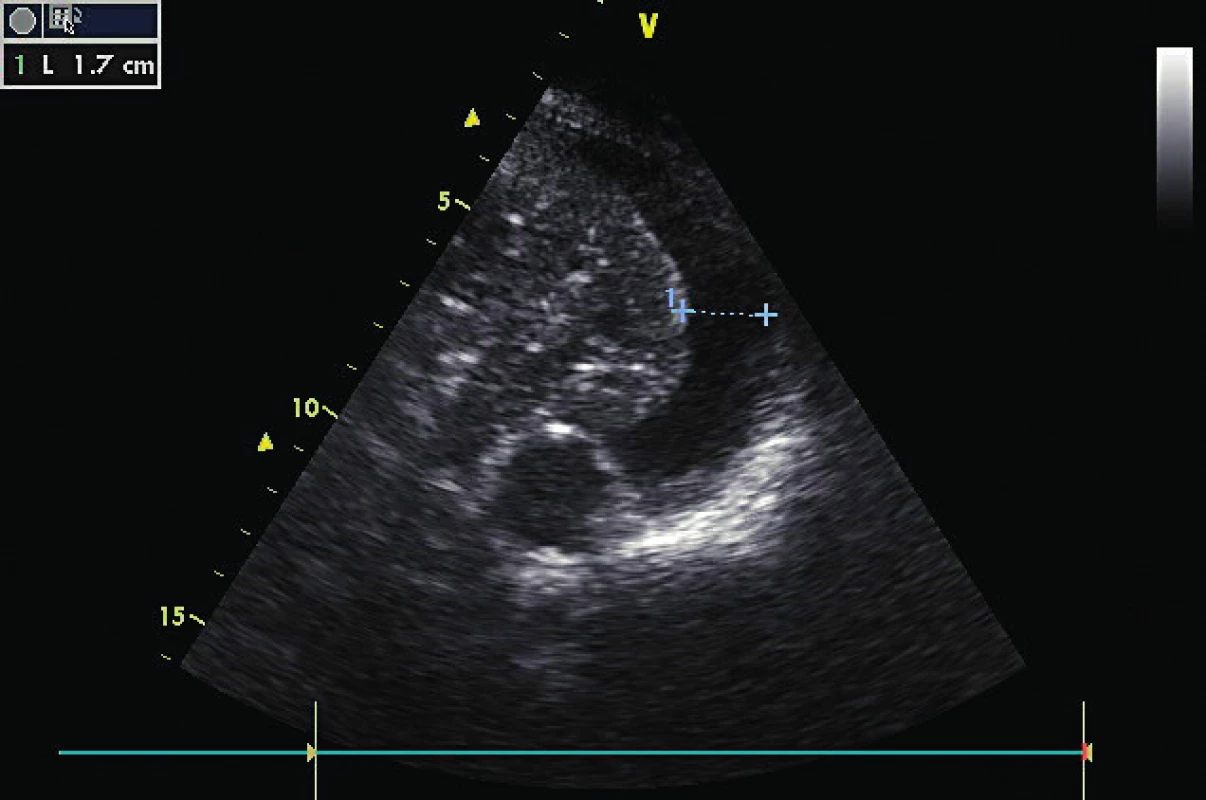
Odhadovaný objem je 340 ml (= 17 x 20). 10. Lung point v přední axilární čáře potvrzující diagnózu okultního ventrálního pneumotoraxu 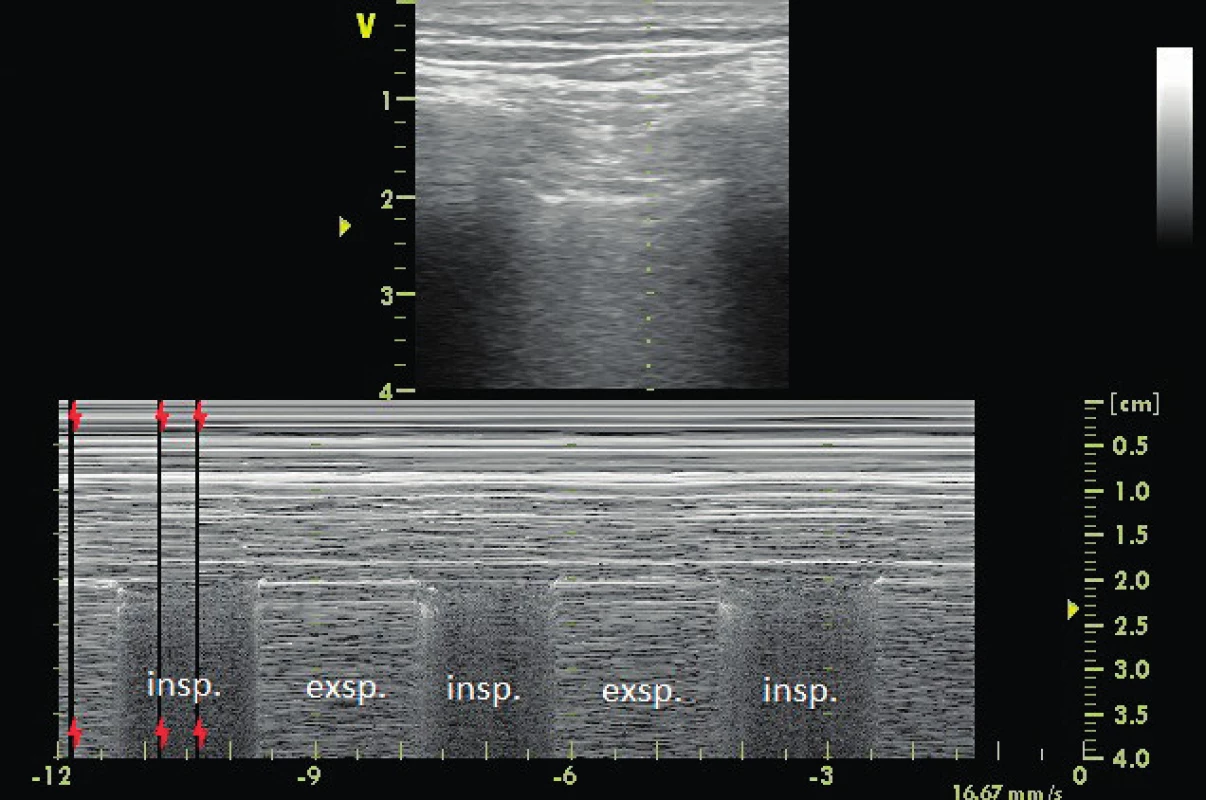
Pneumotorax je patrný v exspiriu. Ultrasonografie je citlivá k změnám poměru vzduch-voda v plicích, což má praktický význam pro diagnostiku řady plicních onemocnění a vyšetření extravaskulární plicní vody. Nevýhodou je neschopnost zobrazit hluboké plicní patologie, ultrazvuk zobrazuje jen interakci povrchních struktur orgánu s ultrazvukem. Interpretace B-linií je velmi jednoduchá jako ztráta vzdušnosti a zvýšení objemu extravaskulární plicní vody [28], ztrácí však specificitu při diferenciaci mezi specifickými plicními syndromy, jako jsou např. ARDS a kardiální plicní edém. Tyto případy vyžadují komplexní echokardiografické vyšetření.
Obráceně, hrudní sonografie může take přispět k hemodynamickému managementu kriticky nemocných určením plicní tolerance k náloži tekutin. Nemůže však určit objemovou responzibilitu, což je nejdůležitější parametr pro určení vhodnosti nálože tekutin. Převažující A linie, tj. izolované nebo mnohočetné reverberace pleurální linie ve středních nebo bazálních plicních segmentech, indikují s přijatelnou specificitou plnicí tlak levého srdce nižší než 18 mm Hg. Zmnožené B linie jako známka akumulace tekutiny v plicním intersticiálním prostoru středních a horních plicních segmentů indikují levostranné plnicí tlaky nad 13 mm Hg [29]. Specificita mezi 13 a 18 mm Hg je nedostatečná a potvrzuje nutnost kombinovat hrudní sono s echokardiografií.
Stupňování intersticiálního syndromu ve stupních A linie (I), zmnožené B4–7 linie (II), zmnožené B2–3 linie (III) a konsolidace (IV) se splývajícím parenchymem na ultrasonografickém vyšetření může být užito k odhadu nikoliv pouze stupně hydratace nebo zánětlivé konsolidaceale také k odhadu odpovědi na IPPV a polohu pacienta [30]. Cílem terapie je eliminace závažnějších stupňů intersticiálního syndromu s udržením nebo zlepšením hemodynamické stability. Monitorování plicního recruitmentu je omezeno při odeznění intersticiálního syndromu, protože ultrazvuk nemůže odlišit normálně vzdušnou plíci od over-inflace při excesivním IPPV. Obraz normálního alveolárního obsahu vzduchu a alveolární distenze mají identický ultrazvukový obraz.
Základní podmínkou v aplikaci ventilace pozitivním přetlakem pro recruitment plicního parenchymu je odlišit signifikantní pleurální tekutinu s indikací k drenáži a vyloučit atelektázu s absencí dynamického bronchogramu [31]. Hrudní ultrazvuk má dostatečnou specificitu k indikaci fibreoptické bronchoskopie pro eliminaci atelektáz a zajištění otevřeného bronchiálního stromu, což je obvykle podpořeno i jinými klinickými příznaky.
Snaha o recruitment vitální kapacity pomocí agresivní IPPV nemá místo u grade IV, tj. plicní konsolidace, a to zvláště u postižení bazálních a dorzálních plicních segmentů [29]. Toto vyšetření má potom preventivní efekt – kontraindikací recruitment manévru nedojde k zbytečnému vzestupu RV afterload a diastolickému selhání LV s poklesem SV a srdečního výdeje [32, 33]. U vyšších stupňů plicního intersticiálního syndromu (III–IV) je nastavení IPPV adjustováno pomocí hrudního ultrazvuku. Ideálně, pacienti jsou polohováni a ventilováni s monitorováním plicního parechymu v supinní, semipronační a pronační poloze [34]. Kombinovaný přístup s echokardiografií a hrudním ultrazvukem je zvláště přínosný u těžkého respiračního selhání s preexistující plicní hypertenzí a omezenou výkonností pravé komory srdeční. Vyvarování se agresivní IPPV společně s pečlivou titrací preload, polohováním pacienta spojeným s časnou pronací, a eventuální nasazení plicnicových vazodilatátorů může být život zachraňující. Tento přístup může také pomoci indikovat ECLS u těžkého respiračního selhání a přesun na pulmoprotektivní formu IPPV, což většinou asociuje se zlepšením oběhové stability.
Odvykání od IPPV je usnadněno echokardiografií a plicním ultrazvukem u lůžka pacienta. Pokles intermitentního pozitivního tlakuv hrudníku modifikuje LV preload a zvyšuje LV afterload, což může vést k selhání odvykání u kompromitované LV. Proto zajištění LVEDP na normální nebo nižší úrovni má opodstatnění před extubací/odpojením IPPV. Echokardiografie společně se stanovením stupně plicní hydratace ultrazvukem jsou v odvykání IPPV velmi efektivní metody překonávající podle většiny literatury biomarkery jako jsou natriuretické peptidy [35, 36].
RESPIRAČNÍ SELHÁNÍ A EXTRAKORPORÁLNÍ METODY (ECLS)
Rychlé echokardiografické vyšetření těžkého respiračního selhání pomahá rozhodnout o indikaci k mimotělní život zachraňující podpoře (ECLS). Vedle těžké hypoxie (tj. paO2/FiO2 < 100), retence CO2 , a přítomnosti barotraumatu vede často některá z forem hemodynamické nestability k indikaci ECLS. Před indikací exkluzivní podpory funkce plic a kanylací veno-venózního ECMO je nutno vyloučit souběžné srdeční selhání [37]. Primární virové ARDS může být doprovázeno virovou replikací v srdečním svalu a selháním levé komory srdeční. Podobně bakteriální pneumonie a primární ARDS může postihnout srdce ve formě septické kardiomyopatie a hypodynamického septického šoku [38]. Tyto dva scénáře musí být odlišeny velmi urgentně a směřovat intenzivistu k arterio-venóznímu nebo veno-arterio-venóznímu ECMO, tj. náhradě nikoliv pouze plic, ale i srdce. Při absenci levostranného selhání musí být vyloučeno selhání pravého srdce. Agresivní režim ventilace u ARDS často vede k středně závažné plicní hypertenzi s dysfunkcí RV, která se obvykle upravuje se započetím VV-ECMO a zavedením plíce a srdce šetřícího režimu IPPV. Nicméně, je zde početná skupina pacientů s primární dysfunkcí RV, kteří mohou na IPPV rozvinout při kritickém vzestupu afterload obraz akutního cor pulmonale. Echokardiografie zde hraje klíčovou roli v rozhodnutí se pro VA nebo VAV-ECMO spíše než pro čistě plicní podpory ve formě VV-ECMO [22].
TTE může indikovat režim ECLS a ultrazvuk může být využíván ke kanylaci ECLS. Kanylace se sono kontrolou je mandatorní pro arteriální kanylaci pro IBP u pacienta na VA-ECMO bez pulzatilního flow a také pro prográdní kanylaci superficiální femorální arterie zajišťující perfuzi nohy distálně od arteriální návratové ECMO kanyly. Echokardiografie je mandatorní pro polohování dual lumen kanyly pro VV-ECMO zavedené přes vnitřní jugulární žílu. Její distální konec musí být bezpečně v IVC, zatímco návratové ústí musí být směrováno na trikuspidální chlopeň. Při duální kanylaci VV-ECMO je TTE mandatorní pro zajištění konce nasávací kanyly v IVC na úrovni suprahepatických žil [37].
Echokardiografické monitorování plnicích tlaků LV a funkce pravého srdce v kombinaci s hrudní ultrasonografií usnadňuje odvykání ECLS. Denní UZ vyšetřování hrudníku nejen ovlivňuje odvykání ECMO, ale i nastavení IPPV, pleurální drenáž, indikaci k bronchoskopii a polohu pacienta během terapie.
SHRNUTÍ
Základní otázky na echokardiografické vyšetření, které je potřeba zodpovědět v rutinní péči o kriticky nemocného pacienta s akutním respiračním selháním jsou:
- Jaký je LVEDP a LAP? Mohou být symptomy ovlivněny a stav pacienta zlepšen úpravou preload, kontraktility, afterload nebo srdeční frekvence/rytmu?
- V případě primárního srdečního selhání lze symtomy ovlivnit zavedením ventilace pozitivním přetlakem a jejím nastavením?
- Jaká je funkce RV/RA a jejich funkční rezerva tolerovat IPPV?
- Je plíce rekrutovatelná? Jak nastavit ventilator s pomocí echokardiografie a plicní sonografie?
- Jaká je optimální poloha pacienta? Může pacientovi pomoci pleurální drenáž? Je indikována fibreoptická bronchoskopie?
- Je pacient indikován k ECLS? Jaký typ ECLS je indikován a jaká je v konkrétním případě optimální kanylace? Jaká je optimální modalita a nastavení IPPV během ECLS?
Poděkování:
Echokardiografický monitoring pacientů byl umožněn díky grantové podpoře EU z projektu reg. No. CZ.2.16/3.1.00/21565 OP Prague Competitiveness.
Autor prohlašuje, že nemá střet zájmů.
Práce nebyla publikována ani není odeslána k recenznímu řízení v jiném časopise.
Do redakce došlo dne 2. 9. 2016.
Do tisku přijato dne 15. 9. 2016.
Adresa pro korespondenci:
doc. MUDr. Martin Balík, Ph.D., E.D.I.C.
Klinika anesteziologie, resuscitace a intenzivní medicíny, 1. LF UK a VFN
U Nemocnice 2
128 08 Praha 2
email: martin.balik@vfn.cz
Sources
1. Brun-Buisson, C., Minelli, C., Bertolini, G. et al. Epidemiology and outcome of acute lung injury in European intensive care units. Results from the ALIVE study. Intensive Care Med., 2004, 30, p. 51–61.
2. Gajic, O., Afessa, B., Thompson, B. T. et al. for the 2nd International Study of Mechanical Ventilation and ARDS-net Investigators. Prediction of death and prolonged mechanical ventilation in acute lung injury. Crit Care, 2007, 11, p. R53.
3. Pinsky, M. R., Payen, D. Functional hemodynamic monitoring. Crit Care, 2005, 9, p. 566–572.
4. Orme, R. M., Oram, M. P., McKinstry, C. E. Impact of echocardiography on patient management in the intensive care unit: an audit of district general hospital practice. Br. J. Anaesth., 2009, 102, p. 340–344.
5. ARDS Definition Task Force, Ranieri, V. M., Rubenfeld, G. D., Thompson, B. T., Ferguson, N. D., Caldwell, E., Fan, E., Camporota, L., Slutsky, A. S. Acute respiratory distress syndrome: the Berlin Definition. JAMA, 2012, 307, 23, p. 2526–2533.
6. Lang, R. M., Badano, L. P., Mor-Avi, V. et al. Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. European Heart Journal – Cardiovascular Imaging, 2015, 16, p. 233–271.
7. Nagueh, S. F., Appleton, C. P., Gillebert, T. C., Marino, P. N., Oh, J. K., Smiseth, O. A., Waggoner, A. D., Flachskampf, F. A., Pellikka, P. A., Evangelisa, A. Recommendations for the evaluation of left ventricular diastolic function by echocardiography. Eur. J. Echocardiogr., 2009, 10, p. 165–193.
8. Haji, D. L., Ali, M. M., Royse, A., Canty, D. J., Clarke, S., Royse, C. F. Interatrial septum motion but not Doppler assessment predicts elevated pulmonary capillary wedge pressure in patients undergoing cardiac surgery. Anesthesiology, 2014, 121, p. 719–729.
9. Vieillard-Baron, A., Chergui, K., Augarde, R., Prin, S., Page, B., Beauchet, A. et al. Cyclic changes in arterial pulse during respiratory support revisited by Doppler echocardiography. Am. J. Respir. Crit. Care Med., 2003, 168, p. 671–676.
10. Cha, J. J., Chung, H., Yoon, Y. W. et al. Diverse geometric changes related to dynamic left ventricular outflow tract obstruction without overt hypetrophic cardiomyopathy. J. Cardiovasc. Ultrasound, 2014, 12, p. 23.
11. Boussugues, A., Blanc, P., Molenat, F., Burnet, F., Burnet, H., Habib, G., Sainty, J. M. Evaluation of left ventricular filling pressure by transthoracic Doppler echocardiography in the intensive care unit. Crit. Care Med., 2002, 30, p. 362–367.
12. Yamamoto, K., Nishimura, R. A., Chaliki, H. P., Appleton, C. P., Holmes, D. R. Jr., Redfield, M. M. Determination of left ventricular filling pressure by Doppler echocardiography in patients with coronary artery disease: critical role of left ventricular systolic function. J. Am. Coll. Cardiol., 1997, 30, p. 1819–1826.
13. Vignon, P., Ait Hussain, A., Francois, B., Preaux, P. M., Pichon, N., Clavel, M., Frat, J. P., Gastinne, H. Noninvasive assessment of pulmonary artery occlusion pressure in ventilated patients: a transesophageal study. Crit. Care, 2008, 12, p. R18.
14. Vargas, F., Gruson, D., Valentino, R., Bui, H. N., Salmi, L. R., Gilleron, V., Gbikpi-Bennisan, G., Guenard, H., Hilbert, G. Transesophageal pulsed Doppler echocardiography of pulmonary venous flow to assess left ventricular filling pressure in ventilated patients with acute respiratory distress syndrome. J. Crit. Care, 2004, 19, p. 187–197.
15. Kinnaird, T. D., Thompson, C. R., Munt, B. I. The deceleration time of pulmonary venous diastolic flow is more accurate than the pulmonary artery occlusion pressure in predicting left atrial pressure. J. Am. Coll. Cardiol., 2001, 37, p. 2025–2030.
16. Sohn, D. W., Song, J. M., Zo, J. H., Chai, I. H., Kim, H. S., Chun, H. G., Kim, H. C. Mitral annulus velocity in the evaluation of left ventricular diastolic function in atrial fibrillation. J. Am. Soc. Echocardiogr., 1999, 12, p. 927–931.
17. Naughton, M. T., Rahman, M. A., Hara, K., Floras, J. S., Bradley, T. D. Effect of continuous positive airway pressure on intrathoracic and left ventricular transmural pressures in patients with congestive heart failure. Circulation, 1995, 91, p. 1725–1731.
18. Schmitt, J. M., Vieillard-Baron, A., Augarde, R., Prin, S., Page, B., Jardin, F. Positive end-expiratory pressure titration in acute respiratory distress syndrome patients: Impact on right ventricular outflow impedance evaluated by pulmonary artery Doppler flow velocity measurements. Crit. Care Med., 2001, 29, p. 1154–1158.
19. Jardin, F., Vieillard-Baron, A. Is there a safe plateau pressure in ARDS? The right heart only knows. Intensive Care Med., 2007, 33, p. 444–447.
20. Haddad, F., Couture, P., Tousignant, C., Denault, A. Y. The Right Ventricle in Cardiac Surgery, a Perioperative Perspective: I. Anatomy, Physiology, and Assessment. Anesth. Analg., 2009, 108, p. 407–421.
21. Mekontso Dessap, A., Boissier, F., Leon, R., Carreira, S., Campo, F. R., Lemaire, F., Brochard, L. Prevalence and prognosis of shunting across patent foramen ovale during acute respiratory distress syndrome. Crit. Care Med., 2010, 38, p. 1786–1792.
22. Belohlavek, J., Rohn, V., Jansa, P., Tosovsky, J., Kunstyr, J., Semrad, M., Horak, J., Lips, M., Mlejnsky, F., Balik, M., Klein, A., Linhart, A., Lindner, J. Veno-arterial ECMO in severe acute right ventricular failure with pulmonary obstructive hemodynamic pattern. J. Invasive Cardiol., 2010, 22, p. 365–369.
23. Mahjoub, Y., Pila, C., Friggeri, A. et al. Assessing fluid responsiveness in critically ill patients: False-positive pulse pressure variation is detected by Doppler echocardiographic evaluation of the right ventricle. Crit. Care Med., 2009, 37, p. 2570–2575.
24. Vieillard-Baron, A., Charon, C., Caille, V., Belliard, G., Page, B., Jardin, F. Prone positioning unloads the right ventricle in severe ARDS. Chest, 2007, 132, p. 1440–1446.
25. Mercat, A., Diehl, J. L., Meyer, G. et al. Hemodynamic effects of fluid loading in acute massive pulmonary embolism. Crit. Care Med., 1999, 27, p. 540–544.
26. Balik, M., Plasil, P., Pazout, J. et al. Ultrasound guided thoracentesis in mechanically ventilated patients. Intensive Care Med., 2006, 32, p. 318–321.
27. Lichtenstein, D., Meziere, G., Biderman, R. et al. The lung point: an ultrasound sign specific to pneumothorax. Intensive Care Med., 2000, 26, p. 1434–1440.
28. Baldi, G., Gargani, L., Abramo, A., D‘Errico, L., Caramella, D., Picano, E., Giunta, F., Forfori, F. Lung water assessment by lung ultrasonography in intensive care: a pilot study. Intensive Care Med., 2013, 39, p. 74–84.
29. Lichtenstein, D., Meziere, G. A., Lagoueyte, J. F., Biderman, P., Goldstein, I., Gepner, A. A-Lines and B-Lines. Lung Ultrasound as a Bedside Tool for Predicting Pulmonary Artery Occlusion Pressure in the Critically Ill. Chest, 2009, 136, p. 1014–1020.
30. Bouhemad, B., Brisson, H., Le-Guen, M., Arbelot, C., Lu, Q., Rouby, J. L. Bedside Ultrasound Assessment of Positive End-Expiratory Pressure-induced Lung Recruitment. Am. J. Respir. Crit. Care Med., 2011, 183, p. 341–347.
31. Lichtenstein, D., Meziere, G., Seitz, J. The dynamic dynam bronchogram: A Lung Ultrasound Sign of Alveolar Consolidation Ruling Out Atelectasis. Chest, 2009, 135, p. 1421–1425.
32. Nielsen, J., Østergaard, M., Kjaergaard, J., Tingleff, J., Berthelsen, P. G., Nygård, E., Larsson, A. Lung recruitment maneuver depresses central hemodynamics in patients following cardiac surgery. Intensive Care Med., 2005, 31, p. 1189–1194.
33. Gernoth, C., Wagner, G., Pelosi, P., Luecke, T. Respiratory and haemodynamic changes during decremental open lung positive end-expiratory pressure titration in patients with acute respiratory distress syndrome. Crit. Care, 2009, 13, R59.
34. Tsubo, T., Yatsu, Y., Tanabe, T., Okawa, H., Ishihara, H., Matsuki A. Evaluation of density area in dorsal lung region during prone position using transesophageal echocardiography. Crit. Care Med., 2004, 32, p. 83–87.
35. Caille, V., Amiel, J. B., Charron, C., Belliard, G., Vieillard-Baron, A., Vignon, P. Echocardiography: a help in the weaning process. Crit. Care, 2010, 14, p. R120.
36. Soummer, A., Perbet, S., Brisson, H., Arbelot, C., Constantin, J. M., Lu, Q., Rouby, J. J. Lung Ultrasound Study Group Ultrasound assessment of lung aeration loss during a successful weaning trial predicts postextubation distress. Crit. Care Med., 2012, 40, p. 2064–2072.
37. Peris, A., Lazzeri, C., Cianchi, G., Bonizzoli, M., Batacchi, S., Bernardo, P., Valente, S., Gensini, G. F. Clinical significance of echocardiography in patients supported by venous-venous extracorporeal membrane oxygenation. J. Artif. Organs, 2015, 18, p. 99–105.
38. Brechot, N., Luyt, C. E., Schmidt, M. et al. Venoarterial Extracorporeal Membrane Oxygenation Support for Refractory Cardiovascular Dysfunction During Severe Bacterial Septic Shock. Crit. Care Med., 2013, 41, p. 1616–1626.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2017 Issue 1
Most read in this issue- The most frequent complications associated with general anaesthesia from the patient’s point of view. Questionnaire comparative study 2007/2014
- Acute respiratory failure and echocardiographic examination
- Prediction of fluid responsiveness
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

