-
Medical journals
- Career
Invazivní mykotické onemocnění: terminologie, definice, léčebné přístupy – aktualizace 2009
Authors: Haber Jan; Forsterová Kristina
Authors‘ workplace: I. interní klinika – klinika hematologie, UK v Praze, 1. LF a VFN Praha
Published in: Anest. intenziv. Med., 21, 2010, č. 1, s. 31-38
Category: Intensive Care Medicine - Review Article
Overview
Invazivní mykotická onemocnění jsou dnes reálnou součástí léčby nejen maligních onemocnění, ale stávají se aktuálním problémem i na jednotkách intenzivní péče. V roce 2002 byla publikována kritéria definující „jistou“, „pravděpodobnou“ a „možnou“ diagnózu invazivní mykózy, a tak sjednotila množství výrazů a popisů, které byly v této oblasti do té doby nekoncepčně používány. Tyto definice byly přijaty jak v Evropě, tak v USA a v roce 2008 byly aktualizovány. V přehledovém článku tato aktualizovaná kritéria uvádíme. Dále uvádíme charakteristiky jednotlivých léčebných přístupů (profylaxe – empirická – preemptivní – cílená léčba) a v závěru pak kritéria hodnocení léčebné odpovědi u mykotického onemocnění. Cílem je sjednotit přístupy a formální kritéria v této medicínské disciplíně, a tak vytvořit základ pro multicentrické studie a přinejmenším základ pro spolupráci mezi různými pracovišti.
Klíčová slova:
definice – invazivní mykotické onemocnění – jistá diagnóza – pravděpodobná diagnóza – možná diagnóza – profylaxe – empirická léčba – preemptivní léčba – cílená léčba – odpověď na léčbuTerminologie
Pracovní skupina evropských a amerických odborníků v mykologii (European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group) uveřejnila v roce 2002 [1] konsenzuální návrh definic a kritérií, které ujednotily množství synonym dosud používaných pro určení invazivních mykotických infekcí, a dala pojmům jednotný obsah. Později se o návrzích opět diskutovalo [2], zejména z pohledu nových diagnostických možností a s uplatněním pro širší spektrum nemocných s imunitním deficitem, až nakonec v roce 2008 byly definice v některých aspektech aktualizovány [3].
Komise odborníků navrhla zaměnit dosud užívaný termín „fungémie“ termínem „hematogenní mykotická infekce“. Nový termín tak vylučuje možný nesprávný výklad, že při fungémii je infekce omezena pouze na krevní řečiště. Termín „invazivní mykotická infekce“ (invasive fungal infection – IFI) navrhla zaměnit za termín „invazivní mykotické onemocnění“ (invasive fungal disease – IFD), neboť mnohem lépe vystihuje fakt, že jde o systémové onemocnění způsobené mykotickou infekcí [3].
Definice mykotické infekce, diagnóza invazivního mykotického onemocnění
Na základě výsledků vyšetření jsou definovány tři úrovně jistoty diagnózy invazivního mykotického onemocnění:
- diagnóza „jistá“,
- diagnóza „pravděpodobná“,
- diagnóza „možná“.
Zařazení do jednotlivých skupin (jistá, pravděpodobná, možná) vyžaduje splnění minimálních kritérií, vycházejících z výsledků vyšetření klinického, laboratorního (sérologického), rentgenologického (CT) a mykologického [1–3]. Původně šlo spíše o pracovní definice určené pro klinické či epidemiologické studie a toto určení potvrzuje i nová revize z roku 2008. Skutečnost však ukazuje, že se tyto definice postupně vžily a staly se součástí klinické praxe v diagnostickém a nakonec i v terapeutickém rozhodovacím procesu. Aktuální revize [3] původní rozdělení zachovává, ale rozšiřuje kritéria definice pro diagnózu „pravděpodobné“ mykózy, kde zohledňuje pokrok v nepřímých (sérologických) diagnostických metodách. Diagnózu „možného“ mykotického onemocnění naopak zužuje na nemocné jen s velkou pravděpodobností mykotického onemocnění, ale bez mykologického nálezu. Klasifikaci „jistá“ diagnóza rozšiřuje i na imunokompetentní pacienty, zatímco kategorie „pravděpodobná“ a „možná“ limituje pouze na imnunoalterované nemocné [3]. Podrobnosti jsou uvedeny v tabulkách 1 a 2. Diagnóza „prokázaného“ invazivního mykotického onemocnění je založena v zásadě pouze na histologickém nebo cytologickém průkazu nebo na pozitivní kultivaci ze vzorku získaného sterilním odběrem z místa infekce. Diagnóza „pravděpodobného“ invazivního mykotického onemocnění je definovaná přítomností alespoň jednoho kritéria z každé ze tří skupin kategorií, tj. faktoru hostitele (např. febrilní neutropenie), klinického kritéria (např. nálezy při zobrazovacích vyšetřeních) a mykologického kritéria (např. přímý mikroskopický průkaz nebo nepřímý průkaz sérologickými testy). Diagnóza „možného“ invazivního mykotického onemocnění stojí na přítomnosti alespoň jednoho faktoru hostitele (nejčastěji jde o febrilní neutropenii) a jednoho klinického faktoru (nejčastěji jde o nálezy při zobrazovacích vyšetřeních), avšak bez mykologického potvrzení infekce.
Table 1. Prokázané invazivní mykotické onemocnění – kritéria (podle [3]) ![Prokázané invazivní mykotické onemocnění – kritéria (podle [3])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f48cd3641dff182c2aa7222ae9eac297.png)
*Je-li dostupná kultivace, pak doplnit druh, rod a kvantitu nálezu. +Tkáň a buňky pro histo- a cytopatologické vyšetření nabarvit podle Grocotta-Gomorriho, nebo PAS a pokud to jde, použít i fluorescenční barvení. ++Candida, Trichosporon a kvasinkovité Geotrichum sp. a Blastoschizomyces capitatus mohou také tvořit pseudohyfy nebo pravé hyfy. **Průkaz aspergila v hemokultuře je vždy známkou kontaminace. Table 2. Pravděpodobné invazivní mykotické onemocnění 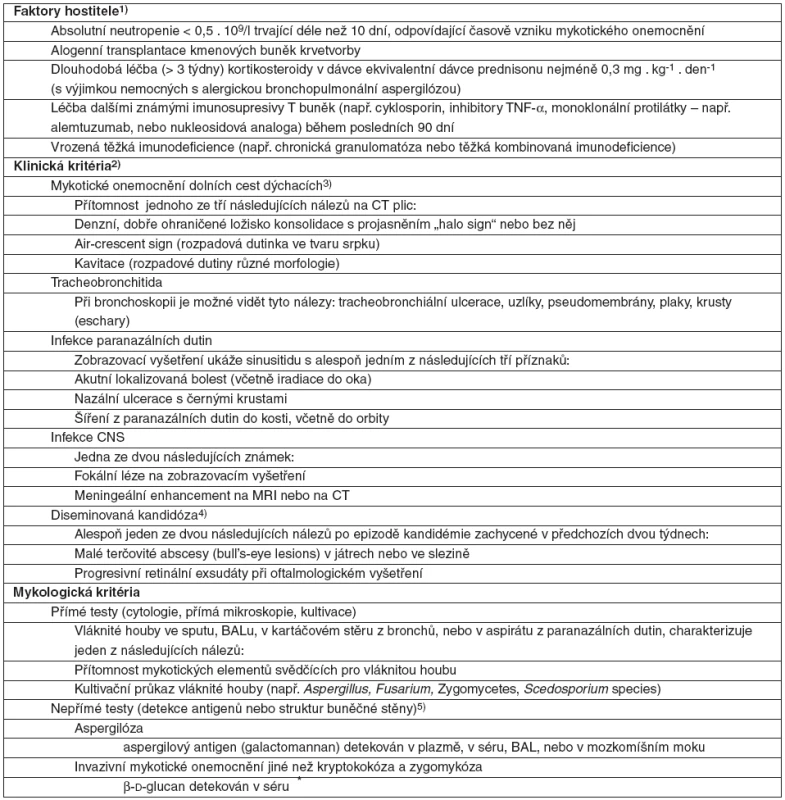
Je definované přítomností alespoň jednoho kritéria z každé ze tří skupin kategorií, tj. faktoru hostitele, klinického kritéria a mykologického kritéria. Možné invazivní mykotické onemocnění je charakterizováno pouze faktory hostitele a klinickými kritérii, bez kritérií mykologických (blíže v textu) – podle [3]. Poznámka: Pro stanovení diagnózy „pravděpodobného“ mykotického onemocnění se vyžaduje přítomnost faktorů hostitele, klinického kritéria a mykologického kritéria. 1)Faktory hostitele nejsou synonymem pro rizikové faktory. Charakterizují každého jednotlivce z hlediska faktorů, kterými predisponuje ke vzniku invazivního mykotického onemocnění. Slouží primárně k užití u nemocných léčených pro maligní onemocnění, u nemocných po alogenní transplantaci kostní dřeně nebo po transplantaci solidních orgánů. Tyto faktory lze použít i u nemocných léčených kortikosteroidy nebo jinými imunosupresivy T lymfocytů nebo s vrozenou těžkou imunodeficiencí. 2)Musí odpovídat mykologickým nálezům, jsou-li nějaké, musí časově odpovídat probíhající infekční epizodě 3)Je nutné vynaložit veškeré racionální úsilí k vyloučení jiné etiologie. 4)Přítomnost projevů odpovídajících sepsi svědčí pro akutní diseminované onemocnění, zatímco jejich nepřítomnost ukazuje na chronické diseminované onemocnění. 5)Tyto testy se používají primárně u aspergilózy a kandidózy, ale nehodí se k diagnóze kryptokokózy nebo zygomykózy (tj. Rhizopus, Mucor, Absidia sp.). Detekce nukleových kyselin není uvedena, protože dosud nejsou ověřeny nebo standardizovány příslušné metody. Léčebné přístupy – principy
Z hlediska terapeutické intervence antimykotiky rozlišujeme čtyři přístupy: profylaxe, empirická léčba, preemptivní a cílená léčba [4-6] – graf 1.
Graph 1. Principy léčebného přístupu ve vztahu k jistotě diagnózy invazivního mykotického onemocnění (podle [7]) ![Principy léčebného přístupu ve vztahu k jistotě diagnózy invazivního mykotického onemocnění (podle [7])](https://pl-master.mdcdn.cz/media/image/ca3feb71d5cec2759c318504757c9468.jpeg?version=1537790253)
Profylaxe
Při profylaktické intervenci je antimykotikum podáno ještě před známkami infekce, s cílem předejít závažnému infekčnímu onemocnění. Na základě klinických studií a metaanalýz (medicíny založené na důkazech) se význam profylaxe ukazuje u nemocných s nejvyšším rizikem vzniku invazivního mykotického onemocnění, tj. u nemocných v období indukční (reindukční) léčby akutní leukémie, po protinádorové léčbě spojené s prolongovanou neutropenií a u nemocných po alogenní transplantaci kmenových buněk krvetvorby [8–15]. Antimykotická profylaxe je v těchto případech spojena se snížením mortality na mykotickou infekci a se snížením i celkové mortality. U jiných diagnóz a léčebných postupů (transplantace solidních orgánů, autologní transplantace kmenových buněk krvetvorby, léčba maligních lymfoproliferací) nejsou o významu profylaxe přesvědčivé údaje.
Empirická léčba
Cílem empirické intervence je získat kontrolu nad teprve rozvíjející se infekcí. Empirická léčba antimykotiky je zahájena bez přesvědčivých dokladů (kultivačních nálezů) o charakteru infekce, pouze na základě klinického hodnocení při 3–5 dní přetrvávající horečce (i přes adekvátní léčbu antibiotiky), jejíž etiologii však neznáme [16]. Tento léčebný přístup byl zahájen již v 80. letech 20. století [17] a následně podpořen výsledky dalších studií, kdy empirické přidání antimykotika do již stávající palety antibiotik vedlo ke snížení počtu invazivních mykóz a ke snížení mortality [18]. Filosofie empirické léčby je odrazem období, kdy nebyly k dispozici dostatečné diagnostické možnosti a vysoké procento mykóz unikalo intravitální diagnostice a potvrdilo se až v sekčním materiálu [19]. Současně byla projevem obavy, že by nemocní mohli umřít, kdyby se antimykotická léčba zpozdila [20–22]. Pomocí v rozhodování, kdy zahájit empirickou léčbu, je zhodnocení rizikových faktorů predisponujících k invazivní infekci [10, 16, 23, 24] a znalost epidemiologické situace daného oddělení, která nakonec zásadně ovlivňuje volbu konkrétního antimykotika. Ukazuje se, že např. v případě kandidózy má volba adekvátního antimykotika z hlediska přežití v některých případech významnější vliv než časový faktor zahájení léčby [25]. V indikaci empirické léčby v zásadě bereme v úvahu kritéria, která charakterizují „možnou“ diagnózu invazivní mykózy. Klinické studie empirické léčby antimykotiky používají pro posouzení antimykotické účinnosti testovaného léčiva kompozitní skóre [18], ve kterém je jedním ze základních kritérií hodnocení ústup horečky. Tento postup je velmi často kritizován [26–28] a jako cíle jsou navrhována jiná kritéria [6, 29, 30].
Preemptivní léčba
Předností preemptivní antimykotické léčby je skutečnost, že je podložena již objektivními známkami mykotické infekce [6, 28]. S využitím moderních diagnostických možností (CT vyšetření, sérologické vyšetření s časným stanovením antigenů /galaktomannanu/ v séru a ve vzorku z BAL) získá klinik informaci relativně brzy. Při rozhodování o preemptivním přístupu tak v zásadě bereme v úvahu faktory, které charakterizují „pravděpodobnou“ diagnózu invazivní mykózy, tj. stále chybí definitivní potvrzení histologickým nebo kultivačním průkazem. Některé klinické studie preemptivní léčby potvrzují, že při kvalitním diagnostickém zázemí s rychlým dosažením výsledků je možné empirický přístup nahradit preemptivním [31]. Ten je jednak racionálnější, jednak se celkově sníží počet léčených nemocných, neboť zahájení léčby je založeno na objektivních datech a vybraných klinických situacích (např. septický šok, mukozitida). Obvykle také dochází k pozdějšímu zahájení léčby než při empirické indikaci cca o jeden týden, bez zhoršení celkového přežití nemocných [32].
Nedostatkem preemptivního přístupu, který může znamenat riziko pro pacienta, je stále nedokonalá diagnostika [28]. Chybí nástroje k zachycení infekce zygomycetami, které se aktuálně stávají hrozbou transplantačních center [33, 34], není definitivně zhodnocen význam sérologického vyšetření (zejména galaktomannanu) u non-neutropenických imunokompetentních pacientů a stále zůstává vysoké procento falešně negativních hemokultur při screeningu kandidémie.
Cílená léčba
Cílená léčba je indikována při „jisté“ diagnóze invazivního mykotického onemocnění (viz tab. 1).
Definice odpovědi na léčbu
I když stanovení kritérií odpovědi na léčbu invazivního mykotického onemocnění bylo formulováno primárně pro klinické studie [35], je i v klinické praxi vhodné tato kritéria znát. Zejména proto, abychom při dosažení kritérií úplné odpovědi (= vyléčení infekce), mohli kvalifikovaně léčbu ukončit, nebo naopak najít zdůvodnění pro změnu léčebného režimu.
Kritéria léčebné odpovědi hematogenní kandidové infekce (kandidémie) a invazivní kandidózy
Zásadním kritériem úspěšné léčby hematogenní kandidové infekce /kandidémie/ (= primární cíl terapeutické studie) je prokázaná eradikace kandidy z krve. Možné klinické projevy nejsou specifické, při hodnocení účinnosti léčby mají nepodstatnou roli a jejich přetrvávání neznamená selhání léčby. Vzhledem k možné rekurenci mykotického onemocnění, zejména u imunoalterovaných nemocných, je vhodné hodnotit efekt léčby nejméně po 4 týdnech sledování. Hodnocení primárního cíle terapeutické studie již v době skočení léčby je proto považováno za nevhodné, jednak pro variabilitu tohoto termínu, a jednak proto, že nepostihne období možného časného relapsu (tab. 3).
Table 3. Kritéria hodnocení odpovědi hematogenní kandidové infekce (kandidémie) a jiných forem invazivní kandidózy na antimykotickou léčbu (podle [35]) ![Kritéria hodnocení odpovědi hematogenní kandidové infekce (kandidémie) a jiných forem invazivní kandidózy na antimykotickou léčbu (podle [35])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/633969c8a1a26d88c583f3475217029b.png)
Poznámky: Nejkratší doba sledování je 4 týdny od zahájení léčby. Zdůvodnění tohoto intervalu spočívá v možnosti zachycení relapsu onemocnění. Za relaps je obecně považována pozitivní kultivace ze vzorku krve nebo jinak sterilní tkáně a ne pouze rekurence klinických projevů (např. horečka), které jsou obvykle nespecifické. V případě postižení viscerálních orgánů (endokard, meningy, sítnice, chronická diseminovaná kandidóza) předpokládáme dobu sledování alespoň 12 týdnů od zahájení léčby. Horečka bez lokálních projevů a bez jiných abnormálních nálezů při fyzikálním vyšetření je nejčasnějším projevem kandidémie. Vzhledem k tomu, že horečka může být způsobena mnoha příčinami bez souvislosti s kandidémií, přisuzujeme v hodnocení odpovědi na léčbu větší váhu eradikaci kandidy z krve než ústupu horečky. A tak je přetrvávající nebo rekurentní horečka, i přes eradikaci infekce z krve, hodnocena jako nejméně částečná odpověď a tedy jako úspěšná odpověď. U viscerální kandidózy (jako je hepatosplenická kandidóza) se vstupně negativní hemokulturou může být perzistující horečka jediným odpovídajícím klinickým příznakem kandidózy a radiologické nálezy mohou přetrvávat po dlouhou dobu. V takové situaci je ústup horečky a stabilní radiologický nález hodnocen jako částečná odpověď. Laboratorní nálezy, jako je PCR a stanovení β-D-glukanu, nebyly dosud ověřeny jako markery odpovědi na léčbu invazivní kandidózy. Kritéria léčebné odpovědi invazivní aspergilózy a jiné infekce vláknitými houbami
Při hodnocení léčebné odpovědi invazivní aspergilózy je zásadní hodnocení radiologické odpovědi a sérologických markerů – aspergilového antigenu, galaktomannanu (GM). Ústup klinických známek infekce (horečka, hemoptýza) není zásadním kritériem. Nejen proto, že klinický projev invazivní plicní aspergilózy není specifický, ale také proto, že nejčastěji jsou postiženi nemocní s leukémií nebo po alogenní transplantaci kmenových buněk krvetvorby, u nichž podobný klinický obraz mohou vyvolat jiné infekce a i neinfekční příčiny.
Při hodnocení radiologické odpovědi je nutné zvážit skutečnost, že CT nález i při úspěšné léčbě invazivní plicní aspergilózy je v prvním týdnu léčby zhoršen – dochází až ke čtyřnásobnému zvětšení radiologických lézí [36], a až teprve po dalším týdnu také radiologické změny potvrzují úspěšnou léčbu. Podobně vznik rozpadových dutin je často projevem reparace granulocytů u původně granulocytopenického pacienta a nikoli projevem progrese choroby. Syndrom zánětlivé imunitní rekonstrukce (Immune Reconstitution Inflammatory Syndrome IRIS) [37], spojený s klinickým i radiologickým zhoršením, je nutné také odlišit od progrese infekce. Svědčí pro něj zejména normalizace počtu neutrofilů a klesající koncentrace GM v séru. GM se stává významným markerem jak diagnostickým, tak i monitorujícím dynamiku průběhu onemocnění s významným prognostickým efektem. Kritéria léčebné odpovědi uvádí podrobně tabulka 4.
Table 4. Kritéria hodnocení odpovědi infekce vláknitými houbami na antimykotickou léčbu (podle [35]) ![Kritéria hodnocení odpovědi infekce vláknitými houbami na antimykotickou léčbu (podle [35])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/472e5124dbfbb7e90404df38ffb4db80.png)
Poznámky: Ve studiích primární terapie je nejkratší doba sledování 6 týdnů od zahájení léčby, ale jako sekundární cíl studie by mělo být zařazeno konečné zhodnocení ve 12. týdnu nebo později. Ve studiích záchranné léčby by mělo být hodnocení primárního cíle studie provedeno nejdříve 12. týden po zařazení. 1) Jasný průkaz radiologické odpovědi (zmenšení průměru lézí nejméně o 25 %, bez průkazu nových lézí) by měl mít větší váhu než subjektivní, nespecifické a těžko kvantifikovatelné hodnocení klinických známek a příznaků onemocnění. A tak v případě mykotické pneumonie doporučujeme hodnotit zlepšení radiologického nálezu, i při přetrvávání horečky nebo kašle, jako částečnou odpověď. Ke zlepšení radiologického nálezu dochází často až s časovým odstupem za zlepšením klinickým (zejména při krátkém období sledování), doporučujeme hodnotit stabilizaci radiologických nálezů se současným vymizením odpovídajících klinických známek a příznaků onemocnění jako částečnou odpověď. Stanovení galaktomannanu v séru je považováno za perspektivní korelát léčebné odpovědi. Definice relapsu a reinfekce
Relaps znamená opětné vzplanutí infekce způsobené stejným agens (např. stejným izolátem A. fumigatus), který vyvolal předchozí, úspěšně vyléčené onemocnění. Reinfekce je způsobena jiným izolátem (aspergila) stejného druhu (A. fumigatus) [38]. Rozlišení relapsu od reinfekce není v běžné klinické praxi při klinickém zhodnocení a při použití běžných standardních laboratorních metod prakticky uskutečnitelné. Patogeneze relapsu spočívá v reaktivaci latentní infekce, která nebyla předchozí léčbou zcela eradikována, i když současné vyšetřovací metody (sérologie, CT) svoji limitovanou senzitivitou infekci při ukončení léčby nepotvrdily. K reaktivaci infekce dochází obvykle při další léčebném postupu, který navodí opět imunosupresivní stav a lokalizace je nejčastěji v místě původní infekce.
Závěr
Definice nemají řídit každodenní klinickou praxi. Mají usnadnit jasnou komunikaci a pomoci jednoznačně a stejnými výrazy popsat klinické stavy. To umožní spolupráci různých center a pracovních skupin a srozumitelným způsobem i prezentovat výsledky klinické práce.
Došlo dne 21. 10. 2009.
Přijato dne 1. 11. 2009.
Adresa pro korespondenci
MUDr. Jan Haber, CSc.
U Nemocnice 2
128 08 Praha 2
e-mail: janhaber@quick.cz
Sources
1. Ascioglu, S., Rex, J. H., de Pauw, B. et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus. Clin. Infect. Dis., 2002, 34, 1, p. 7–14.
2. de Pauw, B. E., Patterson, T. F. Should the consensus guidelines’ specific criteria for the diagnosis of invasive fungal infection be changed? Clin. Infect. Dis., 2005, 41, Suppl., 6, p. S377–380.
3. De Pauw, B., Walsh, T. J., Donnelly, J. P. et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin. Infect. Dis., 2008, 46, 12, p. 1813–1821.
4. Rubin, R. H., Ikonen, T., Gummert, J. F., Morris, R. E. The therapeutic prescription for the organ transplant recipient: the linkage of immunosuppression and antimicrobial strategies. Transpl. Infect. Dis., 1999, 1, 1, p. 29–39.
5. O’Brien, S. N., Blijlevens, N. M., Mahfouz, T. H., Anaissie, E. J. Infections in patients with hematological cancer: recent developments. Hematology Am. Soc. Hematol. Educ. Program, 2003, p. 438–472.
6. de Pauw, B. E., Rubin, R. H. Empiric versus preemptive therapy in the management of febrile neutropenia in the patient being treated for hematologic malignancy. Transpl. Infect. Dis., 2006, 8, 1, p. 1–2.
7. Ruping, M. J., Vehreschild, J. J., Cornely, O. A. Patients at high risk of invasive fungal infections: when and how to treat. Drugs, 2008, 68, 14, p. 1941–1962.
8. Goodman, J. L., Winston, D. J., Greenfield, R. A. et al. A controlled trial of fluconazole to prevent fungal infections in patients undergoing bone marrow transplantation. The New England journal of medicine, 1992, 326, 13, p. 845–851.
9. Slavin, M. A., Osborne, B., Adams, R. et al. Efficacy and safety of fluconazole prophylaxis for fungal infections after marrow transplantation – a prospective, randomized, double-blind study. The Journal of Infectious Diseases, 1995, 171, 6, p. 1545–1552.
10. Prentice, H. G., Kibbler, C. C., Prentice, A. G. Towards a targeted, risk-based, antifungal strategy in neutropenic patients. British Journal of Haematology, 2000, 110, 2, p. 273–284.
11. Cordonnier, C., Calandra, T. The first European conference on infections in leukaemia: Why and how? European Journal of Cancer Supplements, 2007, 5, 2, p. 2–4.
12. Cornely, O. A., Bohme, A., Buchheidt, D. et al. Primary prophylaxis of invasive fungal infections in patients with hematologic malignancies. Recommendations of the Infectious Diseases Working Party of the German Society for Haematology and Oncology. Haematologica, 2009, 94, 1, p. 113–122.
13. Cornely, O. A., Bohme, A., Buchheidt, D. et al. Prophylaxis of invasive fungal infections in patients with hematological malignancies and solid tumors – guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Annals of Hematology, 2003, 82, Suppl. 2, p. S186–200.
14. Cornely, O. A., Maertens, J., Winston, D. J. et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. The New England Journal of Medicine, 2007, 356, 4, p. 348–359.
15. Robenshtok, E., Gafter-Gvili, A., Goldberg, E. et al. Antifungal prophylaxis in cancer patients after chemotherapy or hematopoietic stem-cell transplantation: systematic review and meta-analysis. J. Clin. Oncol., 2007, 25, 34, p. 5471–5489.
16. Pizzo, P. A. Fever in immunocompromised patients. The New England Journal of Medicine, 1999, 341, 12, p. 893–900.
17. Pizzo, P. A., Robichaud, K. J., Gill, F. A., Witebsky, F. G. Empiric antibiotic and antifungal therapy for cancer patients with prolonged fever and granulocytopenia. The American Journal of Medicine, 1982, 72, 1, p. 101–111.
18. EORTC IATCG Empiric antifungal therapy in febrile granulocytopenic patients. EORTC International Antimicrobial Therapy Cooperative Group. The American Journal of Medicine, 1989, 86, 6 Pt 1, p. 668–672.
19. Bodey, G., Bueltmann, B., Duguid, W. et al. Fungal infections in cancer patients: an international autopsy survey. Eur. J. Clin. Microbiol. Infect. Dis., 1992, 11, 2, p. 99–109.
20. Morrell, M., Fraser, V. J., Kollef, M. H. Delaying the empiric treatment of candida bloodstream infection until positive blood culture results are obtained: a potential risk factor for hospital mortality. Antimicrobial Agents and Chemotherapy, 2005, 49, 9, p. 3640–3645.
21. Garey, K. W., Rege, M., Pai, M. P. et al. Time to initiation of fluconazole therapy impacts mortality in patients with candidemia: a multi-institutional study. Clin. Infect. Dis., 2006, 43, 1, 25–31.
22. von Eiff, M., Roos, N., Schulten, R., Hesse, M., Zuhlsdorf, M., van de Loo, J. Pulmonary aspergillosis: early diagnosis improves survival. Respiration; international review of thoracic diseases, 1995, 62, 6, p. 341–347.
23. Blumberg, H. M., Jarvis, W. R., Soucie, J. M. et al. Risk factors for candidal bloodstream infections in surgical intensive care unit patients: the NEMIS prospective multicenter study. The National Epidemiology of Mycosis Survey. Clin. Infect. Dis., 2001, 33, 2, p. 177–186.
24. Fukuda, T., Boeckh, M., Carter, R. A. et al. Risks and outcomes of invasive fungal infections in recipients of allogeneic hematopoietic stem cell transplants after nonmyeloablative conditioning. Blood, 2003, 102, 3, p. 827–833.
25. Parkins, M. D., Sabuda, D. M., Elsayed, S., Laupland, K. B. Adequacy of empirical antifungal therapy and effect on outcome among patients with invasive Candida species infections. The Journal of Antimicrobial Chemotherapy, 2007, 60, 3, p. 613–618.
26. Bennett, J. E., Powers, J., Walsh, T. et al. Forum report: issues in clinical trials of empirical antifungal therapy in treating febrile neutropenic patients. Clin. Infect Dis., 2003, 36, Suppl 3, p. S117–122.
27. Schiel, X., Link, H., Maschmeyer, G. et al. A prospective, randomized multicenter trial of the empirical addition of antifungal therapy for febrile neutropenic cancer patients: results of the Paul Ehrlich Society for Chemotherapy (PEG) Multicenter Trial II. Infection, 2006, 34, 3, p. 118–126.
28. de Pauw, B. E., Donnelly, J. P. Timely intervention for invasive fungal disease: should the road now lead to the laboratory instead of the pharmacy? Clin. Infect. Dis., 2009, 48, 8, p. 1052–1054.
29. Klastersky, J. Antifungal therapy in patients with fever and neutropenia – more rational and less empirical? The New England journal of medicine, 2004, 351, 14, p. 1445–1447.
30. Marr, K. A. Empirical antifungal therapy – new options, new tradeoffs. The New England Journal of Medicine, 2002, 346, 4, p. 278–280.
31. Maertens, J., Theunissen, K., Verhoef, G. et al. Galactomannan and computed tomography-based preemptive antifungal therapy in neutropenic patients at high risk for invasive fungal infection: a prospective feasibility study. Clin. Infect. Dis., 2005, 41, 9, p. 1242–1250.
32. Cordonnier, C., Pautas, C., Maury, S. et al. Empirical versus preemptive antifungal therapy for high-risk, febrile, neutropenic patients: a randomized, controlled trial. Clin. Infect. Dis., 2009, 48, 8, p. 1042–1051.
33. Bouza, E. M., Guinea, J. Mucormycosis: an emerging disease? Clin. Microbiol. Infect., 2006, 12, 7, p. 7–23.
34. Sun, H. Y., Singh, N. Emerging importance of infections due to zygomycetes in organ transplant recipients. International Journal of Antimicrobial Agents, 2008, 32, Suppl 2, p. S115–118.
35. Segal, B. H., Herbrecht, R., Stevens, D. A. et al. Defining responses to therapy and study outcomes in clinical trials of invasive fungal diseases: Mycoses Study Group and European Organization for Research and Treatment of Cancer consensus criteria. Clin. Infect. Dis., 2008, 47, 5, p. 674–683.
36. Caillot, D., Couaillier, J. F., Bernard, A. et al. Increasing volume and changing characteristics of invasive pulmonary aspergillosis on sequential thoracic computed tomography scans in patients with neutropenia. J. Clin. Oncol., 2001, 19, 1, p. 253–259.
37. Miceli, M. H., Maertens, J., Buve, K. et al. Immune reconstitution inflammatory syndrome in cancer patients with pulmonary aspergillosis recovering from neutropenia: Proof of principle, description, and clinical and research implications. Cancer, 2007, 110, 1, p. 112–120.
38. Sipsas, N. V., Kontoyiannis, D. P. Clinical issues regarding relapsing aspergillosis and the efficacy of secondary antifungal prophylaxis in patients with hematological malignancies. Clin. Infect. Dis., 2006, 42, 11, p. 1584–1591.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2010 Issue 1-
All articles in this issue
- Využití ultrazvuku v regionální anestezii a intervenční léčbě bolesti
- Kardiogenní šok se systémovou zánětlivou odpovědí – komplikace akutního infarktu myokardu
- Osmoterapie v neurochirurgii – manitol nebo chlorid sodný?
- Imunoterapie sepse
- Invazivní mykotické onemocnění: terminologie, definice, léčebné přístupy – aktualizace 2009
- Vývoj dětské anesteziologie a resuscitace v Praze
- Vzpomínky na pražskou dětskou anesteziologii 50. let
- Historie dětské anesteziologie v Praze – anesteziologické postupy v dětské stomatologii
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Osmoterapie v neurochirurgii – manitol nebo chlorid sodný?
- Využití ultrazvuku v regionální anestezii a intervenční léčbě bolesti
- Vývoj dětské anesteziologie a resuscitace v Praze
- Imunoterapie sepse
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

