-
Medical journals
- Career
Imunoterapie sepse
: Průcha Miroslav 1; Černý Vladimír 2
: Oddělení klinické biochemie, hematologie a imunologie, Nemocnice Na Homolce, Praha 1; Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové 2
: Anest. intenziv. Med., 21, 2010, č. 1, s. 23-30
: Intensive Care Medicine - Review Article
Poruchy mechanismů vrozené i adaptivní imunity, nepřiměřená zánětlivá reakce a/nebo imunoparalýza to jsou důvody, které vedou ke hledání vhodných imunomodulačních postupů u pacientů v sepsi. Během uplynulých třiceti let byly zkoušeny různé přístupy, které dosud nevedly k podstatnému efektu. Imunomodulační terapie sepse obsahuje na jedné straně použití terapie protizánětlivé – intravenózních imunoglobulinů, systémových kortikosteroidů, terapie zasahující do rozvoje zánětlivé kaskády – inhibitory cytokinů nebo inhibitory toll-like receptorových mechanismů rozpoznávání. Na druhé straně je to terapie imunostimulační, jejíž repertoár je významně menší – použití růstových faktorů nebo leukocytárního dialyzátu. Dosavadní poznatky o imunopatogenezi sepse svědčí pro dominantní úlohu imunosuprese u pacientů se sepsí. Nadějné výsledky použití imunomodulační terapie v experimentálních studiích nebyly potvrzeny ve studiích klinických. Imunoterapie sepse tak představuje “magic bullet“, který zatím nebyl nalezen. Článek shrnuje dosavadní poznatky a aktuální výsledky klinických studií o imunoterapii sepse.
Klíčová slova:
sepse – imunita – imunosuprese – terapie protizánětlivá – imunostimulaceÚvod
Sepse představuje závažný medicínský a ekonomický problém [1]. U pacientů na anesteziologicko--resuscitačních odděleních v České republice je prevalence sepse 34% a těžké sepse 17% [2]. Sepse není jasně nozologicky definované onemocnění, je to komplex klinických syndromů s různým klinickým obrazem [3]. Po patofyziologické stránce sepse znamená systémovou zánětlivou reakci organismu na infekci probíhající na podkladě interakce mezi makro - a mikroorganismem. Tato interakce je provázena řadou imunopatologických dějů postihujících systém vrozené a adaptivní imunity. Přežití nemocných se sepsí závisí na schopnosti imunity organismu ochránit své tkáně před účinkem patogenů, kromě toho hrají důležitou roli intenzita a rozsah obranné reakce organismu. Nedostatečnost imunitní odpovědi vede k rozvoji sekundární infekce v důsledku imunosuprese, naopak excesivní – stupni inzultu nepřiměřená a nadměrná reakce může vést často k většímu poškození tkání, než by odpovídalo závažnosti primárního poškození.
Z hlediska imunopatologie je sepse charakterizována přesmykem Th1 do Th2 odpovědi s rozdílnou produkcí cytokinů (typ Th1 s produkcí prozánětlivých cytokinů – tumor nekrotizujícího faktoru alfa (TNF-α), interferonu-γ (IFN γ) a interleukinu-2 a dáletyp Th2 s produkcí protizánětlivých cytokinů – IL-4 a IL-10). Dalším charakteristickým rysem imunopatologie sepse je přítomnost přestřelující zánětlivé odpovědi na straně jedné a imunoparalýzy na straně druhé. Obě fáze imunitní odpovědi se vyskytují časově nezávisle na sobě.
Od poznání imunopatogeneze sepse se odvíjí snaha ovlivnit poruchy imunitních mechanismů imunomodulační terapií. Zjednodušeně lze říci, že u pacientů se sepsí se kontinuálně prolínají na jedné straně hyperzánětlivý stav s velkou lokální i celkovou produkcí pro - a protizánětlivých cytokinů a na straně druhé stav imunoparalýzy s funkční nedostatečností imunitního systému. Imunomodulační terapie ovlivňuje jednak stav hyperzánětlivý s použitím terapie protizánětlivé, respektive imunosupresivní v širším i užším slova smyslu, např. intravenózní imunoglobuliny (IVIG), kortikosteroidy, inhibitory cytokinů a jejich receptorů, inhibitory toll-like receptorů. Terapie imunostimulační se snaží reagovat na stav imunoparalýzy, např. použitím růstových faktorů.
Počátky imunomodulační terapie
Hlavní role endotoxinu v patogenezi sepse vedla již v 70. a 80. letech minulého století k použití terapie, která blokovala jeho aktivitu. Průkopníky byli A. Braude a E. Ziegler, kteří imunizovali dobrovolníky bakterií E. coli J5 a poté aplikovali jejich imunní plazmu pacientům s gramnegativní sepsí. První výsledky byly povzbudivé [4], pozdější studie ale závěry nepotvrdily [5]. Rozvoj technologií umožňujících výrobu monoklonálních protilátek přinesl další studie. Použití monoklonálních protilátek – HA1A, E5 proti jedné ze základních stavebních součástí endotoxinu – lipidu A skončil s podobným výsledkem [6, 7].
Imunomodulační léčba postihující hyperzánětlivý stav při sepsi
Léčba intravenózními imunoglobuliny
Léčba intravenózními imunoglobuliny u pacientů v sepsi představuje jednu z kontroverzních stránek dosavadní imunomodulační terapie sepse. Co představuje racionální jádro pro indikaci této terapie?
Účinky IVIG jsou:
- a) Substituční a inaktivační – neutralizace endotoxinů a exotoxinů, zvýšení clearance endotoxinu, redukce adherence bakterií, migrace a invazivnosti;
- b) Imunomodulační – stimulace leukocytů a baktericidie, zvýšení oxidativního vzplanutí při použití 7S-IVIG nebo intaktního IgG, redukce endotoxinem indukovaného oxidativního vzplanutí při použití 5S-IVIG nebo Fab IgG fragmentu a IgM, zvýšení opsonizační aktivity sér [8, 9, 10];
- c) Imunomodulační efekt na produkci cytokinů – snížení produkce prozánětlivých mediátorů, zvýšení produkce protizánětlivých mediátorů, neutralizace cytokinů anticytokinovými protilátkami [11, 12].
V nedávné době byly prezentovány tři metaanalýzy k podání IVIG u pacientů se sepsí. Metaanalýza Lauplanda hodnotila 14 randomizovaných klinických studií z let 1988–2006 [13]. Ve studiích byli zařazeni pacienti s těžkou sepsí nebo septickým šokem a byl testován efekt IVIG na mortalitu. Metaanalýza prokázala významnou redukci mortality u pacientů, kteří dostali IVIG (RR 0,66; 95% CI 0,53–0,83, p < 0,0005). Větší terapeutický efekt byl zaznamenán u studií s menší metodologickou kvalitou a ve studiích s vyšší podanou dávkou IVIG. Turgeon et al. hodnotili publikované práce od roku 1996 do roku 2006 [14]. Ze 4 096 studií bylo vybráno 20 s 2 621 pacienty. Byl prokázán příznivý efekt podání IVIG na mortalitu pacientů (RR 0,74, 95% CI 0,62–0,89, p = 0,001). Metaanalýza Kreymanna et al. prokázala rovněž příznivý efekt podání IVIG u dospělých pacientů (RR 0,79; CI 0,69–0,90 p < 0,0003), stejně jako v populaci dětí a novorozenců (RR 0,56; 95% CI 0,42–0,74, p < 0,0001) [15]. Jednou z posledních větších studií byla multicentrická studie SBTIS (Score-based immunoglobulin G therapy of patients with sepsis), která neprokázala pozitivní účinek podání IVIG na mortalitu v dávce 0,9 g . kg-1 hmotnosti [16].
V současnosti není podání IVIG doporučeno k léčbě sepse a septického šoku u dospělých. Naopak, u dětí je doporučeno podání IVIG u pacientů s těžkou sepsí – 2c [17]. Zvláštní skupinu tvoří pacienti po transplantaci kostní dřeně a hematoonkologičtí pacienti s neutropenií a sekundární hypogamaglobulinémií, u kterých je přítomnost sepse indikací pro podání IVIG .
Léčba inhibitory cytokinů
Úloha cytokinů v patogenezi sepse je zřejmá. Na straně jedné jsou cytokiny nezbytnou součástí adekvátní reakce organismu na infekční inzult – reakce, jejímž primárním cílem je ohraničení působícího inzultu a následně reparace poškozené tkáně, na druhé straně nadměrná a velikosti původního vyvolávajícího inzultu neúměrná produkce cytokinů je zdrojem poškození orgánů a tkání manifestující se různým stupněm orgánové dysfunkce. Na základě preklinických studií byly identifikovány cytokiny podílející se na orgánovém poškození – TNF-α a interleukin-1. TNF-α je klíčovým mediátorem u lipopolysacharidem indukované sepse [18]. Použití purifikovaného rekombinantního cytokinu způsobilo stejné orgánové poškození s následkem smrti u experimentálních zvířat, jaké vidíme u sepse [19, 20]. Podání monoklonálních protilátek proti TNF-α, respektive receptoru pro TNF (TNFR) zabránilo v experimentálním modelu rozvoji příznaků sepse [21]. Následně proběhla celá řada klinických studií, ale bez prokazatelného klinického přínosu [22). Zajímavé vyhodnocení experimentálních studií s použitím inhibitorů TNF provedli Lorente s Marshallem. Při podrobné analýze zjistili, že účinnost léčby se lišila v závislosti na modelu sepse, který byl použit. Největší pozitivní efekt byl přítomen u modelu s aplikací endotoxinu, kde nedocházelo k množení bakterií, naproti tomu škodlivý efekt terapie byl prokázán u modelu s intracelulárními patogeny. Lepší účinnost byla prokázána u modelu s bakteriémií ve srovnání s modelem s lokalizovanou infekcí (pneumonie) a zřejmá byla závislost na čase aplikace – lepší efekt u profylaktického podání než u modelu s podáním po infekčním inzultu [23]. Kapitola s použitím inhibitorů TNF dosud nebyla uzavřena. V současné době začala III. fáze klinické studie s použitím polyklonální protilátky proti TNF-α.
K obdobné nepříznivé situaci došlo ve studiích s použitím inhibitoru pro interleukin-1(IL-1), respektive antagonisty pro receptor IL-1 (IL-1RA). IL-1 se vyskytuje ve dvou různých formách – IL-1α a IL-1β. V plazmě je dominantní IL-1β. IL-1 působí v synergii s TNF u sepse a podílí se na orgánovém a buněčném poškození [24, 25]. Primární klinická studie sice prokázala příznivý vliv na mortalitu [26], následné studie ale tento efekt nepotvrdily [27, 28]. V současné době žádná další klinická studie neprobíhá.
Co říci k použití inhibitorů cytokinů v léčbě sepse? Pokud vycházíme z imunopatogeneze sepse, je jejich úloha nezpochybnitelná a inhibice účinku pomocí monoklonálních protilátek se jeví jako racionální. Důvody neúspěchu jejich použití mohou být následující:
- Nesprávné načasování terapie – časové okno je velice malé a dynamika sepse obrovská.
- Nesprávné cíle – dobře víme, že model sepse s podáním LPS neodpovídá ve většině případů klinické skutečnosti.
- Špatná dávka a nedostatečná znalost dynamiky produkce cytokinů v jednotlivých orgánových kompartmentech – u pacientů se sepsí dochází ke stavu imunoparalýzy a tento stav je funkčně spojen se sníženou produkcí TNF po stimulaci lipopolysacharidem. Provedené klinické studie dokumentovaly korelaci koncentrace TNF v séru s mortalitou pouze u necelé poloviny pacientů. Je potom otázkou, nakolik je terapie inhibitory u pacientů, kteří TNF nejsou schopni produkovat, racionální.
- Specificita použitých monoklonálních protilátek – z klinické praxe u léčby jiných onemocnění inhibitory TNF (Crohnova choroba, revmatoidní artritida) víme, že při neúspěchu jedné léčebné látky se doporučuje zkusit nasadit jinou, protože se při této změně může projevit dosud nepřítomný léčebný efekt.
- Indikace protizánětlivé terapie u nevhodných pacientů s vazbou na intenzitu zánětu – studie Eichackera et al. zkoumala souvislost mezi účinností protizánětlivé léčby u sepse a závažností klinického stavu. Provedená metaanalýza experimentálních a klinických studií prokázala, že účinnost protizánětlivé terapie závisí na závažnosti klinického stavu. Čím závažnější byl klinický stav, tím lepší byl efekt protizánětlivé terapie [29].
V souvislosti s léčbou inhibitory cytokinů je třeba zmínit také důležitou obrannou úlohu cytokinů proti infekci, konkrétně TNF-α. Německá experimentální studie prokázala u zvířat s navozenou imunoparalýzou sníženou produkci TNF-α. Superinfekce vedla ke zvýšené letalitě, ale aplikace exogenního rekombinantního TNF působila protektivně a snížila mortalitu [30]. Informace o možných nežádoucích účincích protilátek neutralizujících TNF-α při léčbě některých autoimunitních zánětlivých onemocnění, zejména zvýšené riziko závažných infekcí včetně TBC a vyšší výskyt malignit [31, 32] jsou důvody, pro které je nutná opatrnost při jejich aplikaci. Samozřejmě s vědomím, že doba léčby se zásadně liší u pacientů se sepsí a autoimunitním onemocněním.
Použití inhibitorů toll-like receptorové cesty
Objevení rozpoznávacích mechanismů vrozené imunity přineslo další možnosti, jak terapeuticky zasáhnout. Imunokompetentní stejně jako neimunokompetentní buňky mají na svém povrchu tzv. PRRs (Pattern recognition receptors – motivy rozpoznávající receptory), které jsou schopné rozeznat bakteriální motivy jednotlivých infekčních agens (PAMPs – Pathogen Associated Molecular Patterns). Jednou z nejdůležitějších skupin receptorů jsou toll-like receptory (TLRs – Toll-Like Receptors). Toll-like receptory jsou transmembránové receptory, které rozpoznávají celou řadu molekul – LPS, peptidoglykan, bakteriální lipoproteiny a lipopeptidy, lipoteichoovou kyselinu [33, 34, 35, 36]. Aktivace těchto receptorů vede přes NF-κB a AP-1 k expresi genů spjatých se zánětlivou odpovědí [37]. TLR4 je odpovědný za rozpoznání lipopolysacharidu, který – jak již bylo zmíněno – je jedním z hlavních mediátorů sepse. Při infekci po iniciační fázi aktivace TLR 4 na non-imunokompetentních buňkách dochází k sekundární odpovědi s aktivací endoteliálních buněk, s produkcí adhezivních molekul, infiltrací makrofágů a zvýšené vaskulární permeabilitě [38]. Důsledkem je spuštění koagulační kaskády, porucha tkáňové perfuze a orgánové selhání [39]. Zabránění aktivace TLR je jednou z cest, jak zabránit aktivaci dějů zánětlivé reakce s jejími devastujícími účinky. Existuje řada látek blokujících interakci TLR s lipopolysacharidem, s pracovním označením CRX--526, E5531, E5564, TAK-242, nicméně jen u dvou z nich došlo k zahájení klinických zkoušek. Aktuálně probíhá III. fáze klinické studie s látkou E5564 (Eritoran), u TAK-242 byla studie v tomto roce přerušena. K vysvětlení podrobných mechanismů účinku odkazujeme na práce Czeislicka a Kaneka [40, 41].
Kortikosteroidy
Mechanismus účinku kortikosteroidů je komplexní. Kortikosteroidy se vážou na kortikosteroidní receptory, s nimiž vytvářejí aktivní komplex kortikosteroid-kortikosteroidní receptor (KS-KSR). Komplex KS-KSR se může přímo navázat na transkripční prozánětlivé faktory, jako jsou aktivační protein-1 (AP-1) nebo nukleární faktor-κB (NF-κB ), čímž se zamezí funkci těchto transkripčních faktorů a jejich dalšímu nepříznivému účinku. Hovoříme o nepřímém genomovém účinku kortikosteroidů [42, 43]. Přímý genomový účinek je spojen s proniknutím komplexu KS-KSR do jádra buňky, kde se váže na sekvence jaderné DNA, označené GRE (Glucocorticoid Response Elements). Výsledkem interakcí je vznik aktivačních nebo represorických proteinů, které modifikují strukturu chromatinu. Tyto proteiny způsobují aktivaci nebo inhibici transkripčního procesu [44, 45]. Negenomový mechanismus účinku je zprostředkován interakcí kortikosteroidního receptoru asociovaného s membránou a tzv. druhého posla [46, 47].
V minulém století byla 70. a 80. léta ve znamení prací dokazujících nepříznivý vliv podání vysokých dávek kortikosteroidů na mortalitu pacientů se septickým šokem [48, 49]. Průlom způsobila práce Annana, která prokázala příznivý vliv podání substituční dávky kortikosteroidů u pacientů s časným těžkým septickým šokem a prokázánou deficiencí produkce endogenních kortikosteroidů [50]. Závěry Annanovy studie nepotvrdila studie Corticus, ve které byl naopak příznivý efekt podání systémových kortikosteroidů zpochybněn, respektive jejich podání přineslo více nežádoucích vedlejších účinků [51]. Ani v současnosti dostupná data neumožňují formulovat jednoznačně roli steroidů v léčbě sepse, respektive septického šoku, a převažuje shoda nad nutností dalších kontrolovaných studií [52, 53, 54]. Recentní doporučení zmiňují podání substitučních dávek kortikosteroidů u pacientů se septickým šokem, kteří nereagují na adekvátní tekutinovou resuscitaci a podání vazopresorů (2C).
Imunostimulační terapie sepse
Růstové faktory
Pacienti se sepsí jsou často ve stavu imunosuprese, která funkčně znamená sníženou produkci prozánětlivých cytokinů při přítomnosti endotoxinu nebo intaktních bakterií [55, 56]. Postižená je rovněž buňkami zprostředkovaná imunita se sníženou odpovědí na endotoxin, sníženou proliferační odpovědí, sníženou expresí HLA-DR na monocytech [57, 58, 59, 60]. Granulocyty-kolonie stimulující faktor (G-CSF), granulocyty-makrofágy-kolonie stimulující faktor (GM-CSF) a IFN γ jsou představitelé imunostimulační terapie. G-CSF byl primárně použit pro pacienty s neutropenií, aktuální imunosupresí a vysokým rizikem infekce po transplantacích kmenových buněk nebo antitumorózní terapii. G-CSF má významné protizánětlivé účinky a zvyšuje bakteriální clearance. Z uvedených důvodů vycházelo jeho použití u pacientů se sepsí, ale klinické studie neprokázaly efekt na mortalitu [51, 62]. Studie naznačují, že efekt G-CSF by mohl rozdílným způsobem souviset s místem infekce a etiologickým agens. Zatímco u extravaskulární sepse s lokalizovaným ložiskem infekce působil G-CSF pozitivně, u sepse navozené intravaskulárním podáním infekčního agens byl bez efektu [63]. Ještě zásadnější rozdíl byl vázán na druh infekčního agens [64]. GM-CSF stimuluje produkci a funkci neutrofilů i monocytárních granulocytů. Výsledky klinických studií jsou nekonzistentní. Studie amerických autorů neprokázaly benefit této terapie na mortalitu pacientů s těžkou sepsí, ale určitý efekt byl zaznamenán na funkční parametry imunitního systému – zvýšená exprese adhezivních molekul, zvýšená exprese HLA-DR na monocytech [65, 66]. Studie s podáním GM-CSF u chirurgických pacientů s netraumatickou abdominální sepsí zaznamenala efekt v nižším počtu hospitalizačních dnů, menším počtu infekčních komplikací a nižších finančních výdajích [67]. Zcela recentní multicentrická studie prokázala efekt GM-CSF na zlepšení funkční schopnosti imunitního systému [68].
Obdobná situace je u podání GM-CSF u novorozenců a dětí. Studie Bilgina et al. prokázala efekt podání GM-CSF na mortalitu neutropenických dětí [69], recentní metaanalýzy toto nepotvrdily [70, 71].
Interferon-γ vykazuje celou řadu antibakteriálních účinků ovlivněním funkční schopnosti imunitního systému – zvyšuje expresi HLA-DR molekuly a Fc receptoru na monocytech, podporuje funkci NK buněk, aktivuje monocyty s makrofágy ve smyslu baktericidní aktivity [72, 73]. Klinické studie prokázaly účinek ve smyslu zlepšení těchto jeho funkcí, stejně jako účinek na snížení mortality [74, 75]. Nicméně do širšího klinického použití se dosud nedostal.
Farmaky navozená imunomodulace u kriticky nemocných
V intenzivní péči často používána farmaka mohou mít významný vliv na funkci imunitního systému a znalost těchto účinků by měla být vždy součástí indikační rozvahy před jejich použitím v individuální klinické situaci. Imunomodulační účinky jsou popsány mj. u látek používaných k analgosedaci, antibiotik, statinů a nesteroidních antiflogistik. Potenciální efekt může mít rovněž jakákoliv farmakologická manipulace s parasympatikem, známá je dnes tzv. cholinergic-anti-inflammatory pathway a stimulace n. vagus je spojována s oslabením cytokinové produkce a zlepšením přežívání v experimentálním modelu sepse, hemoragického šoku, ischémie-reperfuze a řady dalších modelů kriticky nemocných [76].
Účinek opioidů na imunitní systém je přímý a nepřímý. Přímý efekt je zprostředkován přes opioidní receptory, zejména typ „μ3“ na povrchu imunologicky aktivních buněk (neutrofily, monocyty/makrofágy a lymfocyty), vazba na zmíněný receptor indukuje imunosupresi zejména cestou nukleárního faktoru kappa B. Výsledkem je redukce fagocytózy a chemotaxe, zvýšení apoptózy, snížení adherence, snížení proliferace T lymfocytů a tvorby protilátek. Nejsilnější vazbu na receptor „µ3“ mají morfin a jeho metabolit morfin-6-glukuronid, novější opioidy typu fentanyl či sufentanil mají afinitu minimální. Nepřímý efekt opioidů je vykládán jejich vlivem na zvýšení tvorby kortikotropinu vyplavujícího hormonu, adrenokortikotropinu a kortisolu [77, 78]. Propofol v koncentracích, kterých je dosaženo při běžném dávkování v režimech sedace, se ukazuje in vitro jako velmi potentní látka z pohledu suprese chemotaxe, fagocytózy a výrazně snižuje schopnost organismu zbavovat se bakterií; benzodiazepiny mají obdobný efekt [79].
Experimentální přístupy imunomodulační léčby
Kromě výše uvedených možností imunomodulační terapie, kde klinické studie již proběhly nebo aktuálně probíhají, se v experimentu aplikují další přístupy. Jejich uplatnění vychází z poznatků imunopatogeneze sepse, krátký přehled je uveden v tabulce 1.
1. Přehled imunomodulačních terapií 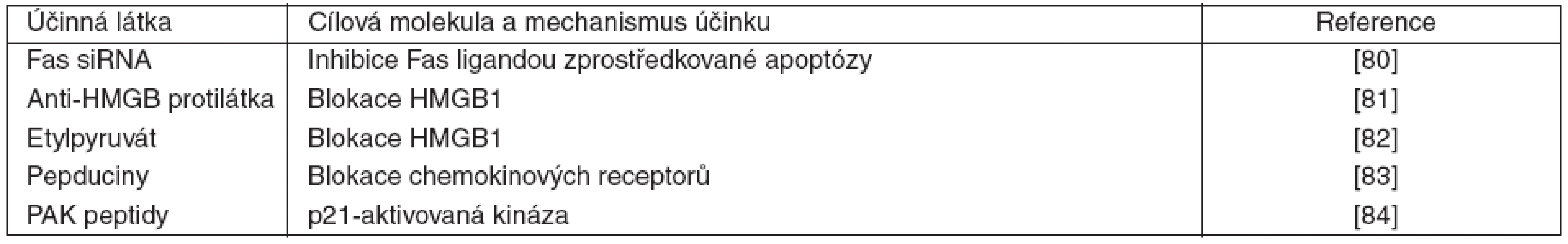
Závěr
Imunomodulační terapie sepse dosud zdaleka nenaplnila očekávání, která do ní byla vkládána. Z velké míry to souvisí:
- s nedostatečným poznáním imunopatogeneze sepse;
- s nedostatečnou diagnostikou aktuálního stavu imunity u septických pacientů.
Nedávno uveřejněné studie prokázaly aktivaci cytomegaloviru a herpes simplex viru u kriticky nemocných [85, 86]. O čem tato skutečnost svědčí? O tom, že dva momenty imunopatogeneze sepse, které jsou ve zdánlivém rozporu, tzn. hyperzánětlivý stav a stav imunoparalýzy, se v klinickém kontextu spojí v jedno – imunosupresi, která je u těchto pacientů dominantní. Je to zásadní rozdíl oproti jiným onemocněním chronického charakteru, která jsou rovněž spjata s přestřelující zánětlivou odpovědí (např. autoimunitní onemocnění), kde však protizánětlivá léčba je léčbou imunosupresivní a je schopna působit terapeuticky příznivě. Příkladem je léčba kortikosteroidy nebo inhibitory TNF. Je to i v souladu s dosavadními výsledky léčby kortikosteroidy u sepse, kde jejich vysoké imunosupresivní dávky vedly ke zhoršení mortality, zatímco dávky substituční prokázaly určitý prospěch. Podporu tomuto tvrzení dokládá nedávná studie Kaufmanna, ve které „stresové“ dávky hydrokortizonu vedly ke zlepšení funkční schopnosti neutrofilů u pacientů se septickým šokem [87]. Velké rezervy má diagnostika u septických pacientů – zjištění aktuálního stavu imunity a nalezení parametrů, které budou schopny pacienty identifikovat a indikovat imunomodulační terapii. Ovlivnění průběhu sepse na základě parametrů vrozené imunity (např. nukleotidové polymorfismy cytokinů) je doloženo řadou klinických studií [88, 89]. Modulace intenzity zánětu, kdy je ovlivňována zejména oblast vrozené imunity, může být velmi riziková, jak prokazuje recentní studie použitím anti-CD28 monoklonální protilátky [90]. Parametry adaptivní imunity mohou být velice prospěšné v diagnostice jednotlivých „fenotypů“ pacientů se sepsí. Nedávné studie dokládájí, že fenotyp leukocytů může být markerem pro stratifikaci pacientů se sepsí a septickým šokem [91, 92, 93]. Samostatnou kapitolu představuje problematika apoptózy. Apoptóza představuje jeden ze základních mechanismů navození imunosuprese u septických nemocných [94, 95] a její ovlivnění je velice nadějným terapeutickým přístupem [96, 97]. Naprosto unikátní studie potvrdila aplikovatelnost poznatků o apoptóze z experimentálního na lidský model [98]. Zatímco možností protizánětlivé terapie je celá řada, imunostimulační terapie je velice omezená. S výjimkou G-CSF, GM-CSF a interferonu-γ nemáme k dispozici jiný léčebný preparát. V ryze českých specifických podmínkách je k dispozici leukocytární dialyzát, který však mortalitu sepse neovlivnil [99]. Humorální imunitu jsme schopni ovlivnit podáním IVIG, ale imunodeficience v buňkami zprostředkované imunitě je dominantní [100]. Perspektivou by mohla být imunomodulační terapie na několika úrovních – např. zasažení rozpoznávacích mechanismů a snížení intenzity zánětu na straně jedné, imunostimulační terapie na straně druhé.
Imunomodulační terapie u pacientů se sepsí tak zůstává nadále otevřenou oblastí, kde je mnohem více otázek než jasných odpovědí. Je zřejmé, že jednoduchá diagnostika k posouzení aktuálního stavu funkce imunitního systému organismu doposud není optimální, stejně tak jako bezpečný a účinný způsob terapie, kterým bychom dosáhli modulace imunitních mechanismů podle aktuální potřeby daného pacienta.
Seznam zkratek:
AP-1 – aktivační protein 1 (activator protein 1)
DNA – deoxyribonukleová kyselina
G-CSF – faktor stimulující kolonie granulocytů (granulocyte-colony stimulating factor)
GM-CSF – faktor stimulující kolonie granulocytů a makrofágů (granulocyte-monocyte colony-stimulating factor)
GRE – glucocorticoid response elements
IFN – interferon
IL – interleukin
IL1-RA – agonista receptoru pro interleukin 1
IVIG – intravenózní imunoglobuliny
LPS – lipopolysacharid
NF-κB – jaderný faktor kappa B (nuclear factor-ĸB)
PHA – fytohemaglutinin (phytohemaglutinin)
PRRs – pattern recognition receptors (motivy rozpoznávající receptory)
TLRs – toll-like receptory
TNF-α – faktor nekrotizující tumory alfa (tumor necrosis factor-alfa)
TNFR – receptor pro faktor nekrotizující nádory
Došlo dne 8. 10. 2009.
Přijato dne 1. 11. 2009.
Adresa pro korespondenci:
MUDr. Miroslav Průcha, Ph.D.
Oddělení klinické biochemie, hematologie a imunologie, Nemocnice Na Homolce, Praha
Roentgenova 2150 00 Praha 5e-mail: miroslavprucha@gmail.com
Sources
1. Argus, D. C., Linde-Zwirble, W. T., Lidicker, J. et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit. Care Med., 2001, 29, p. 1303–1310.
2. Černý, V., Novák, I., Šrámek, V. Prevalence těžké sepse v České republice – prospektivní multicentrická jednodenní studie. Anest. Intenziv. Med., 2003, 14, p. 218–222.
3. Hotchkiss, R. S., Karl, I. E. The pathophysiology and treatment of sepsis. N. Engl. J. Med., 2003, 348, p. 138–150.
4. Ziegler, E. J., McCutchan, J. A., Fierer, J., Glauser, M. P. et al. Treatment of gram-negative bacteremia and shock with human antiserum to a mutant Escherichia coli. N. Engl. J. Med., 1981, 307, p. 1225-1230.
5. Freeman, B. D., Natanson, C. Anti-inflammatory therapies in sepsis and septic shock. Expert Opin. Investig. Drugs, 2000, 9, p. 1651–1663.
6. Ziegler, E. J., Fisher, C. J. Jr., Sprung, C. L. et al. Treatment of gram-negative bacteremia and septic shock with HA-1A human monoclonal antibody against endotoxin. A randomized, double-blind, placebo-controlled trial. The HA-1A Sepsis Study Group. N. Engl. J. Med., 1991, 14, p. 429–436.
7. McCloskey, R. V., Straube, R. C., Sanders, C. et al. Treatment of septic shock with human monoclonal antibody HA-1A. A randomized, double-blind, placebo-controlled trial. CHESS Trial Study Group. Ann. Intern. Med. 1994, 121, p.1–5.
8. Koch, T., Helller, S., Weber, K. et al. Effekte von humanem i.v. Immunglobulin auf die Bakterien-Clearence und Granulozytenfunktion bei Endotoxinamie. Anasthesiol. Intensivmed. Notfallmed. Schmerzther., 1997, 32, p. 420–425.
9. Trautmann, M., Held, T. K., Susa, M. et al. Bacterial lipopolysaccharide (LPS) - specific antibodies in commercial human immunoglobulin preparations: superior antibody content of an IgM-enriched product. Clin. Exp. Immunol., 1998, 111, p. 81–90.
10. Wagner, D. R., Heinrich, D. Influence of polyclonal immunoglobulins on the polymorphonuclear leukocyte response to lipopolysaccharide of Salmonella enteritidis as measured with luminol-enhanced chemiluminiscence. Infect. Immun., 1994, 62, p. 4320–4324.
11. Menezes, M. C. S., Benard, G., Sato, M. N. et al. In vitro inhibitory activity of tumor necrosis factor alpha and interleukin--2 of human immunoglobulin preparations. Int. Arch. Allergy Immunol., 1997, 114, p. 323–328.
12. Kekow, J., Reinhold, D., Pap, T., Ansorge, S. Intravenous immunoglobulins and transforming growth factor b. Lancet, 1998, 351, p. 184–185.
13. Laupland, K. B., Kirkpatrick, A. W., Delaney, A. Polyclonal intravenous immunoglobulin for the treatment of severe sepsis and septic shock in critically ill adults: A systematic review and meta-analysis. Crit. Care Med., 2007, 35, p. 2686–2692.
14. Turgeon, A. F., Hutton, B., Fergusson, D. A. et al. Meta-analysis: intravenous immunoglobulin in critically ill adult patients with sepsis. Ann. Intern. Med., 2007, 146, p. 193–203.
15. Kreymann, K. G., de Heer, G., Nierhaus, A., Kluge, S. Use of polyclonal immunoglobulins as adjunctive therapy for sepsis or septic shock. Crit. Care Med., 2007, 35, p. 2677–2685.
16. Werdan, K., Pilz, G., Bujdoso, O., Fraunberger, P. et al. Score-Based Immunoglobulin Therapy of Sepsis (SBITS) Study Group: Score-based immunoglobulin G therapy of patients with sepsis: the SBITS study. Crit. Care Med., 2007, 35, p. 2693–2701.
17. Dellinger, R. P., Levy, M. M., Carlet, J. M. et al. Surviving Sepsis Campaign: International guidelines for management of severe sepsis and septick shock: 2008. Crit. Care Med., 2008, 36, p. 296–326.
18. Fong, Y., Tracey, K. J., Moldawer, L. L. et al. Antibodies to cachectin/tumor necrosis factor reduce interleukin 1 beta and interleukin 6 appearance during lethal bacteremia. J. Exp. Med., 1989, 170, p. 1627–1633.
19. Remick, D. G., Larrick, J., Kunkel, S. L. Tumor necrosis factor-induced alterations in circulating leukocyte populations. Biochem. Biophys. Res. Commun., 1986, 141, p. 818–824.
20. Tracey, K. J., Beutler, B., Lowry, S. F. et al. Shock and tissue injury induced by recombinant human cachectin. Science, 1986, 234, p. 470 – 474.
21. Tracey, K. J., Fong, Y., Hesse, D. G., Manogue, K. R. et al. Anti-cachectin/TNF monoclonal antibodies prevent septic shock during lethal bacteraemia. Nature,1987, 330, p. 662–664.
22. Arndt, P., Abraham, E. Immunological therapy of sepsis: experimental therapies. Int. Care Med., 2001, 27, Suppl 1: p. 104–115.
23. Lorente, J. A., Marshall, J. C. Neutralization of tumor necrosis factor in preclinical models of sepsis. Shock, 2005, 24, Suppl 1, p. 107–119.
24. Stashenko, P., Dewhirst, F. E., Peros, W. J., Kent, R. L., Ago, J. M. Synergistic interactions between interleukin 1, tumor necrosis factor, and lymphotoxin in bone resorption. J. Immunol., 1987, 138, p. 1464–1468.
25. Waage, A., Espevik, T. Interleukin 1 potentiates the lethal effect of tumor necrosis factor alpha/cachectin in mice. J. Exp. Med., 1988, 167, p.1987–1992.
26. Fisher, C. J. Jr., Slotman, G. J., Opal, S. M. et al. IL-1RA Sepsis Syndrome Study Group. Initial evaluation of human recombinant interleukin-1 receptor antagonist in the treatment of sepsis syndrome: a randomized, open-label, placebo-controlled multicenter trial. Crit. Care Med., 1994, 22, p. 12–21.
27. Fisher, C. J. Jr., Dhainaut, J. F., Opal, S. M. et al. Recombinant human interleukin 1 receptor antagonist in the treatment of patients with sepsis syndrome. Results from a randomized, double-blind, placebo-controlled trial. Phase III rhIL-1ra Sepsis Syndrome Study Group. JAMA, 1994, 271, p. 1836–1843.
28. Opal, S. M., Fisher, C. J. Jr., Dhainaut, J. F. et al. Confirmatory interleukin-1 receptor antagonist trial in severe sepsis: a phase III, randomized, double-blind, placebo-controlled, multicenter trial. The Interleukin-1 Receptor Antagonist Sepsis Investigator Group. Crit. Care Med., 1997, 25, p. 1115–1124.
29. Eichacker, P. Q., Parent, C., Kalil, A. et al. Risk and the efficacy of antiinflammatory agents: retrospective and confirmatory studies of sepsis. Am. J. Respir. Crit. Care Med., 2002, 166, p. 1197–1205.
30. Echtenacher, B., Urbaschek, R., Weigl, K. et al. Treatment of experimental sepsis-induced immunoparalysis with TNF. Immunobiology, 2003, 208, p. 381–389.
31. Bongartz, T., Sutton, A. J., Sweeting, M. J., et al. Anti-TNF antibody therapy in rheumatoid arthritis and the risk of serious infections and malignancies: systematic review and meta-analysis of rare harmful effects in randomized controlled trials. JAMA, 2006, 295, p. 2275–2285.
32. Wallis, R. S. Infectious complications of tumor necrosis factor blockade. Curr. Opin. Infect. Dis., 2009, 22, p. 403 – 409.
33. Beutler, B. Inferences, questions and possibilities in toll-like receptor signaling. Nature, 2004, 430, p. 257–263.
34. Levitz, S. M. Interactions of Toll-like receptors with fungi. Microbes Infect., 2004, 6, p. 1351–1355.
35. Takeda, K. Evolution and integration of innate immune recognition systems: the Toll-like receptors. J. Endotoxin Res., 2005, 11, p. 51–55.
36. Ulevitch, R. J. Therapeutics targeting the innate immune system. Nat. Rev. Immunol., 2004, 4, p. 512–520.
37. Doyle, S. L., O’Neill, L. A. Toll-like receptors: from the discovery of NF kappaB to new insights into transcriptional regulations in innate immunity. Biochem. Pharmacol., 2006, 72, p. 1102–1113 .
38. Bosshart, H., Heinzelmann, M. Targeting bacterial endotoxin: two sides of a coin. Ann. N. Y. Acad. Sci., 2007, 1096, p. 1–17 .
39. Wendel, M., Paul, R., Heller, A. L. Lipoproteins in inflammation and sepsis. II. Clinical aspects. Int. Care Med., 2007, 33, p. 25–35.
40. Czeslick, E., Struppert, A., Simm, A., Sablotzki, A. E5564 (Eritoran) inhibits lipopolysaccharide-induced cytokine production in human blood monocytes. Inflamm. Res., 2006, 55, p. 511–515.
41. Kaneko, K., Ueda, R., Kawata, T. et al. LPS binding protein does not participate in the pharmacokinetics of E5564. J. Endotoxin Res., 2004, 10, p. 185–189.
42. De Bosscher, K., Van den Berghe, W., Haegeman, G. The interplay between the glucocorticoid receptor and nuclear factor-kappaB or activator protein-1: molecular mechanisms for gene repression. Endocr. Rev., 2003, 24, p. 488–522.
43. McKay, L. I., Cidlowski, J. A. Molecular control of immune/inflammatory responses: interactions between nuclear factor-kappa B and steroid receptor-signaling pathways. Endocr. Rev., 1999, 20, p. 435–459.
44. Hebbar, P. B., Archer, T. K. Chromatin remodeling by nuclear receptors. Chromosoma, 2003, 111, p. 495–504.
45. Nagaich, A. K., Rayasam,G. V., Martinez, E. D. et al. Subnuclear trafficking and gene targeting by steroid receptors. Ann. N. Y. Acad. Sci., 2004, 1024, p. 13–20.
46. Hafezi-Moghadam, A., Simonini, T., Yang, Z. et al. Acute cardiovascular protective effects of corticosteroids are mediated by non-transcriptional activation of endothelial nitric oxide synthase. Nat. Med., 2002, 8, p. 473–479.
47. Cato, A. C., Nestl, A., Mink, S. Rapid actions of steroid receptors in cellular signaling pathways. Sci. STKE, 2002, 138, RE9.
48. Bone, R. C., Fischer, C. J. Jr, Clemmer, T. P. et al. Early methylprednisolone treatment for septic syndrome and the adult respiratory distress syndrome. Chest, 1987, 92, p. 1032–1036.
49. Cronin, L., Cook, D. J., Carlet, J. et al. Corticosteroid treatment for sepsis: a critical appraisal and meta-analysis of the literature. Crit. Care Med.,1995, 23, p. 1430–1439.
50. Annane, D., Seville, V., Charpentier, C. et al. Effect of treatment with low doses of hydrocortisone and fludrocortisone on mortality in patients with septic shock. JAMA, 2002, 288, p. 862–871.
51. Sprung, C. L., Annane, D., Keh, D. et al. CORTICUS Study Group. Hydrocortisone therapy for patients with septic shock. N. Engl. J. Med., 2008, 358, p. 111–124.
52. Bauer,W., Ball, J., Grounds, M. Unanswered questions from Corticus and pragmatic suggestions. Crit. Care, 2008, 12, p. 426.
53. Marik, P.E. Critical illness-related corticosteroid insufficiency. Chest, 2009, 135, p. 181–193.
54. Mason, P. E., Al-Khafaji, A., Milbrandt, E. B. et al. CORTICUS: The end of unconditional love for steroid use? Crit. Care, 2009, 13, p. 309.
55. Ertel, W., Kremer, J. P., Kenney, J. et al. Downregulation of proinflammatory cytokine release in whole blood from septic patients. Blood, 1995, 85, p. 1341–1347.
56. Majetschak, M., Krehmeier, U., Bardenheuer, M. et al. Extracellular ubiquitin inhibits the TNF-alpha response to endotoxin in peripheral blood mononuclear cells and regulates endotoxin hyporesponsiveness in critical illness. Blood, 2003, 101, p. 1882–1890.
57. Sedláčková, L., Průcha, M., Dostál, M. Imunologické monitorování sepse průtokovou cytometrií – kvantitativní stanovení exprese HLA-DR na monocytech a CD64 na granulocytech. Epidemiol. Mikrobiol. Imunol., 2005, 54, s. 54–61.
58. Decker, D., Schondorf, M., Bidlingmaier, F. et al. Surgical stress induces a shift in the type-1/type-2 T-helper cell balance, suggesting down-regulation of cell-mediated and up-regulation of antibody-mediated immunity commensurate to trauma. Surgery, 1996, 19, p. 316–325.
59. Dadák, L., Štouračová, M., Štětka, P., Kuklínek, P., Šrámek, V. Rozšířený imunologický profil v prvních dnech pobytu a prognóza nemocných dlouhodobě hospitalizovaných na JIP. Anest. Intenziv. Med., 2007, 18, s. 164–169.
60. Průcha, M., Zazula, R., Kavka, B., Hyánek, J. Imunoparalýza a infekční komplikace u kriticky nemocných. Anest. neodklad. Péče, 2001, 12, s. 320–323.
61. Nelson, S., Belknap, S. M., Carlson, R. W. et al. A randomized controlled trial of filgrastim as an adjunct to antibiotics for treatment of hospitalized patients with community-acquired pneumonia. CAP Study Group. J. Infect. Dis., 1998, p. 1781075–1781080.
62. Root, R. K., Lopato, R. F., Patrick, W. et al. Pneumonia Sepsis Study Group. Multicenter, double-blind, placebo-controlled study of the use of filgrastim in patients hospitalized with pneumonia and severe sepsis. Crit. Care Med., 2003, 31, p. 367–673.
63. Sevansky, J. E., Parent, C., Cui, X. et al. Granulocyte colony-stimulating factor has differing effects comparing intravascular versus extravascular models of sepsis. J. Trauma, 2004, 57, p. 618–625.
64. Karzai, W., von Specht, B. U., Parent, C. et al. G-CSF during Escherichia coli versus Staphylococcus aureus pneumonia in rats has fundamentally different and opposite effects. Am. J. Respir. Crit. Care Med., 1999, 159, p. 1377–1382.
65. Presneill, J. J., Hartus, T., Stewart, A. G. et al. A randomized phase II trial of granulocyte-macrophage colony-stimulating factor therapy in severe sepsis with respiratory dysfunction. Am. J. Respir. Crit. Care Med., 2002, 166, p. 138–143.
66. Rosenbloom, A. J., Linden, P. K., Dorrance, A. et al. Effect of granulocyte-monocyte colony-stimulating factor therapy on leukocyte function and clearance of serious infection in nonneutropenic patients. Chest, 2005, 127, p. 2139–2150.
67. Orozco, H., Arch, J., Medina-Franco, H. et al. Molgramostim (GM-CSF) associated with antibiotic treatment in nontraumatic abdominal sepsis: a randomized, double-blind, placebo - -controlled clinical trial. Arch. Surg., 2006, 141, p. 150–153.
68. Neosel, C., Schefold, J. C., Pschowski, R. et al.GM-CSF to Reverse Sepsis-associated Immunosuppression: A Double-blind Randomized Placebo-controlled Multicenter Trial. Am. J. Respir. Crit. Care Med., 2009. doi:10.1164/rccm.200903 - -0363OC.
69. Biotin, K., Yaramiş, A., Naspílat, K. et al. A randomized trial of granulocyte-macrophage colony-stimulating factor in neonates with sepsis and neutropenia. Pediatrics, 2001, 107, p. 36–41.
70. Carr, R., Modi, N., Doré, C. G-CSF and GM-CSF for treating or preventing neonatal infections. Cochrane Database Syst. Rev., 2003, 3, CD003066.
71. Carr, R., Brocklehurst, P., Doré, C. J., Modi, N. Granulocyte-macrophage colony stimulating factor administered as prophylaxis for reduction of sepsis in extremely preterm, small for gestational age neonates (the PROGRAMS trial): a single-blind, multicentre, randomised controlled trial. Lancet, 2009, 373, p. 226–233.
72. Sano, C., Sato, K., Shimizu, T. et al. The modulating effects of proinflammatory cytokines interferon-gamma (IFN-γ) and tumour necrosis factor-alpha (TNF-α), and immunoregulating cytokines IL-10 and transforming growth factor-beta (TGF-β), on anti-microbial activity of murine peritoneal macrophages against Mycobacterium avium-intracellulare complex. Clinical and Experimental Immunology, 1999, 115, p. 435–442.
73. Matsumura, H., Onozuka, K., Terada, Y. et al. Effect of murine recombinant interferon-gamma in the protection of mice against Salmonella. Int. J. Immunopharmacol., 1990, 12, p. 49–56.
74. Nakos, G., Malamou-Mitsi, V. D., Lachtana, A. et al. Immunoparalysis in patients with severe trauma and the effect of inhaled interferon-gamma. Crit. Care Med., 2002, 30, p. 1488–1494.
75. de Metz, J., Romijn, J. A., Endert, J. A. et al. Interferon - -gamma increases monocyte HLA-DR expression without effects on glucose and fat metabolism in postoperative Patiens. J. Appl. Physiol., 2004, 96, p. 597–603.
76. Johnston, G. R., Webester, N. R. Cytokines and the immunomodulatory function and the vagus nerve. Br. J. Anaesth., 2009, 102, p. 453–462.
77. Cabot, P. J. Immune derived opioid and peripheral antinociception. Clin. Exper. Pharmacol. Physiol, 2001, 28, p. 230–232.
78. Sharp, B. M., Roy, S., Bidlack, J. M. Evidence of opioid receptors on cells involved in hot defense and the immune system. J. Neuroimmunol., 1998, 83, p. 45–56.
79. Galley, H. F., Dubbels, A. M., Webster, N. R. The effect of midazolam and propofol in interleukin-8 fdrom human polymorphonuclear leukocytes. Anesth. Analg, 1998, 86, p. 1289–1293.
80. Wesche-Soldato, D. E., Chung, C. S., Lomas-Neira, J. et al. In vivo delivery of caspase-8 or Fas siRNA improves the survival of septic mice. Blood, 2005, 106, p. 2295–301.
81. Yang, H., Ochani, M., Li, J. et al. Reversing established sepsis with antagonists of endogenous high-mobility group box 1. Proc. Natl. Acad. Sci. U S A, 2004, 101, p. 296–301.
82. Ulloa, L., Ochani, M., Yang, H. et al. Ethyl pyruvate prevents lethality in mice with established lethal sepsis and systemic inflammation. Proc. Natl. Acad. Sci. U S A, 2002, 99, p. 12351–12356.
83. Kaneider, N. C., Agarwal, A., Leger, A. J,, Kuliopulos, A. Reversing systemic inflammatory response syndrome with chemokine receptor pepducins. Nat. Med. , 2005, 11, p. 661–665.
84. Reutershan, J., Stockton, R., Zarbock, A. et al. Blocking p21-activated kinase reduces lipopolysaccharide-induced acute lung injury by preventing polymorphonuclear leukocyte infiltration. Am. J. Respir. Crit. Care Med., 2007, 175, p. 1027–1035.
85. Limane, A. P., Kirby, K. A., Rubenfeld, G. D. et al. Cytomegalovirus reactivation in critically ill immunocompetent patients. JAMA, 2008, 300, p. 413–422.
86. Luyt, C. E., Combes, A., Deback, C. et al. Herpes simplex virus lung infection in patients undergoing prolonged mechanical ventilation. Am. J. Respir. Crit. Care Med., 2007, 175, p. 935–942.
87. Kaufmann, I., Briegel, J., Schliephake, F. et al. Stress doses of hydrocortisone in septic shock: beneficial effects on opsonization-dependent neutrophil functions. Intensive Care Med., 2008, 34, p. 344–349.
88. Michálek, J., Světliková, P., Fedora, M. et al. Interleukin-6 gene variants and the risk of sepsis development in children. Hum. Immunol., 2007, 68, p. 756–760.
89. Průcha, M., Zazula, R., Peková, S. Genomic polymorphism and sepsis – is there a reason for optimism? Prague Med. Rep., 2008, 109, p. 113–126.
90. Suntharalingam, G., Perry, M. R., Ward, S. et al. Cytokine storm in a phase 1 trial of the anti - CD28 monoclonal antibody TGN1412. N. Engl. J. Med., 2006, 355, p. 1018–1028.
91. Monserrat, J., de Pablo, R., Prieto, A. et al. Using surface molecule expression on lymphocytes to classify septic shock patients. Crit. Care, 2009,13, p. 412.
92. Schwulst, S. J., Muenzer, J. T., Chany, K. C. et al. Lymphocyte phenotyping to distinguish septic from nonseptic critical illness. J. Am. Coll. Surg., 2008, 206, p. 335–342.
93. Holub, M., Klučková, Z., Helcl, M. et al. Lymphocyte subset numbers depend on the bacterial origin of sepsis. Clin. Microbiol. Infect., 2003, 9, p. 202–211.
94. Ayala, A., Lomas, J. L., Grutkoski, P. S., Chung, C. S. Pathological aspects of apoptosis in severe sepsis and shock? Int. J. Biochem. & Cell Biol., 2003, 35, p. 715–720.
95. Hotchkiss, R. S., Swanson, P. E., Freeman, B. D., Tinsley, K. et al. Apoptotic cell death in patients with sepsis, shock and multiple organ dysfunction. Crit. Care Med., 1999, 27, p. 1230–1251.
96. Wesche-Soldato, D. E., Stan, R. Z., Chung, CH. S., Ayala, A. The apoptotic pathway as a therapeutic target in sepsis. Curr. Drug Targets, 2007, 8, p. 493–500.
97. Schwulst, S. J., Muenzer, J. T., Peck-Palmer, O. M. et al. Bim siRNA decreases lymphocyte apoptosis and improves survival in sepsis. Shock, 2008, 30, p. 127–134.
98. Unsinger, J., McDonough, J. S., Shultz, L. D. et al. Sepsis-induced human lymphocyte apoptosis and cytokine production in “humanized” mice. J. Leukoc. Biol., 2009, 86, p. 219–227.
99. Šrámek, V., Dadák, L., Štouračová, M. et al. Immodin v léčbě imunoparalýzy nemocných v intenzivní péči. Vnitřní Lékařství, 2007, 53, s. 954–959.
100. Poehlmann, H., Schefold, J. C., Zuckermann-Becker, H. et al. Phenotype changes and impaired function of dendritic cell subsets in patients with sepsis: a prospective observational analysis. Crit. Care., 2009, 13, R119.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2010 Issue 1-
All articles in this issue
- Ultrasound guidance in regional anaesthesia and interventional pain management
- Cardiogenic shock with systemic inflammatory response: Complications of acute myocardial infarction
- Osmotherapy in neurosurgery – hyperosmolar mannitol or hypertonic saline?
- Immunotherapy of sepsis
- Invasive fungal disease: terminology, definition and therapeutic approach – 2009 update
- The development of paediatric anaesthesiology and intensive therapy in Prague
- Paediatric anaesthesia in Prague in the 1950s
- The history of paediatric anaesthesiology in Prague: Anaesthesiological procedures in paediatric stomatology
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Osmotherapy in neurosurgery – hyperosmolar mannitol or hypertonic saline?
- Ultrasound guidance in regional anaesthesia and interventional pain management
- The development of paediatric anaesthesiology and intensive therapy in Prague
- Immunotherapy of sepsis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

