-
Medical journals
- Career
Dávkování a způsob podání antibiotik u kriticky nemocných
Authors: Chytra Ivan; Štěpán Martin
Authors‘ workplace: Anesteziologicko-resuscitační klinika LF UK a Fakultní nemocnice v Plzni
Published in: Anest. intenziv. Med., 20, 2009, č. 1, s. 25-29
Category: Intesive Care Medicine - Review Article
Overview
Časná a adekvátní antibiotická léčba je u septických nemocných zásadním léčebným opatřením. V hyperdynamickém stadiu léčené sepse je při tekutinové resuscitaci zvýšená renální perfuze a clearance, což spolu se zvýšením permeability kapilár a s únikem tekutiny do intersticia vede ke zvětšení distribučního prostoru s významným rizikem poklesu účinné plasmatické hladiny antibiotik. Naproti tomu rozvoj orgánové dysfunkce (jater, ledvin) na podkladě sepse je spojen s poklesem eliminace antimikrobiálních látek a s rizikem jejich toxických účinků.
Pro optimalizaci antibiotické léčby je nutno znát jak farmakokinetické a farmakodynamické vlastnosti užívaných antibiotik, tak patofyziologické změny spojené s rozvojem sepse, jimiž mohou být tyto parametry ovlivněny.Klíčová slova:
antibiotická léčba – sepse – patofyziologické změny – farmakokinetické a farmakodynamické parametry – dávkování antibiotikÚvod
U nemocných se sepsí nebo septickým šokem je časná a adekvátní antibiotická léčba společně s ošetřením infekčního ložiska zásadním léčebným opatřením a měla by být zahájena do 1 hodiny po stanovení diagnózy sepse [1]. Patofyziologické změny spojené s rozvojem sepse ovlivňují distribuční objem a eliminaci podávaných antibiotik, a tím i jejich koncentraci v cílovém místě. Farmakodynamické parametry určující antibakteriální účinnost jsou u různých skupin antibiotik rozdílné, a navíc mohou být u kriticky nemocných změněny. Pro správnou volbu dávkovacího režimu, který povede k nejlepším léčebným výsledkům při minimalizaci rizika nežádoucích účinků a rozvoje rezistence, je znalost patofyziologických změn a základních farmakodynamických parametrů nezbytná.
Patofyziologické změny ovlivňující distribuci léků
Endotoxiny, jako lipopolysacharidy (gramnegativní patogeny), nebo peptidoglykan či kyselina lipoteichoová (grampozitivní patogeny), nebo mannan (kvasinky), stimulují produkci různých endogenních mediátorů, které přímo nebo nepřímo ovlivňují cévní endotel a vedou k vazokonstrikci nebo k vazodilataci s poruchou distribuce toku krve, k poškození endotelu a zvýšení kapilární permeability. Únik tekutiny do intersticia zvyšuje distribuční objem antibiotik a vede k poklesu jejich hladiny v séru. Léčba hypotenze při rozvoji sepse je spojena s velkým přívodem tekutin, často v kombinaci s vazopresory a inotropiky. V iniciální hyperdynamické fázi sepse je srdeční výdej zvýšen, a pokud ještě nedošlo k rozvoji orgánové dysfunkce, vede větší renální perfuze ke zvýšení kreatininové a lékové clearance [2, 3]. Větší distribuční objem se zvýšenou lékovou eliminací jsou hlavním důvodem odlišných požadavků na dávkování léků u nemocných v intenzivní a standardní péči [4].
Při progresi sepse dochází k depresi myokardu se snížením orgánové perfuze, která ve spojení s poruchou distribuce krevního toku vede k rozvoji orgánové dysfunkce včetně postižení ledvin a jater. Následné snížení lékové eliminace může vést k prodloužení plasmatického poločasu a k nárůstu plasmatické koncentrace antibiotika nebo jeho metabolitů (obr. 1).
Image 1. Schéma základních patofyziologických změn při sepsi a jejich vliv na farmakokinetiku 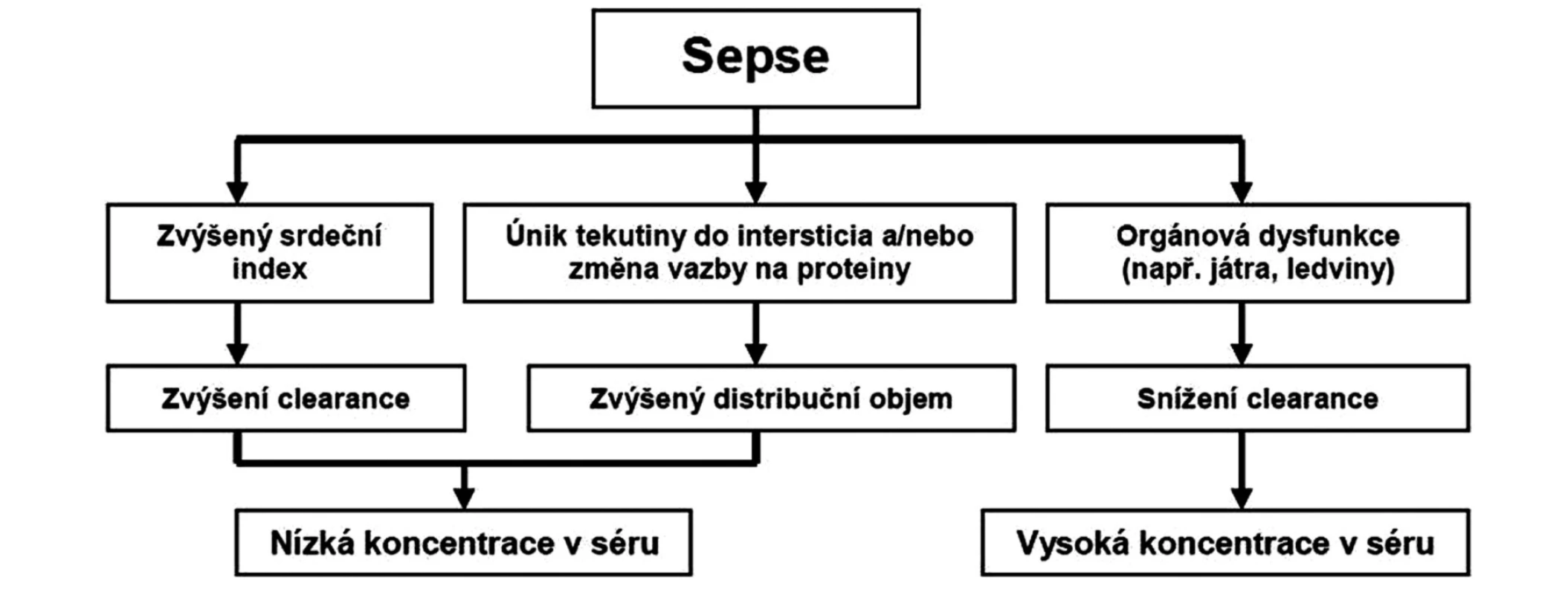
Další patofyziologické změny, které mohou u kriticky nemocných ovlivňovat farmakologickou charakteristiku antimikrobiálních látek, zahrnují změny v koncentraci albuminu, koncentraci proteinů akutní fáze, změny v pH krve a koncentraci bilirubinu a změny ledvinných a jaterních funkcí. Při renálním selhání s nutností užití mimotělních eliminačních metod (kontinuálních nebo intermitentních) je nutno dávkování upravit podle doporučení uvedených v řadě přehledných článků [5].
Po zvládnutí sepse dochází k regresi výše uvedených patofyziologických změn a dávkování antibiotika musí být upraveno v závislosti na aktuálním stavu orgánových funkcí a velikosti distribučního prostoru.
K dosažení nejlepšího výsledku léčby infekce je nezbytné optimalizovat možné interakce mezi pacientem, patogenem a antibiotikem. Dosažení tohoto cíle není jednoduché, protože doporučené režimy dávkování byly odvozeny ze studií se zdravými dobrovolníky nebo s pacienty, kteří nebyli v kritickém stavu. Navíc fyziologické poměry a stav orgánových funkcí se u nemocných v kritickém stavu mohou v krátkém časovém období významně měnit, proto je nutno stav nemocného opakovaně hodnotit a dávkování antibiotik upravovat.
Farmakokinetické parametry se vztahem ke změnám koncentrace antibiotika v souvislosti s daným časovým intervalem:
- distribuční objem (Vd)
- clearance
- poločas eliminace (t1/2)
- vrcholová koncentrace po aplikaci jednotlivé dávky (Cmax), minimální koncentrace během dávkovacího intervalu (Cmin)
- plocha pod křivkou sérové koncentrace v průběhu času (AUC)
Tyto faktory jsou užívány ke zjištění, zda bylo v cílové tkáni dosaženo plánované koncentrace antimikrobiální látky.
Farmakodynamické parametry určující účinnost antibiotika ve vztahu k farmakokinetickým faktorům:
- doba dávkovacího intervalu, po kterou je koncentrace antibiotika v séru vyšší než minimální inhibiční koncentrace (T > MIC)
- poměr vrcholové plasmatické koncentrace léku a MIC (Cmax/MIC)
- poměr plochy pod křivkou sérové koncentrace v průběhu 24hodinového intervalu a MIC (AUC24/MIC)
Velikost antimikrobiálního účinku na infekční agens je závislá na interakci mezi koncentrací antibiotika v místě infektu, na množství bakterií, na fázi bakteriálního růstu a na MIC patogenu. Změna jakéhokoliv z uvedených parametrů může ovlivnit léčebné výsledky.
Charakteristika jednotlivých tříd antibiotik
Z hlediska farmakodynamiky mají různé třídy antibiotik odlišnou charakteristiku antibakteriálního účinku. Tyto charakteristiky byly stanoveny na základě in vitro studií a popisují farmakokinetické modely, které reprezentují optimální baktericidní aktivitu. Skupina beta-laktamových antibiotik vykazuje nejlepší antibakteriální účinek v závislosti na době, po kterou je hladina antibiotika v séru vyšší než MIC (T > MIC). Naproti tomu u aminoglykosidů je pro optimální efekt rozhodující dosažení co nejvyšší plasmatické koncentrace (Cmax/MIC).
Charakteristika fluorochinolonů je komplexnější a pro nejlepší účinek je důležité jak dosažení co nejvyšší sérové koncentrace, tak plocha pod křivkou sérové koncentrace v průběhu času (AUC24/MIC) – obrázek 2.
Image 2. Farmakodynamické a farmakokinetické parametry antibiotik – časový průběh plasmatické koncentrace antibiotika po bolusové aplikaci 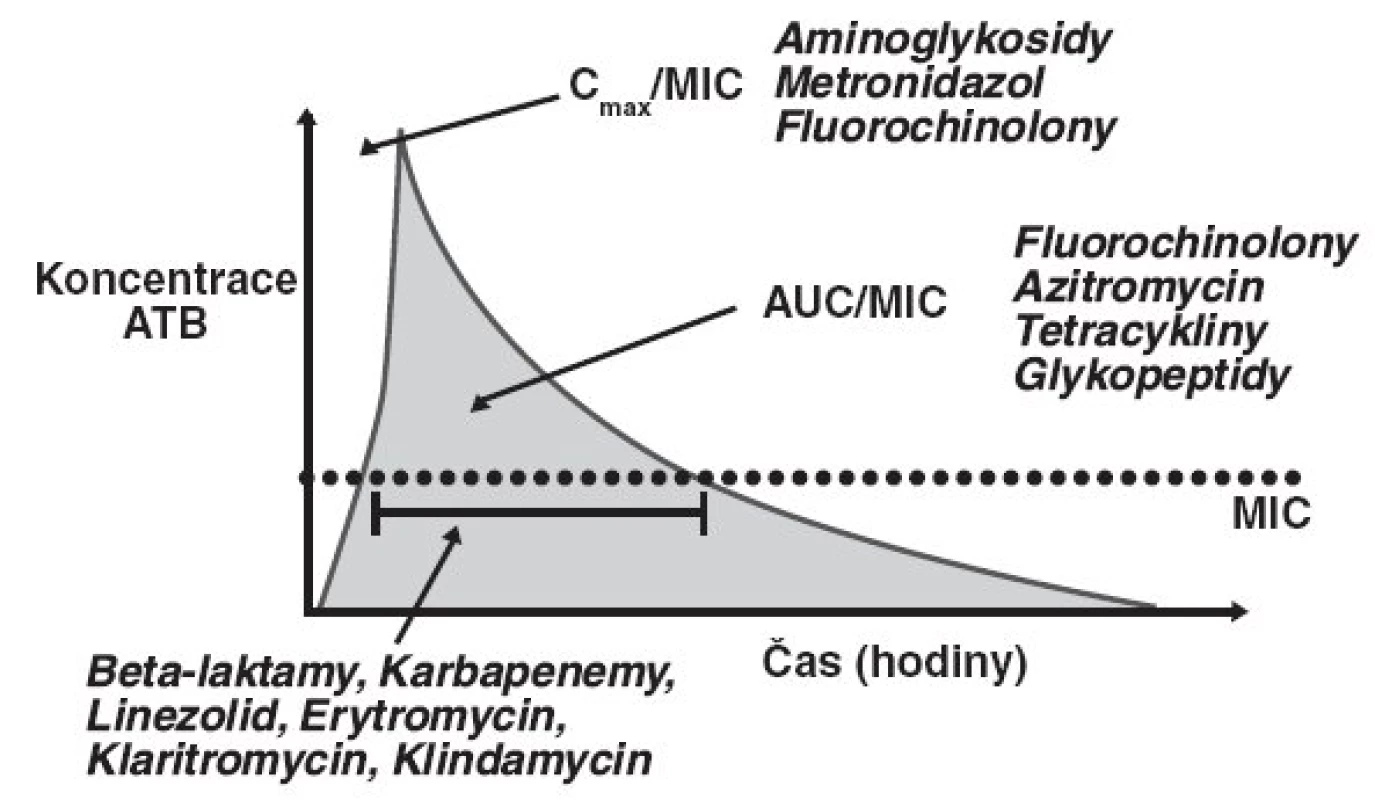
Postantibiotický efekt (PAE)
Většina antibiotik vykazuje určitý stupeň PAE. Podstatou PAE je pokračující suprese bakteriálního růstu i v období, kdy plasmatická hladina antibiotika klesne pod MIC patogenu. Beta-laktamová antibiotika vykazují mírný PAE proti grampozitivním mikroorganismům, ale ne proti gramnegativním patogenům (s výjimkou karbapenemů). Aminoglykosidy a fluorochinolony vykazují výrazný a prolongovaný PAE a jeho trvání je závislé na vrcholové koncentraci v séru. PAE se může měnit u stavů s alterovanou imunitou, jako je neutropenie, nebo u kriticky nemocných se sepsí [6].
Jednotlivé třídy antibiotik
Aminoglykosidy
Přibývá důkazů, že podání aminoglykosidů jednou denně je spojeno s nižší nefro - a ototoxicitou než aplikace stejného množství za 24 hodin ve více dávkách [7, 8, 9], proto je tento způsob aplikace aminoglykosidů preferován. Výjimkou je léčba bakteriální endokarditidy, kdy bývá doporučováno denní dávku aminoglykosidu aplikovat rozděleně ve 2–3 dávkách v průběhu 24 hodin. Pro snížení rizika toxických účinků je monitorování sérových hladin nezbytné. Plasmatický poločas aminoglykosidů se při zhoršení renálních funkcí prodlužuje, protože jsou vylučovány téměř nezměněny glomerulární filtrací. Jejich účinnost je závislá na velikosti vrcholové hladiny v séru. U nemocných v sepsi bez orgánové dysfunkce je clearance aminoglykosidů zvýšena. Zvýšení distribučního objemu koreluje se závažností stavu, který se může velmi rychle měnit, proto je dávkování aminoglykosidů v průběhu léčby velmi variabilní.
Iniciální dávka gentamicinu a tobramycinu by měla být 7 mg . kg-1 za 24 hodin (amikacinu 20–30 mg . kg-1), s následným monitorováním jejich hladin před podáním a po něm. Toto výchozí dávkování by mělo být dostatečné k dosažení poměru Cmax/MIC > 10, který zabezpečuje optimální antibakteriální účinek. Následné dávkování by mělo být individualizováno.
Pro gentamicin a tobramycin je doporučeno po aplikaci dosažení plasmatické koncentrace 8–12 mg . l-1, s poklesem na hodnoty nižší než 1–2 mg . l-1 před aplikací. Pro amikacin je doporučeno po podání dosáhnout vrcholové koncentrace v séru 25–35 mg . l-1, plasmatická hladina před podáním by měla být nižší než 4–8 mg . l-1. Při snížení renálních funkcí by měl být zachován poměr Cmax/MIC > 10 a prodloužen interval dávkování na 36–48 nebo i více hodin.
Beta-laktamová antibiotika
Skupina beta-laktamových antibiotik zahrnuje peniciliny, cefalosporiny, karbapenemy a monobaktamy. Při konvenčním způsobu dávkování dochází mezi jednotlivými bolusy k poklesu plasmatických koncentrací na nízké hodnoty. Vylučování beta-laktamů ledvinami je většinou lineární s kreatininovou clearance, proto při snížení renálních funkcí dochází k vzestupu jejich sérových hladin, s výjimkou oxacilinu a ceftriaxonu, na jejichž eliminaci se významně podílí biliární clearance. Antibakteriální účinek beta-laktamových antibiotik závisí na době, po kterou je hladina antibiotika v séru vyšší než MIC. Pokud koncentrace antibiotika poklesne pod tuto hranici, téměř okamžitě dochází k růstu zbývajících bakterií. Tento stav rovněž usnadňuje vznik rezistence, především pokud dojde k poklesu hladiny pod MIC po dobu delší, než je polovina dávkovacího intervalu. Vzhledem k minimálnímu PAE je žádoucí, aby plasmatická koncentrace antibiotika byla vyšší než MIC po 90–100 % dávkovacího intervalu. Maximálního antibakteriálního účinku je dosaženo při plasmatické koncentraci 4–5krát vyšší než MIC [10]. Optimální antibakteriální účinnosti a zlepšení léčebných výsledků je pravděpodobně možno dosáhnout zkrácením dávkovacího intervalu nebo kontinuálním podáním [11]. V akutní fázi sepse bez orgánové dysfunkce mohou být při zvýšení glomerulární filtrace a distribučního objemu plasmatické hladiny příliš nízké [10], proto je doporučováno podání zvýšených (lépe maximálních) dávek s krátkými intervaly mezi jednotlivými aplikacemi, nebo kontinuální infuzní podání (ceftriaxon, ceftazidim). Při ledvinné nebo jaterní dysfunkci může dojít ke snížení clearance podávaného antibiotika a ke zvýšení jeho plasmatické koncentrace. Dávkovací režim je potom nutno upravit ve smyslu snížení dávek se zachováním kratších intervalů.
Karbapenemy
Karbapenemy jsou zvláštní třídou beta-laktamů, vykazují PAE a působí proti širokému spektru grampozitivních i gramnegativních patogenů. Stejně jako ostatní beta-laktamy mají minimální nežádoucí účinky. Při konvenčním způsobu dávkování klesají mezi jednotlivými dávkami sérové koncentrace na nízké hodnoty. Vylučování ledvinami koreluje s clearance kreatininu, proto při renální insuficienci, pokud není dávkování upraveno, dochází k jejich akumulaci.
Antimikrobiální účinek je jako u ostatních beta-laktamů závislý na době, po kterou je hladina antibiotika v séru vyšší než MIC (T > MIC). Vzhledem k PAE je baktericidní efektivita karbapenemů zachována již při T > MIC kolem 40 % dávkovacího intervalu. Vhodným způsobem podání může být intermitentní aplikace 3hodinových infuzí [12], nicméně optimální způsob aplikace je stále předmětem výzkumu.
U sepse bez orgánového selhání, stejně jako u předchozích tříd antibiotik, je při zvýšení clearance a distribučního objemu standardní dávkování karbapenemů spojeno s velkým rizikem nízkých sérových koncentrací. V této situaci je indikováno buď zvýšení dávky, nebo zkrácení intervalu mezi jednotlivými aplikacemi. Kontinuální infuzní podání je diskutovanou otázkou a některá předběžná data demonstrovala při jeho užití u kriticky nemocných lepší klinické výsledky a snížení nákladů na antibiotickou léčbu [13, 14].
Dávkování karbapenemů by mělo být v průběhu léčby individualizováno na podkladě klinického stavu, hodnocení distribučního objemu a stavu renálních funkcí.
Vankomycin (reprezentant glykopeptidů)
Vankomycin je přednostně eliminován ledvinami a je potenciálně nefrotoxický, především v kombinaci s jinými nefrotoxickými látkami a inzulty. Při náležitém dávkování na podkladě monitorovaných sérových hladin je však jeho nefrotoxicita výrazně snížena.
Farmakodynamické vlastnosti glykopeptidů nejsou zcela objasněny. Vankomycin vykazuje farmakodynamické vlastnosti jako aminoglykosidy i jako beta-laktamy. Antibakteriální účinek je tedy dán jak vrcholovou hladinou v séru s uplatněním PAE, tak dobou, po kterou je hladina antibiotika v séru vyšší než MIC. Optimální dávkovací režim pro vankomycin zatím není znám. Některá data demonstrují výhody T > MIC při kontinuálním podání [15], jiné práce prezentují výhody PAE při bolusové aplikaci. Výhodou kontinuálního podání mohou být nižší náklady [16].
U sepse bez orgánového selhání je konvenční dávkování vankomycinu spojeno s rizikem poddávkování (zvýšení clearance, větší distribuční objem), proto je doporučeno zahájení léčby úvodním bolusem 20 mg . kg-1 za den a denní dávkou 40 mg . kg-1. Další dávkování by mělo být individualizováno na podkladě sérových hladin, které by se měly při kontinuální aplikaci pohybovat v rozmezí 15–20 mg . l-1. Nevýhodou vankomycinu je špatný průnik do jednotlivých orgánů, především do plic a do likvoru. Je-li příčinou sepse infekce solidního orgánu, je doporučeno vyšší dávkování vankomycinu k dosažení průběžných hladin vyšších než 20 mg . l-1, s iniciálním dávkováním 60 mg . kg-1 za den. Vhodnější alternativou je však užití jiného antibiotika s lepším průnikem (linezolid, tigecycline nebo televancin).
Ciprofloxacin (reprezentant chinolonů)
Ciprofloxacin je širokospektré antibiotikum s dobrým průnikem do tkání. Je metabolizován v játrech na řadu metabolitů, které jsou vylučovány ledvinami. Antimikrobiální účinek ciprofloxacinu závisí především na vrcholové koncentraci v séru (Cmax/MIC), ale částečně i na době, po kterou je hladina antibiotika v séru vyšší než MIC (T > MIC). Optimální léčebné výsledky byly demonstrovány při AUC24/MIC > 125 pro gramnegativní mikroby, pro grampozitivní patogeny dostačuje AUC24/MIC > 30. Nicméně fluorochinolony by jako monoterapie grampozitivních infekcí neměly být užívány. Nízké dávkování ciprofloxacinu bylo spojeno se vznikem rezistence, především enterokoků, Pseudomonas a MRSA. Riziko vzniku rezistence gramnegativních bakterií se zvyšuje při AUC24/MIC < 100.
Distribuční objem pro ciprofloxacin u septických nemocných bez orgánové dysfunkce není – na rozdíl od výše uvedených antibiotik – podstatněji alterován, protože ciprofloxacin je distribuován též intracelulárně, kde je vázán. Iniciální zvýšené dávkování není nutné. Doporučené hodnoty AUC24/MIC > 125 je u dospělých spolehlivě dosaženo při dávkování 400 mg po 8 hodinách. Toto dávkování není nutno měnit, pokud se nerozvine těžká renální dysfunkce.
Závěr
Současné doporučované dávkovací režimy antibiotik vycházejí ze studií se zdravými dobrovolníky nebo s pacienty, kteří nebyli v kritickém stavu. Pro optimální dávkovací režim u kriticky nemocných je nutno vzít v úvahu jak patofyziologické změny spojené s rozvojem SIRS a sepse, tak rozdílné charakteristiky antibakteriálního účinku různých antibiotických tříd. Výsledkem budou dávkovací režimy často odlišné od doporučených standardních schémat, ale podstatně vhodnější pro nemocné v kritickém stavu.
U septického nemocného v těžkém stavu je při užití netoxických antibiotik menší chybou mírné předávkování než poddávkování spojené s nedostatečným efektem a rizikem vzniku rezistence. Při užití antibiotik s úzkým terapeutickým indexem a vyšším rizikem závažných toxických následků je však nezbytné dávkování modifikovat podle monitorovaných sérových koncentrací.
Práce byla podpořena grantem VZ MSM 0021620819.
Došlo 21. 10. 2008.
Přijato 7. 12. 2008.
Adresa pro korespondenci:
Doc. MUDr. Ivan Chytra, CSc.
ARK FN Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: chytra@fnplzen.cz
Sources
1. Dellinger, R. P., Levy, M. M., Carlet, J. M. et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock: 2008. Intensive Care Med., 2008, 34, p. 17–60.
2. Lipman, J. et al. Ciprofloxacin pharmacokinetic profiles in paediatric sepsis: how much ciprofloxacin is enough? Intensive Care Med., 2002, 28, p. 493–500.
3. Lipman, J. et al. Low cefpirome levels during twice daily dosing in critically ill septic patients: pharmacokinetic modelling calls for more frequent dosing. Intensive Care Med., 2001, 27, p. 363–370.
4. Pinder, M., Bellomo, R., Lipman. J. Pharmacological principles of antibiotic prescription in the critically ill. Anaesth. Intensive Care, 2002, 30, p. 134–144.
5. Pea, F. Pharmacokinetic considerations for antimicrobial therapy in patients receiving renal replacement therapy. Clin. Pharmacokinet., 2007, 46, p. 997–1038.
6. Fisman, D. N., Kaye, K. M. Once daily dosing of aminoglycoside antibiotics. Infect. Dis. Clin. North. Am., 2000, 14, p. 475–487.
7. Munckhof, W. J., Grayson, M. L., Turnidge, J. D. A meta-analysis of studies on the safety and efficacy of aminoglycosides given either once daily or as divided doses. J. Antimicrob. Chemother., 1996, 37, p. 645–663.
8. Freeman, C. D., Nicolau, D. P., Belliveau, P. P. Once-daily dosing of aminoglycosides: review and recommendations for clinical practice. J. Antimicrob. Chemother., 1997, 39, p. 677–686.
9. Olsen, K. M., Rudis, M. I., Rebuck, J. A. et al. Effect of once-daily dosing vs. multiple daily dosing of tobramycin on enzyme markers of nephrotoxicity. Crit. Care Med., 2004, 32, p. 1678–1682.
10. Angus, B. J. et al. Pharmacokinetic-pharmacodynamic evaluation of ceftazidime continuous infusion vs intermittent bolus injection in septicaemic melioidosis. Br. J. Clin. Pharmacol., 2000, 50, p. 184–191.
11. Krueger, W. A. et al. Influence of combined intravenous and topical antibiotic prophylaxis on the incidence of infections, organ dysfunctions, and mortality in critically ill surgical patients: a prospective, stratified, randomized, double-blind, placebo-controlled clinical trial. Am. J. Respir. Crit. Care Med., 2002, 15, p. 1029–1037.
12. Jaruratanasirikul, S. et al. Comparison of the pharmacodynamics of meropenem in patients with ventilator-associated pneumonia following administration by 3-hour infusion or bolus injection. Antimicrob. Agents Chemother., 2005, 49, p. 1337–1339.
13. Lorente, L. et al. Meropenem by continuous versus intermittent infusion in ventilator-associated pneumonia due to gram-negative bacilli. Ann. Pharmacother., 2006, 40, p. 219–223.
14. Chytra, I. et al. Clinical efficacy of continuous versus intermittent administration of meropenem. Intensive Care Med., 2006, 32, Suppl. 1, p. 9.
15. Rello, J. et al. Pneumonia caused by oxacillin-resistant Staphylococcus aureus treated with glycopeptides. Crit. Care Med., 2005, 33, p. 1983–1987.
16. Wysocki, M., Delatour, F., Faurisson, F. et al. Continuous versus intermittent infusion of vancomycin in severe Staphylococcal infections: prospective multicenter randomized study. Antimicrob. Agents Chemother., 2001, 45, p. 2460–2467.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2009 Issue 1-
All articles in this issue
- Robotem asistovaná laparoskopie z pohledu anesteziologa
- Výsledky dětské intenzivní péče v České republice za rok 2007
- Význam dechového objemu a jeho monitorování při vysokofrekvenční umělé plicní ventilaci
- Dávkování a způsob podání antibiotik u kriticky nemocných
- Léčba invazivních mykotických infekcí u imunoalterovaných nemocných – doporučení odborných společností*
- Léčba invazivní kandidózy – doporučení odborných společností*
- Léčba invazivní aspergilózy – doporučení odborných společností
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dávkování a způsob podání antibiotik u kriticky nemocných
- Robotem asistovaná laparoskopie z pohledu anesteziologa
- Význam dechového objemu a jeho monitorování při vysokofrekvenční umělé plicní ventilaci
- Léčba invazivní kandidózy – doporučení odborných společností*
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

