-
Medical journals
- Career
Robotem asistovaná laparoskopie z pohledu anesteziologa
: Jurenka Božetěch 1; Lásziková Eva 1; Köhler Otto 2; Langer Daniel 3; Balcárek Lukáš 1; Henlín Tomáš 1; Netuková Daniela 1; Ryska Miroslav 3
: Anesteziologicko-resuscitační oddělení ÚVN Praha 1; Urologické oddělení ÚVN Praha 2; Chirurgická klinika 2. LF UK Praha a ÚVN Praha 3
: Anest. intenziv. Med., 20, 2009, č. 1, s. 8-12
: Anaesthesiology - Review Article
Robotická asistence v laparoskopické chirurgii (RALPSK) je nově a rychle se rozvíjející technologií posledního desetiletí. Výhodou pro operatéra je 3D zobrazení operačního pole a manipulační pohyblivost instrumentaria ve srovnání se současnými laparoskopickými nástroji.V případě nekomplikovaného průběhu je významně zkrácena doba hospitalizace pacienta oproti klasickému otevřenému výkonu. Naopak problémem robotického systému zůstává vysoká pořizovací cena zařízení a provozní náklady.
Otázkou však zůstává, zda-li robotem asistované operační výkony zůstávají miniinvazivní a bezpečné i pro pacienty s přidruženými onemocněními.Klíčová slova:
robotický chirurgický systém da Vinci® – patofyziologie – operační zátěž – anesteziologický management – pooperační péče – miniinvazivitaPrincipy robotické břišní chirurgie a urologie
Robotem asistovaná břišní chirurgie a urologie využívá laparoskopického přístupu do břišní dutiny se zavedením pneumoperitonea. Speciální robotické nástroje jsou ovládány operatérem prostřednictvím robotického systému. Operatér sedí u ovládacího pultu – konzole – a na základě 3D vizualizace operačního pole ovládá pomocí joysticků nástroje na konci ramen robotického systému, které umožňují v břišní dutině pohyb v 7 směrech, na rozdíl od laparoskopických nástrojů umožňujících pohyb pouze ve 4 směrech. Zavedený nástroj se pohybuje srovnatelně s lidským zápěstím a prsty. Dalším rozdílem od manuálně laparoskopicky prováděné operace je odfiltrovaný třes operatérovi ruky, jemný pohyb nástroje a možnost zvětšení obrazu operačního pole. Roboticky asistovaný systém neobsahuje prvky umělé inteligence, představuje pouze sofistikovaný manipulátor.
Na rozdíl od manuálního laparoskopického výkonu je operatér v uvolněné poloze, nemusí být sterilně oblečen, vyjma doby, kdy s asistentem zavádí porty do břišní dutiny a instaluje nástroje, které jsou upevněny na pracovních ramenech robotického systému. Asistent, který je sterilně oblečen po celou dobu výkonu a stojí u operačního stolu, pomáhá operatérovi prostřednictvím zavedeného pomocného portu. V případě potřeby může pomoci při změně polohy nástrojů, eventuálně při jejich dislokaci.
Nevýhodou robotického systému oproti manuální laparoskopické operaci je v současné době časová náročnost, nutnost edukace personálu, menší flexibilita při změně polohy nemocného během operace a vysoká pořizovací a provozní cena.
Roboticky lze provést všechny původně manuálně prováděné laparoskopické výkony. Za nejvhodnější indikaci k RALPSK je dnes považována radikální prostatektomie.
V současné době se v klinické praxi celosvětově používají robotické systémy da Vinci®.
Patofyziologické změny při RALPSK z pohledu anesteziologa
Indukce do celkové anestezie
Již pouhý úvod do celkové anestezie, podání indukčních látek s kardiodepresivním účinkem, snižuje CO (cardiac output – srdeční výdej ). U zdravých pacientů s ASA I–II (hodnocení klinického stavu podle American Society of Anestesiologists) je snížení krátkodobé a bezvýznamné. U pacientů limitovaných kardiálním onemocněním s ASA III – IV mohou být oběhové změny významnější. Při současném založení kapnoperitonea jsou hemodynamické změny markantnější.
Pneumoperitoneum [1, 2]
Ideální plyn k založení pneumoperitonea by měl být netoxický, bezbarvý, nevznětlivý, v krvi rozpustný a dobře odventilovatelný plícemi, v konečném důsledku i levný. Plynem insuflovaným při robotické chirurgii intraperitoneálně i extraperitoneálně je CO2. Jeho předností je dobrá rozpustnost v krvi, tím je však též zvyšován PaCO2 [3].
K udržení normokapnie je zapotřebí zvýšení minutové ventilace (MV).
Ke katastrofálnímu zvýšení PaCO2 ale může dojít u pacientů s intersticiálním plicním onemocněním a chronickou obstrukční plicní nemocí (CHOPN).
Po založení pneumoperitonea s IAP (intraabdominal pressure – intaabdominální tlak) do 10 mmHg je CO prakticky beze změn. Obecně však platí, že alterace globální i lokální hemodynamiky je přímo závislá na hodnotě intraabdominálního tlaku. Při IAP do 20 mm Hg dochází ke kompresi vena cava inferior, snížení žilního návratu, zvýšení afterloadu a v konečném důsledku ke snížení CO. IAP nad 20 mmHg vede nejen k již výše popsaným jevům, nýbrž i ke snížení průtoku krve ledvinou a ke snížení glomerulární filtrace s následkem oligurie. Renální homeostáza je však většinou obnovena do 24 hodin.
Insuflace plynu s sebou může nést zároveň i možnost vzniku arytmií, jak ve smyslu tachyarytmií aktivací sympatiku, tak i bradyarytmií vagovou stimulací.
Operační poloha
Trendelenburgova poloha vede k zvýšení centrálního žilního tlaku a žilního návratu, zvýšení systémové vaskulární rezistence (SVR). Zároveň je v této poloze možnost vzniku fatální komplikace – plynové embolie.
Pneumoperitoneum při současné Trendelenburgově poloze je při RALPSKnejvětším anesteziologickým problémem nejen pro uvedené oběhové a respirační konsekvence, ale též pro neurologické a endokrinní změny [4]. Mezi patofyziologické následky této kombinace patří:
- a) oběhové – vzestup SVR a středního arteriálního tlaku, pokles splanchnického a portálního průtoku. Srdeční výdej zůstává i při abdominálním tlaku do 15 mmHg beze změny a mělo by být v kompetenci anesteziologa vyšší abdominální tlak nepřipustit;
- b) respirační – zhoršení ventilačně/perfuzního poměru, pokles compliance a funkční reziduální kapacity plic, vzestup špičkového inspiračního tlaku, hyperkapnie a respirační acidóza;
- c) CNS – vzestup intrakraniálního tlaku a průtoku krve mozkem;
- d) endokrinní – zvýšené vyplavování katecholaminů, aktivace systému renin-angiotenzin a vzestup vazopresinu.
V anti-Tredenlenburgově poloze je nutno dbát zvýšené pozornosti na venostázu v oblasti dolních končetin akcentovanou pneumoperitoneem, která může akcelerovat vznik žilní trombózy a riziko vzniku plicní embolie.
Obezita
Obézní pacienti mají jak zvýšenou spotřebu kyslíku, tak i zvýšenou produkci CO2, sníženou compliance a zvýšený pulmonální průtok; také je zvýšen intrapulmonální zkrat. Obézní pacienti potřebují k udržení normokapnie o 15 % vyšší MV při změně polohy ze sedu do polohy vleže. U těchto skupin pacientů zvýšení MV může být značně obtížné až nemožné, extrémně vysoké tlaky v dýchacích cestách mohou vést k barotraumatu. Zároveň vysoký nitrohrudní tlak výrazně zhoršuje žilní návrat a tím může podmiňovat vznik oběhového selhání. Úprava ventilace, ve smyslu ventilace malými objemy při vyšší dechové frekvenci, je efektivní jen dočasně.
Komplikace
K peroperačním chirurgickým komplikacím patří poranění vnitřních orgánů trokarem či zavedenými nástroji a krvácení.
K anesteziologickým komplikacím řadíme dislokaci endotracheální kanyly po založení kapnoperitonea do pravostranného bronchu. Současný vysoký stav bránice je predisponujícím faktorem pro regurgitaci žaludečního obsahu. Zcela zásadní je ověření správné těsnosti manžety endotracheální kanyly.
Anatomické abnormality bránice mohou vést k rozvoji tenzního pneumotoraxu, pneumomediastina a zároveň ke vzácnější komplikaci – pneumoperikardu. Nerozpoznání těchto komplikací vyústí v oběhové selhání.
Při nedokonalém zavedení nástrojů do peritoneální dutiny nebo následné dislokaci a nechtěné insuflaci plynu mezi vrstvy břišní stěny dochází k rozvoji podkožního emfyzému. Z intersticia se insuflovaný CO2 výborně vstřebává do krevního oběhu, což se může projevit výrazným nárůstem ETCO2 a poklesem pH krve.
Další fatální komplikací, kterou s sebou nese laparoskopická i robotem asistovaná laparoskopická chirurgie, je plynová embolie. Insuflace 3–8 ml . kg-1 plynu i. v. vede ke snížení nebo až k nulovému žilnímu návratu, výraznému snížení CO a oběhovému kolapsu. Obstrukce plicních žil vede k prohloubení poruchy poměru ventilace/perfuze, hypoxii a opětovně k oběhovému selhání.
V naší populaci u 20–30 % pacientů perzistuje otevřené foramen ovale. Plynová embolie u těchto pacientů vede k systémové plynové embolii (mozek, srdce) a k oběhovému selhání.
Předoperační vyšetření
Předoperační vyšetření před robotickým výkonem v břišní chirurgii a urologii jsou prováděna ve standardním rozsahu podle ASA.
Absolutní kontraindikace robotické břišní chirurgie a urologie
Kardiální insuficience
Ejekční frakce LK pod 40 % podle ECHO
CHOPN s těžkou obstrukcí (FEV1 pod 1 l/sec) a restrikcí
Obezita s BMI:
- ženy nad 35 kg/m2,
- muži nad 40 kg/m2.
Anémie s anemickým syndromem
Hypovolémie
Intrakraniální hypertenze
Gravidita nad 12. týden
Relativní kontraindikace robotické břišní chirurgie a urologie
- Kardiak s kompromitovanou srdeční funkcí
- CHOPN – středně těžká obstrukce a restrikce
- Obezita
- Anémie
- Gravidita pod 12. týden
- Ascites při pravostranném srdečním selhávání
- Revmatické chlopenní vady – při posuzování rizika anestezie a možnosti výkonu nutno zvážit prolongované negativní kardiopulmonální vlivy – operační polohu, délku výkonu, přístup k pacientovi, hypotermii.
Doporučená doplňující vyšetření při přidružených onemocněních
- ICHS – srdeční ECHO (při vyšetření pomýšlet i na perzistující foramen ovale provedením Valsalova manévru s ECHO kontrastním roztokem i. v.).
- CHOPN – spirometrie. Každý pacient by měl být posuzován k vhodnosti robotického operačního výkonu individuálně a ve spolupráci anesteziologa a operatéra.
- U žen ve fertilním věku cílený dotaz na menses, graviditu, v případě nejasností gravitest.
Vedení anestezie
Celková anestezie je u RALPSK standardem. Vzhledem k výše popsaným oběhovým i ventilačním rizikům je nezbytné dokonalé monitorování pacienta. K základnímu monitorování patří EKG, IBP (invazivní krevní tlak), CVP (centrální žilní tlak), ETCO2 (kapnografie), SaO2, hodinová diuréza, tělesná teplota v jícnu. Pro obtížnou dostupnost k pacientovi zavádíme u těchto výkonů vždy základní invazivní monitorování hemodynamiky (IBP, CVP), včetně pacientů s nižším operačním rizikem (ASA II).
Nazogastrická sonda se nezavádí rutinně, pouze na přání operatéra nebo při distenzi žaludku.
U pacientů ASA III s kardiálním a plicním onemocněním je výhodné rozšíření monitorování o kontinuální monitorování srdečního výdeje a odvozené hemodynamické parametry.
Celková anestezie je vedena inhalačně nosnou směsí N2O + O2 s FiO2 0,5. Jako volativní anestetikum je použit izofluran nebo sevofluran, k analgezii titračně bolusově sufentanil i. v.
Umělá plicní ventilace je preferována v režimu tlakem řízené normoventilace s P do 30 cmH2O s Vt do 7 ml . kg-1 a PEEP 5 cm H2O.
Ventilační a hemodynamický management u nekomplikovaných výkonů při striktním dodržení anesteziologických kontraindikací většinou nečiní obtíže. Ty mohou nastat při současném plicním a kardiálním postižení v extrémní Trendelenburgově poloze.
Při rutinním použití nedepolarizujících kuraremimetik je nutno přihlédnout ke snížené tělesné teplotě pacienta. S výhodou lze proto použít monitorování nervosvalového přenosu. V klinické praxi může vzniknout problém při nedostatečně zajištěném prostoru v oblasti monitorované horní končetiny s možným vznikem artefaktů.
U robotem asistovaných urologických výkonů může být sledování hodinové diurézy přechodně ovlivněno dočasným odpadem moči mimo vývodné močové cesty. V určitých fázích těchto operací dochází k přerušení kontinuity močovových cest (podle typu operace horních nebo dolních). V období, kdy dochází k úniku moče mimo vývodné močové cesty, nemá anesteziolog k dispozici přesné monitorování výdeje moči. Tekutinová bilance se stává nepřehlednou, zejména pak při rozsáhlejším krvácení. S krví z operačního pole může být navíc odsávána i moč.
Jako vodítko suficientního preloadu u kardiálně nekompromitovaných pacientů postačuje CVP, u pacientů s ASA III monitorování hemodynamiky s užitím měření kontinuálního srdečního výdeje a odvozených hemodynamických parametrů.
U resekčních urologických výkonů je snaha o hemodynamický management s relativně nízkým centrálním žilním tlakem, který je v Trendelenburgově poloze kolem 10–15 mmHg.
K udržení normotermie pacienta se používá kombinace zevního ohřevu pacienta, ohřevu podávaných infuzí a korekce teploty na operačním sále. Udržení normotermie však v praxi činí obtíže a tato opatření jsou většinou ne zcela dostatečná.
K eliminaci anesteziologických příhod při obtížné dostupnosti k pacientovi během robotického výkonu (obr. 1) je nezbytně nutné pečlivě zajistit fixaci endotracheální rourky včetně všech invazivních vstupů proti rozpojení a zalomení.
1. Obtížná dostupnost k pacientovi 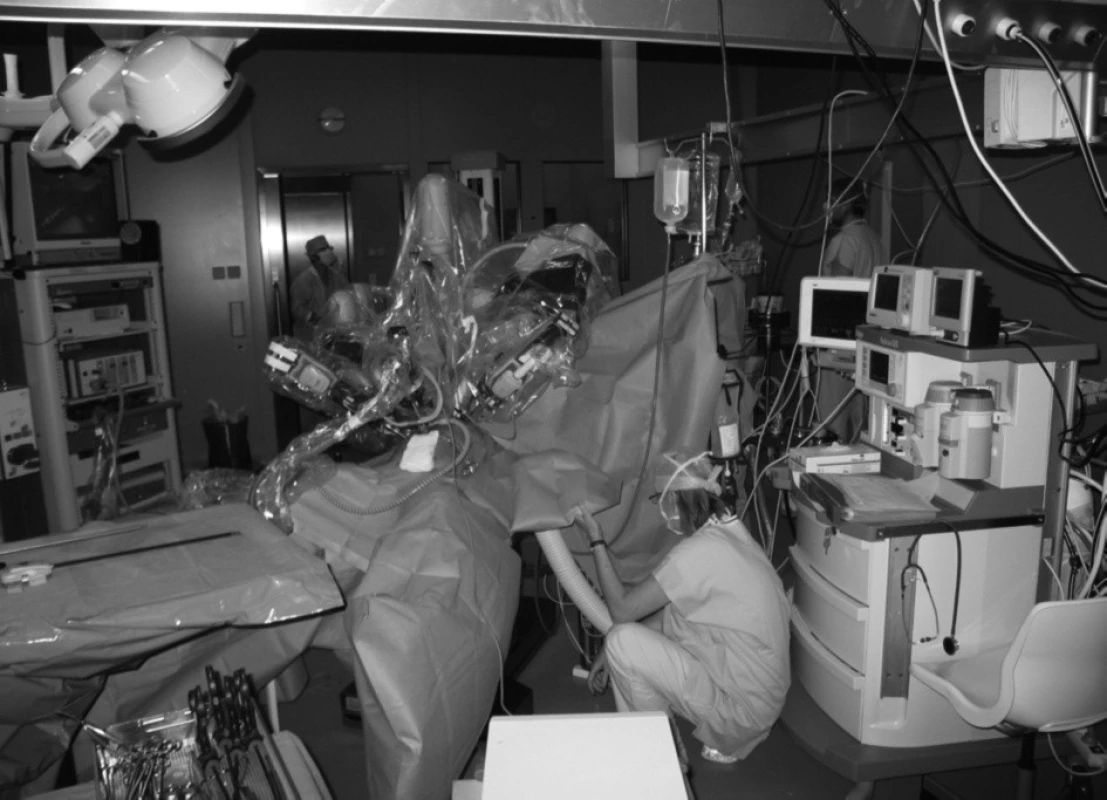
ATB profylaxe je rutinně podávána všem pacientům podstupující roboticky asistovaný výkon podle surveilance na doporučení ústavního epidemiologa.
K bezprostřední pooperační analgezii postačuje paracetamol i. v. 20–30 minut před koncem výkonu.
Epidurální katétr k pooperační analgezii u pacientů podstupující RALPSK není rutinně používán.
Specifika pooperační péče
Pooperační péče u nemocných po RALPSK by se dala charakterizovat v případě nekomplikovaného průběhu jako krátkodobá intenzivní až resuscitační, s trváním do 24 hodin [5]. Po této době lze pacienta přeložit na standardní oborové chirurgické oddělení bez nutnosti intermediární péče.
Pacient přijíždí po nekomplikovaných RALPSK na pooperační jednotku vedenou intenzivistou či anesteziologem zpravidla extubován, spontánně ventilující (výjimečně s nutností pokračující umělé plicní ventilace), hemodynamicky stabilní s invazivním monitorováním hemodynamiky (IBP, CVP, hodinovou diurézou, eventuálně monitorování hemodynamiky s užitím měření kontinuálního srdečního výdeje a odvozených hemodynamických parametrů u ASA III), v mírné hypotermii, bez nutnosti agresivních zásahů do hemodynamiky.
V případě spontánní ventilace je k oxygenoterapii použit intermitentní CPAP 5–7 cmH2O.
Pooperační analgezie je vedena na cílovou VAS (vizuální analogová škála) pod 4. Na našem pracovišti používáme piritramid i. m. v kombinaci s paracetamolem i. v.
Časná pooperační léčba musí probíhat v podmínkách plně materiálně a personálně vybavené jednotky, s možností poskytnutí kvalifikované neodkladné resuscitační péče.
Základní rozdíly mezi RALPSK a laparoskopií (LPSK) z pohledu anesteziologa
Délka operačního výkonu
Publikované výsledky [6], u kterých vyžaduje roboticky asistovaná laparoskopie oproti LPSK o 20 % operačního času navíc u stejného výkonu, celkový čas na sále je pak u RALPSK delší až o 28 %, se v současné době neliší od zkušeností z našeho pracoviště (149 RALPSK v roce 2007, 177 RALPSK období 1–11/2008). Delší doba výkonu s sebou přináší potenciální anesteziologické komplikace, jako je vyšší oběhová zátěž, hypotermie či riziko poškození nervových pletení z dlouhé nevhodné imobilizace.
Trendelenburgova poloha
Většinou je operatérem u RALPSK požadováno sklonění pacienta o 30–45 stupňů, tudíž výrazněji než u obdobných LPSK výkonů. Extrémní Trendelenburgova poloha se zhoršeným žilním návratem vyžaduje zcela jiný tekutinový management než při stejném laparoskopickém výkonu či laparotomii, např. zhoršený odtok venózní krve z oblasti hlavy přináší riziko laryngeálního edému.
Obtížný přístup k pacientovi
Nastává po začátku operace, především k dýchacím cestám a vstupům do cévního řečiště.
Invazivní monitorování hemodynamiky
IBP, CVP u pacientů s nižším operačním rizikem (ASA II) vzhledem k obtížnému přístupu k pacientovi.
V případě radikální prostatektomie nutno brát na zřetel i časté komorbidity (průměrný věk při diagnóze karcinomu prostaty je 70 let).
Závěr
Miniinvazivita RALPSK, zkrácení doby hospitalizace i rychlejší rekonvalescence u nekomplikovaných výkonů jsou nespornými výhodami v souladu s laparoskopickým přístupem u pacientů s nízkým operačním rizikem.
U rizikových pacientů však má RALPSK svá úskalí a limity.
Pro anesteziologa znalého patofyziologické problematiky přináší oproti LPSK zvýšenou zátěž, akcentovanou v případě komplikací, kterou lze částečně eliminovat striktním dodržováním kontraindikací.
Vzhledem k delší době operace oproti klasickým laparoskopickým výkonům, akcentované extrémní, hemodynamicky nevýhodnou operační polohou může být výsledek operace významně ovlivněn zkušeností celého týmu.
Nelze opomenout ani zvýšenou ekonomickou náročnost pro bezpečný anesteziologický management a krátkodobou specifickou pooperační péči, která zatím není zohledněna zdravotními pojišťovnami.
Základní podmínkou je tedy dostatečná efektivnost provozu tohoto vybavení, která se může uplatnit pouze ve „vysokoobjemových“ operačních provozech [7, 8].
Robotický chirurgický systém da Vinci® je používán multidisciplinárně Urologickým oddělením, Chirurgickou klinikou a gynekologickým oddělením Ústřední vojenské nemocnice v Praze od prosince 2005.
Práce je podpořena sekcí rozvoje a výzkumu MO ČR č. S9180.
Došlo 21. 8. 2008.
Přijato 7. 12. 2008.
Adresa pro korespondenci:
MUDr. Božetěch Jurenka
Anesteziologicko-resuscitační oddělení
Ústřední vojenská nemocnice
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: bozetech.jurenka@uvn.cz
Sources
1. Larsen, J. F., Svendsen, F. M., Pedersen, V. Randomized clinical trial of the effect of pneumoperitoneum on cardiac function and haemodynamics during laparoscopic cholecystectomy. British Journal of Surgery, 2004, 91, 7, p. 848–854.
2. Falabella, A., Moore-Jeffries, E., Sullivan, M. J., Nelson, R., Lew, M. Cardiac function during steep Trendelenburg position and CO2 pneumoperitoneum for robotic-assisted prostatectomy: a transeopahageal Doppler probe study. The International Journal of Medical Robotics Assisted Surgery, 2008, 3, 4, p. 312–315.
3. Streich, B., Decailliot, F., Perney, C., Duvaldestin, P. Increased carbon dioxide absorption during retroperitoneal laparoscopy. BJA, 2003, 91, p. 793–796.
4. Phong, S. V., Koh, L. K. Anaesthesia for robotic-assisted radical prostatectomy: considerations for laparoscopy in the Trendelenburg position. Anaesthesia and Intensive Care, 2007, 35, 2, p. 281–285.
5. Patel, V. R., Chammas, F.M. jr., Shah, S. Robotic assisted laparoscopic radical prostatectomy: a review of the current state of the affairs. International Journal of Clinical Practice, 2007, 61, 2, p. 309–314.
6. Link, R. E. et al. A Prospective Comparison of Robotic and Laparoscopic Pyeloplasty. Annals of Surgery, 2006, 243, 4, p. 486–491.
7. Scales, C. D., Charles, D. et al. Local cost structures and the economics of robot assisted radical prostatectomy. Journal of Urology, 2005, 174, 6, s. 2323–2329.
8. Breitenstein, S. et al. Robotic-assisted Versus Laparoscopic Cholecystectomy: Outcome and Cost Analyses of a Case-matched Control Study. Annals of Surgery, 2008, 247, 6, p. 987–993.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care Medicine
Article was published inAnaesthesiology and Intensive Care Medicine

2009 Issue 1-
All articles in this issue
- Robot-assisted laparoscopic surgery from the anaesthesiologist’s perspective
- Paediatric intensive care outcomes in the Czech Republic in 2007
- The importance of tidal volume and its monitoring during high-frequency ventilation
- Dosage and administration of antibiotics in critically ill patients
- Guidelines for the treatment of invasive fungal infections in immunocompromised patients
- Guidelines for the treatment of invasive candidiasis
- Guidelines for the treatment of invasive aspergillosis
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dosage and administration of antibiotics in critically ill patients
- Robot-assisted laparoscopic surgery from the anaesthesiologist’s perspective
- The importance of tidal volume and its monitoring during high-frequency ventilation
- Guidelines for the treatment of invasive candidiasis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

