-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Thymom – onemocnění mnoha tváří
Thymoma – disease of many faces
A thymoma belongs to rather rare tumors, although it holds the first place among primary mediastinal tumors in adults. The biological characteristics of thymomas are considerably divergent. The tumors are usually asymptomatic at the begining, later due to a local spread, symptoms from the infiltration or compression of adjacent structures arise, they metastasize rarely. Thymomas are often associated with various autoimmune or endocrinologic diseases. The authors present case of the patient with less common paraneoplasia – autoimmune hemolytic anemia (AIHA). Main strategy of treatment thymom with AIHA isn´t clear. The most important seems to be the early started corticotherapy. Achieving remission of secondary AIHA has importace in following therapy of thymoma – surgical resection or chemotherapy. Thymectomy has positive effect on the course of associated paraneoplastic syndromes and prognosis in general.
Keywords:
autoimunne hemolytic anemia – paraneoplastic symptom – thymoma – warm antibodies
Autoři: Kateřina Pokorná; Vladimír Kojecký
Působiště autorů: Interní oddělení, Nemocnice Tomáše Bati ve Zlíně
Vyšlo v časopise: Vnitř Lék 2021; 67(4): 240-243
Kategorie: Kazuistiky
Souhrn
Thymom patří mezi poměrně raritní nádory, zaujímá však prvenství mezi primárními nádory mediastina u dospělých. Biologické vlastnosti thymomů jsou značně divergentní. Nádory bývají zpočátku asymptomatické, později se v důsledku lokálního šíření manifestují příznaky z infiltrace či útlaku okolních struktur, vzácněji metastazují. K thymomu často bývají přidružena různá autoimunitní či endokrinní onemocnění. V kazuistice je prezentována jedna z méně častých paraneoplazií – autoimunitní hemolytická anémie (AIHA). Všeobecná strategie léčby AIHA asociované s thymomem není dána. Stěžejní je včasné nasazení kortikoidů. Dosažení remise sekundární AIHA je důležité pro možnost další terapie thymomu – chirurgickou resekci či podání chemoterapie. Thymektomie má pozitivní vliv na průběh přidružených chorob a celkovou prognózu onemocnění.
Klíčová slova:
autoimunitní hemolytická anémie – paraneoplastický příznak – tepelné protilátky – thymom
Úvod
Thymom patří mezi nejčastější primární nádory mediastina. Celkově je však poměrně raritní (incidence 0,1–0,2/100 000 osob) (1). Nejčastěji je diagnostikován ve 4.–5. dekádě života. Rizikové faktory vzniku nejsou známy (2). Biologická povaha kolísá od pomalu rostoucích nádorů benigního charakteru, často s tendencí k lokálním recidivám, po vysoce agresivní metastazující tumory se špatnou prognózou (3, 4). Zpočátku bývají asymptomatické, až v jedné třetině případů se jedná o náhodný nález. Později se v důsledku lokálního šíření mohou manifestovat příznaky z infiltrace či útlaku okolních struktur předního mediastina (4).
U thymomu dochází k maligní transformaci thymických epiteliálních buněk (2). Ty jsou odvozeny z bipotentní progenitorové buňky, která se za kontroly vícestupňové signální kaskády (při níž se uplatňují např. TNFR, RANK, CD40, FGFs, foxn1, Aire a další) vyvíjí ve funkčně zralou epiteliální buňku. Podle místa působnosti dělíme epiteliální buňky na kortikální a medulární (5). Obě jsou klíčovou komponentou pro vývoj T-lymfocytů a eliminaci autoreaktivních T-buněk (6). Dysfunkce epiteliálních buněk thymu tedy může vyústit v produkci autoreaktivních T-lymfocytů, a tak vést k rozvoji autoimunitních procesů (7). Z tohoto důvodu bývají s thymomem často asociovány různé autoimunitní choroby (8) či duplicitní tumory (např. Kaposiho sakrom, akutní leukemie, mnohočetný myelom, non-Hodgkinův lymfom). Typickou paraneoplazií je myastenia gravis (4). Vzácnou komplikací může být autoimunitní hemolytická anémie (9). Prezentujeme případ nemocného s imunní hemolytickou anémií jako první manifestací thymomu.
Kazuistika
47letému pacientovi byl pro dušnost proveden rentgenový snímek hrudníku. Zde bylo popsáno ložiskové zastínění pravé plíce (Obr. 1). Následně byl pacient odeslán k dalšímu došetření.
Obr. 1. RTG hrudníku s patrným ložiskem 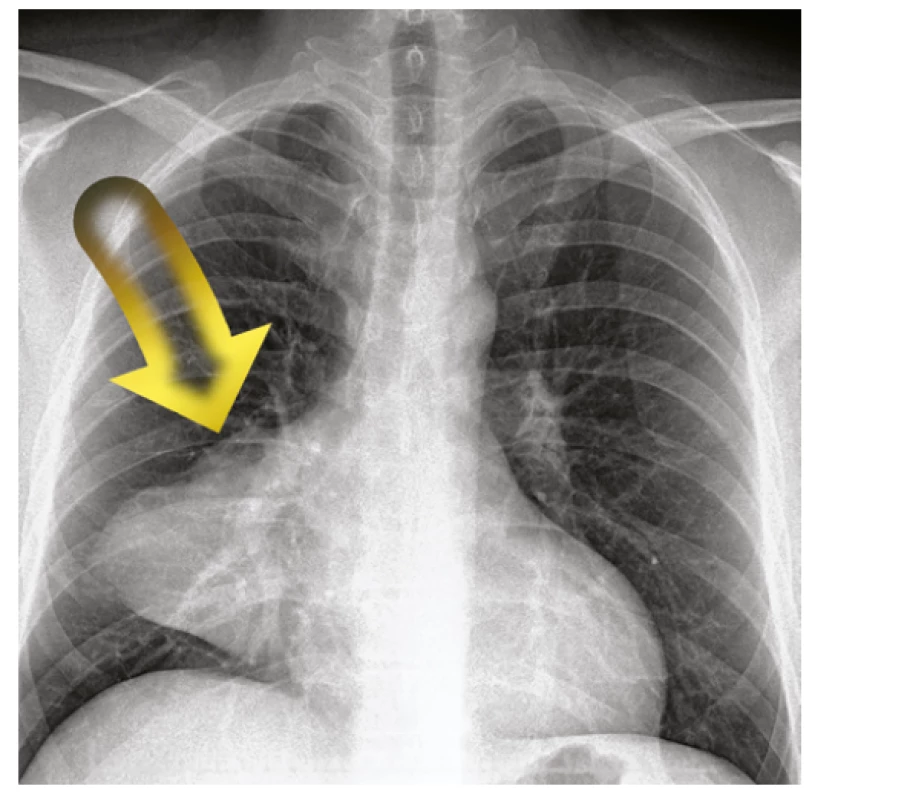
Jednalo se o muže dosud bez závažnějších komorbidit, mimo hypertenzní chorobu. V popředí jeho stesků byla asi měsíc trvající námahová dušnost, slabost, nevýkonnost, bolesti kloubů, navíc příbuzní pozorovali zežloutnutí kůže pacienta. V objektivním nálezu byl patrný subikterus kůže, sklér a hepatomegalie. Slezinu ani periferní uzliny se nahmatat nepodařilo. V laboratorních odběrech dominovala hyperbilirubinémie, zvýšená laktátdehydrogenáza, v krevním obraze leukocytóza s eozinofilií v absolutním počtu, těžká makrocytární anémie (hemoglobin 60 g/l), výrazná retikulocytóza (19 %). S ohledem na zvýšený bilirubin, laktátdehydrogenázu, anémii a retikulocytózu jsme pojali podezření na hemolýzu. Pacientovi byla odebrána krev na přímou zkoušku s nálezem pozitivity přímého i nepřímého Coombsova testu (pozitivní anti-IgG, anti C3d+). Nálezy ukazovaly na hemolýzu imunní. Stav jsme hodnotili jako autoimunitní hemolytickou anémii s tepelnými protilátkami (typu IgG) paraneoplastické etiologie při ložiskovém postižení pravé plíce. Zahájili jsme intravenózní kortikoterapii. Po 3 dnech léčby byl však efekt minimální, proto byla navýšena dávka kortikoidů a přechodně přidán intravenózní imunoglobulin. Poté konečně došlo ke kýženému zlepšení, hemoglobin vystoupal k hodnotě 99 g/l.
V mezidobí byla doplněna vyšetření k objasnění charakteru ložiska pravé plíce. Na CT hrudníku byla patrná kulovitá ostře ohraničená expanze vpravo v předním dolním mediastinu naléhající na vtokovou část pravé síně a ventrálně na pleuru (Obr. 2). Svou lokalizací neodpovídala tumoru plic, ale thymickému nádoru. K histologické verifikaci byla následně provedena biopsie patologického ložiska pod ultrazvukovou kontrolou přes stěnu hrudní. Histologický nález připouštěl diagnózu thymomu B3, nebylo však možno jednoznačně vyloučit dlaždicobuněčný karcinom. Pro suspektní naléhání tumoru k pravé srdeční síni byla doplněna echokardiografie srdce, bez průkazu prorůstání tumoru do srdečních oddílů.
Obr. 2. Nádorová expanze v předním dolním mediastinu (CT hrudníku) 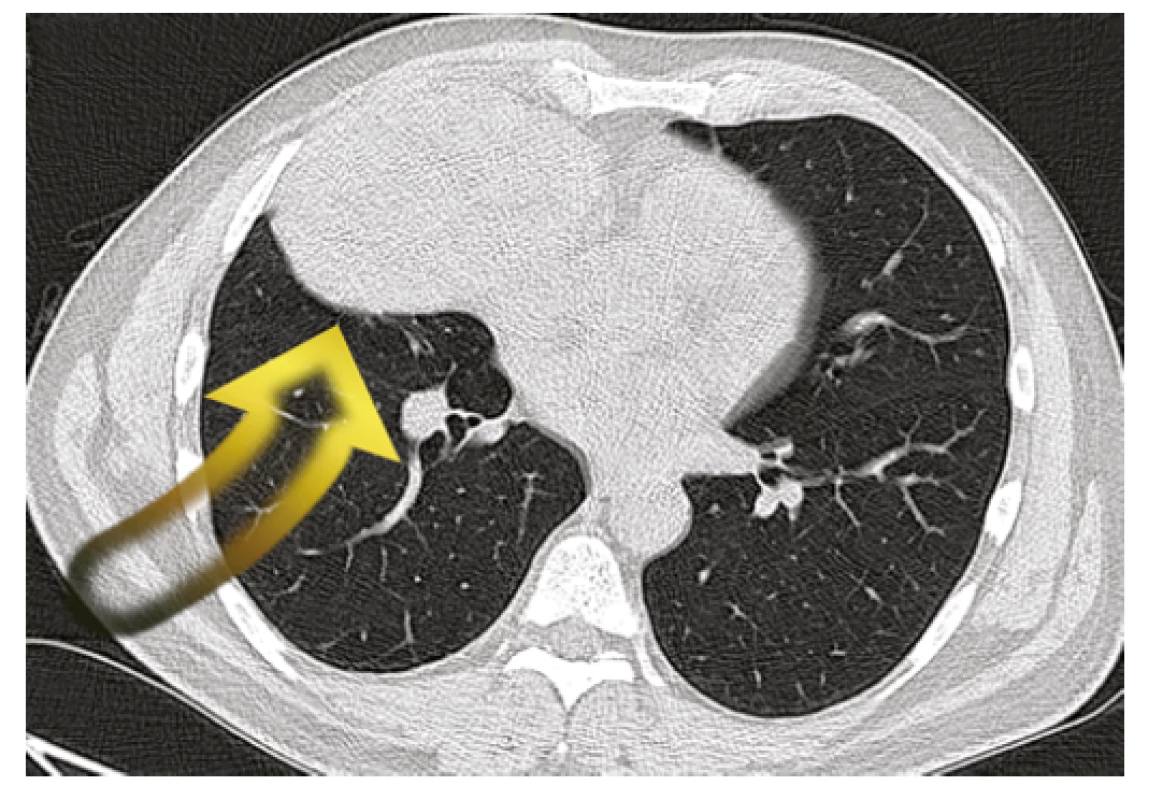
Po zhruba měsíc trvající terapii perorálními kortikoidy byly dále hodnoty krevního obrazu uspokojivé (hemoglobin 135 g/l). Trvala pozitivita přímého Coombsova testu, ale již bylo možno zajistit kompatibilní erymasy pro eventuální potřebu podání během chirurgického výkonu. S ohledem na stále nejasnou biologickou povahu tumoru a absenci známek generalizace bylo indikováno primárně chirurgické řešení. Po exstirpaci tumoru byl průběh nekomplikovaný, bez nutnosti podání krevní transfuze. Histologicky byl v resekátu popsán epiteliální thymom typu A, Masaoka stage I, pT1.
Thymom typu A patří mezi thymomy s nejlepší prognózou (Tab. 1). Navíc bylo u pacienta onemocnění zachyceno v klinickém stadiu I dle Masaoky (Tab. 2). Jelikož nebyly ani mikroskopické známky prorůstání do pouzdra nádoru (4), resekcí bylo dosaženo celkové remise. Další terapie nebyla nutná. K vyloučení myastenie gravis (pro pocity svalové slabosti) pacient podstoupil neurologické vyšetření včetně elektromyografie, s negativním nálezem. Po téměř 2měsíční hospitalizaci jsme pacienta propustili do domácího ošetření při dávce prednisonu 30 mg/den. V časovém odstupu 4 měsíců od propuštění (tzn. cca 6 měsíců od diagnózy thymomu) je pacient bez obtíží, již na minimální udržovací dávce prednisonu 5 mg/den. Nejsou známky pokračující hemolýzy.
Tab. 1. Thymom (WHO klasifikace) (2) 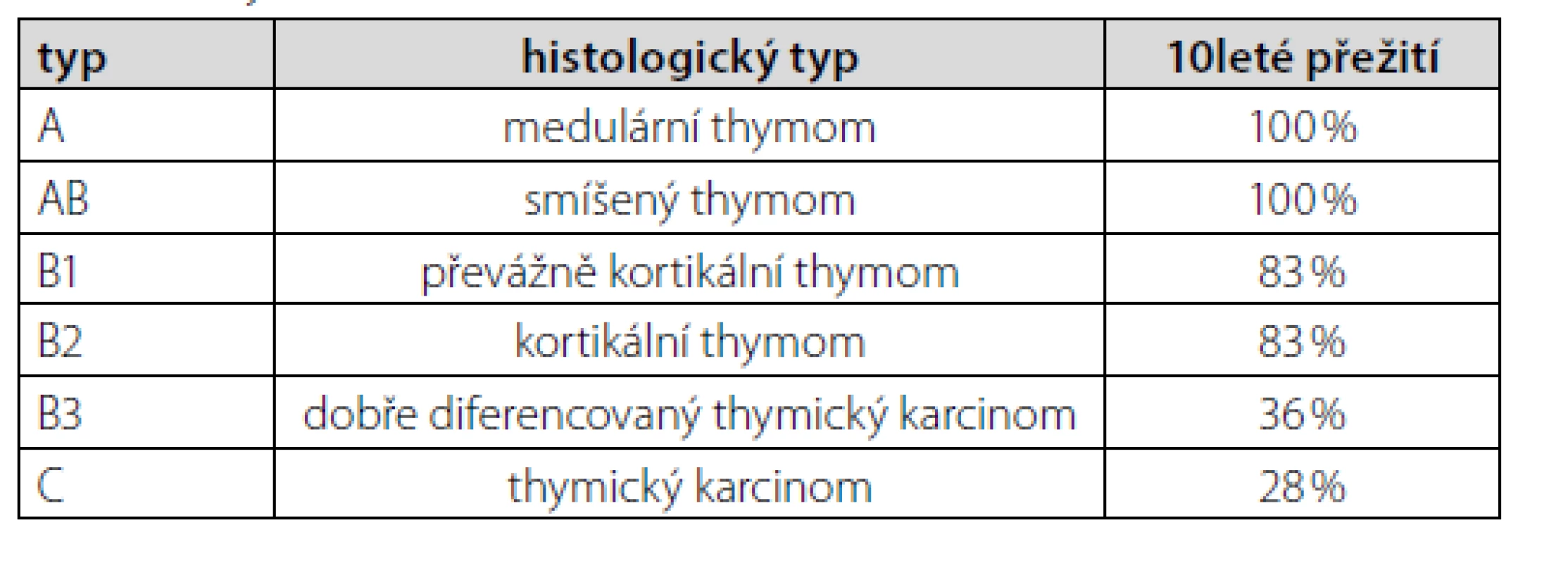
Tab. 2. Masaokův modifikovaný systém klinických stadií thymomu (1) 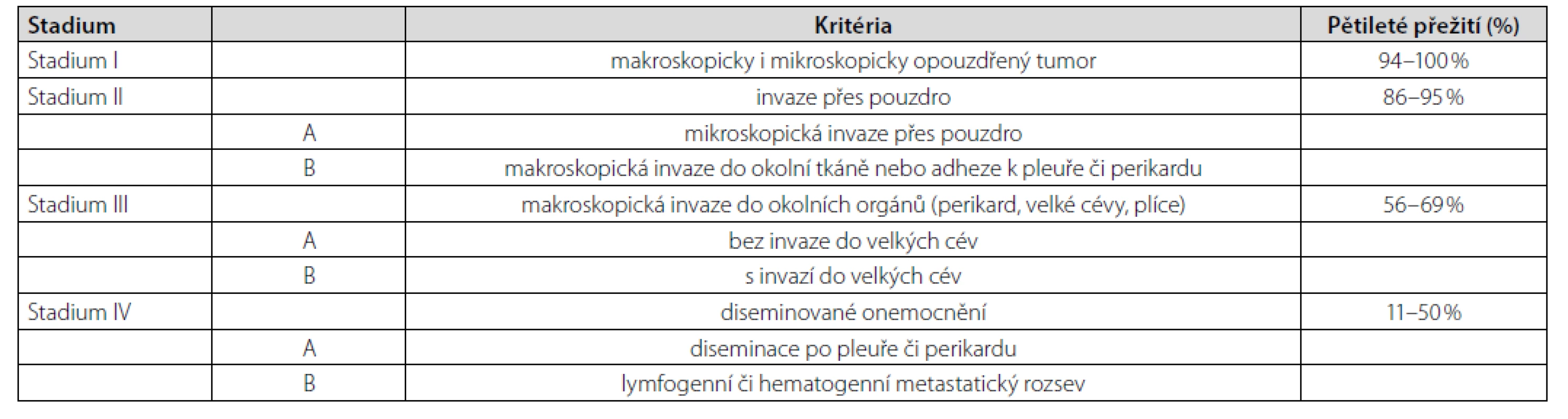
Diskuze
Thymom je častěji než jiné nádory asociován s paraneoplastickými projevy a autoimunitními procesy. Thymus hraje ústřední roli v adaptivní (získané) imunitě. Je místem selekce a maturace T-lymfocytů, které za normálních okolností tolerují antigeny tělu vlastní. Selekce v thymu je dvojí. V kortexu probíhá tzv. pozitivní selekce, která zajišťuje přežití pouze plně funkčních imunokompetentních thymocytů. Tyto migrují do dřeně. Zde probíhá tzv. negativní selekce, která je stěžejní v prevenci rozvoje autoimunity. Dochází k apoptóze thymocytů, jenž si vytvořily receptory proti tkáňově specifickým antigenům organismu. Pokud je tedy z nějakého důvodu narušeno vnitřní mikroprostředí thymu, může dojít k nekontrolované proliferaci autoreaktivních klonů thymocytů s přesáhnutím „limitu“ pozitivní selekce v kortexu. Nezralé autoreaktivní T-lymfocyty pak mohou obejít negativní selekci ve dřeni, proniknout do systémové cirkulace a ve svém konečném důsledku vést k rozvoji autoimunitního onemocnění (8, 9, 10).
Souvislost mezi thymickým tumorem a výskytem autoimunitních a paraneoplastických příznaků byla poprvé popsána v roce 1901 – jako asociace s myastenií gravis. Autoimunitní příznaky se mohou projevit v řadě tkání a orgánů těla (Tab. 3). Prvenství zaujímá postižení nervového systému (8). Nejčastější paraneoplazií je myastenia gravis. Postihuje 30–50 % pacientů s thymomem (1). Méně často bývají postiženy jiné orgány, např. gastrointestinální (autoimunitní hepatitida, cholangoitida, pankreatitida), kardiovaskulární (myokarditida, hluboká žilní trombóza i v atypických lokalizacích), kožní (pemfigus, lichen planus). Nejčastější přidruženou hematologickou paraneoplazií je čistá aplazie červené krevní řady (8).
Tab. 3. Přidružené nemoci u pacientů s thymomem (4) 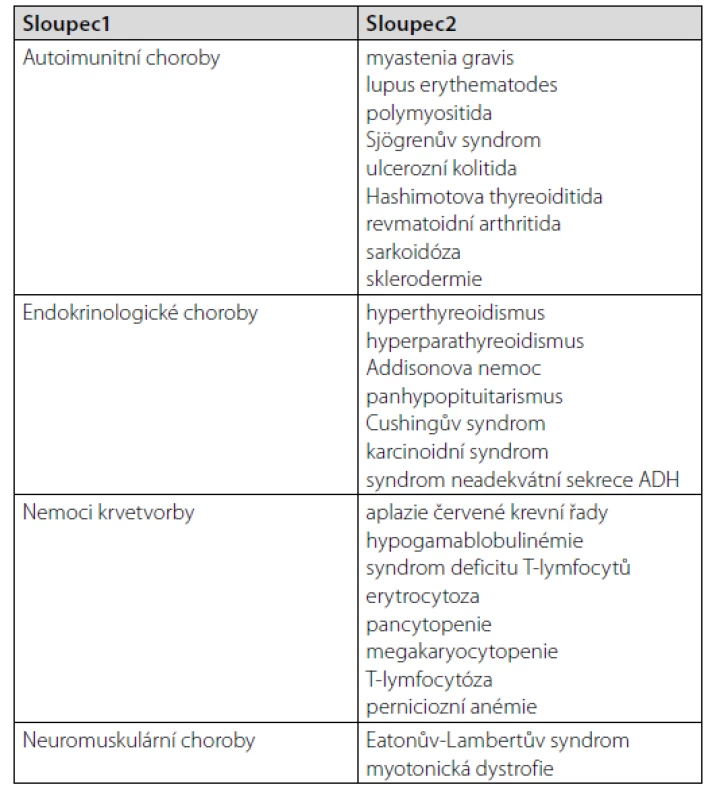
U našeho pacienta se thymom manifestoval autoimunitní hemolytickou anémií. Současný výskyt thymomu a AIHA je velmi raritní. Prameny uvádí pouze 17 případů thymomu spojených právě s AIHA. Nejčastějším typem thymomu asociovaného s AIHA je karcinom thymu (typ C dle WHO), dále pak thymom medulární (typ A dle WHO), jako tomu bylo u našeho nemocného (9).
Všeobecná strategie léčby AIHA asociované s thymomem není dána. V terapii je stěžejní včasné nasazení kortikoidů (9, 11). Kortikoidy suprimují tvorbu protilátek, omezují jejich vazbu na erytrocyty a brání zvýšenému zániku komplexů erytrocytů s navázanými protilátkami v monocyto-makrofágovém systému sleziny (12). Dávka a způsob podání kortikoidů závisí na iniciální hodnotě hemoglobinu. U pacientů s lehčí formou hemolýzy (hemoglobin > 80 g/l) „je podáván prednison v dávce 1–1,5 mg/kg/den po dobu 3–4 týdnů“ (13). U nemocných s těžkou hemolýzou je indikována intravenózní kortikoterapie methylprednisolonem „v dávce 250–1 000 mg denně“ (13), někdy v kombinaci s intravenózním imunoglobulinem „v dávce 0,5 g/kg/den po dobu 3–5 dnů“ (13). Při vysokých titrech volných cirkulujících protilátek je účinná plazmaferéza. Léčbu AIHA hodnotíme jako efektivní při dosažení stabilních hodnot hemoglobinu > 100 g/l bez nutnosti podání krevní transfuze. Poté je možno kortikoidy pozvolna detrahovat. Celková doba podání kortikoidů by v indikaci AIHA měla přesahovat 3–4 měsíce, vysadit je lze až při opakované negativitě přímého antiglobulinového testu. Asi u poloviny pacientů však bývá nutná kortikoterapie dlouhodobá, někdy i v kombinaci s jinými imunosupresivy (13).
U našeho pacienta byla pro těžkou anémii přímo indikována vysokodávková parenterální kortikoterapie. Pro nedostatečný efekt kortikoidů byla terapie eskalována o přechodné podání intravenózního imunoglobulinu. V průběhu 10 dní došlo k pozvolnému vzestupu a udržení hodnoty hemoglobinu nad 100 g/l bez potřeby transfuze erytrocytů. Až poté jsme mohli dávku kortikoidů snižovat.
Dosažení remise sekundární AIHA je nezbytné pro další terapii thymomu – chirurgickou resekci či podání chemoterapie. Bylo prokázáno, že thymektomie má pozitivní vliv na průběh asociovaných paraneoplazií a autoimunit (9). Dle retrospektivního přehledu paraneoplastických syndromů asociovaných s thymomem, z 500 pacientů 75 % z nich dosáhlo thymektomií kompletní nebo parciální remise přidružené paraneoplazie. U 20 % pacientů došlo časně v pooperačním období k relapsu téže paraneoplazie či se objevil jiný typ. Dosažení remise přidruženého paraneoplastického syndromu vede ke zlepšení celkové prognózy onemocnění thymomem (14).
Závěr
Sekundární AIHA je vzácnou komplikací zřídkavého onemocnění thymomem. Proto jsme tuto koincidenci odhalili v průběhu vyšetření. Včasným nasazením kortikoidů lze u části pacientů dosáhnout alespoň dočasné remise AIHA. Stěžejní pro dlouhodobou prognózu je odstranění thymomu.
KORESPONDENČNÍ ADRESA AUTORKY:
MUDr. Kateřina Pokorná
Nemocnice Tomáše Bati ve Zlíně, Interní oddělení
Havlíčkovo nábřeží 600, 762 75 Zlín
Článek přijat redakcí: 2. 3. 2021
Článek přijat po recenzích: 16. 5. 2021
Zdroje
1. Büchler T et al. Speciální onkologie. Maxdorf: Praha 2017 : 33–37, ISBN 978-80-7345-539-2.
2. Souček M et al. Vnitřní lékařství, 1. díl. In: Souček M, Špinar J, Vorlíček J (eds) et al. Grada: Praha 2011 : 572–573, ISBN 978-80-247-2110-1.
3. Rajan A, Zhao C. Deciphering the biology of thymic epithelial tumors. Mediastinum. 2019; 3 : 36. Dostupné z DOI:.
4. Adam Z, Krejčí M, Vorlíček J et al. Speciální onkologie. Příznaky, diagnostika a léčba maligních chorob. Galén: Praha 2010 : 49–53, ISBN 978-80-7262-648-9.
5. Sun L, Li H, Luo H et al. Thymic epithelial cell development and its dysfunction in human diseases. Biomed Res Int. 2014; 2014 : 206929. Dostupné z DOI:.
6. Alexandropoulos K, Bonito AJ, Weinstein EG et al. Medullary thymic epithelial cells and central tolerance in autoimmune hepatitis development: novel perspective from a new mouse model. Int J Mol Sci. 2015; 16(1): 1980–2000. Published 2015 Jan16. Dostupné z DOI:.
7. Shelly S, Agmon-Levin N, Altman A et al. Thymoma and autoimmunity. Cell Mol Immunol. 2011; 8(3): 199–202. Dostupné z DOI:.
8. Blum TG, Misch D, Kollmeier J et al. Autoimmune disorders and paraneoplastic syndromes in thymoma. J Thorac Dis. 2020;12(12):7571-7590. Dostupné z DOI:.
9. Suzuki K, Inomata M, Shiraishi S et al. Thymoma with autoimmune hemolytic anemia. Case Rep Oncol. 2014;7(3):764-768. Published 2014 Nov 19. Dostupné z DOI:.
10. Fletcher AL, Calder A, Hince MN et al. The contribution of thymic stromal abnormalities to autoimmune disease. Crit Rev Immunol. 2011; 31(3): 171–187. Dostupné z DOI:.
11. Fábryová V, Cupaníková D, Grmanová L et al. Imunohematológia a transfúzna medicína pre prax. In: Libuša Ceizelová, Adriena Sakalová. Grada: Bratislava 2012 : 69–70, ISBN 978-80-8090-002-1.
12. Go RS, Winters JL, Kay NE. How I treat autoimunne hemolytic anemia. Blood 2017; 129(22): 2971–2979. Dostupné z DOI:.
13. Adam Z, Belada D, Bělohlávková P et al. Léčebné postupy v hematologii 2020. Doporučení České hematologické společnosti České lékařské společnosti Jana Evangelisty Purkyně. In Doubek M, Mayer J. Česká hematologická společnost ČLS JEP: 2020 : 481-485, ISBN 978-80-270-8240-7. Dostupné z WWW:.
14. Zhao J, Bhatnagar V, Ding L et al. A systematic review of paraneoplastic syndromes associated with thymoma: Treatment modalities, recurrence, and outcomes in resected cases. J Thorac Cardiovasc Surg. 2020; 160(1): 306–314.e14. Dostupné z DOI:. Vydáváme knihy
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2021 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Použití léků vyvinutých pro jiné indikace v léčbě infekce covid-19
- Cílené a biologické léky v léčbě zánětlivých revmatických onemocnění
- Léčba střevních zánětů ve 21. století – individualizovaná terapie a telemedicína
- Biologická léčba dyslipidemií
- Sledování dynamiky klinických a laboratorních markerů chronického srdečního selhání při 12měsíční léčbě sacubitril/valsartanem
- Význam a úspěšnost léčby hypertenze nejen u pacientů s diabetes mellitus 2. typu
- Obrovskobuněčná arteriitida: kontroverzní otázky
- Chronická obstrukční plicní nemoc – diagnóza a léčba stabilní fáze onemocnění; personalizovaný přístup k léčbě s využitím fenotypických rysů nemoci Souhrn pozičního dokumentu České pneumologické a ftizeologické společnosti 2020–2021
- Thymom – onemocnění mnoha tváří
- Efektivní komunikace lékař – pacient při časné intervenci hypertenze a dyslipidemie
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Chronická obstrukční plicní nemoc – diagnóza a léčba stabilní fáze onemocnění; personalizovaný přístup k léčbě s využitím fenotypických rysů nemoci Souhrn pozičního dokumentu České pneumologické a ftizeologické společnosti 2020–2021
- Thymom – onemocnění mnoha tváří
- Cílené a biologické léky v léčbě zánětlivých revmatických onemocnění
- Biologická léčba dyslipidemií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



