-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Manažment liečby pacientov s neuroendokrinnými nádormi tráviaceho traktu
Management of treatment in patients with neuroendocrine neoplasmas of digestive tract
Neuroendocrine neoplasmas are a form of cancer arising from cells of diffuse neuroendocrine system. They produce peptides or amines that act as hormones or neurotransmitters. Incidence of NENs is relatively low. Diagnostic work-up and treatment requires a multidisciplinary team approach. The aim of this study was an analysis of data from patients with well-differentiated neuroendocrine neoplasmas of gastrointestinal tract. The study included patients followed up from 1998 to 2013 with histologically confirmed well-differentiated digestive neuroendocrine neoplasm with low or intermediate malignant potential. 97 patients were included; 34 men (35.1 %) and 63 women (64.9 %). In patients being diagnosed after 2005 interferon treatment is significantly less used than endoscopic and peptide receptor radionuclide therapy. We have identified more appropriate discriminant values of 5-HIAA and chromogranin A (6.8 mg/24 hours; 70 ng/ml) for predicting the presence of metastases at the time of diagnosis. We have identified following risk factors for overall mortality: liver metastases, presence of diarrhea, flush, small bowel primary tumor, high values of CgA and 5-HIAA at the time of diagnosis (5-HIAA > 520.52 mg/24 hours, CgA > 174.5 ng/ml). Surgical treatment was found to be a positive prognostic factor.
Key words:
chromogranin A – 5-hydroxyindoleacetic acid – neuroendocrine neoplasm
Autoři: Soňa Kiňová 1; Martina Kováčová 1; Martin Čaprnda 2; Michal Koreň 1
Působiště autorů: I. interná klinika LF UK a UN Bratislava, Slovenská republika, prednostka doc. MUDr. Soňa Kiňová, PhD. 1; II. interná klinika LF UK a UN Bratislava, Slovenská republika, prednosta doc. MUDr. Ľudovít Gašpar, CSc. 2
Vyšlo v časopise: Vnitř Lék 2015; 61(Suppl 5): 12-20
Kategorie: Původní práce
Souhrn
Neuroendokrinné nádory (NEN) vychádzajú z buniek difúzneho neuroendokrinného systému. Produkujú peptidy alebo amíny, ktoré účinkujú ako hormóny alebo neurotransmitery. Incidencia NEN je pomerne nízka. Diagnostika a liečba týchto tumorov je multidisciplinárna. Cieľom práce bola analýza súboru pacientov s dobre diferencovaným neuroendokrinným nádorom tráviaceho traktu. Zaradení boli pacienti sledovaní od roku 1998 do roku 2013, ktorí mali histologicky potvrdený dobre diferencovaný, nízko alebo stredne malígny neuroendokrinný nádor gastrointestinálneho traktu. Do súboru bolo zaradených 97 pacientov. Z toho 34 (35,1 %) mužov a 63 (64,9 %) žien. Zistili sme, že v liečbe pacientov so stanovením diagnózy po roku 2005 sa signifikantne menej využíva interferón a signifikantne častejšie sa využíva endoskopická a PRRT liečba. Identifikovali sme najvhodnejší diskriminant pre rozdelenie pacientov z hľadiska výskytu metastáz v čase stanovenia diagnózy podľa hladiny 5-HIAA na 6,8 mg/24 hod, podľa hladiny CgA na 70 ng/ml. Identifikovali sme nasledovné rizikové faktory pre celkovú mortalitu: pečeňové metastázy, hnačky, flush, lokalizácia primárneho tumoru v tenkom čreve, vysoké hodnoty CgA a 5-HIAA v čase stanovenia diagnózy (5-HIAA > 520,52 mg/24 hod, CgA > 174,5 ng/ml). Ako pozitívny prognostický faktor sme identifikovali chirurgickú liečbu.
Kľúčové slová:
chromogranín A – kyselina 5-hydroxyindoloctová – neuroendokrinný nádorÚvod
Neuroendokrinné nádory (NEN) nepatria medzi časté malignity, ale sú z klinického hľadiska dôležité, pretože ich diagnostika a liečba je v mnohých aspektoch odlišná od klasických malígnych nádorov [1,15]. V posledných desaťročiach došlo podľa niektorých údajov k dramatickému nárastu incidencie týchto tumorov. Napr. v Spojených štátoch vzrástla incidencia z 1,09 na 5,25 prípadov na 100 000 obyvateľov v rokoch 1973–2004 [14]. Diagnostika a liečba neuroendokrinných nádorov je multidisciplinárna, vyžaduje si spoluprácu viacerých špecialistov [8].
Neuroendokrinný nádor vychádza z buniek difúzneho neuroendokrinného systému. Produkuje peptidy alebo amíny, ktoré účinkujú ako hormóny alebo neurotransmitery. Ich zvýšené hladiny v sére sú zvyčajne zodpovedné za vedľajšie prejavy nádoru. Podľa produkcie konkrétneho amínu (peptidu) ich nazývame aj gastrinómy, inzulinómy, VIP-ómy, somatostatinómy a iné. Aj napriek tomu, že sú v rôzne vysokom percente malígne (10–90 %) a vytvárajú lokálne a vzdialené metastázy, majú podstatne lepšiu prognózu ako klasické gastrointestinálne karcinómy. Podľa prítomnosti klinických prejavov ich delíme na funkčné a nefunkčné. Funkčnosť nádoru znamená prítomnosť klinických prejavov karcinoidného syndrómu alebo syndrómu vyvolaného príslušným hormónom produkovaným tumorom, spolu so zvýšenou koncentráciou špecifických hormónov v sére pacienta. Vo všeobecnosti majú nefunkčné nádory horšiu prognózu. Dôvodom je neskoršia klinická manifestácia [2].
Stanovenie diagnózy NEN-u závisí od prítomnosti lokálnych príznakov nádoru alebo jeho hormonálnej produkcie [3]. Diagnostický algoritmus by mal vychádzať z klinických príznakov a primárnej lokalizácie NEN-ov. Keďže až 75 % nádorov je lokalizovaných v tráviacom trakte, začíname lokalizačnú diagnostiku práve tam. Po ultrasonografickom vyšetrení brucha nasleduje endoskopické vyšetrenie gastrointestinálneho traktu (GIT), CT enteroklýza a CT abdomen, pri podozrení na nádor pankreasu endosonografické vyšetrenie. V rámci staging ochorenia dopĺňame CT hrudníka, somatostatínovú receptorovú scintigrafiu (Octreoscan) a PET CT vyšetrenie [2].
V terapii je podobne ako pri iných solídnych nádorových ochoreniach na prvom mieste snaha o odstránenie – resekciu tumoru, a pokiaľ je to možné aj o resekciu metastáz. Rozsah chirurgického výkonu závisí na primárnej lokalizácii nádoru a pokročilosti ochorenia [3]. Podľa štúdie PROMID je biologická liečba oktreotidom LAR liečbou voľby u pacientov s novodiagnostikovaným, funkčne aktívnym alebo neaktívnym, dobre diferencovaným metastatickým midgut NEN-om s nízkym objemom hepatálnych metastáz [11]. Na základe výsledkov štúdie CLARINET má lanreotid AUTOGEL antiproliferatívny účinok a odporúča sa pri liečbe pokročilých, resp. metastatických pankreatických a midgut tumorov G1 a G2 (Ki67 < 10 %) NEN-ov [1].
Vzhľadom na nízku efektívnosť cytostatickej liečby a s prihliadnutím k jej nežiadúcim účinkom, sa má dnes cytostatická liečba indikovať iba v pokročilých fázach ochorenia, keď dôjde ku zlyhaniu alternatívnych liečebných postupov, alebo pokiaľ ide histologicky o anaplastické a málo diferencované neuroendokrinné karcinómy [3]. Izotopová liečba (peptid receptor radionuclid therapy – PRRT), je modalitou, ktorá sa využíva v terapii inoperabilných alebo metastazujúcich gastroenteropankreatických nádorov [4]. Pri tejto liečbe sa využíva schopnosť nádorov vychytávať rádionuklidom značený oktreotid [13].
Cieľ práce
Cieľom práce bola analýza súboru pacientov s dobre diferencovaným neuroendokrinným nádorom gastrointestinálneho traktu s hlavným dôrazom na liečbu. Porovnávali sme typ liečby a 5-ročné prežívanie u pacientov so stanovením diagnózy pred rokom a po roku 2005. Súčasne sme analyzovali pacientov podľa výskytu metastáz v čase stanovenia diagnózy. Cieľom bolo aj určenie najvhodnejšieho diskriminantu pre rozdelenie pacientov z hľadiska výskytu metastáz podľa hladiny kyseliny 5-hydroxyindoloctovej (5-HAA) a chromogranínu A v čase stanovenia diagnózy. Posledným cieľom bolo určenie 5-ročného prežívania a identifikovanie rizikových faktorov pre celkovú mortalitu.
Súbor pacientov a metodika
Do súboru boli zaradení pacienti sledovaní na endokrinologickej ambulancii I. internej kliniky LF UK a UN Bratislava v období od roku 1998 do roku 2013. Pacienti zaradení do súboru mali histologicky potvrdený dobre diferencovaný nízko (G1) alebo stredne malígny (G2) neuroendokrinný nádor. Pacienti s vysoko malígnymi neuroendokrinnými karcinómami neboli do súboru zaradení. Do štúdie bolo zaradených 97 pacientov. U každého pacienta boli zaevidované základné demografické údaje, osobná a rodinná anamnéza s ohľadom na malígne ochorenia, vek v čase stanovenia diagnózy, symptómy, origo tumoru, prítomnosť alebo neprítomnosť metastáz, laboratórne hodnoty, typ liečby a prežívanie. V rámci laboratórnych vyšetrení boli analyzované viaceré parametre (NSE, CEA, CgA, 5-HIAA), ktoré boli zaznamenané v čase stanovenia diagnózy a počas ďalšieho sledovania pacienta.
Na štatistickú analýzu bol použitý štatistický program SPSS for Windows, verzia 19, od firmy IBM. Použité boli funkcie deskriptívnej štatistiky, Kolmogorovov-Smirnovov test, Pearsonov χ2 test, Kaplanove-Meierove krivky, Mantelov-Coxov test, Mannov-Whitneyho U-test, dvojcestný nepárový Studentov T-test, Coxova regresná analýza a ROC analýza.
Základná charakteristika súboru
Do súboru bolo zaradených spolu 97 pacientov. Z toho 34 (35,1 %) mužov a 63 (64,9 %) žien. Nezaznamenali sme signifikantný rozdiel vo veku mužov (49,94 ± 17,00) a žien (49,83 ± 14,35). Duplicita tumoru sa vyskytla u 7 (7,2 %) pacientov. Pozitívnu rodinnú anamnézu v zmysle malígneho ochorenia malo 25 (25,8 %) pacientov. Do decembra roku 2013 zo súboru zomrelo 25 (25,8 %) pacientov.
Prvú skupinu tvoria pacienti, ktorých diagnóza bola stanovená pred rokom 2005. Druhá skupina pacientov mala diagnózu stanovenú po roku 2005. V skupine s diagnózou pred rokom 2005 bolo spolu 36 pacientov, z toho 15 mužov a 21 žien. Priemerný vek v čase stanovenia diagnózy u týchto pacientov bol 46,50 ± 16,91 rokov. Druhú skupinu s diagnózou stanovenou po roku 2005 tvorí 61 pacientov, z toho 19 mužov a 42 žien. Priemerný vek v čase stanovenia diagnózy v tejto skupine je 51,85 ± 13,94 rokov. Rozdiel vo veku pacientov medzi skupinami, u ktorých bola diagnóza stanovená pred a po roku 2005, nebol štatisticky signifikantný (p = 0,091). Základnú charakteristiku súboru aj so základnou klinickou charakteristikou uvádza tab. 1. Medzi sledovanými parametrami ako výskyt metastáz (MTS), príznakov, osobná anamnéza (OA), rodinná anamnéza (RA) neboli zistené signifikantné rozdiely.
Tab. 1. Základná charakteristika súboru + základná klinická charakteristika s ohľadom na rok stanovenia diagnózy 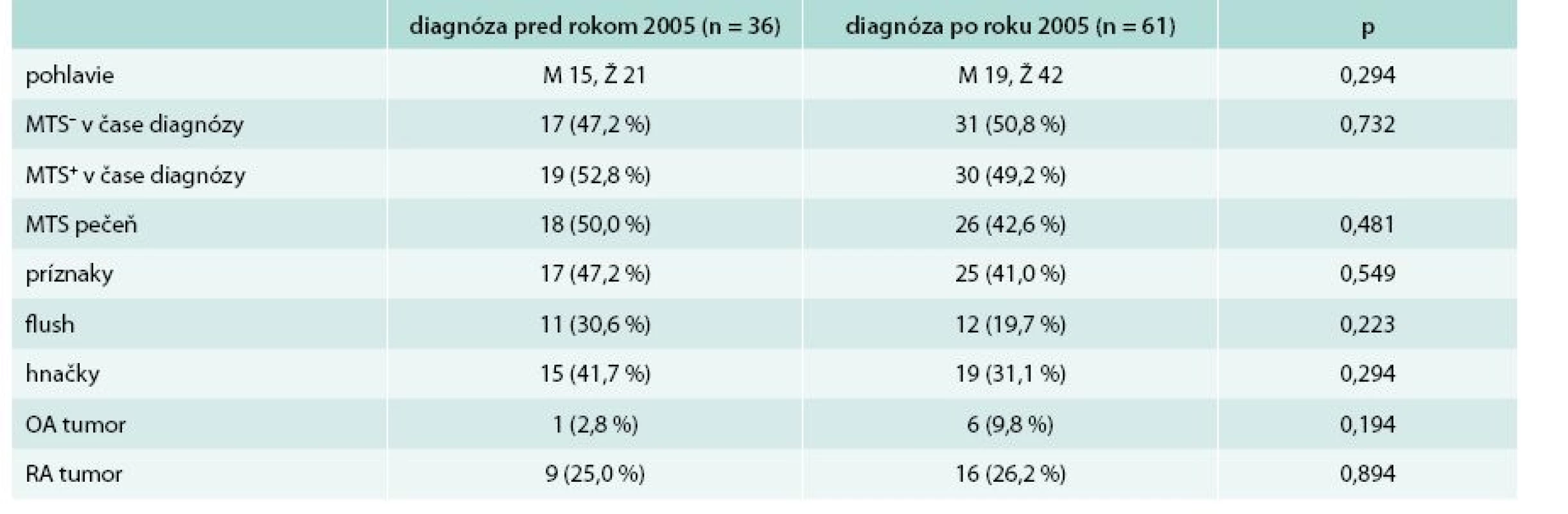
MTS- – bez prítomnosti metastáz MTS+ – s prítomnosťou metastáz OA – osobná anamnéza p – štatistická významnosť podľa Pearsonovho χ2 testu RA – rodinná anamnéza Výsledky
U pacientov so stanovením diagnózy po roku 2005 sa signifikantne častejšie využívala endoskopická (p = 0,012) a PRRT (p = 0,041) liečba. Na druhej strane po roku 2005 došlo k signifikantnému poklesu využívania liečby interferónom (p = 0,042). Kompletný prehľad liečby pacientov so stanovením diagnózy pred a po roku 2005 sa nachádza v tab. 2.
Tab. 2. Liečba pacientov so stanovením diagnózy pred a po roku 2005 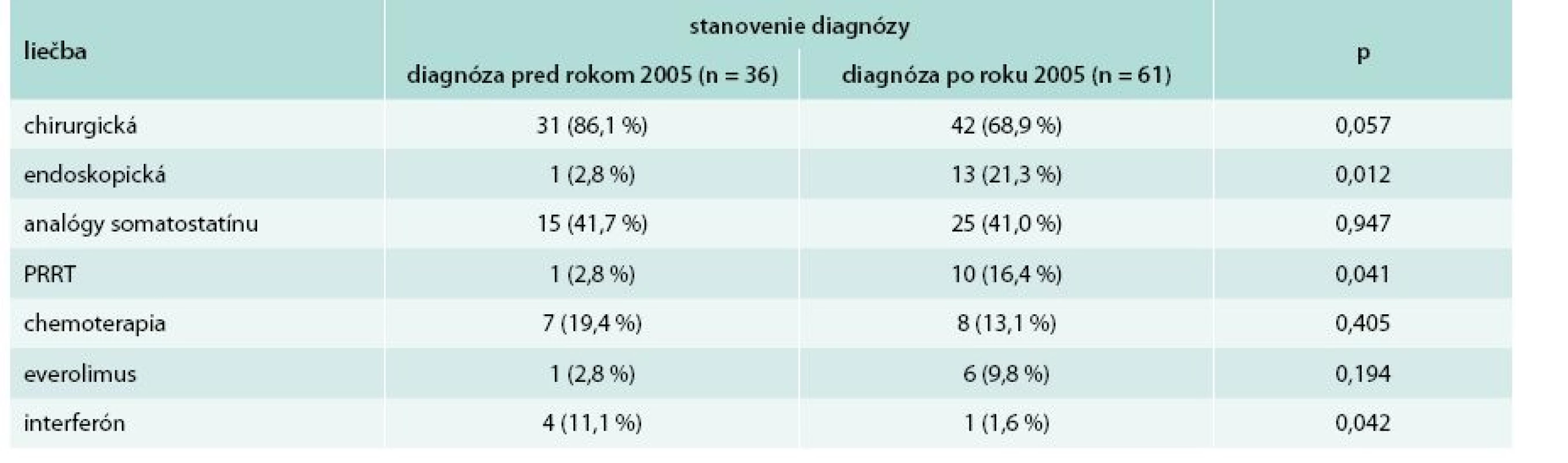
p – štatistická významnosť podľa Pearsonovho χ2 testu PRRT – Peptide Receptor Radionuclide Therapy/izotopová liečba V skupine pacientov so stanovenou diagnózou pred rokom 2005 sme zaznamenali úmrtie do 5 rokov od stanovenia diagnózy u 5 pacientov (13,9 %). V skupine so stanovenou diagnózou po roku 2005 zomrelo do 5 rokov od stanovenia diagnózy 8 pacientov (13,1 %). Rozdiel v počte pacientov, ktorí zomreli do 5 rokov od stanovenia diagnózy, nebol v skupinách so stanovenou diagnózou pred a po roku 2005 signifikantný (p = 0,914). Päťročné prežívanie pacientov od času stanovenia diagnózy uvádza tab. 3.
Tab. 3. 5-ročné prežívanie pacientov od času stanovenia diagnózy pred a po roku 2005 
p – štatistická významnosť podľa Pearsonovho χ2 testu Metastatické postihnutie v čase stanovenia diagnózy
Nasledujúce rozdelenie súboru zohľadňuje prítomnosť alebo neprítomnosť metastatického postihnutia v čase stanovenia diagnózy. V skupine bez metastatického postihnutia v čase stanovenia diagnózy sa nachádzalo 48 (49,5 %) pacientov, z toho 14 mužov (29,2 %) a 34 žien (70,8 %). V skupine s metastatickým postihnutím v čase stanovenia diagnózy bolo zaradených 49 (50,5 %) pacientov, z toho 20 mužov (40,8 %) a 29 žien (59,2 %). Priemerný vek v čase stanovenia diagnózy u pacientov bez metastatického postihnutia bol 43,81 ± 16,57 rokov, u pacientov s metastatickým postihnutím bol priemerný vek 55,80 ± 11,10 rokov. Pacienti s metastatickým postihnutím boli v čase stanovenia diagnózy signifikantne starší (p = 0,003) v porovnaní s tými, ktorí metastázy v čase stanovenia diagnózy nemali. Tab. 4 uvádza základnú charakteristiku súboru a základnú klinickú charakteristiku. Najčastejšia lokalizácia primárneho nádoru u pacientov bez metastatického postihnutia bol apendix. V skupine pacientov s metastatickým postihnutím v čase stanovenia diagnózy sa primárny tumor najčastejšie nachádzal v ileu. Porovnanie lokalizácie primárneho nádoru z hľadiska výskytu metastáz v čase stanovenia diagnózy sa nachádza v tab. 5.
Tab. 4. Základná charakteristika súboru + základná klinická charakteristika s ohľadom na výskyt metastáz (MTS) v čase stanovenia diagnózy 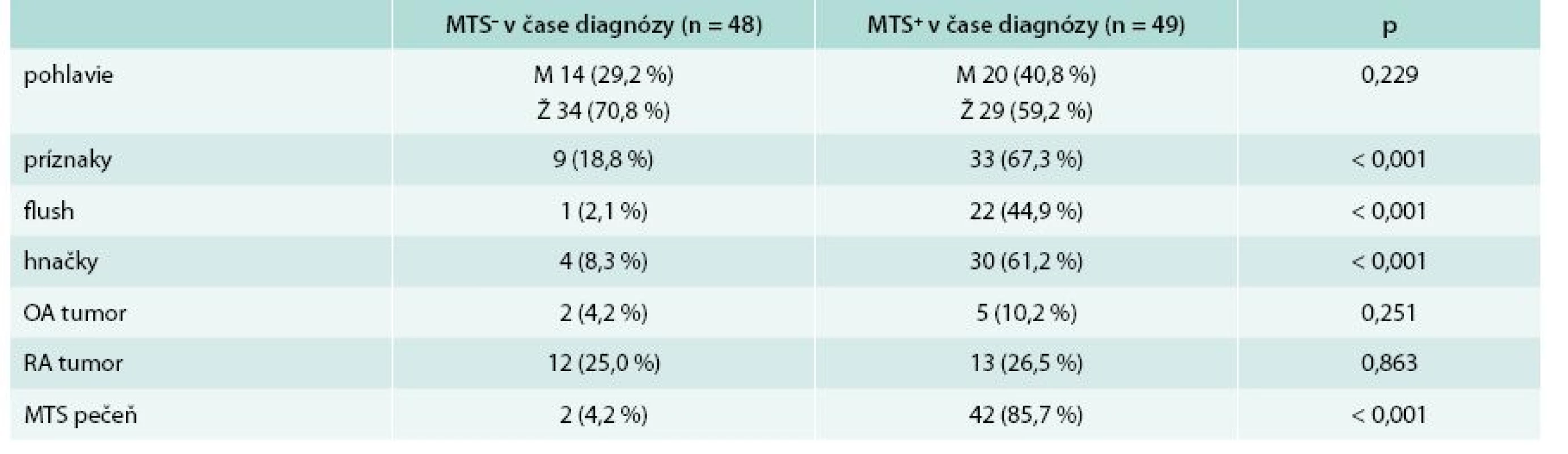
MTS – metastázy OA – osobná anamnéza p – štatistická významnosť podľa Pearsonovho χ2 testu RA– rodinná anamnéza Tab. 5. Porovnanie lokalizácie primárneho tumoru z hľadiska výskytu metastáz v čase stanovenia diagnózy 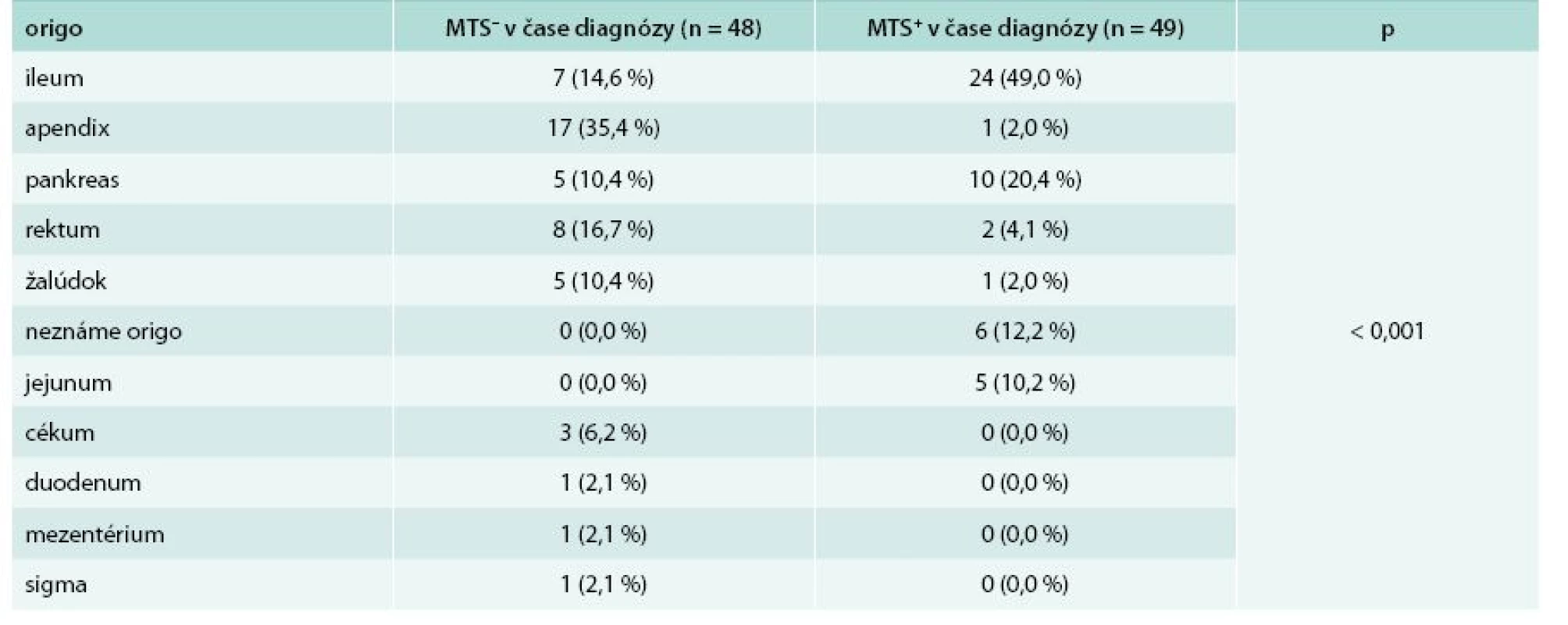
MTS- – bez prítomnosti metastáz MTS+ – s prítomnosťou metastáz p – štatistická významnosť podľa Pearsonovho χ2 testu U pacientov bez metastatického postihnutia v čase stanovenia diagnózy bola najčastejšie indikovaná chirurgická liečba v 75,0 %. V skupine pacientov s metastatickým postihnutím v čase stanovenia diagnózy dominovala liečba somatostatínovými analógmi, ktorá bola indikovaná u 38 (77,6 %) pacientov. Kompletný prehľad liečby sa nachádza v tab. 6.
Tab. 6. Porovnanie liečby u pacientov z hľadiska výskytu metastáz v čase stanovenia diagnózy 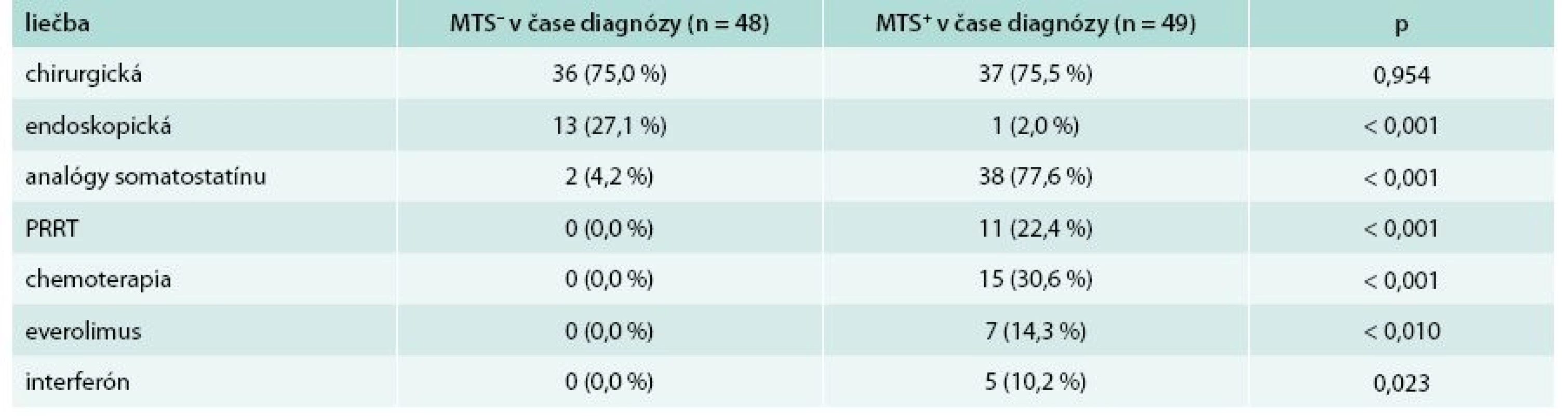
MTS- – bez prítomnosti metastáz MTS+ – s prítomnosťou metastáz p – štatistická významnosť podľa Pearsonovho χ2 testu PRRT – Peptide Receptor Radionuclide Therapy/izotopová liečba V súbore pacientov bolo sledované 5-ročné prežívanie od doby stanovenia diagnózy. Dlhšie ako 5 rokov od stanovenia diagnózy prežívalo 84 (86,6 %) pacientov, z toho 27 (32,1 %) mužov a 57 (67,9 %) žien. Do 5 rokov od stanovenia diagnózy zomrelo 13 (13,4 %) pacientov z celého sledovaného súboru. Z toho zomrelo 7 (53,8 %) mužov a 6 (46,2 %) žien. Všetci pacienti (100 %), ktorí do 5 rokov zomreli, mali metastázy v čase stanovenia diagnózy. Každý pacient, ktorý do 5 rokov zomrel, mal metastázy v pečeni. Väčšina pacientov (92,3 %) zo skupiny tých, ktorí neprežili 5 rokov, mala príznaky v čase stanovenia diagnózy. Z príznakov boli prevažne zaznamenané hnačky, ktoré udávalo 11 (84,6 %) pacientov, flush sa pozoroval u 6 (46,2 %) pacientov. Z analýzy súboru pacientov, ktorých prežívanie bolo kratšie ako 5 rokov od stanovenia diagnózy, vyplynulo signifikantne vyššie riziko úmrtia do 5 rokov u pacientov s metastatickým postihnutím pečene (p < 0,001) v čase stanovenia diagnózy, ako aj u pacientov s klinickými prejavmi ako sú hnačky (p < 0,001) a flush (p = 0,041) v čase stanovenia diagnózy. Kompletnú charakteristiku súboru z hľadiska 5-ročného prežívania od doby stanovenia diagnózy uvádza tab. 7.
Tab. 7. Charakteristika súboru s ohľadom na 5-ročné prežívania od času stanovenia diagnózy 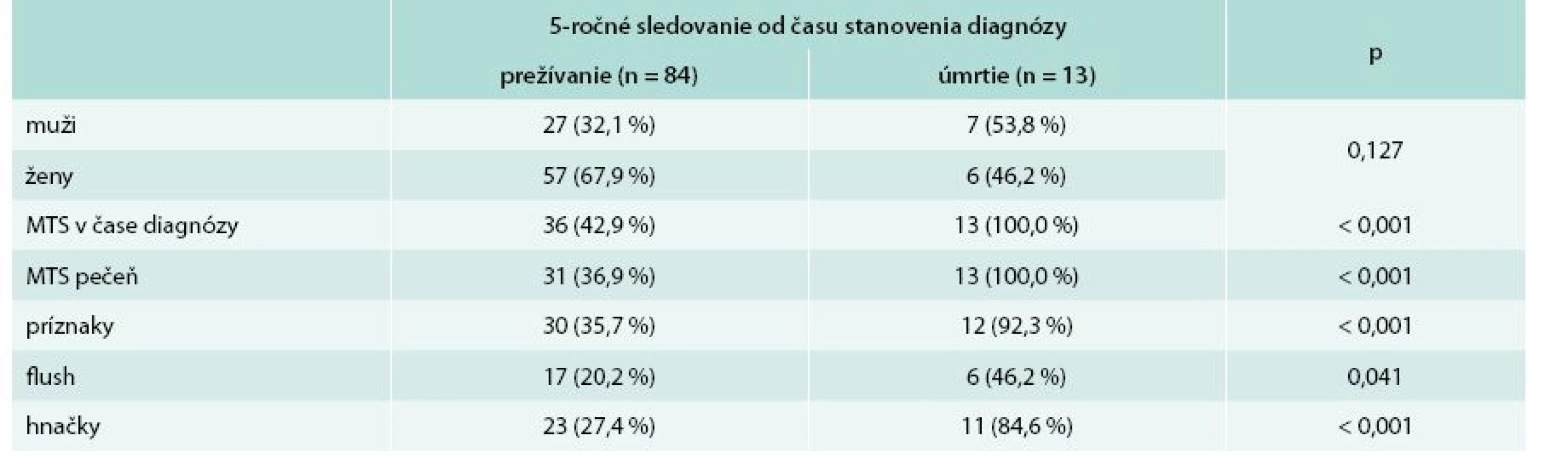
p – štatistická významnosť podľa Pearsonovho χ2 testu Na grafe 1 je zobrazená mortalita pacientov pomocou Kaplanových-Meierových kriviek podľa prežívania v skupinách pacientov s hnačkami a bez hnačiek v čase stanovenia diagnózy. Z Mantelovho-Coxovho testu vyplýva, že pacienti, ktorí mali v čase stanovenia diagnózy hnačky, mali signifikantne (p < 0,001) horšie 5-ročné prežívanie v porovnaní s pacientmi, ktorí hnačky v čase stanovenia diagnózy nemali.
Graf 1. Kaplanova-Meierova krivka, porovnanie prežívania v skupinách pacientov s hnačkami a bez hnačiek v čase stanovenia diagnózy 
p < 0,001 (Mantelov-Coxov test) Tab. 8 uvádza porovnanie liečby pacientov s ohľadom na 5-ročné prežívanie. U pacientov, ktorí prežívali dlhšie ako 5 rokov, dominovala liečba chirurgická (78,6 %). Najčastejšie používanou liečebnou modalitou v skupine pacientov s prežívaním kratším ako 5 rokov boli somatostatínové analógy (84,6 %).
Tab. 8. Porovnanie liečby s ohľadom na 5-ročné prežívanie od času stanovenia diagnózy 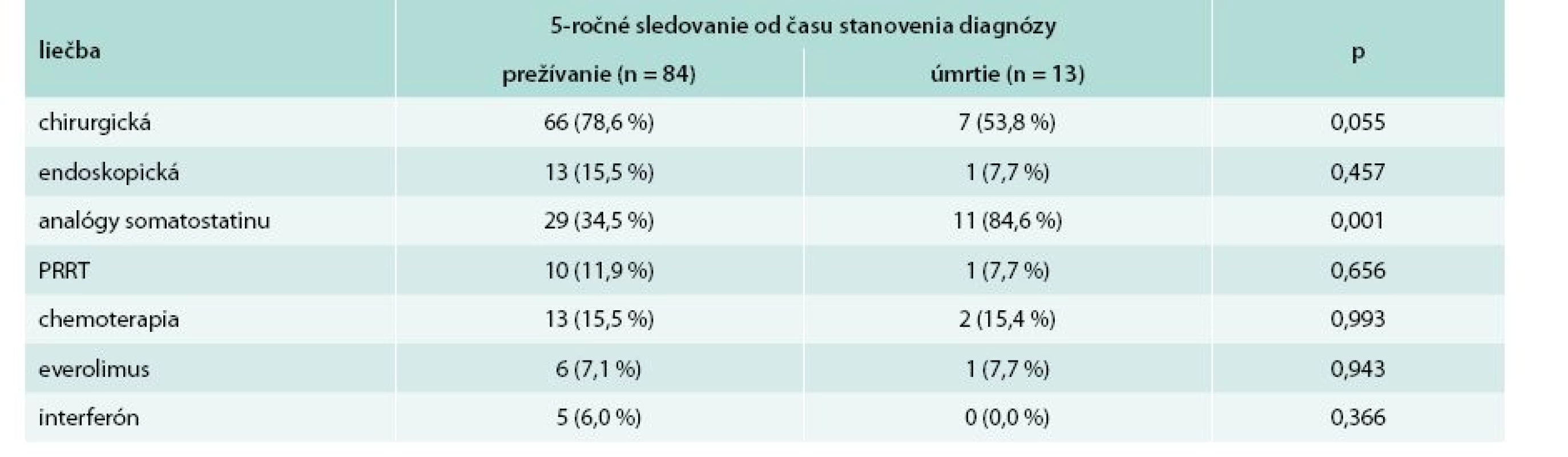
p – štatistická významnosť podľa Pearsonovho χ2 testu PRRT – Peptide Receptor Radionuclide Therapy/izotopová liečba Na grafoch 2 a 3 je zobrazená mortalita pacientov s ohľadom na liečbu somatostatínovými analógmi a chirurgickú liečbu pomocou Kaplanových-Meierových kriviek. Z Mantelovho-Coxovho testu vyplýva, že pacienti, ktorí boli liečení analógmi somatostatínu, majú signifikantne (p = 0,002) horšie 5-ročné prežívanie v porovnaní so skupinou pacientov, ktorí nevyžadovali liečbu somatostatínovými analógmi. Pacienti, ktorí podstúpili chirurgickú liečbu, mali signifikantne (p = 0,043) lepšie 5-ročné prežívanie v porovnaní s tými, ktorí túto liečbu nepodstúpili.
Graf 2. Kaplanova-Meierova krivka, porovnanie prežívania v skupinách pacientov s ohľadom na liečbu somatostatínovými analógmi 
p = 0,002 (Mantelov-Coxov test) Graf 3. Kaplanova-Meierova krivka, porovnanie prežívania v skupinách pacientov s ohľadom na chirurgickú liečbu 
p = 0,043 (Mantelov-Coxov test) Najviac zastúpenou lokalizáciou primárneho tumoru v skupine pacientov s úmrtím do 5 rokov bolo ileum (38,5 %), po ňom nasleduje neznáme origo (23,1 %). Viac ako polovica pacientov (53,9 %) s prežívaním kratším ako 5 rokov mala nádor lokalizovaný v tenkom čreve (ileum, jejunum).
Laboratórne parametre
Najvyššie hodnoty CgA a 5-HIAA v čase stanovenia diagnózy dosahovali pacienti s metastatickým postihnutím, ktorí zomreli do 5 rokov od stanovenia diagnózy. Graf 4 zobrazuje špecificitu a senzitivitu 5-HIAA s ohľadom na výskyt metastáz. Z analyzovaných hodnôt sme stanovili hladinu 5-HIAA s najlepšou senzitivitou (95,7 %) s ohľadom na špecificitu (58,8 %) na 6,8 mg/24 hod. Graf 5 zobrazuje špecificitu a senzitivitu CgA s ohľadom na výskyt metastáz. Z analyzovaných hodnôt sme stanovili hladinu CgA s najlepšou senzitivitou (90 %) s ohľadom na špecificitu (78,9 %) na 70 ng/ml. Graf 6 zobrazuje špecificitu a senzitivitu CgA s ohľadom na 5-ročné prežívanie. Z analyzovaných hodnôt sme stanovili hladinu CgA s najlepšou senzitivitou (83,3 %) s ohľadom na špecificitu (78,8 %) na > 174,5 ng/ml. Graf 7 zobrazuje špecificitu a senzitivitu 5-HIAA s ohľadom na 5-ročné prežívanie. Z analyzovaných hodnôt sme stanovili hladinu 5-HIAA s najlepšou senzitivitou (66,7 %) s ohľadom na špecificitu (100 %) na > 520,52 mg/24 hod.
Graf 4. Research operator curve (ROC) analýza, špecificita a senzitivita 5-HIAA v čase stanovenia diagnózy s ohľadom na výskyt metastáz 
Graf 5. Research operator curve (ROC) analýza, špecificita a senzitivita CgA v čase stanovenia diagnózy s ohľadom na výskyt metastáz 
Graf 6. Research operator curve (ROC) analýza, špecificita a senzitivita CgA v čase stanovenia diagnózy s ohľadom na 5-ročné prežívanie 
Graf 7. Research operator curve (ROC) analýza, špecificita a senzitivita 5-HIAA v čase stanovenia diagnózy s ohľadom na 5-ročné prežívanie 
Diskusia
V našej práci sme analyzovali súbor pacientov s neurendokrinným nádorom gastrointestinálneho traktu. Pozitívnu rodinnú anamnézu v zmysle malígneho ochorenia malo 25 (25,8 %) pacientov. Podľa literárnych údajov je incidencia NEN v prvostupňovom príbuzenstve 4krát vyššia oproti bežnej populácii, ak sa NET vyskytne u 2 príbuzných, je incidencia až 12krát vyššia. V sledovanom období sa duplicita nádoru v našom súbore vyskytla u 8 (8,2 %) pacientov. Marschall et al v súbore 55 pacientov identifikovali sekundárnu malignitu u 18 % pacientov [7]. Nižší výskyt v našom súbore súvisí s kratším obdobím sledovania.
U pacientov so stanovením diagnózy po roku 2005 sa signifikantne menej využíval v liečbe interferón. V literatúre sa popisuje stabilizácia ochorenia pri liečbe interferónom v 30–40 % prípadoch, k regresii tumoróznej masy však dochádza len v 10–15 %, liečba je pacientmi horšie tolerovateľná pre vedľajšie účinky (flu like syndrome) a nutnosť častejšej aplikácie [4,5]. Preto je liečba interferónom v súčasnosti biologickou liečbou 2. voľby a nahradili ju somatostatínové analogy [1]. U pacientov so stanovením diagnózy po roku 2005 sa podľa našej analýzy signifikantne častejšie využíva endoskopická a PRRT liečba. Vzostup endoskopickej liečby môže súvisieť so zlepšením diagnostiky, preto sú zachytené aj menšie polypoidné útvary, ktorých liečba je endoskopická. Vyšší výskyt PRRT liečby u nás súvisí so spoluprácou nášho pracoviska s pracoviskom nukleárnej medicíny vo Švajčiarsku. PRRT je liečebná modalita, ktorá sa využíva v terapii inoperabilných alebo metastazujúcich gastroenteropankreatických tumorov [5,6]. Ide teda o skupinu pacientov s najhoršou prognózou. Najnovšie dáta uvádzajú kompletnú alebo parciálnu odozvu u 28 % pacientov, medián pre progresiu viac ako 38 mesiacov pre lutécium a benefit prežívania 3,5–6 rokov [4,5].
V analyzovanom súbore sa nachádzalo 48 pacientov bez metastatického postihnutia a 49 pacientov s metastatickým postihnutím v čase stanovenia diagnózy.
Pacienti s metastatickým postihnutím boli v čase stanovenia diagnózy signifikantne starší v porovnaní s tými, ktorí metastázy v čase stanovenia diagnózy nemali.
Vo všeobecnosti sa väčšina metastáz NEN vyskytuje v pečeni, pľúcach a kostiach, ostatné lokality sú zriedkavé [6,14]. V analyzovanom súbore malo v skupine pacientov s metastatickým postihnutím v čase stanovenia diagnózy až 85,7 % pacientov metastatické postihnutie pečene. V skupine pacientov s metastatickým postihnutím udávalo flush 44,9 % pacientov a hnačky až 61,2 % pacientov.
U pacientov bez metastatického postihnutia v čase stanovenia diagnózy sa v našom súbore primárny nádor vyskytoval najčastejšie v apendixe (35,4 %), nasleduje rektum (16,7 %), ileum (14,6 %), pankreas (10,4 %) a žalúdok (10,4 %). V skupine pacientov s metastatickým postihnutím bol primárny tumor najčastejšie lokalizovaný v ileu (49,0 %), nasledoval pankreas (20,4 %), neznáme origo (12,2 %) a jejunum (10,2 %). Pri metastatickom postihnutí bol tumor nájdený v tenkom čreve (ileum + jejunum) až u 59,2 % pacientov. Tento fakt môže súvisieť s ťažšou lokalizačnou diagnostikou nádorov tenkého čreva.
Godwin popísal vo svojej štúdii s 2 837 pacientmi s neuroendokrinným tumorom ako najčastejšiu lokalizáciu primárneho tumoru apendix, rektum a ileum [2]. Modlin et al analyzovali 13 715 pacientov s NET. V ich súbore bol tumor najčastejšie lokalizovaný v tenkom čreve (41,8 %), rekte (27,4 %) a v žalúdku (8,7 %) [7]. Uvedené štúdie nerozdeľovali pacientov podľa metastatického postihnutia, avšak nimi označené najčastejšie lokalizácie primárneho tumoru sa zhodujú s naším pozorovaním.
Podľa európskej a americkej databázy 77 % pacientov s tumorom pankreasu a 91 % pacientov s tumorom čreva majú v čase stanovenia diagnózy metastatické postihnutie [10]. V našom súbore malo 66,7 % pacientov s tumorom pankreasu a 75,7 % pacientov s tumorom čreva metastázy v čase stanovenia diagnózy. Rozdiely medzi našou analýzou a európskou databázou s najväčšou pravdepodobnosťou súvisia s menším počtom pacientov v našom súbore.
U pacientov bez metastatického postihnutia v čase stanovenia diagnózy bola najčastejšie indikovaná chirurgická liečba (75,0 %), druhá najčastejšie využívaná liečebná modalita v tejto skupine pacientov bola liečba využívajúca endoskopické výkony (27,1 %).
V skupine pacientov s metastatickým postihnutím v čase stanovenia diagnózy dominovala liečba somatostatínovými analógmi (77,6 %). Tesne za ňou nasledovala liečba chirurgická (75,5 %). U pacientov s metastatickým postihnutím sa dostala chirurgická liečba na druhé miesto, vzhľadom k tomu, že chirurgické riešenie je často v čase diagnózy už nemožné pre bilobárne postihnutie pečene alebo viac ako 75% postihnutie pečeňového parenchýmu [9].
V súbore pacientov bolo sledované 5-ročné prežívanie od doby stanovenia diagnózy. Dlhšie ako 5 rokov od stanovenia diagnózy prežívalo 86,6 % pacientov. Do 5 rokov od stanovenia diagnózy zomrelo 13,4 % pacientov z celého sledovaného súboru.
Modlin et al vo svojej analýze 13 715 pacientov s NET udávajú 5-ročné prežívanie pre celú skupinu neuroendokrinných tumorov 67,2 % [7]. Lepší výsledok 5-ročného prežívania v našom súbore v porovnaní s prácou Modlina sa dá vysvetliť selekciou nami sledovaných pacientov. V našom súbore sa nachádzajú pacienti v štádiu G1 a G2. Modlin do svojej analýzy zahrnul aj G3 štádium.
Analýzou skupiny pacientov s prežívaním kratším ako 5 rokov sme zistili, že všetci pacienti (100 %) mali metastázy v pečeni v čase stanovenia diagnózy, 84,6 % pacientov udávalo hnačky a 46,2 % pacientov malo flush v čase stanovenia diagnózy. Na základe týchto údajov sme stanovili, že pacienti, ktorí majú v čase stanovenia diagnózy metastatické postihnutie pečene, hnačky a flush, majú signifikantne vyššie riziko úmrtia do 5 rokov od stanovenia diagnózy. Naše závery korelujú s literatúrou, v ktorej sa uvádza, že prítomnosť pečeňových metastáz je jeden z najdôležitejších prognostických faktorov, ktoré dramaticky ovplyvňujú prežívanie pacientov [12].
V skupine pacientov s prežívaním menej ako 5 rokov bol primárny tumor najčastejšie lokalizovaný v ileu (38,5 %). Až polovica pacientov (53,9 %), ktorí zomreli do 5 rokov od stanovenia diagnózy, mala tumor lokalizovaný v tenkom čreve (ileum, jejunum).
U pacientov, ktorí prežívali dlhšie ako 5 rokov, dominovala liečba chirurgická (78,6 %). V skupine pacientov, ktorých prežívanie bolo kratšie ako 5 rokov od stanovenia diagnózy, podstúpilo chirurgickú liečbu 53,8 % pacientov. Z Mantelovho-Coxovho testu vyplynulo, že pacienti, ktorí podstúpili chirurgickú liečbu, mali signifikantne lepšie 5-ročné prežívanie v porovnaní s pacientmi, ktorí túto liečbu nepodstúpili.
Analýzou laboratórnych parametrov sme dospeli k záveru, že najvyššie hodnoty CgA a 5-HIAA v čase stanovenia diagnózy dosahovali pacienti s metastatickým postihnutím, ktorí zomreli do 5 rokov od stanovenia diagnózy. Rozdiel v hodnote kyseliny 5-hydroxyindoloctovej medzi skupinami pacientov s nemetastatickým a metastatickým postihnutím v čase stanovenia diagnózy je signifikantný (5,74 mg/24 hod u pacientov bez MTS, 118,2 mg/24 hod u pacientov s MTS). ROC analýzou bol pre náš súbor určený najvhodnejší diskriminant pre rozdelenie pacientov z hľadiska výskytu metastáz v čase stanovenia diagnózy podľa hladiny 5-HIAA s najlepšou senzitivitou (95,7 %) s ohľadom na špecificitu (58,8 %) na 6,8 mg/24 hod.
Rozdiel v hodnote CgA medzi skupinami pacientov s metastatickým a nemetastatickým postihnutím v čase stanovenia diagnózy je taktiež signifikantný (22,82 ng/ml u pacientov bez MTS, 174,5 ng/ml u pacientov s MTS). ROC analýzou bol pre náš súbor určený najvhodnejší diskriminant pre rozdelenie pacientov z hľadiska výskytu metastáz v čase stanovenia diagnózy podľa hladiny CgA s najlepšou senzitivitou (90 %) s ohľadom na špecificitu (78,9 %) na 70 ng/ml.
Rozdiel v hodnote 5-HIAA v čase stanovenia diagnózy medzi skupinami pacientov, ktorí prežili 5 rokov, a tými, ktorí do 5 rokov zomreli, je signifikantný. ROC analýzou bol pre náš súbor určený najvhodnejší diskriminant pre rozdelenie pacientov z hľadiska 5-ročného prežívania podľa hladiny 5-HIAA v čase stanovenia diagnózy s najlepšou senzitivitou (66,7 %) s ohľadom na špecificitu (100 %) na hodnotu > 520,52 mg/24 hod.
Rozdiel v hodnote CgA v čase stanovenia diagnózy medzi skupinami pacientov, ktorí prežili 5 rokov, a tými, ktorí do 5 rokov zomreli, je signifikantný. ROC analýzou bol pre náš súbor určený najvhodnejší diskriminant pre rozdelenie pacientov z hľadiska 5-ročného prežívania podľa hladiny CgA v čase stanovenia diagnózy s najlepšou senzitivitou (83,3 %) s ohľadom na špecificitu (78,8 %) na hodnotu > 174,5 ng/ml.
Predkladaná štúdia môže byť prínosom a podkladom pre ďalší perspektívny výskum v tejto oblasti.
doc. MUDr. Soňa Kiňová, PhD.
sonakinova@hotmail.com
I. interná klinika LF UK a UN, Bratislava, Slovenská republika
www.fmed.uniba.sk
Doručeno do redakce 20. 7. 2015
Přijato po recenzi 30. 9. 2015
Zdroje
1. Caplin ME, Pavel M, Ćwikła JB et al. CLARINET Investigators. Lanreotide in Metastatic Enteropancreatic Neuroendocrine Tumors. N Engl J Med 2014; 371(3): 224–233.
2. Godwin JD 2nd. Carcinoid tumors. An analysis of 2837 cases. Cancer 1975; 36(2): 560–569.
3. Kiňová S, Kekeňák L, Kováčová E et al. Multidisciplinárny prístup k liečbe gastroenteropankreatických neuroendokrinných tumorov. Vnitř Lék 2010; 56(9 Suppl): S946-S950.
4. Kiňová S, Hulín I. Choroby tráviaceho systému. ProLitera: Bratislava 2011. ISBN 978–80–970253–5-9.
5. Kwekkeboom DJ, Krenning EP, Lebtahi R et al. ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: Peptide Receptor Radionuclide Therapy with Radiolabeled Somatostatin Analogs. Neuroendocrinology 2009; 90(2): 220–226.
6. Maiuri F, Cappabianca P, Del Basso De Caro M et al. Single brain metastases of carcinoid tumors. J Neurooncol 2004; 66(3): 327–332.
7. Marshall JB, Bodnarchuk G. Carcinoid tumors of the gut: Our experience over three decades and review of the literature (Review). J Clin Gastroenterol 1993; 16(2): 123–129.
8. Modlin IM, Lye KD, Kidd M. A 5-decade analysis of 13,715 carcinoid tumors. Cancer 2003; 97(4): 934–959.
9. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Neuroendocrine Tumors. V. 1. 2012. Dostupné z WWW: <http://www.nccn.org/professionals/physician_gls/f_guidelines.asp>.
10. Oberg K. Pancreatic endocrine tumors. Semin Oncol 2010; 37(6): 594–618.
11. Pavel M, Baudin E, Couvelard A et al. ENETS Consensus Guidelines for the Management of Patients with Liver and Other Distant Metastases from Neuroendocrine Neoplasms of Foregut, Midgut, Hindgut, and Unknown Primary. Neuroendocrinology 2012; 95(2): 157–176.
12. Rinke A, Muller HH, Schade-Brittinger C et al. Placebo-Controlled, Double-Blind, Prospective, Randomized Study on the Effect of Octreotide LAR in the Control of Tumor Growth in Patients With Metastatic Neuroendocrine Midgut Tumors: A Report From the PROMID Study Group. J Clin Oncol 2009; 27(28): 4656–4663.
13. Steinmüller T, Kianmanesh R, Falconi M et al. Consensus Guidelines for the Management of Patients with Liver Metastases from Digestive (Neuro)endocrine Tumors: Foregut, Midgut, Hindgut, and Unknown Primary. Neuroendocrinology 2008; 87(1): 47–62.
14. Wagnerova M. Neuroendokrinné nádory z pohľadu onkológa. Onkológia (Bratisl) 2011; 6(4): 205–210.
15. Yao JC, Hassan M, Phan A et al. One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol 2008; 26(18): 3063–3072.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2015 Číslo Suppl 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Manažment liečby pacientov s neuroendokrinnými nádormi tráviaceho traktu
- Špecifiká využitia ambulantného monitorovania krvného tlaku u starších osôb
- Artériová hypertenzia – viacnásobný cievny bludný kruh
- Spomienka na pána profesora Ivana Ďuriša
- Hormonálne zmeny pri chronických zápalových chorobách čreva
- Diagnostika syndrómu polycystických ovárií
- Neobvyklé prípady hypoglykémie – hypoglycaemia factitia
- Je železo dôležité u srdcového zlyhávania?
- Nové diagnostické a liečebné postupy pri diabetickej nefropatii
- Máme venovať pozornosť defektu koagulačného faktora XII?
- Odhalenie pamätnej tabule profesorovi MUDr. Viliamovi Ganzovi, PhD., FACC, dňa 9. októbra 2014 v Košiciach
- Epidemiologické údaje o výskyte hyperurikémie u mužov a u žien v podmienkach primárnej liečebnej starostlivosti na Slovensku
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Máme venovať pozornosť defektu koagulačného faktora XII?
- Diagnostika syndrómu polycystických ovárií
- Artériová hypertenzia – viacnásobný cievny bludný kruh
- Hormonálne zmeny pri chronických zápalových chorobách čreva
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



