-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Katetrizační ablace fokálně spouštěné fibrilace komor u pacientů se strukturálním postižením srdce
Catheter ablation of focus triggering ventricular fibrillation in patients with structural heart disease
First experiences with ablation of focus triggering ventricular fibrillation were reported in isolated cases of idiopathic ventricular fibrillation. Later, there were described the options in management of an electrical instability triggered by ectopic activity in patients after myocardial infarction. In both cases it was shown that the sources of extrasystoles originate almost exclusively from conducting system of chambers. Subsequently, isolated cases were also reported in other structural diseases. It is important that the urgent catheter ablation is able to remove focus which triggers electric instability. In many cases it is a lifesaving procedure. This review summarizes the current knowledge of the catheter ablation of focus triggering ventricular fibrillation with structural heart disease.
Key words:
catheter ablation – Purkinje fibres – ventricular fibrillation
Autoři: Josef Kautzner; Petr Peichl
Působiště autorů: Klinika kardiologie IKEM Praha, přednosta prof. MUDr. Josef Kautzner, CSc.
Vyšlo v časopise: Vnitř Lék 2014; 60(12): 1055-1061
Kategorie: 70. narozeniny prof. MUDr. Michaela Aschermanna, DrSc., FESC, FACC
Souhrn
První zkušenosti s ablací fokálního spouštěče fibrilace komor byly popsány u ojedinělých případů idiopatické fibrilace komor. Později byla popsána možnost zvládnutí elektrické bouře spouštěné ektopickou aktivitou u pacientů po infarktu myokardu. V obou případech bylo prokázáno, že zdroje extrasystol pocházejí téměř výlučně z převodního systému komor. Později byly popsány izolované případy i u dalších strukturních onemocnění. Důležité je, že urgentní katetrizační ablace dokáže odstranit spouštěcí fokus a přerušit tak elektrickou bouři. V mnoha případech jde o život zachraňující výkon. Tento přehled shrnuje současné znalosti o katetrizační ablaci fokálně spouštěné fibrilace komor u strukturního onemocnění srdce.
Klíčová slova:
fibrilace komor – katetrizační ablace – Purkyňova vláknaÚvod
Fibrilace komor (FiK) je komplexní porucha srdečního rytmu, která vede nevyhnutelně k oběhové zástavě. Mechanizmy, díky kterým FiK vzniká a udržuje se, nejsou zcela známy. Předpokládá se, že podobně jako u fibrilace síní, je možné vznik FiK vysvětlit teorií dominantního okruhu (mother rotor theory) [1,2]. Tato hypotéza byla však potvrzena pouze v experimentu na malých zvířatech [3]. U větších savců byl popsán lokalizovaný dominantní zdroj FiK v posteroseptální oblasti levé komory [4–6]. Některé práce ukázaly, že důležitou úlohu může hrát posteriomediální papilární sval, který slouží jako možný kotevní bod pro okruhy funkčního reentry při FiK. Posteroseptální oblast levé komory je místem, kde je přítomna hustá síť Purkyňových vláken převodního systému [7]. Klíčový význam této oblasti na udržení FiK potvrdily experimentální práce, které ukázaly, že katetrizační ablace okolo posteromediálního papilárního svalu může u psího a králičího srdce snížit možnost vyvolání FiK [7–9].
U člověka se na vzniku a udržení FiK pravděpodobně podílí více mechanizmů [13]. Klinické zkušenosti ukazují, že se na spouštění FiK významně podílí fokální ektopická ložiska, která lze ovlivnit katetrizační ablací [10–12]. To platí jak pro nemocné s idiopatickou FiK, tak pro pacienty s FiK při strukturním onemocnění srdce. Cílem tohoto přehledu je uvést souhrn znalostí o možnostech katetrizační ablace fokálně pouštěné FiK u pacientů se strukturním onemocněním srdce.
První zkušenosti s ablací idiopatické FiK
První výkony katetrizační ablace spouštěcích zdrojů FiK byly popsány koncem 90. let minulého století u pacientů bez strukturálního onemocnění srdce. Příkladem může býti námi popsaný případ mladého muže, který byl resuscitován pro oběhovou zástavu při idiopatické FiK [14]. U tohoto nemocného došlo po reimplantaci kardioverteru-defibrilátoru (ICD) k rozvoji elektrické bouře, při níž byla každá epizoda FiK spouštěna monotopní komorovou extrasystolou s krátkým vazebným intervalem okolo 240 ms. Na EKG měla tato extrasystola relativně štíhlý komplex QRS a morfologii blokády pravého Tawarova raménka a levé přední hemiblokády. To svědčilo pro původ ektopie v blízkosti převodního systému zadního svazečku levého Tawarova raménka. Tato lokalizace byla potvrzena endokardiálním mapováním, na němž při extrasystole předcházel lokální elektrogram Purkyňových vláken aktivaci okolního myokardu o 60–80 ms. Katetrizační ablace v tomto místě odstranila komorovou ektopii a potlačila běhy FiK. Podobné případy vedly k vzestupu zájmu o tuto problematiku a vzniku společné studie pod vedením M. Haïssaguerra [10,11]. Pilotní studie i následná analýza 27 pacientů ukázaly, že dominantním zdrojem spouštěcí ektopie je převodní systém pravé či levé komory. První stah FiK (spouštěcí ektopie) měl vždy stejnou morfologii komplexu QRS a krátký vazebný interval (297 ± 41 ms). U 23 pacientů byly zdroje ektopie nalezeny v převodním systému a u 4 pacientů vycházela spouštěcí ektopie z výtokového traktu pravé komory bez vztahu k převodnímu systému. Po provedení katetrizační ablace spouštěcí ektopie nemělo po dobu 24 ± 28 měsíců 24 pacientů (89 %) recidivu FiK.
Dlouhodobé sledování souboru pacientů po katetrizační ablaci idiopatické FiK ukázalo, že během 5 let mělo po katetrizační ablaci recidivu FiK pouze 18 % (7/38) pacientů. Medián doby do recidivy arytmie byl 4 měsíce. Pět z těchto 7 pacientů podstoupilo reablaci, po které nebyly zaznamenány žádné recidivy [15].
Tyto studie potvrdily hypotézu, že FiK bývá (alespoň u části nemocných) spouštěna z jednoho místa, a položily tak základy pro ablaci FiK u pacientů se strukturálním onemocněním srdce.
Fokálně spouštěná FiK u pacientů s ischemickou chorobou srdeční
Fokálně spouštěná FiK byla u ischemické choroby srdeční popsána ve 2 rozdílných klinických situacích: buď časně po akutním infarktu myokardu (přibližně v odstupu 1–2 týdnů), nebo v chronické fázi (měsíce až roky), kdy je již vytvořena kompaktní poinfarktová jizva [12,16–20]. Spouštěcí ektopie opět pocházela z buněk převodního systému lokalizovaných v oblasti nekrózy nebo jizvy po infarktu. V tomto smyslu prokázaly experimentální studie přežívání Purkyňových vláken v oblasti nekrózy při infarktu [21]. To je vysvětlováno jejich větší odolností k ischemii nebo možnosti jejich výživy buď retrográdně z dutiny levé komory přes síť žilních sinusů a žil [22,23], nebo přímou difuzí kyslíku z dutiny levé komory [24]. Tyto ischemizované přežívající buňky přitom mohou vykazovat zvýšenou automaticitu, spouštěnou aktivitu, případně supernormální excitabilitu. Tyto mechanizmy mohou spolu s prodlouženým trváním akčního potenciálu vytvořit potřebné podmínky pro spuštění a udržení polymorfní komorové tachykardie nebo FiK [21,25,26]. Méně jasný je důvod, proč se spouštěcí ektopie objevuje náhle v chronické fázi po infarktu myokardu. Příčinou může být subklinicky probíhající recidiva infarktu nebo akutní ischemie, která zvýší spontánní elektrickou aktivitu přežívajících buněk převodního systému. Některé práce však ukazují, že tito pacienti mohou mít abnormální anatomické struktury, které se na vzniku arytmií podílejí. Nogami et al [27] publikovali kazuistiku pacienta s ischemickou chorobou srdeční, který podstoupil katetrizační ablaci FiK. Pacient později zemřel na srdeční selhání a pitva prokázala v místě katetrizační ablace fibromuskulární trabekulu, která spojovala posteriorní papilární sval a mezikomorové septum. Histologicky byla uprostřed této trabekuly potvrzena přítomnost Purkyňových vláken.
Elektrická bouře časně po infarktu myokardu
U některých pacientů s rozsáhlejším akutním infarktem myokardu dojde navzdory provedené revaskularizaci náhle v subakutní fázi onemocnění k rozvoji elektrické bouře s četnými recidivami polymorfní komorové tachykardie nebo FiK. Bouři lze obvykle dočasně přerušit hlubokou sedací s umělou plicní ventilací a podáváním betablokátorů a amiodaronu (obr. 1). Nicméně často recidivuje při pokusech o ukončení umělé plicní ventilace. První zkušenosti s katetrizační ablací spouštěcí ektopie FiK v těchto téměř ztracených případech publikovali Bänsch et al [12]. Arytmie byly vždy spouštěny monotopními komorovými extrasystolami a obdobně jako u idiopatické FiK byly zdrojem spouštěcí ektopie buňky převodního systému. Ve všech 4 případech vycházela ektopie ze zadního svazečku levého Tawarova raménka. Katetrizační ablace spouštěcí ektopie úspěšně potlačila elektrickou bouři a žádný z pacientů neměl recidivu FiK po dobu sledování od 5 do 33 měsíců. Autoři považovali tento mechanizmus vzniku FiK za velmi vzácný – dle jejich zkušeností bylo provedení katetrizační ablace nutné pouze u 4 uvedených pacientů z 2 340 nemocných s infarktem myokardu (tj. u 0,17 % nemocných). Enjoji et al [16] publikovali podobné zkušenosti s katetrizační ablací u 4 pacientů s akutním koronárním syndromem, nízkou ejekční frakcí levé komory a rekurentními běhy polymorfní komorové tachykardie nebo FiK, a to navzdory provedené revaskularizaci. Ektopická ložiska opět vycházela z převodního systému a byla uložena v posteroseptální části levé komory srdeční.
Obr. 1. Záznam z telemetrie u pacienta po akutním infarktu myokardu, u kterého docházelo k opakovaným recidivám fokálně spouštěných komorových tachykardií navzdory podávání antiarytmik, hluboké sedaci a umělé plicní ventilaci 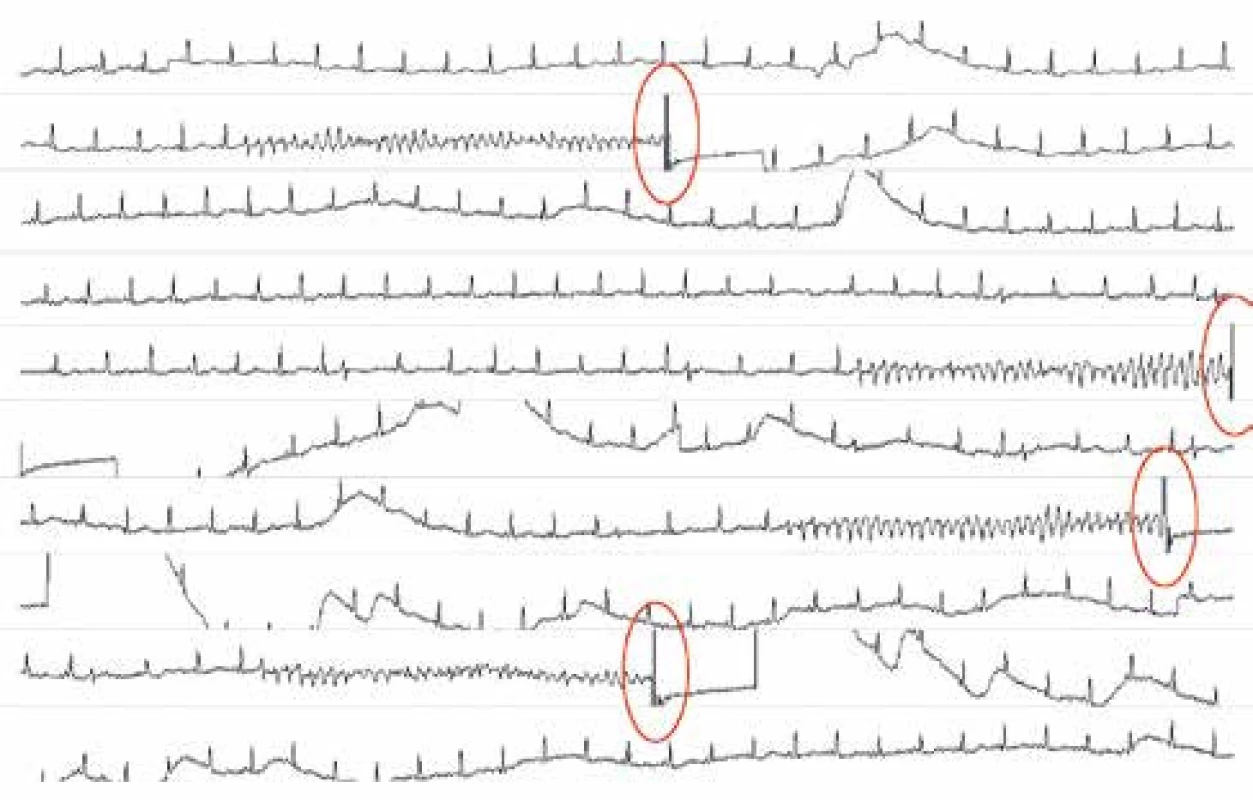
Elektrická bouře v odstupu od akutního infarktu myokardu
I v odstupu od akutního infarktu myokardu mohou hrát roli v genezi FiK ložiska spouštěcí ektopie. Marrouche et al [17] analyzovali způsob inicializace FiK u 29 nemocných s ischemickou kardiomyopatií a elektrickou bouří. Všichni pacienti prodělali infarkt před více než 6 měsíci a ve všech případech spouštěly běhy FiK monomorfní komorové extrasystoly. U 8 nemocných bylo k potlačení recidiv FiK třeba provedení katetrizační ablace. Spouštěcí ektopií bylo možno mapovat u 5 z těchto 8 pacientů. Ve všech případech vycházela ektopie z okrajové zóny infarktové jizvy a v místě úspěšné ablace byly nalezeny signály převodního systému. U zbývajících 3 pacientů se spouštěcí ektopie objevovala sporadicky, a proto se nepodařilo zdroj ektopie lokalizovat. U těchto nemocných byly provedeny lineární léze podél okraje jizvy s cílem odstranit všechny signály převodního systému v této oblasti. Tato strategie byla velmi účinná, po dobu sledování 10 ± 6 měsíců došlo k recidivě FiK pouze u 1 pacienta a recidiva arytmické bouře nebyla pozorována u žádného z nemocných, kteří podstoupili katetrizační ablaci. Tato studie ukazuje, že katetrizační ablace okrajové zóny poinfarktové jizvy může účinně potlačit recidivy FiK i v případě, že spouštěcí ektopii nelze mapovat.
Elektrická bouře objevující se časně i v odstupu po infarktu myokardu
Nové poznatky o mechanizmu FiK po infarktu myokardu přinesla práce Szumowského et al [18]. Tito autoři zahrnuli do svého souboru pacienty časně i v odstupu po akutním infarktu myokardu. Pomocí 3D mapovacího systému bylo ověřeno, že spouštěcí ektopie vychází v obou případech z převodního systému lokalizovaného v okrajové části poinfarktové jizvy. Vazebný interval spouštěcí ektopie byl v rozmezí 320–600 ms. Během běhů polymorfní komorové tachykardie nebo FiK pozorovali autoři repetitivní aktivaci buněk převodního systému a v některých případech se tato aktivita nepřeváděla do pracovního myokardu. Tato pozorování naznačují, že větvení převodního systému v okrajové zóně infarktové jizvy hraje roli nejen v inicializaci, ale podílí se také na udržení prvních stahů FiK. Po katetrizační ablaci spouštěcí ektopie byli pacienti bez recidivy arytmie po dobu 16 ± 5 měsíců.
Naše první zkušenosti s katetrizační ablací spouštěcího zdroje FiK byly publikovány nedávno [19]. Šlo o soubor 9 nemocných (průměrný věk 62 ± 7 let, 2 ženy po infarktu myokardu v rozmezí 3 dnů až 171 měsíců, průměrná ejekční frakce levé komory 25 ± 7 %). V 6 případech (67 %) byla katetrizační ablace provedena na umělé plicní ventilaci. Katetrizační ablace byla úspěšná u 8 pacientů, u jednoho pacienta bylo nutno provést k zvládnutí bouře transplantaci srdce. Během průměrného sledování 13 ± 7 měsíců zemřeli 2 nemocní na terminální srdeční selhání bez recidiv KT. Jeden z pacientů měl recidivu fokálně spouštěné FiK z druhého svazečku levého Tawarova raménka, která byla opět úspěšně vyřešena katetrizační ablací. Druhá nemocná měla recidivu arytmické bouře, příčinou byly však monomorfní KT a pacientka podstoupila úspěšnou reablaci. V současné době máme soubor čítající více než 20 nemocných s fokálně spouštěnou FiK po infarktu myokardu, kteří podstoupili katetrizační ablaci fokálního zdroje. Katetrizační ablace byla úspěšná u více než 85 % z nich a data podrobněji analyzujeme pro publikaci. Zajímavé je, že u části z nich došlo k časným recidivám z jiného zdroje, než byla původní ablace. Proto v současnosti provádíme rozšířený výkon směřující k eliminaci většího množství tkáně převodního systému v oblasti nekrózy nebo jizvy po infarktu. Důležité je, že více než 80 % pacientů, kteří byli takto léčeni, nemělo v průběhu více než 2letého sledování recidivu elektrické bouře.
Dilatační kardiomyopatie
Někteří autoři popsali ojedinělé případy úspěšné katetrizační ablace fokálně spouštěné FiK u pacientů s neischemickou dilatační kardiomyopatií a elektrickou bouří refrakterní na antiarytmickou léčbu [28,29]. Takové případy jsou však výrazně vzácnější. Na rozdíl od stavů po infarktu myokardu se zdá, že u dilatační kardiomyopatie nestačí částečně empirická ablace Purkyňových vláken v okrajové části jizvy, ale naopak je velmi důležité mapovat přímo spouštěcí ektopii. To může být obtížné, protože ta se často objevuje pouze sporadicky. V jedné kazuistice bylo k lokalizaci sporadické ektopie použito bezkontaktní mapování (EnSite Array, St. Jude Medical), přičemž ektopické ložisko bylo lokalizováno mimo převodní systém [29]. Jiní autoři se k lokalizaci ektopie snaží používat metodu mapováno elektrických potenciálů z povrchu hrudníku (body surface mapping). Výsledky takového přístupu se v současné době analyzují. V další sérii byla provedena katetrizační ablace u 5 pacientů s neischemickou kardiomyopatií s použitím elektroanatomického mapovacího systému k lokalizaci jizvy a převodního systému. U 4 z 5 pacientů byla nalezena malá jizva v blízkosti mitrálního anulu a lokální signály byly podobné signálům z převodního systému Purkyňových vláken. Po ablaci této oblasti měl pouze 1 pacient během sledování 1 roku recidivu elektrické bouře [28].
FiK u pacientů s aortální vadou
Fokálně spouštěná FiK byla také popsána u mladého pacienta, u kterého byla provedena rekonstrukce aortální chlopně pro významnou aortální regurgitaci při perforaci nekoronárního cípu [30]. Během elektrofyziologického vyšetření byly pozorovány frekventní krátké běhy polymorfní komorové tachykardie (přecházející někdy do FiK) spouštěné komorovou ektopií s úzkým komplexem QRS. Po detailním mapování pravé a levé komory byla nalezena 2 ložiska ektopie v anteroseptální a inferoseptální části levé komory, obě ložiska byla úspěšně odstraněna katetrizační ablací. V místech úspěšné ablace byly opět pozorovány časné signály Purkyňových vláken, které předcházely komplex QRS při ektopii o 68 ms. Podobný pacient s arytmickou bouří po náhradě aortální chlopně byl popsán skupinou z Lipska [31]. Pomocí elektroanatomického mapovacího systému bylo úspěšně lokalizováno a odstraněno spouštěcí ložisko na středním septu levé komory. Shodně s předchozími případy byl zdrojem ektopie převodní systém.
Chronická myokarditis
Dva pacienti v sérii publikované skupinou z Lipska měli fokálně spouštěnou FiK v kontextu chronické myokarditidy [31]. U jednoho pacienta bylo spouštěcí ložisko lokalizováno pomocí elektroanatomického mapování do převodního systému levé komory (bazálně, midseptálně). U druhého nemocného vycházela spouštěcí ektopie z volné stěny pravé komory a v lokálním elektrogramu byl přítomen ostrý potenciál, který při ektopii předcházel komplex QRS o 28 ms. U tohoto pacienta byla také vyvolatelná a úspěšně odstraněna komorová tachykardie typu raménkové reentry (bundle branch). Žádný z pacientů neměl během sledování recidivu KT.
Amyloidóza srdce
Katetrizační ablace může být účinná v prevenci FiK i u pacientů se srdečním postižením při amyloiodóze [32]. V jedné práci, která zahrnuje 2 pacienty, byla spouštěcí ektopie lokalizována do endokardu levé komory, do míst, kde nebyla přítomna žádná jizevnatá tkáň. U prvního nemocného nebyly v místě úspěšné ablace v inferolaterální/apikální oblasti pozorovány žádné potenciály Purkyňových vláken. V druhém případě byla nejčasnější aktivace během ektopie zachycena v oblasti zadního svazečku levého Tawarova raménka. Komorová ektopie vymizela po katetrizační ablaci v obou případech a recidivy FiK nebyly zachyceny.
Strategie katetrizační ablace
Jak vyplývá z výše uvedeného, je cílem katetrizační ablace odstranění ektopie, která spouští běhy polymorfní komorové tachykardie nebo FiK. V porovnání s pacienty s idiopatickou FiK mají nemocní se strukturálním onemocněním srdce častěji více spouštěcích ložisek. Přítomnost ektopické aktivity z více míst však neznamená, že všechna ložiska mají stejný arytmogenní potenciál. Naopak, z některých míst může vycházet relativně frekventní ektopie, která ale běhy maligní arytmie nevyvolá. Primárním cílem ablace je potlačení těchto arytmií, což nemusí nutně vyžadovat odstranění veškeré ektopické aktivity. Proto je zásadní dokumentovat spouštěcí ektopii na 12svodovém EKG, morfologie komplexu QRS ektopických stahů pak slouží jako primární cíl katetrizační ablace (obr. 2).
Obr. 2. 12svodové EKG v době arytmické bouře u pacienta po infarktu myokardu 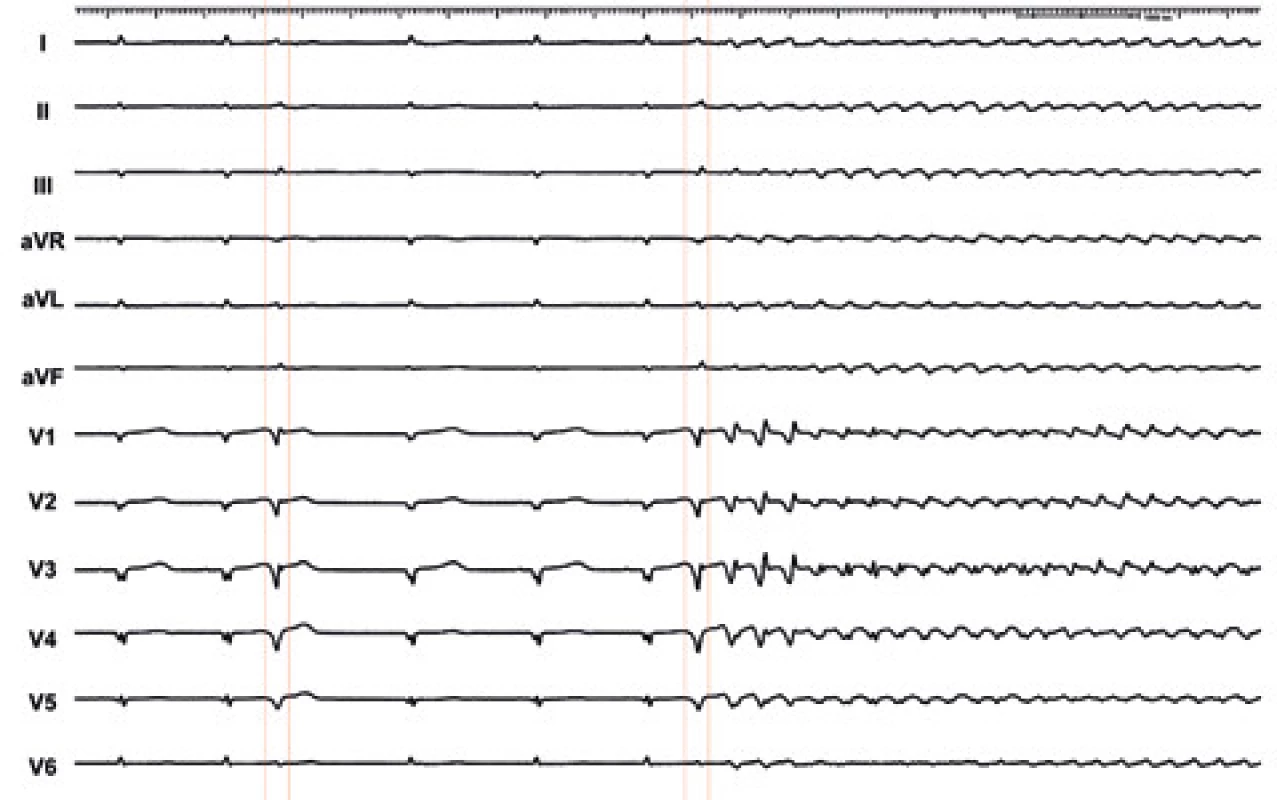
Je přítomna komorová ektopie s relativně štíhlými komplexy QRS a morfologií blokády pravého raménka (označena červenými šipkami), která naznačuje původ z převodního systému levé komory. Druhá extrasystola spouští polymorfní komorovou tachykardii, která degeneruje do FiK. Protože u pacientů se strukturálním onemocněním srdce vychází ektopie prakticky pouze z Purkyňových vláken v levé komoře, je vhodné zvolit při katetrizaci retrográdní přístup, který obvykle umožňuje rychlé dosažení a mapování mezikomorového septa a převodního systému (obr. 3). Výběr přístupu (transseptální/retrográdní) však závisí na preferenci operatéra. Na rozdíl od idiopatické FiK se především u pacientů po infarktu myokardu doporučuje použití elektroanatomického mapovacího systému, kterým lze snadno lokalizovat okrajovou zónu poinfarktové jizvy. Elektroanatomickou mapu je možno použít jako anatomický model, do kterého lze označit místa se signály převodního systému a zdroje ektopické aktivity. To je výhodné především pro případy, kdy dojde k mechanickému potlačení ektopie při manipulaci katétrem v levé komoře.
Obr. 3. Záznamy z povrchového EKG (I, aVF, V1, V2, V6) a distálního bipólu mapovacího katétru (Abl d) 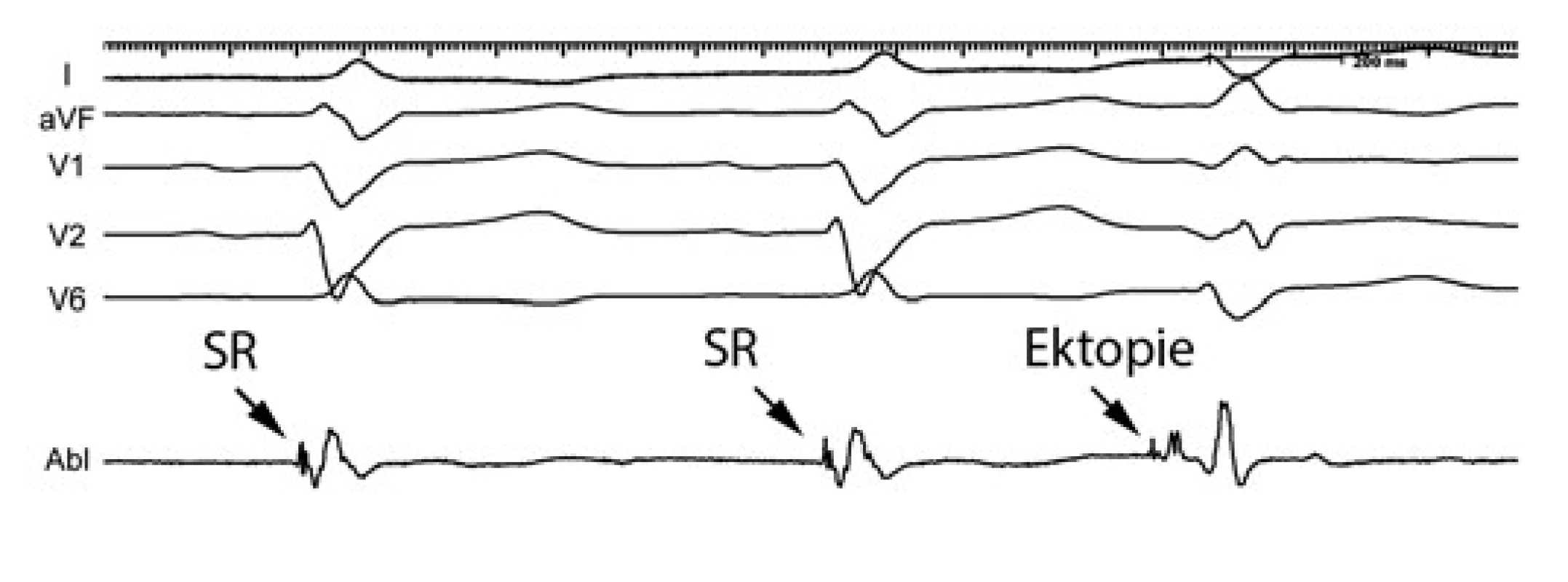
První 2 stahy jsou sinusové (SR), 3. stah je ektopie. Lokální komorový elektrogram při sinusovém rytmu i při ektopii má na začátku ostrý potenciál, který odpovídá aktivaci Purkyňových vláken. Při sinusovém rytmu tento potenciál předchází komplex QRS o 13 ms a odpovídá aktivaci distální části převodního systému. Při ektopii je signál Purkyňových vláken výrazně časnější (45 ms), a potvrzuje tak původ ektopie v buňkách převodního systému. Použití elektroanatomického mapovacího systému umožňuje nejen identifikovat místa s nejčastější aktivitou při ektopii, ale také průběh a větvení ramének převodního systému. Následná ablace může být následně rozšířena na okolí ektopického zdroje a na okraj jizevnaté oblasti (obr. 4). Tato strategie může být také použita, pokud se při mapování neobjevuje žádná ektopická aktivita. Může pomoci i v případě, že při mapování dojde k mechanické blokádě levého Tawarova raménka, která obvykle vede k vymizení ektopie i signálů převodního sytému, které by bylo možno mapovat. Na druhé straně, převodní systém a Purkyňova vlákna jsou umístěna subendokardiálně, a proto lze ektopii potlačit obvykle relativně snadno několika aplikacemi radiofrekvenční energie.
Obr. 4. Voltážová elektroanatomická mapa levé komory u pacienta po ablaci fokálně spouštěné FiK časně po infarktu myokardu v pravé šikmé projekci 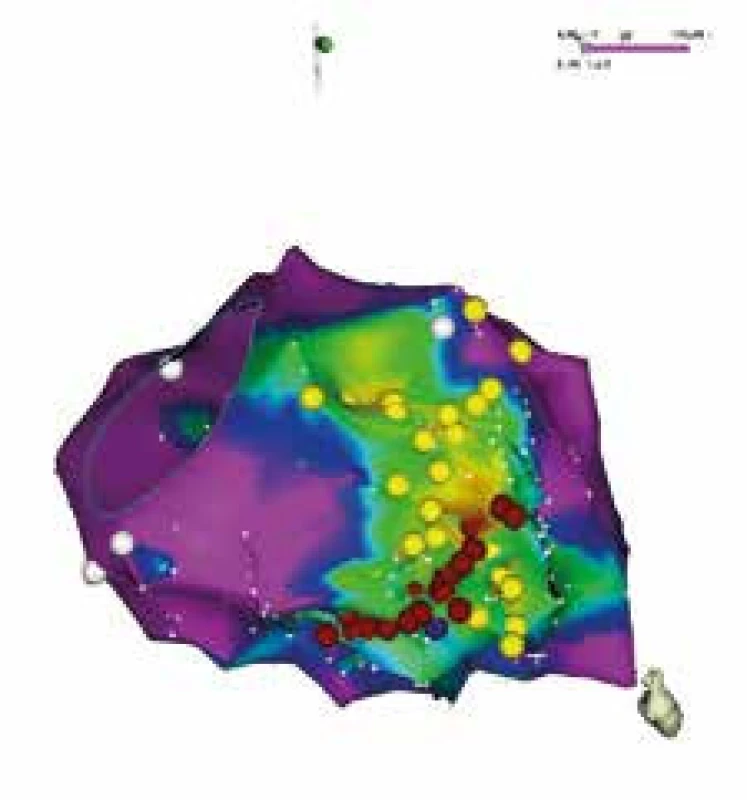
Zelenou barvou jsou označeny oblasti s nízkou voltáží, které odpovídají jizvě. Žlutými body jsou označena místa se signály převodního systému, které odpovídají zadnímu a přednímu svazečku levého raménka. Tmavě červené body označují místa aplikace radiofrekvenční energie. Katetrizační ablace byla provedena napříč krajovou částí jizevnaté tkáně s cílem odstranit přežívající buňky převodního systému. Je také důležité zdůraznit, že aplikace radiofrekvenční energie v místech ektopických ložisek vede velmi často k akceleraci elektrické aktivity, která spustí FiK. Na základě našich zkušeností se zdá, že odstranění této akcelerace, která se objevuje během aplikace radiofrekvenční energie, může být dobrým prediktorem úspěšné ablace. V některých případech může být problémem opačný extrém, a to vymizení ektopické aktivity po farmakologické stabilizaci elektrické bouře s hlubokou sedací. V takovém případě někteří autoři doporučují provokaci ektopie pomocí izoprenalinu.
Na základě vlastních zkušeností u pacientů s ischemickou kardiomyopatií preferujeme provedení extenzivní ablace v blízkosti ektopického ložiska – podél celé okrajové zóny jizvy, v níž jsou detekovatelné signály Purkňových vláken. Důvodem je pozorování, že po „úspěšné“ ablaci může dojít k recidivě arytmické bouře spouštěné z nových ektopických ložisek. Navíc větší modifikace arytmogenního substrátu může ovlivnit struktury, které se podílejí na udržení FiK.
Velmi důležitou otázkou je správné načasování výkonu. Katetrizační ablace může být pro pacienty, kteří nereagují na konvenční terapii, život zachraňujícím výkonem. Proto je vhodné pacienta transportovat do specializovaného centra časně, protože při frekventních epizodách FiK může dojít rychle ke zhoršení hemodynamického stavu nemocného a transport nemusí být již možný. Mezi hlavní předpoklady úspěšné léčby pacientů s fokálně spouštěnou FiK proto patří znalost této nozologické jednotky a kontakt na specializované centrum, které je schopné pacient akutně převzít.
Závěr
FiK může být spouštěna monotopní komorovou ektopií, kterou lze s vysokou účinností odstranit katetrizační ablací. I přes dobrou účinnost této metody se jedná o invazivní zákrok, který vyžaduje značnou zkušenost a který může být spojen s rizikem periprocedurálních komplikací. Proto základním způsobem léčby pacienta s FiK zůstávají současně užívané postupy. Ty zahrnují revaskularizaci, podávání betablokátorů a antiarytmik, hlubokou analgosedaci a overdrive stimulaci. U většiny pacientů jsou tato opatření dostatečně účinná, alespoň v první fázi. Na druhé straně u nemocných, u kterých dochází k recidivě arytmií, může katetrizační ablace účinně zabránit recidivám elektrické bouře. Na základě našich zkušeností se domníváme, že nejvhodnějším řešením je v takovém případě transport pacienta do specializovaného centra k provedení katetrizační ablace. V řadě případů se může jednat o život zachraňující výkon. Protože nelze vývoj situace předpovědět v době stabilizace stavu, je vhodné konzultovat každého pacienta s fokálně spouštěnou FiK v specializovaném centru.
prof. MUDr. Josef Kautzner, CSc.
joka@medicon.cz
Klinika kardiologie IKEM, Praha
www.ikem.cz
Doručeno do redakce 13. 10. 2014
Přijato po recenzi 27. 10. 2014
Zdroje
1. Jalife J. Ventricular fibrillation: Mechanisms of initiation and maintenance. Annu Rev Physiol 2000; 62 : 25–50.
2. Zaitsev AV, Berenfeld O, Mironov SF et al. Distribution of excitation frequencies on the epicardial and endocardial surfaces of fibrillating ventricular wall of the sheep heart. Circ Res 2000; 86(4): 408–417.
3. Chen J, Mandapati R, Berenfeld O et al. High-frequency periodic sources underlie ventricular fibrillation in the isolated rabbit heart. Circ Res 2000; 86(1): 86–93.
4. Newton JC, Smith WM, Ideker RE. Estimated global transmural distribution of activation rate and conduction block during porcine and canine ventricular fibrillation. Circ Res 2004; 94(6): 836–842.
5. Nanthakumar K, Huang J, Rogers JM et al. Regional differences in ventricular fibrillation in the open-chest porcine left ventricle. Circ Res 2002; 91(8): 733–740.
6. Huang J, Walcott GP, Killingsworth CR et al. Quantification of activation patterns during ventricular fibrillation in open-chest porcine left ventricle and septum. Heart Rhythm 2005; 2(7): 720–728.
7. Pak HN, Kim YH, Lim HE et al. Role of the posterior papillary muscle and purkinje potentials in the mechanism of ventricular fibrillation in open chest dogs and Swine: Effects of catheter ablation. J Cardiovasc Electrophysiol 2006; 17(7): 777–783.
8. Pak HN, Oh YS, Liu YB et al. Catheter ablation of ventricular fibrillation in rabbit ventricles treated with beta-blockers. Circulation 2003; 108(25): 3149–3156.
9. Pak HN, Kim GI, Lim HE et al. Both Purkinje cells and left ventricular posteroseptal reentry contribute to the maintenance of ventricular fibrillation in open-chest dogs and swine: effects of catheter ablation and the ventricular cut-and-sew operation. Circ J 2008; 72(7): 1185–1119.
10. Haïssaguerre M, Shah DC, Jaïs P et al. Role of Purkinje conducting system in triggering of idiopathic ventricular fibrillation. Lancet 2002; 359(9307): 677–678.
11. Haïssaguerre M, Shoda M, Jaïs P et al. Mapping and ablation of idiopathic ventricular fibrillation. Circulation 2002; 106(8): 962–967.
12. Bänsch D, Oyang F, Antz M et al. Successful catheter ablation of electrical storm after myocardial infarction. Circulation 2003; 108(24): 3011–3016.
13. Nash MP, Mourad A, Clayton RH et al. Evidence for multiple mechanisms in human ventricular fibrillation. Circulation 2006; 114(6): 536–542.
14. Kautzner J, Bytešník J. Catheter ablation of arrhythmogenic focus in “short-coupled” variant of Torsade de Pointes. Pacing Clin Electrophysiol 2000; 23(Pt 2): 717.
15. Knecht S, Sacher F, Wright M et al. Long-term follow-up of idiopathic ventricular fibrillation ablation: a multicenter study. J Am Coll Cardiol 2009; 54(6): 522–528.
16. Enjoji Y, Mizobuchi M, Muranishi H et al. Catheter ablation of fatal ventricular tachyarrhythmias storm in acute coronary syndrome – role of Purkinje fiber network. J Interv Card Electrophysiol 2009; 26(3): 207–215.
17. Marrouche NF, Verma A, Wazni O et al. Mode of initiation and ablation of ventricular fibrillation storms in patients with ischemic cardiomyopathy. J Am Coll Cardiol 2004; 43(9): 1715–1720.
18. Szumowski L, Sanders P, Walczak F et al. Mapping and ablation of polymorphic ventricular tachycardia after myocardial infarction. J Am Coll Cardiol 2004; 44(8): 1700–1706.
19. Peichl P, Cihák R, Kozeluhová M et al. Catheter ablation of arrhythmic storm triggered by monomorphic ectopic beats in patients with coronary artery disease. J Interv Card Electrophysiol 2010; 27(1): 51–59.
20. Friedman PL, Stewart JR, Fenoglio JJ Jr et al. Survival of subendocardial Purkinje fibers after extensive myocardial infarction in dogs: in vitro and in vivo correlations. Circ Res 1973; 33(5): 597–611.
21. Myers WW, Honic CR. Amount and distribution of Rb transported into myocardium from ventricular lumen. Am J Physiol 1966; 211(3): 739–745.
22. Moir TW. Study of luminal coronary collateral circulation in the beating canine heart. Circ Res 1969; 24(5): 735–744.
23. Bagdonas AA, Stuckey JH, Piera J et al. Effects of ischemia and hypoxia on the specialized conduction system of the canine heart. Am Heart J 1961; 61 : 206–218.
24. Arnar DO, Bullinga JR, Martins JB. Role of the Purkinje system in spontaneous ventricular tachycardia during acute ischemia in a canine model. Circulation 1997; 96(7): 2421–2429.
25. Berenfeld O, Jalife J. Purkinje-muscle reentry as a mechanism of polymorphic ventricular arrhythmias in a three-dimensional model of the ventricles. Circ Res 1998; 82(10): 1063–1077.
26. Kupersmith J, Li ZY, Maidonado C. Marked action potential prolongation as a source of injury current leading to border zone arrhythmogenesis. Am Heart J 1994; 127(6): 1543–1553.
27. Nogami A, Kubota S, Adachi M et al. Electrophysiologic and histopathologic findings of the ablation sites for ventricular fibrillation in a patient with ischemic cardiomyopathy. J Interv Card Electrophysiol 2009; 24(2): 133–137.
28. Sinha AM, Schmidt M, Marschang H et al. Role of left ventricular scar and Purkinje-like potentials during mapping and ablation of ventricular fibrillation in dilated cardiomyopathy. Pacing Clin Electrophysiol 2009; 32(3): 286–290.
29. Kirubakaran S, Gill J, Rinaldi CA. Successful catheter ablation of focal ventricular fibrillation in a patient with nonischemic dilated cardiomyopathy. Pacing Clin Electrophysiol 2011; 34(4): e38-e42. Dostupné z DOI: <http://DOI: 10.1111/j.1540–8159.2010.02750.x>.
30. Li YG, Gronefeld G, Israel C et al. Catheter ablation of frequently recurring ventricular fibrillation in a patient after aortic valve repair. J Cardiovasc Electrophysiol 2004; 15(1): 90–93.
31. Bode K, Hindricks G, Piorkowski C et al. Ablation of polymorphic ventricular tachycardias in patients with structural heart disease. Pacing Clin Electrophysiol 2008; 31(12): 1585–1591.
32. Mlcochova H, Saliba WI, Burkhardt DJ et al. Catheter ablation of ventricular fibrillation storm in patients with infiltrative amyloidosis of the heart. J Cardiovasc Electrophysiol 2006; 17(4): 426–430.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Obezita a srdce
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2014 Číslo 12- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
-
Orientační běh od intervence k prevenci.
Prof. MUDr. Michael Aschermann slaví významné životní jubileum - Životní jubileum prof. MUDr. Michaela Aschermanna, DrSc., FESC, FACC
- Antikoagulační léčba v sekundární prevenci koronárních příhod
-
Anémie a nedostatek železa v interní praxi:
od gastroenterologie ke kardiologii a ještě dál - Embolizační ischemické cévní mozkové příhody
- Minulost a současnost problematiky plicní cirkulace ve Všeobecné fakultní nemocnici v Praze
- Katetrizační ablace fokálně spouštěné fibrilace komor u pacientů se strukturálním postižením srdce
- Současné postavení intravaskulární ultrasonografie v intervenční kardiologii
- Obezita a srdce
- Karotický stenting – vývoj, trendy a inovace
- Mají natriuretické peptidy novou šanci v léčbě srdečního selhání?
-
Renální denervace u pacientů s rezistentní hypertenzí:
je možné ji ještě resuscitovat? - Moderní léčba akutních iktů: příklad multidisciplinární spolupráce
- Katetrizační metoda léčby chronické mitrální regurgitace pomocí mitrální svorky (MitraClip)
- IMProved Reduction of Outcomes: Vytorin Efficacy International Trial (studie IMPROVE-IT)
- Pomůže nám nový SGLT2 inhibitor empagliflozin snížit riziko hypoglykemie?
-
Orientační běh od intervence k prevenci.
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Katetrizační metoda léčby chronické mitrální regurgitace pomocí mitrální svorky (MitraClip)
-
Anémie a nedostatek železa v interní praxi:
od gastroenterologie ke kardiologii a ještě dál - Embolizační ischemické cévní mozkové příhody
- Obezita a srdce
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



