-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chronická bolest u intersticiální cystitidy
Chronic pain in interstitial cystitis
Intersticial cystitis (IC) is a chronic, non-bacterial inflammatory disorder of the wall of the bladder manifested with very painful and unpleasant symptoms. It may resemble a bacterial inflammation of the urinary bladder, with no response to antibiotic treatment, however. The characteristic symptoms are: pain, urgent and frequent micturition. The pain is usually present in the hypogastrium and small pelvis, sometimes irradiating to the sacral area, vagina, groins and thighs (in men also to the penis, the testicles and the perineum). The urge of micturition is constant and typically persistent. This disorder prevailingly affects women (90 % of cases). About 10 % of patients with IC are men with previous wrongly diagnosed abacterial prostatitis or prostatodynia. IC can also be found in children. Treatment must be individual and also polypragmatic with regard to IC ethiopathogenesis. Response to treatment is highly individual and only a small part of therapeutic procedures can be declared curative. The authors summarise the available knowledge concerning the disorder, its diagnosing and treatment, and report their own experience with this nosologic unit and in the treatment of pain caused by IC..
Key words:
interstitial cystitis, pelvic pain syndrome, intravesical treatment
Autoři: MUDr. Libor Zámečník; Febu 1; prof. MUDr. Tomáš Hanuš, DrSc. 1,2
Působiště autorů: Urologická klinika VFN a 1. LF UK 1; Katedra urologie IPVZ Praha 2
Vyšlo v časopise: Urol List 2007; 5(2): 41-47
Souhrn
Intersticiální cystitida (IC) je chronické, nebakteriální zánětlivé onemocnění stěny močového měchýře a je provázeno velmi bolestivými a nepříjemnými příznaky. Připomíná bakteriální zánět močového měchýře, antibiotika však nemají žádný efekt. Charakteristickými symptomy jsou: bolest, urgentní a časté močení. Bolest bývá v oblasti podbřišku, malé pánve, někdy vyzařuje do křížové oblasti, do pochvy, třísel, na stehna (u mužů též do penisu, varlat, skrota a na perineum). Nucení na močení je stálé a bývá velmi trvalé. Převážně se jedná o onemocnění postihující ženy (v 90 %). Asi 10 % nemocných s IC jsou muži, u nichž byla dříve nesprávně diagnostikována nonbakteriální prostatitida nebo prostatodynie. IC lze nalézt i u dětí. Léčba musí být individuální a vzhledem k etiopatogenezi je polypragmatická. Odpověďna léčbu je vysoce individuální a pouze malou část terapeutických výkonů lze prohlásit za kurativní. Autoři shrnují dostupné poznatky o tomto onemocnění, jeho diagnostice a léčbě, prezentují vlastní zkušenosti s touto nozologickou jednotkou a léčbou bolesti u tohoto onemocnění.
Klíčová slova:
intersticiální cystitida, syndrom pánevní bolesti, intravezikální léčbaÚVOD
Intersticiální cystitida (IC) je chronické nebakteriální zánětlivé onemocnění stěny močového měchýře, provázené bolestivými a nepříjemnými příznaky: bolest nad sponou, v močovém měchýři i mimo močení, urgence a frekventní mikce, strangurie, dyspareunie nebo bolesti v konečníku a hematurie. Bolest bývá v oblasti podbřišku, malé pánve, vyzařuje do křížové oblasti, do pochvy, třísel, na stehna a do uretry. Nucení na močení (i v noci) je prakticky trvalé a velmi frustrující. Jedná se o onemocnění postihující převážně ženy. Bylo označováno různými názvy (chronická cystitida, neurogenní cystitida, syndrom chronické pánevní bolesti). Podle konzultace European Society for the Study of Interstitial Cystitis/Painful Bladder Syndrome (ESSIC) z roku 2006 je oficiální název syndrom bolestivého měchýře – bladder pain syndrome (IC/BPS). Hunner popsal zánětlivou afekci měchýře u několika pacientů již v roce 1914 [1]. Pacientkami byly ženy ve věku od 20 do 40 let. Při cystoskopii zjistil, že sliznice měchýře po dotyku začne krvácet. Tento nález byl později označen jako Hunnerův vřed.
Mezi známé příčiny BPS patří poradiační či specifická cystitida. Obdobnou symptomatologii lze pozorovat také při karcinomu měchýře, carcinoma in situ nebo bakteriální cystitidě. Je tedy nutno vyloučit onemocnění, která vyvolávají chronickou pánevní bolest a mohla by imitovat IC: postižení ilioingvinálního, iliohypogastrického a genitofemorálního nervu, pánevního sympatiku, hematom m. pyramidalis, osteitis pubis a adduktorové tendinitidy.
Epidemiologie
Práce z Finska udává prevalenci IC 10,6/100 000 všech obyvatel a 18,1/100 000 žen všech věkových skupin [2]. V USA je prevalence onemocnění zhruba 2násobná [3]. Onemocnění se vyskytuje i u mužů, kde je dáváno do souvislosti s diagnózou chronické prostatitidy. Průměrný věk na počátku onemocnění je cca 40 let. IC bývá častěji sdružena s dalšími chronickými či bolestivými příznaky (tab. 1).
Tab. 1. Prevalence sdružených onemocnění diagnostikovaných u pacientů s IC v porovnání s ostatní populací. 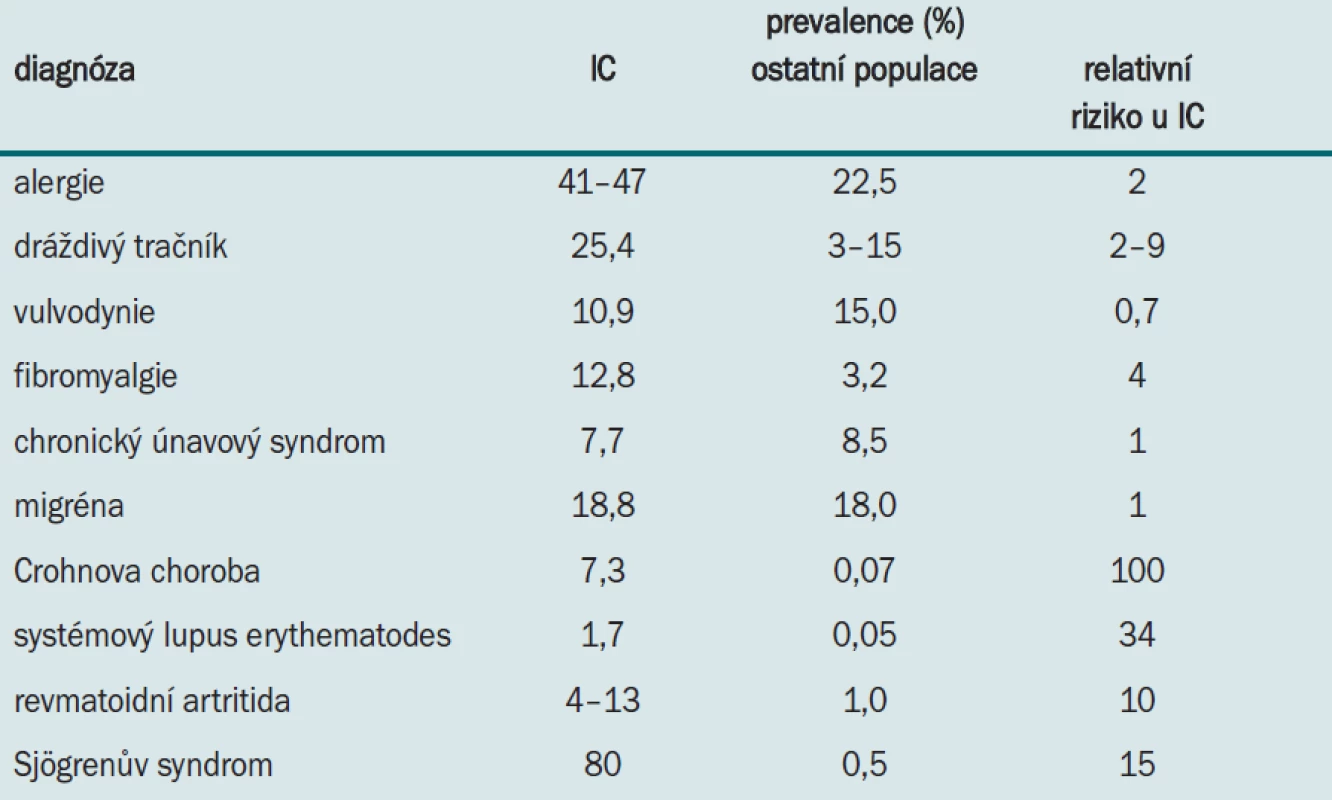
Kombinace příznaků souvisejících s močením a pánevních bolestí mnohdy vede k mylné diagnóze gynekologického onemocnění a laparoskopii či hysterektomii. Z gynekologických příčin BPS se uvádějí: endometrióza, pánevní infekce a srůsty a také leiomyom dělohy. Hormonální změny mají efekt na degranulaci mastocytů a zhoršují příznaky v premenstruální fázi a také s nástupem menopauzy.
Etiopatogeneze
Etiopatogeneze IC/BPS zůstává stále neobjasněná. Následuje výčet nejvýznamnějších teorií:
- autoimunitní podklad IC – přítomnost protilátek (ANA), jejich titr koreluje s aktivitou onemocnění [4]
- porucha integrity stěny močového měchýře – podporuje původní názor, že je za změny ve stěně měchýře zodpovědná porucha bariéry na úrovni uroteliálních buněk. Urotel s normální stavbou a funkcí představuje aktivní metabolickou bariéru [5].
- destrukce defektu tvorby glykosamino-glykanové (GAG) vrstvy mukózy v měchýři [6] – působí snazší penetraci moči urotelem do intersticia stěny měchýře, dojde k narušení bariéry hlenu a ke zvýšení propustnosti pro draslík, který se dostává do intersticia. Zde se vstřebává nebo přetrvává ve stěně a depolarizuje senzitivní nervy, snad ovlivňuje hladké svalstvo a poškozuje krevní zásobení. Může vzniknout sekundární detruzorová instabilita indukcí kontrakce hladké svaloviny. Toto vysvětluje zesílení symptomů po jídle bohatém na draslík (citrusy, čokoláda, rajčatový protlak).
- neurogenní zánět [7] – proces způsobený stimulací periferních nervů, následovaný vazodilatací a extravazací plazmy. V měchýři může být způsoben stimulací viscerálních větví v aferentní části pánevních nervů. Podstatou neurogenně podmíněného zánětu je uvolnění neuropeptidů stimulovaných antidromálních senzorických zakončení s následnou aktivací mastocytů a jejich meditátorů. Histamin uvolněný z mastocytů byl popsán jako příčina příznaků IC [8]. Jako spouštěče degranulace mastocytů se uvádí např. anafylatoxiny, bakterie, cytokiny, léky (lokální anestetika) nebo některé hormony.
Bolest u IC nepatří mezi tzv. normální či akutní bolest. Zánětlivé změny v měchýři při IC mohou zapříčiňovat hypersenzitivitu chemosenzitivních aferentních nervových zakončení v měchýři a hyperalgezii. Pokud není bolest již v tomto okamžiku adekvátně léčena, perzistující bolestivé signály jsou předávány z měchýře do oblasti centrálního nervového systému zadními míšními rohy a dochází k fixaci tohoto procesu.
Neuropatická bolest
U IC se jedná o bolest neuropatickou (podle definice Mezinárodní společnosti pro studium bolesti (IASP) zahrnuje všechny bolesti způsobené primárním poškozením nebo dysfunkcí periferního nebo centrálního nervového systému) [9]. V česky psané odborné literatuře se jako neuropatická bolest přednostně označuje postižení periferního nervového systému.
Taková bolest je často závislá na psychice. Existují bolestivé syndromy, které se zhoršují např. s dekompenzací diabetické polyneuropatie, ale jsou naopak i neuropatické bolesti, jejichž prevence je ve své podstatě složitá, resp. neznámá - komplexní regionální bolestivý syndrom typu II., tzv. kauzalgie, u něhož se jedná o primární poškození periferního nervu [10]. Membránové procesy na primárních aferentních vláknech jsou ovlivňovány i funkcí dalších iontových kanálů. Mezi těmi jsou důležité kanály vápníkové a draslíkové. Změny funkce draslíkových kanálů patří k dalším faktorům, které ovlivňují funkci periferních nervových vláken při nocicepci.
Velmi důležitým, ale současně jen obtížně ovlivnitelným faktorem podílejícím se na zesílení a udržování neuropatických bolestí je lokální dysfunkce autonomního nervového systému, zejména sympatiku.
DIAGNOSTIKA
Mezi typické příznaky IC patří: bolesti nad sponou, bolest v močovém měchýři i mimo močení (69,9 %), urgence (91,9 %), polakisurie či frekventní mikce (91,2 %), nykturie, intervaly mezi mikcemi kratší než 60–30 min. Méně častým příznakem bývá dysurie (60,5 %), strangurie (55,1 %), někdy také urgentní inkontinence a dyspareunia (55,2 %) a bolesti v konečníku. Hematurie se objevuje asi ve čtvrtině případů (21,6 %). Kombinace příznaků močového ústrojí a bolestí v pánvi mnohdy vede k mylné diagnóze gynekologického onemocnění (např. endometrióze) a zbytečné laparoskopii či dokonce hysterektomii až u jedné třetiny pacientek postižených IC.
Symptomatologie se objeví buďspontánně bez zjevné příčiny, nebo někdy po chirurgickém výkonu - zejména u žen např. po hysterektomii nebo jiné gynekologické operaci, po porodu či jako následek těžké formy bakteriální cystitidy. Ve velmi časných stadiích může onemocnění probíhat pouze záchvatovitě. Z toho vyplývá, že je zásadní provést kultivaci moči, aby se odlišila bakteriální urocystitida.
V rámci anamnézy klademe důraz na přidružená onemocnění. Při vyšetření hodnotíme vstupní subjektivní stav a dále stav po léčbě a během sledování pomocí dotazníků (např. O'Leary-Sant Symptom and Problem Indexes - OSQ (tab. 2) [11]. Standardizovaný Dotazník OSQ obsahuje celkem 8 otázek. část A má 4 otázky; jedná se o dotazy na frekvenci symptomů IC (tzv. SYMPTOM Index - ICSI frekvence mikcí ve dne, nykturie, cystalgie, urgence), zatímco část B zahrnuje 4 otázky týkající se míry obtěžování těmito příznaky (PROBLEM Index - ICPI).
Tab. 2. Dotazník O'Leary-Sant pro pacienty s intersticiální cystitidou. 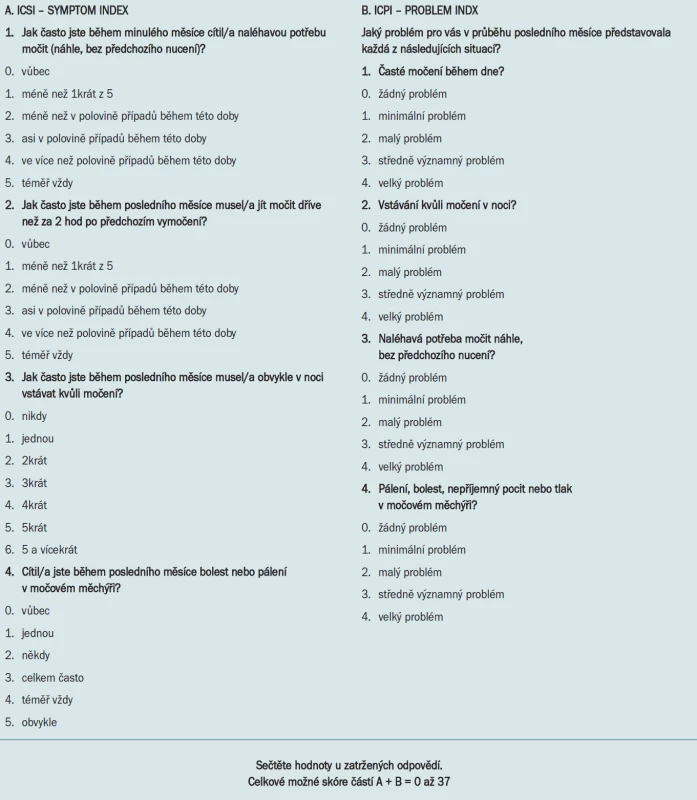
Celkové možné skóre je pro část A (index frekvence příznaků – SYMPTOM Index) 0–21 a pro část B (index míry subjektivní zátěže – PROBLEM Index) 0–16, takže celkové možné skóre je od 0 do 37.
Zásadní je také pečlivé fyzikální vyšetření včetně orientačního neurologického vyšetření. Standardní laboratorní vyšetření krve (krevní obraz, biochemie séra) a moči (rozbor chemický a vyšetření sedimentu) bývají normální. Nelze opomenout cytologické vyšetření moči, které může spolehlivě vyloučit jiné etiologie mikčních obtíží (carcinoma in situ a karcinom měchýře). Při kultivačním vyšetření moči je nutno vyloučit také chlamydiovou a trichomonádovou infekci, při klasické IC je bakteriologický nález negativní.
Dosud nebyl nalezen specifický nález pro IC při urodynamickém vyšetření. Provádí se hlavně kvůli odlišení příznaků hyperaktivního detruzoru.
Kaliový test
Jedním z průlomů v léčbě IC je používání technik pokrývajících přechodní epitel, tj. používání sulfátových polysacharidů a heparinoidů. Léky se podávají perorálně či intravezikálně. Intaktní epitelová hlenová vrstva významně redukuje bakteriální adherenci a infekci. Defektní vrstva může být reparována léky, jako jsou heparin a pentosanpolysulfát. Sulfátové polysacharidy, primární součást hlenu, jsou extrémně hydrofilní. Tato vrstva je silná a redukuje adherenci bakterií i močových solí. Intaktní vrstva chrání povrch měchýře před transportem urey, kalcia, draslíku a vody. Ve studiích, kde byla tato vrstva zničena protaminsulfátem, byla zvýšena absorpce urey a draslíku, které vyvolávají iritační příznaky. Po použití heparinu se přenos urey a draslíku snížil. Potvrzuje to hypotézu, že hlen je důležitou součástí ovlivňující permeabilní bariéru společně s bilipidovou nepolární membránou a těsnými junkcemi (tight junctions). Ke zjištění permeability se užívá intravezikální test senzitivity k draslíku (potassium sensitivity test - PST). Do klinické praxe jej uvedl Parsons v roce 1994 [12]. Pacientům je instilována do močového měchýře sterilní voda a poté 40 mEq KCl ve 100 ml roztoku. Při pozitivní odpovědi nastává během 3–5 min provokace symptomů (bolest v měchýři, za sponou apod) u 70 % pacientů s IC po aplikaci KCl. Po narušení membrány hlenu např. vysoce nabitým kationtem, který se naváže na anion povrchového glykosaminoglykanu (GAG, polysacharidy), dojde k narušení bariéry hlenu a zvýšení propustnosti pro draslík, který se dostává do intersticia. Zde se vstřebává nebo přetrvává ve stěně a depolarizuje senzitivní nervy, snad ovlivňuje hladké svalstvo a poškozuje krevní zásobení. Může vzniknout sekundární detruzorová hyperaktivita indukcí kontrakce hladké svaloviny. To vysvětluje nárůst symptomů po jídle bohatém na draslík (citrusy, čokoláda, rajčatový protlak). Parsons et al [13] sledovali intravezikální senzitivitu k draslíku u pacientů s IC spolu s kontrolní skupinou pacientů k určení incidence bolesti a/nebo urgencí vyvolaných pomocí testu senzitivity k draslíku.
Modifikovaný kaliový test
Hohlbrugger et al z Innsbrucku studovali efekt intravezikálně instilovaného draslíku M v podobě 0,2molárního roztoku chloridu draselného na maximální kapacitu močového měchýře u pacientů s intersticiální cystitidou. Jako pozitivní odpověďna aplikaci 0,2 M KCl považovali snížení cystometrické kapacity (Cmax) o více než 20 % [14].
Metodika:
- změření kapacity měchýře náplní fyziologického roztoku (0,9 % NaCl)
- instilace 0,2M roztoku KCl
Interpretace:
Rozdíl v cystometrické kapacitě > 30 % je považován za pozitivní a pacient je vhodný pro instilační intravezikální terapii.
Cystoskopie
Velmi důležitou a v podstatě zatím nenahraditelnou diagnostickou metodou zůstává cystoskopie v celkové anestezii. Při pokročilé formě onemocnění lze na stěně měchýře pozorovat jizvy nebo vředy. Po naplnění měchýře na jeho maximální kapacitu (objem měříme při intravezikálním tlaku do 80 cm H2O) necháváme měchýř distendovaný po dobu 1 min. Poté náplň vypustíme a pozorujeme sliznici měchýře. Pro diagnózu IC přímo svědčí krvácející petechie (tzv. glomerulace) či trhliny sliznice či jizvy na sliznici měchýře. Po cystoskopii odebíráme biopsii z hloubky tak, aby postihovala i svalovinu měchýře (detruzoru). Biopsie může být buďstudená, či provedená resektoskopem. Vzhledem k relativně vysokému riziku ruptury močového měchýře již při distenzi v celkové anestezii (až 13 %) odebíráme biopsii zásadně až po distenzi a cystoskopii. Vyšetření se provádí i přesto, že z několika studií vyplývá, že role biopsie pro definitivní stanovení diagnózy IC je nejasná [15].
Intersticiální cystitida se podle cystoskopického nálezu dělí na 2 základní formy: na ulcerózní a nonulcerózní. Ulcerózní forma (ačkoliv je Hunnerova ulcerózní cystitida již přes 40 let synonymem IC) je vzácnější - je popisována v pouhých 8 %.
Změny sliznice se posuzují dle stupnice určené protokolem ESSIC [16]:
- GRADE 0: normální mukóza
- GRADE 1: petechie
- GRADE 2: ekchymózy (velkoplošné submukózní krvácení)
- GRADE 3: difúzní globální krvácení
- GRADE 4: ruptury mukózy s/bez edému, s/bez krvácení.
Histopatologie
Pro potřeby histopatologického vyšetření odebíráme u ulcerózní formy biopsii z ulcerace u nonulcerózní formy biopsie z glomerulací.
Základním nálezem jsou zánětlivé změny v lamina propria mukózy, průkaz mastocytů a eozinofilů, fibrotická přestavba detruzoru, zánětlivá celulizace (lymfocyty, plazmatické buňky) a hemoragie v lamina propria. Mezi ultrastrukturální změny patří alterace glykosaminoglykanové vrstvy. Při imunohistochemickém vyšetření jsou patrné protilátky IgM ve stěně cév, spolu s komplementem C3, C4 a C1q a změny v poměru T a B lymfocytů. Histopatologické hodnocení dle ESSIC by mělo obsahovat následující informace [16]:
EPITEL: přítomen, nepřítomen, dysplazie, (grading), abnormální (ale nikoli dysplazie)
PROPRIA: normální, zánět, jiné
DETRUZOR: popsat abnormální buňky
MASTOCYTY: určit počet na mm2 resp. zorné pole
Markery IC
Jako u mnoha jiných onemocnění je i u IC snaha o neinvazivní, pacienta nezatěžující vyšetření, s velkou senzitivitou a specificitou pro dané onemocnění. Jako nejvýhodnější se zdá vyšetření moči, tedy nebolestivé a v kterékoli fázi diagnostiky a léčby onemocnění opakovatelné.
Speciální metodiku vyžaduje vyšetřování ECP (eosinophil cationic protein), GAG v moči nebo 1,4-MIAA (metylimidazol-acetic acid). ECP bývá zvýšen zejména u pacientů, kteří mají prokázánu tzv. eozinofilní cystitidu. Dosud otevřenou otázkou zůstává nalezení markeru specifického pro IC. Zdálo se, že by tuto úlohu mohl splňovat např. interleukin 1b či jiné cytokiny. Bylo prokázáno, že moč pacientů s IC obsahuje APF (antiproliferative factor), který působí jako inhibitor primární proliferace epiteliálních buněk měchýře. Dále, v porovnání s kontrolní skupinou zdravých pacientů, obsahuje nižší hladinu HB-EGF (heparin-binding epidermal growth factor - like growth factor) a zvýšenou hladinu EGF (epidermal growth factor). U APF byla zastižena 94% senzitivita a 95% specificita [17]. Tyto nálezy autory opravňují k tvrzení, že lze tato vyšetření využít jako markery pro IC.
GYNEKOLOGICKÉ ASPEKTY IC
Okolo 90 % pacientek s IC jsou ženy. Velké množství z nich podstoupí řadu vyšetření, a u praktického lékaře, či lékařů odborných, protože mají, mnohdy nespecifické, obtíže. V průměru trvá 3–5 roků, než je stanovena definitivní diagnóza. Mnoho počátečních symptomů přivede pacientku právě do ordinace gynekologa. Velké množství gynekologických onemocnění se může projevit symptomy, které jsou vyjádřeny také u IC.
Je velice důležité odlišit původ obtíží, nebo řada pacientek může podstoupit dokonce gynekologický operační výkon zcela zbytečně. Je tedy na lékaři vyšetřujícím a léčícím pacientku s pánevními bolestmi, aby určil, je-li to možné, příčinu obtíží. V praxi se samozřejmě vyskytuje určitá část pacientek, u kterých lze současně s IC objevit také některé z dále uvedených gynekologických onemocnění. Z gynekologických příčin syndromu chronické pánevní bolesti se uvádějí: endometrióza, vulvodynie, pánevní infekce, srůsty v malé pánvi a také leiomyom dělohy. Okolo 50 % pacientek uvádí jako podstatný symptom dyspareunii [18]. Tu lze rozdělit ještě podle etáže, kde jsou bolesti největší. Nejčastěji je tedy nutno odlišit v rámci diferenciální diagnostiky endometriózu, vulvodynie, urogenitální atrofii, pánevní infekce a gynekologické malignity.
LÉČBA IC
Léčba bolesti u IC
Pro velkou část pacientů s IC je bolest podstatným projevem nemoci, pro určitou část pacientů dokonce velmi limitujícím faktorem jejich osobního života. Přestože je bolest svým stupněm a mnohdy obtížným terapeutickým ovlivněním srovnatelná s bolestí nádorovou, stojí dosud mimo oblast zájmu specialistů věnujících se bolesti. Lékaři pečující o pacienty s IC tuto součást léčby někdy opomíjejí, protože pochopení mechanizmu vzniku a ovlivnění bolesti je náročné a efekt léčby minimální.
Vzhledem k množství možných etiopatogenetických faktorů podílejících se na vzniku IC a vzhledem k polymorfním obtížím pacientů je léčba tohoto onemocnění svízelná a polypragmatická. Odpověďna léčbu je vysoce individuální a pouze malou část terapeutických výkonů lze prohlásit za kurativní. Prvním a společným prvkem v léčbě nově diagnostikované IC je tzv. podpůrná či režimová terapie: informovanost pacienta, psychická podpora, redukce stresu, zvýšený příjem tekutin, dietní opatření, trénink močového měchýře.
Medikamentózní léčba
Odpověďna léčbu je individuální a pouze malou část výkonů lze prohlásit za kurativní. Prvním krokem v léčbě nově diagnostikované IC je tzv. režimová terapie: redukce stresu, dietní opatření. Z praxe je totiž známo, že změnou diety může dojít ke zmírnění či dokonce vymizení bolestivých příznaků IC.
Léčbu lze dělit podle různých hledisek. Podle mechanizmu účinku: prvním typem jsou léky redukující bolest a ovlivňující senzitivitu (např. antidepresiva, anticholinergika, hypnotika, neopiátová analgetika, opioidy, antikonvulziva). Dalším typem jsou cytodestruktivní techniky – chemické či mechanické ničení povrchní či hlubší vrstvy přechodního epitelu. Efekt je většinou krátkodobý. Dále užíváme epiteliální coating techniky, tj. heparin, pentosanpolysulfát, hyaluronovou kyselinu. Jiné může být dělení na základě lékové formy a aplikace: tj. systémová léčba perorální, subkutánní, intravezikální. Vzhledem k výhodám je dnes preferována léčba instilací léčiv do močového měchýře.
Principy farmakoterapie založené na znalosti mechanizmů neuropatické bolesti
Na základě objasněných patofyziologických mechanizmů se v posledních 2 desetiletích modifikovaly principy farmakoterapie tohoto typu bolesti. Mohla být opuštěna pouze empirická terapie.
Je obecně známo, že neopioidní analgetika, tj. analgetika-antipyretika a nesteroidní antirevmatika (NSA), jsou u neuropatických bolestí málo účinná. Opioidní analgetika mají u neuropatických bolestí nižší účinnost, ze slabých opioidů bylo opakovaně popsáno uspokojivé potlačení bolestí po vyšších dávkách tramadolu.
Z farmak, která zasahují specifičtěji do uvedených mechanizmů neuropatické bolesti, jsou na prvém místě léčiva s membránově stabilizujícími účinky, tj. léky inhibující činnost iontových kanálů. Lékovými skupinami inhibujícími činnost sodíkových kanálů využívanými v léčbě neuropatických bolestí jsou lokální anestetika, antiepileptika a do určité míry i tricyklická antidepresiva.
Antikonvulziva (antiepileptika) jsou v těchto indikacích široce využívána. Gabapentin (Neurontin) účinkuje dosud ne přesně objasněnými mechanizmy, mezi něž patří zesílení GABAergních účinků, inhibice a2d podjednotky napěově řízených kanálů pro vápník a inhibice uvolňování glutamové kyseliny na synapsích. Rozšířením léčiv této skupin se jeví pregabalin (Lyrica).
Tricyklická antidepresiva vykazují několik farmakologických účinků, jimiž potlačují neuropatické bolesti. Bylo zjištěno, že se vedle svého hlavního účinku na neurotransmitery podílejí na blokádě sodíkových a vápníkových kanálů v nervovém systému. Výhodou je zlepšení spánku a nálady. Nejvíce jsou užívána antidepresiva I. generace, zejména amitriptylin. Počáteční nízká dávka 10–25 mg na noc se postupně zvyšuje podle léčebného efektu a podle výskytu vedlejších negativních účinků (srdeční arytmie, ortostatická hypotenze, poruchy paměti, zmatenost, suchost sliznic, retence moči). Z novějších antidepresiv (skupina inhibitorů zpětného vychytávání serotoninu a noradrenalinu - SNRI) byl popsán příznivý efekt na neuropatické bolesti po podání venlafaxinu a duloxetinu. Naopak, specifické inhibitory zpětného vychytávání serotoninu (SSRI) mají podstatně nižší účinnost.
U neuropatických a neuralgických bolestí, které nelze dostatečně potlačit monoterapií, je účelné zvolit kombinaci látek s analgetickými účinky. Byl popsán příznivý efekt kombinace morfinu s gabapentinem.
Myorelaxancia – ze škály prepa-rátů je nejčastěji indikován u neuropatické bolesti v malé pánvi baklofen zejména u neuropatických bolestí s muskuloskeletální komponentou (svalo-vé spazmy). Používají se dávky do 80–100 mg/den.
Chirurgická léčba
Při rozhodování o nutnosti invazivní chirurgické léčby je užitečné mít na zřeteli také neúspěchy v případě velmi invazivních chirurgických postupů, od kterých se ustupuje.
Nejjednoduššími jsou výkony endoskopické: hydrodistenze měchýře nebo transuretrální resekce ulcerací sliznice. Chirurgické metody zaměřené na inervaci močového měchýře mají za cíl redukci hypersenzitivity a intravezikálního tlaku. Obnovují jeho jímací funkci. Parciální či totální cystektomie s náhradou měchýře střevním segmentem zůstává jedinou kurativní metodou léčby IC s dlouhodobým efektem. Vzhledem k možné recidivě histologických i cystoskopických změn i na střevním segmentu je vhodnější metodou volby provedení subtrigonální (totální) cystektomie. Progrese resp. recidiva onemocnění byla popsána také v distální části močovodu (terminální intersticiální ureteritida). Varovným signálem před unáhlenou indikací k závažným chirurgickým výkonům je údaj, že až v 60 % případů se u takto ošetřených pacientů objevují tzv. fantomové bolesti v malé pánvi.
Dietní a režimová opatření
Existuje jen málo údajů v literatuře, které by přímo popisovaly závislost symptomů IC na dietě a jejich změny v souvislosti se změnou diety. Většinou jsou tyto práce zaměřeny na pozorování působení jednotlivých metabolitů na stěnu močového měchýře. Je však známo z klinické praxe, že při změně stravy může dojít ke zmírnění či dokonce vymizení bolestivých a jinak obtěžujících příznaků IC.
KOMPLIKACE
Možné komplikace vyplývají z podstaty onemocnění (psychická dekompenzace při intenzivních subjektivních obtížích, enormní zhoršení kvality života) nebo vznikají jako následky léčby IC (vedlejší účinky léků, chemická cystitida po intravezikálním podání léčiva, vezikoureterální reflux, dilatace horních močových cest na podkladě stenotizace močovodů, opakované pyelonefritidy, renální nedostatečnost po sub - či totální náhradě měchýře).
PROGNÓZA
Přes intenzivní výzkum a změnu taktiky diagnostiky a terapie IC je onemocnění pro své nositele psychicky i fyzicky náročné. Je léčitelné, leč ve většině případů nevyléčitelné. Přestože v posledních letech opět převažuje konzervativnější trend v léčbě IC, u některých pacientů je možné zlepšit kvalitu života jen metodami chirurgickými. Onemocnění je chronické, recidivující a vyžaduje multidisciplinární přístup.
U chronické perzistující bolesti je nezbytná dlouhodobá dispenzarizace vzhledem k obtížnému ovlivnění bolestivého stavu a chronicitě obtíží. Při péči o pacienta s neuropatickou bolestí je vhodná i konzultace odborníka na psychosomatickou problematiku i sociálních pracovníků, protože onemocnění je často doprovázeno příznaky vyplývajícími z bolesti a ty mají známé bio-psycho-sociální důsledky.
ZÁVĚR
Neuropatické bolesti představují heterogenní skupinu, u níž se v posledních letech významně rozšířily poznatky o jejich mechanizmech. Na jejich základě mohlo dojít ke změně empirické terapie na terapii patofyziologicky podloženou. Léčba zde má vycházet nejen z postupů doporučených obecně pro tento typ bolesti, ale současně z jejich etiologie. Z toho se snažme vycházet i u pacientů s intersticiální cystitidou.
Práce byla podpořena grantem IGA MZ čR 8098-3.
MUDr. Libor Zámečník, FEBU1
prof. MUDr. Tomáš Hanuš, DrSc.1,2
1Urologická klinika VFN a 1. LF UK
Ke Karlovu 6
128 08 Praha 2
e-mail: libor.zamecnik@lf1.cuni.cz
2Katedra urologie IPVZ Praha
Zdroje
1. Hunner GL. A rare type of bladder ulcer in women: report of cases. Trans South Surg Gynecol Assoc 1915; 27 : 247-292.
2. Oravisto KJ. Epidemiology of interstitial cystitis. Ann Chir Gynaecol Fenn 1975; 64 : 75-77.
3. Clemens JQ, Meenan RT, Rosetti MC et al. Prevalence and incidence of interstitial cystitis in a managed care population. J Urol 2005; 173 : 98-102.
4. Peeker R, Atanasiu L, Logadottir Y. Intercurrent autoimmune conditions in classic and non-ulcer interstitial cystitis. Scand J Urol Nephrol 2003; 37 : 60-63.
5. Kanai A, de Groat W, Birder L et al. Symposium report on urothelial dysfunction: pathophysiology and novel therapies. J Urol 2006; 175 : 1624-1629.
6. Anderson VR, Perry CM. Pentosan polysulfate: a review of its use in the relief of bladder pain or discomfort in interstitial cystitis. Drugs 2006; 66 : 821-835.
7. Elbadawi A. Interstitial cystitis: a critique of current concepts with a new proposal for pathologic diagnosis and pathogenesis. Urology 1997; 49 : 14-40.
8. Parsons M, Toozs-Hobson P. The investigation and management of interstitial cystitis. J Br Menopause Soc 2005; 11 : 132-139.
9. Lotenfoe RR, Christie J, Parsons A et al. Absence of neuropathic pelvic pain and favorable psychological profile in the surgical selection of patients with disabling interstitial cystitis. J Urol 1995; 154 : 2039-2042.
10. Kozák J, černý R, Vrba I. Neuropatická bolest z pohledu algeziologa. Neurol pro Praxi 2004; 7 : 259-263.
11. Propert KJ, Mayer RD, Wang Y et al. Responsiveness of symptom scales for interstitial cystitis. Urology 2006; 67 : 55-59.
12. Parsons CL, Stein PC, Bidair M, Lebow D. Abnormal sensitivity to intravesical potassium in interstitial cystitis and radiation cystitis. Neurourol Urodyn 1994; 13 : 515-520.
13. Parsons CL, Albo M. Intravesical potassium sensitivity in patients with prostatitis. J Urol 2002; 168 : 1054-1057.
14. Hohlbrugger G, Riedl CR. A new direct test of bladder permeability. J Urol 2001; 165 : 914-915.
15. Zámečnik L, Hanuš T, Pavlík I et al. Interstitial cystitis-its diagnostics and treatment. čas Lék česk 2005; 144(suppl 2): 23-29.
16. Nordling J, Anjum FH, Bade JJ et al. Primary evaluation of patients suspected of having interstitial cystitis (IC). Eur Urol 2004; 45 : 662-669.
17. Keay SK, Zhang CO, Shoenfelt J et al. Sensitivity and specificity of antiproliferative factor, heparin-binding epidermal growth factor-like growth factor, and epidermal growth factor as urine markers for interstitial cystitis. Urology 2001; 57 : 9-14.
18. Clemons JL, Arya LA, Myers DL. Diagnosing interstitial cystitis in women with chronic pelvic pain. Obstet Gynecol 2002; 100 : 337-341.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2007 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Infekce močových cest u dospělých – mezery v současných guidelines a doporučení pro klinickou praxi
-
Všechny články tohoto čísla
- KVÍZ
- Nádorová bolest a možnosti její léčby
- Patofyziologie pánevní bolesti
- Chronické pánevní bolesti a sexuální funkce pohledem urologa a anatoma
- Chronická bolest a sexuální dysfunkce u pacientů s chronickou prostatitidou/ syndromem chronické pánevní bolesti
- Chronická bolest u intersticiální cystitidy
- Ze zahraničních periodik
- Pooperační bolest
- Zpráva z konference AUA Annual Meeting 2007 Anaheim, California, USA
- GUIDELINES EAU PRO ZVLÁDÁNÍ CHRONICKÉ PÁNEVNÍ BOLESTI
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chronické pánevní bolesti a sexuální funkce pohledem urologa a anatoma
- Chronická bolest u intersticiální cystitidy
- Patofyziologie pánevní bolesti
- Pooperační bolest
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



