-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Atypická, extrapankreatická pseudocysta pankreatu
Atypical, extra pancreatic pseudocyst of the pancreas
The pseudocyst of the pancreas is one of the most common cystic lesions of the pancreas. The pseudocysts can be defined as intrapancreatic, peripancreatic or extrapancreatic fluid collections with a defined wall formed mostly on the basis of acute or chronic pancreatitis. This is a relatively common complication of acute or chronic pancreatitis. Sonography is essential for the diagnosis given its noninvasivity and availability. Other assessments that show the highest accuracy, specificity and sensitivity include MDCT and ERCP. The MDCT and ERCP assessments can be used to classify the pseudocyst; the treatment algorithm is then determined based on this classification. MDCT should ideally be preceded by ERCP. EUS-FNAB or aspiration with the determination of oncomarkers and AMS in the aspirate have been shown to be most important to distinguish the pseudocyst from malignant cystic lesions. Functional classification of the pseudocyst is an important prerequisite for successful algorithm of the treatment. The classification is based mainly upon anatomical relations of the pseudocyst to the pancreatic outlet and morphology of the pancreatic parenchyma. Percutaneous drainage, endoscopic and surgical methods are mainly applied in the treatment. The authors present a case report of a very rare extrapancreatic pseudocyst.
Key words:
pseudocyst − pancreatic pseudocyst classification − extrapancreatic pseudocyst
Autoři: L. Havlůj; B. Mlýnek; R. Gürlich
Působiště autorů: Chirurgická klinika 3. LF Univerzity Karlovy a FN Královské Vinohrady přednosta: prof. MUDr. R. Gürlich, CSc.
Vyšlo v časopise: Rozhl. Chir., 2016, roč. 95, č. 3, s. 126-130.
Kategorie: Kazuistika
Souhrn
Pseudocysta pankreatu patří mezi nejčastější cystické léze pankreatu. Pseudocystu lze definovat jako tekutinovou intrapankreatickou, peripankreatickou nebo extrapankreatickou kolekci s definovanou stěnou vznikající nejčastěji na pokladě chronického nebo akutního zánětu pankreatu. Jde o poměrně častou komplikaci akutní nebo chronické pankreatitidy. V diagnostice má zásadní význam UZ pro svou neinvazivitu a dostupnost. Mezi další vyšetření vykazující nejvyšší přesnost, specificitu a senzitivitu patří MDCT a ERCP. Na základě MDCT a ERCP vyšetření lze stanovit klasifikaci a na základě této klasifikace následně algoritmus léčby. MDCT vyšetření by optimálně mělo předcházet ERCP. K odlišení od maligních cystických lézí pak prokazuje největší význam EUS s FNAB nebo aspirací obsahu se stanovením onkomarkerů a AMS v aspirátu. Funkční klasifikace pseudocyst je důležitým předpokladem pro úspěšný algoritmus léčby. Klasifikace vycházejí zejména z anatomického vztahu pseudocysty k pankreatickému vývodu a morfologii parenchymu pankreatu. V léčbě se uplatňují zejména perkutánní drenáž, endoskopické a chirurgické metody.
Klíčová slova:
pseudocysta – klasifikace pseudocyst pankreatu – extrapankreatická pseudocystaÚvod
Intrapankreatické pseudocysty vznikají nekrózou parenchymu pankreatu nebo rupturou větších pankreatických vývodů. Predikčním místem je hlava pankreatu a jsou většinou menších rozměrů. Peripankreatické pseudocysty jsou nejčastější, jsou lokalizované zejména v oblasti ocasu, méně často v oblasti těla pankreatu. Vždy jsou alespoň v minimálním rozsahu v přímém kontaktu s pankreatem. Podle lokalizace se jedná o retrogastrické (nejčastější), gastrokolické, gastroduodenální, gastrosplenické nebo submesokolické pseudocysty. Peripankreatické pseudocysty vznikají progresí velikosti intrapankreatických pseudocyst, organizací peripankreatických kolekcí nebo disrupcí drobných pankreatických vývodů. Extrapankreatické pseudocysty jsou kompletně mimo pankreas a jsou extrémně vzácné, jejich patogeneze není úplně objasněna. Alkoholismus jako příčinu vzniku pseudocyst lze prokázat až v 59−78 %. Dále biliární příčina v 8 %, tupé poranění pankreatu v 5 %, penetrující poranění v 1 %, supramesokolické operace do 1 %. Až v 6−16 % je ale příčina neznámá [1]. Po stanovení diagnózy pseudocysty pankreatu je nutné pseudocystu klasifikovat a na základě klinicky fungující klasifikace zvolit řádný léčebný postup.
Kazuistika
76letá žena vyšetřena a následně přijata 10. 7. 2012 na interní oddělení pro cca 6 hodin trvající kruté bolesti v nadbřišku, zvracení světlého obsahu a nevolnost. Bolest s iradiací do obou podžebří a do zad. Anamnesticky byla léčena pro arteriální hypertenzi, polytopní VAS, stp erysipelu 5/2012, operace katarakty l. utr., operace varixů. Abusus alkoholu uvádí jako velmi příležitostný, nekuřačka. Níže uvedené laboratorní hodnoty jsou uvedeny při přijetí, maximální dosažená hodnota a poslední měřená hodnota. Krevní obraz leu 7,4…13.5…12,5 10⁹/l, ostatní parametry krevního obrazu v normě. Biochemické vyšetření séra prokázalo S-AMS 26,53... 26,53...2,49 µkat/l, lipáza 315,46...315,46...16,84 µkat/l, CRP 6,0...313,6...72,0 mg/l. Z jaterního souboru S-GMT 1,3...2,62...1,96 µkat/l, S-AST 3,12...3,12...1,13 µkat/l, S-ALT 1,91...2,22...1,28 µkat/l, bilirubin 19,4...30,2...10,7 µmol/l, S-ALP byla po celou dobu v normě. Lehká hypokalemie byla korigovaná parenterálním podáním draslíku. Urea a kreatinin po celou dobu hospitalizace v normě. V den přijetí bylo provedeno UZ břicha s nálezem cholecystolithiazy, byla popsána hraniční šíře choledochu až počínající obraz městnání. Pankreas lipomatózní, v okolí s jemným srpkem tekutiny v. s. při pancreatitis acuta. Na základě UZ nálezu a vstupní laboratoře byla stanovena diagnóza akutní biliární pankreatitidy. Následující den hospitalizace bylo provedeno ERCP vyšetření: Po aplikaci kontrastní látky se zobrazují četné drobné defekty v hepatocholedochu a nad papilou. Blok cystiku. Provedena papilotomie a Dormia košíkem konkrementy odstraněny (Obr. 1). Po ERCP stav rychle regredoval, došlo k poklesu laboratorních hodnot včetně zánětlivých ukazatelů, realimentace s dobrou tolerancí. Dimise 9. hospitalizační den. Vzhledem k mnohočetné drobné cholecystolithiáze byla doporučena elektivní cholecystektomie. Při kontrole na chirurgii před stanovením termínu operačního řešení bylo indikováno kontrolní UZ břicha. Na základě kontrolního UZ byla prokázána suspektní pseudocysta hlavy pankreatu. Onkomarkery (CEA a CA19-9) byly v normě. Pacientka byla dále dovyšetřována k vyloučení maligního onemocnění. Dle EUS popsán nález objemného cystického, septovaného útvaru v oblasti hlavy pankreatu, bez komunikace s pankreatem, nepřístupným k FNAB. Na MDCT byl potvrzen nález pseudocysty (Obr. 2, 3).
Obr. 1. ERCP nález, normální Wirsung, dilatace HCH Fig. 1. Normal ERCP finding, normal Wirsung duct, CBD dilatation 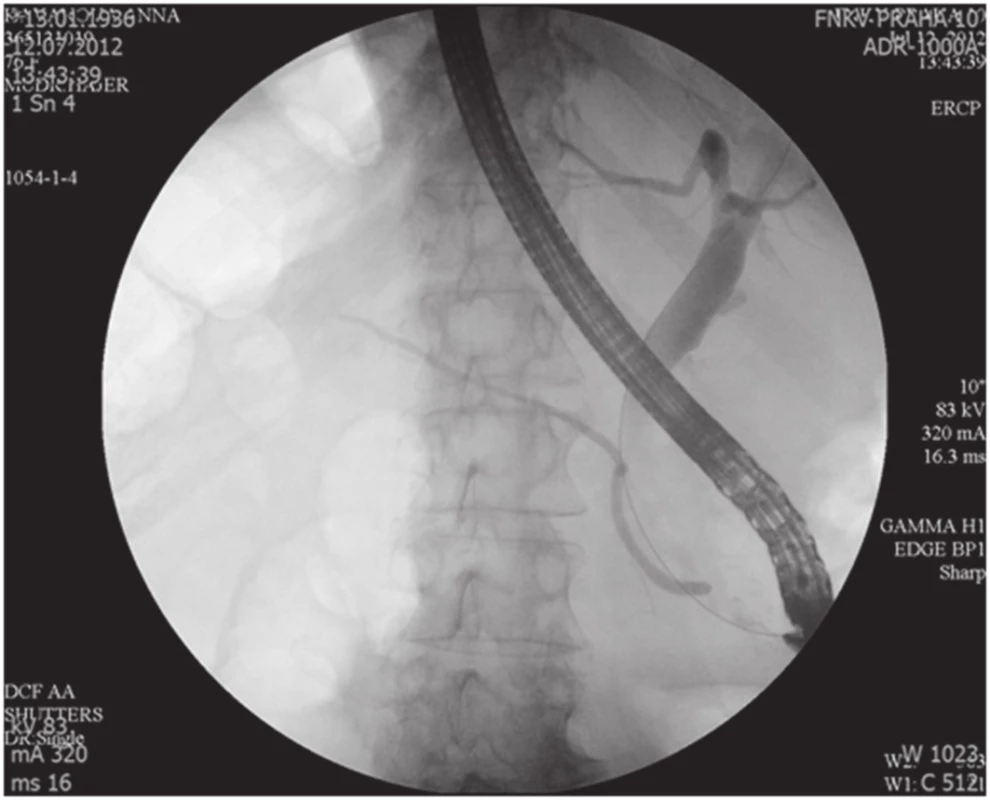
Obr. 2. Koronární MDCT scan, útlak žaludku a L jaterního laloku Fig. 2. Coronal MDCT scan, compression of the stomach and left liver lobe 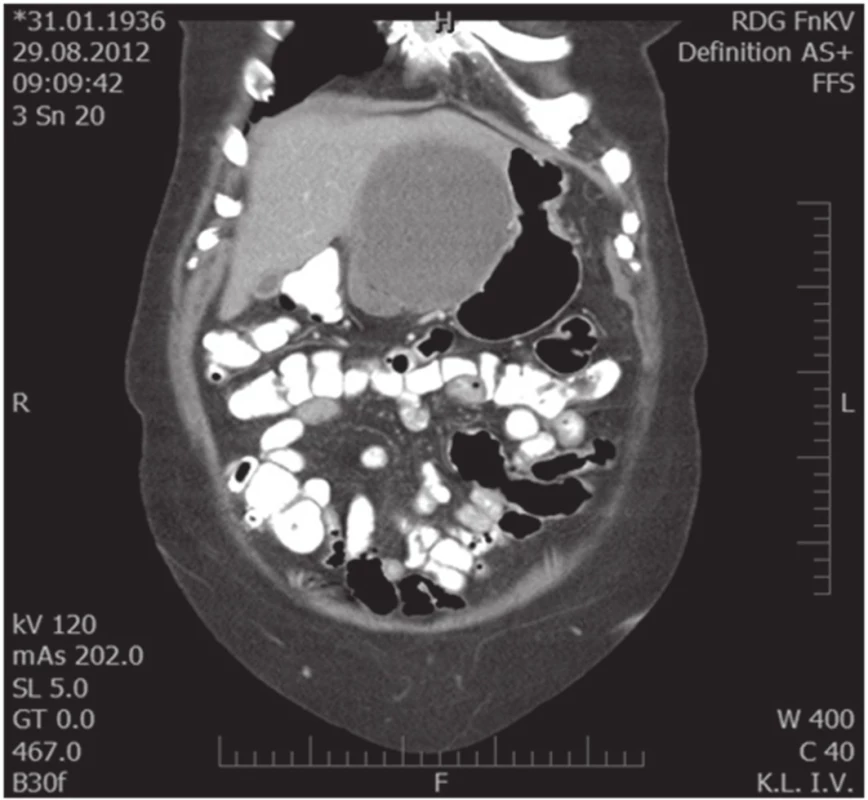
Obr. 3. Předoperační MDCT scan, transverzální snímek Fig. 3. Preoperative MDCT scan, transversal scan 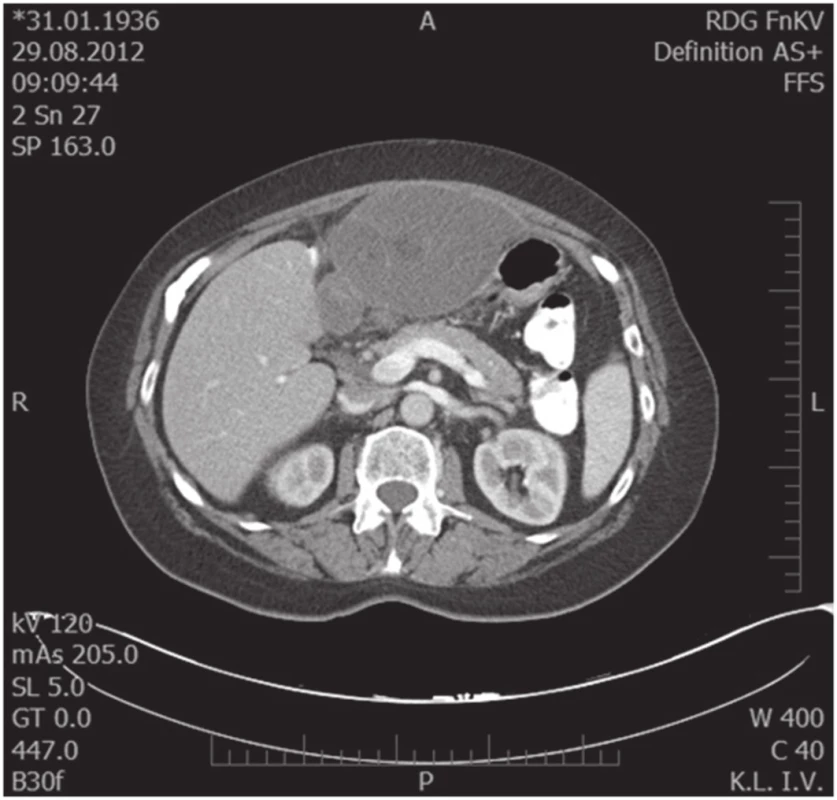
Pacientce byl navržen postup – operační revize laparotomickou cestou s plánovanou CHCE a vnitřní drenáží pseudocysty, na žádost pacientky až v listopadu 2012. Laparoskopická cholecystektomie se zevní drenáží vzhledem k septům pseudocysty nebyla vhodná. 11/2012 revize z příčné laparotomie, peroperačně však nález supramezokolické rezistence (velikost cca 12x10 cm) v oblasti ligamentum teres hepatis a l. falciforme hepatis od jaterního parenchymu SIVB až k umbiliku. Proximálně zasahující až subdiafragmaticky (Obr. 4). Vaskularizované adheze k omentu a ligamentum gastrocolicum přerušeny. Pankreas byl palpačně normální. Vzhledem k tomu, že se rezistence nacházela kompletně mimo pankreas, byla peroperačně zvažována i diagnóza chronického abscesu. Byla provedena kompletní exstirpace rezistence (Obr. 5). Base v jaterním parenchymu SIVB prošita PDS stehem. Po exstirpaci útvaru byla provedena punkce (Obr. 6), obsah rezistence charakterem spíše odpovídal pseudocystě, punktát byl odeslán na bakteriologické vyšetření a biochemické vyšetření ke stanovení AMS. Peroperační hladina AMS byla v rezistenci nízká. Následně retrográdní cholecystektomie. Výkon trval 100 minut, min. krevní ztráta, pooperační průběh bez komplikací, zhojena per primam. Bakteriologicky byl nález sterilní. Dimise 6. pooperační den.
Obr. 4. Peroperační pohled z příčné laparotomie, mobilizace pseudocysty od bránice Fig. 4. Peroperative view from transversal laparotomy, mobilisation of the pseudocyst from the diaphragm 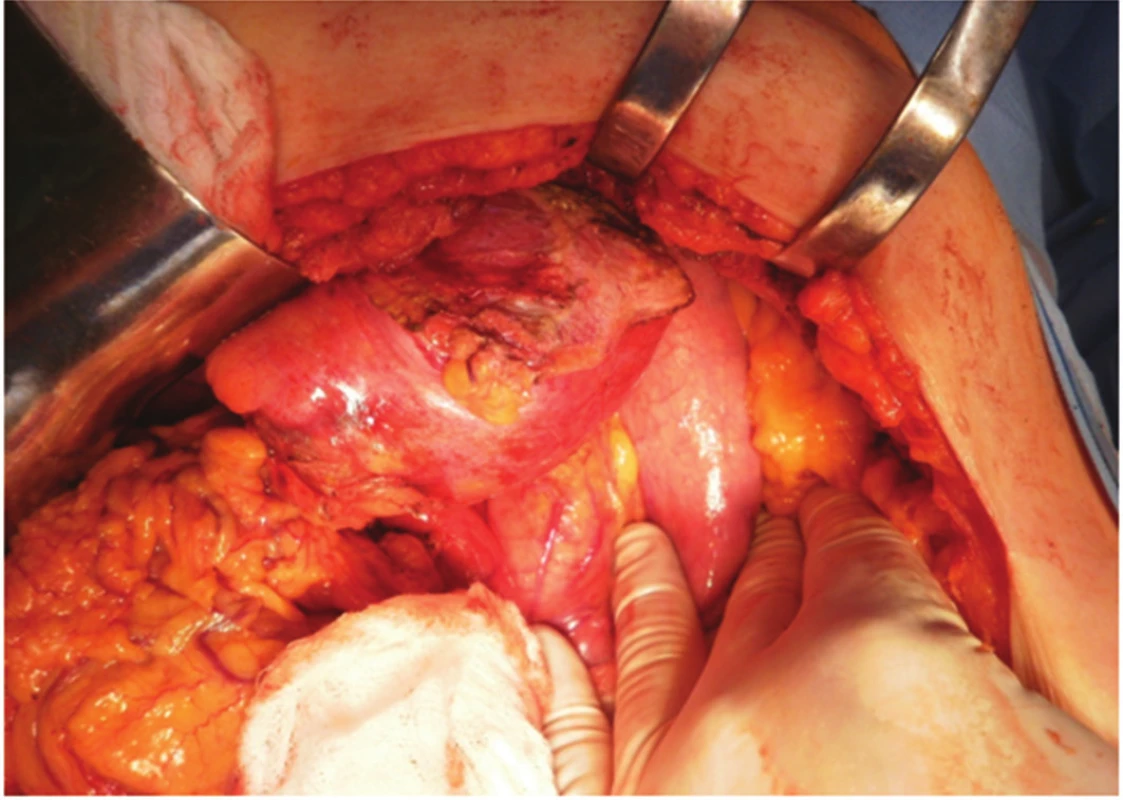
Obr. 5. Kompletní pseudocysta Fig. 5. Complete pseudocyst 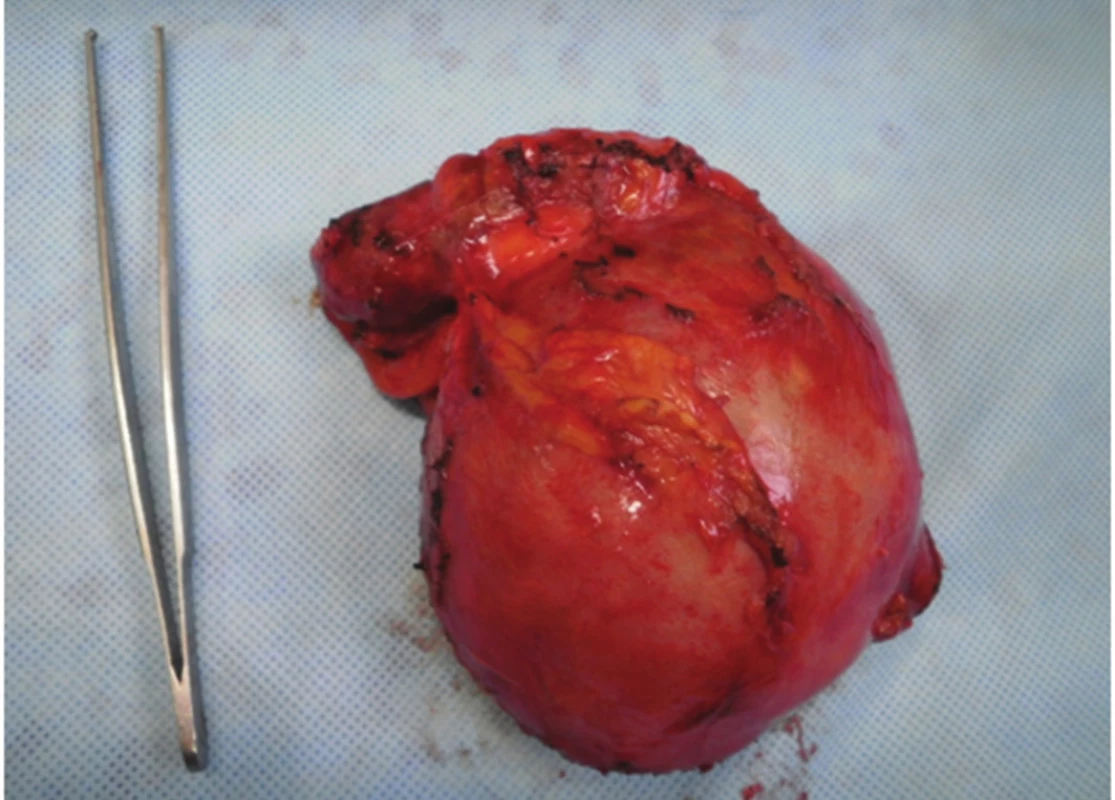
Obr. 6. Punktát pseudocysty, obsah makroskopicky typický pro pseudocystu Fig. 6. Pseudocyst punctate with fluid collection macroscopically typical for a pseudocyst 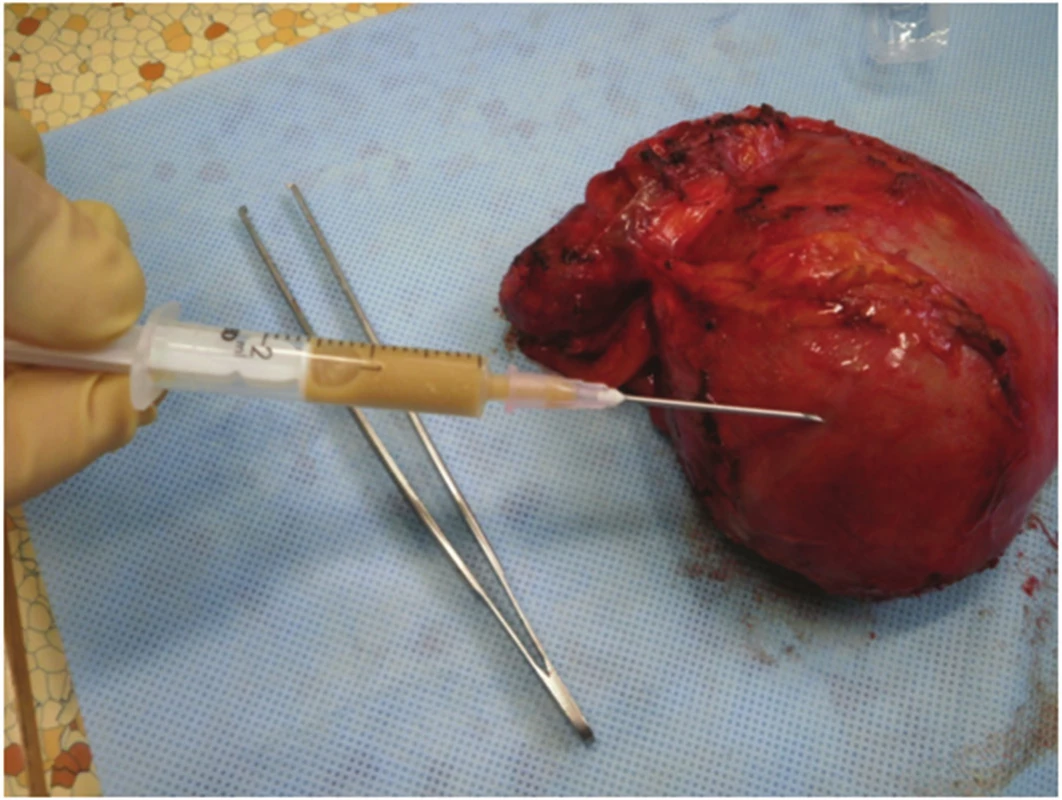
Definitivní histologie potvrdila klinickou diagnózu pseudocysty. Závěr histopatologického vyšetření: zaslaný materiál je tvořen tukově vazivovou tkání, v centrální části se zachycenou postnekrotickou pseudocystou měkkých tkání, jejíž stěna je tvořena ve většině rozsahu vazivem, místy s ložisky nepříliš intenzivní lymfoplazmocytární zánětlivé celulizace a granulomatózní zánětlivou reakcí, v lumen zachyceny zbytky nekrotické tukové tkáně, fokálně s depozicí solí kalcia (pozitivní barvení dle von Kossy), ve stěně pseudocysty dále zachycena depozice hemosiderinu (pozitivní Perlsova reakce), dále v nekrotických hmotách zachycena přítomnost hematogenních pigmentů, které se neznázorňují barvením dle Foucheta. Floridní zánětlivé změny mikroskopicky ve vyšetřeném rozsahu nebyly identifikovány, zachycena je pouze mírná lymfoplazmocytárně zánětlivá celulizace ve vazivové stěně pseudocysty. Histopatologický závěr odpovídal starší pseudocystě s ložisky steatocytonekróz, tento obraz nejspíše souvisí s klinicky udávanou pankreatitidou a pseudocystou v pankreatu, o stěnu abscesu se nejedná. Pacientka byla kontrolována s odstupem 4 měsíců od operace, laparotomie zhojena, pacientka zcela bez obtíží, bez známek recidivy.
Diskuze
Tekutinové kolekce v lig. teres a l. falciforme hepatis jsou raritní a v literatuře jsou uvedeny kazuistiky jednotlivých případů [2]. Nejčastěji se jedná o nespecifický absces, např. jako raritní komplikace ERCP s papilotomií [3]. Dále se může jednat o absces vzniklý v důsledku proběhlé omfalitidy v dospělém (umbilikální piercing) [3,4] nebo novorozeneckém věku. Další příčinou kolekce může být vzácně progrese akutní cholecystitidy. Maligní variantu tekutinové kolekce v lig. teres hepatis představuje mucin-hypersecernující papilární cholangiokarcinom [5]. Pseudocysty vznikají po atace AP v 30−60 % případů, v terénu CHP je incidence nižší 20−40 % [6]. Klasifikace vycházejí zejména z MDCT a ERCP vyšetření. Dle Atlantské klasifikace se pseudocysty dělí na akutní a chronické. Akutní pseudocysty vznikají následkem akutní pankreatitidy nebo následkem traumatu. Stěna akutní pseudocysty je tvořena křehkou granulační tkání a obsahem je pankreatická šťáva obvykle s vysokou aktivitou amyláz. Akutní pseudocysty mohou až v polovině případů spontánně regredovat do 4−6 týdnů od vzniku [1,7]. Pokud dle MDCT akutní pseudocysta obsahuje bubliny plynu (i minimální), pak se již nejedná o pseudocystu, ale jedná se o pankreatický absces. Jedině pomocí MDCT lze odlišit akutní pseudocystu od abscesu pankreatu. Léčba akutní pseudocysty je zejména konzervativní, event. extraperitoneální drenáž pod MDCT. Operační léčba je indikovaná pouze při komplikacích (krvácení, perforace). Naopak chronická pseudocysta má stěnu tvořenou spíše fibrózní tkání, nevzniká většinou jako následek akutní pankreatitidy a bývá způsobena regresivními změnami pankreatického duktu (stenózy). Na vzniku pseudocyst se podílí i anatomie vztahu hlavního a akcesorního (Santoriniho) vývodu, morfologické varianty jako pankreas divisum [8].
Klasifikace dle D‘Egidio, vychází jak z anatomické lokalizace pseudocysty, tak ze vztahu pseudocysty a pankreatického vývodu. Pseudocysty se dle této klasifikace člení na 3 typy. Typ I je akutní pseudocysta, zřídkakdy komunikující s pankreatickým vývodem, vzniká následkem akutní pankreatitidy. Při nekrotizující pankreatitidě se z akutní nekrózy vyvíjí ohraničená nekróza (WON či WOPN), která není označována jako pseudocysta. V případě typu II k tvorbě pseudocysty dochází po akutní pankreatitidě nebo atace chronické pankreatitidy, pseudocysta komunikuje s vývodným systémem pankreatu, který je chronicky změněný, ale nejsou patrné striktury. Typ III vzniká v terénu chronické pankreatitidy se strikturami pankreatických vývodů s retencí pankreatické šťávy [9].
Klasifikace dle W. H. Nealona je nejsložitější a stanovuje VII skupin. Vychází podrobně z morfologie pankreatického duktu, parenchymu žlázy a vztahu s pseudocystou (Tab. 1).
Tab. 1. Klasifikace pseudocyst a léčby upravená dle WH Nealona Tab. 1. Pseudocyst and therapy classification adapted according to WH Nealon 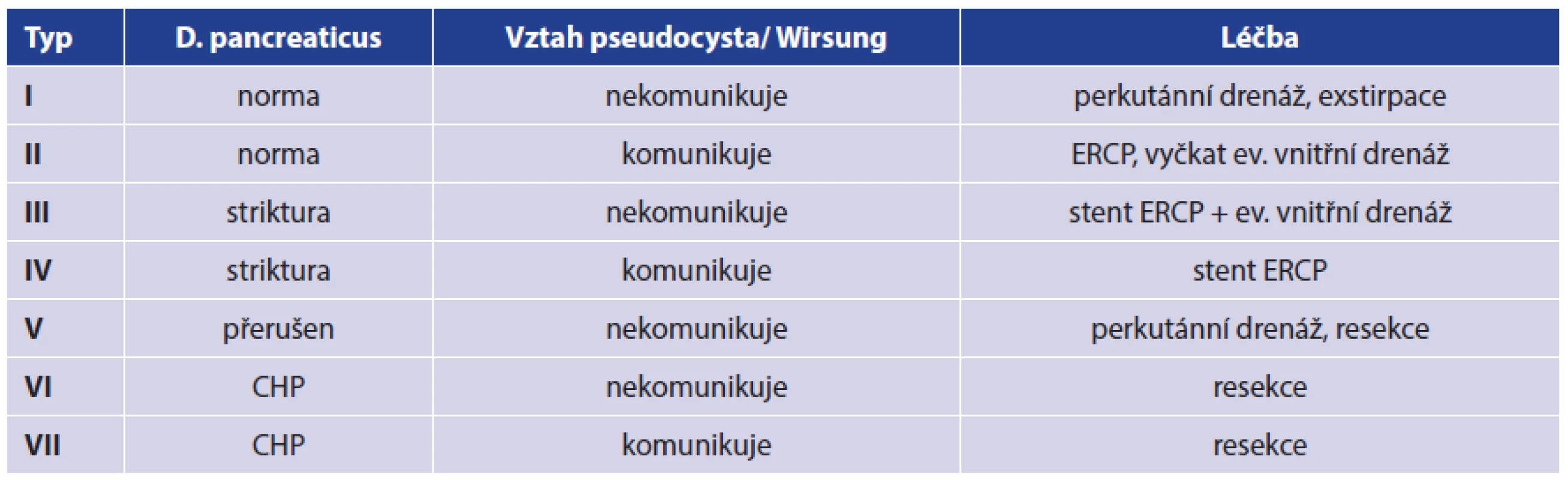
Pokud je normální pankreatický vývod a pseudocysta komunikuje s vývodem, pak je vhodné s řešením pseudocysty vyčkat. Perkutánní drenáž pseudocysty může být úspěšná až v 42−92 %, předpokladem je však ponechání drénu často déle než 2 měsíce [10−14]. Nejčastější komplikací perkutánní drenáže je obstrukce katétru se známkami sepse, vyskytuje se v průběhu drenáže až u 70 % pacientů. Endoskopické řešení je vhodné pro pseudocysty větší než 6 cm se vzdáleností maximálně 1 cm od stěny zažívacího traktu. Před endoskopickým řešením je nutné provést EUS. Endoskopická léčba má srovnatelné výsledky stran morbidity (10−30 %), mortality (1−5 %) a rekurence (10−20 %) jako chirurgický přístup. Výkon se provádí laterálním endoskopem, punkce papilotomem, je vhodné zavést min. dva 10F stenty. Základem úspěchu je správné zvolení místa fenestrace, tak aby byla pseudocysta pokud možno celá drenovaná do žaludku [15].
Operační výkony lze dělit na drenážní operace a resekční výkony. Převažují drenážní operace nad resekčními. Historicky uváděná marsupializace se dnes již neprovádí. Resekční výkony jsou vzácněji indikované a lze provést např. centrální resekci, distální resekci ideálně se zachováním sleziny. V některých případech lze výkon provést i laparoskopicky [16]. Při lokalizaci pseudocysty v hlavě pankreatu v terénu chronické pankreatitidy lze provést proximální resekci s limitovanou resekcí duodena, jak ji publikoval v roce 1998 Nakao. Begerovu resekci na našem pracovišti neprovádíme pro riziko ischemie choledochu a duodena při přerušení a. gastroduodenalis [17]. Extrapankreatická tekutinová kolekce, kterou jsme uvedli v kazuistice, byla peroperačně klinicky hodnocena spíše jako chronický absces. Peroperačně stanovená hladina AMS a lipázy v obsahu kolekce byla v mezích sérových hladin. Definitivní histologický nález však diagnózu abscesu vyloučil a vyloučil i cystické tumory. Hladina AMS a lipázy v obsahu pseudocysty může být ve vzácných případech v normálních sérových hladinách [18]. Z těchto důvodů jsme diagnózu nakonec přehodnotili a tuto tekutinovou kolekci označili jako atypickou pseudocystu pankreatu. Atypickou svým charakterem obsahu a lokalizací. Podle klasifikace W. H. Nealona se jednalo o typ I (normální parenchym a bez vztahu kolekce s pankreatickými vývody).
Závěr
Extrapankreatická pseudocysta pankreatu s nízkou hladinou AMS v obsahu, lokalizovaná do lig. teres hepatis a l. falciforme hepatis nebyla dosud v dostupné literatuře uvedena. Extrapankreatické lokalizace jsou navíc extrémně vzácné. Nejčastějším místem výskytu extrapankreatických pseudocyst jsou játra a slezina [19]. Ojediněle jsou popisovány případy uložení pseudocysty v mediastinu, v pleurální dutině, v malé pánvi. Námi uvedená kazuistika je raritní lokalizací pseudocysty a je raritní nízkým obsahem amylázy, klinická diagnóza chronického abscesu byla vyloučena histopatologickým nálezem. Navíc kompletní chirurgická exstirpace pseudocysty nepatří mezi typické výkony pro tuto diagnózu. Bakteriologicky bývá obsah pseudocysty v 50−80 % sterilní. Chirurgická léčba pseudocysty je dnes indikovaná pouze u případů neřešitelných endoskopicky nebo perkutánní drenáží. Základním předpokladem možnosti mininvazivní léčby formou drenáže je vyloučení malignity [20]. Indikací k primárně operačnímu řešení je tedy podezření na malignitu. Na maligní variantu cystické léze je nutné pomýšlet, zejména pokud z anamnestických údajů nevyplývají údaje o proběhlé AP nebo probíhající CHP. Na druhou stranu i terén CHP a cystických lézí nevylučuje maligní potenciál nebo maligní formu onemocnění. K vyloučení malignity je nutné provést biopsii nebo je vhodné kombinovat vyšetřovací metody (MDCT a MR) a indikovat pacienty k resekčnímu výkonu než sledovat nález s odstupem času.
Seznam zkratek:
S-AMS – sérová alfa-pankreatická amyláza
S-GMT – sérová gama-glutamyltransferáza
S-AST – sérová aspartátaminotransferáza
S-ALT – sérová alaninaminotransferáza
CRP – C reaktivní protein
MDCT – multidetektorová výpočetní tomografie
EUS – endoskopický ultrazvuk
VAS – vertebrogenní algický syndrom
ERCP – endoskopická retrográdní cholangiografie
FNAB – aspirační biopsie tenkou jehlou
EPT – endoskopická papilotomie
PDS – polydioxanon
CHP – chronická pankreatitida
CHCE – cholecystektomie
HCH – hepatocholedochus
UZ – ultrazvuk
CEA – karcinoembryonální antigen
CA19-9 – nádorový antigen 19−9
MR – magnetická rezonanceKonflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.MUDr. Lukáš Havlůj
Chirurgická klinika FNKV a 3. LF UK
Šrobárova 50
100 34 Praha 10
e-mail: lukashavluj@atlas.cz
Zdroje
1. Andrén-Sandberg A, Dervenis Ch. Pancreatic pseudocysts in the 21st century. Part I: Classification, pathophysiology, anatomic considerations and treatment. JOP (Online) 2004;5 : 8−24.
2. Moon SB, Lee HW, Park KW, et al. Falciform ligament abscess after omphalitis: Report of a case. J Korean Med Sci 2010;25 : 1090−2.
3. Tsukuda K, Furutani K, Nakahara S, et al. Abscess formation of the round ligament of the liver: report of a case. Acta Medica Okayama 2008;62 : 411−3.
4. van Vugt ST, Gerritsen DJ. Liver abscess following navel piercing. Ned Tijdschr Geneeskd 2005;149 : 1588−9.
5. Ko SF, Chen YS, Ng SH, et al. Mucin-hypersecreting papillary cholangiocarcinoma presenting as abdominal wall abscess: CT and spiral CT cholangiography. Abdom Imaging 1996;21 : 222−5.
6. Bradley EL 3rd. A clinically based classification system for acute pancreatitis. Arch Surg 1993;128 : 586−90.
7. Bradley E, Clements JL Jr, Gonzales AC. The natural history of pancreatic pseudocysts: a unified concept of management. Am J Surg 1979;137 : 135−41.
8. Traverso LW, Kozarek RA. Pancreatoduodenectomy for chronic pancreatitis: anatomic selection criteria and subsequent long-term outcome analysis. Ann Surg 1997;226 : 429−35.
9. D’Egidio A, Schein M. Pancreatic pseudocysts: A proposed classification and its management implications. Br J Surg 1999;78 : 981−4.
10. Heider R, Meyer AA, Galanko JA, et al. Percutaneous drainage of pancreatic pseudocysts is associated with a higher failure rate than surgical treatment in unselected patients. Ann Surg 1999;6 : 781−89.
11. Van Sonnenberg E, Wittich GR, Casola G, et al. Percutaneous drainage of infected and noninfected pancreatic pseudocysts: experience in 101 cases. Radiology 1989;170 : 757−61.
12. Criadoe Desterano AA, Weiner TM, Jacques PF. Long-term results of percutaneous catheter drainage of pancreatic pseudocysts. Surg Gynecol Obstet 1992;175 : 293−7.
13. Adams DB, Anderson MC. Percutaneous catheter drainage compared with internal drainage in the management of pancreatic pseudocyst. Ann Surg 1992;215 : 571–8.
14. Nealon WH, Wasler E. Main pancreatic ductal anatomy can direct choice of modality for treating pancreatic pseudocysts (surgery versus percutaneous drainage). Ann Surg 2002;235 : 751−8.
15. Chak A. Endosonographic-guided therapy of pancreatic pseudocysts. Gastrointest Endosc 2000; 52(6 Suppl):S23−7.
16. Gürlich R, Sixta B, Oliverius M, et al. Laparoscopic distal resection of the pancreas. Rozhl Chir 2005;84 : 463−5.
17. Nakao A. Pancreatic head resection with segmental duodenectomy and preservation of the gastroduodenal artery. Hepato-gastroenterology 1998;45 : 533−5.
18. Balzan S, Kianmanesh R, Farges O, et al. Right intrahepatic pseudocyst following acute pancreatitis: an unusual location after acute pancreatitis. J Hepatobiliary Pancreat Surg 2005;12 : 135–7.
19. Mahmood NS, Suresh HB. Intrahepatic pancreatic pseudocyst complicating chronic calcific pancreatitis − a rare cause for a cystic liver lesion. The Internet Journal of Radiology 2010;11 : 2.
20. Pitchumoni CS, Agarwal N. Pancreatic pseudocysts. When and how should drainage be performed? Gastroenterol Clin North Am 1999;28 : 615−39.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2016 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Lumbálna sympatektómia − prehľad svetovej literatúry za posledných 15 rokov
- Porovnání perkutánní a otevřené radiofrekvenční ablace metastáz kolorektálního karcinomu ve FN Plzeň v letech 2001−2015
- Optimálne načasovanie laparoskopickej cholecystektómie v liečbe akútnej cholecystitídy
- Použití metody endoskopického odběru velké safény v periferní infrainguinální cévní chirurgii – zhodnocení iniciálních zkušeností
- Gigantické aneuryzma abdominální aorty a pánevních tepen
- Atypická, extrapankreatická pseudocysta pankreatu
- Sekundární angiosarkom břišní stěny po adjuvantní radioterapii pacientky s karcinomem dělohy − kazuistika
- Podmínky rozvoje chirurgie anebo pohled pravdě do očí
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Atypická, extrapankreatická pseudocysta pankreatu
- Optimálne načasovanie laparoskopickej cholecystektómie v liečbe akútnej cholecystitídy
- Lumbálna sympatektómia − prehľad svetovej literatúry za posledných 15 rokov
- Gigantické aneuryzma abdominální aorty a pánevních tepen
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



