-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Extragastrointestinální stromální tumor (EGIST)
Extragastrointestinal stromal tumor (EGIST)
Gastrointestinal stromal tumor (GIST) is the most common mesenchymal tumor of the gastrointestinal tract. Due to the presence of thyrosine kinase receptors within the tumor tissue, GIST is thought to originate from gastrointestinal pacemaker cells, the intersticial cells of Cajal. Tumors with the same morphological and imunohistochemical characteristics detected outside the gastrointestinal tract, are called extragastrointestinal stromal tumors (EGIST). Biological characteristics of these tumors is uncertain and the malignancy rates are difficult to predict. Surgical R0 resection in resecable tumors is the only option with the potential for complete cure. Nevertheless, the recurrence rates are high. Adjuvant biological treatment with imatinib, a thyrosine kinase inhibitor, reduces the risk of relapses. Imatinib administration is also the principal treatment method in metastatic GIST disorders. The article offers a short and complex overview of gastrointestinal stromal tumor (GIST) problematics and presents a case report of a patient suffering from EGIST of mesocolon transversum treated by R0 resection which was performed under multidisciplinary cooperation, with a specialist follow up.
Key words:
GIST – EGIST – KIT receptor – R0 resection – recurrence, biological treatment – multidisciplinary cooperation
Autoři: J. Kolařík; J. Drápela
Působiště autorů: Chirurgické oddělení Okresní nemocnice Havlíčkův Brod, primář: MUDr. Jiří Drápela
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 4, s. 241-245.
Kategorie: Kazuistika
Souhrn
Gastrointestinální stromální tumor (GIST) je nejčastějším mezenchymálním tumorem gastrointestinálního traktu. Vzhledem k přítomnosti tyrosinkinázových receptorů je původ GIST spojován s pacemakerovými buňkami střevní motility, intersticiálními Cajalovými buňkami. Tumor vykazující stejné morfologické a imunohistochemické znaky nalezený mimo gastrointestinální trakt se nazývá extragastrointestinální stromální tumor (EGIST). Biologická povaha těchto nádorů je nejistá a výskyt maligního chování GIST lze obtížně předpovědět. Jedinou nadějí na úplné vyléčení je u resekabilních tumorů chirurgická R0 resekce. Častý je výskyt rekurence. Adjuvantní biologická léčba imatinibem, inhibitorem tyrosinkináz, snižuje riziko relapsu. Imatinib hraje hlavní roli i v léčbě GIST ve stadiu metastáz. Sdělení uvádí stručný komplexní přehled problematiky GIST a představuje kazuistiku pacientky s EGIST mesocolon transversum řešenou multidisciplinární spoluprací R0 resekcí a následnou dispenzární péčí.
Klíčová slova:
GIST – EGIST – KIT receptor – R0 resekce – rekurence – biologická léčba – multidisciplinární spolupráceÚvod
Gastrointestinální stromální tumor (GIST) je nejčastějším mezenchymálním tumorem gastrointestinálního traktu, z celkového množství gastrointestinálních malignit však tvoří jen 2–5 %. S názvem „gastrointestinální stromální tumor“ se setkáváme až v roce 1983, kdy byl použit Mazurem a Clarkem. Do té doby byly GIST řazeny mezi leiomyosarkomy či atypické leiomyomy. Jednotná nosologická jednotka GIST je uváděna od r. 1998, kdy byl objeven tyrosinkinázový receptor [18]. Tumor vykazující stejné morfologické a imunohistochemické znaky nalezený mimo gastrointestinální trakt se nazývá extragastrointestinální stromální tumor (EGIST).
Epidemiologie
Roční incidence je odhadována přibližně na 10 až 20 případů na 1 milion obyvatel. Průměrný věk při stanovení diagnózy je 60 let. Vzácně se tyto nádory vyskytují u mladých dospělých a u dětí jsou zcela ojedinělé [1]. Prevalence GIST se odhaduje na 120–150 případů na milion osob [2]. Výskyt zachycených případů stále stoupá, pravděpodobně se zlepšováním laboratorních imunohistochemických a diagnostických metod. Nálezy EGIST tvoří méně než 5 % případů GIST, většinou jsou diagnostikovány u pacientů starších 50 let. Nemocný mladší 40 let bývá výjimkou [3].
Etiopatogeneze
Původ gastrointestinálních stromálních tumorů je odvozován od intersticiálních Cajalových buněk, které jsou považovány za pacemakery střevní motility. Imunohistochemicky můžeme na jejich povrchu prokázat tyrosinkinázový receptor (KIT receptor), který hraje roli při proliferaci a migraci buněk při embryogenezi a při vývoji fyziologické hematopoézy. Receptor KIT je prokazatelný i na povrchu buněk GIST, tím je lze odlišit od populací buněk leiomyomů či leiomyosarkomů, u kterých se tento receptor většinou nevyskytuje. KIT receptor nádorových buněk GIST bývá často mutován. Tyrosinkinázové receptory se podílejí na signalizačních procesech regulujících proliferaci, diferenciaci, přežívání či apoptózu buněk. Dalším popisovaným mechanismem vzniku GIST je mutace genu pro receptor destičkového růstového faktoru PDGFR, který se po své aktivaci podílí na buněčném růstu a brání apoptóze. Etiopatogeneze EGIST není přesně známa. Exprese KIT receptoru EGIST lze vysvětlit přítomností pacemakerových buněk mimo gastrointestinální trakt nebo schopností mesenchymálních buněk opakovat fenotyp pacemakerů [4].
V naprosté většině se setkáváme se sporadickým výskytem GIST. V literatuře však byly zaznamenány i familiární formy. Familiární GIST je extrémně vzácné, autosomálně dominantní onemocnění, do nynější doby bylo popsáno jen asi 20 postižených rodin [5]. Podezření budí zejména začátek choroby u mladších pacientů kolem 25. roku věku, mnohočetné synchronní postižení pacienta, současný nález kožní hyperpigmentace zevního genitálu či podpaží a výskyt onemocnění u několika členů rodiny. Genetickou analýzou lze zjištěnou mutaci potvrdit v každé buňce jedince, kdežto u sporadické formy jen v buňce nádorové. Velkou vzácností je GIST v dětském věku. Zde mívá mnohočetnou lokalizaci a často neexprimuje receptory KIT a PDGFR. Je tedy zpravidla rezistentní na biologickou léčbu.
Patologická anatomie
Mikroskopicky rozlišují patologové vřetenobuněčné, epiteloidní a smíšené typy. Hodnotí proliferační aktivitu uváděnou v počtu mitóz na 50 zorných polí. V diferenciální diagnostice je třeba vyloučit karcinomy a lymfomy. Histomorfologicky lze také hodnotit odpověď na terapii imatinibem, u citlivých sledovat pokles proliferační aktivity, u rezistentních setrvalý stav či posun od vřetenobuněčné k epiteloidní formě. Z makroskopického popisu patologem je důležitá zejména velikost tumoru. Imunohistochemické vyšetření umožňuje stanovení KIT (CD 117) a PDGF receptoru, molekulární analýza nabízí stanovení konkrétní mutace KIT receptoru a rozlišit mutace např. v 9. či 11. exonu, což však zatím do běžné diagnostiky v klinické praxi nepatří. Toto vyšetření by mohlo odhadnout citlivost nádoru před nasazením biologické léčby a ověřit histopatologickou diagnózu. Další stanovované receptory přesahují rozsah této publikace.
V době stanovení diagnózy lze zjistit metastatické postižení u 20–40 % pacientů s GIST. Nejčastěji dochází ke generalizaci krevní cestou. Generalizace může vzniknout i cestou portální či cestou implantačních metastáz. Postižena jsou zejména játra, omentum či peritoneum. Poskrovnu se vyskytuje pánevní či intraabdominální lymfadenopathie nebo metastázy v plicích [6]. Sporadicky jsou popisovány metastázy do skeletu [7].
Biologická povaha GIST je těžko předpověditelná, dochází často k pozdní rekurenci i po radikální resekci s několikaletou latencí. Dvěma hlavními prognostickými faktory jsou velikost nádoru a proliferační aktivita s vysokým počtem mitóz. Klasifikace TNM pro GIST dle literatury nehraje významnou roli. Velikost nádoru do 2 cm svědčí spíše pro benigní chování, 2–5 cm spíše benigní, 5–10 cm spíše maligní a >10 cm téměř vždy maligní. Podle proliferační aktivity <5/50 spíše benigní, 5–10/50 spíše maligní a >10/50 nejspíše maligní chování [8]. Kromě počtu mitóz sledují patologové také proliferační antigen Ki67. Významným rizikovým faktorem je peroperační ruptura těchto měkkých a křehkých tumorů se vznikem implantačních metastáz. Podobně symptomatické krvácení či spontánní ruptura GIST jsou popisovány jako rizikový faktor. Riziko rekurence podle primární lokalizace tumoru je v literatuře popisováno rozporuplně. V některých pramenech je popisováno větší riziko maligního chování u GIST tenkého střeva, střední riziko u lokalizace v kolon a spíše benigní chování při výskytu v žaludku. Kazuistika pacienta s krvácejícím GIST žaludku velikosti <2 cm s proliferační aktivitou <5 mitóz na 50 zorných polí a recidivou v anastomóze po 8 letech po provedené resekci žaludku je příkladem obtížné predikce chování tumorů [9].
Z hlediska lokalizace GIST nejčastěji postihuje žaludek (60–70 %), tenké střevo (20–25 %) a tlusté střevo (5 %). Lokalizace mimo trávicí trakt charakterizuje extragastrointenstinální stromální tumor (EGIST). Vyskytuje se méně než v 5 %. Častěji je uváděn EGIST omenta [10, 11, 12], mesenteria [10], méně často lokalizace v retroperitoneu, v pánvi [13, 14], vagině, gynekologických orgánech, prostatě či v močovém měchýři, skrótu, nadledvině nebo EGIST pleury. Dále EGIST jater, žlučníku a pankreatu.
V době stanovení diagnózy dosahují EGIST často větší velikosti, jejich lokalizace umožňuje delší asymptomatický růst a opoždění příznaků, které teprve vedou k jejich odhalení [4]. Celularita, mitotická aktivita a přítomnost nekróz patří mezi rizikové faktory biologického chování EGIST [15]. Miettinen et al. [10] sledoval skupinu devíti případů omentálního EGIST a sedmi případů mesenteriálního EGIST. Mesenteriální vykazovaly větší mitotickou aktivitu a častější sklon k malignímu chování.
Symptomatologie
Mnoho pacientů s GIST je asymptomatických. U většiny však lze v anamnéze vysledovat nespecifické obtíže s bolestmi břicha, nauzeou, zvracením, abdominálním dyskomfortem a váhovým úbytkem. Významným viditelným příznakem GIST je krvácení a následná anemizace. Další příznaky odpovídají lokalizaci GIST, projevují se útlakem okolních struktur či obstrukcí střevního lumen s ileózní symptomatologií. Příznaky obstrukce jsou nejčastější v duodenální lokalizaci tumoru. GIST může být i příčinou invaginace.
Diagnostika
Klíčovou roli mezi diagnostickými metodami GIST zastává endoskopie. Často se jedná o nález prominence stěny GIT kryté normální sliznicí. Asi v 10 % lze nalézt exulcerace sliznice, případně s projevem krvácení do GIT. Okraje léze bývají navalité s exulcerovanou prominující sliznicí. Nález prominence krytý normální sliznicí vede často gastroenterologa k provedení endosonografie. Detekce intramurálního solidního ložiska různé velikosti při GIST, ale i leiomyomu, někdy lymfomu či karcinoidu vede ke stanovení operační indikace, a nevynucuje tedy nezbytně odběr biopsie, který lze vnímat jako porušení integrity tumoru. Dalším důležitým vyšetřením je bezesporu UZ břicha s popisovanou vysokou citlivostí záchytu GIST velikosti > 2 cm až 100 %. Je vhodné také k vyloučení extraintestinálního postižení, zejména jater. Vzhledem k jeho dostupnosti lze využít u pacientů s nejasnými dyspepsiemi a abdominálním dyskomfortem. Pokud je provedeno opakovaně, vede k nárůstu záchytu GIST ještě v časných stadiích onemocnění. CT břicha lze využít v rámci předoperačního stagingu, sledování odpovědi na zavedení biologické léčby i na poli dispenzarizace. Pro úspěch biologické léčby svědčí zmenšení ložisek, snížení denzity Hounsfieldových jednotek /HU/ či cystická přestavba v případě nekrózy tkáně jaterních metastáz. PET a PET/CT jsou velmi citlivé na detekci extraintestinálního postižení a lze jimi sledovat i snížení metabolické aktivity tumorózních buněk při časné odpovědi po nasazení biologické léčby. Kapslová enteroskopie má v případě GIST tenkého střeva jen malý význam. Pokud není úspěšné UZ nebo CT vyšetření, pomůže zvláště u intraluminálně pendulujících lézí enteroklýza. U krvácejících lézí pak lze využít angiografii, CT angiografii, k vyloučení metastáz skeletu scintigrafické vyšetření [8]. Jehlová biopsie bývá často nevýtěžná, pokud se pro ni endoskopista rozhodne, je vhodný vícečetný odběr. Z onkologického pohledu lze biopsii přirovnat k peroperační ruptuře tumoru se všemi následnými riziky. Proto by měla být rezervována jen pro pacienty, u nichž jsou pochybnosti o indikaci k operační léčbě pro rozsah onemocnění, neresekabilní tumory, či u pacientů, pro které by operační léčba byla vzhledem k přidruženým chorobám velmi riziková. Jinou specifickou indikací jsou GIST jícnu, duodena či rekta, kde může předoperační znalost histologie hrát roli ve volbě typu chirurgického výkonu. V diagnostice EGIST je důležité potvrdit, že se jedná o primární tumor, a vyloučit, že se nejedná jen o metastázu GIST jiné lokalizace.
Léčba
Chirurgická terapie R0 resekcí tumoru s mikroskopicky intaktními resekčními okraji je pro pacienty s GIST jedinou nadějí na úplné vyléčení [8,16]. GIST patří mezi nádory značně refrakterní vůči radio i chemoterapii. Pacienti, u kterých není R0 resekce možná, jsou indikováni k biologické léčbě imatinibem, selektivním inhibitorem tyrosinkináz, čili KIT i PDGFR.
V rámci chirurgické léčby lze kritérium R0 resekce dodržet, jen pokud nedojde k peroperační ruptuře tumoru. Toho lze docílit maximální opatrností, pečlivou preparační technikou, zásadami fyziologického operování a uplatněním techniky „no touch“ s minimální manipulací s nádorem během operace. Část odstraněného tumoru je vhodné odeslat na rychlou peroperační biopsii k ověření diagnózy. Laparoskopické výkony někteří autoři u GIST nedoporučují pro vyšší riziko ruptury tumoru. V literatuře nalezneme zprávy o provedení laparoskopické klínovité resekce en blok se synchronní epiteliální neoplazií žaludku [17]. Chirurgická léčba může najít uplatnění ve všech stadiích GIST. U neresekabilních nádorů s progresí při léčbě imatinibem může chirurgická resekce ložiska oddálit na blíže nespecifikovanou dobu vznik rezistence a nutnost nasazení tyrosinkinázových inhibitorů 2. linie [18]. Nejsou jasné doporučené postupy pro dodržení bezpečnostního lemu resekce bez tumoru, některé prameny uvádějí jako dostatečnou resekci v mikroskopicky nepostižené tkáni, podle jiných je dostatečný lem 1–2 cm. Tato skutečnost nabízí u GIST, na rozdíl od klasických karcinomů, větší uplatnění méně invazivních a mikrochirurgických technik zvláště v rektu, jícnu či duodenu. Vzhledem k převážně hematogennímu šíření nebyl dosud prokázán přínos radikální lymfadenektomie. Mezi indikace paliativních resekcí patří řešení ileózních náhlých příhod při obstrukci střevního lumen R0 neresekabilním tumorem, resekce chronicky krvácejících tumorů. Primární cytoredukční výkony R0 neresekabilních tumorů nejsou doporučovány, zatěžují pacienta pooperační morbiditou a zpravidla nedosahují efektu dobré odpovědi na biologickou léčbu.
Pacienti primárně R0 neresekabilní jsou indikováni k perorální biologické léčbě imatinibem. Léčba je ukončována až při nesnášenlivosti pacientem či při progresi onemocnění i přes navýšení dávky.
Adjuvantní biologická léčba imatinibem jasně prodlužuje dobu disease free intervalu [1, 19]. Je schválena americkou Food and Drug Administration (FDA) u všech pacientů po resekci GIST, v Evropě je European Medicines Agency (EMEA) doporučuje u pacientů s vyšším a středním rizikem rekurence, nespecifikuje však přesně, kteří to jsou [8]. Ideální doba trvání adjuvantní terapie imatinibem je stále nejasná [16]. I u pacientů s původně neresekabilním GIST je při downstagingu biologickou léčbou k resekabilnímu nálezu indikována chirurgická terapie. Izolované přetrvávající resekabilní ložisko rezistentní na terapii je též indikováno k operační léčbě. Může se jednat o nádorovou duplicitu či rezistentní klon buněk tumoru.
Neoadjuvantní terapie GIST biologickou léčbou zatím nemá jasně vymezené místo. Vliv částečné regrese tumoru by mohl vést ke zpevnění pouzdra tumoru, které je v době progrese velmi křehké, a snížit tak riziko peroperační ruptury. U hraničně resekabilních tumorů v lokalizaci, kde jejich zmenšení může mít vliv na nutný rozsah operačního výkonu či jeho riziko, jícen, duodenum, rektum, můžeme uvažovat o neoadjuvantní terapii. V těchto případech je s výhodou predikovat citlivost k biologické léčbě stanovením konkrétních mutací KIT či PDGFR.
Nadějí pro pacienty rezistentní na léčbu imatinibem i při navýšení dávky je biologická léčba 2. linie sunitinibem. Citlivou odpověď vykazují zejména formy bez mutací KIT či s mutací v exonu 9 [20].
Dispenzarizace
Ideální dispenzarizační schéma není dostupné, vzhledem k obtížné predikci chování jednotlivých GIST je složité je stanovit. Pro GIST s vysokým maligním potenciálem se doporučuje CT vyšetření každé 3–4 měsíce první 3 roky, každých 6 měsíců dalších 5 let a dále jednou ročně [8]. Dle National Comprehensive Cancer Network (NCCN) je vhodné sledování UZ, CT, PET/CT, MR každých 3–6 měsíců po dobu 5 let, dále jednou za rok [1].
Kazuistika
76letá žena s nespecifickými dyspeptickými obtížemi odeslána praktickým lékařem k ultrazvukovému vyšetření břicha v lednu 2011, kde nález dobře ohraničené hypoechogenní formace nejspíše související se žaludkem, velikosti 38 x 57 x 36 mm, klidná cholecystolithiáza a steatóza jaterní. V závěru diferenciálně diagnosticky tumor žaludku či colon transversum. Pacientka přijata k dovyšetření na naše interní oddělení. V rodinné anamnéze onemocnění otce kolorektálním karcinomem, v předchorobí pacientky operace příštítných tělísek 2002, diabetes na dietě a léčená hypertenze. V trvalé medikaci Inhibace, Isoptin, Caltrate. Při přijetí klinické i laboratorní vyšetření bez pozoruhodností. Zadopření rtg hrudníku, gastroskopie s normálním nálezem, koloskopicky jen polypektomie benigních polypů levostranného tračníku. CT břicha popisuje exofyticky rostoucí tumor těla žaludku, možný leiomyom a jednu hraniční uzlinu v retroperitoneu. Vedlejším nálezem cholecystolithiáza v klidném žlučníku, konkrement středního kalichu pravé ledviny. Po překladu na chirurgické oddělení operační revize s R0 resekcí dobře ohraničeného tumoru mesocolon transversum velikosti 50 mm. Část vyjmutého preparátu odeslaná jako peroperační biopsie vyhodnocena patologem jako mezenchymální tumor, suspektní GIST, biologické chování nelze zcela určit. V definitivních vzorcích extragastrointestinální stromální tumor, potvrzeno II. čtením v Hradci Králové. Zachycena 1 mitóza na 50 zorných polí, exprimuje CD117. S100 protein negativní, tedy nejspíše nízké riziko maligního chování. Pooperační průběh bez komplikací, 1. pooperační den překlad na standardní oddělení a 9. pooperační den propouštíme pacientku domů. Případ předveden na onkochirurgickém semináři včetně konzultace centra ve FN Motol. Tento případ spadá do nízkého rizika, doporučena dispenzarizace: jednou za rok endosonografie žaludku, CT břicha, zadopřední rtg hrudníku, v prvním roce CT břicha a rtg hrudníku jednou za 6 měsíců. Pacientka nyní nadále dispenzarizovaná, klinicky zcela bez obtíží, dle CT bez známek recidivy tumoru.
Obr. 1. CT obraz, dle popisu exofyticky rostoucí tumor žaludku Fig. 1: Abdominal CT, the findings described as a gastric tumor with exophytic proliferation 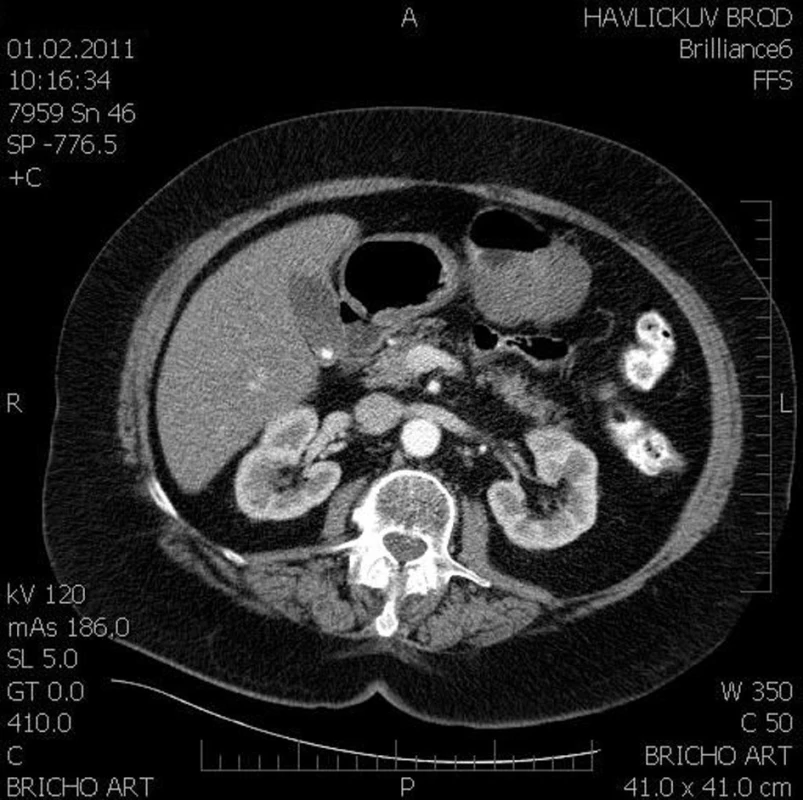
Obr. 2. Makroskopický obraz resekátu prokrájený patologem Fig. 2: Macroscopic image of EGIST resecate 
Obr. 3. Histologický obraz resekátu Fig. 3: Histological image of EGIST resecate 
Diskuze
Kazuistika této pacientky potvrzuje oprávněnost indikace elektivního ultrazvukového vyšetření u pacientů s nespecifickými obtížemi. V tomto případě umožnilo toto vyšetření včasnou diagnózu a adekvátní léčbu. CT nález exofyticky rostoucího tumoru žaludku při negativní gastroskopii nás přivádí k podezření na GIST. Pečlivá chirurgická technika bez porušení integrity tumoru a R0 resekci zlepšuje pacientovu prognózu. Konzultace pacienta v rámci multioborové spolupráce s konzultací a sdílením dat se specializovaným centrem je přínosem.
Závěr
Případ EGIST je poměrně vzácný. Problematika GIST je příkladem moderní léčby s nezbytností multioborové spolupráce. GIST patří mezi nádory nejisté povahy s těžko odhadnutelným průběhem, častou dlouhou latencí progrese onemocnění, a proto i nadále bude snaha odhalit nové markery či faktory, podle kterých by bylo možné chování těchto tumorů predikovat, stanovit citlivost na biologickou léčbu či vytipovat konkrétní vhodný cíl pro genovou terapii. Chirurgická léčba pacientů s GIST klade vysoké nároky na pečlivou preparaci a techniku fyziologického operování. Problematiku GIST budeme v rámci multioborové spolupráce nadále sledovat, rozvíjet spolupráci s programem reGISTer a ostatními pracovišti.
MUDr. Jan Kolařík
V Bytovkách 42,
140 00 Praha 10,
e-mail:czoll@seznam.cz
Zdroje
1. Zezulová M, Melichar B. Adjuvantní terapie imatinibem u gastrointestinálních stromálních tumorů. Farmakoterapie 2010;10 : 23–25, speciální příloha.
2. Nilson B, Bumming P, Meis-Kindblom JM, et al. Gastrointestinal stromal tumours: The incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era. Cancer 2005;103 : 821–9.
3. Castillo-Sang M, Mancho S. A malignant omental extra-gastrointestinal stromal tumor on a young man: a case report and overwiew of the literature, World Journal of Surgical Oncology 2008;6 : 50.
4. Jong-Han K, Yoon-Jung B. Multiple malignant extragastrointestinal stromal tumors of greater omentum and results of immunohistochemistry and mutation analysis: A case report. World J Gastroenterol 2007;6,28;13(24):3392–3395.
5. Kuroda N, Tanida N, Hirota S, Daum O, Hes O, Michal M, Lee GH. Familial gastrointestinal stromal tumor with ge rm line mutation of the juxtamembrane domain of the KIT gene observed in relatively young women, Ann Diagn Pathol 2010;6 : 19.
6. Kocáková I. Významná účinnost imatinib mesylátu u gastrointestinálního stromálního tumoru s multiorgánovým metastatickým postižením, Farmakoterapie 2010;10 : 33–35, speciální příloha.
7. Tezcan Y, Koć M. Gastrointestinal stromal tumor of the rectum with bone and liver metastasis: a case study, Med Oncol 2010; 10 : 17.
8. Kysela P, Kala Z, Novotný I. Chirurgická léčba pacientů s gastrointestinálním stromálním tumorem Farmakoterapie 2010;10 : 14–18, speciální příloha.
9. Papalambros A, Petrou A, Brennan N, Bramis K, Felekouras E, Papalambros E. GIST suture-line recurrence at a gastrojejunal anastomosis 8 years after gastrectomy: can GIST ever be described as truly benign? A case report., World J Surg Oncol 2010;14;8(1):90.
10. Miettinen M, Monihan JM. Gatrointestinal stromal tumors primary in omentum and mesentery: clinicopathologic and immunohistochemical study of 26 cases. Am J Surg Pathol 1999;23 : 1109–1118.
11. Dedemadi G, Georgoulis G. Extragastrointestinal stromal tumors of the omentum: review apropos of a case with a novel gain-of-function KIT mutation. J Gastrointest Cancer 2009;40 : 3–4.
12. Franzini C, Alessandri L. Extra-gastrointestinal stromal tumor of the greater omentum: report of a case and review of the literature. World J Surg Oncol 2008;6 : 25.
13. Zhang W, Peng Z. Extragastrointestinal stromal tumor arising in the rectovaginal septum: report of an unusual case with literature review, Gynecol Oncol 2009;11(33):399–401.
14. Pasku D, Karantanas A. Bilateral gluteal metastases from a misdiagnosed intrapelvic gastrointestinal stromal tumor. World J Surg Oncol 2008 Dec 30;6 : 139.
15. Reith JD, Goldblum JR. Extragastrointestinal stromal tumors: an analysis of 48 cases with emphasis on histologic predictors of outcome. Mod Pathol 2000;13 : 577–85.
16. Deshaies I, Cherenfant J, Gusani NJ, Jiang Y, Harvey HA, Kimchi ET, Kaifi JT, Staveley-O’Carroll KF. Gastrointestinal stromal tumor (GIST) recurrence following Ther. Clin. surgery: review of the clinical utility of imatinib treatment. Ther Clin Risk Manag 2010;10 : 5;6 : 453–8.
17. Mou YP, Xu XW, Xie K, Zhou W, Zhou YC, Chen K. Laparoscopic wedge resection of synchronous gastric intraepithelial neoplasia and stromal tumor: A case report., World J Gastroenterol 2010; 21;16(39):5005–8.
18. Hasegawa J, Kanda T, Hirota S, et al. Surgical interventions for focal progression of advanced gastrointestinal stromal tumors during imatinib therapy. Int J Clin Oncol 2007;12 : 212–7.
19. Duffaud F, Salas S, Huynh T. Recent advances in the management of gastrointestinal stromal tumors, F1000 Med Rep 2010;5 : 11.
20. Linke Z, Prausová J. Léčba pokročilého gastrointestinálního stromálního tumoru, Farmakoterapie 2010;10 : 19–22, speciální příloha.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2012 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Budoucnost úrazové chirurgie u nás
- GIST: Novodobé poznatky a léčebné modality
- Kvalita života je důležitým faktorem indikační rozvahy u nemocných s pokročilým karcinomem pankreatu – multicentrická prospektivní studie
- Biomarkery detekce minimální systémové diseminace u nemocných s karcinomem plic
- Prevence parastomální hernie primoimplantací síťky laparoskopicky – první zkušenosti
- Klinické prognostické faktory kolorektálního karcinomu po jeho radikální léčbě
- Laparoskopická adrenalektomie – indikace a selekční kritéria
- Retroperitoneoskopická adrenalektomie dorzálním přístupem
- Překlad knihy Schein´s Common Sense Emergency Abdominal Surgery – Urgentní břišní chirurgie
- Extragastrointestinální stromální tumor (EGIST)
- McKittrick-Wheelockov syndróm: Komplikácia mucinózneho adenómu rekta
- Gastrointestinal Cancers Symposium
- XXI. Jarní setkání Loket – pokroky v léčbě nemocných s karcinomem pankreatu
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- GIST: Novodobé poznatky a léčebné modality
- Laparoskopická adrenalektomie – indikace a selekční kritéria
- Prevence parastomální hernie primoimplantací síťky laparoskopicky – první zkušenosti
- Extragastrointestinální stromální tumor (EGIST)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



