-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
VYUŽITIE MULTIPLEXNEJ RT PCR V DIAGNOSTIKE MIKROBIONÁLNYCH PATOGÉNOV
VYUŽITIE MULTIPLEXNEJ RT PCR V DIAGNOSTIKE MIKROBIONÁLNYCH PATOGÉNOV
The aim of this paper is to show the potential of using a diagnostic kit AnyplexTM STI-7 (Seegene, South Korea), which uses technology to multiplex real time PCR. We can detect the seven of the most common sexually transmitted pathogens simultaneously in one PCR reaction with use AnyplexTM STI-7. These are the six microbial pathogens (Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum and Ureaplasma parvum) and the protozoan (Trichomonas vaginalis). According to the European Guidelines for management of non-gonococcal urethritis of 2016 are infections caused by Chlamydia trachomatis and Mycoplasma genitalium most frequently reported sexually transmitted diseases. Chlamydia trachomatis and Mycoplasma genitalium are the most commonly reported sexually transmitted diseases. Using the multiplex real time PCR AnyplexTM STI-7, we found out that in our group of infertile men was Ureaplasma parvum most frequently detected pathogen.
Keywords:
Multiplex real time PCR, AnyplexTM STI-7, Chlamydia, Mycoplasma
Autoři: Marianna Trebuňová 1,2; Ivan Vanát 1; Zuzana Vaczy 1; Ján Rosocha 1; Ladislav Bobák 1; Jozef Živčák 2
Působiště autorů: Združená tkanivová banka UNLP Košice, Košice, Slovensko 1; Katedra biomedicínskeho inžinierstva a merania SjF TU, Košice, Slovensko 2
Vyšlo v časopise: Lékař a technika - Clinician and Technology No. 3, 2016, 46, 74-77
Kategorie: Původní práce
Souhrn
Cieľom príspevku je poukázať na potenciál využitia diagnostickej súpravy AnyplexTM STI-7 (Seegene, Južná Kórea), ktorá využíva technológiu multiplexnej real time PCR. AnyplexTM STI-7 umožňuje detegovať sedem najčastejších sexuálne prenosných patogénov naraz v jednej PCR reakcii. Jedná sa o šesť mikrobiálnych patogénov (Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum a Ureaplasma parvum) a jeden protozoálny (Trichomonas vaginalis). Podľa údajov Európskych odporúčaní pre menežment negonokokových uretritíd z roku 2016 sú infekcie spôsobené Chlamydia trachomatis a Mycoplasma genitalium najčastejšie hlásenými sexuálne prenosnými ochoreniami. S použitím multiplexnej real time PCR AnyplexTM STI-7 sme zistili, že v našej skupine infertilných mužov bola Ureaplasma parvum najčastejšie detegovaným patogénom.
Kľúčové slová:
multiplexná real time PCR, AnyplexTM STI-7, chlamýdie, mykoplazmyÚvod
Sexuálne prenosné infekcie sú príčinou neplodnosti v 35 % prípadov. Ich príčinou je široké spektrum vírusových, bakteriálnych a protozoálnych patogénov.
Podľa údajov Svetovej zdravotníckej organizácie z roku 2012 pribudne denne vo vekovej skupine od 15 do 49 rokov 131 miliónov sexuálne prenosných ochorení zapríčinených Chlamydia trachomatis, 78 miliónov Neisseria gonorrhoeae a 142 miliónov Trichomonas vaginalis [1–4]. V Európe sú najčastejšie hlásenými sexuálne prenosnými ochoreniami infekcie spôsobené Chlamydia trachomatis a Mycoplasma genitalium („Európske odporúčania pre menežment negonokokových uretritíd“, 2016) [4–10].
Pre efektívne riešenie neplodnosti je preto potrebné zaviesť komplexné vyšetrenie pacienta na najčastejšie sexuálne prenosné ochorenia. Z hľadiska laboratórnej diagnostiky sa javí ako najefektívnejší komplexný skríning pôvodcov sexuálne prenosných ochorení. Takúto možnosť ponúka súprava AnyplexTM STI-7 (Seegene, Južná Kórea), ktorá využíva technológiu multiplexnej real time PCR. AnyplexTM STI-7 umožňuje detegovať sedem najčastejších sexuálne prenosných patogénov naraz v jednej PCR reakcii. Jedná sa o šesť mikrobiálnych patogénov (Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma hominis, Mycoplasma genitalium, Ureaplasma urealyticum a Ureaplasma parvum) a jeden protozoálny (Trichomonas vaginalis).
AnyplexTM STI-7 a multiplexná real time PCR
Multiplexná real time PCR je vysoko citlivá metóda, ktorá využíva technológiu multiplikácie viacerých cieľových sekvencií genetického materiálu v jednej reakčnej skúmavke. V tomto procese sa využívajú viaceré páry primerov a optimalizované reakčné podmienky. Za posledné roky zaznamenala technológia výrazný rozvoj, ktorý umožnil jej použitie aj v oblastiach, ktoré vyžadujú vysokú presnosť, spoľahlivosť a reprodukovateľnosť. Jednou z nich je aj laboratórna diagnostika infekčných ochorení. Práve v tejto oblasti si metóda multiplexnej real time PCR nachádza široké uplatnenie. Umožňuje rýchlo a spoľahlivo vyšetrovať rôzne typy biologických vzoriek a detegovať v nich mikrobiálne, vírusové a protozoálne patogény. Rýchlosť a spoľahlivosť získanej informácie je hlavným benefitom tejto metódy. Okrem kvalitatívneho hodnotenia, mnohé multiplexné testy umožňujú aj semikvantitatívne hodnotenie a následne zahájiť cielenú terapiu, sledovať priebeh a efektivitu liečby. V našom laboratóriu sme testovali možnosti využitia diagnostickej súpravy AnyplexTM STI-7(Seegene, Južná Kórea), ktorá slúži na diagnostiku hlavných patogénov sexuálne prenosných ochorení. Súprava má CE -IVD certifikát a preto je vhodná pre použitie v klinickej diagnostike. Juhokórejská firma Seegene je inovátorom v oblasti technológie multiplexnej real time PCR.
Technológia systému
Diagnostiké sety AnyplexTM sú založené na dvoch nových inovatívnych technológiách: technológii DPOTM a TOCETM [11,12].
DPOTM technológia
Technológia využíva systém DPO primerov (Dual Priming Oligonukleotide), ktoré sú štrukturálne a funkčne odlišné od bežných primerov, pričom je blokovaná tvorba nešpecifických templátov, a tým sa dosahuje trvalo vysoká špecifickosť aj za menej optimálnych reakčných podmienok.
DPO™ sa skladá z dvoch samostatných základných priming častí (5'-koniec stabilizátor a 3'-koniec určovateľ), spojených pomocou polydeoxyinozínového linkera - spojovacieho mostíka. Linker má tvar bubliny, sám o sebe nie je zapojený do primingu, ale skôr vymedzuje hranice medzi 5'-koncom a 3'-koncom.
Princíp technológie
DPO™ má dva funkčné väzobné regióny, pričom jeden je dlhší ako druhý a sú oddelené poly (I) linkerom. Tieto dva nerovnako dlhé väzobné regióny vytvárajú dvojaké väzobné reakcie, v dôsledku čoho sa tvorí cieľovo špecifický produkt.
V prvom kroku nastáva aktivácia Poly (I) linkera deoxyinozínu, ktorý má v dôsledku slabších vodíkových väzieb pomerne nízku hodnotu teploty topenia (Tm). Poly (I) linker tvorí štruktúru bubliny pri určitej teplote topenia a oddelí 5'-koniec stabilizátora od 3'-konca určovateľa na samostatný stabilizátor a určovateľ.
V druhom kroku prebehne prvá väzobná reakcia. Dlhší 5'-koniec sa prednostne viaže na templátovú DNA a iniciuje stabilné naviazanie. Pôsobí ako stabilizátor.
V treťom kroku prebehne druhá väzobná reakcia: Krátky 3'-koniec sa selektívne viaže na cieľové miesto a je základom pre cieľovo špecifické predĺženie. Pôsobí ako určovateľ.
Obr. 1. Princíp DPO<sup>TM</sup> technológie [13]. ![Princíp DPO<sup>TM</sup> technológie [13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b9622ae83254a9b1983e69f8779e51be.jpg)
TOCETM technológia
Technológia TOCE™ umožňuje multiplexnú detekciu hľadaných cieľových sekvencií DNA v jednej reakčnej skúmavke. Technológiou TOCE™ je možné realizovať kvalitatívny a zároveň aj semikvantívny test. Je to umožnené vďaka dvom použitým analýzam: Cyclic Catcher Melting Temperature Analysis a High Resolution Melting analysis. Použitie technológií DPOTM a TOCE™ v diagnostických súpravách posúva molekulárnu diagnostiku na novú, vyššiu úroveň.
Princíp technológie
Kľúčovými komponentmi TOCE™ technológie sú páry DPO™ primerov, pitchers a catchers. Pitcher je značkovací oligonukleotid, ktorý špecificky hybridizuje v cieľovej oblasti. Catcher je fluorescenčne značený templát.
Obr. 2. Princíp TOCE<sup>TM</sup> technológie. A: Primer a pitcher sa naviažu na cieľovú sekvenciu. B: Počas predĺženia je pitcher odstrihnutý DNA-polymerázou a označená oblasť je uvoľnená. C: Uvoľnená označená oblasť sa naviaže na catcher, ktorý má komplementárnu sekvenciu k uvoľnenej časti. D: Predĺženie označenej časti oddelí fluorescenčne značenú molekulu R od tzv. zhášacej molekuly Q, čo sa prejaví vznikom signálu [14]. ![Princíp TOCE<sup>TM</sup> technológie. A: Primer a pitcher sa naviažu na cieľovú sekvenciu. B: Počas predĺženia je pitcher odstrihnutý DNA-polymerázou a označená oblasť je uvoľnená. C: Uvoľnená označená oblasť sa naviaže na catcher, ktorý má komplementárnu sekvenciu k uvoľnenej časti. D: Predĺženie označenej časti oddelí fluorescenčne značenú molekulu R od tzv. zhášacej molekuly Q, čo sa prejaví vznikom signálu [14].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/744355a24722ebc7de00afcde686c834.jpg)
Hodnota teploty topenia catcher-a je závislá od dĺžky sekvencie. Táto vlastnosť slúži na vytváranie dostatočne odlíšiteľných templátov. Pre optimalizáciu TOCE™ môžeme hodnotu teploty topenia catcher-a ľahko upraviť, nie je obmedzená na cieľové sekvencie. Detekčné limity diagnostickej súpravy AnyplexTM STI-7 za použitia technológie TOCE™ sú porovnateľné s výsledkami testov na báze single plex real time PCR.
Technológia TOCE™ umožňuje identifikovať viac cieľových analytov súčasne v jednom kanáli. Signál je meraný v reálnom čase a analyzovaný na základe teploty topenia (Tm) catcher-a, ktorá slúži na detekciu prítomnosti cieľového analytu.
Parametrizácia a vyhodnotenie
V Laboratóriu pre diagnostiku infertility a banke spermií Združenej tkanivovej banky Univerzitnej nemocnice L. Pasteura v Košiciach sme vyšetrili v priebehu dvoch mesiacov 53 mužov (priemerný vek 31 rokov). Na izoláciu DNA boli použité dva typy vzoriek: ejakulát a moč. Odber biologického materiálu prebiehal v odberovej miestnosti za štandardných podmienok. Moč bol odoberaný v objeme 10-40 ml, vždy prvý prúd ranného moču. Skladovaný bol maximálne po dobu dvoch hodín, pri laboratórnej teplote a následne bol použitý na izoláciu DNA. Ejakulát bol odoberaný od pacientov po minimálne trojdňovej a maximálne sedemdňovej sexuálnej abstinencii do sterilnej nádoby. Následne prebiehalo jeho skvapalnenie v termostate po dobu 30 minút pri teplote 37°C. Vzorky ejakulátu boli použité na izoláciu DNA v časovom limite do 2 hodín od odberu. DNA bola izolovaná komerčnou súpravou od firmy QIAGEN: QIAamp DNA Mini kit. Izoláciu sme urobili podľa inštrukcií výrobcu s jedinou modifikáciou, keď sme predĺžili čas lýzy na 60 min [15]. Kvalita a koncentrácia izolovanej DNA bola stanovená spektrofotmetricky systémom NanoDrop. Na multiplexnú real time PCR sme použili prístroj od firmy BIO-RAD CFX 96 Real Time PCR System, verzia softwaru 2.0.5 a súpravu AnyplexTM STI-7 (Seegene, Južná Kórea). Súprava AnyplexTM STI-7 umožňuje detegovať sedem hlavných patogénov sexuálne prenosných infekcií v jednej PCR reakcii. Na obsluhu prístroja a definovanie reačných podmienok sme použili program Bio-Rad CFX Manager IVD Editor 1.6 a na kvalitatívne a semikvantitatívne vyhodnotenie výsledkov sme použili program Seegene Viewer (Obr. 3).
Obr. 3. Kvalitatívne a semikvantitatívne vyhodnotenie programom Seegene Viewer. UU - Ureaplasma urealyticum, UP - Ureaplasma parvum, MG - Mycoplasma genitalium, MH - Mycoplasma hominis, NG - Neisseria gonorrhoeae, CT - Chlamydia trachomatis, TV - Trichomonas vaginali, IC – interná kontrola. 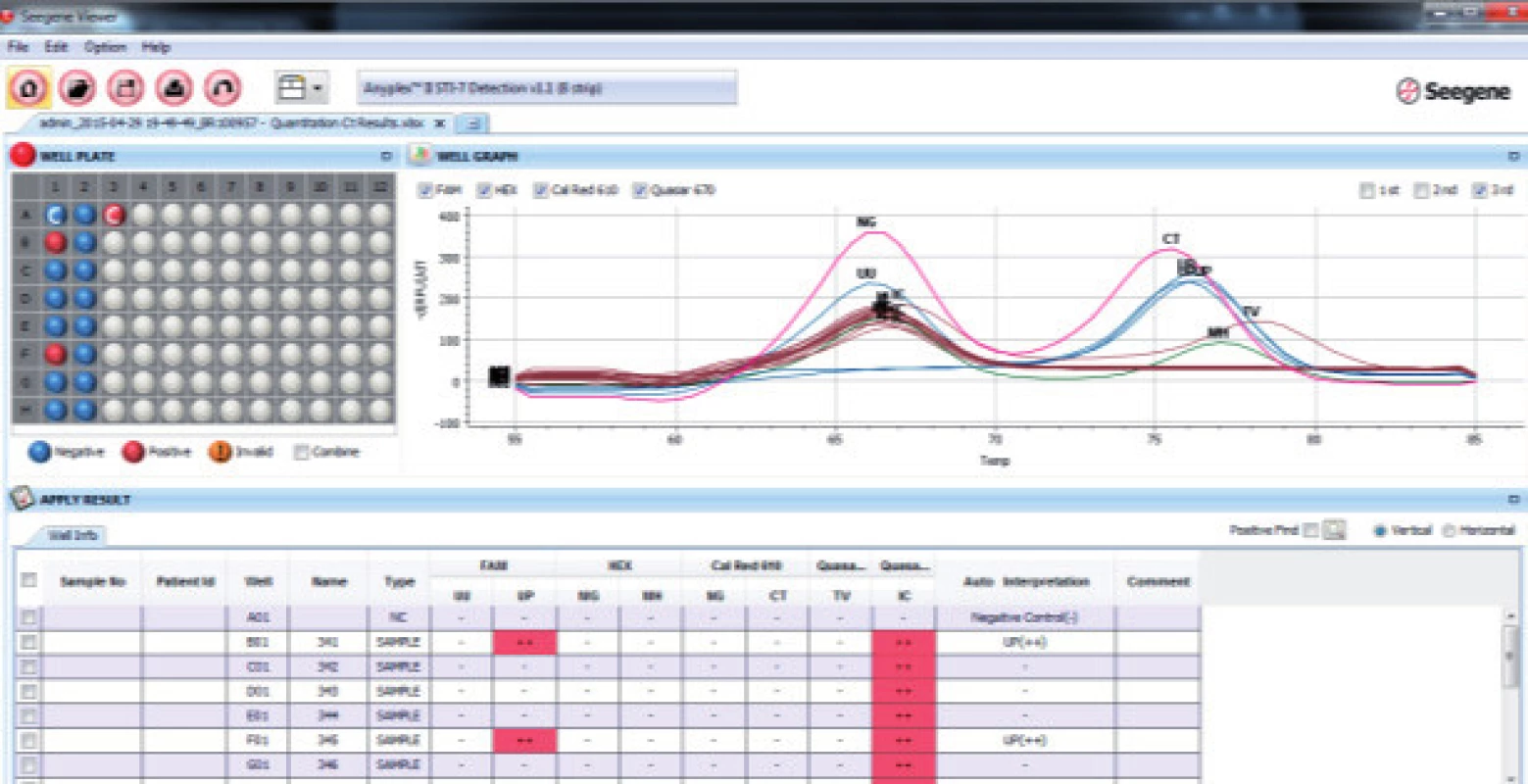
U 6-tich mužov sme vzorku DNA získali súbežne z ejakulátu a moču (100% zhoda výsledkov). U 5-tich mužov z tejto prvej vyšetrenej skupiny neboli potvrdené patogény. U jedného muža bola potvrdená kombinovaná infekcia Ureaplasma parvum (+) a Mycoplasma hominis (+). Zvyšnú skupinu tvorilo 47 mužov, kde sme vzorku DNA získali len z ejakulátu. U siedmich mužov v ejakuláte sme identifikovali Ureaplasmu parvum (++) a u jedného Ureaplasmu urealyticum (+). Vzorky ejakulátu 39 mužov z druhej vyšetrenej skupiny boli negatívne.
Diskusia a záver
Uvedenou metódou sme otestovali 53 vzoriek DNA izolovanej z moču a ejakulátu. Jedným zo zámerov testovania bolo zistiť využiteľnosť súpravy AnyplexTM STI-7 pre diagnostiku sexuálne prenosných ochorení z ejakulátu. Uvedený typ vzoriek sme testovali pre jednoduchosť prístupu k vzorkám, v Laboratóriu pre diagnostiku infertility sú vyšetrované spermiogramy infertilných mužov. Vzhľadom na odporúčania autorít vyšetrovať prvý prúd moču a/alebo výter z uretry metódami amplifikácie nukleových kyselín sme u niekoľkých pacientov porovnali výsledky vyšetrení vzoriek ejakulátu a moču.
Optimalizáciou podmienok izolácie DNA z ejakulátu sme docielili využiteľnosť súpravy AnyplexTM STI-7 aj pre dôkaz vybraných sexuálne prenosných patogénov v ejakuláte. Úspešnosť optimalizácie bola potvrdená spektrofotometrickým sledovaním výťažnosti a kvality DNA. Benefitom súpravy AnyplexTM STI-7 je interná kontrola kvality, ktorá slúži na kontrolu kvality izolácie DNA a možnosť vplyvu inhibičných látok na amplifikáciu DNA. Tým sa zároveň vylúčia falošne negatívne výsledky vyšetrenia.
Test je vhodný pre rýchlu laboratórnu diagnostiku sexuálne prenosných ochorení, umožňuje získať výsledok v deň odberu vzorky.
Môžeme konštatovať, že multiplexná real time PCR je vysoko citlivá metóda vhodná na skríning a diagnostiku sexuálne prenosných infekcií. Použitie in vitro diagnostických súprav AnyplexTM STI-7 umožňuje súčasnú detekciu siedmich patogénov sexuálne prenosných ochorení v jednej PCR reakcii, čím sa stáva diagnostika jednoduchšou a finančne efektívnejšou. V prípade potreby je možné získať finálne výsledky do siedmich hodín. Diagnostická súprava AnyplexTM STI-7 a použitý real time PCR systém CFX 96 spĺňa kritéria CE-IVD.
Poďakovanie
Práca bola podporená výzkumným grantom Vega č. 1/0515/13.
Dr.h.c. prof. Ing. Jozef Živčák, Ph.D.
Katedra biomedicínskeho inžinierstva a merania
Strojnícka fakulta
Technická univerzita v Košicach
Letná 9, SK-042 00 Košice
E-mail: jozef.zivcak@tuke.sk
Phone: +421 556 022 381
Zdroje
[1] Maruška, M.; Darja, K.; Jovan, M.; Mojca, M.: Clinical role of Ureaplasma parvum and Ureaplasma urealyticum presence in female lower urogenital tract: is there a place for routine screening and treatment?. Zdrav. Vestn. 2014, 83 : 629–637.
[2] WHO Sexually transmitted infections. World Health Organization 2013; Available November 15, 2013 from: http://www.who.int/mediacentre/factsheets/fs110/en/.
[3] World Health Organisation. Sixty-ninth World Health Assembly, document WHA69/2016/REC/1, GLOBAL HEALTH SECTOR STRATEGY ON SEXUALLY TRANSMITTED INFECTIONS 2016–2021, TOWARDS ENDING STIs, June 2016, 64 pp.
[4] Horner, P.J.; Blee, K.; Falk, L.; van der Meijden, W.; Moi, H.: European Guideline on the management of non-gonococcal urethritis. 2016, 26 pp.
[5] Holmes, K.K.; Stamm, W.E.; Sobel, J.D.: Lower genital tract infection syndromes in women. In: Holmes KK, Sparling PF, Stamm WE, Piot P, Wasserheit JN, Corey L, et al, eds. Sexually transmitted diseases. 4th ed. New York: McGraw-Hill; 2008. p. 987–1016.
[6] Povlsen, K.; Bjornelius, E.; Lidbrink, P.; Lind, I.: Relationship of Ureaplasma urealyticum biovar 2 to nongonococcal urethritis. Eur J Clin Microbiol Infect Dis 2002; 21 : 97–101.
[7] Deguchi, T.; Yoshida, T.; Miyazawa, T.; Yasuda, M.; Tamaki, M.; Ishiko, H., et al.: Association of Ureaplasma urealyticum (biovar 2) with nongonococcal urethritis. Sex Transm Dis 2004; 31 : 192–5.
[8] Couldwell, D.L.; Gidding, H.F.; Freedman, E.V.; McKechnie, M.L.; Biggs, K.; Sintchenko, V., et al.: Ureaplasma urealyticum is significantly associated with non-gonococcal urethritis in heterosexual Sydney men. Int J STD AIDS 2010; 21 : 337–41.
[9] Ondondo, R.O.; Whittington, W.L.; Astete, S.G.; Totten, P.A.: Differential association of ureaplasma species with non-gonococcal urethritis in heterosexual men. Sex Transm Infect 2010; 86 : 271–5.
[10] Maeda, S.; Deguchi, T.; Ishiko, H.; Matsumoto, T.; Naito, S.; Kumon, H., et al.: Detection of Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma parvum (biovar 1) and Ureaplasma urealyticum (biovar 2) in patients with non-gonococcal urethritis using polymerase chain reaction-microtiter plate hybridization. Int J Urol 2004; 11 : 750–4.
[11] Chun, J. Y.: Multiplex molecular diagnostics: shifting the paradigm. In: Medical laboratory observed. 2012; Seegene bulletin, Vol.1.
[12] Choe, H. S.; Lee, D. S. et al.: Performance of AnyplexTM II multiplex RT PCR for the diagnosis of seven sexually transmitted infections: comparison with currently available methods. IJID. 17(12): 1134-1140. 2013. ISSN 1201-9712.
[13] DPO TM Technology. Novel Oligo platformo f super multiplex PCR. URL: http://seegene.com/neo/en/introduction/core_dpo.php
[14] TOCE TM Technology. The New Paradigm for High multiplex Real/time PCR. URL: http://seegene.com/neo/en/introduction/core_toce.php
[15] Kweon, O.J.; Lim, Y.K.; Oh, S.M.; Kim, T.H.; Choe, H.S.; Lee, S.J.; Cho, Y.H.; Lee, M.K.: Prevalence and Antimicrobial Susceptibility of Mycoplasma hominis, Ureaplasma urealyticum and Ureaplasma parvum in Individuals With or Without Symptoms of Genitourinary Infections. Lab Med Online. 2016 Apr;6(2):79-87. URL: https://doi.org/10.3343/lmo.2016.6.2.79.
Štítky
Biomedicína
Článek vyšel v časopiseLékař a technika

2016 Číslo 3
Nejčtenější v tomto čísle- VYUŽITIE MULTIPLEXNEJ RT PCR V DIAGNOSTIKE MIKROBIONÁLNYCH PATOGÉNOV
- ANTIBACTERIAL ACTIVITY OF TITANIUM DIOXIDE AND AG-INCORPORATED DLC THIN FILMS
- RESPIRATORY ARRHYTHMIA AS AN ENCOURAGEMENT OF INAPPROPRIATE ICD THERAPY
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



