-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Klinická rezistence lidského cytomegaloviru při léčbě gancyklovirem u pacientů po alogenní transplantaci hematopoetických buněk – zkušenosti jednoho centra
Ganciclovir treatment failure in adult allogeneic hematopoietic stem cell transplant recipients with cytomegalovirus infection – a single centre experience
Objective:
To determine the incidence of infection with ganciclovir-resistant cytomegalovirus (CMV) in adult allogeneic hematopoietic stem cell transplant (HSCT) recipients. Clinical resistance or treatment failure was defined as persistent DNAemia or increasing viral load in peripheral blood after 2 weeks of virostatic treatment. The association between the treatment failure and viral resistance was analysed. The presence of ganciclovir – resistant CMV strains was confirmed by genotypic testing able to detect mutations conferring resistance.Methods:
In 2012 and 2014, 40 patients who underwent allogeneic HSCT for hematologic malignancies and were treated for human CMV reactivation/disease were followed up prospectively. In patients with treatment failure, CMV DNA was isolated and analysed by nucleotide sequence analysis of the UL 97 and UL 54 genes conferring resistance to the virostatic agent.Results:
The treatment failure occurred in seven patients, but ganciclovir resistance conferring mutations were only detected in two of them (mutations L595F and M460I in the UL 97 gene). Another mutation in the UL 97 gene (N510S) was found in a patient with recurrent CMV replication who needed to be retreated but did not meet the criteria for treatment failure.Conclusion:
The low incidence of genetically confirmed ganciclovir-resistant CMV isolates in HSCT recipients with relatively common clinical treatment failure suggests that the mechanism underlying slower viral clearance is often other than mutations conferring ganciclovir resistance to the virus.Key words:
human cytomegalovirus – ganciclovir – valganciclovir – viral resistance – hematopoietic stem cell transplantation
Autoři: E. Vejražková 1; P. Hubáček 2
; R. Kutová 3; L. Plíšková 3; M. Košťál 1; V. Štěpánová 4; A. Zavřelová 1; J. Radocha 1; E. Malá 5; P. Žák 1
Působiště autorů: IV. interní hematologická klinika, Fakultní nemocnice v Hradci Králové a Lékařská fakulta v Hradci Králové Univerzity Karlovy v Praze 1; Klinika dětské hematologie a onkologie a Ústav lékařské mikrobiologie, Fakultní nemocnice v Motole a 2. lékařská fakulta Univerzity Karlovy v Praze 2; Ústav klinické biochemie a diagnostiky, Fakultní nemocnice v Hradci Králové a Lékařská fakulta v Hradci Králové Univerzity Karlovy v Praze 3; Ústav klinické mikrobiologie, Fakultní nemocnice v Hradci Králové a Lékařská fakulta v Hradci Králové Univerzity Karlovy v Praze 4; Ústav klinické imunologie a alergologie, Fakultní nemocnice v Hradci Králové a Lékařská fakulta v Hradci Králové Univerzity Karlovy v Praze 5
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 64, 2015, č. 3, s. 160-168
Kategorie: Původní práce
Souhrn
Cíl práce:
Zjištění incidence rezistence lidského cytomegaloviru (CMV) na virostatickou léčbu gancyklovirem u pacientů po alogenní transplantaci hematopoetických kmenových buněk. Jako klinická rezistence (selhání léčby) byl označen stav, kdy po dvou týdnech řádně vedené léčby, nadále přetrvávala nebo narůstala virová nálož v periferní krvi. Byl analyzován vztah mezi klinickou rezistencí a rozvojem CMV rezistentního kmene, u kterého byla určena mutace kódující tuto změnu.Metody:
V letech 2012–2014 bylo prospektivně sledováno 40 pacientů po alogenní transplantaci hematopoetických kmenových buněk (HSCT) pro hematologickou malignitu, kteří byli léčeni pro aktivní infekci lidským cytomegalovirem (CMV). U případů rezistentních k léčbě byla z klinických vzorků izolována CMV DNA a sekvenovány části genu UL 97 a UL 54 spojené s rezistencí viru vůči virostatiku.Výsledky:
Jako klinicky rezistentní k léčbě bylo označeno sedm případů replikace CMV, ale pouze u dvou pacientů byla prokázána známá mutace způsobující rezistenci na gancyklovir (mutace L595F a M460I v oblasti UL 97). Mutace (N510S v oblasti UL 97) byla prokázána i u jednoho pacienta s opakovanými epizodami replikace viru, opakovaně léčeného, nicméně nesplňujícího kritéria klinické rezistence.Závěr:
Nízká incidence záchytu mutací, spojených s rezistencí CMV na gancyklovir, u relativně častého klinického selhání léčby naznačuje, že mechanismus pomalé eliminace viru při léčbě je pravděpodobně častěji jiný než vznik mutace viru vedoucí k lékové rezistenci.Klíčová slova:
cytomegalovirus – gancyklovir – valgancyklovir – rezistence – transplantace hematopoetických kmenových buněkÚVOD
Před zavedením virostatické terapie byla infekce lidským cytomegalovirem (CMV) jednou z hlavních příčin úmrtí pacientů po HSCT [1, 2, 3, 4]. S dostupností profylaktické a preemptivní léčby virostatiky se mortalita i morbidita spojená s CMV infekcí snížila [1, 5], ale tato terapie s sebou přinesla i riziko vzniku k léčbě rezistentních kmenů viru [6].
V běžné klinické praxi jsou k dispozici 4 léky pro celkové podání: gancyklovir (GCV) a jeho perorální derivát valgancyklovir (VGCV), foscarnet (FOS) a cidofovir (CDV) [3, 7, 8]. V první linii léčby je nejčastěji používán GCV [1, 7, 8, 9], pro profylaktickou a preemptivní terapii pak stále více VGCV [1, 10]. FOS a CDV jsou vzhledem k toxicitě léčby zpravidla léky druhé volby [1, 7]. Všechny tři léky působí jako inhibitory virové DNA polymerázy (kódované genem UL 54) [3, 7, 8].
GCV je nukleosidový analog, který je v infikované buňce iniciálně monofosforylován virovou proteinkinázou (kódovanou genem UL 97) a následně pak buněčnými kinázami dále fosforylován do formy trifosfátu. Takto aktivovaný GCV kompetitivně inhibuje DNA polymerázu viru a zároveň se inkorporuje do virové DNA, čímž zpomaluje, případně zastavuje, její elongaci. CDV oproti tomu potřebuje ke své aktivaci (fosforylaci) pouze buněčné enzymy, a poté účinkuje také jako kompetitivní inhibitor podobně jako GCV. FOS je naopak přímý inhibitor virové polymerázy, působící jako pyrofosfátový analog [7].
Rezistence viru na GCV je v 85–95 % způsobena mutací v genu UL 97, která alteruje terciární strukturu vazebného místa léku [11], což způsobuje snížení jeho fosforylace, a tedy nižší hladinu monofosforylovaného GCV. To následně vede k nižší hladině GCV-trifosfátu, který inhibuje virovou DNA polymerázu [3, 7, 8]. Intenzita zbytkové fosforylace pak ovlivňuje míru citlivosti viru vůči léku. Mutace v genu pro virovou DNA polymerázu (UL 54) mohou vést ke zvýšené exonukleázové aktivitě, která vede k rozpoznání a selektivnímu vystřižení nukleotidových analogů GCV a CDV z virové DNA [7, 12]. Další možná vysvětlení vzniku rezistence jsou pokles selektivní inkorporace inhibitoru do prodlužujícího se řetězce virové DNA, případně snížení afinity vůči inhibitoru, přičemž toto je patrně i případ FOS, který není inkorporován do virové DNA. Jednotlivé mechanismy se mohou kombinovat a vést k mnohočetné rezistenci. Mutace UL 54 také bývají spojeny se silnější rezistencí viru vůči terapii [6].
Je popsáno, že k léčbě méně citlivé kmeny se v celé populaci viru vyskytují jen v malém procentu (což je patrně dáno jejich nižší replikační schopností) a v průběhu léčby narůstá rezistentní frakce [3, 7]. K tomu dochází při neúplné eliminaci virové replikace, k čemuž může dojít např. při suboptimálním dávkování léku (ať už vlivem zhoršené absorpce či nespolupráci pacienta), při adekvátní léčbě vlivem selekčního tlaku virostatika nebo při extrémním imunodeficitu pacienta. Vzhledem k tomu, že se tyto méně citlivé subpopulace viru mohou v přítomnosti virostatika dále replikovat, mohou se vyvíjet a mutovat, a tak získat lepší replikační schopnosti při zachování rezistence k terapii. Tím dochází k přerůstání původního citlivého viru velkou populací rezistentní mutanty. U pacientů po HSCT je incidence vzniku genetické rezistence na GCV odhadována na2–8 % léčených pacientů a obvykle se objevuje po 2–3 měsících terapie [6, 8, 11, 13].
Dosud není jediná obecně přijímaná definice rezistence vůči virostatikům, protože existuje více hledisek pro její posouzení. Často používaná je klinická rezistence, ta však nemusí být dána jen biologickými vlastnostmi viru, ale může záviset na míře imunosupresivní terapie, dosahovaných koncentracích léků, dalších vlastnostech infekce a léčby u jednotlivého pacienta, stejně ale také např. na nespolupráci pacienta [3, 14]. Klinická rezistence, nebo selhání léčby, bývá udáváno jako neklesající nálož virové DNA po dvou týdnech řádně vedené terapie [6, 8, 15]. Někteří autoři používají časový interval jednoho týdne [7], jindy tří týdnů [16]. Pro definování skutečné virové rezistence je nezbytná přesná charakteristika virového kmene, kdy vycházíme z fenotypové a genotypové (sekvenační) analýzy přítomného CMV.
Fenotypové metody jsou založeny na stanovení koncentrace léku potřebného pro redukci virového růstu v buněčné kultuře (zlatým standardem zůstává plaková redukční metoda a určení 50% inhibiční koncentrace, IC50) [3, 7, 8, 17, 18]. Takto definovaná rezistence je uváděna jako určitý (např. dvounásobný) nárůst IC50 vůči referenčnímu virovému kmeni citlivému na GCV, případně je daná konkrétní hodnota IC50 (ta bývá různými zdroji uváděna různě, např. IC50 ≥ 6 – 12 µM pro GCV, pro FOS IC50 ≥ 400–600 µM a pro CDV IC50 ≥ 2–4 µM) [12, 17]. Fenotypové metody jsou však náročné jak na zařízení laboratoře pro práci s buněčnými kulturami a živým virem, tak na čas, protože CMV má dlouhou generační dobu. Tyto metody jsou proto nevhodné pro rutinní diagnostickou praxi, kdy může být problém také získat izolát z klinického vzorku, zejména po zahájení terapie. Navíc, pokud je u jednoho pacienta smíšená populace viru, může divoký citlivý virus přerůst rezistentní variantu [17]. Fenotypové metody ale umožňují testovat klinický vzorek, který se může sestávat z virových populací majících více mutací, a stanovit míru rezistence takového vzorku jako celku [3]. Tyto metody zůstávají zásadní pro verifikaci a určení míry rezistence u nově popsaných mutací virového genomu, které jsou testovány pomocí rekombinantních virů [3, 7, 8, 17, 18].
Genotypová rezistence je prokázána molekulárně-biologickými metodami, tj. průkazem mutace, dříve literárně dokumentované. Testování rezistence metodou sekvenční analýzy je nyní metodou první volby [3]. Zásadními výhodami sekvenačních metod je možnost průkazu rezistentního viru přímo z klinického vzorku, detekce přesně definovaných mutací již z malých náloží viru (již od 200 kopií CMV/ml krve), možnost stanovení mutantní subpopulace a jejich rychlost detekce (do 48 hodin). Vzhledem k dostupným lékům a jejich mechanismu působení jsou testovány oblasti virového genu UL 97 a UL 54 [3, 8]. Nejběžnějším způsobem detekce mutací je sekvenační analýza dané oblasti genu. Konvenční Sangerovo sekvenování umožňuje detekovat mutovanou populaci viru, pokud je její zastoupení vyšší než 20% [8]. Pro rychlou detekci a screening mutací lze použít metody se štěpením PCR produktů restrikčními enzymy (RFLP – restriction fragment length polymorphism), analýzu polymorfismu délky restrikčních fragmentů, která je založena na vzniku nebo zániku restrikčního místa v sekvenci vlivem mutace, případně specifickou PCR s primery a sondami navrženými přímo pro detekci určité mutace [8, 13].
Rizikové faktory vzniku rezistence viru nejsou u pacientů po HSCT stále zcela objasněné [14]; nejčastěji jsou jmenovány dlouhotrvající expozice léku [3, 4, 10, 12, 15], vysoká virová nálož [4, 12] a suboptimální hladiny léku [4, 15]. V jednotlivých studiích bývají také uvedeny vysoké dávky virostatik a výrazná imunosuprese pacienta [3, 12, 15], haploidentická HSCT [6], opakované epizody CMV replikace v průběhu virostatické léčby a sérostatus: dárce CMV séronegativní/recipient CMV séropozitivní (D-/R+) [15]. Tyto situace mohou přímo vést k nedostatečně kontrolované replikaci viru během virostatické léčby [6, 7, 8].
Cílem naší práce je zjištění incidence rezistence lidského cytomegaloviru (CMV) k virostatické léčbě gancyklovirem u pacientů po alogenní transplantaci hematopoetických kmenových buněk (HSCT).
METODY
Soubor nemocných
Do prospektivního sledování byli zařazeni pacienti po alogenní HSCT. Jednalo se o pacienty IV. interní hematologické kliniky Fakultní nemocnice v Hradci Králové, kteří byli transplantováni pro hematoonkologické onemocnění. Od července r. 2012 do dubna 2014 bylo do studie zařazeno 68 pacientů, z nichž dva podstoupili retransplantaci. Jednalo se o 34 mužů a 34 žen s věkovým mediánem 53 let (v rozmezí 22–72 let) v době transplantace. Alogenní transplantace byla provedena u 32 pacientů s akutní myeloidní leukémií, 11 pacientů s akutní lymfoblastickou leukémií, 9 pacientů s chronickou lymfatickou leukémií, 6 pacientů pro myelodysplastický syndrom, 5 pacientů s Ph - myeloproliferací, 4 pacientů s nehodgkinovým lymfomem, 2 nemocných s chronickou myeloidní leukémií a 1 pacienta s mnohočetným myelomem (graf 1). Doba sledování byla alespoň 1 rok po transplantaci.
Graf 1. Pacienti – zastoupení jednotlivých diagnóz Fig. 1. Distribution of patients by diagnosis 
ALL – akutní lymfoblastická leukémie, AML – akutní myeloidní leukémie, CLL – chronická lymfatická leukémie, CML – chronická myeloidní leukémie, MDS – myelodysplastický syndrom, MM – mnohočetný myelom, MPD – myeloproliferativní choroby, NHL – nehodgkinův lymfom ALL – acute lymphoblastic leukemia, AML – acute myeloid leukemia, CLL – chronic lymphocytic leukemia, CML – chronic myeloid leukemia, MDS – myelodysplastic syndrome, MM – multiple myeloma, MPD – myeloproliferative diseases, NHL – non-Hodgkin’s lymphoma U 88 % výkonů byl použit přípravný režim kombinující fludarabin a busulfan s thymoglobulinem či bez něj. V 5 případech (7 %) bylo provedeno celotělové ozáření v dávce 12 Gy (blíže graf 2). Dárce byl v 22 % případů HLA identický sourozenec, v 53 % případů nepříbuzný dárce HLA identický v A, B, C, DR a DQ systému a v 24 % byl pacient transplantován s jednou neshodou v HLA systému (graf 3). Thymoglobulin byl podán u 84 % transplantačních výkonů; u nepříbuzenských transplantací nebo v případě neshody HLA byl podán v celkové dávce 6 až 7,5 mg/kg. Imunosupresivní léčba byla podávána v kombinaci takrolimus a mykofenolát mofetil.
Graf 2. Transplantační režimy Fig 2. Transplant regimens 
Bu – Busulfan, Cy – Cyklofostamid A, Flu – Fludarabin, MEL – Melfalan, TBI – celotělové ozáření, TG – Thymoglobulin, Tre – Treosulfan, Vep – Vepesid Bu – Busulfan, Cy – Cyclophosphamide A, Flu – Fludarabine, MEL – Melphalan, TBI – total body irradiation, TG – Thymoglobulin, Tre – Treosulfan, Vep – Vepesid Graf 3. Charakteristika pacientského souboru Fig. 3. Characteristics of study patients 
CMV status: D - CMV séronegativní dárce, D+ CMV séropozitivní dárce, R- CMV séronegativní příjemce HSCT, R+ séropozitivní příjemce HSCT. Typ transplantace: MMUD – částečně shodný nepříbuzný dárce, MSD plně shodný příbuzenský dárce (sourozenec), MUD – plně shodný nepříbuzný dárce CMV status: D – CMV seronegative donor, D + CMV seropositive donor, R- CMV seronegative HSCT recipient, R+ seropositive HSCT recipient. Transplant type: MMUD – mismatched unrelated donor, MSD – matched sibling donor, MUD – matched unrelated donor U všech pacientů byla zároveň podávána standardní profylaxe trimetoprimem/sulfametoxazolem proti Pneumocystis jirovecii (2krát 960 mg 2krát týdně 2 dny po sobě), acyklovirem (2krát 800 mg/den) a flukonazolem (400 mg/den). Délka podávané profylaxe byla upravo-vána podle přítomnosti reakce štěpu proti hostiteli a při imunosupresivní terapii. Specifická profylaxe proti CMV nebyla nasazena u žádného z pacientů, s výjimkou jednoho pacienta, který 296. den po HSCT podstoupil transplantaci srdce, po které měl profylaxi VGCV.
Schéma léčby CMV
CMV replikace byla konstatována při průkazu více než 100 kopií CMV DNA/ml plné krve (odpovídá 91 UI/ml). Léčba CMV reaktivace byla zahájena, pokud CMV nálož překročila 1 000 kopií/ml, dávkou VGCV 900 mg 2krát denně do poklesu virové nálože o 50 % a poté minimálně 2 týdny udržovací terapie 900 mg 1krát denně při negativních výsledcích vyšetření virémie. Léčba FOS byla preferována při závažnější formě cytopenie. Při terapii CMV nemoci byl podán GCV nebo FOS (podle schématu GCV 5 mg/kg á12 hodin po 2 týdny a následně 5 mg/kg/den po 2–4 týdny; FOS 90 mg/kg á12 hod po 2 týdny a poté 120 mg/kg/den 2–4 týdny do vymizení symptomů), u jednoho pacienta se současnou adenovirovou enteritidou byl podán CDV (podle schématu 5 mg/kg jednou týdně 1. a 2. týden, dále jednou za dva týdny, léčba byla kombinována s probenecidem; náš pacient dostal 1 dávku, pak byl převeden při již odeznělé adenovirové enteritidě na FOS) [19].
CMV specifický hyperimunní globulin nebyl v naší skupině pacientů podáván, protože je podle doporučení evropské pracovní skupiny zaměřené na infekce u hematologických pacientů (ECIL – European Conference on Infection in Leukemia) ke zvážení jeho přidání k virostatikům jen při CMV pneumonii (síla doporučení CII) [20] a s jeho podáváním nemáme na našem pracovišti zkušenosti.
Detekce CMV infekce
U pacientů po alogenní HSCT byla pravidelně monitorována CMV virémie pomocí kvantitativní real-time PCR z plné nesrážlivé periferní krve v EDTA. Frekvence odběrů byla při nekomplikovaném průběhu 1krát týdně do dne 100 po HSCT a dále podle potřeby a klinického stavu nemocných. Sekvenční analýza pak byla prováděna u pacientů suspektně rezistentních k léčbě. Za klinickou rezistenci k VGCV/GCV byl považován stav, kdy po 2 týdnech řádně vedené terapie neklesala virémie. Sekvenační vyšetření bylo provedeno i v případě prolongovaného vylučování viru nebo při opakovaných reaktivacích CMV.
Nukleová kyselina byla ze zaslaných vzorků extrahována pomocí QIAamp DNA Mini Kitu (Qiagen, Hilden, Spolková republika Německo) podle pracovního návodu výrobce pro izolaci DNA z biologického materiálu.
Ke kvantitativnímu stanovení virové DNA byl použit komerční kit CMV RG PCR (Qiagen, Hilden, Spolková republika Německo). Mez stanovitelnosti (kvantifikace) této metody byla 500 kopií/ml, mez detekce pak 100 kopií/ml.
Pozitivní vzorky byly uchovány pro případné pozdější zpětné testování k přesnému určení doby vzniku konkrétní mutace UL 97. Vzorky CMV DNA byly uchovány při teplotě -20 °C.
Sekvenační analýza
Při sekvenační analýze byly sekvenovány části genů UL 97 a UL 54 [21] a získané sekvence byly srovnávány se sekvencemi referenčního kmene CMV AD 169 pomocí programu na detekci odchylek proti referenčnímu kmenu, který byl pro naše potřeby vytvořen (dostupný na http://www.vejrazka.name/apps/med/dna/sample_matching/). Původně byl program napsán pro automatické vyhledávání veškerých mutačních změn a polymorfismů CMV v oblasti UL 97 a UL 54 proti referenční sekvenci. Výsledek sekvenace je možné přímo zadat do webové stránky. Program pak automaticky detekuje shodu s vybranou referenční sekvencí a zobrazí odchylky v sekvenované DNA, a tak je analýza vzorku prakticky okamžitá. Výhodou je, že program dokáže pracovat i s tzv. degenerovanou sekvencí, ve které jsou na jednom místě detekovány dva nukleotidy, zapsány podle mezinárodně uznávaného kódu – např. sekvenační hodnota „M“ je chápána jako „nukleotid A a G“, hodnota „H“ znamená „nukleotid A a C a T“ atd. Program může být jednoduše rozšířen o další referenční sekvence a je nyní provozován ve zkušební verzi bez garance dostupnosti. Získané výsledky tohoto porovnání DNA byly následně porovnány s naší databází polymorfismů a mutací (popsaných v literatuře) a poté i německým programem na vyhledávání mutací CMV na http://www.informatik.uniulm.de/ni/mitarbeiter/HKestler/hcmv) [3].
Statistická analýza
Statistické zhodnocení dat bylo provedeno v programu SigmaPlot 11.0 pro Windows. Závislost CMV reaktivace na jednotlivých faktorech byla hodnocena v kontingenčních tabulkách pomocí chí-kvadrát testu s Yatsovou korekcí a Fisherovým přesným testem, pokud byla kontingenční tabulka ve formátu 2 x 2. Použitá hladina významnosti: p = 0,05. Datové grafy byly zpracovány pomocí programu Microsoft Excel.
VÝSLEDKY
U 43 pacientů (63 %) jsme detekovali celkem 89 epizod detekce CMV (tj. pozitivní virémie pomocí PCR nebo průkaz CMV v tkáni imunohistochemicky), z toho časných, tj. vzniklých do dne 100 po HSCT, 63 epizod (tj. 71 %) a 26 pozdních. U každé pozdní replikace u konkrétního pacienta vždy předcházela epizoda časné CMV replikace. Z uvedených 89 CMV epizod byla zahájena preemptivní léčba v 65 případech (tj. v 73 %, 51krát GCV nebo VCV, 13krát FOS a 1krát CDV) u celkem 40 pacientů (graf 4).
Graf 4. Četnost infekce CMV a indikované léčby v našem souboru. Proporční výskyt CMV časné a pozdní infekce Fig. 4. Incidence of CMV infection and indicated treatment in study patients. Cases of early vs late CMV infection. 
CMV nemoc (definovaná jinde [22]) byla v našem souboru prokázána 9krát; opakovaně CMV kolitida a jednou CMV retinitida. U 6 pacientů (9 %) byla celkem 8krát prokázána CMV kolitida (5krát časná v rozmezí 29.–84. den a 3krát pozdní kolitida v rozmezí 132.–346. den). Dále bylo jednou vysloveno podezření na časnou CMV kolitidu, ale nebyla splněna diagnostická kritéria této nemoci. V jednom případě pak byla pozorována suspektní pozdní CMV pneumonie (den 450. po HSCT), s odpovídajícím klinickým a radiologickým obrazem a vysokou CMV náloží v BALu. I při prokázané CMV nemoci jsme replikaci viru v periferní krvi detekovali zpravidla jen v malých kvantitách, nejčastěji 102–103kopií/ml periferní krve.
V jednom případě došlo k úmrtí pacienta s jaterní GVHD mající možnou příčinnou souvislost s CMV nemocí a těžkou enteritidou. Tento pacient byl klinicky rezistentní k terapii gancyklovirem i foscarnetem, ale při opakované sekvenaci klinického izolátu nebyla prokázána mutace CMV vedoucí ke snížené citlivosti na tato virostatika. Ve zbytku souboru nedošlo k úmrtí, které by bylo v přímé souvislosti s CMV nemocí, a to včetně pacientů s prokázanou rezistentní mutantou viru. Ve sledovaném období zemřelo celkem 23 pacientů (34 %). Příčinou úmrtí byla nejčastěji infekční komplikace (mimo CMV) a relaps a progrese základní nemoci.
Podezření na klinickou rezistenci CMV vůči virostatikům bylo vysloveno v 7 případech, tj. u 10 % transplantovaných a 17,5 % léčených. Ve třech případech (tj. u 4 % transplantací, ve 3 % ze všech CMV replikací) byla prokázána rezistence na gancyklovir v oblasti UL 97 (mutace L595F, N510S a M460I, viz tabulka 1). Tyto kodony byly již v dřívějších pracích prokázány jako oblasti, obsahující mutace spojené s touto rezistencí [23–28]. U každého pacienta se jednalo o jednu prokázanou genotypovou rezistenci v oblasti UL 97 vedoucí k rezistenci na GCV, žádná mutace v UL 54 nebyla nalezena. Dva ze tří pacientů s prokázanou genotypovou rezistencí byli klinicky rezistentní k léčbě, ale pacient s mutací L595F nesplňoval definovaná kritéria klinické rezistence. U tohoto pacienta bylo prokázáno 5 epizod reaktivace CMV, přičemž léčba virostatiky byla podána ve dvou případech.
Tab. 1. Pacienti s prokázanou mutací CMV v UL 97 Table 1. Patients with a detected mutation in the CMV UL97 gene 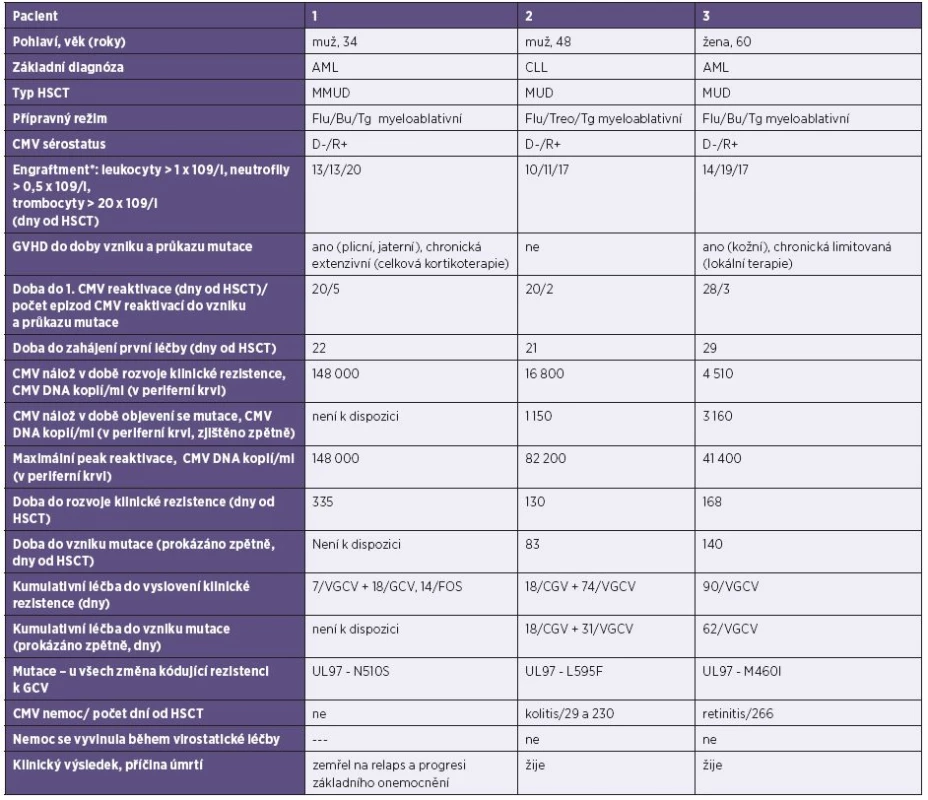
AML – akutní myeloidní leukémie, Bu – Busulfan, CLL – chronická lymfatická leukémie, CMV cytomegalovirus, cp/ml – kopie DNA/ml, D-CMV séronegativní dárce, F – fenylalanin, Flu – Fludaratin, FOS – foscarnet, GCV – gancyklovir, GVHD – reakce štěpu proti hostiteli, HSCT – transplantace hematopoetických kmenových buněk, I – izoleucin, L – leucin, M – methionin, MMUD – částečně shodný nepříbuzný dárce, MUD –plně shodný nepříbuzný dárce, N – asparagin, R- – CMV séronegativní příjemce, R+ – CMV séropozitivní příjemce, S – serin,Tg – thymoglobulin, Treo – treosulfát, VGCV – valganciclovir. AML – acute myeloid leukemia, Bu – Busulfan, CLL – chronic lymphocytic leukemia, CMV cytomegalovirus, cp/ml – DNA copies/ml, D- CMV seronegative donor, F – phenylalanine, Flu – Fludaratin, FOS – foscarnet, GCV – ganciclovir, GVHD – graft versus host disease, HSCT – hematopoietic stem cell transplantation, I – isoleucine, L – leucine, M – methionine, MMUD – mismatched unrelated donor, MUD – matched unrelated donor, N – asparagine, R- CMV – seronegative recipient, R+ CMV – seropositive recipient, S – serine,Tg – thymoglobulin, Treo – treosulfan, VGCV – valganciclovir *Datum přihojení je definováno jako první den ze tří po sobě následujících dní splňujících kvantitativní kritérium, přičemž poslední transfuze byla alespoň 7 dní před tímto datem [36]. *Date of engraftment is defined as the first of three consecutive days on which the quantitative criterion is met, with the last blood transfusion given not less than seven days before this date [36]. U pacientů klinicky rezistentních k léčbě se výrazně častěji objevovala CMV nemoc než ve zbytku souboru – z prokázaných 9 CMV nemocí se 6 případů vyvinulo u klinicky rezistentních pacientů, z nichž dva měli genotypovou rezistenci vůči virostatikům.
U prokázané genotypové rezistence byla doba do zahájení testování 130–338 dní od transplantace, po kumulativní době léčení 25 dní VGCV/GCV a 14 dnech FOS v jednom případě a po 90, respektive 92 dnech léčby VGCV u druhých dvou pacientů. V tu dobu byla virová nálož v plné krvi 103-5 kopií/ml DNA CMV.
V našem souboru nebyl statisticky signifikantní rozdíl ve vzniku CMV reaktivace při rozdělení pacientů do skupin podle HLA shody (plně shodný příbuzenský dárce (sourozenec) vs. plně shodný nepříbuzenský dárce vs. částečně shodný nepříbuzenský dárce p = 0,277, Fisherův test), ani podle intenzity transplantačního režimu (myeloablativní vs. nemyeloablativní, p = 0,217), ani při rozdělení pacientů podle podání thymoglobulinu v rámci přípravného režimu (podán/nepodán p = 0,516).
DISKUSE
Incidence klinické rezistence byla v našem souboru transplantovaných pacientů 10% a mutace v oblasti UL 97byly prokázány ve 4 %. Tyto hodnoty jsou ve shodě s dalšími autory [6, 8, 11, 29, 30]. Tato čísla ukazují, že příčina pomalé eliminace viru při léčbě je i v našem případě pravděpodobně častěji jiná než vznik mutace viru vedoucí k lékové rezistenci. Tato pomalá eliminace viru je patrně způsobena nedostatečnou imunologickou kontrolou virové replikace při těžké imunosupresi, případně nedostatečnou koncentrací léků v cílových kompartmentech [3, 14].
Ačkoliv se rezistentní kmeny objevily pouze u pacientů se sérostatem D-/R+, jednoznačný vztah nebyl potvrzen (p = 0,394), což může být dáno velikostí souboru. Literárně je sérostatus D-/R+ po HSCT rizikovější stran opakovaných CMV infektů, virové replikace a jejich léčby, což zvyšuje riziko, že se vyvine virová mutace [31]. Z klinicky rezistentních pacientů mělo sérostatus D-/R+ pět nemocných, zbylí dva pacienti byli D+/R+ (p = 0,888).
Ve srovnání s velkou retrospektivní studií provedenou u profylakticky zajištěných příjemců solidních orgánů (n = 240) Limayem et al. [32], který popisuje u pacientů s rezistentními kmeny 20% výskyt CMV nemoci, se v našem souboru CMV nemoc vyvinula u 2 ze 3 pacientů s prokázanou virovou rezistencí. Vztaženo na klinicky rezistentní pacienty se jednalo dokonce o 67 % všech CMV nemocí (6 z 9) v souboru. Na rozdíl od práce Luraina et al. [17], který popsal, že minimálně polovina pacientů s CMV nemocí a prokázaně rezistentním virem zemřela na přímé následky této nemoci, naši 2 pacienti s prokázanou mutací UL 97 CMV nemoc překonali, byť u pacientky s CMV retinitidou došlo ke zhoršení vizu na postiženém oku. Třetí pacient zemřel později při progresi základní nemoci z důvodu srdeční tamponády při leukemické infiltraci perikardu, a tedy bez souvislosti s rezistentním virem. Zde se však může zcela projevit fakt, že Lurain pracoval s pacienty po transplantaci solidních orgánů (SOT). Boutolleau [4], v jehož souboru byli pacienti jak po SOT, tak i HSCT, popisuje úmrtí pouze jednoho z 11 pacientů s rezistentními CMV. Rozdíly v jednotlivých souborech mohou být dány různými pacientskými soubory, stejně jako možným různým nastavením hranice pro zahájení antivirové terapie a odlišností léčebných režimů, protože v uvedených pracích nejsou přesně uvedena léčebná schémata (zejména pro GCV a FOS), a naše zkušenosti jsou výhradně od pacientů po HSCT.
Na rozdíl od studie van den Beek [14], která popsala selhání léčebné odpovědi v 96 % případů (u 25 z 26 pacientů) již při první zahájené preemptivní terapii, naši nemocní byli převážně vyšetřeni pro klinickou rezistenci až při dalších léčených epizodách CMV replikace: při druhé 8 pacientů a ve třetí 4 pacienti. K selhání léčby v první epizodě došlo jen u 4 pacientů (z šestnácti). Van den Beek ale kromě toho, že pracuje s pacienty po HSCT s depletovanými T lymfocyty ve štěpu, používá jinou definici klinické rezistence, kde vychází z absolutních hodnot CMV nálože (více než 1 000 kopií/ml po 2 týdnech léčby). My jsme vycházeli z definice, která zohledňuje trend poklesu nálože při léčbě. Definice v uvedené studii je proto „přísnější“ než naše, což může vysvětlit selhání léčby u většiny jejích pacientů již během první epizody. Také Lurain [17] ve své studii udává vznik virové rezistence po druhé a třetí léčené epizodě CMV.
U třech pacientů byla prokázána virová rezistence na gancyklovir v oblasti UL 97, jak je prezentováno v tabulce 1. Detekované mutace v kodonech L595F, N510S a M460I byly popsány se spojení s rezistencí na GCV [23–28]. Mutace v kodonech 460, 594 a 595 patří mezi nejčastější genotypy spojené s rezistencí na GCV [33]. Námi prokázaná mutace M460I patří mezi časné mutace, také L595F bývá v klinických izolátech nalézána, méně často pak N510S. Prokázali jsme pouze jednu mutaci u každého pacienta, což je ve shodě s jinými autory, vícečetné mutace (ať již v jedné oblasti, nebo v UL 97 a 54 zároveň) nebo zkřížená rezistence bývá popisována méně často [34]. Protože valgancyklovir nebo gancyklovir byl podáván pro léčbu nejčastěji, vyskytly se v našem souboru pouze mutace spojené s tímto lékem. Důvodem může být i to, že léčba FOS trvala zpravidla kratší dobu než GCV, a v našem souboru pacientů byla účinná, protože po jeho podání docházelo k rychlé eliminaci viru z organismu.
V naší práci jsme k průkazu virové rezistence vycházeli výlučně z techniky sekvenovaní, a pak byly výsledky analýzy srovnány s literárně dokumentovanými mutacemi. Metody fenotypové analýzy nejsou v České republice dostupné, a nemohli jsme tedy vzorky od klinicky rezistentních pacientů testovat i těmito metodami. Je proto teoreticky možné, že jsme v souboru zachytili polymorfismy, které ještě nebyly popsány a publikovány jako mutace vedoucí ke snížené citlivosti na GCV, a proto může být skutečný výskyt rezistentních mutací o něco vyšší. V rámci tohoto projektu jsme se zaměřili na výskyt genotypové rezistence u dospělých pacientů po HSCT a další možné příčiny klinického selhání léčby nebyly studovány. V této souvislosti je často zvažovaný např. vliv suboptimálního dávkování virostatiky [3, 7, 8]. Tyto vzorky pro měření hladin GCV byly odebírány a uchovány, ale nejedná se o dosud standardní testování, a proto budou získaná data analyzována v další fázi této práce spolu s rozborem dalších vlivů ovlivňující měření hladiny GCV.
U pacientů č. 2 a 3, u kterých po 2 týdnech léčby nebyla dosažena odpověď na virostatikum a byla prokázaná mutace v UL 97, byla doba rozvoje klinické rezistence 130 a 168 dní od HSCT (respektive 110 a 140 dní po první detekci CMV u pacienta), podobně jako u již zmiňované studie Boutolleau [4] (medián 145 dní), a došlo k ní po 92 dnech kumulativní léčby val/gancyklovirem, respektive 90 dnech gancyklovirem. Také Gilbert a Boivin [7] ve své analýze 3 studií u pacientů po transplantaci plic uvádějí průkaz virové rezistence po kumulativní délce léčby 79–100 dní po transplantaci, Shmueli [6] uvádí mírně kratší medián léčby – 70 dní (39–330 dní po HSCT), naopak Lurain [17] u pacientů po SOT delší – 194 dní. Zde se jistě může projevit heterogenita pacientských souborů – různé transplantované orgány, různé přípravné režimy, různý druh imunosupresivní léčby a nejednotné léčebné režimy CMV. Pacienti po SOT ze zmiňovaných studií byli také často zajištěni val/ganciclovirem profylakticky, což může vést k oddálení CMV replikace a na druhou stranu může vést, dojde-li k proliferaci CMV, ke snadnějšímu vývoji virové rezistence. Emery a Griffiths [35] ve své práci z roku 2000 na základě výsledků získaných od pacientů s AIDS ukázali pomocí matematických modelů, že účinnost i. v. GCV vůči divokému viru je 91,5% a při v té době podávaném p. o. GCV (který má ale horší biologickou dostupnost než VGCV [1]) je 46,5% [35], ale u rezistentní mutanty (jako s typickým rezistentním kmenem je v této práci počítáno s mutantou UL 97 L595F a s dvojitou mutací v UL 97 M460V + L595F) jen 62%, respektive 35%. Při prolongovaném podávání GCV tak dochází k postupnému exponenciálnímu nárůstu dvou populací – divokého typu a rezistentní mutanty. Na základě údajů o replikační schopnosti mutanty L595F vytvořili matematický model nárůstů rezistentní frakce. Pokud je počítáno, že v úvodu je rezistentní kmen zastoupen pouze 0,5% populací, pak po 21denní terapii GCV vzroste asi 3násobně, tj. pouze na cca 1,7 %. Pokud je však GCV podáván dlouhodobě, mutanta se dále replikuje, dochází k exponenciálnímu růstu, a v den 145.léčby dosahuje rezistentní kmen 30 % CMV populace a v den 150. již více než 90 %, přestože v úvodu byla mutanta zastoupena 0,5 % populací. V našem souboru došlo k projevu nárůstu nálože mutovaného viru – tj. klinické rezistenci – u pacienta č. 2 po 92 dnech léčby kombinované i. v. a p. o. léčby a u pacienta č. 3 po 90 dnech p. o. léčby. Toto naznačuje podobný princip i u našich pacientů. Virová rezistence u pacienta č. 1 byla testována mnohem později, 11 měsíců po transplantaci. U tohoto pacienta jsme však nezaznamenali prolongovanou perzistenci viru, ale docházelo k opakovaným reaktivacím v nízkých kvantitách (nejčastěji v neléčených kvantitách 102, méně často pak 103 kopií/ml CMV DNA, kdy již byla podávána léčba). Sekvenace viru byla provedena až při 5. epizodě, kdy se virus náhle replikoval do hodnot 105 kopií/ml krve. V tu dobu se jednalo o intenzivně léčeného těžce imunosuprimovaného pacienta se 4. relapsem akutní myeloidní leukémie, s chronickou extenzivní GVHD a po léčbě rituximabem pro post-transplantační EBV-asociovanou lymfoproliferaci. Po zahájení léčby foscarnetem virová nálož rychle klesla do negativních hodnot. Mutace byla zjištěna po kumulativní léčbě 25 dní val/gancyklovirem + 14 dní foscarnetem.
Naše práce umožnuje sledovat vývoj mutace viru v čase, a je tedy možné zjistit, kdy přesně se daná mutace objevila a za jakou dobu se projevila klinicky. Takovou „časovou osu“ bylo možné sestavit u dvou rezistentních pacientů. U pacienta č. 2 se jednalo o 43 dní a u pacienta č. 3 o 28 dní, kdy byli nadále léčeni valgancyklovirem, a již se u nich vyvíjela rezistentní mutanta (viz tabulka 1). Tento interval je tedy v naší studii dobou, kdy je trvale podávaná léčba, při které může mutovaný a rezistentní virus přerůstat rychleji se replikující divokou (tj. citlivou) populaci viru, aniž by se ještě projevil klinicky.
ZÁVĚR
Dostupnost terapie CMV infekcí snížila mortalitu i morbiditu pacientů po HSCT. V posledních letech se ale setkáváme se selháním této léčby jako se závažnou komplikací podávání virostatik. Naše data podporují tezi, že v současnosti je jen menší část klinicky rezistentních případů virové replikace CMV u dospělých příjemců alogenního transplantátu HSCT způsobena pravou virovou rezistencí. Testování a nové poznatky týkající se citlivosti CMV vůči virostatikům pomáhají optimalizovat přístup ke konkrétnímu pacientovi a budou dále nabývat významu při užívání nové virostatické léčby.
Poděkování
Děkujeme lékařům IV. interní kliniky FNHK, zejména z transplantační a intermediální jednotky, všem ošetřujícím lékařům a zdravotním sestrám, stejně tak pracovníkům Ústavu klinické biochemie a diagnostiky FNHK. Velké poděkování patří také panu Jiřímu Vejražkovi za sestavení softwaru na detekci změn mutací a paní Mirce Židové za pomoc se shromažďováním dat.
Tato práce byla podpořena grantem IGA MZ ČR NT13691-4.
Do redakce došlo dne 23. 5. 2015.
Adresa pro korespondenci:
MUDr. Eva Vejražková
Interní hematologická klinika FN
Sokolská 581
500 05 Hradec Králové
e-mail: eva.vejrazkova@fnhk.cz
Zdroje
1. Mori T, Kato J. Cytomegalovirus infection/disease after hematopoietic stem cell transplantation. Int J Hematol, 2010;91 : 588–595.
2. Prentice HG, Gluckman E, Powles RL, et al. Impact of long-term acyclovir on cytomegalovirus infection and survival after allogeneic bone marrow transplantation. European Acyclovir for CMV Prophylaxis Study Group. Lancet, 1994;343 : 749–753.
3. Chevillotte M, von Einem J. Meier BM, et al. A new tool linking human cytomegalovirus drug resistance mutations to resistance phenotypes. Antiviral Research, 2010;85 : 318–327.
4. Boutolleau D, Deback C, Bressollette-Bodin C, et al. Resistance pattern of cytomegalovirus (CMV) after oral valganciclovir therapy in transplant recipients at high-risk for CMV infection. Antiviral Research, 2009;81 : 74–179.
5. Patel N, Snyder LD, Finlen-Copeland CA, et al. Is Prevention the Best Treatment? CMV After Lung Transplantation. Am J Transplant, 2012;12 : 539–544.
6. Shmueli E, Or R, Shapira MY, et al. High Rate of Cytomegalovirus Drug Resistance Among Patients Receiving Preemptive Antiviral Treatment After Haploidentical Stem Cell Transplantation. J Infect Dis, 2014;209 : 557–561.
7. Gilbert C, Boivin G. Minireview. Human Cytomegalovirus Resistance to Antiviral Drugs. Antimicrob Agents Chemother, 2005;49(3):873–883.
8. Lengerová M, Volfová P, Ráčil Z. Laboratorní diagnostika CMV infekce u nemocných s hematologickou malignitou. Postgrad med, 2013;15(4):45–50.
9. Rozsypal H. Chemoterapie infekcí vyvolaných cytomegalovirem. Remedia, 2002;12(5):339–342.
10. Marfori JE, Exner MM, Marousek GI, et al. Development of new cytomegalovirus UL97 and DNA polymerase mutations conferring drug resistance after valganciclovir therapy in allogeneic stem cell recipients. J Clin Virol, 2007;38 : 120–125.
11. Psohlavec J, Förstl M, Horáček J, et al. Možnosti rychlého průkazu ganciclovir rezistentních kmenů lidského cytomegaloviru (HCMV, CMV) u pacientů po transplantaci ledviny. Detekce bodových mutací v UL 97 genu CMV spojených s rezistencí vůči gancykloviru. Klin Farmakol Farm, 2006;18 : 70–74.
12. Gordon E. Treatment of Ganciclovir - Resistant Cytomegalovirus in Adult Solid Organ Transplant Recipients. Caught Between a Rock and a Hard Place? [online]. Univerzity of Texas, 2013 [cit.2014-05-05]. Dostupný na www: http://www.utexas.edu/pharmacy/divisions/pharmaco/rounds/gordon11-01-13.pdf
13. Volfova P, Lengerova M, Lochmanova J, et al. Detecting human cytomegalovirus drug resistant mutations and monitoring the emergence of resistant strains using real-time PCR. J Clin Virol, 2014 Oct;61(2):270–274.
14. Van der Beek MT, Marijt EW, Vossen AC, et al. Failure of pre-emptive treatment of cytomegalovirus infections and antiviral resistance in stem cell transplant recipients. Antivir Ther, 2012;17(1):45–51.
15. Ljungman P, Hakki M, Boeckh M. Cytomegalovirus in Hematopoietic Stem Cell Transplant Recipients. Hematol Oncol Clin North Am, 2011;25(1):151–169.
16. Hantz S, Garnier-Geoffroy F, Mazeron MC, et al. Drug-resistant cytomegalovirus in transplant recipients: a French cohort study. J Antimicrob Chemother, 2010;65 : 2628–2640.
17. Lurain NS, Bhorad SM, Pursell KJ, et al. Analysis and characterization of antiviral drug–resistant cytomegalovirus isolates from solid organ transplant recipients. J Infect Dis, 2002;186 : 760–768.
18. Chou S, van Wechel LC, Lichy HM, et al. Phenotyping of cytomegalovirus drug resistance mutations by using recombinant viruses incorporating a reporter gene. Antimicrob Agents Chemother, 2005;49 : 2710–2715.
19. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Prevention and Treatment of Cancer-Related Infections. Version 2.2014 [online]. 2014-11-08 [cit. 2014-12-12]. Dostupný na www: http://file.trsgo.org/userfiles/file/NCCN%20Cancer-Related%20Infections%20Guideline%202015.pdf
20. Ljungman P, de la Camara R, Einsele H, et al. Recommendations for CMV and HHV 6 management in patients with haematological diseases [online]. ECIL 4 Update, 2011 [cit. 2015-06-01]. Dostupný na www: http://www.ebmt.org/Contents/Resources/Library/ECIL/Documents/ECIL%204%20%20Update%202011%20CMV.pdf
21. Scott GM, Isaacs MA, Zeng F, et al. Cytomegalovirus Antiviral Resistance Associated With Treatment Induced UL97 (Protein Kinase) and UL54 (DNA Polymerase) Mutations. J Med Virol, 2014;74 : 85–93.
22. Ljungman P, Griffiths P, Paya C. Definitions of Cytomegalovirus Infection and Disease in Transplant Recipients. Clin Inf Dis, 2002;34 : 1094–1097.
23. Chou S, Guentzel S, Michels KR, et al. Frequency of UL97 phosphotransferase mutations related to ganciclovir resistance in clinical cytomegalovirus isolates. J Infect Dis, 1995;172 : 239–242.
24. Smith IL, Cherrington JM, Jiles RE, et al. High-level resistance of cytomegalovirus to ganciclovir is associated with alterations in both the UL97 and DNA polymerase genes. J Infect Dis, 1997;176 : 69–77.
25. Baldanti F, Underwood MR, Stanat SC, et al. Single amino acid changes in the DNA polymerase confer foscarnet resistance and slow-growth phenotype, while mutations in the UL97-encoded phosphotransferase confer ganciclovir resistance in three double-resistant human cytomegalovirus strains recovered from patients with AIDS. J Virol, 1996;70 : 1390–1395.
26. Erice A, Borrell N, Li W, et al. Ganciclovir susceptibilities and ana-lysis of UL97 region in cytomegalovirus isolates from bone marrow recipients with CMV disease after antiviral prophylaxis. J Infect Dis, 1998;178 : 531–534.
27. Chou S, Erice A, Jordan MC, et al. Analysis of the UL97 phosphotransferase coding sequence in clinical cytomegalovirus isolates and identification of mutations conferring ganciclovir resistance. J Infect Dis, 1995;171 : 576–583.
28. Wolf DG, Smith IL, Lee DJ, et al. Mutations in human cytomega-lovirus UL97 gene confer clinical resistance to ganciclovir and can be detected directly in patient plasma. J Clin Investig, 1995;95(1):257–263.
29. Gilbert C, Roy J, Belanger R, et al. Lack of Emergence of Cytomegalovirus UL97 Mutations Conferring Ganciclovir (GCV) Resistance following Preemptive GCV Therapy in Allogeneic Stem Cell Transplant Recipients. Antimicrobial Agents Chemoter, 2001;45 : 3669–3367.
30. Nichols WG, Corey L, Gooley T, et al. Rising pp65 antigenemia during preemptive anticytomegalovirus therapy after allogeneic hematopoietic stem cell transplantation: risk factors, correlation with DNAload, and outcomes. Blood, 2001;97(4):867–874.
31. Boeckh M, Ljungman. How we treat cytomegalovirus in hematopoietic cell transplant recipients. Blood, 2009;113(23):5711–5719.
32. Limaye AP. Ganciclovir-resistant cytomegalovirus in organ transplant recipients. Clin Inf Dis, 2002;35 : 866–872.
33. Chou S, Waldemer RH, Senters AE, et al. Cytomegalovirus UL97 phosphotransferase mutations that affect susceptibility to ganciclovir. J Infect Dis, 2002;185(2):162–169.
34. Kleiboeker S, Nutt J, Schindel B, et al. Cytomegalovirus antiviral resistance: characterization of results from clinical specimens. Transpl Infect Dis, 2014;16(4):561–567.
35. Emery VC, Griffiths P. Prediction of cytomegalovirus load and resistence patterns after antiviral chemotherapy. Proc Natl Acad Sci USA, 2000;97(14):8039–8044.
36. Ruutu T. Engraftment [online]. EBMT, 2011 [cit. 2016-06-02]. Dostupný na www: http://www.ebmt.org/Contents/Resources/Library/Slidebank/Documents/EBMT%202011%20SC%20Slide%20Bank/1439%20Ruutu.pdf
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek Nové knihy
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2015 Číslo 3- Jak souvisí postcovidový syndrom s poškozením mozku?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Lidská prionová onemocnění v České republice
- Genetický a molekulový podklad vývoja autoimunitného diabetes mellitus
- Antigenní variabilita kmenů Bordetella pertussis izolovaných v letech 1967–2010 v České republice – možné vysvětlení vzestupu nemocnosti pertusí?
- Vyhodnocení epidemie spalniček v Ústeckém kraji
- Klonální analýza populace meningokoků z invazivního onemocnění a od zdravých nosičů izolovaných v České republice v období 1971 – 2014 (květen)
- Kampylobakteriózy na Klinice infekčních chorob Fakultní nemocnice Brno v letech 2011–2013: retrospektivní studie
- Klinická rezistence lidského cytomegaloviru při léčbě gancyklovirem u pacientů po alogenní transplantaci hematopoetických buněk – zkušenosti jednoho centra
- Hodnocení tvorby biofilmu vybraných patogenů vyskytujících se v potravinářském průmyslu
- Nové knihy
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Lidská prionová onemocnění v České republice
- Klinická rezistence lidského cytomegaloviru při léčbě gancyklovirem u pacientů po alogenní transplantaci hematopoetických buněk – zkušenosti jednoho centra
- Genetický a molekulový podklad vývoja autoimunitného diabetes mellitus
- Hodnocení tvorby biofilmu vybraných patogenů vyskytujících se v potravinářském průmyslu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



