-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Malígne nádory štítnej žľazy u detí
Malignant tumours of thyroid gland in children
Background:
Thyroid nodules are less common among children than among adults. In contrast, thyroid nodules are more often malignant in childhood than in adulthood: in children 26% of thyroid nodules are malignant, while in adults the corresponding value is 5–10%.Methods:
The authors retrospectively analyzed the pediatric patients that were surgically treated for thyroid disease at the Department of ENT and Head and Neck Surgery CU JMF in Martin between 2006–2013. Incidence of malignant disease, indications for surgery and its complications were evaluated.Results:
A total of 1745 patients were surgically treated for thyroid disease at the Department of Otorhinolaryngology, Head and Neck Surgery, Comenius University, Jessenius Faculty of Medicine, Teaching Hospital in Martin, Slovakia from the 1st of January 2006 to the 31st of December 2013. There were 125 patients (7%) in pediatric age goup. Malignant tumours were identified in 26 children (21%). Incidence of malignant tumours was significantly higher in younger children (below 10 years) (p=0.026). Solitary node of thyroid gland was the most often indication for surgery (69 children, 55%), that was caused by malignancy in 15 children (22%). Lymph node enlargement was first sign of malignant disease in 4 children. All children were treated surgically by total thyroidectomy. Lymphadenectomy of central and lateral neck compartment was performed in 28% of children. Postoperative hypocalcaemia was detected in 4 children. Unilateral transient palsy of laryngeal recurrent nerve was present in 1 child. Permanent complications of thyroid surgery were not observed.Conclusion:
Total thyroidectomy is the method of choice in the treatment of malignant tumour of thyroid gland. It is a safe operation with a low incidence of complication. If the lymphatic nodes are affected, the dissection of lymphatic node is indicated.Key words:
malignant tumour, thyroid gland, children, diagnosis, therapy
Autoři: B. Uhliarová 1,2; G. Bugová 1; M. Čiljaková 3; A. Hajtman 1
Působiště autorů: Klinika otorinolaryngológie a chirurgie hlavy a krku, UK JLF a UN, Martinprednosta prof. MUDr. A. Hajtman, PhD. 1; Oddelenie otorinolaryngológie, FNsP F. D. Roosevelta, Banská Bystrica primár MUDr. M. Švec3Klinika detí a dorastu, UK JLF a UN, Martin prednosta prof. MUDr. P. Bánovčin, CSc. 2
Vyšlo v časopise: Čes-slov Pediat 2015; 70 (1): 14-19.
Kategorie: Původní práce
Souhrn
Úvod:
Ochorenia štítnej žľazy sa vyskytujú u 4–7 % dospelej populácie, incidencia u detí sa udáva 0,2–1,8 %. Malígne nádory sú častejšie u detí (26 % tyreopatií) v porovnaní s dospelými (5–10 % tyreopatií).Materiál a metódy:
V práci autori retrospektívne analyzovali pacientov v detskom veku, ktorí boli chirurgicky liečení na Klinike ORL a ChHaK UK JLF a UN v Martine v rokoch 2006–2013 pre ochorenie štítnej žľazy. V sledovanom súbore sledovali incidenciu malígneho ochorenia, indikácie chirurgickej liečby a jej komplikácie.Výsledky:
Na Klinike ORL a ChHaK UK JLF a UNM bolo v rokoch 2006–2013 operovaných 1745 pacientov pre ochorenie štítnej žľazy. 125 pacientov (7 %) bolo v detskom veku. Malígne ochorenia štítnej žľazy diagnostikovali u 26 detí (21 %). U detí v najmladšej vekovej skupine (do 10 rokov) bol signifikantne vyšší výskyt malignity (p = 0,026). Najčastejšou indikáciou na chirurgickú liečbu bol solitárny uzol štítnej žľazy (69 detí, 55 %), ktorý bol podmienený malignitou u 15 detí (22 %). U 4 detí bolo prvým príznakom ochorenia patologické zväčšenie lymfatických uzlín. Všetky deti boli liečené chirurgicky, a to v zmysle totálnej tyreoidektómie, ktorá bola doplnená o resekciu lymfatických uzlín centrálneho a laterálneho kompartmentu u 28 % pacientov. U 4 detí s malígnym ochorením štítnej žľazy autori v pooperačnom období zaznamenali hypokalciémiu. Jednostrannú tranzitórnu parézu návratného nervu malo 1 dieťa. Trvalé komplikácie chirurgickej liečby štítnej žľazy v sledovanom súbore pacientov nezaznamenali.Záver:
Metódou voľby v liečbe malígneho nádoru štítnej žľazy je totálna tyreoidektómia. Ide o bezpečnú operáciu s nízkou incidenciou komplikácií aj u pacientov v detskom veku. V prípade metastatického postihnutia lymfatických uzlín krku je indikovaná bloková disekcia.Klíčová slova:
malígny nádor, štítna žľaza, detský vek, diagnostika, liečbaÚvod
Ochorenia štítnej žľazy (ŠŽ) sa vyskytujú u 4–7 % dospelej populácie, incidencia u detí sa udáva 0,2–1,8 %. Na rozdiel od prevalencie, malígne nádory sú častejšie u detí (26 % tyreopatií) v porovnaní s dospelými (5–10 % tyreopatií) [1]. Najčastejším histopatologickým typom je papilárny karcinóm (80 % všetkých malignít štítnej žľazy), a to u dospelých aj u detí.
K rizikovým faktorom ich vzniku patrí už existujúce ochorenie štítnej žľazy, predchádzajúce ožarovanie oblasti hlavy, krku a mediastina a pozitívna rodinná anamnéza tyreopatie [2].
Materiál a metodika
V práci sme retrospektívne analyzovali súbor 125 pacientov v detskom veku, ktorí boli chirurgicky liečení na Klinike otorinolaryngológie a chirurgie hlavy a krku UK JLF a UN v Martine v rokoch 2006–2013 pre ochorenie štítnej žľazy. V sledovanom súbore sme sledovali incidenciu malígneho ochorenia, indikácie chirurgickej liečby a jej komplikácie. Zamerali sme sa na rizikové faktory vzniku malígneho ochorenia – vek, pohlavie, pozitívna rodinná anamnéza v zmysle tyreopatie, predchádzajúce ožarovanie oblasti hlavy, krku a mediastina a charakter ochorenia štítnej žľazy.
Analýza pacientov podľa veku
Do súboru boli zaradení pacienti v detskom veku, t.j. do 18 rokov + 364 dní. Podľa veku boli pacienti rozdelení do 3 skupín: A. ≤10 rokov, B. 11–14 rokov, C. 15–18 rokov.
Charakter ochorenia štítnej žľazy a indikácie na chirurgickú liečbu
Všetci pacienti boli vyšetrení endokrinológom, ktorý indikoval chirurgickú liečbu. Všetci pacienti mali vyšetrený funkčný (TSH, T3, T4, protilátky) aj morfologický (ultrasonografia) stav ŠŽ.
Typ ochorenia štítnej žľazy sme stanovili na základe histopatologického vyšetrenia. Pri uzlovej degenerácii sme stanovovali veľkosť uzla štítnej žľazy v milimetroch, a to jeho meraním v resekáte štítnej žľazy. Za „de novo“ patológiu ŠŽ sme považovali ochorenie, ktoré bolo endokrinológom indikované na chirurgickú liečbu bez predchádzajúcej konzervatívnej terapie.
V diagnostike malígneho ochorenia ŠŽ sme sledovali indikácie a úspešnosť tenkoihlovej aspiračnej cytológie (FNAC) a peroperačného histopatologického vyšetrenia (POH). Pri viacuzlovej degenerácii parenchýmu bola vzorka na cytologické a peroperačné histologické vyšetrenie odobratá z dominantného uzla a/alebo uzla suspektného z malignity.
Výsledok cytologického vyšetrenia bol hodnotený podľa Bethesda klasifikácie z roku 2010 [3]: I. – nediagnostikovateľná/nedostačujúca vzorka, II. – benígne, III. – atypie neistého významu alebo folikulárne lézie neistého významu, IV. – folikulárna neoplázia alebo podozrenie z folikulárnej neoplázie, V. – podozrenie z malignity, VI. – malignita. Výsledok FNAC sme rozdelili do 3 skupín: A. skupina II, B. skupina III a IV, C. skupina V a VI. Záver peroperačného histopatologického vyšetrenia sme podobne ako v prípade cytológie rozdelili do 3 skupín: A. benígny nález, bez štruktúr konvenčného papilárného karcinómu, B. folikulárna lézia, atypie, nález suspektný z malignity, ale s odkazom na definitívne histopatologické vyšetrenie, C. nález vysoko suspektný z malignity, jednoznačná malignita.
Chirurgická liečba
Všetci pacienti v sledovanom súbore boli liečení chirurgicky. Sledovali sme rozsah chirurgickej liečby u pacientov s malígnym ochorením ŠŽ.
Z komplikácií sme sa zamerali na výskyt hypokalciémie (hodnota celkového kalcia <2,2 mmol/l a ionizovaného kalcia <1,13 mmol/l) a lézie nervus laryngeus recurrens (NLR). Za trvalý sme považovali nález, ktorý pretrvával viac ako 6 mesiacov.
Štatistická analýza
Charakteristiku súboru pacientov a sledované dáta sme vyhodnotili pomocou frekvenčnej sumarizácie a deskriptívnej štatistiky: priemer, medián, smerodajná odchýlka, medián, kvartil minima a maxima. Rozdiely medzi sledovanými parametrami sme vyhodnotili štandardnými neparametrickými testami. Neparametrické metódy sme zvolili preto, že nebol splnený predpoklad parametrických testov, normalita dát.
Pri hodnotení vzťahu kategoriálnych premenných pre dve kategórie binárneho charakteru (áno/nie) sme použili Pearsonov x2-test s Yatesovou koreláciou. Rozdiely sledovaných parametrov medzi sledovanými skupinami pacientov sme vyhodnotili pomocou Mannova-Whitneyho U testu (2 nezávislé kategórie) a Kruskalovho-Wallisovho testu (3 nezávislé kategórie). Na analýzu rozptylu sledovanej hodnoty s prítomnosťou viacerých faktorov sme použili dvojfaktorovú ANOVA s post hoc Duncan testom.
Za štatisticky významné sme v rámci všetkých použitých testov považovali hodnoty hladiny významnosti p <0,05. Na štatistickú analýzu sme použili program STATISTICA Cz 10.
Výsledky
Charakteristika súboru pacientov
Na Klinike ORL a ChHaK UK JLF a UN v Martine bolo v rokoch 2006–2013 operovaných 1745 pacientov pre ochorenie štítnej žľazy. 125 pacientov (7 %) bolo v detskom veku. V súbore bolo 28 chlapcov, priemerný vek 14,5 ± 3,2 rokov (v rozmedzí od 5 do 18 rokov) a 97 dievčat, priemerný vek 15,1 ± 2,9 rokov (v rozmedzí od 2 do 18 rokov).
Malígne ochorenia štítnej žľazy sme diagnostikovali u 26 detí (21 %). Histopatologické typy malígneho ochorenia ŠŽ sú uvedené v tabuľke 1. Rozdiel vo výskyte malignity medzi dievčatami a chlapcami sme nezaznamenali (chlapci 21 %, dievčatá 20 %, p = 0,832). U detí v najmladšej vekovej skupine (do 10 rokov) sme v porovnaní so staršími deťmi zaznamenali signifikantne vyšší výskyt malignity (p = 0,026) (obr. 1). Pozitívna rodinná anamnéza v zmysle tyreopatie bola u 31 % prípadov benígneho a 20 % malígneho ochorenia (p = 0,306). Predchádzajúce ožarovanie oblasti hlavy, krku a mediastina sa v našom súbore pacientov nevyskytovalo.
Tab. 1. Histopatologické typy malígnych nádorov štítnej žľazy. 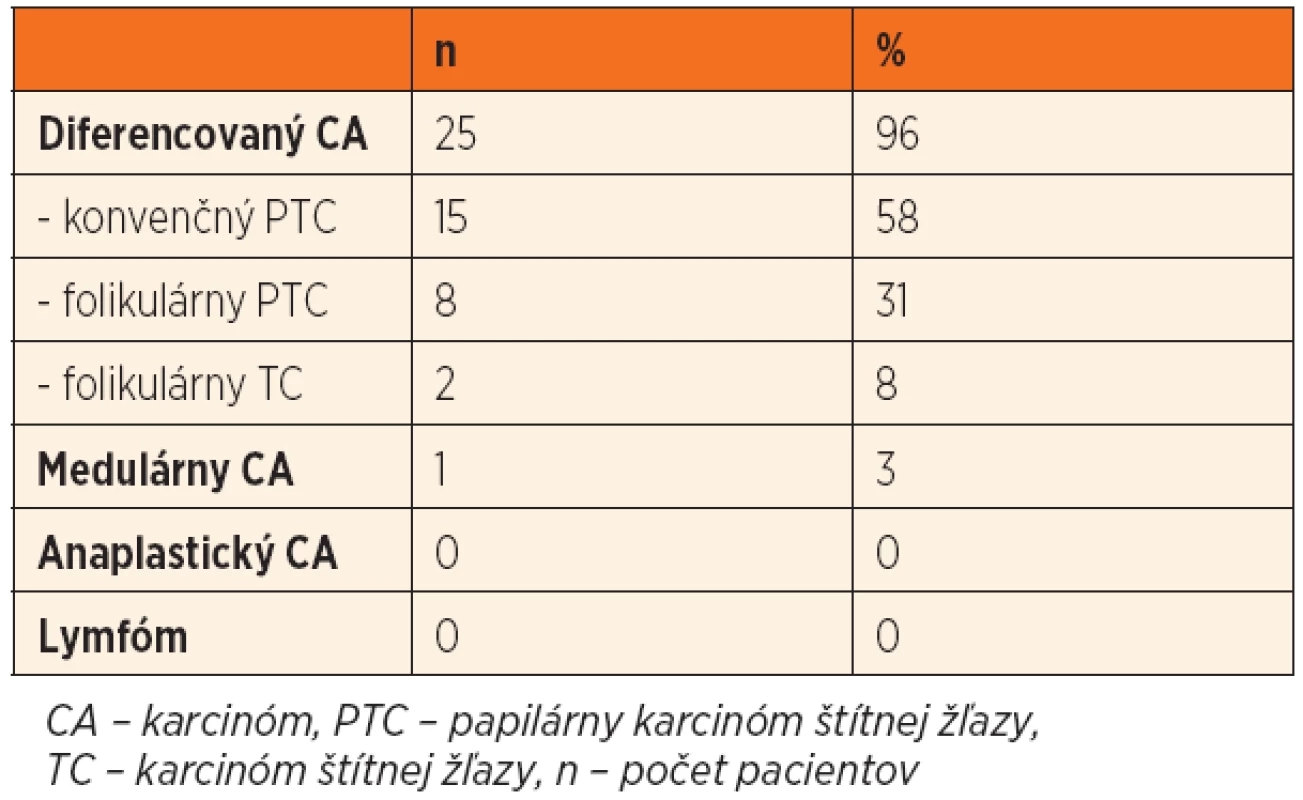
Obr. 1. Výskyt malígneho nádoru štítnej žľazy v jednotlivých vekových skupinách. 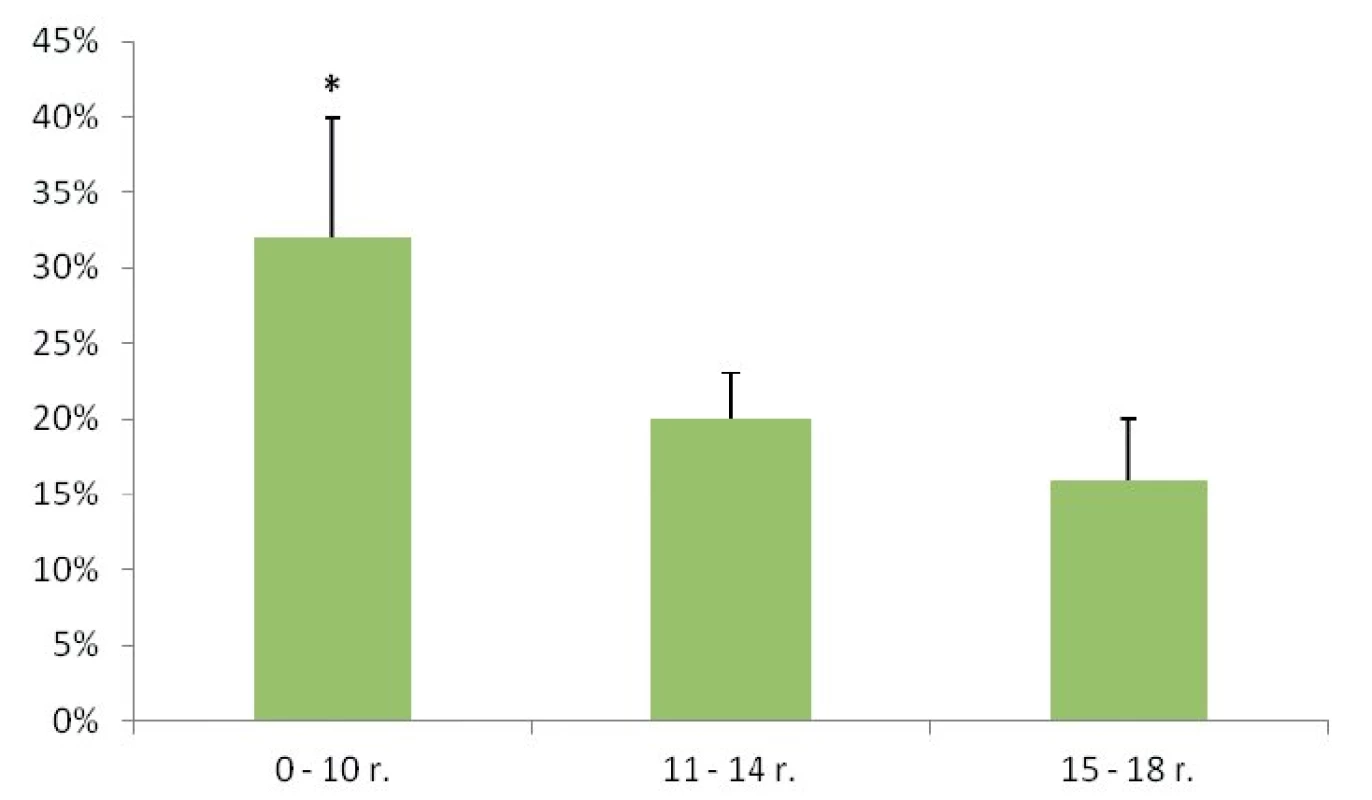
* p < 0,05, údaje sú uvedené ako medián ± SD Indikácie na chirurgickú liečbu ochorenia štítnej žľazy
Najčastejšou indikáciou na chirurgickú liečbu bol solitárny uzol štítnej žľazy (69 detí, 55 %), ktorý bol podmienený malignitou u 15 detí (22 %). U 4 detí bolo prvým príznakom ochorenia patologické zväčšenie lymfatických uzlín krku (tab. 2). Medián veľkosti uzla bol 14 ± 9,3 mm (8–37 mm) u detí s polynodóznou strumou a 22 ± 11,5 mm (8–50 mm) v skupine so solitárnym uzlom (p = 0,003). Signifikantné rozdiely vo veľkosti uzla v prípade malignity v jednotlivých diagnózach sme nezaznamenali (solitárny uzol: p = 0,885, polynodózna struma: p = 0,830) (obr. 2).Indikáciu na chirurgickú liečbu pre „de novo“ ochorenie štítnej žľazy sme detegovali u 41 (33 %) pacientov. Malignita sa u nich vyskytovala v 51 % (p = 0,003).
Tab. 2. Indikácie na chirurgickú liečbu a výskyt malignity v jednotlivých diagnózach. 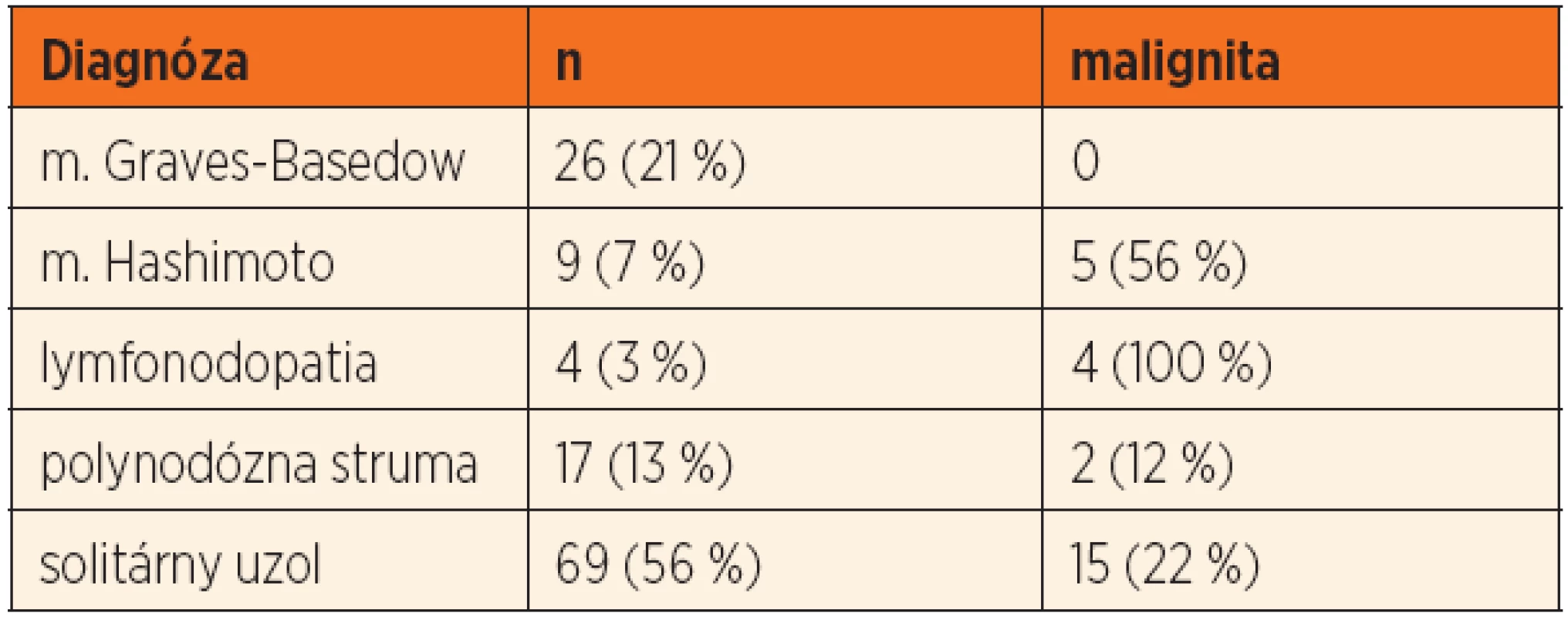
Obr. 2. Rozdiely vo veľkosti uzla v prípade malignity. 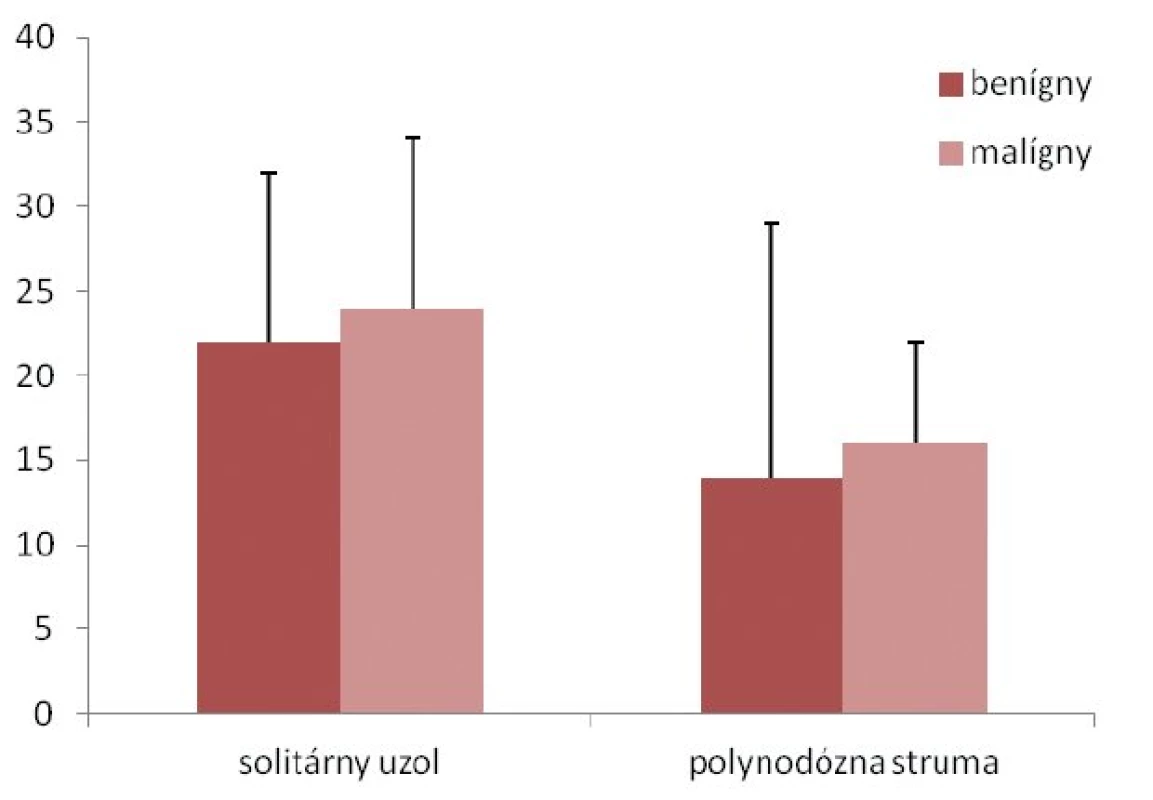
údaje sú uvedené ako medián ± SD Tenkoihlová aspiračná cytológia a peroperačné histopatologické vyšetrenie
V diagnostike malígneho ochorenia ŠŽ bola tenkoihlová aspiračná cytológia realizovaná u 39 detí (31 %) a POH u 71 detí (57 %). Najčastejšou indikáciou na FNAC aj POH bola lymfonodopatia a solitárny uzol (obr. 3). Senzitivita a špecificita FNAC v diagnostike malígneho ochorenia ŠŽ bola 80 %, resp. 91 %. Senzitivita a špecificita POH v diagnostike malígneho ochorenia ŠŽ bola 73 %, resp. 100 % (obr. 4).
Obr. 3. Indikácie FNAC a POH. 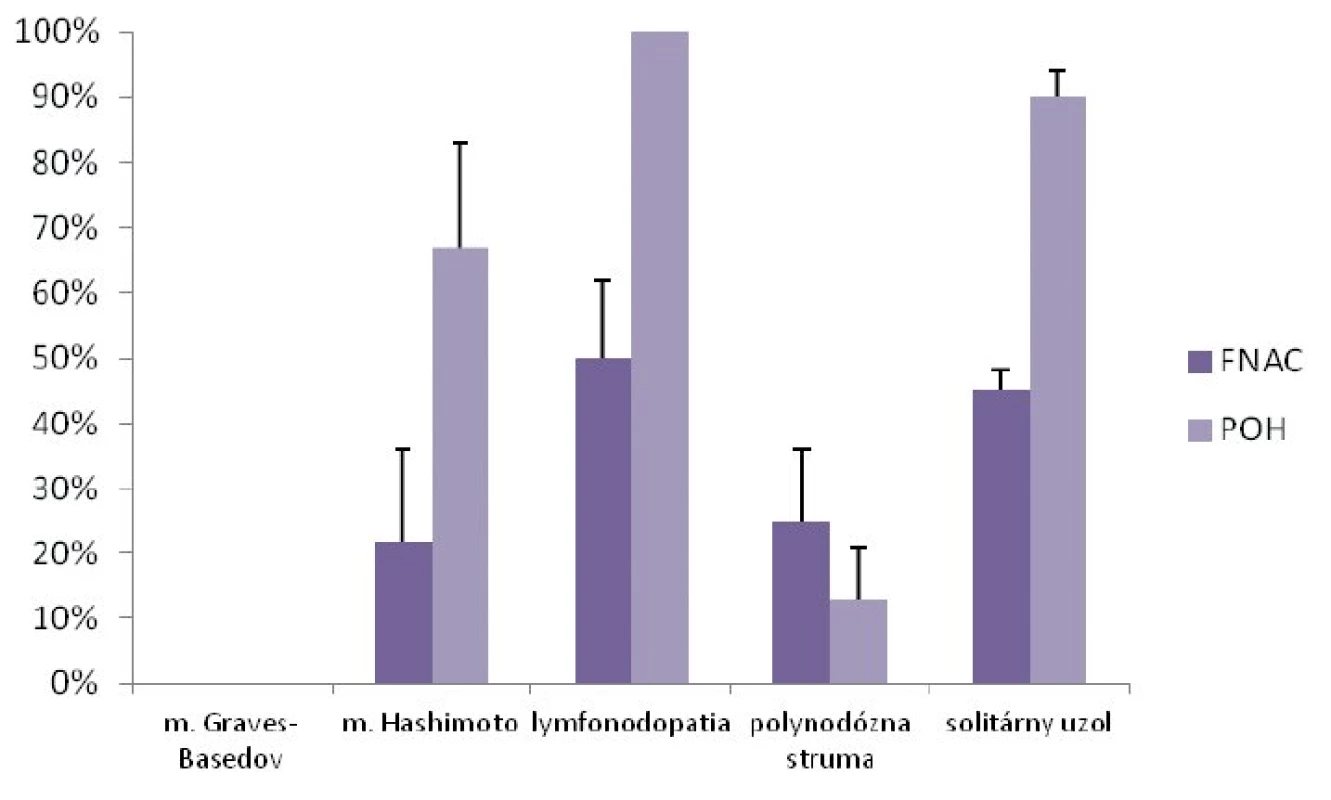
FNAC – tenkoihlová aspiračná cytológia, POH – peroperačné histopatologické vyšetrenie údaje sú uvedené ako medián ± SD Obr. 4. Úspešnosť FNAC a POH v diagnostike uzlov štítnej žľazy. 
FNAC – tenkoihlová aspiračná cytológia, POH – peroperačné histopatologické vyšetrenie skupina A.: benígny nález, bez štruktúr konvenčného papilárného karcinómu, skupina B.: folikulárna lézia, atypie, nález suspektný z malignity, ale s odkazom na definitívne histopatologické vyšetrenie, skupina C.: nález vysoko suspektný z malignity, jednoznačná malignita údaje sú uvedené ako medián ± SD Rozsah chirurgickej liečby a jej komplikácie
Všetci pacienti v sledovanom súbore pacientov boli liečení chirurgicky. Hemityreoidektómia ako primárny chirurgický výkon bola realizovaná u 11 detí (42 %). Všetky tieto deti podstúpili dokončenie tyreoidektómie spolu s revíziou lymfatických uzlín (LU) centrálneho kompartmentu. Medián následnej operácie bol 17 ± 8 dní, v rozmedzí od 12 do 39 dní po prvotnej chirurgickej liečbe. Vo zvyšných prípadoch bola vykonaná totálna tyreoidektómia (TTE) ako primárny chirurgický výkon, a to u 15 % samostatne, u 15 % spolu s revíziou LU centrálneho kompartmentu a u 28 % spolu s resekciou LU centrálneho a laterálneho (level II.–V.) kompartmentu.
U 4 detí s malígnym nádorom ŠŽ sme v pooperačnom období zaznamenali hypokalciémiu, ktorá u 2 bola sprevádzaná aj klinickými prejavmi v zmysle parestézií, ktoré sme riešili konzervatívne. U 1 dieťaťa bola pozorovaná jednostranná tranzitórna paréza návratného nervu, táto bola riešená konzervatívne. Trvalé komplikácie chirurgickej liečby ŠŽ sme v sledovanom súbore pacientov nezaznamenali.
Diskusia
Etiopatogenéza
Malígne nádory štítnej žľazy tvoria 0,5–3 % všetkých nádorov detského veku. Incidencia je vyššia u dievčat ako u chlapcov v pomere 3 : 1 pred 15. rokom a 6 : 1 medzi 15.–19. rokom života [4, 5]. V našom súbore sme rozdiely vo výskyte malignity medzi pohlaviami nezaznamenali. Zaujímavé bolo zistenie, že mladšie deti (do 10 rokov) boli postihnuté častejšie v porovnaní so staršími deťmi, čo je v rozpore s výsledkami iných autorov, ktorí detegovali karcinóm ŠŽ u detí do 10 rokov zriedkavo [2, 4, 5]. Vysvetľujeme si to koncentráciou tyreochirurgie u detských pacientov na našom pracovisku, kedy operujeme aj veľmi malé deti. Najmladšia pacientka v súbore mala iba 2 roky. Staršie deti (nad 12 rokov) sú operované aj na iných pracoviskách, ktoré sa zaoberajú chirur-giou ŠŽ.
Histologicky sa u detí diagnostikuje najčastejšie papilárny a medulárny karcinóm. Folikulárne, anaplastické a ostatné karcinómy sa vyskytujú menej často. Je to prakticky jediná lokalita, kde sa u detí vyskytujú častejšie primárne epitelové karcinómy ako mezenchýmové nádory [6, 7]. Rovnaké výsledky sme zaznamenali aj v našom súbore pacientov.
Etiológia malígnych nádorov štítnej žľazy je multifaktoriálna. Genetická predispozícia je dokázaná u medulárneho karcinómu, ktorý je súčasťou syndrómu mnohopočetnej endokrinnej neoplázie (MEN II) [8], častejšie sa tyreoidálne malignity vyskytujú u pacientov s Pendredovým syndrómom [9], ako aj u detí s pozitívnou rodinnou anamnézou tyreopatie. Deficit jódu, zvýšená hladina TSH a vývojové abnormality patria tiež ku kancerogénnym faktorom. Bola opísaná aj malignita tyreoi-dálneho tkaniva v mediálnej krčnej cyste [2].
Jedným z dokázaných exogénnych rizikových faktorov spôsobujúcich malígny zvrat tyreoidálnej bunky je rádioaktívne žiarenie. Štítna žľaza detí je v porovnaní s dospelými oveľa citlivejšia na karcinogénne účinky ionizujúceho žiarenia. Jedným z vysvetlení tohto zaujímavého biologického javu je zistenie, že tyreocyty v dospelosti majú oveľa nižšiu schopnosť delenia v porovnaní s mladšími vekovými skupinami. Prenos radiačne indukovaných mutácií do ďalšej generácie buniek je preto menej pravdepodobný vo vyšších vekových skupinách [10, 11, 12].
Negatívny efekt radiačného žiarenia v patogenéze malígnych nádorov ŠŽ dokazuje havária jadrovej elektrárne Černobyľ v roku 1986. Incidencia malígnych nádorov ŠŽ u detí sa zvýšila z 0,1–0,3/100 000 pred haváriou na 3,3–13,5/100 000 v rokoch 1990–1996 [13, 14, 15].
V súčasnosti sa s anamnézou radiačnej záťaže v oblasti hlavy, krku a mediastína stretávame u detí, ktoré boli liečené rádioterapiou pre malignitu v danej lokalite. Riziko rakoviny štítnej žľazy sa zvyšuje paralelne s radiačnou dávkou do 20–29 Gy, ale pri vyšších dávkach klesá [11]. Aj chemoterapia môže pôsobiť na tyreocyty karcinogénne [16].
Zo sledovaných rizikových faktorov sme nezaznamenali rozdiely v ich výskyte medzi benígnymi a malígnymi ochoreniami štítnej žľazy. Všetky deti boli zdravé, bez vývojových abnormalít, bez expozície radiačného žiarenia. Tyreopatia v rodine sa vyskytovala bez významného rozdielu u detí s benígnym aj malígnym ochorením štítnej žľazy. V našom súbore bolo 1 dieťa so syndrómom MEN II, u ktorého bola vykonaná tyreoidektómia s potvrdením ložiska medulárneho karcinómu v laloku štítnej žľazy.
Diagnostika a liečba
Klinicky sa malígny nádor v štítnej žľaze prejavuje ako uzol. Riziko malignity v solitárnej uzlovej strume je 5–10 % u dospelých a až 20 % u detí [17]. Preto je potrebné každú uzlovú strumu, predovšetkým v detskom veku považovať za potenciálnu malignitu. Donedávna rozšírený názor, že v multinodóznej strume je oveľa nižšia pravdepodobnosť výskytu zhubného nádoru ako v solitárnom uzle, neplatí. Pacienti s viacuzlovou strumou majú rovnaké riziko malignity ako pacienti so solitárnym uzlom [18].V našom súbore sme malignitu diagnostikovali u 22 % solitárnych uzlov a 12 % pri polynodóznej prestavbe ŠŽ. Zaujímavý bol nález vysokej incidencie malignity v teréne Hashimotovej tyreoiditídy, ktorá je charakterizovaná aj polynodóznou prestavbou parenchýmu štítnej žľazy. Podobné výsledky zaznamenali aj iní autori [19, 20].
U detí sa v porovnaní s dospelými malígny nádor častejšie diagnostikuje v pokročilejšom štádiu ochorenia. U 30–50 % detí býva prvým príznakom zväčšenie lymfatických uzlín krku, častejší je aj výskyt pľúcnych metastáz [21, 22]. V sledovanom súbore u 4 detí (15 %) bolo prvým príznakom malígneho nádoru ŠŽ zväčšenie lymfatických uzlín na krku. Metastázy do LU krku sme detegovali u 7 (28 %) detí.
Diagnostika chorôb štítnej žľazy zahŕňa funkčné (endokrinologické) a morfologické (sonografické) vyšetrenie. V predoperačnej diagnostike uzlov ŠŽ má významné postavenie aspiračná cytológia. Úspešnosť FNAC u detí je 75–95 %, čo je porovnateľné s dospelými pacientmi [6]. Aj v našom súbore detských pacientov sme zaznamenali vysokú senzitivitu a špecificitu FNAC v diagnostike malígnych nádorov. Falošne negatívny výsledok sme detegovali u 1 a falošne pozitívny u 2 detí. Dôležitou otázkou však ostáva, či je aspiračná cytológia naozaj najdôležitejšou metódou v detekcii malignity ŠŽ. Diagnostická výpovednosť tohto vyšetrenia je limitovaná predovšetkým u pacientov s folikulárnou proliferáciou – skupina III. podľa Bethesda klasifikácie [23]. Je vhodná pri zvažovaní chirurgického výkonu, čomu zodpovedá aj relatívne nízky počet FNAC v predoperačnej diagnostike uzlov ŠŽ v našom súbore pacientov liečených chirurgicky. Všetkým deťom v našom súbore bola štítna žľaza vyšetrená sonograficky. Aspiračná cytológia bola vykonaná u 31 % detí. Najčastejším dôvodom jej nevykonania bol nesúhlas rodičov, potreba celkovej anestézie pre nespoluprácu u veľmi malých detí, multinodózna struma a uzol menší ako 1 cm. Ak je indikovaná chirurgická liečba – progresia rastu uzla, pozitívna rodinná anamnéza malígneho nádoru štítnej žľazy, preferujeme peroperačné histopatologické vyšetrenie a FNAC neindikujeme. POH bolo vykonané u 72 % detí s uzlovou prestavbou ŠŽ. Falošne negatívny výsledok bol u 3 detí, falošne pozitívny sme nezaznamenali. Aj keď je peroperačné histopatologické vyšetrenie nádorov štítnej žľazy problematické, malo by sa robiť aspoň na pracoviskách, kde sa koncentruje operatíva pacientov s uzlovou strumou. Výsledok tohto vyšetrenia často zjednoduší a zefektívni operačný postup. Zníži sa najmä počet reoperácií a tým aj výskyt možných operačných komplikácií. Podobný manažment je aj na iných pracoviskách [24, 25].
Definitívne slovo v diferenciálnej diagnostike uzlovej strumy má však až histopatologické vyšetrenie. Operačný výkon na štítnej žľazy indikuje po komplexnom vyšetrení zásadne endokrinológ, ktorý určuje aj jeho predbežný rozsah. Liečba malígneho ochorenia ŠŽ u detí sa nelíši od jeho liečby u dospelých pacientov. Ak výsledok cytologického vyšetrenia jednoznačne potvrdí malignitu (napr. papilokarcinómu), môže sa priamo indikovať TTE. Častejšie sa však indikuje parciálny výkon v zmysle hemityreoidektómie (resekcia laloka spolu s istmom ŠŽ), lobektómie (resekcia laloka ŠŽ), event. istmektómie (resekcia istmu ŠŽ). Ďalší postup závisí od výsledku rýchleho peroperačného a/alebo definitívneho histopatologického vyšetrenia. Ak sa peroperačne potvrdí malignita, tak sa vykonáva totálna tyroidektómia. Ak sa malignita potvrdí až definitívnym histologickým vyšetrením, vykoná sa lobektómia na druhej strane (dokončenie tyreoidektómie). Pri negatívnom histopatologickom vyšetrení v zmysle malignity sa kontralaterálny lalok ponecháva [7, 26, 27].
Ak sa predoperačnými a/alebo peroperačnými vyšetreniami dokážu evidentne zväčšené LU (8 mm a viac v najväčšom rozmere uzliny) v centrálnom kompartmente, vykonáva sa terapeutická lymfadenektómia (odstránenie LU spolu s tukovo-fibróznym tkanivom) tejto oblasti (pretracheálne, prelaryngeálne, paratracheálne a para-ezofageálne lymfatické uzliny). Pokiaľ sa dokážu zväčšené LU aj v laterálnych kompartmentoch (pozdĺž v. jugularis interna), vykonáva sa modifikovaná krčná disekcia LU, pri ktorej sa okrem centrálnej lymfadenektómie odstraňujú aj LU spolu s okolitým tukovým a väzivovým tkanivom z jugulárnej oblasti, pričom sa zachováva musculus sternocleidomastoideus, nervus accessorius a vena jugularis interna [27, 28].
Názory na profylaktickú centrálnu lymfadenektómiu (PCLE) – situácia, že pacient nemá teda zväčšené lymfatické uzliny, sú aj v súčasnosti rozdielne. PCLE patrí medzi najkontroverznejšie témy v celej tyreochirurgii a v poslednej dekáde je jej význam predmetom rozsiahleho skúmania. Hlavným dôvodom kontroverzie je, že PCLE so sebou prináša vyššie riziko komplikácií ako samotná TTE. Centrálna lymfadenektómia si vyžaduje preparáciu návratného nervu (NLR) v celom krčnom priebehu, takže pravdepodobnosť poranenia je väčšia, ako keď sa preparuje iba krátky úsek (pri samotnej TTE). Jemnou preparáciou sa dá toto riziko znížiť, ale hrozba poškodenia prištítnych teliesok (PT) je dosť vysoká. Tukovo-fibrózne tkanivo, v ktorom sú uložené lymfatické uzliny, sa odstraňuje en bloc, takže môže dôjsť aj k odstráneniu dolných PT (ich lokalizácia je variabilná, a ak sú malé, môžu sa zameniť s lymfatickými uzlinami). Incidencia trvalej hypoparatyreózy po PCLE sa podľa literárnych údajov pohybuje v rozmedzí 0–14,3 % [29]. Zástancovia profylaktickej centrálnej lymfadenektómie (pri každom papilárnom karcinóme, s výnimkou mikrokarcinómu) tvrdia, že znižuje riziko lokálnej recidívy tým, že odstraňuje jej potenciálne zdroje, zvyšuje presnosť „stagingu“, čím pomáha aj pri rozhodovaní o liečbe rádiojódom, znižuje pravdepodobnosť reoperácie, ktorá je spojená s vyšším rizikom komplikácií a presnejšie dokáže v rámci dispenzarizácie detegovať lokálnu recidívu alebo metastázy na základe hodnôt stimulovaného tyreoglobulínu [27, 28, 30].
Napriek týmto dôvodom mnoho autorov vo svojich referenciách publikovaných v ostatných piatich rokoch rutinnú PCLE pri diferencovanom karcinóme štítnej žľazy odmieta, pričom argumentujú viacerými faktami. Jednak je to skutočnosť, že tento výkon výrazne neredukuje výskyt lokálnej recidívy [31, 32] a okrem toho doteraz nie je dokázané, že PCLE zlepšuje dlhodobé karcinóm-špecifické prežívanie [29]. Autori odmietajúci PCLE poukazujú tiež na skutočnosť, že na elimináciu mikrometastáz sa s úspechom využíva rádiojód. Liečba rádiojódom 131I je základnou adjuvantnou liečebnou modalitou u chorých s nádorom akumulujúcim jód. Zahajuje sa 6–8 týždňov po operácii, keď je pacient v hypotyreóze a sú optimálne podmienky pre akumuláciu rádiojódu. Pôsobením beta a gama žiarenia dochádza na jednej strane k tyreodeštrukcii, na strane druhej sa pri scintigrafickom vyšetrení zobrazí prípadné reziduum, eventuálne mikrometastáza v LU. Ak nádor neakumuluje jód, doplnkovou liečebnou modalitou je externá rádioterapia. Chemoterapia má význam v liečbe lymfómov a metastáz vzdialených nádorov do štítnej žľazy. Adjuvantnú liečbu indikuje vždy endokrinológ na základe predoperačných vyšetrení, operačného nálezu a výsledku histopatologického vyšetrenia [7].
Na našom pracovisku vykonávame u všetkých pa-cientov s malígnym nádorom ŠŽ TTE spolu s revíziou LU centrálneho kompartmentu. Lymfadenektómiu vykonávame iba v prípade zväčšených LU. Výnimku tvoria pacienti, ktorým bola vykonaná TTE pre pôvodne benígne ochorenie a malígny nádor sa dokázal až definitívnym histopatologickým vyšetrením. Ak sa sonografickým vyšetrením nedokáže zväčšenie LU, neindikujeme reoperáciu v zmysle revízie LU centrálneho a laterálneho kompartmentu. Výskyt komplikácií v našom súbore pacientov sa nelíšil medzi jednotlivými typmi operácií (TTE vs. TTE + lymfadenektómia centrálneho kompartmentu vs. TTE + lymfadenektómia centrálneho kompartmentu + laterálneho kompartmentu).
Záver
Choroby štítnej žľazy u detí sú zriedkavé, avšak až u 20 % sú podmienené malignitou. Zhubný nádor je častejší u detí do veku 10 rokov. Najčastejším histopatologickým typom je papilárny karcinóm, ktorý sa prejavuje ako solitárny uzol ŠŽ, ale často vzniká v teréne multinodóznej prestavby parenchýmu ŠŽ, predovšetkým u chorých s Hashimotovou tyreoiditídou.
V diferenciálnej diagnostike uzlov ŠŽ má dôležitú úlohu sonografické vyšetrenie, aspiračná cytológia a peroperačné histopatologické vyšetrenie.
Metódou voľby v liečbe malignity štítnej žľazy je totálna tyreoidektómia. Ide o bezpečnú operáciu s nízkou incidenciou komplikácií aj u pacientov v detskom veku. Ak sú chorobou postihnuté aj LU, tak je indikovaná bloková disekcia. U chorých s jód akumulujúcim nádorom je dôležitou súčasťou liečby adjuvantná terapia rádiojódom.
Došlo: 21. 10. 2014
Přijato: 18. 12. 2014
MUDr. Barbora Uhliarová, PhD.
ORL oddelenie
FNsP F. D. Roosevelta
Nam. L. Svobodu 1
974 01 Banská Bystrica
Slovenská republika
e-mail: b.uhliarova@gmail.com
Zdroje
1. Niedziela M. Pathogenesis, diagnosis and management of thyroid nodules in children. Endocr Relat Cancer 2006; 13 : 427.
2. Corrias A, Mussa A. Thyroid nodules in pediatrics: Which ones can be left alone, which ones must be investigated, when and how. J Clin Res Pediatr Endocrinol 2013; 5 (Suppl 1): 57–69.
3. Dušková J. Nový systém pro sjednocené hodnocení tenkojehlových aspiračních biopsií štítné žlázy – Bethesda 2010. Cesk Patol 2011; 47 (1): 8–14
4. Halac I, Zimmerman D. Thyroid nodules and cancers in children. Endocrinol Metab Clin North Am 2005; 34 : 725–744.
5. Dean DS, Gharib H. Epidemiology of thyroid nodules. Best Pract Res Clin Endocrinol Metab 2008; 22 : 901–911.
6. Corrias A, Mussa A, Baronio F, et al. Diagnostic features of thyroid nodules in pediatrics. Arch Pediatr Adolesc Med 2010; 164 : 714–719.
7. Janoušek P, Kabelka Z, Betka J, et al. Chirurgická léčba maligních nádorů štítné žlázy u dĕtí. Otorinolaryngol Foniat 2006; 55 : 168–173.
8. Jackson MB, Guttenberg M, Hedrick H, Moshang T Jr. Multiple endocrine neoplasia type 2A in a kindred with C634Y mutation. Pediatrics 2005; 116 (3): 468–671.
9. Massa G, Jaenen N, de Varebeke SJ, et al. Solitary thyroid nodule as presenting symptom of Pendred syndrome caused by a novel splice-site mutation in intron 8 of the SLC26A4 gene. Eur J Pediatr 2003; 162 (10): 674–677.
10. Jarzab B, Handkiewicz-Junak D, Wloch I. Juvenile differentiated carcinoma and the role of radioiodine in its treatment: a qualitative review. Endocr Relat Cancer 2005; 12 : 773–803.
11. Sigurdson AJ, Ronckers CM, Mertens AC, et al. Primary thyroid cancer after a first tumors in childhood (the Childhood Cancer Survivor Study): a nested case control study. Lancet 2005; 365 : 2014–2023.
12. Duffy BJ Jr, Fitzgerald PJ. Thyroid cancer in childhood and adolescence; a report on 28 cases. Cancer 1950; 3 : 1018–1032.
13. Rabes HM, Demidchik EP, Sidorow JD, et al. Pattern of radiation-induced RET and NTRK1 rearrangements in 191 post-chernobyl papillary thyroid carcinomas: biological, phenotypic, and clinical implications. Clin Cancer Res 2000; 6 : 1093–1103.
14. Nikiforov Y, Gnepp DR. Pediatric thyroid cancer after the Chernobyl disaster. Pathomorphological study of 84 cases (1991–1992) from the Republic of Belarus. Cancer 1994; 74 : 748–766.
15. Pacini F, Vorontsova T, Demidchik EP, et al. Post-Chernobyl thyroid carcinoma in Belarus children and adolescents: comparison with naturally occurring thyroid carcinoma in Italy and France. J Clin Endocrinol Metab 1997; 82 : 3563–3569.
16. Cohen A, Rovelli A, Merlo DF, et al. Risk for secondary thyroid carcinoma after hematopoietic stem-cell transplantation: an EBMT Late Effects Working Party Study. J Clin Oncol 2007; 25 : 2449–2454.
17. Venhačova J. Uzly ve štítné žláze. Pediatrie pro praxi 2002; 3 : 122–123.
18. Wartofsky L, Van Nostrand D (Eds). Thyroid Cancer. A Comprehensive Guide to Clinical Management. Totowa: Humana Press, 2006 : 1–709.
19. Koibuchi H, Omoto K, Fukushima N, et al. Coexistence of papillary thyroid cancer and Hashimoto thyroiditis in children: report of 3 cases. J Ultrasound Med 2014; 33 (7): 1299–1303.
20. Anand A, Singh KR, Kushwaha JK, et al. Papillary thyroid cancer and Hashimoto‘s thyroiditis: An association less understood. Indian J Surg Oncol 2014; 5 (3): 199–204.
21. Piciu D, Piciu A, Irimie A. Thyroid cancer in children: a 20-year study at a Romanian oncology institute. Endocr J 2012; 59 (6): 489–496.
22. Grigsby PW, Gal-or A, Michalski JM, Doherty GM. Childhood and adolescent thyroid carcinoma. Cancer 2002; 95 : 724–729.
23. Peli M, Capalbo E, Lovisatti M, et al. Ultrasound guided fine-needle aspiration biopsy of thyroid nodules: guidelines and recommendations vs clinical practice; a 12–month study of 89 patients. J Ultrasound 2012; 15 : 102–107.
24. Jamil F, McNally RJ, Richardson D, et al. High likelihood of malignancy in young patients presenting with a thyroid nodule in Northern England. Clin Endocrinol (Oxf) 2013; 79 (2): 294–295.
25. Saavedra J, Deladoëy J, Saint-Vil D, et al. Is ultrasonography useful in predicting thyroid cancer in children with thyroid nodules and apparently benign cytopathologic features? Horm Res Paediatr 2011; 75 (4): 269–275.
26. Brychta I. Papilárny karcinóm štítnej žľazy – kontroverzie pokračujú. Slov chir 2012; 9 (3): 98–101.
27. Podoba J, Králik R, Borovičová F, a kol. Štandardné postupy v manažmente karcinómu štítnej žľazy v Onkologickom ústave sv. Alžbety v Bratislave. Onkológia (Bratisl) 2008; 3 (3): 152–163.
28. Králik R, Straka V, Marek V, a kol. Centrálna krčná disekcia lymfatických uzlín v liečbe diferencovaného karcinómu štítnej žľazy – naše skúsenosti. Rozhl Chir 2008; 87 (3): 149–153.
29. Carling T, Carty SE, Ciarleglio MM, et al. American thyroid association. Surgical affairs committee. American thyroid association design and feasibility of a prospective randomized controlled trial of prophylactic central lymph node dissection for papillary thyroid carcinoma. Thyroid 2012; 22 (3): 237–244.
30. Moo TA, McGill J, Allendorf J, et al. Impact of prophylactic central neck lymph node dissection on early recurrence in papillary thyroid carcinoma. World J Surg 2010; 34 (6): 1187–1191.
31. Zetoune T, Keutgen X, Buitrago D, et al. Prophylactic central neck dissection and local recurrence in papillary thyroid cancer: a meta-analysis. Ann Surg Oncol 2010; 17 (12): 3287–3293.
32. Forest VI, Clark JR, Ebrahimi A, et al. Central compartment dissection in thyroid papillary carcinoma. Ann Surg 2011; 253 (1): 123–130.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2015 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Malígne nádory štítnej žľazy u detí
- Poranění periferních nervů u dětí a mladistvých
- Pseudo-Bartterov syndróm ako prvý prejav cystickej fibrózy
- Endoteliální dysfunkce u dětí s Crohnovou chorobou – kombinovaný diagnostický přístup
- Rabdomyolýza po nadmernej telesnej námahe vo fitnes centre
- Praktický lékař pro děti a dorost (PLDD) a jeho možnosti poskytování služeb dětskému a dorostovému pacientovi
- Syndrom renálních cyst a diabetu (RCAD) – druhá nejčastější příčina ledvinných cyst u dětí
- Cizí tělesa v gastrointestinálním traktu
- Hemateméza
- Krev ve stolici
- Management průduškového astmatu u dětí podle ICON
- Odpověď na diskusní příspěvek MUDr. Jiřího Nováka
- DORASTOVÉ LEKÁRSTVO
- Otevřený dopis praktickým lékařkám a lékařům pro děti a dorost
-
Jak velký je zájem/nezájem o pediatrickou primární péči?
Je v popředí vůle/nevůle ji posílit a zefektivnit? -
Rubén Bild, Iván Goméz:
An Unwanted Journey (Nechcenou cestou). - Alergie na betalaktamová antibiotika v dětském věku
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Krev ve stolici
- Hemateméza
- Rabdomyolýza po nadmernej telesnej námahe vo fitnes centre
- Praktický lékař pro děti a dorost (PLDD) a jeho možnosti poskytování služeb dětskému a dorostovému pacientovi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



