-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pánevní neuropatická bolest (diferenciální diagnostika)
Pelvic neuropathic pain (differential diagnosis)
Objective: General practitioners, surgeons, neurologists, urologists and gynecologists all encounter patients suffering from neurogenic pelvic pain. Correct management demands knowledge from all above mentioned specialties. The primary goal is to help patients suffering from chronic or acute pelvic pain coupled with functional disorders like dysuria, urgency, dyspareunia, mobility disorders orhypoesthesia. Neurogenic defects are not the most common etiology for either of listed symptoms. However, after exclusion of the more common ones and failure to respond to basic therapeutic methods such as physiotherapy or analgotheraphy doctors tend to mark the illness as idiopathic and incurable. The goal of this review is to show the most common nosological units and a robust diagnostic algorithm to describe the type and level of the damage. Methods: Review of literature using databases Pubmed, Science direct, Medline and sources of the international school of neuropelveology. Conclusion: Over a lifetime, one in seven women will suffer from chronic pelvic pain. Outside of the cases where a clear postoperative etiology is established, the time to make a correct diagnosis is often long for the unspecific and varied symptomatology. Neuropelveological diagnostic algorithm is demonstrably efficient in shortening the time to diagnosis and more importantly to the treatment.
Keywords:
chronic pelvic pain – pudendal neuralgia – neuropelveology – decompression and neurolysis – pelvic congestion syndromes
Autoři: Fučík T.; Mašata J.
Působiště autorů: Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Ceska Gynekol 2021; 86(4): 279-283
Kategorie: Přehledový článek
doi: https://doi.org/10.48095/cccg2021279Souhrn
Cíl: S pacienty s příznaky pánevní neuropatické bolesti se setkávají obvodní lékaři, chirurgové, urologové, neurologové a gynekologové. Správná diagnostika vyžaduje specifické znalosti ze všech zmíněných oborů. Zaměřujeme se na pacienty, kteří trpí chronickou i akutní pánevní bolestí s přidruženými funkčními poruchami, jako jsou dysurie, urgence, dyspareunie, poruchy mobility končetin či hypestezie. Žádný z těchto příznaků nemá neurogenní postižení jako nejčastější příčinu. Po vyloučení běžných etiologií a špatné odpovědi na konvenční způsoby léčby jako fyzioterapie a analgoterapie se ošetřující lékaři často v diagnostickém procesu zastaví a označí onemocnění za idiopatické a neléčitelné. Cílem tohoto článku je představit nejčastější nozologické jednotky a robustní diagnostický algoritmus, který má za cíl přesně popsat typ a úroveň postižení. Metodika: Literární rešerše databáze Pubmed, Science direct, Medline a zdrojů mezinárodní neuropelveologické školy. Závěr: Chronická pánevní bolest postihne během života až sedminu žen. Diagnostika je mimo případy evidentní pooperační etiologie často zdlouhavá a nepřesná pro nespecifickou symptomatiku. Neuropelveologický diagnostický algoritmus prokazatelně zkracuje dobu stanovení správné diagnózy, a tím i léčebné intervence.
Klíčová slova:
chronická pánevní bolest – pudendální neuralgie – neuropelveologie – dekomprese a neurolýza – syndrom pánevní kongesce
Úvod
Chronická pánevní bolest (CPP – chronic pelvic pain) je onemocnění, které postiženým ženám výrazně snižuje kvalitu života, pracovní produktivitu a klade velké nároky na primární poskytovatele zdravotní péče. Nejčastěji tento syndrom zahrnuje závažnou dysmenoreu s prevalencí 12–14 %, dyspareunii s prevalencí 8–21 % a necyklickou pánevní bolest s prevalencí 2–24 % [1]. Také bolest v oblasti lumbální páteře s iradiací do pánve a dolních končetin bez jasného ložiskového neurologického postižení je v běžné populaci poměrně častá (celoživotní prevalence 60–70 %, jednoletá 15–45 % dle Světové zdravotnické organizace) [2]. Zdaleka nejčastější příčinou jsou postižení míchy a páteřního kanálu. Ale ve specifických populacích žen po laparoskopických operacích, s endometriózou či po závažných zánětech v oblasti pánve je výrazně častěji příčinou postižení pánevních nervů [3].
Inervace pánevních struktur
Rozlišujeme dráhy senzitivní a motorické. Motorické mají axony vedoucí z centrální nervové soustavy (CNS – central nervous system) do efektorových orgánů na periferii, dělíme je dle cílových struktur na somatomotorické vycházející z předních kořenů míšních a visceromotorické. Visceromotorické dělíme na vycházející ze sympatiku (přední kořeny míšních nervů T1–L2) a parasympatické (přední kořeny míšních nervů S2–S4/S5). Senzitivní neurony mají axony vedoucí z periferie do CNS a zajišťují příjem informací z těla a okolního prostředí. Rozlišujeme viscerosenzitivní, somatosenzitivní a senzorické, které zaznamenávají vjemy doteku, vibrací, pozice končetin, tepla, chladu a bolesti.
Vzhledem k častým anastomózám a větvení nervů v oblasti pánve je výše uvedené dělení značně nepřesné. Přesto se můžeme orientovat podle hlavních jednotek, kterými jsou sakrální plexus, hypogastrické plexy s přidruženými splanchnickými nervy a lumbální plexus [3,4].
1. Sakrální plexus tvoří lumbosakrální truncus a ventrální větvě sakrálních míšních nervů. Vystupuje z něj nervus gluteus superior et inferior, nervus cutaneus femoris posterior, nervus ischiadicus, nervus pudendus. Parasympatické nervi splanchnicii inervují colon descendens, rektum, močový měchýř a pohlavní orgány.
2. Plexus hypogastricus superior je pokračováním plexus aorticus abdominalis. Vychází z něj dva hypogastrické nervy, které se sakrálními a pelvickými splanchnickými nervy tvoří plexus hypogastricus inferior. Párová struktura u žen se nachází po stranách dorzokraniální části pochvy a přidruženého rekta.
3. Lumbální plexus tvoří čtyři lumbální nervy (L1–L4) a nervus subcostalis. Několik z jeho větví inervuje struktury pánve a jsou přístupné během laparoskopických operací. Jedná se o nervus iliohypogastricus (T12, L1), nervus ilioinguinalis (L1), nervus genitofemoralis (L1, L2), nervus cutaneus femoris lateralis (L2, L3), nervus obturatorius (L2–L4) a nervus femoralis (L1–L4).
Diagnostický algoritmus
Jako první musíme rozhodnout, zda se jedná o somatickou nebo viscerální bolest. Somatická bolest je nejčastěji způsobena postižením sakrálního plexu a jeho větví. Pacienti ji často popisují jako pálení či bodání, „mravenčení“ či ochabnutí příslušných svalů. Mohou ji doprovázet funkční postižení jako sexuální dysfunkce a omezení pohyblivosti končetin. Viscerální bolest je popisována jako tupá, nepřesně lokalizovaná, s pocitem slabosti nebo tlaku, což odpovídá síťovité struktuře viscerální inervace pánevních struktur. Často je doprovázena vegetativními symptomy, jako je nevolnost, zvracení, bledost, tachykardie či pocení. Dalším krokem je určit, které nervové struktury jsou postižené a v jaké úrovni.
Somatické senzitivní nervy inervují dané dermatomy. Tedy z primární postižené oblasti lze odvodit postižený nerv/míšní kořen (obr. 1–3): dorzální strana stehna (S1, S2), perigenitálně, perianálně a na perineu (S3, S4), na hýždích (S1–S3), v oblasti lumbálních dermatomů (L5, S1), na vnitřní straně stehna (nervus obturatorius), zevní a přední strana stehna (nervus femoralis). Léze pudendálního nervu se projevuje izolovanou ipsilaterální bolestí v oblasti vulvy, perianálně a perigenitálně bez projevů inkontinence, pokud není postižení oboustranné [5]. Sakrální radikulopatie mohou mít projevy smíšené jako pudendální bolest (S3, S4), ischias (L5, S1, S2), hýžďová bolest (S1–S3), bolest v bederní oblasti (L5, S1, S2). Čím více dermatomů je postiženo, tím kraniálněji je postižení, a pokud soubor příznaků anatomicky neodpovídá průběhu nervů, je důležité pomyslet na centrální příčinu jako roztroušenou sklerózu či neuroboreliózu.
Obr. 1. Dermatomy dolních končetin, pohled zepředu.
Fig. 1. Dermatomes of the lower limbs, front view.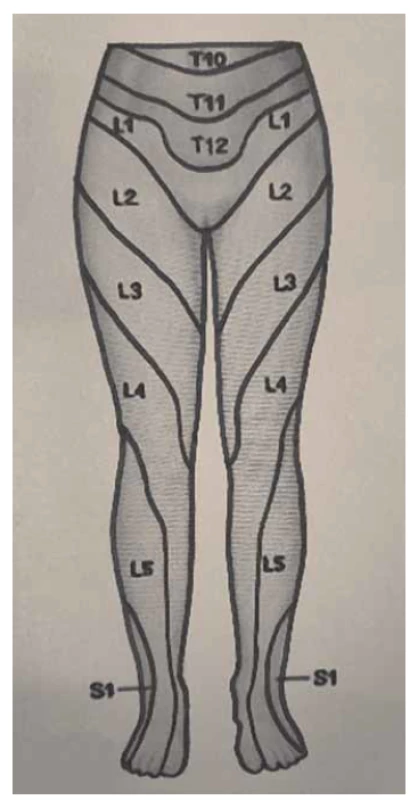
Obr. 2. Dermatomy dolních končetin, pohled zezadu.
Fig. 2. Dermatomes of the lower limbs, rear view.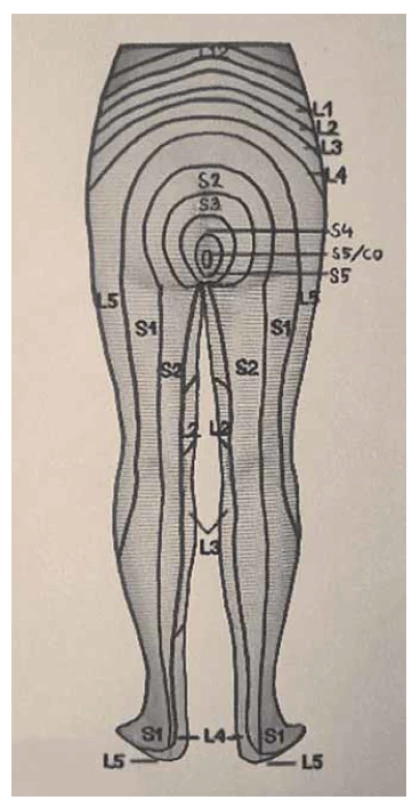
Obr. 3. Dermatomy perineální oblasti.
Fig. 3. Dermatomes of the perineal region.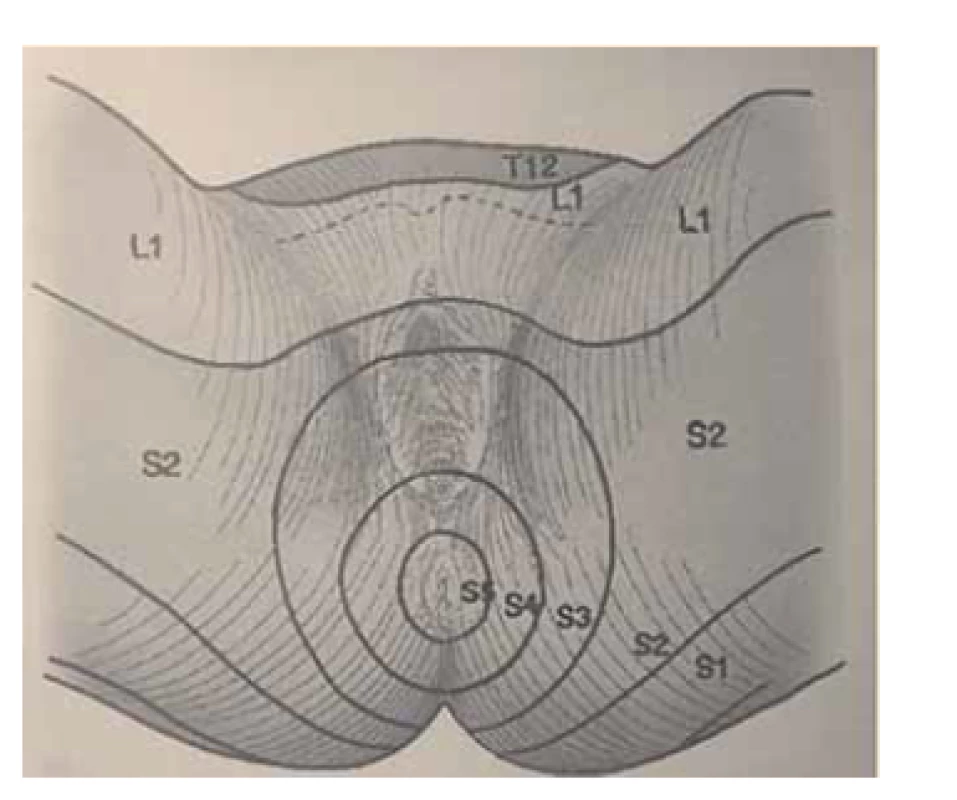
Klíčová je anamnéza předchozích operací a úrazů, protože případná nervová postižení jsou dost typická. Pudendální nerv bývá postižen při operačních vaginálních porodech, Amreichově fixaci či při operacích kyčelního kloubu. Zákroky na ledvinách jsou rizikové pro poranění nervů lumbálního plexu jako nervus iliohypogastricus a nervus ilioinguinalis. Téměř každá operace s preparací retroperitonea v oblasti malé pánve je riziková, protože fibrotické změny v rámci hojení mohou utlačovat procházející nervy sakrálního plexu. Postižení má charakter kompartment syndromu. Vzácně mohou být pánevní nervy postižené endometriózou [1,6].
Diagnostické metody
V první řadě je vyšetření kvality bolesti, lokalizace vyzařování a pohybů, které bolest zlepšují, či zhoršují. U somatického postižení je často přítomný i tzv. trigger point – bod, jehož stimulace bolest vyvolá či výrazně zhorší. Dalším krokem by mělo být komplexní pánevní vyšetření. Inspekce pohlavních orgánů – kolposkopie, kultivace z pochvy, stanovení pH pochvy, chemické a kultivační vyšetření moči a bioptické vyšetření případných abnormálních ložisek vulvy či v pochvě. Dalším krokem je rektovaginální palpační vyšetření se zaměřením na parametria, rektovaginální septum, nervus pudendus a sakrální míšní kořeny (vyjma kořenů L5 a S1, které nejsou palpačně vyšetřitelné). Přímá palpace nervů je klíčová. U postižených pacientů vyvolá typický pocit mravenčení (Tinel’s sign – Tinelův příznak) v distální inervační oblasti nervu, selektivní lokální nebo epidurální anestezií je u některých onemocnění jako pudendální neuralgie diagnostický [5,7]. Neuropelveologické a urogynekologické vyšetření pokračuje hodnocením svalové síly a svalového tonu, zhodnocením chůze a stoje (Rombergovy testy).
Pánevní ultrazvuk je levnou, dostupnou a klíčovou metodou v gynekologickém vyšetření. V diagnostice pánevní bolesti je důležitý pro zhodnocení anatomických poměrů, posuvnosti jednotlivých orgánů k vyloučení ložisek endometriózy, evaluaci reziduálního množství moči po vyprázdnění a tloušťky stěny močového měchýře nebo pro správné zhodnocení venózních plexů. Typickým nálezem obzvláště v poporodním období jsou varikózní žíly. Diagnostickým kritériem je dilatace > 7 mm v průměru, vinutá struktura a reflux prokazatelný dopplerovským vyšetřením [8–10].
Patologie sakrálních kořenů S2–S4 anebo nervi splanchnici může kromě pánevní bolesti vést k dysfunkci dolních cest močových. Tyto příznaky lze diagnostikovat urodynamickým vyšetřením (cystometrie, uroflowmetrie, stanovení leak point preassure – určení hodnoty intravezikálního tlaku, při které nastává únik moče z měchýře). Cílem je rozlišit detruzorovou hypotonii, která je příznakem axonálního poškození pánevních nervů, od jejich iritace, která se projeví urgencemi – typickým příznakem hyperaktivního močového měchýře [11].
Vybraná specifická onemocnění
Neuralgie pudendálního nervu byla popsána poprvé v roce 1987. Projevuje se úpornou, chronickou a progresivní bolestí v oblasti vulvy, perianálně a na perineu, která se typicky zhoršuje při sezení. Dalšími vzácnějšími projevy mohou být polakisurie, urgence, zácpa a bolestivé vyprazdňování stolice, sexuální dysfunkce či ztráta libida. K diagnóze vede kombinace specifických příznaků, které hodnotíme podle diagnostických kritérií sepsaných na urogynekologickém kongresu v Nantes v roce 2008:
1. bolest v anatomické oblasti pudendálního nervu;
2. bolest zhoršující se při sezení;
3. spánek není rušen bolestí, naopak vleže dochází ke zlepšení;
4. není přítomna porucha senzitivity při klinickém vyšetření;
5. pozitivní anestetický blok pudendálního nervu.
Pro přesnější diagnostiku byla navržena i kritéria vylučující pudendální neuralgii – bolesti pouze v oblasti kostrče, gluteální a hypogastrická bolest, zejména paroxysmální, pruritus a přítomnost abnormalit na zobrazovacích vyšetřeních, které by svědčily pro jinou etiologii.
Klasickým příkladem postižení je chronický útlak nervu při průchodu Alcockovým kanálem [12,13]. Typicky postihuje cyklisty a osoby, jež mají sedavé povolání, nicméně velká část onemocnění je v návaznosti na porod, kdy příčinou může být komprese postpartálním hematomem ve fossa ischiorectalis, idiopatická fibróza kanálu nebo sekundární fibróza v návaznosti na infekci či hematom a dále útlakem nervu proti pánevní stěně při průchodu hlavičky. Rizikovými faktory jsou porodní hmotnost plodu > 4 kg, prodloužená vytlačovací fáze porodu > 30 min a operační klešťový porod. Další častou příčinou je přímo sutura pudendálního nervu nebo jeho nepřímé poškození při sakrospinální fixaci dle Amreich-Richtera [14,15].
Syndrom pánevní kongesce
Nejčastěji postihuje premenopauzální ženy ve věku 20–45 let po vícečetných porodech. U žen po menopauze se tento syndrom nevyskytuje. Až 30–40 % žen trpících CPP je postižených tímto syndromem. Patofyziologie syndromu není v současnosti uspokojivě objasněna. Hlavními příznaky jsou bolest a pocit tlaku zhoršující se v průběhu dne. Zhoršení bolesti přichází i během menstruace, po námaze či po pohlavním styku, a naopak poloha vleže vede k výraznému zlepšení obtíží. Typickým nálezem je abnormální dilatace žilního systému pánve. Klíčový je plexus ovaricus ústící do vena ovarica. Dále sakrální, utero-ovariální, vezikulární, hemoroidální žilní plexy ústící do vena iliaca interna. Obě hlavní žíly prochází plica lata.
Insuficience vena iliaca interna a vena cava inferior byly popsány sporadicky. Nejčastěji nacházíme pánevní varixy v povodí vena ovarica a přibližně u 60 % postižených se rozvine syndrom pánevní kongesce [9]. Reflux pánevních žil do žil dolních končetin a vulvární varixy jsou často spojeny s insuficiencí vena circumflexa femoris medialis a vena obturatoria [16].
Primární žilní insuficience je na podkladě absence nebo inkompetence žilních poloměsíčitých chlopní. Vrozená absence chlopní vena ovarica je vpravo u 6 % žen a vlevo u 13–15 %. Žilní insuficience se vyskytuje u 35–46 % žen vpravo a u 41–43 % vlevo [3,8]. V těhotenství se kapacita pánevního žilního systému zvyšuje o polovinu a může vést k retrográdnímu toku krve a k funkčnímu poškození žilních chlopní. Tyto změny mohou přetrvávat i 6 měsíců po porodu [17].
Sekundární žilní insuficienci nejčastěji způsobuje zevní komprese vény vedoucí k obstrukci. Mezi možné příčiny patří levostranný syndrom útlaku vena renalis, kdy je žíla utlačena mezi břišní aortou a odstupem arteria mesenterica superior. Obdobně může docházet k útlaku vena iliaca interna pravou arteria iliaca interna (May-Thurnerův syndrom) [15].
Jeden z efektů estrogenu je i žilní dilatace a kompletní úprava symptomů po menopauze nasvědčuje významné roli hormonů v patofyziologii syndromu pánevní kongesce [18].
Pooperační pánevní neuropatie
Všechny pánevní, perineální a porodnické operace nesou riziko poškození pánevních nervů. Rozlišujeme primární nervové poškození (PNI – primary nerve injury) suturou, elektrokoagulací, ischemizací nebo přímým řezem. Takové poškození se projeví ihned nebo časně pooperačně v řádu několika dnů. Projevy jsou změny citlivosti, bolest a funkční poruchy. Druhá skupina poranění je sekundární nervové poškození útlakem (SNE – secondary nerve entrapment), které se rozvíjí měsíce až roky po operaci, způsobené fibrotizací v těsném okolí nervu nebo vaskulárním útlakem. Příznaky se liší podle typu poškození. Při přímém poškození axonů se objevuje hypotonie až atonie s poruchou motorických funkcí [19] (např. poruchy motoriky palce dolní končetiny při postižení kořene S2), naopak iritační postižení se projevuje hypersenzitivitou a funkčním postižením pánevních orgánů, typicky močového měchýře a rektosigmatu.
U primárního nervového poškození je díky časné diagnostice vysoká šance na adekvátní léčebnou intervenci. Obtíže se objeví již během operace nebo náhle po zákroku a pacient i operatér je snadněji odhalí. U sekundárního poškození útlakem je situace podstatně složitější, protože obtíže se objeví s odstupem a spojitost s předešlou operací není evidentní. Také lokalizace bolesti bývá odlišná od místa poškození nervu [7,20].
Incidenci iatrogenního poranění pánevních nervů nelze dobře odhadnout, jelikož v literatuře bylo popsáno jen několik případů [21]. Mezi typické vysoce rizikové operace patří transvaginální sakrospinózní kolpopexe, laparoskopické kolpopexe/rektopexe či McCallova fixace [22] a miniinvazivní vaginální výkony (např. implantace polypropylenové síťky, kdy se část implantace provádí bez přímé kontroly zraku, je častěji provázena krvácením). Výsledné hematomy mají omezenou drenáž a mohou svou expanzí vést k disekci retroperitoneálního prostoru a k útlaku sakrálních kořenů [23,24]. Diagnostika poranění se opírá o správné urogynekologické a neuropelveologické vyšetření a zobrazovací metody, zejména ultrazvuk a magnetickou rezonanci [25].
Závěr
Chronická neuropatická pánevní bolest je výrazně omezující onemocnění, které během života postihne až jednu sedminu žen. Stejně jako u jiných bolestivých syndromů je diagnostika obtížná a léčba v rámci primární péče pouze symptomatická. Kauzální chirurgická léčba pro chronickou pánevní bolest, tedy resekce ložisek u endometriózy, dekomprese nervů u útlakových syndromů či extrakce problémových implantátů, vede v průměru ke 46% zlepšení příznaků bolesti a 31% zlepšení přidružených depresivních příznaků [6,7]. Cílená fyzioterapie obzvláště pánevního dna vede při dobré adherenci k terapii ke snížení užitých analgetik o 22 % a ke zlepšení subjektivního vnímání nemoci. Bohužel se bolesti mohou vracet nejen na podkladě lokálního postižení, ale také na podkladě remodelace CNS [26]. Prognóza pacientů s chronickou bolestí je lepší u pacientů s menším počtem komorbidit [21]. Správnou evaluaci účinnosti léčby komplikuje nedostatek studií zabývajících se dlouhodobými výsledky. Mnoho studií stanovuje poslední kontrolu měsíce spíše než roky od léčebné intervence.
Doručeno/Submitted: 4. 6. 2021
Přijato/Accepted: 11. 6. 2021
MUDr. Tomáš Fučík
Gynekologicko-porodnická klinika
1. LF UK a VFN v Praze
Apolinářská 18
128 00 Praha 2
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Publication ethics: The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/ práce nemají žádný konflikt zájmů.
Conflict of interests: The authors declare they have no potential conflicts of interest concerning the drugs, products or services used in the study.
Zdroje
1. Lamvu G, Williams R, Zolnoun D et al. Long-term outcomes after surgical and nonsurgical management of chronic pelvic pain: one year after evaluation in a pelvic pain specialty clinic. Am J Obstet Gynecol 2006; 195 (2): 591–600. doi: 10.1016/j.ajog.2006.03.081.
2. Latthe P, Latthe M, Say L et al. WHO systematic review of prevalence of chronic pelvic pain: a neglected reproductive health morbidity. BMC Public Health 2006; 6 : 177. doi: 10.1186/1471-2458-6-177.
3. Ahlberg NE, Bartley O, Chidekel N. Right and left gonadal veins. An anatomical and statistical study. Acta Radiol Diagn (Stockh) 1966; 4 (6): 593–601. doi: 10.1177/028418516600400 601.
4. Robert R, Prat-Pradal D, Labat JJ et al. Anatomic basis of chronic perineal pain: role of the pudendal nerve. Surg Radiol Anat 1998; 20 (2): 93–98. doi: 10.1007/BF01628908.
5. Goldstein AT, Pukall CF, Brown C et al. Vulvodynia: assessment and treatment. J Sex Med 2016; 13 (4): 572–590. doi: 10.1016/j.jsxm.2016.01. 020.
6. Lemos N, Possover M. Laparoscopic approach to intrapelvic nerve entrapments. J Hip Preserv Surg 2015; 2 (2): 92–98. doi: 10.1093/jhps/ hnv030.
7. Labatt JJ, Riant T, Robert R et al. Diagnostic criteria for pudendal neuralgia by pudendal nerve entrapment (Nantes criteria). Neurourol Urodyn 2008; 27 (4): 306–310. doi: 10.1002/nau.20505.
8. Koo S, Fan CM. Pelvic congestion syndrome and pelvic varicosities. Tech Vasc Interv Radiol 2014; 17 (2): 90–95. doi: 10.1053/j.tvir.2014.02.005.
9. O‘Brien MT, Gillespie DL. Diagnosis and treatment of the pelvic congestion syndrome. J Vasc Surg Venous Lymphat Disord 2015; 3 (1): 96–106. doi: 10.1016/j.jvsv.2014.05.007.
10. Wang XH, Xu JJ, Yang G et al. Impact of ultrasound diagnosis for chronic pelvic pain. Medicine (Baltimore) 2019; 98 (39): e17281. doi: 10.1097/MD.00000000000017281.
11. Boogaard S, Heymans MW, de Vet HC et al. Predictors of persistent neuropathic pain – a systematic review. Pain Physician 2015; 18 (5): 433–457.
12. Shafik A, el-Sherif M, Youssef A et al. Surgical anatomy of the pudendal nerve and its clinical implications. Clin Anat 1995; 8 (2): 110–115. doi: 10.1002/ca.980080205.
13. Soon-Sutton TL, Feloney MP, Antolak S. Pudendal neuralgia. In: StatPearls. Treasure Island (FL): StatPearls Publishing 2021. 2021 [online]. Available from: www.ncbi.nlm.nih.gov/books/NBK430685/.
14. Aló KM, Holsheimer J. New trends in neuromodulation for the management of neuropathic pain. Neurosurgery 2002; 50 (4): 690–703. doi: 10.1097/00006123-200204000-00003.
15. Katz R, Golijanin D, Pode D et al. Primary and postoperative retroperitoneal fibrosis – experience with 18 cases. Urology 2002; 60 (5): 780–783. doi: 10.1016/s0090-4295 (02) 01910-6.
16. Masata J, Hubka P, Martan A. Pudendal neuralgia following transobturator inside-out tape procedure (TVT-O-) – case report and anatomical study. Int Urogynecol J 2012; 23 (4): 505–507. doi: 10.1007/s00192-011-1555-4.
17. Martinez A, Howard FM. The efficacy of laparoscopic surgical treatment of ovarian remnant and ovarian retention syndromes. J Minim Invasive Gynecol 2015; 22 (2): 245–249. doi: 10.1016/j.jmig.2014.10.007.
18. Raffetto JD, Qiao X, Beauregard KG et al. Estrogen receptor-mediated enhancement of venous relaxation in female rat: implications in sex-related differences in varicose veins. J Vasc Surg 2010; 51 (4): 972–981. doi: 10.1016/ j.jvs.2009.11.074.
19. Ploteau S, Cardaillac C, Perrouin-Verbe MA et al. Pudendal neuralgia due to pudendal nerve entrapment: warning signs observed in two cases and review of the literature. Pain Physician 2016; 19 (3): E449–E454.
20. Mára M, Fučíková Z, Kužel D et al. Laparoskopie pro chronickou pánevní bolest – retrospektivní klinická studie. Ceska Gynekol 2002; 67 (1): 38–46.
21. Possover M. Neuropelveology: an emerging discipline for the management of pelvic neuropathies and bladder dysfunctions through to spinal cord injury, anti-ageing and the mars mission. J Clin Med 2020; 9 (10): 3285. doi: 10.3390/jcm9103285.
22. Penzias A, Bendikson K, Falcone T et al. Postoperative adhesions in gynecologic surgery: a committee opinion. Fertil Steril 2019; 112 (3): 458–463. doi: 10.1016/j.fertnstert.2019.06.027.
23. Homola P, Hensel G, Škorničková Z et al. Exstirpace suburetrální pásky z důvodu chronických bolestí. Ceska Gynekol 2017; 82 (4): 313–317.
24. Possover M, Schneider T, Henle KP. Laparoscopic therapy for endometriosis and vascular entrapment of sacral plexus. Fertil Steril 2011; 95 (2): 756–758. doi: 10.1016/j.fertnstert.2010.08.048.
25. Gulur P, Nelli A. Persistent postoperative pain: mechanisms and modulators. Curr Opin Anaesthesiol 2019; 32 (5): 668–673. doi: 10.1097/ACO.0000000000000770.
26. Asiri MD, Banjar R, Al-Qahtani W et al. Central nervous system changes in pelvic inflammation/pain patients. Curr Bladder Dysfunct Rep 2019; 14 (8): 223–230. doi: 10.1007/s11884-019-00530-x.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2021 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Matrixové metaloproteinázy MMP-2 a MMP-9 jako markery predikce preeklampsie v prvním trimestru
- HELLP syndrom a HELLP-like syndrom u těhotných s covid-19 – kazuistiky
- Kongenitální syfilis jako příčina úmrtí novorozence ve 31. týdnu gravidity – význam testování na syfilis v průběhu gravidity
- Možnosti léčby lokálně recidivujícího karcinomu vulvy
- Recidiva vzácného maligního Brennerova tumoru ovaria
- Molekulární klasifikace endometriálních karcinomů převedená do praxe
- Molekulární testování u karcinomu endometria – společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP
- Prevence tvorby de novo adhezí u pacientek s Ashermanovým syndromem
- Pánevní neuropatická bolest (diferenciální diagnostika)
- Historie a současné trendy v léčbě idiopatického hyperaktivního měchýře
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pánevní neuropatická bolest (diferenciální diagnostika)
- HELLP syndrom a HELLP-like syndrom u těhotných s covid-19 – kazuistiky
- Molekulární testování u karcinomu endometria – společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP
- Recidiva vzácného maligního Brennerova tumoru ovaria
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



