-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Bimekizumab v léčbě psoriatické artritidy
20. 6. 2024
Artritida se může objevit až u třetiny pacientů s psoriázou, většinou po vzniku kožních příznaků. Včasné rozpoznání tohoto přechodu dermatology a praktickými lékaři je klíčové, protože časná intervence může zabránit nevratnému poškození kloubů. V kontextu s účinnou biologickou léčbu se dokonce hovoří o možné prevenci rozvoje artritidy u jedinců s psoriázou.
Úvod
Psoriatická artritida (PsA) je chronické zánětlivé onemocnění charakterizované různorodými projevy na kloubech – převážně artritidy, ale také entezitidy nebo daktylitidy – a axiálního postižení, jež se často vyskytují ve spojení s psoriázou na kůži a nehtech (1, 2).
Mezi rizikové faktory rozvoje artritidy patří těžké kožní postižení, nehtová psoriáza, obezita a pozitivní rodinná anamnéza (3). Nemoc však bývá často diagnostikována se zpožděním nebo není rozpoznána vůbec, přičemž asi 15 % pacientů léčených s psoriázou má nediagnostikovanou artritidu (4).
InzercePro včasnou diagnostiku muskuloskeletálního postižení je důležité identifikovat symptomy, jako jsou bolesti a otoky kloubů, zánět šlach a jejich úponů, ztuhlost a zánětlivá bolest zad. Zobrazovací metody (rentgen, muskuloskeletální ultrazvuk nebo magnetická rezonance) spolu s hodnocením reaktantů akutní fáze jsou pomocnými vyšetřeními pro přesné stanovení diagnózy (5).
Možnosti léčby PsA
Léčba PsA se řídí typem a závažností klinických projevů (6). U mírných forem periferního či axiálního postižení mohou být dostačující nesteroidní protizánětlivá léčiva (NSAIDs). V případech, kdy je artritida závažnější a postihuje více kloubů, se zpravidla nasazují konvenční syntetická chorobu modifikující antirevmatika (csDMARDs), jako je methotrexát. Pokud tato léčba selže, jsou k dispozici biologické anticytokinové léky, jež cílí na tumor nekrotizující faktor (TNF), interleukin 17 (IL-17) nebo IL-23. V případě převažujícího kožního postižení je vhodné nasadit inhibitory IL-17 či IL-23. Při selhání biologických léků nebo pokud je jejich podání nevhodné, lze nasadit perorálně podávaná cílená syntetická DMARDs (tsDMARDs), jež zasahují na úrovni fosfodiesterázy 4 (PDE4) nebo Janusových kináz (JAK) (6).
Bimekizumab je inovativní léčivý přípravek schválený pro terapii psoriázy a PsA. Jedná se o monoklonální protilátku, která selektivně inhibuje IL-17A a IL-17F – klíčové cytokiny zapojené do patogeneze PsA (viz obr. 1) (7). Tato inhibice potlačuje zánětlivou odpověď a vede ke zlepšení klinických příznaků psoriatického onemocnění.
Obr. 1 Mechanismus účinku bimekizumabu spočívá v selektivní vazbě na cytokiny IL-17A, IL-17F a heterodimer IL-17A/F – tímto způsobem léčivo inhibuje aktivaci receptorového komplexu IL-17RA/RC zmíněnými cytokiny, čímž omezuje následnou zánětlivou kaskádu (7).

Bimekizumab v klinických hodnoceních
Bimekizumab byl u nemocných s PsA hodnocen ve dvou klíčových randomizovaných dvojitě zaslepených placebem kontrolovaných studiích fáze III: BE OPTIMAL a BE COMPLETE (8, 9).
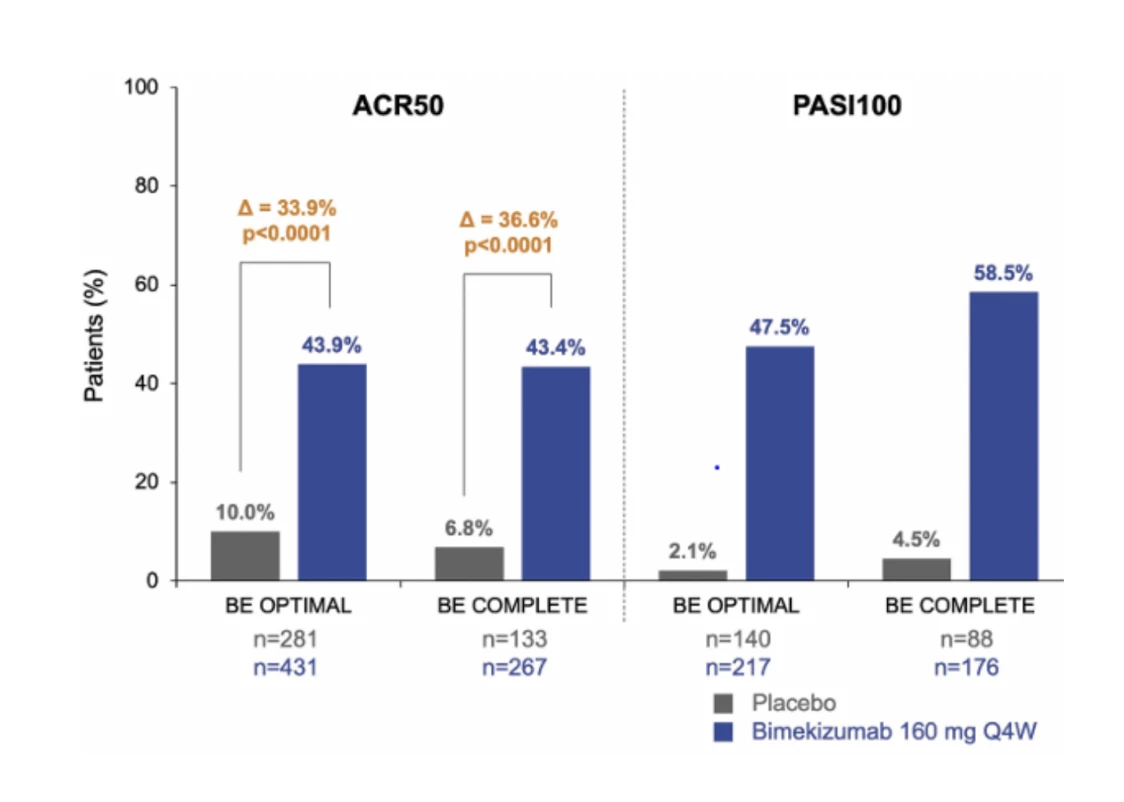
Studie BE OPTIMAL (8) se zaměřila na pacienty, kteří dosud nebyli léčeni biologickou léčbou, zatímco studie BE COMPLETE (9) zahrnovala nemocné s nedostatečnou odpovědí na inhibitory TNF. Obě studie prokázaly, že bimekizumab významně zlepšuje příznaky onemocnění, včetně artritidy, entezitidy i daktylitidy a kožních lézí. Přibližně 44 % pacientů dosáhlo po 16 týdnech léčby v obou zmíněných klinických studiích zlepšení dle kritérií American College of Rheumatology – ACR 50, což znamená alespoň 50% zlepšení z hlediska počtu citlivých a oteklých kloubů a dalších klíčových parametrů. V placebové skupině těchto výsledků dosáhlo pouze 7–10 % pacientů, zatímco ve skupině s aktivním komparátorem (inhibitor TNF adalimumab) bylo v klinickém hodnocení BE OPTIMAL dosaženo primárního cíle ve 46 % případů.
Ještě výraznější účinek byl v klinické studii BE OPTIMAL pozorován při hodnocení kožního skóre PASI 90 (90% zlepšení v Psoriasis Area and Severity Index), kterého dosáhlo 61–69 % pacientů na bimekizumabu ve srovnání s 9–11 % v placebové skupině a 41 % ve skupině s adalimumabem. Úplného vyhojení kožního nálezu (PASI 100) dosáhla přibližně polovina pacientů léčených bimekizumabem, méně než 5 % na placebu a 21 % na adalimumabu (8, 9) (viz obr. 2).
Obr. 2 Podíl respondentů dosahujících ACR 50 a PASI 100 v 16. a 52. týdnu v klinických hodnoceních BE OPTIMAL a BE COMPLETE (8, 9). Výsledky byly analyzovány pomocí metody NRI (non-responder imputation), tedy k chybějícím datům byl přisouzen výchozí předpoklad neúspěchu léčby.
Bimekizumab prokázal významně lepší účinek na kožní příznaky psoriázy, a to i při srovnání s inhibicí IL-17A (10). Tento účinek byl pozorován v klinické studii kde přibližně 62 % pacientů léčených bimekizumabem dosáhlo úplného vyhojení psoriázy po 16 týdnech oproti 49 % léčených secukinumabem. Tento rozdíl zdůrazňuje potenciál bimekizumabu poskytovat výjimečnou kontrolu kožních projevů onemocnění. Je však důležité upozornit na zvýšený výskyt orální kandidózy u nemocných léčených bimekizumabem ve srovnání se secukinumabem.
Dlouhodobá účinnost bimekizumabu byla potvrzena v prodloužených otevřených fázích klinických studií. Po roce léčby byl udržován stabilní klinický účinek, přičemž 50 % pacientů dosáhlo ACR50 a 66 % úplného vyhojení psoriázy (11).
Bimekizumab byl obecně dobře tolerován, nejčastějšími nežádoucími účinky byly infekce horních cest dýchacích, nazofaryngitida, bolesti hlavy a průjem. Byl zaznamenán vyšší výskyt orální kandidózy, což je vedlejší účinek spojený s inhibicí IL-17. Kandidóza byla obvykle mírná až středně těžká a dobře zvládnutelná standardní antimykotickou léčbou.
Závěr
Na základě výsledků klinických hodnocení byl u nemocných s PsA prokázán velmi dobrý účinek inhibice IL-17A a IL-17F za využití bimekizumabu. To zahrnuje zlepšení jak v muskuloskeletálních příznacích, tak i v kožních projevech, včetně úplného vymizení psoriázy u většiny pacientů. Celkově byl bimekizumab dobře tolerován, s bezpečnostním profilem podobným jiným biologickým léčivům kromě vyššího výskytu orální kandidózy.
prof. MUDr. Ladislav Šenolt, Ph.D.
Revmatologický ústav a Klinika revmatologie 1. LF UK v PrazeLiteratura:
1. Fitzgerald O, Ogdie A, Chandran V et al. Psoriatic arthritis. Nat Rev Dis Primers 2021; 7 (1): 59.
2. Scher JU, Ogdie A, Merola JF, Ritchlin C. Preventing psoriatic arthritis: focusing on patients with psoriasis at increased risk of transition. Nat Rev Rheumatol 2019; 15 (3): 153–166.
3. Zabotti A, De Marco G, Gossec L et al. EULAR points to consider for the definition of clinical and imaging features suspicious for progression from psoriasis to psoriatic arthritis. Ann Rheum Dis 2023; 82 (9): 1162–1170.
4. Villani AP, Rouzaud M, Sevrain M et al. Prevalence of undiagnosed psoriatic arthritis among psoriasis patients: systematic review and meta-analysis. J Am Acad Dermatol 2015; 73 (2): 242–248.
5. Polachek A, Furer V, Zureik M et al. Role of ultrasound for assessment of psoriatic arthritis patients with fibromyalgia. Ann Rheum Dis 2021; 80 (12): 1553–1558.
6. Gossec L, Kerschbaumer A, Ferreira RJO et al. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2023 update. Ann Rheum Dis 2024 May 15; 83 (6): 706–719.
7. Tanaka Y, Shaw S. Bimekizumab for the treatment of psoriatic arthritis. Expert Rev Clin Immunol 2024 Feb; 20 (2): 155–168.
8. McInnes IB, Asahina A, Coates LC et al. Bimekizumab in patients with psoriatic arthritis, naive to biologic treatment: a randomised, double-blind, placebo-controlled, phase 3 trial (BE OPTIMAL). Lancet 2023; 401 (10370): 25–37.
9. Merola JF, Landewé R, McInnes IB et al. Bimekizumab in patients with active psoriatic arthritis and previous inadequate response or intolerance to tumour necrosis factor-α inhibitors: a randomised, double-blind, placebo-controlled, phase 3 trial (BE COMPLETE). Lancet 2023; 401 (10370): 38–48.
10. Reich K, Warren RB, Lebwohl M et al. Bimekizumab versus secukinumab in plaque psoriasis. N Engl J Med 2021; 385 (2): 142–152.
11. Coates LC, Landewé R, McInnes IB et al. Bimekizumab treatment in patients with active psoriatic arthritis and prior inadequate response to tumour necrosis factor inhibitors: 52-week safety and efficacy from the phase III BE COMPLETE study and its open-label extension BE VITAL. RMD Open 2024 Feb 22; 10 (1): e003855.
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Revmatologie Dermatologie Praktické lékařství pro dospělé
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




