-
Medical journals
- Career
Dietologické vyšetření pacientů s ledvinnými kameny
Authors: K. L. Penniston
Authors‘ workplace: Department of Urology University of Wisconsin
Published in: Urol List 2015; 13(2): 5-10
Overview
Hlavní body:
1. Hodnocení obvyklých stravovacích návyků pacienta nebo hodnocení příjmu konkrétních potravin a nápojů pomůže objasnit, zda strava přispívá k riziku vzniku litiázy, nebo nikoli. 2. Dietologické vyšetření by měl provádět zkušený dietolog; lékaři, kteří se nespecializují na tuto problematiku, by se měli vyvarovat častých chyb, kterých se obvykle dopouští lékaři bez kvalifikace v dietologii. 3. 24hod sběr moči a rozbor složení litiázy nejsou ekvivalentní alternativou dietologickému hodnocení, neboť látky (ze stravy) obsažené v moči nebo ledvinných kamenech podléhají po konzumaci mnohačetným metabolickým procesům. 4. Dietetická doporučení by měla být stanovena konkrétně pro předpokládaný dietetický rizikový faktor. 5. V případě, že se strava nepodílí na vzniku litiázy nebo pacient již dodržuje dietetická doporučení zaměřená na kontrolu konkrétních rizikových faktorů, pravděpodobně pak jakákoli další změna stravovacích návyků nepovede ke snížení rizika vzniku litiázy. 6. Poskytnutí dietetických doporučení, která nesouvisejí s rizikem vzniku litiázy, může (a.) pacienta zahltit zbytečnými informacemi, (b.) zmást priority jednotlivých doporučení a/nebo (c.) poskytnout pacientovi plané naděje s ohledem na úspěch nutriční terapie.Klíčová slova:
urolitiáza, nefrolitiáza, ledvinné kameny, strava, výživa, dietologické vyšetření, dietetické doporučení, nutriční terapie, nutriční terapie s lékařským dohledemÚvod
Litiáza představuje velmi časté onemocnění a v mnoha případech se jedná o recidivující chorobu, která postihuje pacienta opakovaně v průběhu jeho života [1]. Vzhledem k tomu, že poprvé se onemocnění objevuje obvykle ve středních letech, postihují tak ledvinné kameny nejčastěji jedince v produktivním věku. Obzvláště při opakovaném výskytu jsou ledvinné kameny spojeny s mnohačetnými akutními a bolestivými příhodami, které vyžadují návštěvu pohotovosti, užívání analgetik a/nebo další medikace, operační intervenci, hospitalizaci a opakované diagnostické testy a kontroly. Ledvinné kameny tak pacientovi komplikují pracovní, domácí i společenské aktivity, zatěžují jeho finanční rozpočet a mají negativní dopad i na jeho duševní zdraví. Celkově dochází ke zhoršení kvality života pacienta s močovými kameny [2,3]. Incidence nefrolitiázy se neustále zvyšuje ve všech věkových skupinách, zejména u žen [4–6]. Strategie zacílené na snížení výskytu recidivy jsou tedy naprosto nezbytné.
Strava může (prostřednictvím nejrůznějších mechanizmů) ovlivňovat tvorbu i růst většiny druhů ledvinných kamenů. Složení stravy však představuje pouze jeden z mnoha faktorů predisponujících ke vzniku nefrolitiázy a u pacientů s anamnézou litiázy k její recidivě. Mezi další faktory, které ovlivňují vznik močových kamenů, patří související choroby, některá léčiva, dědičnost, pozměněná anatomie a další faktory (nedietetické) související se životním stylem. Před stanovením dietetických doporučení nebo v případě dietologa – nutriční terapie pod lékařským dohledem, je nutné zhodnotit, zda je strava příčinou vzniku litiázy a případné recidivy.
Posouzení, zda strava hraje významnou roli v rámci tvorby litiázy, má zásadní význam ze dvou důvodů: 1. pakliže nemá litiáza nutriční příčinu, potom nebude pravděpodobně účinná žádná nutriční léčba; 2. bez prokázané dietetické příčiny mohou mít pacienti neopodstatněná očekávání, že úprava stravy bude mít vliv na riziko tvorby močových kamenů. Složení stravy se podílí rovněž na vzniku řady dalších chorob jako např. diabetes mellitus typu 2, osteoporóza a kardiovaskulární onemocnění. V tomto případě může lékař předepsat medikamentózní léčbu nebo (pakliže může být úprava stravy prospěšná) doporučit dietetické změny a/nebo doporučit pacientovi konzultaci s dietologem. Obvykle se využívají obě strategie. Změna stravy však není nezbytná u pacientů, kteří již dodržují preventivní opatření, a pacientů, na jejichž onemocnění nemá strava žádný vliv. Ačkoli by mohla být u všech pacientů s výše uvedenými chorobami dietetická doporučení považována za adekvátní, zdá se logické, že prioritně by měla být specifická dietetická opatření zvolena u jedinců, kteří mají největší pravděpodobnost, že úprava stravy ovlivní jejich patologii [7]. Nevhodné vyzdvihování neúčinných dietetických opatření může v pacientovi zbytečně vzbuzovat neopodstatněné naděje s ohledem na prevenci onemocnění a zbytečně ho rozptylovat od dodržování důležitějších aspektů léčby.
Proč nelze aplikovat všechna dietetická doporučení týkající se prevence litiázy u všech pacientů s močovými kameny? Dietetická doporučení obvykle zahrnují obecné rady o tom, jak by se měl pacient správně stravovat. Vládní a zdravotnické instituce často vydávají dietetická doporučení v rámci zdravotní osvěty nebo jako součást nejrůznějších guidelines pro konkrétní onemocnění a jejich cílem je minimalizovat vznik určitých onemocnění, jako je např. diabetes nebo kardiovaskulární onemocnění, osvojením určitých stravovacích návyků. Primární prevence nefrolitiázy se však obvykle nepraktikuje. U pacienta s ledvinnými kameny lze obvykle konkrétní doporučení stanovit na základě biochemických a dalších parametrů. Dietetické změny, zvláště zásadní změny ve stravování, jsou pro pacienta často velmi obtížné, a je tedy vhodné k nim přistoupit teprve v případě, že jsou opravdu nezbytné. Tímto způsobem zajistíme, že doporučení pro konkrétní rizika jsou oprávněná. Stejným způsobem, jakým se lékaři snaží vyhnout indikaci zbytečných diagnostických testů, předepisování nepotřebné medikace a indikaci zbytečných výkonů, by se měli vystříhat podávání dietetických doporučení, pokud pro ně neexistuje indikace nebo nejsou založena na důkazech.
Sami pacienti často žádají lékaře o rady týkající se úpravy stravy v rámci prevence litiázy ve snaze vyhnout se medikamentózní léčbě. V tomto případě se snažíme zjistit, zda stravování pacienta hraje stejnou roli jako nedietetické faktory (např. některé medikamenty, anatomické nebo fyziologické abnormality, související onemocnění). Pro vyloučení role ostatních nedietetických faktorů lze užít biochemické testy, zobrazovací a fyzikální vyšetření. Podíl stravy na vzniku litiázy se hodnotí pomocí dietologického vyšetření [8].
Hodnocení stravy
Co obnáší dietologické vyšetření?
Dieotologické vyšetření znamená kompletní rozbor pacientovy stravy s ohledem na: 1. antropometrii (tj. výšku, váhu, poměr výšky a váhy), 2. anamnézu a hodnocení medikace a 3. relevantní biochemické parametry specifické pro dané onemocnění, které se liší v závislosti na konkrétním onemocnění, pro které je pacient vyšetřován. V případě litiázy se jedná (ovšem nikoli výlučně) o složení močových kamenů a močové parametry související s litiázou. Dietologické vyšetření hodnotí, které potraviny a potravinové doplňky (tj. volně prodejné, bez předpisu) pacient běžně konzumuje. Interval, po který se hodnotí pacientovy stravovací návyky, a skutečnost, zda se vyšetření zaměřuje pouze na specifické potraviny či doplňky, závisí na indikaci pro toto vyšetření. Dietologické vyšetření by mělo probíhat až po analýze výše uvedených tří kroků, ačkoli informace z kterékoli z těchto tří oblastí lze získat i během vyšetření. Dietologické vyšetření může být zacíleno na hodnocené onemocnění a vždy se zaměřuje na identifikaci konkrétních dietetických mechanizmů, které se podílejí na příčině vzniku onemocnění nebo jeho zhoršení či recidivě. Následující příklad je analogií cíleného vyšetření fyzioterapeutem. Fyzioterapeut obvykle u pacienta s konkrétní svalovou nebo fyzickou poruchou nehodnotí celkový fyzický stav ani muskulaturu, ale spíše se zaměřuje na oblasti nalézající se v místě zájmu. V případě urolitiázy se dietologické vyšetření provádí podobným způsobem.
Hodnocení pacientovy stravy představuje ideální nástroj pro posouzení dietetického rizika pro vznik litiázy. V současné době neexistuje žádný validovaný, na důkazech založený „rizikový profil“ pro hodnocení litogenních rizikových faktorů. 24hod sběr moči, ačkoli se jedná o užitečný nástroj pro identifikaci litogenního rizika souvisejícího s funkcí ledviny [9], může prokázat pouze dietetické extrémy (nadměrný nebo nedostatečný přísun určité látky ve stravě), v žádném případě však nepředstavuje alternativu dietologickému vyšetření, protože řada močových parametrů podléhá metabolické kontrole před průchodem ledvinami, často během trávení a/nebo absorpce. V každém případě jsou všechny metody dietologického hodnocení – 24hod záznam pacientovy stravy, dietetická anamnéza, dotazník pro hodnocení četnosti příjmu jednotlivých potravin, záznamy o hmotnosti porcí – čistě subjektivní a v rukou samotného pacienta. Ochota a schopnost pacienta poskytnout přesné a pravdivé informace závisí na řadě faktorů, včetně pacientovy důvěry ve vyšetřujícího, jeho schopnosti přesně popsat svou stravu a schopnosti vyšetřujícího správně interpretovat všechny informace.
Nejčastější úskalí dietologického vyšetření
Nejčastější chybou dietologů je pokládání zavádějících otázek jako např.: „Nekonzumujete příliš mnoho soli?“, „Které z následujících potravin (vyšetřující předkládá pacientovi vlastní seznam) obvykle konzumujete?“. Pokud pacient vycítí jakákoli očekávání nebo hodnocení ze strany vyšetřujícího, může některé informace zatajovat nebo jinak upravovat [10]. Další častou chybou je nepřesné hodnocení velikosti porcí. Pokud kupříkladu pacient uvede, že konzumuje „hodně burských ořechů“, jeho představa o definici „hodně“ se může značně rozcházet s představou vyšetřujícího. Při dietologickém vyšetření se často využívají nejrůznější strategie pro odhad velikosti porcí, např. fotografování porcí; užívání kuchyňského náčiní pro měření objemu a obsahu potravin; krabičková dieta a/nebo kontrolní otázky zaměřující se na konzumaci adekvátních porcí [11]. Další chybou je dotazovat se pacienta pouze na jídlo. Spíše než zjišťovat, co obvykle snídá, obědvá a večeří, se doporučuje pokládat otázky s otevřeným koncem, jako např. „Popište mi, co je vaše první jídlo nebo nápoj po probuzení“, tímto způsobem nevynecháme potraviny nebo nápoje, které pacient konzumuje mezi jednotlivými jídly. Někteří pacienti mohou mít rovněž specifický stravovací režim a nemusí se ztotožňovat s klasickým rozdělením chodů (snídaně, oběd atd.).
Stravovací návyky jsou naprosto osobní záležitost a často souvisí s kulturní nebo etnickou identitou pacienta. Pacient bude nejraději sdílet informace týkající se svých stravovacích návyků s vyšetřujícím, který nedává najevo své předsudky a respektuje kulturní zázemí pacienta [10,12]. Dietologové a specialisté na výživu však nejsou běžně k dispozici na urologických pracovištích, kam dochází většina pacientů v rámci prevence litiázy [13]. Dietetická doporučení tak často udílí personál bez speciální kvalifikace v tomto oboru. Urologové však nemají k dispozici dostatek času (často může být třeba > 30 min na jednoho pacienta) ani detailní znalosti týkající se potravy, trávení a absorpce, které by umožnily provedení podrobného a smysluplného dietologického hodnocení. Z tohoto důvodu vyjadřuje řada urologů zájem o možnost konzultace s nutričním specialistou [14].
Co dělat, když není dietolog k dispozici?
Dietologové jsou užiteční členové multidisciplinárních týmů na klinikách zabývajících se prevencí litiázy a rovněž užiteční pomocníci pro urology zaměřující se na prevenci. Na druhou stranu dietolog nebo odborník s touto kvalifikací (liší se v jednotlivých státech) poskytuje odborné nutriční poradenství každému pacientovi na míru (stejně jako je to běžné v případě fyzioterapie nebo farmakoterapie) [15]. Pokud není v možnostech urologického zdravotnického zařízení mít vlastního nutričního poradce, je možné pacienta odeslat do jiného centra. Prostřednictvím elektronické zdravotní dokumentace nebo písemné korespondence s dietologem se může lékař ujistit o vhodnosti zvolené terapie a potřebě její případné modifikace.
Souvislost mezi litogenními rizikovými faktory a výsledky dietologického hodnocení
Ačkoli může být lákavé věnovat se každé „odchylce“, kterou odhalí dietologické hodnocení, tento postup může pacienta zatížit množstvím zbytečných doporučení. Cílem dietologického vyšetření je poskytnout pacientovi doporučení s největším možným dopadem na onemocnění litiázou. Dietetické rizikové faktory je třeba korelovat přímo s biochemickými nebo jinými důkazy prokazujícími riziko litiázy. Kupříkladu vysoký příjem sodíku prokázaný během analýzy pacientovy stravy může být dán do souvislosti s nadměrným vylučováním kalcia do moči (v případě, že je detekováno). Vysoký příjem sodíku při současné absenci nadměrné exkrece kalcia do moči však bude mít nižší prioritu a bude vyžadovat pouze informování pacienta o potenciálním riziku do budoucna. Řada pacientů má navzdory vysokému příjmu sodíku podle standardní definice (např. podle „Dietary Reference Intakes“ [16]) normální vylučování kalcia, což může být vyvoláno například pohybovou aktivitou, která způsobuje nadměrné vylučování sodíku kůží. Pokud se v tomto klinickém scénáři pacient zaměří na omezení přísunu sodíku, může zanedbat další případná dietetická opatření nebo prevenci celkově. Tento přístup navíc nepovede ke snížení rizika tvorby litiázy. Další kapitola obsahuje seznam nejčastějších močových rizikových faktorů pro vznik litiázy a jejich potenciální souvislost s dietetickými rizikovými faktory.
Zaměření dietetických doporučení na konkrétní litogenní rizikové faktory
Ze všech typů litiázy bude podíl nutričních faktorů nejpravděpodobnější u kalcium oxalátových, smíšených kalciových a urátových konkrementů. Další kapitoly uvádějí přehled dietetických faktorů souvisejících s těmito typy litiázy.
Vysoká exkrece kalcia do moči – příjem kalcia
U pacientů s normálním vylučováním vápníku do moči nemusí dietologické hodnocení zahrnovat podrobný rozbor příjmu kalcia. Naopak u pacientů s vysokou exkrecí kalcia do moči je nezbytné prokázat, které potraviny či doplňky přispívají k této skutečnosti. Důkazy nasvědčují tomu, že většina dospělých, včetně pacientů s kalciovou litiázou (a možná zejména tito jedinci) mají nedostatečný příjem vápníku [17], tj. přibližně < 1 200 mg/den. Pacientům s nadměrným příjmem kalcia, jenž se může podílet na vysoké exkreci kalcia do moči, se doporučuje snížit/normalizovat svůj příjem na standardní hladinu [16]. Nadměrného příjmu vápníku obvykle nelze docílit bez suplementace kalcia.
Vysoká exkrece kalcia do moči – příjem sodíku
Je známým faktem, že příjem sodíku má vliv na kalciurii [18]. U jedinců s vysokou exkrecí kalcia se tedy doporučuje zhodnotit příjem sodíku. U pacientů bez zvýšené exkrece kalcia do moči má podrobné hodnocení příjmu sodíku ve stravě nižší prioritu. Přestože 24hod exkrece sodíku do moči se může den ode dne lišit, vykazuje víceméně stabilní vliv na vylučování kalcia do moči. Pacienti se zdánlivě stabilní exkrecí sodíku (hodnoceno pouze na základě 24hod exkrece sodíku do moči) tedy mohou přesto vyžadovat analýzu příjmu sodíku v potravě. V případě, že má pacient skutečně zvýšený příjem sodíku, lze doporučit omezení soli a potravin s vyšším obsahem sodíku. Účinnější metodou než pouhé doporučení „nekonzumovat více než“ určité množství (v miligramech) sodíku nebo soli denně jsou jistě strategie zaměřující se na pomoc pacientovi s omezením stávajícího příjmu sodíku (tj. méně než jakýkoli stávající stav), monitorování vlivu na vylučování kalcia při dalším 24hod sběru moči a doporučení omezit příjem sodíku do budoucna.
Vysoká exkrece kalcia do moči – vitamin D
Příjem vitaminu D u dospělých je obvykle omezený, zejména v severních zeměpisných šířkách a během zimních měsíců [19]. Vitamin D podporuje absorpci kalcia gastrointestinálním traktem a redukuje jeho vylučování ledvinami a podporuje jeho ukládání do kostí. Teoreticky platí, že při normálních hodnotách nemá vitamin D (cholecalciferol) patologický vliv na exkreci kalcia do moči. Navíc nebyla prokázána souvislost mezi hyperkalciurií a vyššími dávkami vitaminu D, jak je tomu v případě jeho nedostatečného příjmu [20]. Při vyšším příjmu vitaminu D (např. > 1 000 IU/den) a současném výskytu hyperkalciurie může vzniknout podezření na nadměrný příjem vitaminu; tuto skutečnost odhalí dietologické vyšetření. Pozor na doporučování omezení dávkování vitaminu D, protože pouze výjimečně bude hyperkalciurie vyvolána nadměrným příjmem vitaminu D.
Vysoká exkrece oxalátů do moči – příjem kalcia
Pacientům s nízkým příjmem kalcia a vysokou exkrecí oxalátů do moči se doporučuje upravit příjem kalcia na základě patřičných kulturních/národních standardů a rovněž podle věku a pohlaví pacienta [16]. Příjem kalcia se doporučuje rozdělit mezi jednotlivé pokrmy a svačiny, abychom maximalizovali dostupnost kalcia v gastrointestinálním traktu. Bylo zjištěno, že u pacientů, u nichž se vyskytuje kombinace vysoké exkrece oxalátu do moči spolu s poruchou absorpce, přináší benefit vyšší příjem vápníku ze stravy i potravinových doplňků [21] s titrací dávky dle potřeby na základě exkrece oxalátů (jako primárního parametru).
Vysoká exkrece oxalátů do moči – příjem oxalátů
U pacientů se stabilní exkrecí oxalátů se nemusí dietologické vyšetření zaměřovat na analýzu oxalátů. Pouze u menšiny pacientů s kalcium oxalátovou litiázou bude přítomna hyperoxalurie [22], pro tyto pacienty by měla být vyhrazena analýza oxalátů. Příjem oxalátů je obtížné kvantifikovat, neboť většina nutričních databází vůbec neobsahuje hodnoty oxalátů ve stravě nebo obsahuje hodnoty pochybné kvality [23]. Množství oxalátů v konkrétní potravině však má minimální vliv. Rozhodujícím faktorem pro absorpci oxalátů a jejich exkreci do moči je spíše biologická dostupnost oxalátů v potravinách [23]. Redukci příjmu oxalátů (pokud je nezbytná) se doporučuje omezit pouze na pacienty s prokázanou hyperoxalurií, u které nezabírá normalizace příjmu vápníku, a pouze na potraviny bohaté na oxaláty (např. špenát, rebarbora, mandle, brambory, bulgur, řepa, kešu ořechy). Měli bychom se však vyvarovat úplné eliminace těchto potravin, protože se obvykle jedná o zdravé, nízkokalorické potraviny bohaté na inhibitory tvorby litiázy, jako jsou např. fytáty, magnezium, vláknina, prekurzory hydrogenuhličitanu sodného a antioxidanty, z nichž všechny inhibují určitým způsobem tvorbu litiázy.
Nízká exkrece citrátů – příjem kyselin ve stravě
Kyseliny podporují opakovanou absorpci citrátů ledvinami a omezují jejich vylučování. Strava obsahuje více kyselin, pokud postrádá draslík a prekurzory alkalických látek ve srovnání s příjmem organické síry (nebo naopak, při dostatku organické síry ve srovnání s příjmem alkalických prekurzorů). Menší příjem draslíků vede ke zvýšení sekrece H+, což zvyšuje reabsorpci citrátů [24]. Řada dospělých konzumuje menší množství draslíku, než je doporučená norma. Mezi potraviny bohaté na draslík patří většina druhů ovoce a zeleniny, luštěniny, jogurty, mléko a různé druhy ryb (ačkoli efekt aminokyselin obsahujících síru obsažených v rybách může převážit benefit draslíku). Prekurzory zásaditých látek jsou organické kyseliny, které obvykle v potravě tvoří komplexy s draslíkem (nebo případně s dalšími minerály) a zahrnují kyselinu citronovou, jablečnou a vinnou. Velké množství těchto kyselin lze nalézt ve většině druhů ovoce, zeleniny a ovocných a zeleninových šťávách. Pacientům, kteří denně konzumují méně než pět porcí ovoce a zeleniny a u nichž byla prokázána nedostatečná exkrece citrátů, lze pro začátek doporučit zvýšit příjem ovoce a zeleniny [25]. V případě nadměrného příjmu kyselinotvorných potravin – tedy potravin, které obsahují síru v aminokyselinách – je pro dosažení příznivého výsledku nutné rovněž omezit jejich přísun. Nejvyšší obsah kyselin v běžném jídle lze najít ve všech typech masa (drůbež, savci i mořští živočichové), vaječném žloutku a všech typech obilovin a obilných výrobcích (např. cereálie, těstoviny, mouka) [26]. Vzhledem k tomu, že potřeba methioninu a cystinu (síru obsahující aminokyseliny) se liší s ohledem na věk pacienta a tělesnou stavbu, obvykle se doporučuje snižovat stávající příjem těchto potravin, např. zmenšit porce daných potravin nebo omezit počet podávání. Monitorování efektu na exkreci citrátů do moči napoví, zda jsou nezbytná další omezení. V některých případech může pouhé navýšení příjmu ovoce a zeleniny pomoci dosáhnout kýženého efektu bez dalších omezení. Vzhledem k tomu, že pomocí dietetických opatření lze navýšit exkreci citrátů do moči pouze přibližně o 200 mg, u mnoha pacientů může být nezbytná doplňková farmakoterapie.
Vysoká exkrece kyseliny močové do moči – příjem purinů
Dietetické změny nebudou mít pravděpodobně zásadní vliv na snížení kyseliny močové v moči, která je vyvolaná nadměrnou produkcí kyseliny močové, jako je tomu např. u pacientů s dnou [27]. U pacientů s hyperurikosurií je pro posouzení role stravy nezbytné důkladné odebrání anamnézy a kompletní dietologické vyšetření. Pokud se skutečně prokáže role nutričních faktorů, je třeba se zaměřit na zdroje živočišných purinů, jako jsou mořské plody, ryby a vnitřnosti nebo svalová tkáň jakéhokoli živočicha (vč. drůbeže). Puriny se vyskytují i v některých rostlinách (ovšem v mnohem nižších koncentracích než v živočišných zdrojích), tyto látky však vykazují jiný efekt na metabolizmus kyseliny močové a pravděpodobně se nepodílejí na biosyntéze kyseliny močové [28]. Z tohoto důvodu není nutné jejich příjem omezovat. Neopodstatněné omezení rostlinných zdrojů purinů může vést ke snížení pH moči, v důsledku čehož se zhoršuje rozpustnost kyseliny močové v moči a zvyšuje se riziko jejího vysrážení a vzniku litiázy.
Malý objem moči – příjem tekutin
Vzhledem k tomu, že bylo publikováno obrovské množství informací o primárním efektu příjmu tekutin na výdej moči a riziko litiázy, nebudeme se tomuto tématu věnovat, kromě popisu strategií, které mohou pacientům pomoci při navyšování objemu tekutin (tab. 1).
Table 1. Strategie podporující zvýšení příjmu tekutin. 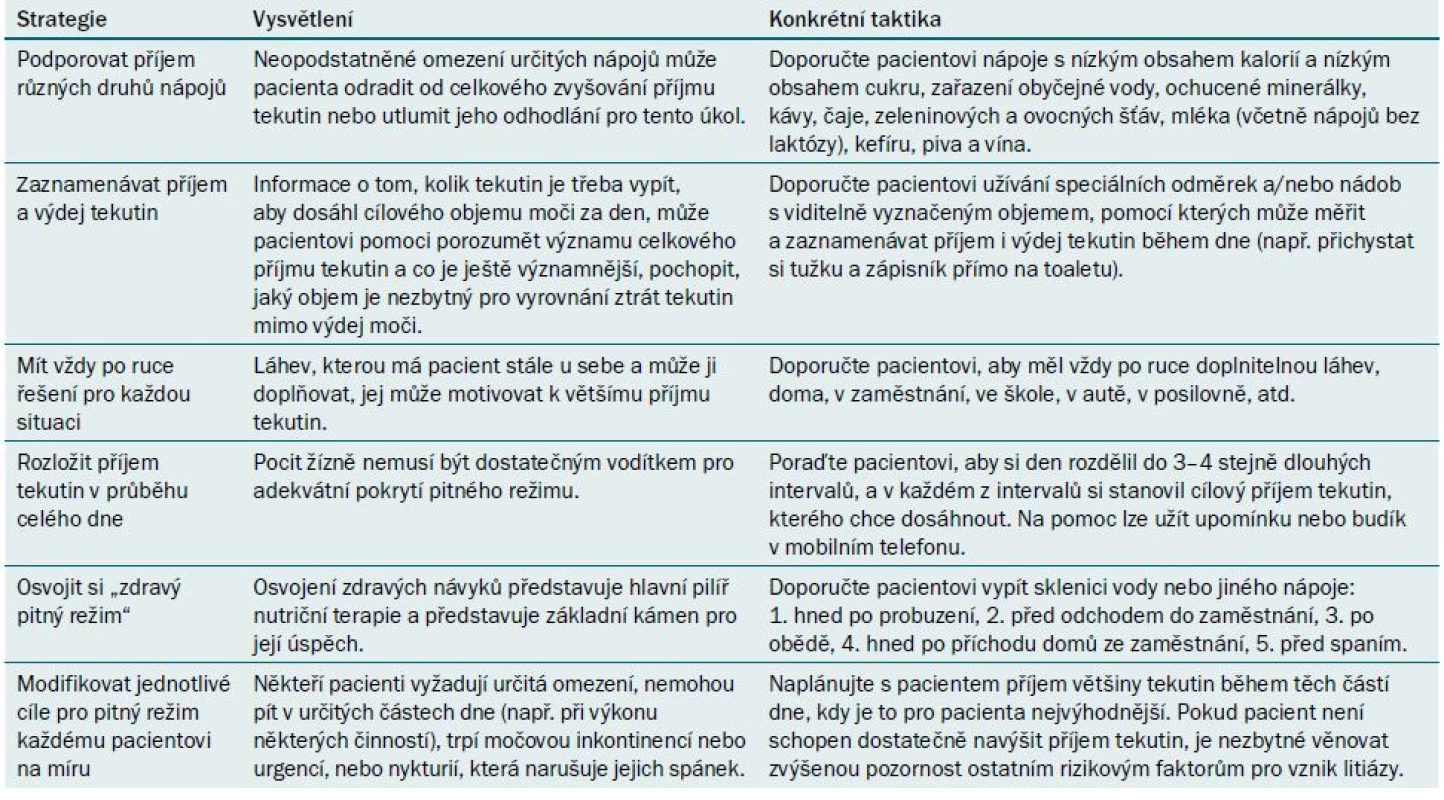
Mnohočetné močové rizikové faktory – příjem ovoce a zeleniny
Nedostatečná konzumace ovoce a zeleniny se může podílet na řadě močových poruch a litogenních rizikových faktorech, např.: 1. nízká exkrece citrátů do moči vyvolaná zvýšenou kyselostí stravy v důsledku nedostatečného příjmu prekurzorů hydrogenuhličitanu sodného; 2. nadměrné vylučování oxalátů do moči v důsledku konzumace prebiotik, která nejsou schopna kolonizovat gastrointestinální trakt bakteriemi rozkládajícími oxaláty; nebo 3. nadměrné vylučování kalcia do moči způsobené větší absorpcí kalcia v důsledku nízkého nebo nedostatečného příjmu vlákniny. V případě podezření, že se složení pacientovy stravy podílí na kterémkoli z výše uvedených faktorů, lze doporučit zvýšení příjmu nejrůznějších druhů ovoce a zeleniny (obvykle alespoň pět porcí nebo šálků denně). Méně zkušeným pacientům je třeba poradit, co obnáší pojem „porce“ při konzumaci ovoce a zeleniny, kde je nakupovat, skladovat a jak je připravovat.
Mezi další faktory, na které je možné se zaměřit a které nebyly v tomto textu diskutovány, patří fytáty, rybí olej, pyridoxin (vitamin B6), magnezium, nadměrný příjem energie/nadváha, alkohol a fruktóza. V nedávné době byla hodnocena prokázaná role redukce nebo naopak zvýšení příjmu výše uvedených faktorů nebo doplňků (v případě rybího oleje, pyridoxinu a magnezia) [29].
Závěr
Nutriční terapie pod dohledem lékaře (rovněž označovaná jako dietologická terapie) se předepisuje pacientovi na míru podobně jako farmakoterapie nebo fyzioterapie. Cíl dietologické terapie spočívá v identifikaci konkrétních dietetických mechanizmů přispívajících ke vzniku nebo riziku litiázy na základě úsudku dietologa a ve volbě terapie zacílené na tyto mechanizmy. Dietetická doporučení může udílet i lékař bez této kvalifikace. Obvykle se jedná o obecné rady týkající se prevence nebo redukce rizika litiázy, vzhledem ke specifickým rizikovým faktorům nefrolitiázy je však nutné je volit u každého pacienta přímo na míru, zejména v případě, že máme k dispozici biochemické nebo jiné údaje.
Kristina L. Penniston, PhD, RDN
Department of Urology
University of Wisconsin
1685 Highland Avenue
Madison, Wisconsin
USA
penn@urology.wisc.edu
Sources
1. Scales CD jr, Smith AC, Hanley JM et al. Prevalence of kidney stones in the United States. Eur Urol 2012; 62(1): 160–165. doi: 10.1016/j.eururo.2012.03.052.
2. Kartha G, Calle JC, Marchini GS et al. Impact of stone disease: chronic kidney disease and quality of life. Urol Clin North Am 2013; 40(1): 135–147. doi: 10.1016/j.ucl.2012.09.004.
3. Penniston KL, Nakada SY. Health related quality of life differs between male and female stone formers. J Urol 2007; 178(6): 2435–2440.
4. Knoll T, Schubert AB, Fahlenkamp D et al. Urolithiasis through the ages: data on more than 200,000 urinary stone analyses. J Urol 2011; 185(4): 1304–1311. doi: 10.1016/j.juro.2010.11.073.
5. Penniston KL, McLaren ID, Greenlee RT et al. Urolithiasis in a rural Wisconsin population from 1992–2008: narrowing of the male-to-female ratio. J Urol 2011; 185(5): 1731–1736.
6. Scales CD jr, Curtis LH, Norris RD et al. Changing gender prevalence of stone disease. J Urol 2007; 177(3): 979–982.
7. Kocvara R, Plasgura P, Petrik A et al. A prospective study of nonmedical prophylaxis after a first kidney stone. BJU Int 1999; 84(4): 393–398.
8. Atkins M, Basualdo-Hammond C, Hotson B et al. Canadian perspectives on the nutrition care process and international dietetics and nutrition terminology. Can J Diet Pract Res 2010; 71(2): e18–e20.
9. Parks JH, Coward M, Coe FL. Correspondence between stone composition and urine supersaturation in nephrolithiasis. Kidney Int 1997; 51(3): 894–900.
10. MacLellan D, Berenbaum S. Canadian dietitians’ understanding of the client-centered approach to nutrition counseling. J Am Diet Assoc 2007; 107(8): 1414–1417.
11. Souverein OW, de Boer WJ, Geelen A et al. Uncertainty in intake due to portion size estimation in 24-hour recalls varies between food groups. J Nutr 2011; 141(7): 1396–1401. doi: 10.3945/jn.111.139220.
12. Spahn JM, Reeves RS, Keim KS et al. State of the evidence regarding behavior change theories and strategies in nutrition counseling to facilitate health and food behavior change. J Am Diet Assoc 2010; 110(6): 879–891. doi: 10.1016/j.jada.2010.03.021.
13. Bell R, Penniston KL. Dietitians in practice: utilization of medical nutrition therapy for prevention of kidney stones. Renal Nutr Forum 2014; 33 : 8–11.
14. Wertheim ML, Nakada SY, Penniston KL. Current practice patterns of urologists providing nutrition recommendations to patients with kidney stones. J Endourol 2014; 28(9): 1127–1131. doi: 10.1089/end.2014.0164.
15. Patrick S. What went right? The story of US Medicare medical nutrition therapy. Nestle Nutr Workshop Ser Clin Perform Programme 2009; 12: 137–158. doi: 10.1159/000235676.
16. Food and Nutrition Board, Institute of Medicine. Dietary reference intakes: applications in dietary assessment. Washington, DC: National Academies Press. [online]. Available at: http://www.iom.edu.
17. Wallace TC, Reider C, Fulgoni VL 3rd. Calcium and vitamin D disparities are related to gender, age, race, household income level, and weight classification but not vegetarian status in the United States: analysis of the NHANES 2001–2008 data set. J Am Coll Nutr 2013; 32(5): 321–330. doi: 10.1080/07315724.2013.83990.
18. Cirillo M, Ciacci C, Laurenzi M et al. Salt intake, urinary sodium, and hypercalciuria. Miner Electrolyte Metab 1997; 23(3–6): 265–268.
19. Cashman KD, Kiely M. Recommended dietary intakes for vitamin D: where do they come from, what do they achieve and how can we meet them? J Hum Nutr Diet 2014; 27(5): 434–442. doi: 10.1111/jhn.12226.
20. Penniston KL, Jones AN, Nakada SY et al. Vitamin D repletion does not alter urinary calcium excretion in healthy postmenopausal women. BJU Int 2009; 104(10): 1512–1516. doi: 10.1111/j.1464-410X.2009.08559.x.
21. Penniston KL, Nakada SY. Effect of dietary changes on urinary oxalate excretion and calcium oxalate supersaturation in patients with hyperoxaluric stone formation. Urology 2009; 73(3): 484–489. doi: 10.1016/j.urology.2008.10.035.
22. Nouvenne A, Meschi T, Guerra A et al. Dietary treatment of nephrolithiasis. Clin Cases Miner Bone Metab 2008; 5(2): 135–141.
23. Massey LK. Food oxalate: factors affecting measurement, biological variation, and bioavailability. J Am Diet Assoc 2007; 107(7): 1191–1194.
24. Caudarella R, Vescini F. Urinary citrate and renal stone disease: the preventive role of alkali citrate treatment. Arch Ital Androl 2009; 81(3): 182–187.
25. Meschi T, Maggiore U, Fiaccadori E et al. The effect of fruits and vegetables on urinary stone risk factors. Kidney Int 2004; 66(6): 2402–2410.
26. Remer T. Influence of diet on acid-base balance. Semin Dial 2000; 13(4): 221–226.
27. Cameron JS, Simmonds HA. Hereditary hyperuricemia and renal disease. Semin Nephrol 2005; 25(1): 9–18.
28. Choi HK, Atkinson K, Karlson EW et al. Purine-rich foods, dairy and protein intake, and the risk of gout in men. N Engl J Med 2004; 350(11): 1093–1103.
29. Penniston KL, Nakada SY. Diet and alternative therapies in the management of stone disease. Urol Clin North Am 2013; 40(1): 31–46. doi: 10.1016/j.ucl.2012.09.011.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2015 Issue 2-
All articles in this issue
- Dietologické vyšetření pacientů s ledvinnými kameny
- Vyšetřování pacientů s kalciovou litiázou
- Jak na perkutánní nefrolitotomii
- Medikamentózní léčba karcinomu močového měchýře
- Urodynamika – průběh vyšetření a indikace
- Poruchy ejakulace, sexuální apetence a orgazmu u mužů po spinálním traumatu v závislosti na rozsahu míšní léze
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Urodynamika – průběh vyšetření a indikace
- Jak na perkutánní nefrolitotomii
- Poruchy ejakulace, sexuální apetence a orgazmu u mužů po spinálním traumatu v závislosti na rozsahu míšní léze
- Vyšetřování pacientů s kalciovou litiázou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

