-
Medical journals
- Career
Možnosti chirurgické léčby hyperaktivního močového měchýře (OAB)
Authors: A. Čermák
Published in: Urol List 2008; 6(1): 35-43
Overview
Prevalence močové inkontinence (UI) a hyperaktivního močového měchýře (OAB) roste s věkem. Lidé vyššího věku jsou nejrychleji rostoucí skupinou obyvatelstva. Mnoho starších lidí se domnívá, že močová inkontinence je projevem stárnutí a nenavštíví svého lékaře. Ten pak musí vynaložit úsilí k získání objektivních informací o jejich potížích a skutečném zdravotním stavu. Přítomnost dalších komorbidit u starších pacientů a často početná medikace vyžaduje komplexní přístup k diagnostice a léčbě. Stejně tak jako jsou příčiny inkontinence obvykle multifaktoriální, tak i způsob léčby může být značně variabilní: může využívat medikamentózní a behaviorální léčbu, jakož i různé technologie. V každém případě musí být léčba vždy zaměřena na konkrétního pacienta. Jestliže selžou konzervativní metody, existují operační a méně invazivní operační techniky, totiž postupy, které při použití nových pomůcek umožňují efektivní léčbu.
Klíčová slova:
geriatrie, hyperaktivní močový měchýř, močová inkontinenceÚVOD
Terminologie
Hyperaktivní měchýř (overactive bladder – OAB) je definován jako soubor symptomů, které ukazují na možnou poruchu funkce dolních močových cest. Charakteristickými rysy jsou urgence, obvykle doprovázené častým močením (frekvence), noční močení (nykturie), v některých případech úniky moči (urgentní inkontinence). Hyperaktivní močový měchýř není stav spojený s vysokou mortalitou či morbiditou, ale může velmi negativně ovlivnit kvalitu života postiženého, zvláště je-li onemocnění doprovázeno projevy inkontinence. V poslední době se doporučuje používat termín mokrý hyperaktivní močový měchýř (wett OAB) pro stavy, kdy je součástí symptomů OAB urgentní inkontinence a termín suchý močový měchýř (dry OAB) pro stav, kdy inkontinence chybí [1,2].
Zůstává realitou, že muži i ženy trpící inkontinencí moči návštěvu lékaře odkládají a vyhledávají ji se zpožděním. I přes poměrně častý výskyt tohoto problému se jen méně než polovina pacientů postižených únikem moči se svými obtížemi svěří lékaři včas, protože se buďto stydí o problému hovořit, nebo považují inkontinenci moči za normální součást stárnutí, případně se ji sami pokoušejí řešit snadno dostupnými absorbujícími pomůckami. Mnozí z nich si obecně neví rady, jak se s problémem vypořádat, nemají velkou důvěru v možnosti léčby nebo mají prostě strach z chirurgického zákroku.
Hovoru o inkontinenci moči (nebo stolice) se vyhýbají nejen pacienti, nezřídka toto téma obcházejí i lékaři. Proto se o těchto problémech obvykle hovoří velmi málo. Takový přístup se podílí na tom, že ekonomickým důsledkům, které péče o osoby trpící inkontinencí moči pro veřejné zdravotnictví i pro inkontinencí postižené osoby a jejich rodiny přináší, není věnována odpovídající pozornost [3].
O inkontinenci moči se většinou uvažuje jako o problému postihujícím převážně ženy. Ve skutečnosti je poměr výskytu inkontinence u žen a mužů zhruba 2 : 1. Ve vyšších věkových skupinách se rozdíly v prevalenci močové inkontinence dále snižují. Z výsledků šetření provedeného v roce 2003 agenturou STEM lze vyvodit, že muži o inkontinenci většinou se svým lékařem nehovoří. Muži se nezřídka chovají tak, jako by se jednalo o problém, o kterém není potřeba se zmiňovat, kterému není třeba věnovat pozornost a který nezasluhuje léčbu [4]. Zmíněný průzkum svědčí o tom, že muži na rozdíl od žen zpravidla a dosti dlouho nevěnují inkontinenci moči přiměřenou pozornost. Pomocí uvedeného průzkumu bylo též zjištěno, že v ČR asi 34 % respondentů trpí alespoň občasnou inkontinencí. Uváděný podíl urgentní inkontinence je asi 29 %.
Etiopatogeneze
I přes pokroky našich znalostí o OAB může zůstat etiopatogeneze v některých případech nejasná; pak se jedná o tzv. idiopatický OAB. Na rozdíl od primárního (idiopatického) hyperaktivního měchýře, vzniká sekundární hyperaktivní měchýř na podkladě zjistitelné vyvolávající příčiny (zánět, cystolitiáza, cizí těleso, nádor močového měchýře, intersticiální cystitida, neurogenní poruchy, subvezikální obstrukce, radioterapie apod). Základním předpokladem úspěšné léčby je správná diagnóza a eliminace eventuální vyvolávající příčiny. Každá dysfunkce dolních močových cest projevující se inkontinencí moče vyžaduje individuální diagnostický i terapeutický přístup.
V případech, kdy konzervativní a méně invazivní metody nevedou k úspěchu, je nutno zvažovat chirurgické metody léčby za účelem zlepšení kvality života, zajištění kontinence, zachování nebo zlepšení funkce ledvin, minimalizace komplikací.
Cílem chirurgické léčby OAB je:
- zvýšení jímavosti močového měchýře
- dosažení optimální kontinence moči
- evakuace močového měchýře bez postmikčního rezidua
- zabránění uroinfekci
- uchování nebo zlepšení stavu funkce ledvin a horních močových cest
Podmínkou úspěšné chirurgické intervence je:
- adekvátní motivace pacienta
- správné posouzení jeho fyzických a psychosociálních limitů
Pro léčbu hyperaktivního močového měchýře jsou indikovány tyto operační postupy: parciální myektomie, augmentační enterocystoplastiky, supravezikální derivace moči (ileální konduit, ureterosigmoideostomie, sigma-rectum pouch), náhrada močového měchýře – ortotopická (na uretru) nebo heterotopická (cévkovatelný ventil do pupku), tzv. kontinentní derivace moči.
Při operaci měchýře musí zůstat nepoškozené hrdlo močového měchýře a sfinkterový mechanizmus. Stejně tak musíme velmi pečlivě dbát, aby preparace v oblasti trigona byla šetrná: musíme zachovat intaktní ureterovezikální spojení a vyhnout se tak vzniku refluxu. Jestliže je reflux již přítomen, je nezbytné operaci doplnit reimplantací močovodu s antirefluxní technikou.
V minulosti se ke zvýšení kapacity měchýře používaly různé denervační operace (cystolýza, transekce apod) nebo aplikace fenolu, hydrodistenze či autoaugmentace.
1. PARCIÁLNÍ MYEKTOMIE
Metoda byla poprvé publikována v r. 1989 [28,29]. Princip techniky spočívá v odpreparování a snesení detruzoru z těla močového měchýře a následné fixaci okrajů zbytku stěny močového měchýře oboustranně k m. psoas. Jde o vytvoření arteficiálního objemného pseudodivertiklu s ponecháním intaktní sliznice. Pseudodivertikl se širokou stopkou zvětšuje kapacitu měchýře a vytváří zónu úniku při nárůstu intravezikálního tlaku. Výkon je relativně jednoduchý a provádí se extraperitoneálně. Ehrlich a Gershman navrhli laparoskopickou autoagumentaci [5]. Přístup je transperitoneální a provádí se několik incizí stěny bez porušení sliznice. Vzniká tak řada pruhů na povrchu měchýře, detruzor však není odstraněn.
Asi v 50 % případů je nutná pooperační evakuace měchýře intermitentní katetrizací. V některých případech nedochází k mikci vůbec, v některých případech je třeba „docévkovávat“ postmikční reziduum.
Časné komplikace se vyskytují asi ve 3 %, při dlouhodobém sledování je výskyt komplikací vyšší (až 40 %). Asi 50 % pacientů dosáhne kontinence. Výhodou metody je relativní jednoduchost operace a v případě potřeby možnost dalších operačních alternativ v druhé době [6,7].
Image 1. Parciální myektomie. (A – preparace svaloviny detruzoru B – vytvoření arteficiálního pseudodivertiklu s ponecháním intaktní sliznice C – fixace okrajů stěny močového měchýře oboustranně k m. psoas) 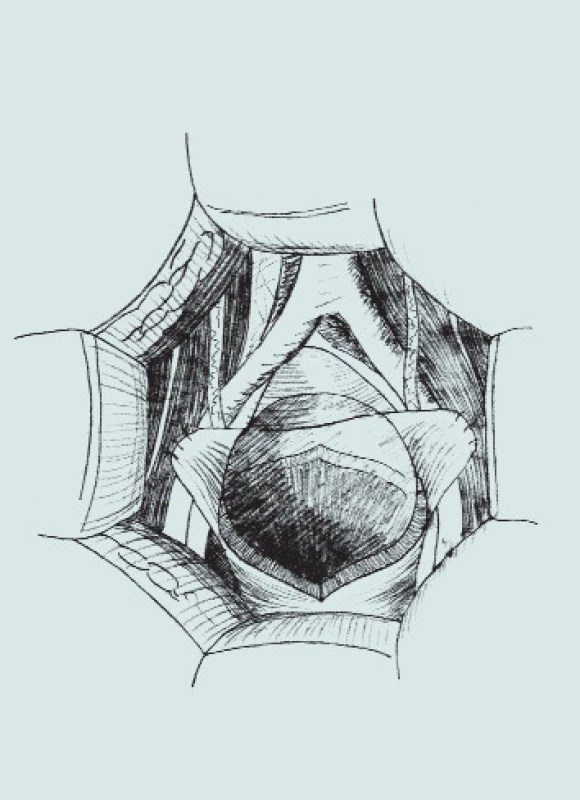
2. AUGMENTACE MOČOVÉHO MĚCHÝŘE
Augmentací močového měchýře (augmentační cystoplastika) rozumíme chirurgickou metodu, která má za cíl zvětšení kapacity močového měchýře. Indikací k augmentaci měchýře je nízká kapacita, nízká kompliance detruzoru, či vysoký LPP (leak point pressure, resp. vysoký intravezikální tlak s rizikem vzniku vezikorenálního refluxu, sekundárních megaureterů atd).
Nejužívanějším augmentačním materiálem zůstává stále střevní segment, nejčastěji terminální ileum. Obdobně lze využít i jiné části střevních segmentů (ileocékální segment, colon, sigma) či žaludeční antrum (gastrocystoplastika). Lze použít i stěnu dilatovaného močovodu u nefunkční ledviny.
Nejčastěji používaná technika je tzv. clam-cystoplastika spočívající v široké incizi močového měchýře a našití detubularizovaného střevního segmentu (podmínkou úspěchu je dostatečně rozsáhlá incize). Střevní segment použitý k augmentaci je nutno vždy detubularizovat (rozpoltit na antimezenteriální straně, zrušit trubicovitý tvar střeva a vytvořit záplatu).
2.1. Ureterální augmentace
V případě, že po předchozí nefrektomii zůstal dostatečně dlouhý pahýl ureteru, nebo v případě nefunkční ledviny s hydroureterem lze k augmentaci použít stěnu močovodu [15]. Podmínkou je zachování výživy použitého močovodu, eventuálně ledvinné pánvičky. V proximálních 3 se důsledně zachovává výživa močovodu přicházející hlavně z a. renalis, a. testicularis, resp. a. ovarica, a. ductus deferentis/ a. uterina. V abdominálním úseku přistupují cévy k močovodu z mediální strany, v pánevním úseku z laterální strany (větévky a. vesicalis superior, media). Výhodou tohoto typu augmentace je zachování uroteliální výstelky měchýře (nedochází k metabolickým změnám z důvodu resorpce) a možnost provedení augmentace bez nutnosti transperitoneálního přístupu (riziko infekce, vznik srůstů, které komplikují nebo znemožňující eventuální následnou peritoneální dialýzu.
Image 2. Ureterální augmentace. (A – podélná incize hydroureteru a m.m., B – vložení vytvořené záplaty do rozpolceného m.m., C – vytvoření kupole m.m.) 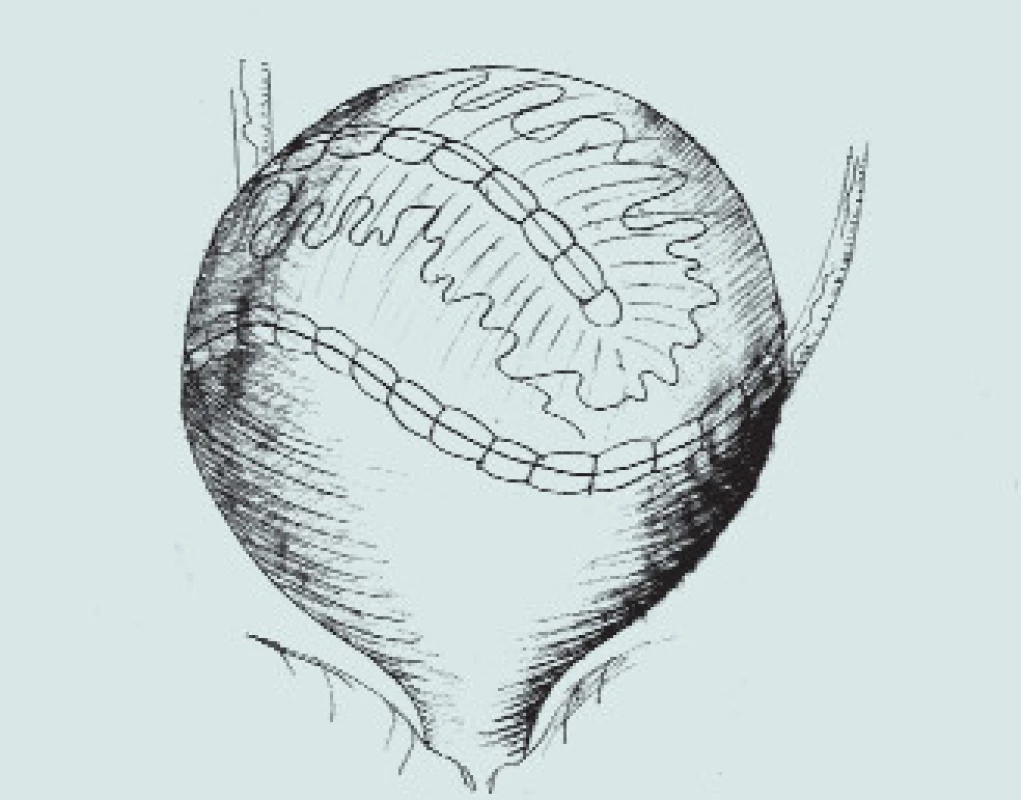
2.2. Intestinální augmentace (enterocystoplastika)
Liší se podle použité části střevního segmentu.
2.2.1. Ileální augmentace
Stále nejužívanějším augmentačním materiálem zůstává střevní segment, nejčastěji terminální ileum. Segment použitý k augmentaci je nutno vždy detubularizovat.
Nejčastěji používaná technika je tzv. clam-cystoplastika spočívající v široké incizi močového měchýře a našití detubularizovaného střevního segmentu. U clamtechniky se močový měchýř inciduje v sagitální, nebo frontální rovině. Podmínkou úspěchu je dostatečně rozsáhlá incize, která dosahuje až k trigonu. Při sagitálním řezu vede incize až k intertrigonální řase, při frontálním řezu asi 1 cm nad hrdlo.
Nedostatečná incize vede ke zúžení vchodu a vznikne močový měchýř ve varu přesýpacích hodin. Nedostatečná evakuace hlenu produkovaného střevem vede k chronickému zánětu a vzniku cystolitiázy. Délka segmentu u clam-cystoplastiky by měla odpovídat obvodu měchýře od jednoho konce discize k druhému [30].
Při použití záplaty, tzv. patch-techniky, se provede resekce močového měchýře subtotální s ponecháním intaktního trigona a hrdla močového měchýře. Následuje použití střevního segmentu, který se připravuje jako u všech substitučních cystoplastik. Nejčastěji se používá preterminální klička ilea. Střevní segment použitý k augmentaci je také nutno vždy detubularizovat. Sutura se provádí vstřebatelným pokračovacím stehem.
Kontinuita zažívacího traktu se zajistí provedením střevní anastomózy end to end zpravidla ruční technikou pokračujícím vstřebatelným stehem v jedné nebo ve 2 vrstvách. Alternativou může být užití mechanické anastomózy – staplerovou technikou nebo pomocí biofragmentabilního prstence Valtrac. Četnost komplikací (dehiscence) je u všech metod srovnatelná a všechny umožňují konstrukci jak konec ke konci tak stranou ke straně [31,32].
Image 3. Clam-cystoplastika - ileální augmentace. (A – příprava a rozpolcení m.m., B – izolace distálního segmentu ilea, C – uzavření mezenteria a anastomóza střevní end-to-end, D – detubularizace ileálního segmentu a vytvoření ileální záplaty, E - anastomóza záplaty s měchýřem a uzavření plastiky m.m.) 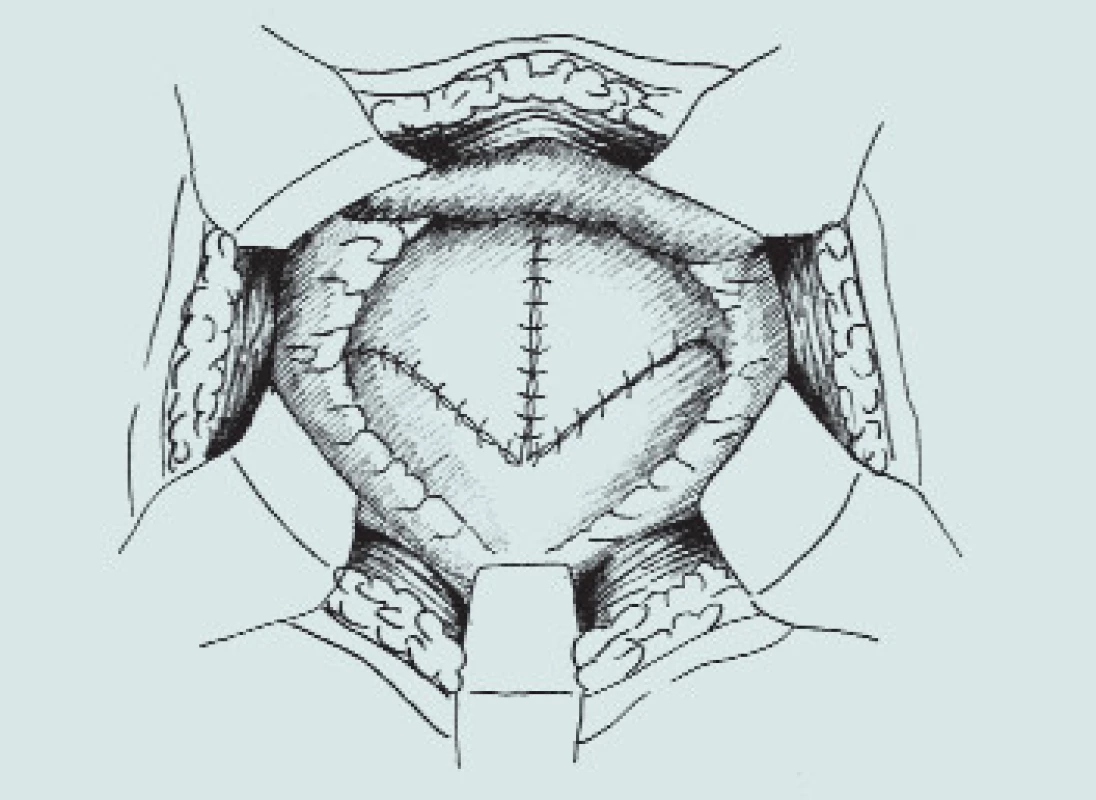
2.2.2. Ileocékální augmentace
Při ileocékální augmentaci se provádí technika Mainz pouch I (mixed augmentation ileum‘n zecum), která byla popsána v roce 1985. Využívá se terminálního ilea a céka. I při této technice je nutné provést detubularizaci incizí střeva na antimezenteriální straně, nejprve se sešijí 2 detubularizované tenké kličky, vzniklá záplata se sešije s detubularizovaným cékem a vytvořená plocha, která je dostatečně rozsáhlá, se použije k náhradě části močového měchýře. Vzniklý vak je dostatečně objemný a má velkou kapacitu.
2.2.3. Sigmoideální augmentace
Pro náhradu u clam - i patch - cystoplastiky lze použít esovitou kličku. Výhodu spatřujeme v tom, že stěna sigmatu je silnější a blíží se tloušťce stěny močového měchýře a také v tom, že lumen sigmoidea je širší a postačí tak exkludovat kratší segment. Výhodou je i anatomická poloha blízko močového měchýře. U pacientů s vrozeně krátkým mezenteriem, u stavů po operaci meningomyelokély nebo u pacientů s výraznou bederní lordózou je použití esovité kličky jediná možnost. Nevýhodu spatřujeme v přítomnosti střevní bakteriální flóry, vyšší produkci hlenu, menší bezpečnosti anastomózy a možnosti vzniku divertiklů.
2.3. Augmentační gastrocystoplastika
Principem je vytvoření klínovité (wedge) resekce těla žaludku se zachováním intaktní malé kurvatury. Podmínkou úspěchu je zachování dostatečné výživy. Ta je většinou zajištěna mobilizací segmentu a zachováním pravých gastroepiploických cév. Celý segment i s cévní stopkou se protahuje za mezokolon přes mezenterium a transponuje se až k močovému měchýři. Vyživovací stopka musí být bez napětí a bez strangulace ve svém průběhu [8–11].
Výhodu gastrocystoplastiky lze spatřovat ve snížení komplikací z hyperchloremické acidózy a lze ji použít i u pacientů s renální insuficiencí.
Mezi nevýhody patří fakt, že u gastrocystoplastiky se setkáváme s tzv. hematuricko - dysurickým syndromem. Vyskytuje až v 1/3 případů, má občasný charakter a s časem se může zlepšovat. Projevuje se intermitentní bolestí nad sponou stydkou, zbarvenou močí, vznikem vředu až perforací žaludeční sliznice [26, 27]. Velmi intenzivně se projevuje u pacientů s insuficiencí hrdla močového měchýře, nebo zejícím hrdlem, kdy dochází k iritaci sliznice uretry močí s velmi kyselým pH [12, 13].
Snížení nežádoucích účinků lze dosáhnout perorálním podáváním omeprazolu nebo intravezikálními instilacemi natriumbikarbonátu. Omeprazol je inhibitor enzymatického systému H+/K+ ATPázy parietální buňky žaludeční sliznice (tzv. protonové pumpy). Je účinným inhibitorem sekrece HCl, tlumí sekreci bazální i stimulovanou bez ohledu na druh sekrečního podnětu.
Image 4. Patch-cystoplastika s použitím colon ascendens. (A – resekční linie močového měchýře a segmentu střeva, B – příprava detubularizovaného segmentu colon, C – sutura okrajů střevního segmentu, D – vytvoření kupole m.m., E – uzavření plastiky nízkotlakého močového měchýře) 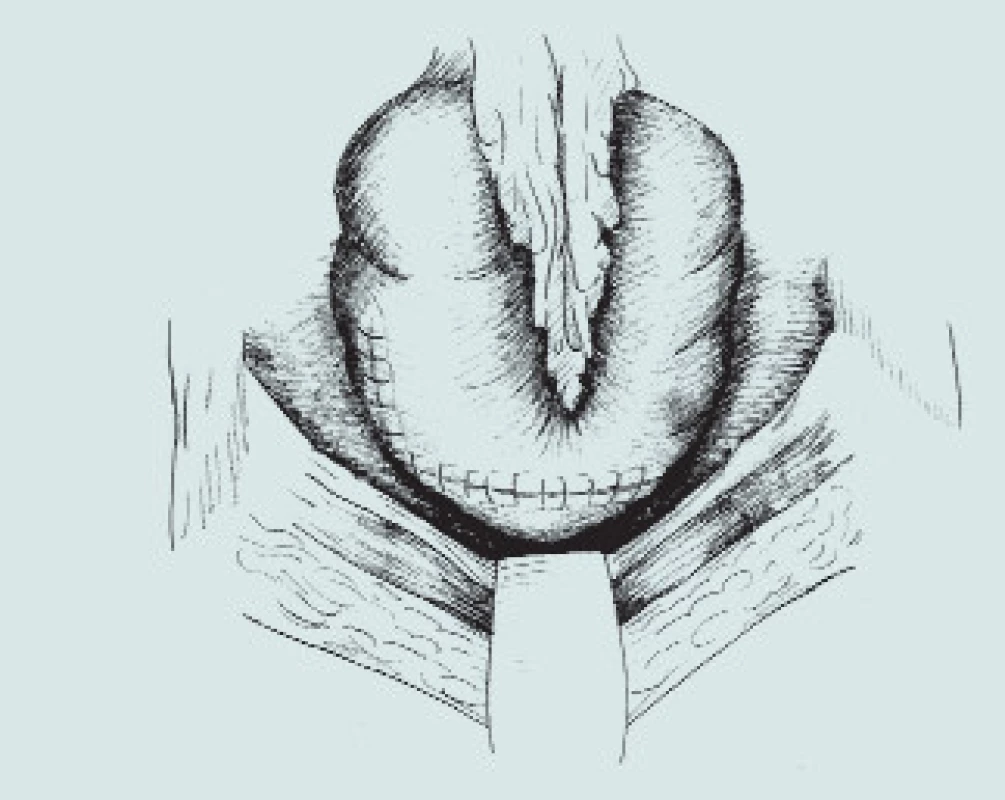
3. AUTOAUGMENTACE
Autoaugmentace spojené se seromuskulárními laloky GIT
3.1. Autoaugmentační sigmoideocystoplastika
Image 5. Ileocékální augmentace. (A – ileocékální resekční linie střevního segmentu, B – příprava detubularizovaného segmentu, sutura okrajů střevního segmentu, rekonfigurace s vytvořením kupole, C – našití vytvořené kupole na stěny močového měchýře) 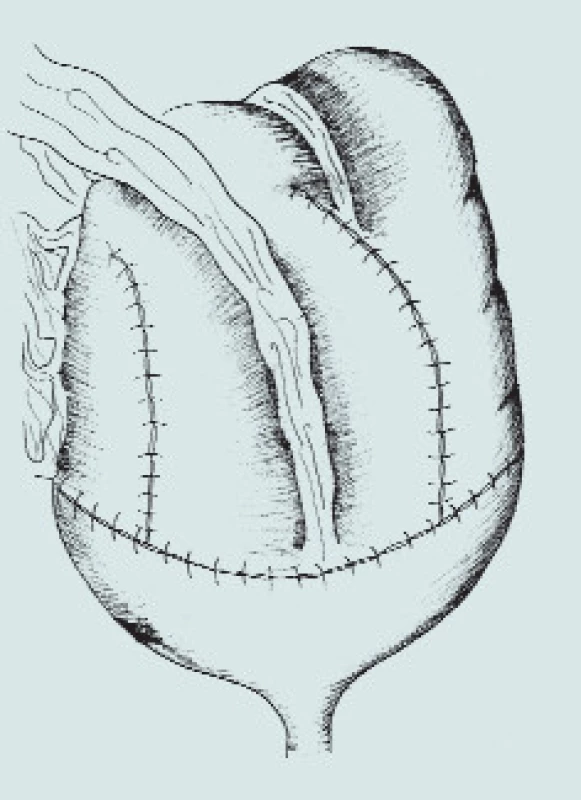
Image 6. Sigmoideální augmentace. (A – izolace sigmoidea se zachováním výživy větví a. colica inferior, B – izolace sigmoidea s použitím stoperu, C – rekonfigurace detubularizovaného sigmoidea a anastomóza s rozpolceným m. měchýřem) 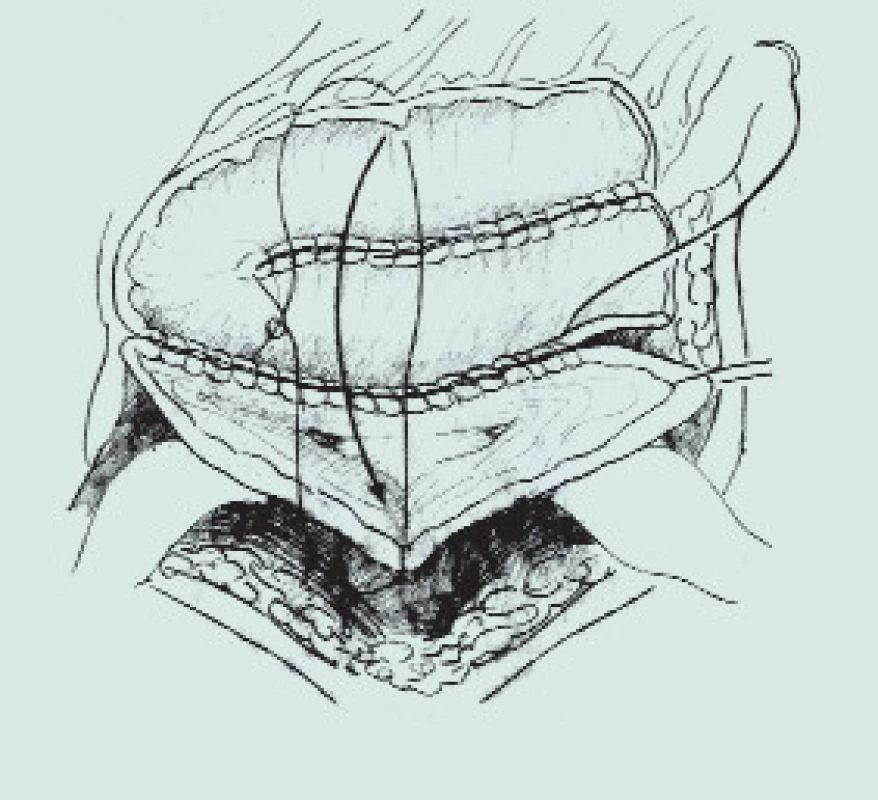
3.2. Autoaugmentační gastrocystoplastika
Obě techniky využívají metody našití záplaty vaskularizovaného laloku (esovitá klička, klínovitá resekce stěny žaludku) s přísně denudovaným epitelem na autoaugmentovaný měchýř. Měchýř se nejprve připraví autoagmentací a vytvoří se objemný arteficiální divertikl. Lalok střeva nebo žaludku se přešije přes sliznici středně naplněného močového měchýře [16]. Problémem může být obtížné odstranění sliznice a submukózy, které musí být kompletní. Sekrece žaludeční šťávy nebo střevního hlenu vede k neúspěchu operace. Také krvácení z ranné plochy po odstranění sliznice (byť minimální) vede ke komplikacím. Záplata musí být našita na mírně distendovaný močový měchýř, aby došlo ke správnému přilnutí v celé ploše a nedošlo ke svraštění před definitivním přihojením. Distenze (hydrodistenze) měchýře můžeme dosáhnout vyvedením epicystostomie a umístěním v úrovni asi 15 cm nad sponou, čímž je vytvořen odpovídající intravezikální tlak s rozepnutím měchýře, nebo naplněním balonku s větším objemem.
3.3. Autoaugmentace spojená s omentoplastikou
Předchozí 2 typy operací jsou technicky i pooperačně ošetřovatelsky náročné. Alternativou, která může zajistit bezpečnost tzv. papírového divertiklu a zabránit jeho perforaci, je metoda, kdy se na autoaugmentovaný měchýř našije záplata z mobilizovaného a vaskularizovaného omenta [14].
Image 7. Autoaugmentace s omentoplastikou. 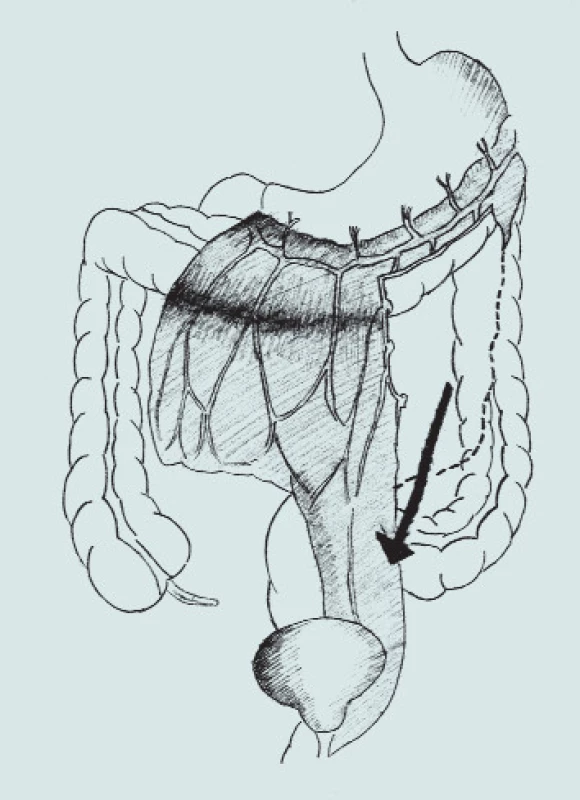
4. AUGMENTACE MOČOVÉHO MĚCHÝŘE Z UROTELIÁLNÍCH ŠTĚPŮ IN VIVO
Pravděpodobně nejlepší perspektivu úspěšného řešení by mělo nabídnout tkáňové inženýrství, které by mohlo poskytnout dostatečné množství kvalitního autologního materiálu k vytvoření náhrady porušené části močového měchýře [17,18].
5. DERIVACE MOČI
5.1. Substituce – náhrada močového měchýře
Ortotopická náhrada – vytvoření neoveziky a její napojení na uretru. Pacient močí přirozenou cestou pomocí břišního lisu.
Heterotopická – vytvoření neoveziky a cévkovatelného ventilu, který je vyústěn na přední stěnu břišní, nejčastěji do oblasti pupku, (kontinentní derivace moče). Pacient se cévkuje do stomatu a neoveziku vyprazdňuje v pravidelných intervalech.
Image 8. Náhrada močového měchýře - schéma ortotopické ileální neoveziky a napojení na stávající uretru. 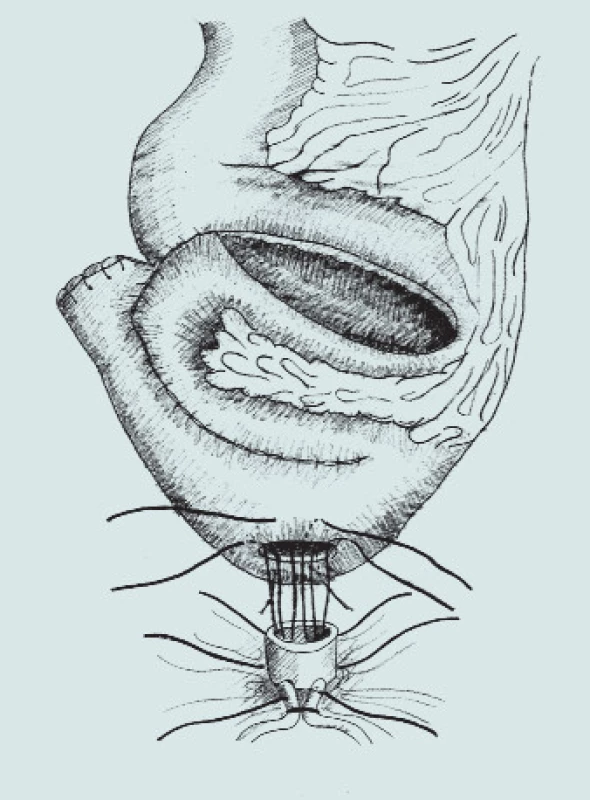
5.2. Derivace moči
Inkontinentní typ (ileální konduit, ureterosigmoideostomie)
KOMPLIKACE
Augmentovaný či autoagumentovaný močový měchýř postrádá v části svého obvodu přirozeně inervovanou svalovinu a stává se tak nízkotlakým rezervoárem. Vyprazdňování moči se tak děje buďto pomocí břišního lisu doplněného Credeho hmatem nebo čistou intermitentní katetrizací. Někteří pacienti se nemohou vymočit vůbec, u některých je třeba „docévkovávat“ postmikční reziduum. Nedokonalé vyprazdňování měchýře, metabolické změny při deficitu střevního segmentu, přítomnost mikroorganizmů a hlenu vedou ke vzniku cystolitiázy. Hlen, jehož produkce závisí na humorálních podnětech, může vést k poruchám vyprazdňování měchýře břišním lisem i při cévkování a části hlenu mohou být základem pro vznik litiázy.
Komplikace vyplývající z použitého materiálu
Zkrácením zažívacího systému dochází k metabolickým poruchám. Při použití terminálního ilea dochází k poruše vstřebávání liposolubilních vitaminů A, D, E, K a vitamínu B12. Deficit vitaminu B12 bývá většinou subklinický. Nepřesáhne-li délka použitého segmentu terminálního ilea 50 cm, postačí ke korekci resorpční schopnosti zbytku střeva a hypovitaminóza se neprojeví [19]. Při větším rozsahu lze malabsorpci vitaminu B12 u normálně živené osoby očekávat za 3–5 let po resekci ilea. Deficit se projevuje anemií a neurologickými příznaky. Porucha metabolizmu (resorpce) žlučových kyselin se projeví průjmovitou stolicí. Resorpční schopnost střevního segmentu vede ke vstřebávání chloridových, vodíkových a amoniových (NH3, NH4) iontů z moči. Amoniové ionty se vážou na chlór a vzniká hyperchloremická acidóza. Ta je zpočátku kompenzována zvýšenou respirací. K rozvoji acidózy dochází za 2–8 měsíců, kdy se klinicky projeví vyčerpání vlastních kompenzačních mechanizmů. Korekci metabolické hyperchloremické acidózy provádíme podáváním natriumbikarbonátu podle aktuálních hodnot biochemického vyšetření acidobazické rovnováhy (ABR). Riziko vzniku intestinální osteopatie lze snížit podáváním kalcia. Tvorbu oxalátové urolitiázy a cholecystolitiázy lze snížit podáváním kalcia perorálně. Absorpci oxalátů (s následnou hyperoxalurií) může též snížit podávání cholestyraminu. Při použití tlustého střeva může dojít ke kolonizaci augmentovaného měchýře původně přirozenými střevními bakteriemi nebo patogeny, což může vyvolat vznik malignit. Incidence maligního zvrhnutí (adenokarcinom) při použití střevních segmentů k augmentaci není přesně známa; dochází k němu s mnohaletou latencí. Výskyt je však nižší než u ureterosigmoideálních derivací moči, kde je nádorová přeměna dávána do přímé souvislosti s působením moči na střevní sliznici za současného kontaktu stolice.
Použití žaludeční sliznice má výhody právě u pacientů s renální insuficiencí. Žaludek produkuje kyselinu chlorovodíkovou, ionty Na+, K+, což je výhodné právě u pacientů s metabolickou acidózou [20]. Při vyšších ztrátách HCl a iontů je však pacient ohrožen hypochloremickou a hyponatremickou alkalózou a dehydratací. U augmentační gastrocystoplastiky se může vyskytnout hematuricko-dysurický syndrom.
U dětí nebo pacientů s chronickou renální nedostatečností se provádí gastrocystoplastika. Výhodná je technika ureterální augmentace. Použití segmentu žaludku u pacientů s renální insuficiencí znázorňuje obr. 7. Výhodou gastrocystoplastiky ve srovnání s enetrocystoplastikou je snadnější ureterogastrická anastomóza, minimální metabolické změny a žádná produkce hlenu.
Image 9. Gastrocystoplastika. (A – klínovitá resekce těla žaludku s bází na velké kurvatuře, B – mobilizace segmentu žaludku s ponecháním výživy pravou gastroepiploickou arterií, C – transpozice segmentu žaludku do pánve a anastomóza s močovým měchýřem) 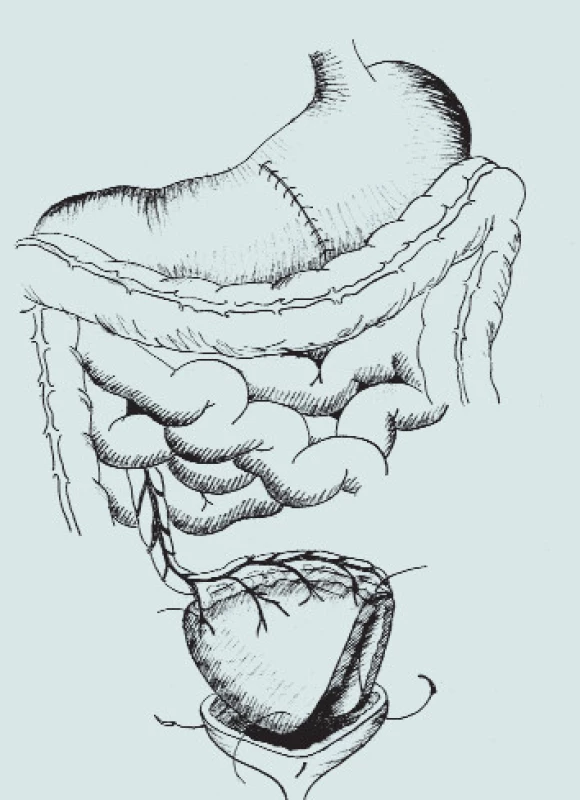
KONTRAINDIKACE
Kontraindikací je relativně málo.
Faktor pacienta
Základní podmínkou úspěchu je správně motivovaný, spolupracující a manuálně způsobilý pacient. Od počátku musí být rodina i pacient informováni, že čistá katetrizace může být trvalou rutinní součástí života.
Ledvinné funkce
Renální nedostatečnost byla původně zařazena mezi absolutní kontraindikace augmentačních operací. Smith předpokládal, že clearence kreatininu < 40 ml/min může vyvolat metabolické komplikace resorpcí metabolitů střevem [21]. Kuss přepdokládal, že clearence > 15 ml/ml jsou dostačující [22]. Hendren naopak předpokládal, že dojde ke zlepšení renálních funkcí eliminací vezikoureterálního refluxu a zabráněním vzniku následné pyelonefritidy [23]. Podobně Stephenson doporučoval vytvoření nízkotlakého rezervoáru jako vhodné přípravy před provedením renální transplantace [24]. Dnes je augmentace všeobecně považována za metodu, která může vést k ochraně nebo zlepšení renálních funkcí. Je však nanejvýš vhodné informovat pacienta i jeho rodinu, že může dojít k poškození ledvinných funkcí s následnými ireverzibilními změnami a vznikem end stage kidney.
Anatomické podmínky
Anatomické poměry a zvláště předchozí vícečetné břišní operace mohou být příčinou komplikací při operačním řešení. V případě již zavedené peritoneální dialýzy je vhodné volit podle možností alternativu s retroperitoneálním přístupem, v případě použití střevního segmentu je nutná důkladná předoperační i pooperační antibiotická léčba – jako prevence infekce peritoneálního shuntu.
Těhotenství a porod
K otěhotnění dochází v převážné většině u žen, které podstoupily ještě v dětství cystoplastiku, nejčastěji pro vrozené vývojové vady. Dříve se předpokládalo, že těhotenství není s těmito operacemi slučitelné, a proto byly uvedené zákroky indikací k jeho ukončení. Předpokládalo se, že gravidní uterus zkomprimuje a poškodí cévní zásobení novotvořeného segmentu. Hill a Kramer těhotenství nevylučují. Pokud je provedena enterocystoplastika bez alterace sfinkterového a kontinentního mechanizmu, doporučují porod přirozenou cestou. V situacích, kdy je provedena rekonstrukce hrdla močového měchýře, fasciální sling, uretropexe nebo implantace umělého svěrače, doporučují porod císařským řezem [25].
MÍŠNÍ STIMULACE
Stav neurogenně podmíněné hyperaktivity detruzoru s dyssynergií sfinketru (DSD) je závažnou poruchou urodynamiky dolních močových cest. Diagnostika i terapie jsou obtížné.
U pacientů s kompletní traumatickou míšní lézí, jejímž důsledkem je např. detruzororabdosfinkterická dyssynergie s hyperreflexií detruzoru je možno využít elektrostimulace míšních nervových kořenů.
Operace má 3 fáze:
- přerušení zadních kořenů míšních (tzv. sakrální deaferentace) S2-S5
- implantace elektrod na přední kořeny míšní
- implantace přijímače pod kůži boku (navíc lze přerušit ještě větev pudendálního nervu v Alcockově kanálu, čímž se docílí souvislejšího mikčního průtoku)
INTERMITENTNÍ KATETRIZACE
Intermitentní katetrizace je pravidelné vyprazdňování močového měchýře cévkou, kterou provádí pacient sám, nebo jeho asistent. Do klinické praxe ji zavedli Guttmann a Frankel v období II. světové války, avšak technika sterilní katetrizace byla nákladná a velmi náročná pro zdravotnický personál. V současné době se používá metoda tzv. čisté intermitentní katetrizace, kterou popularizoval Lapides v roce 1972. Časté a pravidelné vyprazdňování měchýře zajistí nízké hodnoty intravezikálního tlaku a umožňuje překonávání bakteriální invaze vlastními obrannými schopnostmi organizmu.
Čistá intermitentní katetrizace je výkon, který je jednoduchý a snadno proveditelný. Je důležité, aby byl každý lékař schopen pacientovi poradit, jakým způsobem katetrizaci provádět a upozornil jej na možné chyby a komplikace. Katetrizaci mohou provádět muži, ženy i děti. Děti se mohou učit katetrizovat od 4–5 let, jestliže mají v rukou dostatečnou citlivost k manipulaci s katétrem. Pokud ano, měly by být edukovány zdravotní sestrou nebo lékařem, nikoliv poučenými rodiči.
Hydrofilní katétry
Conveen EasiCath katétr je vyrobený z polyvinylchloridu (PVC) a potažený vrstvou polyvinylpyrolidonu (PVP), který váže molekuly vody a tím několikanásobně zvětšuje svůj objem. Po zanoření katétru na třicet sekund do vody se na jeho povrchu vytvoří hydrofilní vrstva, která minimalizuje tření a bolestivost. Díky tomu se snižuje i riziko poranění močové trubice při zavádění katétru.
V neposlední řadě je třeba znát možnosti předpisu pomůcek pro čistou intermitentní katetrizaci; pacient musí mít v zásobě dostatečné množství katétrů a ostatního materiálu.
Katétry se předepisují na poukaz na léčebnou a ortopedickou pomůcku. Katétry EasiCath patří do skupiny 13 číselníku VZP. Jsou hrazeny VZP ze 75 % a podléhají schválení revizního lékaře. Minimální preskripce je jedno balení = 25 ks. (Vyplněný poukaz – vzor obr. 10).
Image 10. Vzor vyplněného poukazu na katétr. 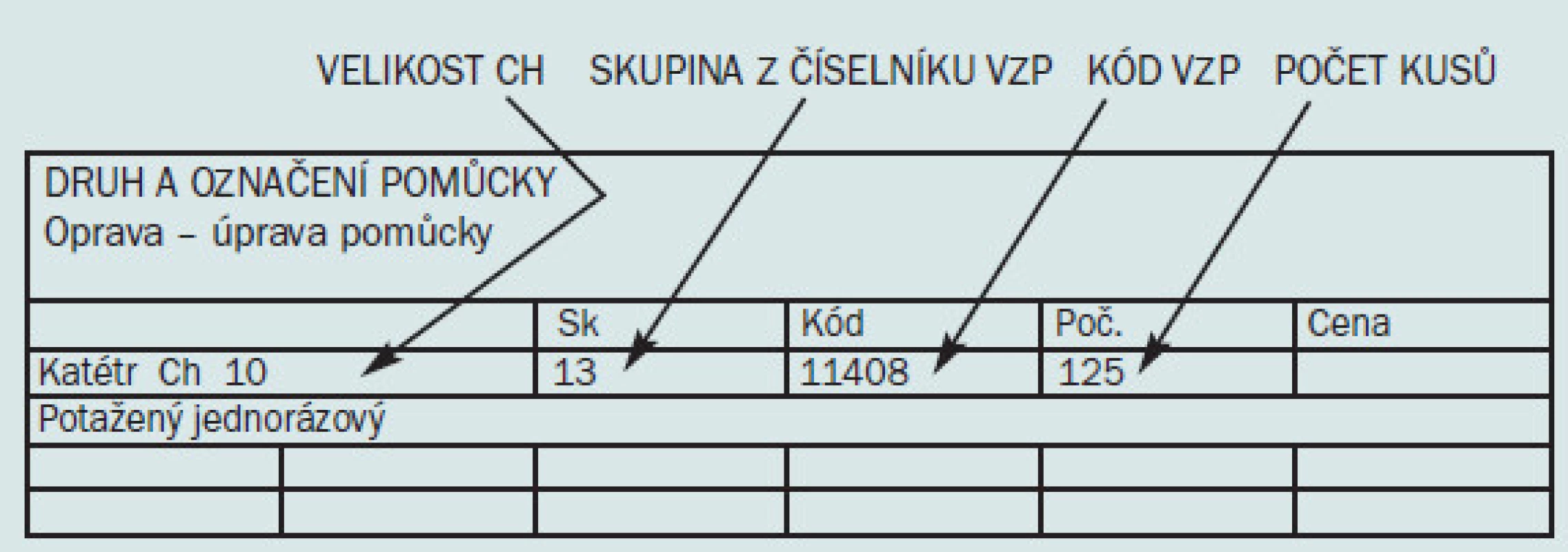
ZÁVĚR
Hyperaktivní měchýř je medicínský problém, kterým podle současných průzkumů trpí asi 16 % dospělé evropské populace. Skládá se ze symptomů urgence, frekvence, urgentní inkontinence a zpravidla i nykturie. Trpí jím obě pohlaví, známá je vzrůstající prevalence v závislosti na věku. I přes současnou úroveň našich znalostí není v řadě případů etiopatogeneze tohoto symptomového komplexu zřejmá.
Množství používaných terapeutických postupů odráží multifaktoriální etiopatogenezi OAB. Farmakoterapie je dosud nejrozšířenější metodou léčby hyperaktivního měchýře. Ačkoliv byla efektivita anticholinergik prokázána v nesčetných studiích i při praktickém použití, dlouhodobá kompliance pacientů při léčbě anticholinergiky je velmi nízká. Tato skutečnost vede k tomu, že jsou intenzivně hledány další cesty, jak dlouhodobou kompliance pacientů zlepšit. V případě, že medikamentózní léčba ani v kombinaci s intermitentní katetrizací nevede k uspokojivému výsledku, je třeba přísně individuálně posoudit stav pacienta a benefit chirurgické léčby. Chirurgické postupy jsou v tomto případě zásahem do integrity organizmu a v kombinaci s čistou intermitentní katetrizací i zásahem do hygienických návyků a standardů. Pro skupinu pacientů, kde jiné konzervativní metody nevedly k úspěchu, zůstává chirurgická léčba metodou léčby symptomů OAB, která zajistí kontinenci a ochrání horní močové cesty a ledvinné funkce.
prim. MUDr. Aleš Čermák
Urologická klinika
LF MU Brno a FN Brno
Jihlavská 20, 625 00 Brno
acermak@fnbrno.cz
Sources
1. Hampel C et al. Definition of overactive bladder and epidemiology of urinary incontinence. Urology 1997; 50 (suppl 6A): 4-14, discussion 15-7.
2. Krhut J. Hyperaktivní močový měchýř. Praha: Maxdorf 2007.
3. Bojar M, Kučera Z, Svěráková M. Poznámky neurologa o epidemiologii inkontinence v ČR a v Evropě. Proč jsou inkontinence moči a sexuální dysfunkce stále tabu? Inco Fórum, Praha, listopad 2003.
4. Močová inkontinence v ČR. Eklektik Porter Novelli. Praha Stem/Mark 2003 : 2-33.
5. Ehrlich, RM, Gershman A. Laparoscopic Seromyectomy (Bladder Autoaugmentation) for Non-neurogenic Bladder in Child: Initial Case Report. Urology 1993; 42 : 175.
6. Leng WW, Blalock HJ, Fredriksson WH et al. Enterocystoplasty or detrusor myectomy? Comparison of indications and outcomes for bladder augmentation. J Urol 1999; 161(3): 758-763.
7. Swami KS, Feneley RC, Hammonds JC, Abrams P. Detrusor myectomy for detrusor overactivity: a minimum 1-year follow-up. Br J Urol 1998; 81(1): 68-72.
8.DeFoor W, Minevich E, Reeves D et al. Gastrocystoplasty: long-term followup. J Urol 2003; 170(4 Pt 2): 1647-1649; discussion 1649-1650.
9. Ngan JH, Lau JL, Lim ST et al. Long-term results of antral gastrocystoplasty. J Urol 1993; 149(4): 731-734.
10. Bissada SA, Bissada NK. Choice of gastroepiploic vessels for gastrocystoplasty. J Urol 1992; 148(1): 101.
11. Sheldon CA, Gilbert A, Wacksman J, Lewis AG. Gastrocystoplasty: technical and metabolic characteristics of the most versatile childhood bladder augmentation modality. J Pediatr Surg 1995; 30(2): 283 - 287; discussion 287-288.
12. Sumfest JM, Mitchell ME. Gastrocystoplasty in children. Eur Urol 1994; 25(2): 89-93.
13. Cartwright PC, Snow BW. Bladder autoaugmentation: early clinical experience. J Urol 1989; 142(2 Pt 2): 505-508; discussion 520-521.
14. Dewan PA, Stefanek W, Lorenz C, Byard RW. Autoaugmentation omentocystoplasty in a sheep model. Urology 1994; 43(6): 888-891.
15. Dewan PA, Nicholls EA, Goh DW. Ureterocystoplasty: an extraperitoneal, urothelial bladder augmentation technique. Eur Urol 1994;26(1): 85-89.
16. Dewan PA, Stefanek W. Autoaugmentation gastrocystoplasty: early clinical results.Br J Urol 1994; 74(4): 460-464.
17. Atala A. Engineering tissues, organs and cells. J Tissue Eng Regen Med. 2007; 1(2): 83-96.
18. Atala A, Bauer SB, Soker S et al. Tissueengineered autologous bladders for patients needing cystoplasty. Lancet 2006; 367(9518): 1241-1246.
19. Davidsson T, Lindergard B, Mansson W. Long-term metabolic and nutritional effects of urinary diversion. Urology 1995; 46(6): 804-809.
20. Gosalbez R Jr, Woodard JR, Broecker BH, Warshaw B. Metabolic complications of the use of stomach for urinary reconstruction. J Urol 1993; 150(2 Pt 2): 710-712.
21. Smith RB. Use of ileocystoplasty in the hypertonic neurogenic bladder. J Urol 1975; 113(1): 125-127.
22. Küss R, Bitker M, Camey M et al. Indications and early and late results of intestino-cystoplasty: a review of 185 cases. J Urol 1970; 103(1): 53-63.
23. Hendren WH. Reconstruction of previously diverted urinary tracts in children. J Pediatr Surg 1973; 8(2): 135-150.
24. Gearhart JP, Albertsen PC, Marshall FF, Jeffs RD. Pediatric applications of augmentation cystoplasty: the Johns Hopkins experience. J Urol 1986; 136(2): 430-432.
25. Hill DE, Kramer SA. Management of pregnancy after augmentation cystoplasty. J Urol 1990; 144(2 Pt 2): 457-459; discussion 460.
26. Chadwick PJ, Snodgrass WT, Grady RW, Mitchell ME. Long-term followup of the hematuria - dysuria syndrome. J Urol 2000; 164(3 Pt 2): 921-923.
27. Nguyen DH, Bain MA, Salmonson KL et al.The syndrome of dysuria and hematuria in pediatric urinary reconstruction with stomach. J Urol 1993; 150(2 Pt 2): 707-709.
28. Cartwright PC, Snow BW. Bladder autoaugmentation: early clinical experience. J Urol 1989; 142(2 Pt 2): 505-508; discussion 520-521.
29. Cartwright PC, Snow BW. Bladder autoaugmentation: partial detrusor excision to augment the bladder without use of bowel. J Urol 1989; 142(4): 1050 - 1053.
30. Dvořáček J et al. Urologie III. Praha: ISV 1998 : 1618.
31. Penka I. Biofragmentabilní anastomóza GIT - Praha. Praha: Grada Publishing 2004 : 139. 32. Penka I, Šefr R, Kaplan Z, Němec L. Kompresivní anastomosa u akutní resekce tračníku. Rozhl Chir 2000; 79 : 81-83.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2008 Issue 1-
All articles in this issue
- Patofyziologie močového měchýře o velké kapacitě
- Periuretrální implantáty u stresové inkontinence (injectables)
- Praktické poznámky k implantaci umělého svěrače močové trubice
- Prolaps pánevních orgánů ženy z pohledu urologa
- Urologické konsekvence gynekologických operací
- Nykturie: diagnóza, klasifikace a léčba
- Validace symptom skóre pro vyšetřování hyperaktivního močového měchýře (Overactive Bladder Symptoms Score – OABSS)
- Analýza medikamentóznej liečby stresovej inkontinencie moču u žien
- Možnosti chirurgické léčby hyperaktivního močového měchýře (OAB)
-
Kolposuspenze dle Burche – zlatý standard v operacích ženské močové inkontinence
Současná urogynekologická operativa I
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prolaps pánevních orgánů ženy z pohledu urologa
-
Kolposuspenze dle Burche – zlatý standard v operacích ženské močové inkontinence
Současná urogynekologická operativa I - Patofyziologie močového měchýře o velké kapacitě
- Urologické konsekvence gynekologických operací
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



















