Periuretrální implantáty u stresové inkontinence (injectables)
Authors:
V. Vik; R. Zachoval; M. Záleský; M. Galas
Published in:
Urol List 2008; 6(1): 48-54
Overview
Močová inkontinence velmi výrazně ovlivňuje kvalitu života a zásadně působí na fyzickou, psychickou a sociální pohodu pacientek a pacientů. Snížení incidence inkontinence, kterou pozorujeme u pacientek a pacientů léčených pomocí periuretrálních implantátů (injectables), má zcela zásadní dopad na jejich kvalitu života. Nemocní se mohou relativně velmi rychle vrátit ke svým běžným aktivitám a vedlejší projevy léčby jsou daleko mírnější než při jiné chirurgické léčbě. Pacientky se sfinkterovou nedostatečností a/nebo hypermobilitou uretry či starší pacientky v celkově špatném stavu jsou nejlepšími kandidátkami na tento typ léčby. S ohledem na nízkou morbiditu výkonu mohou pacientky podstoupit aplikaci implantačního materiálu opakovaně a v případě selhání mohou zvolit jinou chirurgickou léčbu. Mezi preparáty, které se dnes používají, jsou zpravidla malé rozdíly a volba injectables je dána preferencí operatéra, dostupností a cenou preparátu.
Klíčová slova:
inkontinence moči, periuretrální implantáty, injectables
ÚVOD
Močová inkontinence velmi výrazně ovlivňuje kvalitu života a zásadně působí na fyzickou, psychickou a sociální pohodu pacientek a pacientů. Prevalence močové inkontinence se zvyšuje s věkem, postihuje 10–25 % pacientek ve věku do 65 let a až 50 % žen dlouhodobě hospitalizovaných ve zdravotnických zařízeních následné péče [1]. Stresová inkontinence je nejčastěji diagnostikovaný typ úniku moči s prevalencí 21–46 % [2,3] a u postmenopauzálních žen je prevalence stresové inkontinence odhadována minimálně na 40 % [4]. Veškeré odhady prevalence stresové inkontinence v populaci jsou velmi často podhodnocovány, zejména proto, že pacientky považují tento patologický stav za průvodní jev stárnutí, často jim také stud brání se svými obtížemi svěřovat se a podstoupit léčbu [5]. Obecně lze konstatovat, že ženská inkontinence dosud zůstává často opomíjeným problémem.
Léčba inkontinence by měla sestávat z jednotlivých na sebe navazujících kroků, od nejméně invazivních až po chirurgickou intervenci. Mezi možnosti léčby lze v současné době řadit fyzioterapii, která posiluje svaly pánevního dna, minimálně invazivní pomůcky, farmakoterapii, periuretrální implantáty (injectables) a mnohočetná operační řešení. Fyzioterapie je léčbou první volby pro vysoce motivované pacientky s mírným stupněm inkontinence, avšak ne vždy vede k jejímu kompletnímu odstranění. Použití farmakoterapie je u stresové inkontinence značně limitováno. Minimálně invazivní pomůcky, jako např. vaginální tampony, pesary, silikonové kloboučky na zevní meatus uretry atd, inkontinenci pouze zmírňují, hlavní příčinu však neléčí a velmi často vedou k perzistujícím infekcím, kožním iritacím a poraněním poševní stěny. Velký počet chirurgických výkonů jak v celkové, tak v lokální anestezii nabízí vysoce rizikovým pacientům šanci odstranit příčiny úniku moči s malým peroperačním rizikem.
Hlavními mechanizmy, které se při stresových manévrech podílejí na kontinenci moči, je anatomická integrita pánevních struktur, jež podpírají močovou trubici a hrdlo močového měchýře, a funkčnost zevního svěrače. Je zřejmé, že stresová inkontinence může vzniknout na základě hypermobility uretry (selhání podpůrných mechanizmů) a/nebo nedostatečnou funkcí svěrače. Korekční operace závěsného typu přinášejí u pacientek s hypermobilitou velmi dobrý efekt. Jiná situace nastává v případě nedostatečnosti uretrálního svěrače, se kterou se často setkáváme u postmenopauzálních žen nebo u pacientek, které již podstoupily neúspěšnou závěsnou operaci pro stresovou inkontinenci či u žen s poruchou sympatického vegetativního nervového systému [6,7]. V těchto případech lze ke zvýšení rezistence v oblasti svěrače úspěšně využít periuretrální implantáty (injectables). Efektivní a dlouhodobě účinná endoskopická implatační terapie jakožto nejméně invazivní chirurgický zákrok znamená při korekci inkontinence významný přínos pro pacienty. Implantace může být provedena pouze v lokální anestezii či analgosedaci a nevylučuje následnou invazivnější chirurgickou léčbu. Je a stále zůstává nejvhodnější terapeutickou alternativou nejen pro starší a polymorbidní pacientky, ale i pro pacienty, pro které je celková anestezie spojená s rozsáhlejším chirurgickým výkonem neúnosná. Stejně tak ji lze velmi dobře využít v případech selhání předchozí chirurgické terapie. Stále nové materiály a rozvoj tkáňového inženýrství neustále zvyšují úspěšnost a dávají naději do budoucna, že se tato technika stane častější volbou v léčbě stresové inkontinence.
Mechanizmus účinku injectables doposud nebyl zcela jasně vysvětlen, ale je zřejmé, že podslizniční aplikace těchto látek do proximální uretry vede ke zvýšení uzavíracího tlaku [8]. Po úspěšné aplikaci dochází k prodloužení funkční délky močové trubice, která vede k efektivnějšímu přenosu tlaků na proximální čtvrtinu uretry a zvyšuje rezistenci hrdla močového měchýře při stresových manévrech [9]. Prevence otevření hrdla močového měchýře během zátěže při mikci bez obstrukce by byla ideálním stavem, máme však celou řadu urodynamických důkazů o poklesu maximálního průtoku a vzestupu detruzorového tlaku během mikce [10-13]. Rovněž byl jasně prokázán vzestup Valsalva leak point pressure u pacientek a pacientů, u kterých došlo ke zlepšení či kompletnímu ústupu symptomů po aplikaci periuretrálních implantátů [14-16].
Injectabels jsou v léčbě ženské inkontinence užívány řadu let. Již v roce 1938 Murless publikoval práci popisující případ, kdy po aplikaci sklerotizantu na bázi sodné soli organické mastné kyseliny do přední poševní stěny došlo k zajizvení uretrovezikálního spojení, a tím ke zvýšení uretrální rezistence a zlepšení kontinence [17]. Quackles v roce 1955 publikoval 2 případy, u nichž po aplikaci parafinu do perineální oblasti došlo k obnovení kontience následkem komprese membranózní uretry [18]. V roce 1963 popsal Sachse, že využití sklerotizantu Dondren v oblasti membranózní uretry vedlo k určitému zlepšení kontinence [19]. Na počátku 70. let Politano [20] a Berg [21] poprvé publikovali užití polytetrafluoroetylenu (Teflon) jako periuretrálního implantátu. Využití kolagenu a autologní tukové tkáně bylo popsáno v roce 1989, poté následovalo využití silikonu, hyaluronové kyseliny, autologních chondrocytů a dále řady jak autoogních, tak heterologních látek zvyšujících rezistenci v oblasti uretrálního sfinkteru.
Z dosavadních zkušeností s injectables, které by měly zajistit minimálně invazivní, efektivní, a bezpečnou alternativu k otevřené operační léčbě, vyplývají požadavky na ideální periuretrální implantát. Nutno říci, že přes několik desetiletí trvající vývoj nebyl dosud nalezen ideální materiál. Optimální materiál by měl být snadno injikovatelný bez pomoci speciálního aparátu, měl by vykazovat objemovou stabilitu v průběhu času, která zajistí permanentní rezistenci po jediné aplikaci, částečně či kompletně by se měl začlenit do injikovaných tkání [52] a současně by měl být biokompatibilní, neantigenní, neinfekční a nekarcinogenní. Jednotlivé částice injikovaného materiálu by měly být větší než 110 μm, aby bylo zabráněno jejich vzdálené migraci. Materiál by měl být dobře skladovatelný a snadno připravitelný. Po jeho aplikaci by mělo dojít k dokonalé inkorporaci do tkáně s minimální fibrotickou a zánětlivou reakcí. V neposlední řadě je třeba klást důraz na cenu preparátu. Přestože několik materiálů splňuje některá z těchto kritérií, doposud nebyla nalezena látka, která by plně vyhovovala všem požadavkům, a proto výzkum a hledání optimálního injectables nadále pokračuje [22,23].
JEDNOTLIVÉ TYPY IMPLANTÁTŮ A JEJICH ROZDĚLENÍ, EFEKTIVITA A KOMPLIKACE
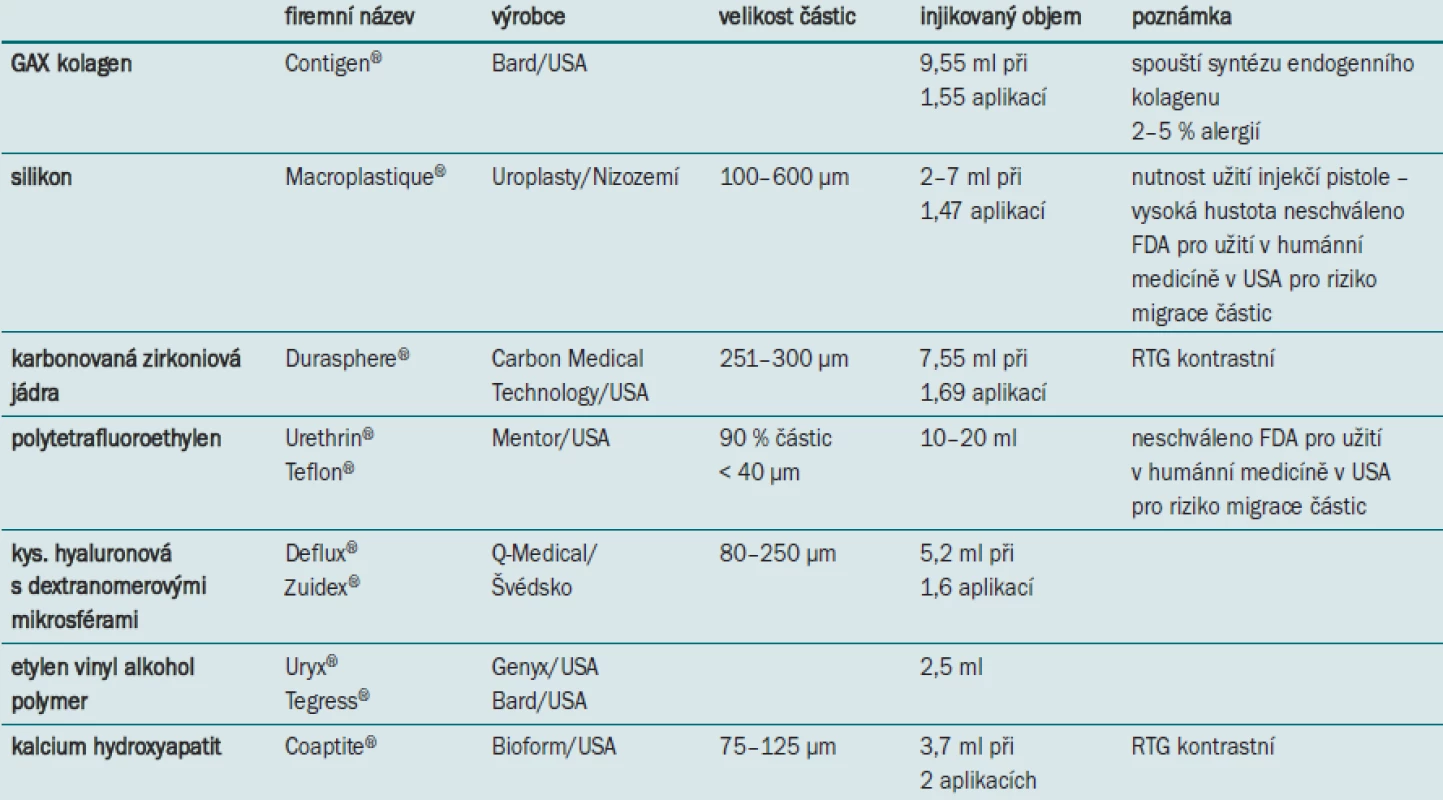
Jednotlivé typy materiálů pro periuretrální aplikaci se dají rozdělit na neautologní a autologní. Mezi hlavní představitele neautologních materiálů patří např.: hovězí GAX kolagen (Contigen®), silikonové mikroimplantáty (Macroplastique®), jádra zirkonia pokrytá karbonem (Durasphere®), polyterafluorethylen (Teflon), kys. hyaluronová s dextanomerovými mikrosférami (Deflux®), calcium hydroxyapatit (Coaptite®), etylen vinyl alkohol polymer (Uryx®). Mezi autologní injectables lze jmenovat kromě obvykle užívané autologní tukové tkáně, i nově zkoušené materiály: autologní chondrocyty, autologní svalové buňky detruzoru a primární myoblasty.
Hovězí GAX kolagen (Contigen®) uvedený do klinické praxe v roce 1989 představoval v 90. letech ve Spojených státech nejrozšířenější terapeutickou volbu pro stresovou inkontinenci u žen. Vlastní materiál je bezbuněčný derivát hovězího kožního kolagenu, který je enzymaticky purifikován s cílem minimalizovat antigenicitu a chemicky stabilizován, aby byla zajištěna rezistence injikovaného materiálu vůči hostitelským kolagenázám. Jedná se o směs kolagenu, ve které je v 95 % zastoupen typ I a v 1–5 % kolagen III. Četné užití GAX kolagenu v urologii, dermatologii a ORL prokázalo jeho dobrou bezpečnost a stabilitu, minimální schopnost migrace částic a minimální schopnost vyvolat lokální zánětlivou reakci [24,25]. S ohledem na relativně častý výskyt alergických reakcí (ve 4–5 %) je nutné rutinně provádět u všech pacientů kožní test 30 dní před vlastní aplikací. Ve většině prací je popisována transuretrální aplikace kolagenu v lokální či celkové anestezii submukózně do oblasti proximální uretry, zpravidla na čísle 3, 6 a 9. Výkon lze provádět ambulantně s pooperačním zavedením permanentního katétru 12– 14F na 24 hod a pod ambulantní kontrolou postmikčního rezidua po jeho odstranění.
Studií, které hodnotí terapeutický efekt aplikovaného kolagenu, byla provedena celá řada. Předkládají velmi rozdílné výsledky zlepšení, resp. vyléčení inkontinence, a to v rozmezí od 26–95 % [8,10, 13,14,26-29]. To je dáno zejména různou definicí úspěchu, resp. vyléčení nebo zlepšení a krátkou dobou sledování, zpravidla méně než 12 měsíců. Pouze práce Corcose a Fourniera [14] s průměrnou dobou sledování 50 měsíců od první aplikace přinesla některá zcela zásadní data. Dlouhodobý efekt přetrvával u 30 až 40 % pacientek, u kterých došlo k vyléčení, resp. zlepšení, ale u 1/3 z nich však byla k dosažení úspěchu nutná opakovaná aplikace s průměrným celkovým objemem injikované látky přibližně 8,8 ml.
Výsledky jiných autorů s výrazně kratší dobou sledování hovoří pro nutnost opakovaní výkonu v 12–40 %, a to pro snížený efekt během prvních 2 let [30].
Přestože kolagen velmi dobře toleruje většina pacientů, nejsou nežádoucí účinky zcela výjimečné. Na prvním místě je potřeba jmenovat nově vzniklé polakisurie a urgence až urgentní inkontinenci, která se může objevit až u 13 % pacientek.
Oproti tomu retence se vyskytuje pouze asi ve 2 % [31] a zpravidla spontánně a velmi rychle odezní. Ostatní komplikace jsou spíše rarita. Od 90. let minulého století se užitý kolagen rutinně testuje na přítomnost BSE.
Silikonové mikroimplantáty (Macroplastique®) jsou vulkanizované částice silikonu o velikosti většinou 100–300 μm, které jsou aplikovány v hydrogelovém nosiči. Mechanizmus účinku je založen na postupném zvětšování objemu aplikované látky. Ten je postaven na principu enkapsulace silikovaných částic tenkou fibrinovou vrstvou, která je později nahrazena proliferujícími kolagenními vlákny. Přes značné rozšíření a využití v Evropě, FDA registraci ve Spojených státech neschválila a nepovolila, zejména s ohledem na 25% zastoupení částic menších než 50 μm, a tím na možné riziko jejich migrace. Tato skutečnost byla prokázána při histologických vyšetřeních plic, mozku, ledvin a lymfatických uzlin u psů 4 měsíce po implantaci. Byly zde histologicky prokázány vícečetné granulomy vzniklé na podkladě nulové biodegradability silikonu [32].
Objem injikovaného materiálu je v porovnání s kolagenem menší a činí přibližně 3 ml. Práce hodnotící úspěšnost léčby Microplastiquem® udávají procento vyléčených mezi 33–70 %. Široké rozmezí je způsobeno zejména délkou sledování terapie a podtypem léčené inkontinence [33]. Obecně lze říci, že středně i dlouhodobé výsledky jsou velmi dobré, s minimem komplikací, a to zejména pro skupinu pacientů se stresovou inkontinencí na podkladě sfinkterové nedostatečnosti. Macroplastique byl prvním injectables, u kterého byla použita tzv. aplikace naslepo, tj. bez kontroly zraku, pomocí speciálně upraveného aplikátoru (viz dále).
Zirkoniová zrna potažená karbonem (Durasphere®) jsou poměrně veliké částice 251–300 μm, které neumožňují migraci v organizmu. Materiál nepodléhá biologické degradaci, a tím je – v porovnání s kolagenem – zajištěna jeho vyšší trvanlivost a dlouhodobější efektivnost. Zirkoniová zrna jsou RTG-kontrastní a jejich výhodou je, že jejich lokalizace může být ověřena prostým snímkem.
Doposud nejrozsáhlejší soubor pacientů léčených zirkoniovými zrny publikoval Lightner v 2001 [34]. Celkově 334 randomizovaných pacientek s nedostatečností sfinkteru bylo léčeno aplikací Durasphere® nebo kolagenem. Výsledky efektivnosti léčby byly po 1 roce od aplikace srovnatelné u obou skupin, ale u pacientek léčených Durasphere® byl signifikantně vyšší počet nežádoucích účinků (zejména 1,5krát vyšší incidence retence moči). Při střední době sledování (více než 4 roky) byla prokázána vyšší úspěšnost Durasphere ® v porovnání s kolagenem [35], avšak s ohledem na malou velikost souboru (56 pacientek) nebyly tyto výsledky statisticky signifikantní.
Od uvedení do klinické praxe přibývají s postupem času sdělení upozorňující na nežádoucí účinky léčby. Kromě vyšší incidence pooperační retence moči, terá zpravidla ustupuje kolem 7. pooperačního dne, je to zejména tvorba bolestivého periuretrálního granulomu (přibližně 3 % pacientek), který vede k výrazné iritační, popř. obstrukční symptomatologii [36].
Polytetrafluoretylen (Teflon) je polymer s velmi vysokou molekulární hmotností a viskozitou, tvořený z velmi malých částic (cca 40 μm v průměru). Je to materiál velmi inertní a stabilní, který nezpůsobuje alergické reakce. Jeho využití a velmi dobré krátkodobé výsledky popsal Politan již v roce 1974 [17]. Přes jeho výbornou charakteristiku nikdy nebyl povolen FDA pro klinické využití ve Spojených státech, jelikož velikost částic umožňuje lokální i vzdálenou migraci aplikovaného materiálu a následnou tvorbu granulomů ať již v oblasti uretry, vedoucí k obstrukci vývodných cest močových, nebo migrací do jiných orgánů (lymfatické uzliny, plíce, ledviny, mozek) s potenciálním karcinogenním vlivem [37]. Dále byly popsány případy vzniku fibrózy uretry, tvorba divertiklů a periuretrálních abscesů [38].
S ohledem na vlastnosti materiálu, zejména na jeho vysokou viskozitu, je k aplikaci teflonu potřebný velmi vysoký tlak – tedy speciální injekční zařízení, popřípadě pistole, která je schopna dostatečný tlak vyvinout.
Výsledky efektivity terapie teflonem se pohybují v širokém rozmezí. Při krátkodobém sledování se úspěšné výsledky v literatuře pohybují mezi 57–86 %, avšak při dlouhodobějším sledování efektivnost léčby klesá na 33–76 % [39]. Lopez et al [40] publikovali největší soubor pacientek (75) se střední dobou sledování 31 měsíců. V jejich souboru bylo 55 % pacientek vyléčeno a 73 % se výrazně zlepšilo nebo bylo vyléčeno. K dosažení těchto výsledků bylo potřeba 1,5 aplikace při průměrné dávce injikovaného materiálu 18,9 ml.
Kyselina hyaluronová s dextranomerovými mikrosférami (Deflux®) – její využití v klinické praxi pro léčbu vezikoureterálního reflexu (VUR) popsali již v roce 1995 Stenberg a Lackgren [41]. Jedná se neimunogenní a biodegradabilní materiál s částicemi o velikosti více než 120 μm, které zajišťují prevenci migrace do vzdálených tkání a orgánů. S ohledem na biodegradabilitu je vlastní mechanizmus tvorby obturujících bul zajištěn migrací fibroblastů a buněk imunitního systému, která vede k neovaskularizaci s následnou tvorbou depozit kolagenu a vznikem měkké fibrózní tkáně v místě aplikace.
Přestože množství prací publikovaných pro léčbu VUR je značné a vykazuje velmi dobré výsledky, byla dosud publikována pouze jediná práce, která hodnotila využití Defluxu® při léčbě stresové inkontinence. Ve studii bylo hodnoceno celkem 20 žen. Po 6měsíčním sledování byly při průměrném injikovaném objemu 5,2 ml a průměru 1,6 aplikací na pacientku v 80 % příznaky odstraněny a nebyly zaznamenány žádné nežádoucí účinky na použitou látku [42]. K bezpečnosti materiálu se vyjadřují velmi pozitivně i další publikované práce [43,44], které se však opětovně týkají pouze terapie VUR.
Kalcium hydroxyapatit (Coaptite®) je syntetická verze organického materiálu zastoupeného v kostech a v zubech, která není antigenní, a proto v tkáni nevyvolává zánětlivou reakci; její částice mají velikost 75–125 μm. Přítomnost kalcia hydroxyapatitu umožňuje detekci aplikované látky a jejího umístění pomocí RTG či ultrasonografického zobrazení, což může být výhoda při opakované aplikaci či videourodynamickém vyšetření. FDA schválila využití tohoto materiálu pro značení měkkých tkání jako metodu fokusace před plánovanou radioterapií. Kalcium hydroxyapatit pro léčbu stresové inkontinence u žen schválila FDA v listopadu 2005 na základě randomizovaných studií (296 sledovaných), ve kterých 92 % pacientů při průměrné době sledování 12 měsíců vykazovalo signifikantní zlepšení. Jako nejčastější nežádoucí účinky se vyskytly retence ve 41,1 %, hematurie v 19,6 % a dysurie v 15,2 %.
Ethylen vinyl alkohol copolymer (Uryx®) byl původně určen jako embolizační agens pro léčbu cévních abnormalit, v roce 2005 FDA schválila jeho využití rovněž jako injectables k léčbě stresové inkontinence u sfinkterové nedostatečnosti. Unikátnost Uryxu®spočívá v jeho schopnosti přeměnit se po kontaktu s tkáněmi z tekutého stavu na solidní resp. poddajnou houbovitou strukturu. Podle dosavadních zkušeností se zdá, že nejlepších výsledků je dosaženo při aplikaci Uryxu® přibližně 1,5 cm od hrdla močového měchýře. S ohledem na chemické vlastnosti látky musí aplikace probíhat velmi pomalu, tj. < 0,6 ml/sec při cca 2,5 ml injikované látky. Dosavadní klinické studie prokázaly bezpečnost materiálu, jeho biokompatibilitu a neschopnost migrace. Při hodnocení účinnosti terapie udávalo po 12 měsících signifikantní zlepšení 50 % sledovaných pacientek, 75 % úspěšnosti bylo dosaženo až po opakované aplikaci [45].
Autologní tukové buňky jako implantační materiál jsou téměř ideální materiál, neboť jsou biokompatibilní, velmi levné, snadno dostupné a před aplikací nepotřebují žádnou laboratorní přípravu. Liposukcí se z břišního tukového polštáře odebírá 15–20 cm3 tukové tkáně, která je po proprání ve fyziologickém roztoku injikována do periuretrální tkáně. Přes všechny tyto výhody však bohužel existuje celá řada nedostatků, které limitují využití autologní tukové tkáně jako ideálního injectables. Na prvním místě je potřeba uvést postupnou ztrátu objemu, a to až na 10 % po 6 měsících od aplikace a na základě toho i snížení efektivnosti léčby [38]. Dále je nutno jmenovat i řadu možných komplikací – od infekcí, retencí moči, hematurií, tvorby hematomů a abscesů až po riziko tukové embolie s fatálními následky pro pacienta [46]. S ohledem na nízkou efektivitu léčby a veliké množství nežádoucích účinků bylo od využívání autologních tukových buněk prakticky upuštěno.
Autologní chondrocyty získané z ušního boltce a 6 týdnů kultivované in vitro a poté injikované pacientkám se sfinkterovou insuficiencí byly zmíněny doposud v jediné publikované Bentově práci z roku 2001 [47]. Po jednom roce sledování bylo 81,3 % pacientek kompletně kontinentních nebo se jejich stav výrazně zlepšil. Jedním z limitujících faktorů této metody je cena výkonu, zahrneme-li do ní náklady na kombinovaný chirurgický výkon, kultivaci a uskladnění materiálu.
Autologní svalové buňky detruzoru a primární myoblasty představují experimentální materiály, které jsou v současné době testovány. Veškeré publikované práce prezentují výsledky, kterých bylo dosaženo na laboratorních zvířatech. Výsledky se zdají být velmi perspektivní, a proto existuje předpoklad, že tkáňové inženýrství může v budoucnu přinést zlepšení vlastností těchto injectabes pro léčbu ženské stresové inkontinence [38].
INDIKACE
Obecně řečeno jsou pro implantační léčbu pomocí injectables ideálními kandidátkami pacientky se sfinkterovou nedostatečností (III. typ) a stabilním detruzorem. Tyto pacientky mají při urodynamickém vyšetření intravezikální tlak při úniku moči (leak point pressure - VLPP) nízký (< 65 cm H2O) a taktéž výrazně snížený maximální uzavírací uretrální tlak (maximal urethral closer pressure - MUCP) < 20 cm H2O. To velmi dobře koreluje s videourodynamickými nálezy, kdy v těchto situacích nacházíme nedostatečnou funkci svěrače hrdla močového měchýře a proximální uretry. Naopak u pacientek s hypermobilitou uretry (I. a II. typ) u stresové inkontinence je intravezikální tlak při úniku moči vyšší [48]. Jelikož se sfinkterová nedostatečnost velmi často, a to zejména u starších pacientek, vyskytuje společně s hypermobilitou uretry, byla publikována řada prací popisujících použití injectables i v indikační skupině se smíšenou stresovou inkontinencí. Výsledky byly jen o málo horší než u pacientek s čistou insuficiencí svěrače [14]. Pro prognózu implantační léčby je kromě typu stresové inkontinence zcela zásadní stav sliznice a podslizničního pojiva uretry v místě aplikace. V případě těžkých jizevnatých změn na hrdle či v oblasti proximální uretry nelze očekávat větší úspěch vzhledem k tomu, že nemůžeme aplikovat dostatečné množství materiálu do správné tkáňové vrstvy a formovat implantační buly. Dalším nepříznivým faktorem ovlivňujícím úspěšnost léčby jsou některé dysfunkce detruzoru. V případě aplikace injectables při hyperaktivitě detruzoru či zhoršené kompliance můžeme dokonce očekávat zhoršení urgentní symptomatologie a stresová inkontinence se může ve svém důsledku změnit na inkontinenci urgentní.
Z tohoto pohledu je zcela nezbytné provést u všech pacientek indikovaných k léčbě pomocí injectables kompletní urologické vyšetření dolních močových cest. Základní roli při hodnocení poruch funkcí dolních močových cest hraje urodynamické vyšetření.
OPERAČNÍ POSTUP
Operační výkon může být u žen proveden jak v lokální, tak v celkové anestezii, u mužů téměř výhradně v anestezii celkové. K lokální anestezii u žen zpravidla stačí retrográdní aplikace gelu s 2% lidokainem (Instilagel®) a infiltrace okolí zevního meatu uretry na čísle 3 a 9 2–4 ml 1% mezokainu. Vlastní aplikace implantátu může být podle preferencí operatéra provedena transuretrálně, periuretrálně či nově pomocí implantačních pomůcek naslepo (MIS – Macroplastique Implantation System) [49], případně transkutánně antegrádně jako jedna z alternativ řešení inkontinence moči u mužů po radikální prostatektomii, jak bylo popsáno Haabem v 1997 [50]. Dnes se zdá, že nejčastěji používaným přístupem je cesta transuretrální. Při aplikaci injectables je důležité, aby byl implantát zaváděn velmi pomalu a pod kontrolou zraku do stěny uretry či hrdla močového měchýře, do submukózy či lamina propria. Volba místa aplikace na obvodu uretry není rozhodující, podle preferencí operatéra a vlastního peroperačního nálezu lze volit mezi 3 a 9 či 4 a 8, tak, aby aplikovaný materiál vytvářel zbytnění imitující laloky prostaty. Po aplikaci by operatér již neměl postupovat cystoskopem za místo aplikace, aby nedošlo ke kompresi s možným vytlačením aplikované látky z podslizničního prostoru. Po aplikaci je vhodné jednorázově vyprázdnit močový měchýř katétrem o nízkém průměru 8–12 F. Drenáž močového měchýře tenkým permanentním katétrem 12–14 Ch na 24 hod či epicystostomií na 2–3 dny je otázka preferencí operatéra. Kontrola postmikčního rezidua v pooperačním průběhu je vždy obligatorní. Většina pacientů je zajištěna před- a pooperační dávkou antibiotik. Velikost aplikační jehly je dána viskozitou injikovaného materiálu a stejně jako případné použití injekční pistole závisí na typu aplikované látky (teflon, silikon a autologní tuk zpravidla vyžadují užití injekčních pistolí vzhledem k jejich vysoké viskozitě).
Transuretrální aplikace – cystoskop je zaveden proximálně od sfinkteru a jehlou vedenou pracovním kanálem přístroje je pomalu aplikován implantát do submukózního prostoru, nejčastěji na čísle 4 a 8 a poté případně opakovaně v jiných lokalizacích, dokud není dosaženo dostafiremní název výtečné obturace hrdla měchýře či proximální uretry. Při vlastním operačním výkonu je nutné mít na paměti některá pravidla: příliš hluboká aplikace vede k obtížnému vytvoření bul a tím nefunkčnímu výkonu, aplikace do příliš těsné blízkosti vezikouretrální junkce často přispívá ke vzniku urgentní symptomatologie.
Periuretrální aplikace – při zavádění cystoskopu do močové trubice u ženy proximálně od sfinkteru proniká operatér aplikační jehlou podél uretry směrem k hrdlu močového měchýře až do sumbukózního prostoru. Za vizuální kontroly, distálně od hrdla močového měchýře se aplikuje na čísle 3 a 9 submukózně vlastní implantační materiál až do dosažení dostatečné obturace lumina uretry.
Aplikace pomocí implantačních pomůcek – tato metoda byla poprvé představena při aplikaci silikonu, ale později byla využita i při použití jiných injectables. Aplikační přístroj sestává z tubusu, který je opatřen měřítkem, centrálním otvorem a minimálně 3 kanály pro implantační jehly. To umožňuje aplikaci implantátu v proximální uretře po celém obvodu do jasně definované hloubky pod určitým úhlem, zpravidla na čísle 6, 10 a 2. K určení místa implantace, které se nachází 10–15 mm od hrdla močového měchýře slouží měřítko na tubusu aplikátoru [38].
ZÁVĚR
Periuretrální aplikaci injectables lze považovat za účinnou léčbu stresové inkontinence nejen u žen, ale i mužů. V mnoha pracích byla prokázána její efektivita, a to zejména v léčbě sfinkterové nedostatečnosti, tedy stavu, který je jinak velmi obtížně terapeuticky zvládnutelný. Pro implantační léčbu existuje celá řadu materiálů vhodných a mnohé další byly nebo jsou ve fázi klinických či pilotních studií nejenom v zahraničí, ale i v České republice (prof. Šimon et al, Originální užití hydrogelových bobtnavých implantátů v léčbě stresové inkontinence) [51]. Ačkoliv úspěšnost léčby není příliš vysoká při dlouhodobém sledování a liší se podle použitého materiálu, lze obecně říci, že krátkodobé výsledky jsou velmi dobré a úspěšnosti či opakovaně dobrých výsledků lze dosáhnout opakovanou aplikací.
Komplikace s výjimkou preparátů, které mohou migrovat, jsou velmi vzácné a pokud se vyskytnou, jejich trvání je pouze přechodné. Tak je tomu například u intermitentní čisté katetrizace při které retence moči zpravidla odeznívá do 72 hod. Mírné krvácení a pocit tlaku či bolesti v místě aplikace jsou časté, ale obvykle se stav rychle restituuje.
Snížení incidence inkontinence, které pozorujeme, přináší zcela zásadní dopad na kvalitu života našich pacientek a pacientů. Nemocní se mohou relativně velmi rychle vrátit ke svým běžným aktivitám a vedlejší projevy léčby jsou daleko mírnější něž při jiné chirurgické léčbě. Pacientky se sfinkterovou nedostatečností a/nebo hypermobilitou uretry či starší pacientky v celkově špatném stavu jsou nejlepšími kandidátkami na tento typ léčby.
S ohledem na nízkou morbiditu výkonu mohou pacientky podstoupit aplikaci implantačního materiálu opakovaně a v případě selhání mohou zvolit jinou chirurgickou léčbu. Mezi jednotlivými preparáty, které se dnes používají, jsou zpravidla malé rozdíly a volba injectables je dána preferencí operatéra, dostupností a cenou preparátu. Cenová výhodnost výkonu je značně diskutabilní a doposud nebyla příliš sledována. Lze pouze konstatovat, že většina materiálů používaných v současné době je značně cenově náročná, a proto v České republice méně využívaná.
MUDr. Viktor Vik
doc. MUDr. Roman Zachoval, Ph.D.
MUDr. Miroslav Záleský
MUDr. Marek Galas
Urologické oddělení FTN
Vídeňská 800, 140 59 Praha 4
viktor.vik@ftn.cz
Sources
1. Urinary incontinence-ACOG Technical Bulletin, No. 213, October 1995. Int J Gynecol Obstet 1996; 52: 75-86.
2. Resnik N, Subbaro Y, Laurino E. Pathophysiology in urinary incontinence amongst institutionalised elderly persons. N Engl J Med 1989; 320: 1-7.
3. Ouslander J, Staskin D, Raz S et al. Clinical versus urodynamic diagnosis in an incontinent geriatric female population. J Urol 1987; 137: 68-71.
4. Nygaard IE, Lemke JH. Urinary Incontinence in Rural Older Women: prevalence, incidence and remission. J Am Geriatr Soc 1996; 44: 1049.
5. Goldstein M, Hawthorne ME, Engeberg S et al. Urinary incontinence. Why people do not seek help. J Gerontol Nurs 1992; 18: 15.
6. Holst K, Wilson PD. The prevalence of female urinary incontinence and reasons form not seeking treatment. NZ Med J 1988; 101: 756-758.
7. Beisland HO, Fossberg E, Noer A, Sander S. Urethral sphincter insufficiency in postmenopausal females: Treatment with phenylpropanolamin and estriol separately and in combination. Urol Int 1984; 39: 211-216.
8. Winters JC, Appell R. Periurethral injection of collagen in the treatment of intrinsic sphincter deficiency in the female patient. Urol Clin North Am 1995; 22: 673-678.
9. Monga AK, Stanton SL. Urodynamics: prediction, outcome and analysis of mechanism of cure of stress incontinence by periurethral collagen. Br J Obstet Gyneacol 1997; 104: 158-162.
10. Eckford SD, Abrams P. Para-urethral collagen implantation for female stress incontinence. Br J Urol 1991; 68: 586-589.
11. O'Connell HE, McGuire EJ, Aboseif S et al. Transurethral collagen therapy in women. J Urol 1995; 154: 1463-1465.
12. Kieswetter H, Fisher M, Wober L et al. Endoscopic implantation of collagen (GAX) for the treatment of urinary incontinence. Br J Urol 1992; 69: 22-25.
13. Monga AK, Robinson D, Stanton SL. Periurethral collagen injection for genuine stress incontinence: 2-year follow-up. Br J Urol 1995; 76: 156-160.
14. Corcos J, Fournier C. Periurethral collagen injection for the treatment of female stress urinary incontinence: 4-year follow-up results. Urology 1999; 54: 815-818.
15. Elsergany R, Ghoniem GM. Collagen injection for intrinsic sphincter deficiency in men: a reasonable option in selected patients. J Urol 1998; 159: 1504- 1506.
16. Faerber G. Endoscopic collagen injection therapy in elderly women with type I stress urinary incontinence. J Urol 1996; 155: 512-514.
17. Politano VA, Small MP, Harper JM, Lynne CM. Periurethral Teflon injection for urinary incontinence. J Urol 1974; 111: 180-183.
18. Quackles R. Deux incontinences apres adenomectmie gueries par injection de parrafine dans le perinee. Acta Urol Belg 1955; 107: 379-381.
19. Sachse S. Treatment of urinary incontinence with sclerosing agent solutions: Indication, results, complications. Urol Int 1963; 15: 225-244.
20. Politano AV. Periurethral polytetrafluoroethylene injection for urinary incontinence. J Urol 1982; 127: 439-442.
21. Berg S. Polytef augmentation urethroplasty correction of surgically incurable incontinence by injection technique. Arch Surg 1973; 107: 379-381.
22. Kershen RT, Atala A. New advances in injectables therapies for the treatment of incontinence and vesicourethral reflux. Urol Clin North Am 1999; 26: 81-94.
23. Dmochowski RR, Appell RA. Injectable agents in the treatment of stress urinary incontinence in women: where are we now? Urology 2000; 56: 32-40.
24. Frey P, Lutz N, Berger D et al. Histological behaviour of glutaraldehyde cross-linked bovine collagen injected into human bladder for the treatment of vesicoureteral reflux. J Urol 1994; 152: 632-635.
25. Remacle M, Marbaix E. Collagen implants in the human larynx. Pathological examinations of two cases. Arch Otorhinolaryngol 1988; 245: 203-209.
26. Bent AE, Foote J, Siegel S et al. Collagen implant for treating stress urinary incontinence in women with urethral hypermobility. J Urol 2001; 166: 1354-1357.
27. Swami S, Batista JE, Abrams P. Collagen for female genuine stress incontinence after a minimum 2-year follow-up. Br J Urol 1997; 80: 757-761.
28. Ang LP, Tay KP, Lim PH et al. Endoscopic injection of collagen for the treatment of female urinary stress incontinence. Int J Urol 1997; 4: 254-258.
29. Cross CA, English SF, Cespedes RD et al. A followup of transurethral collagen injection therapy for urinary incontinence. J Urol 1998; 159: 106-108.
30. Winters JC, Chiverton A, Scarpero HM et al. Collagen injection therapy in elderly women: long-term results and patients satisfaction. Urology 2000; 55: 856-861.
31. Stothers L, Goldenberg SL, Leone EF. Complications of periurethral collagen injection for stress urinary incontinence. J Urol 1998; 159: 806-807.
32. Buckley J, Scott R, Aitchison M at al. Periurethral Microplastique silicone injection for stress incontinence and vesicoureteric reflux. Minim Invasive Ther 1991; 1: 72.
33. Meschia M, Pifarotti P, Gattei U, Crosignani PG. Injection therapy for the treatment of stress urinary incontinence in women. Gynecol Obstet Invest 2002; 54: 67-72.
34. Lightner DJ, Calvosa C, Andersen R et al. A new injectable bulking agent for treatment of stress urinary incontinence: Results of a multicenter, randomised, controlled, double blind study of Durasphere. Urology 2001; 58: 12-15.
35. Chrouser KL, Fick F, Goel A et al. Carbon coated zirconium beads in beta-glucan gel and bovine glutaraldehyde cross-linked collagen injections for intrinsic sphincter deficiency: continence and satisfaction after extended follow-up. J Urol 2004; 171(3): 1152- 1155.
36. Madjar S, Sharma AK, Waltzer WC et al. Periurethral mass formations following bulking agent injection for the treatment of urinary incontinence. J Urol 2006; 175(4): 1408-1410.
37. Aaronson IA, Rames RA, Greene WB et al. Endoscopic treatment of reflux: Migration of Teflon to the lungs and brain. Eur Urol 1993; 23: 394-399.
38. Richard T, Kershen MD, Roger R et al. Beyond collagen: injectable therapies for the treatment of female stress urinary incontinence in the new millennium. Urol Clin N Am 2002; 29: 559-574.
39. Kerrebroeck P, Meulen F, Farrelly E et al. Treatment of urinary incontinence: recent developments in the role of urethral injection. Urol Res 2003; 30: 356- 362.
40. Lopez AE, Padron OF, Patsias G et al. Transurethral polytetrafuorethylene injection in female patients with urinary incontinence. J Urol 1993; 150: 856-858.
41. Stenberg A, Lackgren G. A new bioimplant for the endoscopic treatment of vesicoureteral reflux: experimental and short term clinical results. J Urol 1995; 154: 800-803.
42. Stenberg A, Larsson G, Johnson P et al. DiHA Dextran Copolymer, a new biocompatible material for endoscopic treatment of stress incontinent women. Short term results. Acta Obstet Gynecol Scand 1999; 78: 436-442.
43. Lavelle MT, Conlin MJ, Skoog SJ.: Subureteral injection of Deflux for correction of reflux: analysis of factors predicting success. Urology 2005; 65(3): 564-7.
44. Merrot T, Ouedraogo I, Hery G, Alessandrini P. Preliminary results of endoscopic treatment of vesicoureteric reflux in children. Prospective comparative study of Deflux vs. Coaptite. Prog Urol 2005; 15(6): 1114-1119.
45. Report From the 24th Annual Scientific Meeting of the American Urogynecology Society, September 11.-13. 2003, Hollywood, Florida.
46. Currie I, Drutz HP, Deck J et al. Adipose tissue and lipid droplet embolism following periurethral injection of autologous fat: case report and review of the literature. Int Urogynecol J Pelvic Floor Dysfunct 1997; 8: 377-380.
47. Bent AE, Tutrone RT, McLennan MT et al. Treatment of intrinsic sphincter deficiency using autologus ear chondrocytes as a bulking agent. Neurourol Urodyn 2001; 20: 157-165.
48. McGuire EJ, Fitzpatric CC, Wan J. Clinical assessment of urethral sphincter function. J Urol 1993; 150: 1452-1454.
49. terMeulen PH, Berghmans LCM, vanKerrebroeck EVA. Systematic Review: efficacy of silicone microimplants (Macroplastique) therapy for stress urinary incontinence in adult women. Eur Urol 2003; 44: 573- 582.
50. Haab F. Les injections peri-uretrales pour traitment de l´incontinence urinaire d´effort. Progres en Urologie 1997; 7: 293-296.
51. Šimon V, Halaška M, Otčenášek M et al. Použití hydrogelových bobtnavých implantátů v léčbě stresové incontinence moči u žen - pilotní studie. Čes Gynek 2002; 67: 148-151.
52. Appel AR, Dmochowski RR, Herschorn S. Urethra injections for female stress incontinence. BJU Int 2006; 98(supp1): 27-30.
Labels
Paediatric urologist UrologyArticle was published in
Urological Journal

2008 Issue 1
Most read in this issue
- Prolaps pánevních orgánů ženy z pohledu urologa
- Patofyziologie močového měchýře o velké kapacitě
-
Kolposuspenze dle Burche – zlatý standard v operacích ženské močové inkontinence
Současná urogynekologická operativa I - Urologické konsekvence gynekologických operací
