-
Medical journals
- Career
Vliv endokrinních disruptorů na fertilitu savců
Authors: doc. RNDr. Jana Pěknicová, CSc.
Authors‘ workplace: Laboratoř diagnostiky pro reprodukční medicínu Ústavu molekulární genetiky AV ČR
Published in: Urol List 2007; 5(3): 6-10
Overview
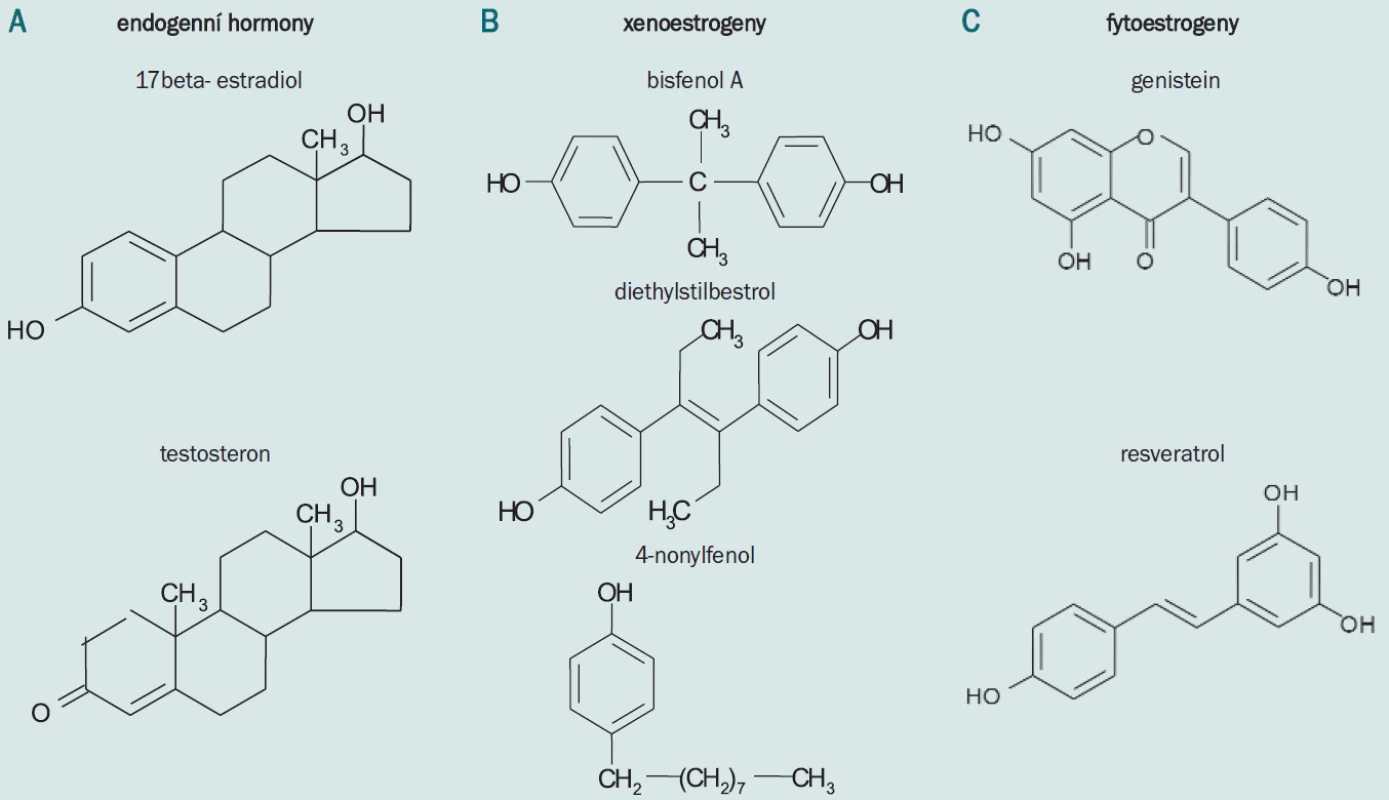
Endokrinní disruptory (ED) jsou látky přítomné jako kontaminanty v životním prostředí a představují toxikologické reprodukční riziko. Dělíme je na xenoestrogeny, chemické látky, které vznikly lidskou činností, a fytoestrogeny, v přírodě se vyskytující látky v rostlinách. Mohou napodobovat nebo interferovat s činností endogenních hormonů. Vliv vybraných polutantů na savčí organizmus (reprodukční orgány, gamety a reprodukci) je možné testovat in vivo (myší model). Xenoestrogeny měly ve vybraných dávkách negativní vliv na in vivo fertilitu a reprodukční orgány. Naproti tomu fytoestrogeny ve vybraných dávkách nevykazovaly negativní vliv na reprodukci savců a jiné sledované parametry.
Klíčová slova:
endokrinní disruptory, váha těla, váha orgánů, stav akrozomu, fertilitaÚVOD
Aby došlo k úspěšnému oplození, tj. splynutí haploidních gamet opačného pohlaví, kterým vzniká diploidní zygota, jako základ budoucího embrya, je třeba, aby nejen gamety, ale celá řada molekul, které se tohoto děje účastní, a které jsou spojeny s gametami a reprodukčním traktem, byla funkční a bez defektů. V případě, kdy vznikají defekty jak gamet, tak reprodukčních orgánů, dochází k poruchám v oplození a reprodukci.
V mnoha zemích v posledních několika desetiletích v lidské populaci stoupl nárůst testikulárních nádorů [1,2], defektů ve vývoji reprodukčních orgánů [3,4]) a snížila se výrazně kvalita mužského spermiogramu [5,6].
V české republice můžeme v poslední době sice pozorovat zvýšenou porodnost, ale ta odpovídá „silným ročníkům“, které se dostaly do reprodukčního věku, současně narůstá počet párů, které mají problémy s reprodukcí. V evropských zemích 15 % párů v reprodukčním věku má problémy v oblasti reprodukce [6]. Mužský faktor je příčinou neplodnosti ve více jak 40 %. V souvislosti s touto realitou vzniká otázka o příčinách tohoto stavu. Příčiny mohou být různé, např. stres, používání drog, kouření. Kromě toho se snižuje kvalita životního prostředí a ta má rovněž výrazný negativní vliv na reprodukci savců včetně člověka. Fyzikální, chemické a biologické polutanty mohou mít vliv na biologickou funkci organizmu a mohou být příčinou neplodnosti. Mezi potravinové kontaminanty patří tzv. endokrinní disruptory, látky, které mohou napodobovat nebo interferovat s funkcí endogenních hormonů [7,8]. Xenoestrogeny jsou chemické látky vznikající lidskou činností. Patří mezi ně např. diethylstibestrol (DES), který byl jako lék podáván těhotným ženám v létech 1945–71 a měl negativní vliv na fertilitu dospělých synů [4,9-11]. Tato látka byla zakázána a setkáme se s ní pouze v experimentech na zvířecím modelu, kde slouží jako pozitivní kontrola k testování vlivu různých látek na reprodukci. Nicméně, celá řada dalších látek je stále v prostředí a její vliv na reprodukci je buď znám, nebo se testuje. Mezi takové látky patří např. bisfenol A (BPA). Jedná se o monomer používaný ve všudypřítomných plastech, polykarbonátech [12] a epoxidových pryskyřicích [13]. Monomery a oligomery bisfenolu A se mohou uvolňovat během polymerace, tepelnou degradací, autoklávováním apod [12]. Uvolňuje se též z vnitřní vrstvy zeleninových konzerv [14] i z kompozitních zubních výplní [13,15].
Nonylfenol (NP) se používá jako aditivum lubrikačních olejů, plastů a byl také nalezen v PVC (polyvinyl chlorid), který se používá např. k balení potravin. Jedná se o poměrně stálou látku, která se hromadí v tucích živých organizmů [16].
Fytoestrogeny jsou přirozené látky a jsou obsaženy v rostlinách, které jsou součástí lidského jídelníčku. Mezi tyto látky patří genistein (GEN), který je hlavní složkou sojových produktů. Epidemiologické studie prokázaly pozitivní vliv příjmu sojových produktů s nízkým výskytem nádorových onemocnění různých orgánů [17,18].
Resveratrol (RES) je součást lidské stravy, byl nalezen ve více jak 300 druzích jedlých rostlin. Ve značném množství je v červeném víně [19,20].
V našich recentních pracích jsme testovali vliv vybraných endokrinních disruptorů na fertilitu myší a na vybrané další parametry (hmotnost zvířat a orgánů, histologický obraz reprodukčních orgánů). Protože poškození reprodukčních orgánů je spojeno s poškozením gamet a o patofyziologii spermií je známo málo, testovali jsme v naší práci proteiny spermie, o kterých víme, že se účastní vazby spermie na zona pellucida vajíčka. Povrchové proteiny jsou důležité pro primární vazbu spermie na vajíčko [21-23] a intraakrozomální proteiny hrají úlohu v sekundární vazbě po akrozomální reakci [24-26].
V našich předchozích pokusech byly monoklonální protilátky proti intra-akrozomálním proteinům použity k detekci kvality lidských spermií a průkazu spermatogenese u mužů s azoospermií [27,28], proto jsme použili monoklonální protilátky k testování kvality spermií u experimentálně navozené patologie.
MATERIÁL A METODY
Experimentální model
V pokusech byly použity outbrední linie myší CD1, které se vyznačují vysokou heterozygotností (napodobuje tak situaci v lidské populaci) a vysokým počtem mláďat ve vrhu (12–13 na myš). Kontrolní skupina myší nebyla vystavena podání vybraných látek. Studie byla multigenerační.
Vybrané látky (ED)
Látky byly podávány ve vodě pro přesné určení dávky použité látky. Byly vybrané následující látky v daných koncentracích.
- Xenoestrogeny:
Diethylstilbestrol ((E)-3,4,bis(4hydroxyfenyl)-3-hexen) - DES, dávka 0,5 µg/váha myši/den, bisfenol A (4,4´-izopropyliden difenol), BPA: (2 ng/váha myši/den a 20 ng/váha myši/den), nonylfenol (para-nonylphenol (4-nonylphenol), (NP): (50 µg/l a 500 µg/l) (obr. 1).
- Fytoestrogeny:
Genistein (4´,5,7-trihydroxy izoflavon, GEN): 2,5 a 25 µg/váha myši/den, resveratrol (3,5,4´ - trihydroxystilben, RES) 3 mg/l (obr. 1).
Příprava buněk a tkání
Spermie byly získané z cauda epididymis a tkáně z reprodukčních orgánů po usmrcení myší. řezy tkání byly připraveny podle odkazů [29,30].
Stav akrozomu
K testování stavu akrozomu byl použit panel monoklonálních protilátek připravených v laboratoři [26,31-33].
Imunohistochemie
Vzorky spermií byly naneseny na podložní sklo, po fixaci a promytí fyziologickým roztokem (PBS) byla přidána monoklonální protilátka (naředěná v PBS, imunoglobulinová koncentrace 20 µg/ml) a vzorky byly 30 min inkubovány. Pro promytí (PBS) byla přidána sekundární protilátka proti myšímu imunoglobulinu značená fluorescein izothicyonatem (FITC) a po další inkubaci (45 min) a promytí byly spermie (200 buněk) hodnoceny ve fluorescenčním mikroskopu (Nikon Labophot-2 a fotografovány kamerou (COHU CCD) s pomocí softwaru Lucie [27].
Histologické hodnocení
Rutinně připravené vzorky byly značeny hematoxylin-eozinem a hodnoceny pomocí mikroskopu (viz výše).
Statistická analýza
Statistické rozdíly mezi skupinami byly porovnávány pomocí ANOVA a Newman-Keuls testy.
VÝSLEDKY
Diethylstilbestrol (DES) měl v pokusech na myších dramatický vliv na reprodukci in vivo i na ostatní parametry (váha myší, orgánů). Byla snížena významně kvalita spermií (stav akrozomu) a nalezen snížený počet spermií - ve 2. generaci již byla nalezena úplná neplodnost.
Bisfenol A (BPA) byl pro ilustraci vybrán jako „ukázkový xenoestrogen“. V pokusech na myších, kdy byl bisfenol-A (BPA) podáván ve 2 dávkách, byl zjištěn negativní vliv na reprodukci myší. Nižší koncentrace BPA měla vyšší účinek než vyšší dávka (graf 1A). Stav akrozomu myších spermií odpovídal počtu narozených mláďat (graf 2).
Graph 1. Vliv xenoestrogenů na počet narozených mláďat. Bisfenol A (A), nonylfenol (B). 
Graph 2. Vliv bisfenolu A na integritu akrosomu myších spermií. 
Histologický obraz ovarií vykazoval nižší počet folikulů (obr. 2) a poruchy v spermatogenezi (obr. 3). Hodnocení akrozomu pomocí monoklonální protilátky proti akrozomálním proteinům v imunofluorescenci prokázala snížený počet označených spermií - tedy s porušeným akrozomem (obr. 4).
Image 2. Vliv bisfenolu A na stav ovarií. Tkáňové řezy ovarií. Kontrolní skupina bez ovlivnění (A) a experimentální po ovlivnění bisfenolem A (B). 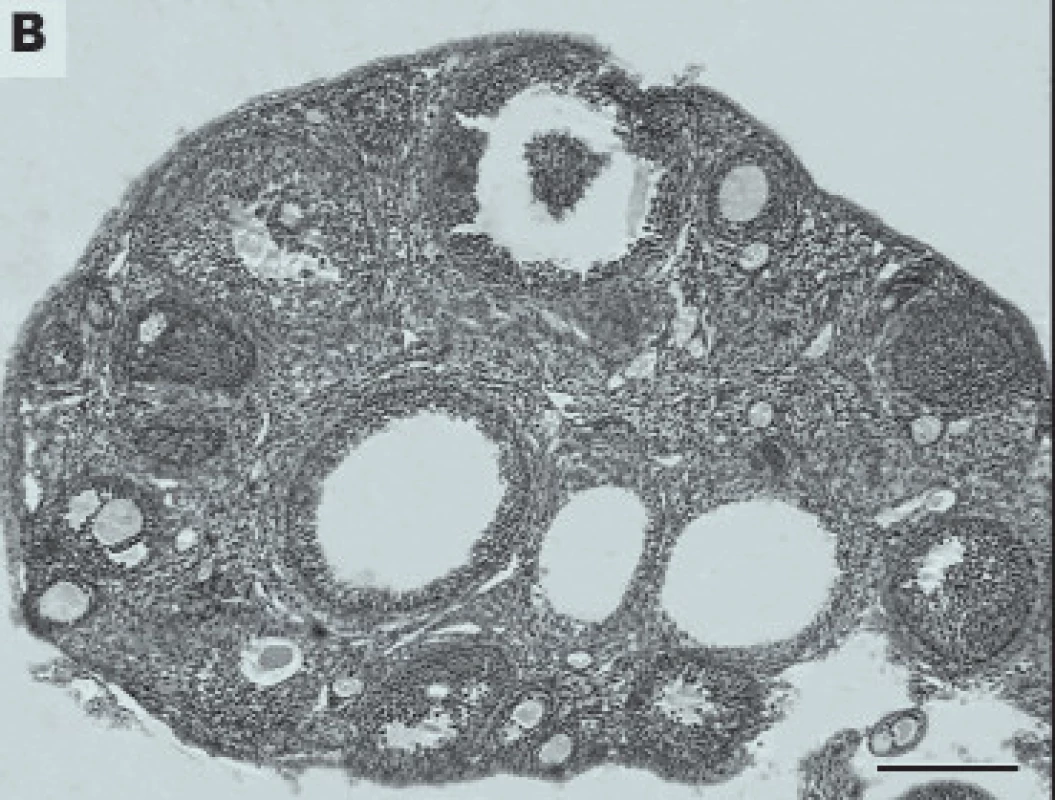
Image 3. Vliv bisfenolu A na spermatogenesi. Tkáňové řezy testes. Kontrolní skupina bez ovlivnění (A) a experimentální po ovlivnění bisfenolem A (B). 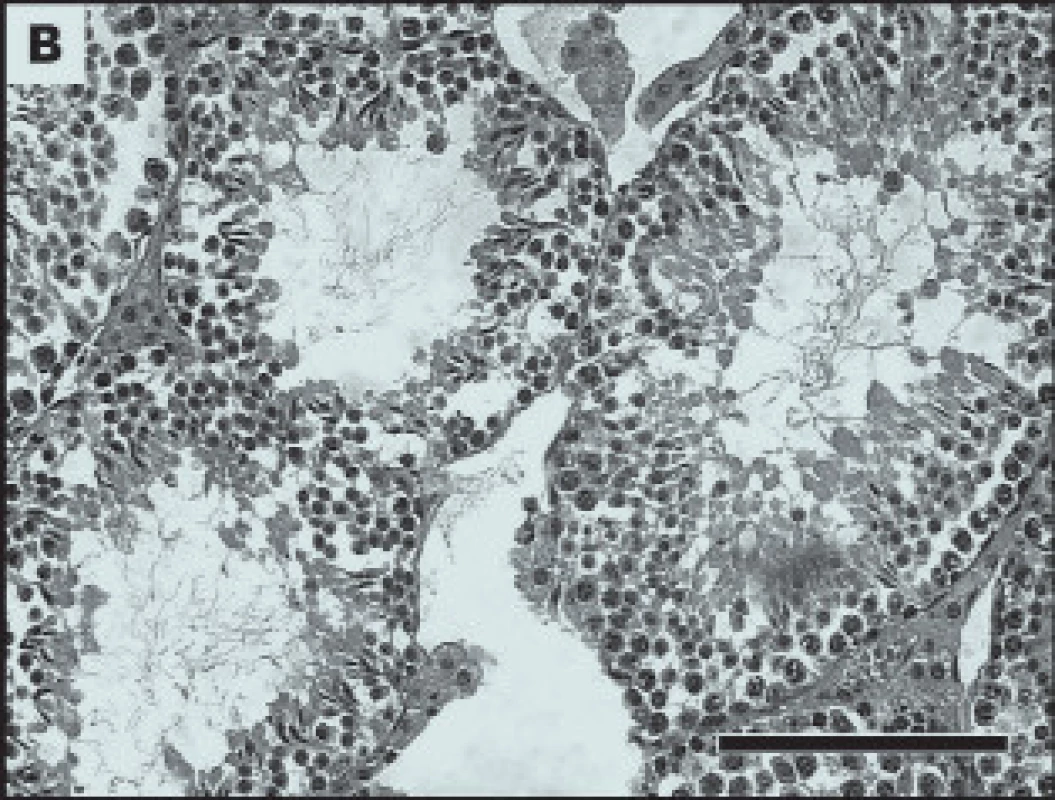
Image 4. Imunofluorescenční značení akrosomu myších spermií pomocí monoklonální protilátky (Hs-14) proti akrozomálním proteinům, kontrolní skupina a experimentální po ovlivnění bisfenolem A. 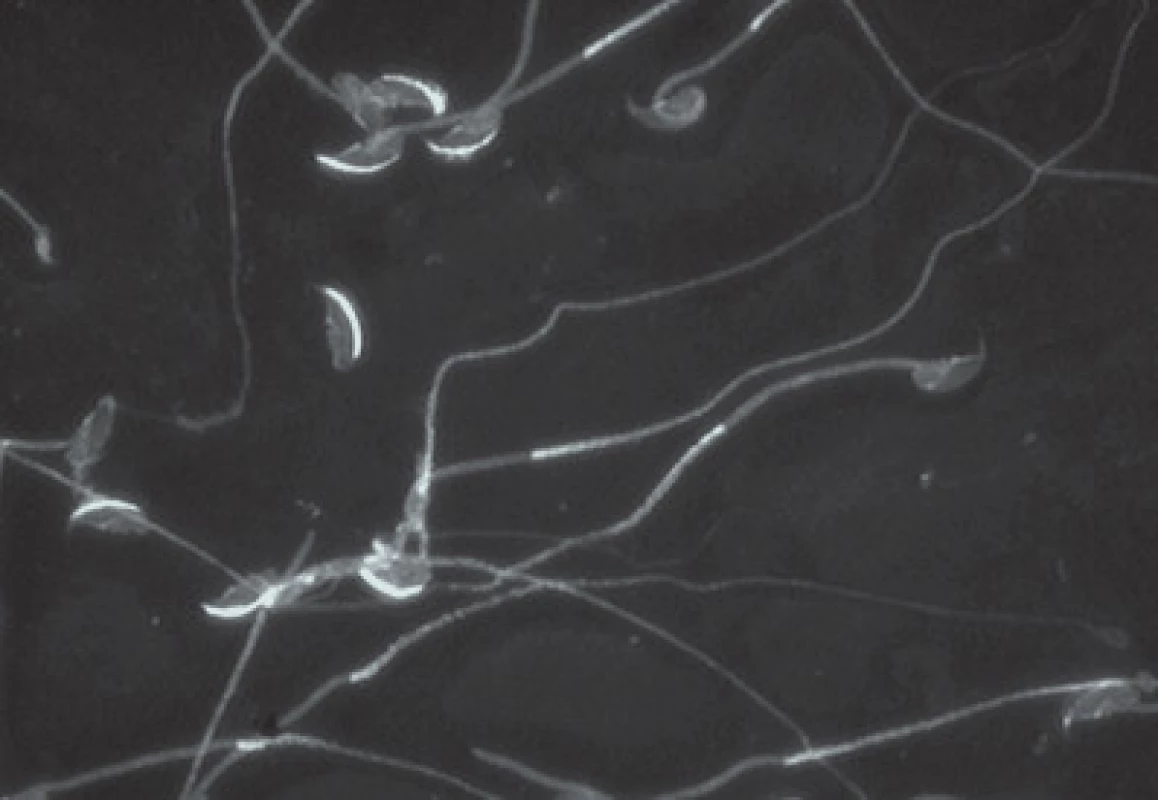
Další xenoestrogen - nonylfenol-A (NP), měl rovněž negativní vliv na in vivo reprodukci a sledované parametry, jeho negativní účinek byl závislý na použité dávce (graf 1B). Histologický obraz reprodukčních orgánů a stav akrozomu byl srovnatelný s působením BPA.
Naproti tomu studované fytoestrogeny, kam patří genistein a resveratrol, neměli vliv na reprodukci myší ani výrazný vliv na další testované parametry.
Detaily výsledků jsou shrnuty v pracích [34-36].
ZÁVĚR
- Počet narozených mláďat ve vrhu je hlavním indikátorem reprodukčního zdraví.
- Pozitivní kontrola testů – podávání diethylstilbestrolu (DES) – mělo zásadní vliv na poškození reprodukčních orgánů a spermií, které vedlo k neplodnosti myších samců.
- Počet mláďat po působení bisfenolu A (BPA) byl statisticky snížen s tím, že nižší dávka měla vyšší efekt – výsledky vykazují pozorování často pozorovaná v endokrinologii, nižší dávka hormonů může stimulovat, zatímco vyšší má opačný efekt.
- Nízké dávky p-nonylfenolu (NP) negativně ovlivňovaly reprodukční potenciál myší. Odpověď organizmu byla v přímé závislosti k dávce látky a prohlubovala se v dalších generacích.
- Oba xenoestrogeny (BPA, NP) měly vliv na váhu reprodukčních orgánů, jejich morfologii a kvalitu spermií, což se odrazilo ve snížené plodnosti samců.
- Působení fytoestrogenů – genistenu (GEN) a resveratrolu (RES) nevedlo k poškození reprodukčních orgánů a spermií myší a to ani v následujících generacích.
- Monoklonální protilátky proti intraakrozomálním proteinům spermie mohou být užitečným nástrojem k testování kvality spermií u experimentálně navozené patologie.
- Vybrané endokrinní disruptory (xenoestrogeny) negativně ovlivňují reprodukci savců a mohou mít dopad i na zhoršení reprodukčních parametrů u lidí.
Autorka děkuje spoluautorům publikací zabývajících se studiem endokrinních disruptorů, jejichž výsledky jsou zde částečně uvedeny a to RNDr. V. Kyselové-Novákové, RNDr. M. Boubelíkovi, (ÚMG AV čR) a MUDr. D. Buckiové (ÚEM AV čR), a dále všem spolupracovníkům Laboratoře diagnostiky pro reprodukční medicínu Ústavu molekulární genetiky AV čR za aktivní přístup k řešení dané problematiky.
Výsledky byly získané za podpory MŠMT, grant 1M06011 a Výzkumného záměru AVOZ50520514.
doc. RNDr. Jana Pěknicová, CSc.
Laboratoř diagnostiky pro reprodukční medicínu Ústavu molekulární genetiky AV ČR
Vídeňská 1083, 142 20 Praha 4
e-mail: jpeknic@biomed.cas.cz
Sources
1. Adami H, Berstrom M, Zatonski W et al. Testicular cancer in nine northern European countries. Int J Cancer 1994; 59 : 33-38.
2. Forman D, Moller H. Testicular cancer. Cancer Surv 1994; 19/20 : 323-341.
3. Ansell EZ, Bennet V, Bull D et al. Cryptochidism: a prospective study of 7 500 consecutive male births, 1984-8. Arc Dis Childhood 1992; 67 : 892-899.
4. Jensen TK, Toppari J, Keiding N, Skakkebaek NE. Do environmental estrogens contribute to the decline in male reproductive health? Clin Chem 1995; 41 : 1896-1901.
5. Carlsen E, Giwercman A, Keiding N, Skakkebaek NE. Evidence for decreasing quality of semen during 50 years. Br Med J 1992; 305 : 609-613.
6. WHO. Laboratory manual for examination of human semen and semen cervical mucus interaction. 3. ed. Cambridge: Cambridge Univ Press 1998.
7. von Saal FS, Cooke PS, Buchanan DL et al. A physiologically based approach to the study of bisphenol A and other Estrogenic chemicals on the size of reproductive organs, daily sperm production, and behavior. Toxicol Ind Health 1998; 14 : 239-260.
8. EPA: Reproductive and development toxicity of Bisphenol A. 1999. www.bisphenol - a.org/toxicology/ reproductive.html
9. Degen GH, Bolt HM. Endocrine disruptors: update on xenoestrogens. Int Arch Occup Environ Health 2000; 73 : 433-441.
10. Whitehead ED, Leiter E. Genital abnormalities and abnormal semen analyses in patients exposed to diethylstilbestrol in utero. J Urol 1981; 125 : 47-50.
11. Klip H, Verloop J, van Gool JD et al. Hypospadias in sons of women to diethylstilbestrol in utero: a cohort study. Lancet 2002; 359 : 1102-1107.
12. Krishnan AV, Statish P, Permuth SF et al. Estrogenic substance is released from polycarbonate flask during autoclaving. Endocrinology 1993; 132 : 2279-2286.
13. Olea N, Pulgar R, Pérez P et al. Estrogenicity of resin-based composites and sealants used in dentistry. Environ Health Perspect 1996; 104 : 298-305.
14. Brotons JA, Olea-Serrano MF, Villalobos M et al. Xenoestrogens released from lacquer coating in food cans. Environ Health Perspect 1995; 103 : 608-612.
15. Lewis JB, Rueggeberg FA, Lapp CA, Ergle JW. Identification and characterization of estrogen-like components in commercial resin-based dental restorative materials. Clin Oral Invest 1999; 3 : 107-113.
16. Ahel M, McEvoy J, Giger W. Bioaccumulation of the lipophilic metabolites of nonionic surfactants in freshwater organisms. Environ Pollut 1993; 79 : 243-248.
17. Adlercreutz H, Honjo H, Higashi A et al. Urinary excretion of lignans and isoflavonoid phytoestrogens in Japanese men and women consuming a traditional Japanese diet. Am J Clin Nutr 1991; 54(6): 1093-1100.
18. Messina MJ. Legumes and soy beans: overview of their nutritional profiles and health effects. Am J Clin Nutr 1999; 70 : 439S-450S.
19. Landcake P, Price RJ. The reproduction of resveratrol by Vitis vinifera and other members of the Vitacea as a response to injection or injury. Physiol Plant Pathol 1976; 9 : 77-86.
20. Savouret JF, Quesne M. Resveratrol and cancer: a review. Biomed Pharmacother 2002; 56 : 84-87.
21. Ward CR, Kopf GS. Molecular events mediating sperm activation. Dev Biol 1993; 158 : 9-34.
22. Yanagimachi R. Mammalian fertilization. In: Knobil E, Neill JD (eds). The Physiology of Reproduction. New York: Raven Press 1994 : 189-317.
23. Calvete JJ, Ensslin M, Mburu J et al. Monoclonal antibodies against boar sperm zona pellucida binding protein AWN-1. Characterization of a continuous antigenic determinant and immunolocalization of AWN epitopes in inseminated sows. Biol Reprod 1997; 57 : 735-742.
24. Moos J, Peknicova J, Tesarik J. Relationship between molecular conversion of acrosin and the progression of exocytosis in the calcium ionophore-induced acrosome reaction. Biochem Biophys Acta 1993; 1176 : 199-207.
25. Brucker C, Lipfors GB. The human sperm acrosome reaction, physiology and regulatory mechanisms. Hum Reprod 1995; 1 : 56-62.
26. Peknicova J, Capkova J, Geussova G et al. Monoclonal antibodies to intra-acrosomal proteins inhibit gamete binding. Theriogenology 2001; 56 : 211-223.
27. Peknicova J, Chladek D, Hozak P. Monoclonal antibodies against spem antigens as markers for detection of physiology and pathology of human spermatozoa and estimation of spermatogenesis. Amer J Immunol Reprod 2005; 53 : 1-8.
28. Tepla O, Peknicova J, Koci K et al. Evaluation of reproductive potential after intracytoplazmatic sperm injection of varied human semen tested by antiacrosomal antibodies. Fertil Steril 2006; 86 : 113-120.
29. Moos J, Veselsky L, Peknicova J, Drahorad J. Purification and partial characterization of zona pellucida binding proteins from boar seminal plasma. Molec Reprod Develop 1992; 33 : 165-171.
30. Veselsky L, Peknicova J, Cechova D et al. Characterization of boar spermadhesins by monoclonal and polyclonal antibodies and their role in binding to oocytes. Amer J Reprod Immunol 1999; 42 : 187-197.
31. Geussova G, Peknicova J, Capkova J et al. Monoclonal antibodies to canine intraacrosomal sperm proteins recognizing acrosomal status during capacitation and acrosome reaction. Andrologia 1997; 29 : 261-268.
32. Peknicova J, Moos J. Monoclonal antibodies against boar acrosomal antigens labeling undamaged acrosomes of spermatozoa in immunofluorescence test. Andrologia 1990; 22 : 427 - 435.
33. Capkova J, Geussova G, Peknicova J. Monoclonal antibody to human sperm acrosomal protein. Folia Biol 2000; 46 : 55-57.
34. Peknicova J, Kyselova V, Buckiova D, Boubelik M. Effect of endocrine disruptor on mammalian fertility. Application of monoclonal antibodies against sperm proteins as markers for testing sperm damage. Amer J Reprod Immunol 2002; 47 : 311-318.
35. Kyselova V, Peknicova J, Buckiova D, Boubelik M. Effect of p-nonylphenol and resveratrol on in vivo fertility and different body parameters in outbred mice CDl. Reprod Biol Endocrinol 2003; 1 : 30. www.rbej.com
36. Kyselova V, Peknicova J, Boubelik M, Buck-iova D. Body and organ weight, sperm acrosomal status and reproduction after genistein and diethylstilbestrol treatment of CD1 mice in a multigenerational study. Theriogenology 2004; 61 : 1307-1325.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2007 Issue 3-
All articles in this issue
- Dihydrotestosteron a inhibitory steroidní 5α-reduktázy
- Výsledky vyšetření mikrodelecí oblasti AZF(Yq) u mužů s reprodukčními problémy
- Klinická anatomie sulcus nervi dorsalis penis/clitoridis
- Mužská antikoncepce
- Genová terapie – nová naděje v léčbě erektilní dysfunkce?
- Stárnoucí muž, hormonální a genetické změny
- Je substitúcia testosterónu potenciálnym rizikom pre prostatickú žľazu u stárnuceho muža?
- Rehabilitace erektilní funkce po radikální prostatektomii
- Erektilní dysfunkce po radikální prostatektomii
- Změny spermiogramu v závislosti na stupni varikokély
- Vliv endokrinních disruptorů na fertilitu savců
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Erektilní dysfunkce po radikální prostatektomii
- Dihydrotestosteron a inhibitory steroidní 5α-reduktázy
- Mužská antikoncepce
- Je substitúcia testosterónu potenciálnym rizikom pre prostatickú žľazu u stárnuceho muža?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career