-
Medical journals
- Career
Je substitúcia testosterónu potenciálnym rizikom pre prostatickú žľazu u stárnuceho muža?
: doc. MUDr. Jozef Marenčák, Ph.D.
: Urologické oddelenie NsP Skalica
: Urol List 2007; 5(3): 46-53
V posledných desaročiach pribúda čoraz viac jedincov vo vyšších vekových skupinách v dôsledku predlžovania priemerného veku dožitia populácie. Značná medicínska pozornos je venovaná poklesu androgénov u stárnucich mužov. Syndróm nedostatku testosterónu (TDS) je klinický a biochemický syndróm, ktorý ovplyvňuje funkciu viacerých orgánov v tele a znižuje kvalitu života najmä starších jedincov mužského pohlavia. Možné patofyziologické mechanizmy poklesu testosterónu (TST) s pribúdajúcim vekom zahrňujú: zníženú produkciu GnRH v hypotalame, poškodenú steroidogenézu v semenníkoch a zmenu v negatívnej spätnej väzbe pohlavných hormónov. V patofyziológii poklesu TST podmieneného rastúcim vekom je stále ešte veľa nejasností. Nové prípravky (orálne, injekčné a transdermálne) boli nedávno úspešne zavedené do terapie TDS. Medikamentózna substitúcia testosterónu u hypogonadických mužov je bezpečná a účinná. Kontraindikácie androgénnej substitučnej liečby (ART) sú dobre definované a riziko ART je nízke. Napriek tomu je potrebná pravidelná kontrola liečených jedincov podľa všeobecne akceptovaných smerníc. Účinok TST na prostatickú žľazu predstavuje jeden z najdiskutovanejších a najrozporuplnejších aspektov poslednej doby v andrológii. Nedávne prospektívne štúdie dokázali nízky výskyt karcinómu prostaty (KP) v súvise s ART. Aplikácia androgénov je absolútne kontraindikovaná u jedincov s dokázanou rakovinou prostatickej žľazy, alebo aj s podozrením na KP; rovnako ako aj u tých so suspektným/ dokázaným karcinómom prsnej žľazy. ART nie je možné indikova u mužov s abnormálnym digitálnym rektálnym vyšetrením (DRV) a/alebo s abnormálnou hladinou prostatického špecifického antigénu (PSA) v sére. Histologicky dokázaná prítomnos prostatickej intraepiteliálnej neoplázie (PIN) je zatiaľ rozporuplne diskutovaná v súvislost s ART.
Závery:
nie je zatiaľ vedecký dôkaz pre to, že TST je príčinou rastu karcinómu prostaty. Vzah mužského pohlavného hormónu ku prostatickej žľaze a k jej možnému chorobnému postihnutiu (benígna prostatická hyperplázia, karcinóm prostaty) zostáva zatiaľ nie celkom objasnený. V článku sú diskutované súčasné poznatky z experimentálnej i humánnej medicíny o bezpečnosti ART u hypogonadických mužov s TDS. Potrebné sú ďalšie kvalitné, najmä dlhodobé, randomizované, klinické štúdie na väčšom počte pacientov.Klúčové slová:
substitúcia testosterónu, prostatická žľaza, bezpečnosťÚVOD
Motto: „Pretože hladina hormónov klesá s vekom, obrátením tohto procesu a špatným obnovením hodnôt hormonálnych hladín spred 20 rokov, urobíme muža mladšieho práve o tých 20 rokov“
(C. Schulman, 2006)
Proces starnutia ľudského organizmu charakterizujú okrem iného aj zmeny v jeho hormonálnom prostredí. Na rozdiel od prudkých hormonálnych zmien u starnúcich žien (menopauza) je zníženie hladín mužského pohlavného hormónu testosterónu (T) u starších mužov pozvoľné. Medzinárodná spoločnos pre štúdium starnúceho muža definuje syndróm androgénnej insuficiencie u muža (známy aj ako Androgen Deficiency of Aging Male - ADAM, alebo Partial Androgen Decline in Aging Male - PADAM, alebo Late Onset Hypogonadism - LOH, alebo Ageing Associated Androgen Deficiency - AAAD a v poslednej dobe prevládajúci názov Testosterone Deficiency Syndrom - TDS) ako klinický a biochemický syndróm, často spojený s pokročilým vekom a charakterizovaný nízkou hladinou sérových androgénov, s alebo bez zníženej vrodenej citlivosti receptorov na androgény (najmä T), čo môže ovplyvni funkciu viacerých orgánových systémov s následným signifikantným znížením kvality života, vrátane zmien v sexuálnej funkcii postihnutého muža [1-8]. Začiatok poklesu hladín TST je individuálny, zrýchľuje sa v 5. dekáde života v dôsledku zníženia počtu Leydigových buniek v semenníkoch, ale tiež následkom zníženia amplitúd pulzov LH v centrálnom nervovom systéme (CNS). Pri starnutí nie sú však prítomné zmeny len v hladine mužského pohlavného hormónu (T), ale vždy ide o komplex zmien aj v tvorbe ďalších hormónov, pričom podstatná je zmena v hypotalamo-hypofyzárnej regulácii. Presné údaje o celkovej prevalencii TDS u starších mužov nie sú známe. Viaceré štúdie potvrdili pokles tvorby androgénov v súvislosti s vyšším vekom jedincov [9-11]. Odhaduje sa, že v USA t. č. žije 5 miliónov hypogonadálnych mužov, z ktorých len 5 % je adekvátne liečených pre ažkosti spojené s TDS [7]. Údaje o incidencii a prevalencii TDS u mužov v Slovenskej republike do t. č. prakticky neexistujú. V roku 2004 bolo v SR medikamentózne liečených 880 mužov pre syndróm starnúceho muža: celkové náklady na terapiu činili 10 644 320 Sk [12].
SUBSTITUČNÁ LIEČBA TDS
Indikácie pre androgénnu substitučnú liečbu (ART - androgen replacement therapy, TRT - testosterone replacement therapy) ukazuje tab. 1 [1,2,5,8]. Ciele a riziká hormonálnej substitučnej terapie (ART) sú uvedené v tab. 2 [1,2,5,8,13]. Liečba TDS je väčšinou dlhodobá so snahou dosiahnu a udrža sérové hladiny TST vo fyziolgických hraniciach [1,2,7,8,14-16]. Na substitučnú terapiu mužov s TDS sú dnes k dispozícii bezpečné a účinné preparáty TST (perorálne, parenterálne, transdermálne, bukálne) (tab. 3) [1,2,5,7,12,13,14,17]. Perorálna (tbl) a najmä transdermálna (mas, krém, náplas, gél a pod) forma aplikácie ukázali vo viacerých štúdiách optimálny farmakokinetický profil u staršieho muža (s možnosou rýchleho ukončenia podávania pri prípadnom neželanom účinku substitučnej liečby) [7,14]. Výhodou „superdepótnych“ injekčných preparátov je tiež dlhodobo stabilná sérová koncentrácia TST v normálnych rozmedziach a najmä pre pacienta prijateľný, až 3mesačný interval medzi jednotlivými aplikáciami [7,14]. Prejavy „predávkovania“ (agresivita, hypersexualita) pacientov po ART sú extrémne vzácne [1,18]. Kontraindikácie ART sú ukázané v tab. 4 [7,13]. Možné nežiaduce účinky substitučnej liečby androgénmi sú: 1. indukcia erytropoézy (polycytémia a zhoršenie prekrvenia mozgu), 2. retencia sodíka (najmä u pacientov so srdcovou alebo obličkovou nedostatočnosou), 3. oligospermia až azoospermia, zníženie množstva ejakulátu, 4. zmeny v hladinách sérových lipidov, 5. vplyv na vývoj prostatickej žľazy je otázny a zrejme nie až tak dramatický, akoby sa predpokladalo [2,7,13,14,17]. U pacientov liečených substitučným podávaním androgénov je nevyhnutné pravidelné sledovanie (klinické kontroly, laboratórne vyšetrenia, efekt liečby a pod.) (tab. 5) [7].
1. Indikácie pre androgénnu substitučnú liečbu u andropauzálnych mužov [1,2,5,8]. ![Indikácie pre androgénnu substitučnú liečbu u andropauzálnych mužov [1,2,5,8].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/cdf9eb6f6273e21aedaada42c9f36cea.png)
2. Androgénna substitučná terapia pre starnúceho hypogonadálneho muža [1,2,5,8,13]. ![Androgénna substitučná terapia pre starnúceho hypogonadálneho muža [1,2,5,8,13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/94d1f2aa77eed25355003f14aa9072ca.png)
3. Preparáty používané (v súčasnosti) na androgénnu substitučnú terapiu u hypogonadálnych mužov [12-14]. ![Preparáty používané (v súčasnosti) na androgénnu substitučnú terapiu u hypogonadálnych mužov [12-14].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/84461f42b54fcfd3261f267f50aecc20.png)
4. Kontraindikácie androgénnej substitučnej terapie [7,13]. ![Kontraindikácie androgénnej substitučnej terapie [7,13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/ff6df19c22db8b9f68aba228164dfaf1.png)
5. Kontroly andropauzálneho pacienta liečeného substitučnou liečbou androgénmi [7]. ![Kontroly andropauzálneho pacienta liečeného substitučnou liečbou androgénmi [7].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/86425a51df3d7ba6d2e7b7845acef886.png)
ART A RIZIKO OCHORENÍ PROSTATICKEJ ŽĽAZY
Testosterón a benígna prostatická hyperplázia (BPH)
Testosterón má značný vplyv na vývoj a proliferáciu buniek predstojnej žľazy. Fyziologické hladiny androgénov sú podmienkou pre potlačenie/zníženie apoptózy (bunkovej smrti) buniek prostatického epitelu. V experimente bolo dokázané, že po androgénnej deprivácii väčšina (60–70 %) sekrečných buniek prostaty rýchlo (v priebehu 7 dní) zaniká. Následná aplikácia androgénov u dospelých, kastrovaných potkaních samcov viedla k „spusteniu“ opätovného rastu prostatickej žľazy [17]. Napriek tomu, že BPH je závislá od prítomnosti cirkulujúcich androgénov, neboli zaznamenané významné rozdiely v hladinách TST u mužov s benígnym zväčšením prostaty v porovnaní s tými, ktorí nemali BPH [17,19-21]. Aj v humánnej medicíne bolo dokázané, že výrazné zníženie sérového TST vedie ku zmenšeniu prostatickej žľazy [17]. V prípade substitúcie TST dochádza k pomerne rýchlemu zvýšeniu objemu prostaty a to už v priebehu prvých 6 týždňov od začiatku liečby [17,19-21]. Nedávna metaanalýza 13 štúdií (zaoberajúcich sa vzahom ART a možným rizikom vzniku chorôb prostaty) ukázala, že ART má za následok: mierne zvýšenie objemu prostaty (len do očakávanej veľkosti u eugonadálnych mužov), marginálne (okrajové) zvýšenie hodnôt sérového PSA (prostatického špecifického antigénu), nezmenenie (nezhoršenie) prúdu moču/ objemu postmikčného rezidua (tab. 6 a 7) [13,17]. Podobné skúsenosti sme potvrdili aj v našom súbore 49 hypogonadálnych mužov liečených TRT (pri 92% efektivite liečby) v NsP Skalica (tab. 8). Aplikácia TST u hypogonadálnych mužov s BPH tiež nezvyšuje frekvenciu komplikácií (retencie moču, chirurgické riešenie BPH a pod.). Dokonca ani dlhodobá aplikácia suprafyziologických dávok TST u eugonadálnych mužov neviedla k podstatnému zvýšeniu hladín PSA v sére [22]. Všetky tieto fenomény je možné vysvetli hypotézou, že zrejme existuje určitá maximálna hranica vplyvu (saturácie) testosterónu, po prekročení ktorej už nie je možná ďalšia stimulácia prostatického tkaniva mužským pohlavným hormónom [17]. Zhoršenie príznakov dolných močových ciest (LUTS - Lower Urinary Tract Symptoms) po TRT bolo pozorované len u hypogonadálnych pacientov s výraznými mikčnými obtiažami (IPSS > 20) spôsobenými benígne zväčšenou prostatickou žľazou [13,17].
6. Substitučná liečba testosterónom a hodnota prostatického špecifického antigénu v sére [13,17]. ![Substitučná liečba testosterónom a hodnota prostatického špecifického antigénu v sére [13,17].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/837fb39105f7180f453b88ccee035765.png)
7. Účinok substitučnej liečby testosterónom na dolné močové cesty [13,17]. ![Účinok substitučnej liečby testosterónom na dolné močové cesty [13,17].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a7ef8d0ef2365e23b4c25e8ad58de514.png)
Testosterón a karcinóm prostaty (KP)
KP je výsledkom zložitých a zatiaľ stále nie celkom jasných interakcií medzi starnutím, genetickými a rastovými faktormi, hormónmi a životným prostredím. Už pred 70 rokmi práce Hugginsa et al [23] poukázali na možný súvis medzi TST a KP. Je všeobecne známe, že s pribúdajúcim vekom sa na jednej strane zvyšuje incidencia a prevalencia KP a na druhej strane klesá hladina TST. Jednoduché vysvetlenie ponúkajúcej sa korelácie medzi TST a KP však nie je možné všeobecne akceptova.
Môže substitúcia TST vyvola KP?
Aplikácia androgénov pri klinickom KP síce vedie k stimulácii bunkovej proliferácie, ale vplyv androgénov na premenu preklinického do klinického KP je nejasný a nebol doteraz potvrdený ani v experimente, ani v klinickej praxi [13,17,24-26]. Niekoľko rokov je známa hypotéza vývoja KP cez prostatickú zápalovú atrofiu (PIA - prostatic inflammatory atrophy) a následnú prostatickú intraepitelovú neopláziu (PIN). Už dávnejšie bolo potvrdené, že ART nemá vplyv na prekanceróznu léziu KP - na tzv. PIA. Existuje hypotéza, že aplikovaný TST môže naopak výhodne uplatni svoj protizápalový účinok na už existujúcu PIA v prostate postihnutého muža [13,17,27-30]. Viacero autorov poukázalo na význam inhibítora cyklín kinázy (p27) pri kontrole opätovného rastu prostatickej žľazy po substitúcii androgénov. V súčasnosti sa podrobne skúmajú vzahy medzi TST a génom p27 [13,17,31,32]. Všeobecne prevláda názor, že TST samotný nemôže by dostatočne „genotoxický“ na to, aby vyvolal karcinogenézu [2,4,5,13,14,17].
Metaanalýza ďalších 8 štúdií (v rozpätí rokov 1997-2004) ukázala, že ART naozaj nezvyšuje riziko KP: pri priemernom 20 (rozpätie 6–36) mesačnom trvaní ART u 433 pacientov bol KP dokázaný len u 7 (1,6 %) mužov (tab. 9) [13,17,33]. Aj novšie analýzy potvrdzujú, že percentuálny podieľ KP dokázaných v publikovaných TRT štúdiách u hypogonadálnych mužov nie je odlišný v porovnaní s výskytom rakoviny prostaty zisteným v štúdiách zameraných na skríning KP [13,17,24-26,34]. V priebehu niekoľko ročnej kontinuálnej TRT sme nezaznamenali vývoj rakoviny prostatickej žľazy ani u jedného z našich 49 pacientov (tab. 8). Nedostatkom tohto tvrdenia je zatiaľ relatívne malý počet mužov sledovaných viac ako 1 rok.
8. Substitučná liečba testosterónom u hypogonadálnych mužov* v NsP Skalica (1. 1. 2002–31. 12. 2006). 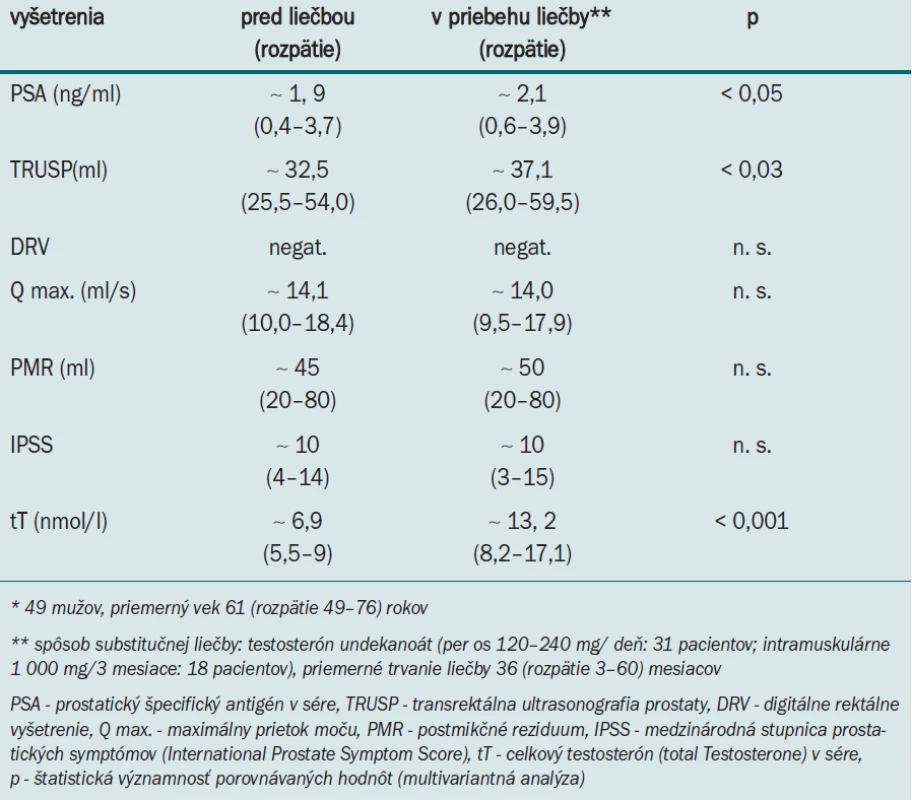
9. Výskyt karcinómu prostaty u hypogonadických mužov v priebehu androgénnej substitučnej liečby [13,17,33]. ![Výskyt karcinómu prostaty u hypogonadických mužov v priebehu androgénnej substitučnej liečby [13,17,33].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/bb2a8cb92d93709dc68a66f4ec4f9e74.png)
Rhoden et al [35] nezaznamenali žiadne prudké zvýšenie vývoja/rastu KP ani v skupine s vysokým rizikom KP (20 hypogonadálnych mužov s histologicky dokázaným HG /High Grade/ PIN) po 12 mesiacoch kontinuálnej TRT.
Možno teda konštatova, že izolované správy o „karcinogenéze de novo“ KP nie sú dostatočne dokázané a ani dokumentované [2,4,5,13,14,17, 24-26].
Znamená vysoká hladina TST aj zvýšené riziko KP?
Gann et al [27] síce zaznamenali zvýšené riziko KP u mužov s vysokými hladinami cirkulujúceho TST a s nízkymi hodnotami SHBG (sexuálne hormóny viažuce proteíny Sexual Hormones Binding Globulins) v sére, ale ďalší autori podobné závery nepotvrdili [13,17, 24 26]. Shaneyfelt et al [36] pozorovali, že muži s vyššou hladinou (v hornej štvrtine normálneho rozpätia) celkového (t)T mali 2,34krát vyššie riziko vzniku KP v porovnaní s mužmi s nižšími hodnotami tT. Treba však konštatova, že práce, ktoré sa zaoberali touto otázkou, mali viaceré nedostatky: neúplne až protirečivé údaje získané z „otvorených“ štúdií, malý počet pacientov a zväčša krátke trvanie sledovania postihnutých jedincov [13,17].
Bolo dokázané, že u pacientov s KP dochádza síce k prechodnému, ale významnému zvýšeniu sérových hladín TST v priebehu prvých 8 až 10 dní po aplikácii LHRH (hormón uvoľňujúci luteotropný hormón - Luteinising Hormone Releasing Hormone) analógov. Napriek tomu v tomto „rizikovom“ období tzv. „vzplanutia androgénov (testosterone flare)“ ani raz nebolo zaznamenané zvýšenie hodnôt PSA v sére [37-39]. Viacerí autori predpokladajú, že zvýšenie hladín TST zrejme nie je príčinou progresie u týchto pacientov [2,5,13,14, 17,24-26,37]. Vedľajšie „príhody“ (zvýšená kostná boles, retencia moču, paraplégia a pod) v priebehu „flare intervalu“ sú zrejme v dôsledku prirodzeného priebehu metastatického KP, prípadne môže zohráva úlohu aj priamy účinok TST na kostný metabolizmus.
Metaanalýza 16 longitudinálnych (populačných) štúdií (612 mužov sledovaných 10,5 roka) nepreukázala žiadny súvis medzi hladinou celkového (t)TST a vznikom a vývojom KP [33]. Len v jednej štúdii bolo zaznamenané zvýšené riziko KP u mužov s nízkymi hladinami TST v sére [33,37].
Yano et al [40] pri analýze svojho súboru 420 mužov (priemerný vek 68,3 roka) nezaznamenali žiadny signifikantný rozdiel v priemernej hladine TST pred liečbou medzi mužmi s BPH a pacientkami postihnutými KP. Súčasne potvrdili zvýšené hladiny TST u jedincov s dobre diferencovanými KP v porovnaní s mužmi so stredne alebo nízko diferencovanými nádormi (p < 0,01). Muži s KP pri hodnotách PSA < 10 ng/ ml a PSAD (density) < 0, 15 ng/ ml mali signifikantne vyššie hodnoty T. ďalšie potvrdenie týchto súvislostí zrejme umožní zvýši efektivitu skríningu KP práve v skupine mužov s relatívne nízkym rizikom KP (v tzv. „šedej zóne“ hodnôt celkového PSA: 4–10 ng/ ml).
Nízka hladina TST a KP
Nebola potvrdená úvaha, že ak zvýšená hladina TST je spojená so zvýšeným rizikom KP, tak potom logicky nízke hodnoty TST predstavujú aj menšie riziko KP. Naopak Morgentaler et al [41] biopticky dokázali KP u 14,3 % hypogonadálnych mužov (priemerný vek 58 rokov, pri normálej hodnote PSA a s negatívnym DRV). V tomto ich súbore bol KP potvrdený až u 29 % mužov starších ako 60 rokov (pre porovnanie len 15,2 % výskyt KP v rovnakej vekovej skupine v placebovom ramene štúdie PCPT – Prostate Cancer Prevention Trial) [41,42]. Viacerí autori zaznamenali signifikantne vyšší výskyt menej diferencovaných, relatívne hormonálne nezávislých, agresívnejších KP práve pri nižšej hladine androgénov, najmä u mladších mužov [1,13,24-26,33,43,44]. U pacientov s lokalizovaným KP môže by „predliečebná“ sérová hladina TST nezávislým prediktorom extraprostatickej choroby [13,17]. Muži s KP a so súčasne nízkou hladinou voľného TST (fTST) mali oveľa rozsiahlejšie ochorenie v porovnaní s jedincami, ktorí mali normálne hodnoty fTST v sére. Niektorí autori potvrdili, že väčšina ich pacientovs KP s nepriaznivou hodnotou Gleasonovho histologického gradingu (GS – Gleason Score ³ 8) mala znížené hladiny sérového TST v čase diagnózy rakoviny prostaty [7,13,17,33].
Aj najnovšie práce poukazujú na to, že nízka hladina sérového TST priamo súvisí: s horším (patologickým i klinickým) štádiom KP, so zvýšenou hodnotou GS, s vyšším výskytom histologicky dokázanej mikrovaskulárnej tumoróznej denzity, so zvýšenou hustotou výskytu androgénovych receptorov v tkanive nádoru a pod [24-26,33]. Teloken et al [45] zaznamenali po radikálnej prostatektómii (RAPE) vyšší (39 %) výskyt pozitívnych chirurgických okrajov u pacientov s nízkym celkovým (t)TST v porovnaní s mužmi s normálou hladinou tT v sére v čase operácie (len 14, 6 %). Imamoto et al[13] potvrdili signifikantne nižšie hladiny sérového TST u mužov s pokročilým KP (pT3-4, N1) v porovnaní s mužmi, ktorý mali len lokalizované ochorenie (pT2).
Aké sú predpokladané mechanizmy, ktoré vedú k endokrinným zmenám u mužov s KP?
Vieme, že prostata (najmä bunky KP) vylučujú rôzne látky (najmä bielkovinovej povahy), ktoré uplatňujú negatívnu spätnú väzbu na hypotalamo-hypofýzo-gonadálnu os. Tieto rôzne, väčšinou inhibičné, faktory (napr. inhibín a pod.) utlmujú tvorbu/ sekréciu gonadotropínov v hypofýze a znižujú aj sérové hladiny T. Hypoteticky je predpokladané, že „tlmivé“ faktory sú produkované (secernované) vo zvýšenej miere práve nediferencovanými neoplastickými bunkami KP. V dôsledku toho sa dá vysvetli, prečo je sérová hladina TST vyššia v priebehu skorších štádií KP v porovnaní s neskoršími (pokročilejšími) stavmi - keď malignita a štádium KP progredujú. K tejto teórii sa v súčasnosti prikláňa viacero autorov, ktorí však upozorňujú, že problematika je určite zložitejšia a nie je ešte dostatočne objasnená [13,17,24-26,33]. ďalší výskum na tomto poli je nevyhnutný. Najnovšie práce poukazujú na význam polymorfizmu androgénových receptorov, vplyv aberácií pri metylácii DNK, ktoré poukazujú na geneticky podmienené rozdiely „stavu androgenizácie“ u každého jedinca mužského pohlavia [46,47]. Heráček et al [48] dokázali u mužov s potvrdeným KP signifikantne vyššiu koncentráciu androgénov (testosterónu, dihodyrotestosterónu a epitestosterónu) v prostatickom tkanive v porovnaní s mužmi s BPH. Podobné rozdiely však neboli zaznamenané pri hodnotení hladín tých istých androgénov v sére - a to ako u pacientov s KP, tak ani u mužov s BPH.
TRT u mužov po radikálnej (kuratívnej) liečbe KP
Dnes sa začínajú diskutova aj možnosti liečebného použitia prípravkov TST u symptomatických hypogonadických mužov po úspešnej kuratívnej liečbe KP [1,7,13,14,49,50]. Najnovšie odporúča-nia Európskej urologickej spoločnosti (EAU - European Association of Urology) a Medzinárodnej spoločnosti pre výskum starnúceho muža (ISSAM - International Society for the Study of the Aging Male) hovoria: „Muži úspešne kuratívne liečení pre KP a trpiaci symptomatickým hypogonadizmom môžu by kandidátmi pre ART po dostproti takémuto odporúčaniu. Lekár musí ma dostatočné praktické skúsenosti a vedomosti o výhodách/nevýhodách ART v tejto situácii“ [50]. Aj keď počet takto liečených mužov je zatiaľ nedostatočný, recidíva KP (vyjadrená rekurenciou PSA) po ART nebola doteraz zaznamenaná ani u jedného pacienta (tab. 10) [13].
10. Androgénna substitučná liečba u pacientov po radikálnej prostatektómii* [13]. ![Androgénna substitučná liečba u pacientov po radikálnej prostatektómii* [13].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/124ad0abacc37dd6b904489caae55e0b.png)
KONTROLY PACIENTA LIEČENÉHO ART
U pacientov liečených substitučným podávaním androgénov je nevyhnutné pravidelné sledovanie (klinické kontroly, laboratórne vyšetrenia, efekt liečby a pod.) (tab. 5). Pri suplementácii TST niektorí autori neodporúčajú laboratórne monitorova hladiny TST a efekt liečby hodnotia len na základe: zmien v subjektívnom stave pacienta a dôkazu objektívnych zmien zaznamenaných pri pravidelnom klinickom vyšetrení starnúceho muža. ďalšia skupina autorov zase zastáva názor, že priebežné kontroly hladiny TST sú vhodné a potrebné pre lepšiu objektivizáciu účinku dlhodobej substitučnej androgénnej liečby u mužov s TDS syndrómom. DRV a stanovenie PSA v sére sú povinné vyšetrenia pred začatím liečby TST, opakujú sa štvrročne počas prvého roku liečby, neskoršie raz za rok. Biopsia prostaty je indikovaná len pri pozitivite aspoň 1 z týchto 2 testov. Morales et al [51] odporúčajú sledova u mužov s TRT prípadnú dynamiku nárastu hodnôt sérovej koncentrácie PSA (tab. 11).
11. Sledovanie prostatickej žľazy a dolných močových ciest v priebehu androgénnej subtitučnej liečby u hypogonadálnych mužov [51]. ![Sledovanie prostatickej žľazy a dolných močových ciest v priebehu androgénnej subtitučnej liečby u hypogonadálnych mužov [51].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8188acd2fce26ea1c21790719e88d4f3.png)
BUDÚCE (MOŽNÉ) SPÔSOBY ART U HYPOGONADÁLNYCH MUŽOV
V súčasnosti je v klinickom skúšaní viacero liekových skupín (napr. selektívne modulátory androgénových/estrogénových receptorov, antiestrogény, iné androgény a hormóny a pod.), ktoré by mohli by efektívne u mužov so syndrómom TDS (tab. 12) [13,17]. Avšak zatiaľ nie je dostatok informácií na ich rutinne použitie v humánnej medicíne a preto zatiaľ chýbajú aj údaje o možných rizikách pre prostatickú žľazu.
ZÁVER
Androgénna nedostatočnos u starších mužov (TDS) je skutočná klinická entita, ktorá je dnes už efektívne liečená substitúciou v organizme chýbajúcich androgénov (tzv. ART - Androgen Replacement Therapy). ART je indikovaná u mužov s príznakmi hypogonadizmu, ktorý je biochemicky potvrdený. Správne indikovaná, aplikovaná a monitorovaná substitučná androgénna liečba má nesporný priaznivý účinok so signifikantným zvýšením kvality života starnúceho muža. Liečbu TDS je potrebné ešte viac „uši“ na konkrétneho, dobre informovaného pacienta, t. j. je nutný individualizovaný výber konkrétneho liečebného prípravku v spolupráci s pacientom! Liečiaci lekár by mal ma dostatočné vedomosti o výhodách a nevýhodách každého preparátu a liečený pacient by mal ma možnos aktívne spolupracova pri výbere lieku. Bežne dostupné prípravky testosterónu (T) sú (s výnimkou alkylovaných - v tomto prehľade neuvedených) bezpečné a účinné. Kontraindikácie ART sú dobre definované - karcinóm prostaty (KP) a karcinóm prsníka sú absolútnymi kontraindikáciami pre substitúciu androgénov. Závažná benígna obštrukcia na úrovni krčka močového mechúra spôsobená benígnou prostatickou hyperpláziou (BOO/ BPH - Bladder Outlet Obstruction/Benign Prostate Hyperplasia) je síce tiež kontraindikáciou pre použitie ART, ale androgénna substitúcia môže by začatá po liečbe BOO (pritom BOO/ BPH mierneho stupňa predstavuje len relatívnu kontraindikáciu ART). Výskyt KP v populácii starších mužov liečených dlhodobou TRT je nízky (1 %) a zodpovedá hodnotám výskytu KP v bežnej/skrínovanej) populácii. Zvýšenie rizika výskytu KP nebolo pozorované ani u mužov so zvýšeným rizikom rakoviny prostaty (HG-PIN). Doteraz nebol podaný žiadny vedecký dôkaz, že vyššia hladina endogénneho TST je rizikovým faktorom prnízkej hladiny sérového TST neznižuje riziko KP. Je potrebné si uvedomi, že TRT nie je opakom kastrácie. Vek (vysoký) muža s LOH nie je dôvodom pre neliečenie mužov so syndrómom TDS.
Starostlivos o starnúceho muža je v súčasnosti len v začiatkoch a stretáva sa s radom problémov a otázok. Samotní starší muži nie sú ešte celkom pripravení na takú medicínsku starostlivos aká je bežne venovaná napr. rovnako starým ženám. Multidisciplinárna spolupráca urológa s ďalšími odborníkmi a viac kvalitných, dlhodobých klinických štúdií na väčšom počte pacientov budú zárukou ešte lepšieho objasnenia tejto modernej a zaujímavej medicínsko - sociálnej problematiky.
doc. MUDr. Jozef Marenčák, Ph.D.
Urologické oddelenie NsP Skalica
Koreszkova 2, 909 02 Skalica
e-mail: marencak@ehs.sk
Sources
1. Morales A. The andropause: bare facts for urologists. BJU Int 2003; 91(4): 311-313.
2. Breza J, Novotný V, Bujdák P. Syndróm starnúceho muža. Sexuológia 2002; 2(1): 20-24.
3. Morales A, Heaton J, Carson C. Andropause: a misnomer for a true clinical entity. J Urol 2000; 163(4): 705-712.
4. Morales, A. , Schulman, C. , Tostain, J. et al. : Testosterone deficiency syndrome (TDS) needs to be named appropriately - the importance of accurate terminology. Eur. Urol. , 50, 2006; (2): 407-409.
5. Morales A, Lunenfeld B. Investigation, treatment and monitoring of late onset hypogonadism in males. Aging Male 2002; 5(5): 74.
6. Krause W. Die endokrine Basis von sexuellen Funktions - storungen im Alter. Urologe A 2000; 39(5): 411-413.
7. Ludwig G. PADAM aus urologischer Sicht. Urologe A 2000; 39(5): 407-410.
8. Morales A, Buvat J, Gooren L et al. Endocrine aspects of men sexual dysfunction. In: Lue T. Sexual Medicine - sexual dysfunctions in men and women. Paris: Health Publication 2005 : 345-382.
9. Harman S, Metter E, Tobin J et al. Baltimore longitudinal study of aging. Longitudinal effects of aging on serum total and free testosterone levels in healthy men. J Clin Endocrinol Metab 2001; 86(4): 724.
10. Feldman H, Longcope C, Derby C et al. Age trends in the levels of serum testosterone and other hormone in middle age men: longitudinal results of the Massachusetts Male Aging Study. J Clin Endocrinol Metab 2002; 87(4): 589.
11. Morley J, Kaiser F, Perry H et al. Longitudinal changes in testosterone, luteinizing hormone and follicle stimulating hormone in healthy older men. Metabolism 1997; 46(5): 410.
12. Marenčák J. Andropauza. Súčas Klin Prax 2006; 3(suppl 1): 4-14.
13. Schulman C. Androgen replacement therapy in men at risk for prostate disease. 6th International Consultation on new developments in prostate cancer and prostate disease, June 24-27 2005, Paris, France.
14. Nieschlag E, Behre H, Bouchard P et al. Testosterone replacement therapy: current trends and future. Hum Reprod Update 2004; 10(5): 409-419.
15. Marenčák J. Syndróm starnúceho muža. Lekár List 2002; 7(28): 5-6.
16. Marenčák J, Moro R, Maskalyk M. Diagnostika a liečba mužov v andropauze. Urológia 2003; 9(4): 20-26.
17. Schulman C, Horie S, Kaufman J et al. Androgen therapy in men at risk for prostate disease. In: Mc Connell J , Denis L, Akaza H et al. Prostate cancer. 21. ed. Paris: Health Publication 2006 : 348-362.
18. Behre H, Nieschlag E. Testosteronsubstitution beim alternden Mann. Urologe A 2000; 39(5): 421-424.
19. Behre H, Bohmeyer J, Nieschlag E. Prostate volume in testosterone - treated and untreated hypogonadal men in comparison to age - matched normal controls. Clin Endocrinol 1994; 40(3): 341-349.
20. Tenover J. Effects of testosterone supplementation in the aging male. J Clin Endocrin Metab 1992; 75(3): 1092-1098.
21. Sih R, Morley J, Kaiser F et al. Testosterone replacement in older hypogonadal men: a 12-months randomised controlled trial. J Clin Endocrin Metab 1997; 82(4): 1661-1667.
22. Bhasin S, Storer T, Berman N et al. The effects of supraphysiologic doses of testosterone on muscle size and strength in normal men. N Eng J Med 1996; 335(1): 1-7.
23. Huggins C, Stevens R, Hodges C et al. The effects of castration on advanced carcinoma of the prostate gland. Arch Surg 1941; 43(2): 209.
24. Tubaro A. Testosterone and prostate cancer. Eur Urol 2007; 51(2): 293-295.
25. Morales A. Testosterone and prostate health: debunking myths demandes evidence, caution, and good clinical judgement. Eur Urol 2006; 50(5): 895-897.
26. Gould D, Kirby R. Testosterone replacement therapy for late onset hypogonadism: what is the risk of inducing prostate cancer? Prostate cancer and prostatic diseases advance online publication, 1. November 2005. doi: 10.1038/sj.pcan.4500839
27. Gann P, Hennekens CH, Ma J et al. Prospective study of sex hormone levels and risk of prostate cancer. J Natl Cancer Inst 1996; 88(4): 1118-1126.
28. Chen L, Stacewicz - Sapuntzakis M, Duncan C et al. Oxidative DNA damage in prostate cancer patients consuming tomato sauce - based entrees as a whole - food intervention. J Natl. Cancer Inst 2001; 93(6): 1872-1879.
29. Clark L, Combs G, Turnbull B et al. Effects of selenium supplementation for cancer prevention in patients with carcinoma of the skin: a randomised controlled trial. JAMA 1996; 276(7): 1957-1963.
30. De Marzo A, Marchi V, Epstein J et al. Proliferative inflammatory atrophy of the prostate: implications for prostatic carcinogenesis. Am J Pathol 1999; 155(8): 1985-1992.
31. Jiang F, Wang Z. Identification of androgen - responsive genes in the rat ventral prostate by complementary deoxyribonucleic acid subtraction and microarray. Endocrinology 2003; 144(7): 1257-1265.
32. Henhgst L, Reed S. Translation control of p27 accumulation during the cell cycle. Science 1996; 271(8): 1861-1864.
33. Rhoden E, Morgentaler A. Risks of testosterone - replacement therapy and recommendations for monitoring. N Eng J Med 2004; 350(2): 482-492.
34. Hsing A. Hormones and prostate cancer: what´s next? Epidemiol Rev 2001; 23(1): 42-58.
35. Rhoden E, Morgentaler A. Testosterone replacement therapy in hypogonadal mena t high risk for prostate cancer: results of 1 year of treatmnet in men with prostatic intraepithelial neoplasia. J Urol 2003; 170(8): 2348-2351.
36. Shaneyfelt T, Husein R, Bubley G et al. Hormonal predictors of prostate cancer: a meta analysis. J Clin Oncol 2000; 18(5): 847-853.
37. Morgentaler A. Testosterone and prostate cancer: an historical perspective on a modern myth. Eur Urol 2006; 50(3): 935-939.
38. Tomera K, Gleason D, Gittelman M et al. The gonadotropin - releasing hormone antagonist Abarelix depot versus luteinizing hormone releasing hormone agonists leuprolide or goserelin: initial results of endocrinological and biochemical efficacies in patients with prostate cancer. J Urol 2001; 16(7): 1585-1589.
39. Freeland S, Partin A. Prostate - specific antigen: update 2006. Urology 2006; 67(2): 458-460.
40. Yano M, Imamoto T, Suzuki H et al. The clinical potential of pretreatment serum testosterone level to improve the efficiency of prostate cancer screening. Eur Urol 2007; 51(1): 375-380.
41. Morgentaler A, Brunning C, De Wolf W. Incidence of occult prostate cancer among men with low total or free serum testosterone. JAMA 1996; 276(8): 1904-1906.
42. Thompson I, Pauler D, Goodman P et al. Prevalence of prostate cancer among men with prostate-specific antigen level ? ng per milliliter. N Eng J Med 2004; 350(8): 2239-2246.
43. Ribeiro M, Ruff P, Falkson G. Low serum testosterone and a younger age predict for a poor outcome in metastatic prostate cancer. Am J Clin Oncol 1997; 20(8): 605-608.
44. Hoffman M, DeWolf W, Morgentaler A. Is low serum free testosterone a marker for high grade prostate cancer? J Urol 2000; 163(7): 824-827.
45. Teloken C, De Ros C, Caraver F et al. Low testosterone levels are associated with positive surgical margins in radical retropubic prostatectomy: hypogonadism represents bad prognosis in prostate cancer. J Urol 2005; 174(9): 2178-2180.
46. Nieschlag E, Gromoll J, Zitzmann M. Clinical relevance of androgen receptor pylomorphism. Eur Andr 2007; 1(suppl 1): 36.
47. Beharka R. Aging male, hormonal and genetic alterations. Eur Andr 2007; 1(suppl 1): 28.
48. Heráček J, Hampl R, Hill M et al. Tissue and serum levels of principal androgens in benign prostatic hyperplasia and prostate cancer. Eur Andr 2007; 1(suppl 1): 58.
49. Morales A. Endocrine aspects of men and women sexual dysfunctions including hormonal treatment. 2nd International Consultation on Erectile and Sexual Dysfunctions, June 28-July 1 2003, Paris, France.
50. Nieschlag E, Swerdloff R, Behre H et al. Investigation, treatment and monitoring of late - onset hypogonadism in males. Guidelines of European Association of Urology 2007. Arnhem 2007 : 1-4.
51. Morales A, Buvat J, Gooren L et al. Endocrine aspects of sexual dysfunction. J Sex Med 2004; 1(1): 69-81.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2007 Issue 3-
All articles in this issue
- Dihydrotestosterone and inhibitors of steroid 5α-REDUCTASE
- RESULTS OF EXAMINATION OF MICRODELETIONS IN THE AZF(YQ) REGION IN MEN WITH REPRODUCTIVE DISORDERS
- CLINICAL ANATOMY OF SULCUS NERVI DORSALIS PENIS/CLITORIDIS
- MALE CONTRACEPTION
- GENE THERAPY - NEW HOPE FOR THE TREATMENT OF ERECTILE DYSFUNCTION?
- AGING MALE, HORMONAL AND GENETIC ALTERATIONS
- Is testosterone supplementation a potential risk for the prostate gland of an ageing male?
- REHABILITATION OF ERECTILE DYSFUNCTION FOLLOWING RADICAL PROSTATECTOMY
- ERECTILE DYSFUNCTION FOLLOWING RADICAL PROSTATECTOMY
- CHANGES IN SPERMIOGRAM DEPENDING ON THE DEGREE OF VARICOCELE
- EFFECT OF ENDOCRINE DISRUPTORS ON MAMMALIAN FERTILITY
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- ERECTILE DYSFUNCTION FOLLOWING RADICAL PROSTATECTOMY
- Dihydrotestosterone and inhibitors of steroid 5α-REDUCTASE
- MALE CONTRACEPTION
- Is testosterone supplementation a potential risk for the prostate gland of an ageing male?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

