-
Medical journals
- Career
Nové poznatky v patofyziológii Ph-negatívnych myeloproliferatívnych neoplázií
Authors: B. Kráľová; K. Hlušičková Kapraľová; V. Divoký; M. Horváthová
Authors‘ workplace: Ústav biologie, LF UP v Olomouci
Published in: Transfuze Hematol. dnes,27, 2021, No. 3, p. 208-217.
Category: Review/Educational Papers
doi: https://doi.org/10.48095/cctahd2021208Overview
Myeloproliferatívne neoplázie (MPN) tvoria skupinu príbuzných klonálnych hematologických porúch s prekrývajúcim sa fenotypom. Hlavným znakom MPN je nadprodukcia plne diferencovaných myeloidných buniek, chronický zápal a riziko transformácie do sekundárnej akútnej myeloidnej leukémie. Klonálna proliferácia je riadená rôznymi somatickými mutáciami, najčastejšie mutáciami v géne kódujúcom Janusovu kinázu 2 (JAK2). Fenotypová diverzita, špecifická pre MPN, však nemôže prameniť len zo súčinnosti rôznych riadiacich mutácií s mutáciami prídavnými, ktoré sú popisované u pacientov s MPN. Naopak, za heterogenitou MPN stojí celý rad genetických ako aj negenetických faktorov. Ako významný determinant, predovšetkým rozvoja klonálnej hematopoézy, sa ukazuje genetická predispozícia. Náš súhrnný článok prináša prehľad najnovších poznatkov týkajúcich sa komplexnosti patobiológie chromozóm Filadelfia (Ph) -negatívnych MPN.
Klíčová slova:
myeloproliferatívne neoplázie – JAK2 – CALR – MPL – genetická predipozícia – heterogenita MPN
ÚVOD
Myeloproliferatívne neoplázie (MPN), popísané už v roku 1951 Dameshekom, sú fenotypovo rôznorodou skupinou klonálnych chorôb, ktorá je charakterizovaná zvýšenou proliferáciou aspoň jedného z myeloidných vývojových radov (erytrocytového, granulocytového alebo megakaryocytového) v kostnej dreni. Nadmerne produkované plne diferencované bunky si zachovávajú svoju typickú funkciu a nevykazujú známky rozsiahlej dysplázie [1]. Avšak najväčším rizikom MPN je, že postupom času môže dôjsť k poruche terminálnej diferenciácie a maturácie progenitorov, kedy pretrvávajúci chronický zápal, remodelácia mikroprostredia kostnej drene a postupná akumulácia genetických a epigenetických zmien vedú k blastickému zvratu a transformácii inak chronického ochorenia do sekundárnej akútnej myleoidnej leukémie (sAML). Hlavným genetickým faktorom tejto leukemickej transformácie sú prídavné mutácie vznikajúce spontánne alebo ako dôsledok mutagénnej liečby [2]. MPN ochorenia vznikajú na podklade mutácií v hematopoetickej kmeňovej bunke (hematopoietic stem cell – HSC) a podľa klinických, histopatologických a molekulárnych charakteristík sa rozdeľujú do 7 rozdielnych entít: chronická myeloidná leukémia (CML), chronická neutrofilná leukémia (CNL), polycytémia vera (PV, pravá polycytémia), primárna myelofibróza (PMF), esenciálna trombocytémia (ET), chronická eosinofilná leukémia (bližšie nešpecifikovaná) a neklasifikovateľné MPN [3].
Dameshekova koncepcia pôvodu MPN je postavená na neznámom myelostimulačnom faktore, ktorý je zodpovedný za vznik týchto ochorení. Odvtedy sa vďaka pokrokom v technológiách molekulárnej biológie do veľkej miery objasnila molekulárna podstata MPN a vytvorila sa komplexná knižnica kauzálnych alebo tzv. „driver“ (riadiacich) mutácií vedúcich k MPN. Väčšina MPN sa javí ako sporadická a býva obvykle diagnostikovaná v piatej až šiestej dekáde života. Avšak pribúdajúce štúdie ukazujú, že existuje skupina MPN pacientov, u ktorých nástup ochorenia nastáva v podstatne mladšom veku a že rôzne hematologické malignity sa môžu častejšie vyskytovať v rámci rodokmeňa jednej rodiny [4,5]. Zdá sa, že toto klastrovanie MPN v rámci rodín nie je náhodné; až 7,6 % zdanlivo sporadických MPN má naopak familiárne pozadie [6]. Diskutovaným javom je aj fenomén tzv. anticipácie, ktorý popisuje stav, kedy sa v každej nasledujúcej generácii ochorenie objavuje v skoršom veku ako v generácii predchádzajúcej [6,7]. Táto kohorta pacientov môže niesť jednu alebo niekoľko dedičných kooperujúcich mutácií s neúplnou penetranciou, čím je podporovaná existencia predispozičného faktora prispievajúceho nielen k prepuknutiu MPN ale aj jeho modulačného efektu na celkový fenotyp ochorenia.
Medzi klasické MPN patrí CML. Jej typickým cytogenetickým nálezom je chromozóm Filadelfia (Ph) vznikajúci recipročnou translokáciou t (9; 22) [8]. Dôsledkom tejto výmeny vzniká fúzny onkogén BCR-ABL1 kódujúci konštitutívne aktívnu tyrozínovú kinázu aktivujúcu spletité signálne dráhy, ktoré zvyšujú proliferačný potenciál mutovaných buniek a zároveň znižujú ich adhezívnu schopnosť a apoptickú odpoveď [9]. Zvýšená produkcia kyslíkových radikálov BCR-ABL1-pozitívnymi bunkami vedie k nestabilite genómu a leukemogenéze [10].
Do klasických, avšak Ph-negatívnych MPN (BCR-ABL1 negatívne MPN), sa zaraďujú PV, ET a PMF. U väčšiny prípadov sú identifikované „driver“ mutácie v génoch kódujúcich Janusovu kinázu 2 (JAK2) [11–14], kalretikulín (CALR) [15,16] alebo trombopoetínový receptor (TPOR, označovaný aj ako MPL z angl. myeloproliferative leukemia virus) [17,18]; mutácie CALR a MPL sa vyskytujú u ET a PMF a len výnimočne u PV. Napriek niektorým spoločným klinickým, patologickým a molekulárnym charakteristikám sa PV, ET a PMF vyznačujú veľkou variabilitou s ohľadom na možné riziká trombotických a krvácavých komplikácií ako aj na riziko progresie do leukémie. Heterogenitu MPN podľa všetkého ovplyvňuje celý rad faktorov zahŕňajúci: prídavné somatické mutácie (vrátane poradia v akom boli získané), genetickú predispozíciu, charakteristiky samotného pacienta a zmeny v mikroprostredí kostnej drene [19].
SOMATICKÉ „driver“ MUTÁCIE u Ph-NEGATÍVNYCH MPN
Somatické „driver“ mutácie v JAK2, [11–14], CALR [15,16] a MPL [17,18] vznikajú v HSC a vedú k neadekvátnej aktivácii JAK2/STAT (signal transducer and activator of transcription) signálnej dráhy (obr. 1), čo poskytuje bunkám myeloidnej línie selektívnu proliferačnú výhodu. Iniciačná mutácia v JAK2 géne, ktorá je najčastejšou „driver“ mutáciou u Ph-negatívnych MPN, pritom vzniká podľa novo publikovaných poznatkov veľmi skoro, v detskom alebo adolescentnom veku alebo dokonca prenatálne („pre-diagnostická“ fáza ochorenia) a môže trvať desiatky rokov, než dôjde k rozvoju signifikantnej klonálnej frakcie a nástupu „diagnostickej“ fázy MPN [20,21].
Image 1. Všeobecný mechanizmus JAK2 signálnej dráhy za fyziologických podmienok (A): po väzbe cytokínu k receptoru dochádza k jeho dimerizácii, následnej trans- a autofosforylácii JAK2 kinázy, ktorá ďalej fosforyluje tyrozínové zvyšky receptora. Tie poskytujú väzbové miesta pre STAT signálne molekuly, ktoré dimerizujú a vo fosforylovanej forme sa presúvajú do jadra, kde pôsobia ako transkripčné faktory génov zabezpečujúcich proliferáciu a prežívanie buniek. Patofyziologická JAK2 signalizácia v prípade JAK2 mutácií (B) a mutácií MPL receptora (C) vedie ku konformačným zmenám JAK2 alebo MPL receptora, následnej konštitutívnej aktivácii JAK2/STAT signálnej dráhy a nadmernej produkcii rôznych krvných elementov. Naopak, sekretovaný mutovaný CALR (mCALR) sa ako „falošný“ cytokín viaže na MPL (D), aktivuje ho, čo u buniek exprimujúcich MPL a súčasne mCALR vedie k trvalej aktivácii JAK2/STAT5 signalizácie. 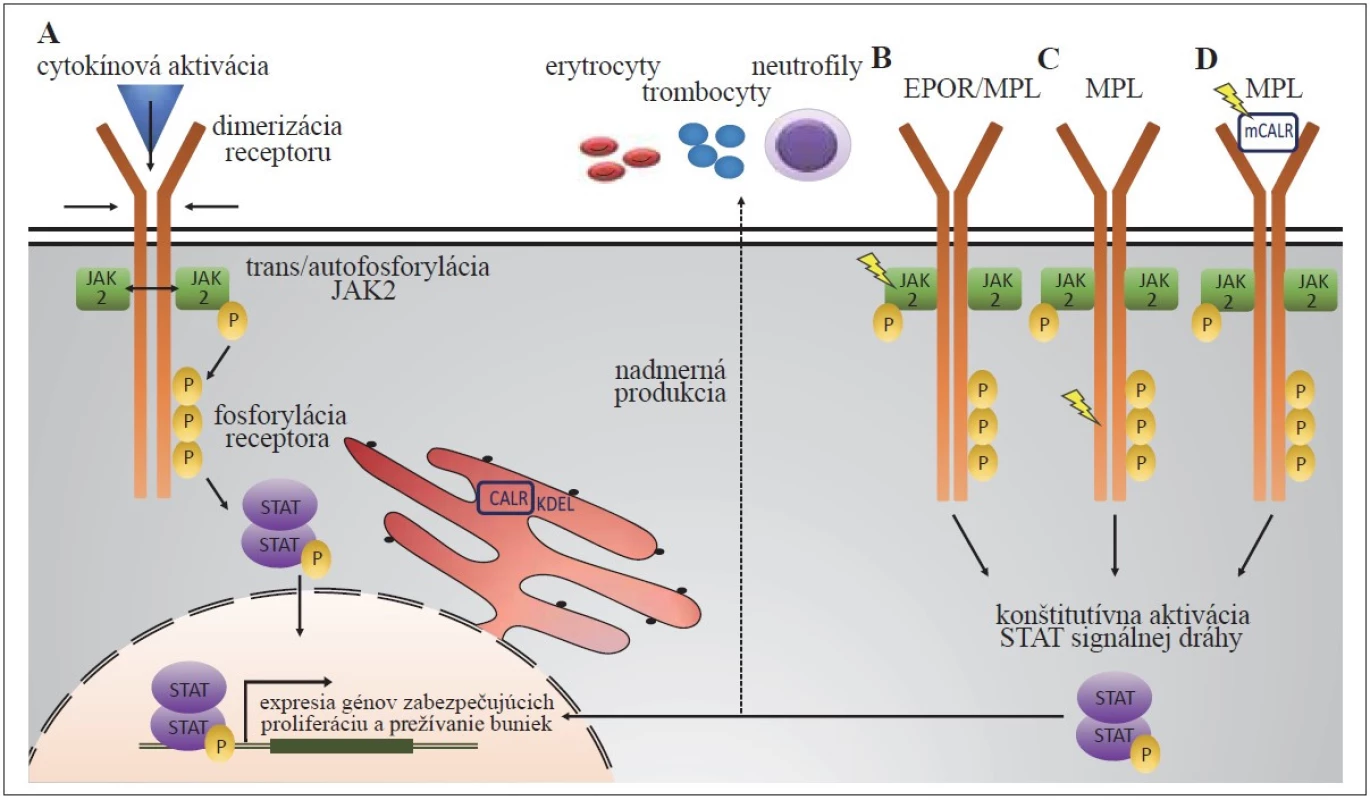
P – fosforylácia, symbol blesku – mutácia JAK2 V617F a JAK2 exón 12 mutácie
JAK2 je súčasťou rodiny nereceptorových tyrozínových kináz. Väzbou ligandu na cytokínové receptory: erytropoetínový receptor (EPOR), MPL a receptor pre kolónie granulocytov stimulujúci faktor (G-CSFR) sa prostredníctvom fosforylácie JAK2 aktivuje signálna dráha odovzdávajúca signál prevažne cez transkripčné faktory rodiny STAT (predovšetkým STAT1, 3 a 5), ktoré v jadre spúšťajú expresiu rôznych génov ovplyvňujúcich diferenciáciu, proliferáciu a prežívanie hematopoetických buniek [22] (obr. 1). Bodová mutácia v exóne 14 JAK2 génu vedúca k aminokyselinovej zámene V617F spôsobuje konštitutívnu aktiváciu JAK2 kinázy aj v neprítomnosti cytokínov a tým stimuluje klonálnu expanziu buniek [11–14]. JAK2 V617F mutácia je prítomná u 95 % pacientov s PV a u približne 50–60 % pacientov s ET a PMF. Klinická a fenotypová heterogenita pacientov nesúcich JAK2 V617F mutáciu, v rozmedzí od často asymptomatickej ET, cez chronickú myeloproliferáciu až po agresívnejšiu formu PMF so zlou prognózou, je veľmi pozoruhodný a doposiaľ nie celkom ozrejmený aspekt. Svoju úlohu hrá čiastočne podiel mutovanej JAK2 V617F k celkovej JAK2, označovaný aj ako alelová záťaž (allele burden) [23]. Nižšia V617F alelvá záťaž (zvyčajne okolo 25 %) je typická pre ET, vyššia (≥ 50 %) pre PV. Úplná V617F homozygozita (alelová záťaž 100 %), ktorá vzniká mitotickou rekombináciou a vedie tak k získanej uniparentálnej dizómii (aUPD) chromozómu 9, je spájaná s PV, post-PV a post-ET myelofibrózou. Prítomnosť nízkej frekvencie JAK2 V617F mutácie (≤ 2 %) u zdravých jedincov bez preukázaných hematologických abnormalít (s tzv. klonálnou hematopoézou s neurčitým potenciálom, clonal hematopoiesis of indeterminate potential – CHIP), s incidenciou až 0,2 %, je ďalším ukazovateľom komplexnej patofyziológie MPN [24].
U 1–2 % PV pacientov, väčšinou JAK2 V617F negatívnych, sa vyskytujú mutácie v exóne 12 JAK2 génu [25]. Doteraz bolo v exóne 12 identifikovaných vyše 40 rôznych mutácií, zahŕňajúcich delécie, inzercie, duplikácie a zámeny, ktoré spôsobujú zvýšenú aktiváciu JAK2/STAT signálnej dráhy. Tieto mutácie sú výlučne asociované s izolovanou erytrocytózou. Ukazuje sa však, že riziko vzniku trombózy ako aj transformácie do PMF alebo sAML je u tejto podskupiny PV porovnateľné s PV pacientmi s mutáciou JAK2 V617F [25].
CALR mutácie
Kalretikulín je chaperónový proteín, ktorý reguluje homeostázu vápnika a zbaľovanie novosyntetizovaných proteínov [26]. Mutácie v CALR géne sa vyskytujú približne v 30 % prípadov ET a PMF a výnimočne u pacientov s PV. Dôsledkom mutácií dochádza k strate KDEL motívu zodpovedného za organelovo-špecifickú lokalizáciu kalretikulínu v endoplazmatickom retikule. Mutovaný kalretikulín (mCALR) sa naopak viaže na MPL, aktivuje ho a následne tak sprostredkováva nadmernú aktiváciu JAK2/STAT signálnej dráhy (obr. 1). Mutovaný kalretikulín vykazuje slabú väzbu s G-CSFR, ale neviaže sa na EPOR, čo má za následok špecifickú asociáciu CALR mutácií s ET a PMF, ale nie s PV. CALR mutácie sa rozdeľujú do dvoch typov. Nadmernú väčšinu tvoria mutácie typu 1 (delécia 52 bázových párov) prevládajúce u pacientov s diagnostikovanou PMF, naopak mutácie typu 2 (inzercia 5 bázových párov) sa vo veľkej miere vyskytujú u pacientov s ET [15,16]. Mutácie typu 1 majú agresívnejší ráz vzhľadom na robustnejší zásah do DNA; ET pacienti s týmito mutáciami častejšie progredujú do myelofibrózy na rozdiel od ET pacientov s mutáciami typu 2, ktoré sú spájané s miernejším priebehom ochorenia [27].
MPL mutácie
Najmenej frekventovanými „driver“ mutáciami u klasických Ph-negatívnych MPN sú aktivujúce mutácie v géne kódujúcom MPL [17,18]. MPL viaže na povrchu buniek trombopoetín a zohráva tak kľúčovú úlohu v procese megakaryopoézy a tvorbe krvných doštičiek [28,29]. MPL mutácie vedú ku konformačným zmenám receptora, ktoré vyústia do jeho aktivácie a následnej konštitutívnej aktivácie JAK2/STAT signálnej dráhy a k cytokínom-nezávislému rastu buniek (obr. 1) [17,18]. Najčastejšími mutáciami sú zámeny tryptofánu v pozícii 515 (MPL W515), ktoré sa vyskytujú výhradne u ET a PMF s prevalenciou 1, resp. 5 % [18] a sú spájané so zvýšeným rizikom myelofibrotickej transformácie u ET [30]. Iná mutácia postihujúca MPL, MPL S505N, bola popísaná ako vrodená mutácia asociovaná s familiárnou trombocytózou a následne aj ako získaná mutácia vo vzácnych prípadoch ET [31,32].
„Triple“ negatívne a biklonálne MPN
Asi 10 % pacientov s MPN, predovšetkým s ET a PMF, je negatívnych na prítomnosť vyššie uvedených „driver“ mutácií v JAK2, CALR a MPL. Tieto prípady označujeme ako tzv. „triple“ negatívne MPN [2]. Zatiaľ čo „triple“ negatívna ET je skôr benígnym ochorením, „triple“ negatívna PMF má veľmi agresívny klinický priebeh a zlú prognózu s viac ako 30 % pravdepodobnosťou leukemickej transformácie. V malej časti „triple“ negatívnych MPN boli popísané nekanonické mutácie v JAK2 (napr. V625F, F556V), MPL (napr. S204P, Y591N) alebo v géne SH2B3 (napr. E208Q, D231fs), ktorý kóduje negatívny regulátor aktivácie JAK2. Často sa však jedná o vrodené varianty a nie o varianty získané [33–35].
Vo väčšine prípadov MPN s identifikovanými „driver“ mutáciami v JAK2, CALR alebo MPL sa ich koexistencia u jednotlivca vylučuje. Existujú však aj pacienti, u ktorých bol popísaný súčasný výskyt mutácií JAK2 V617F/JAK2 exón 12 [36], JAK2/CALR [37], JAK2/MPL [36,37] a ojedinele i CALR/MPL [38]. Jedná sa o biklonálne MPN, vyznačujúce sa prítomnosťou dvoch „driver“ mutácií v dvoch nezávislých klonoch [39]. Toto zistenie spoločne s popisovanými rozdielmi v klinických prejavoch u jednotlivých členov rodín s familiárnym výskytom MPN, ktorí často nesú aj rôzne „driver“ mutácie, poukazuje na úlohu dedičného faktora u MPN. Tento faktor sám o sebe nevedie k vzniku MPN, ale predisponuje k zisku somatických MPN mutácií a/alebo mení vývoj a finálny fenotyp MPN [34].
Postupne sa tak odhaľuje komplexné pozadie MPN biológie, kedy genetická predispozícia v súčinnosti s ďalšími genetickými a negenetickými faktormi ovplyvňuje riziko vzniku a fenotyp MPN.
GENETICKÉ FAKTORY OVPLYVŇUJÚCE HETEROGENITU Ph-NEGATÍVNYCH MPN
Somatické mutácie kooperujúce s „driver” mutáciami
Okrem „driver“ mutácií sa u MPN pacientov popisuje aj výskyt prídavných somatických mutácií, ktoré nie sú špecifické pre MPN, ale objavujú sa aj u iných hematologických malignít (ako napr. myelodysplastický syndróm – MDS a AML). Jedná sa o získané mutácie génov kódujúcich epigenetické modifikátory, faktory dôležité pre zostrih mRNA, niektoré transkripčné faktory alebo signálne molekuly [40,41]. Súčasný výskyt rôznych prídavných mutácií u jedného pacienta je možný, pričom platí, že zvyšujúci sa počet prídavných mutácií negatívne ovplyvňuje prežívanie a zvyšuje riziko leukemickej transformácie [42]. Príklad panelu génov vyšetrovaných u MPN pacientov pomocou sekvenovania novej generácie (next generation sequencing – NGS) je uvedený v tab. 1.
Table 1. NGS (next generation sequencing) myeloidný panel. Prehľad génov, rozdelených podľa ich funkcie, ktoré sú indikované k vyšetreniu u pacientov s MPN.
(zdroj: https://www.illumina.com/products/by-type/clinical-research-products/trusight-myeloid.html#gene-list)
Jednými z najčastejších mutácií, vyskytujúcich sa u všetkých subtypov MPN, sú mutácie génov kódujúcich epigenetické modifikátory DNA: Tet metylcytozín dioxygenázu 2 (TET2) [43] a DNA (cytozín-5) -metyltransferázu 3A (DNMT3A) [44]. Tieto mutácie zvyšujú potenciál sebaobnovy HSCs. Ich prognostický význam u MPN nie je celkom objasnený. Ukázalo sa však, že poradie ich získania s ohľadom na zisk „driver“ mutácie JAK2 V617F, ovplyvňuje fenotyp MPN. Ak JAK2 V617F mutácia vzniká ako prvá, s väčšou pravdepodobnosťou dôjde k rozvoju PV ako ET. Naopak, ak mutácie v TET2 a DNMT3 predchádzajú vzniku JAK2 V617F mutácie, pravdepodobnejší je fenotyp ET [45, 46]. Prídavné mutácie ďalších epigenetických regulátorov remodelujúcich chromatín ako ASXL1 (additional sex comb-like 1) a EZH2 (enhancer of zeste homolog 2) sú častejšie u PMF a bývajú asociované s horšou prognózou a zvýšeným rizikom transformácie do sAML [41].
Prídavné mutácie faktorov kontrolujúcich zostrih mRNA (napr. SF3B1, SRSF2 a U2AF1) sa vyskytujú u PMF a ET, zriedkavo u PV. Ich úloha v patogenéze MPN nie je zrejmá, ale pravdepodobne súvisí s narušením normálneho zostrihu mRNA celého spektra génov. Mutácie SF3B1 zvyšujú riziko progresie ET do myelofibrózy [47]; mutácie SRSF2 sú u pacientov s PMF asociované so zníženým prežívaním a zvýšeným rizikom transformácie do sAML [48].
Mutácie transkripčných faktorov ako napr. tumorového proteínu 53 (TP53) [40], (runt-related transcription factor 1) [49] alebo NF-E2 (nuclear factor erythroid–2) [50] sú vo väčšine prípadov asociované s leukemickou transformáciou MPN. Kým mutácie TP53 narúšajú jeho fyziologickú úlohu v indukcii opravy poškodenej DNA a apoptózy, mutácie NF-E2, ktorý reguluje diferenciáciu a maturáciu buniek erytroidnej a megakaryocytárnej línie, poskytujú bunkám ďalšiu proliferačnú výhodu. Rovnako tak somatické mutácie v génoch kódujúcich ďalšie signálne molekuly (napr. NRAS) sú typické pre MPN progredujúce do leukémie [51].
Genetická predispozícia
Je dlhodobo známe, že riziko vývoja MPN sa u prvostupňových príbuzných pacienta s MPN zvyšuje 5–7× [5], čo indikuje prítomnosť vrodeného genetického faktora podieľajúceho sa na rozvoji ochorenia. Predpokladá sa pritom, že vrodená predispozícia zohráva svoju úlohu pred ale aj po získaní somatických „driver“ mutácií.
Prvým predispozičným faktorom identifikovaným u MPN bol haplotyp JAK2 46/1 [52]. Haplotyp JAK2 46/1 sa rozkladá na chromozóme 9, zahŕňa sadu génov spoločne s JAK2 génom a obsahuje niekoľko polymorfizmov vo väzbovej nerovnováhe. Minimálne jednu rizikovú alelu tohto haplotypu nesie 56 % MPN pacientov [53]. Ďalšie identifikované predispozičné polymorfizmy, ktoré zvyšujú riziko MPN boli popísané v génoch zapojených napr. do bunkového starnutia (TERT), epigenetickej regulácie (TET2), kontroly bunkového cyklu a opravy DNA (CHEK2, ATM), JAK2/STAT signálnej transdukcie (SH2B3) a regulácie transkripcie (GFI1B, PINT, MECOM a HBS1L-MYB) [54–56]. V niektorých z týchto génov sú pritom popisované aj prídavné somatické mutácie, čo podtrhuje ich biologický význam v regulácii hematopoézy a patogenéze MPN. Presné biologické mechanizmy, ktoré spojujú vyššie zmienené vrodené polymorfizmy s vývojom MPN sú predmetom intenzívneho výskumu.
Najnovšie štúdie ukazujú, že genetická predispozícia u MPN má polygénny charakter [57,58]. Rozsiahla celogenómová asociačná štúdia (genome-wide association study – GWAS) odhalila celkom 17 nezávislých rizikových lokusov, s mnohými rizikovými variantami identifikovanými v kódujúcich, nekódujúcich alebo regulačných oblastiach génov [57]. Niektoré rizikové varianty pritom priamo ovplyvňujú biologické vlastnosti HSCs súvisiace s dĺžkou telomér (v TERT), odpoveďou na poškodenú DNA (v ATM, CHEK2) a s potenciálom sebaobnovy (v GFI1B). Ďalej bolo ukázané, že v dôsledku mitotickej rekombinácie a straty heterozygozity sa rizikové varianty dostávajú do homozygotného stavu, ktorý môže znamenať proliferačnú výhodu a podporovať tak následnú klonálnu selekciu [58]. Viac ako 50 vzácnych vrodených variant lokalizovaných v 7 rôznych lokusoch (MPL, ATM, TM2D3, FH, NBN, MRE11 a SH2B3) vykazuje asociáciu so zvýšenou náchylnosťou ku klonálnej hematopoéze [58].
Zárodočné mutácie v JAK2 géne
Vďaka celogenómovému sekvenovaniu boli v JAK2 géne odhalené vzácne zárodočné varianty, ktoré sa vyskytujú samostatne alebo spoločne s JAK2 V617F mutáciou u pacientov s PV, myelofibrózou alebo neutrofíliou [59–61]. Ukazuje sa, že tieto varianty kooperujú s JAK2 V617F mutáciou, amplifikujú kinázovú aktivitu mutovaného JAK2 enzýmu, čo môže taktiež prispievať k fenotypovej heterogenite. Nedávna štúdia kohorty asi 2 000 MPN a AML pacientov z MD Anderson Cancer Center odhalila prítomnosť 35 rôznych variant JAK2 distribuovaných v rámci celého génu; u väčšiny z nich bol potvrdený dedičný pôvod [62]. Výskyt týchto variant bol pritom častejší u pacientov s MPN a AML než v zdravej populácii. Najčastejšími zámenami boli L393V, R1063H a N1108S. Autori zároveň ukázali, že prítomnosť dodatočných variant v JAK2 géne u JAK2 V617F pozitívnych pacientov výrazne zvyšuje kumulatívne riziko progresie do sAML v porovnaní so skupinou JAK2 V617F pozitívnych pacientov bez týchto variant.
Zaujímavosťou je, že niektoré z identifikovaných variant boli už predtým popísané samostatne alebo v kooperácii s inou JAK2 mutáciou vo vzácnych prípadoch hereditárnej trombocytózy (napr. S593C [63], S755R/R938Q [63] a L815P/V1123G [64]) alebo erytrocytózy (E846D/R1063H [65]). Funkčná štúdia E846D a R1063H JAK2 mutácií ukázala, že každá mutácia samostatne má mierny dopad na aktiváciu JAK2/STAT signalizácie a k rozvoju patologického fenotypu dochádza až pri ich vzájomnej kooperácii [65]. Rozdielny klinický fenotyp (erytroidná hyperplázia vs. trombocytóza) pravdepodobne pramení z kvalitatívnych rozdielov v následnej JAK2/STAT signalizácii, napr. z odlišnej miery aktivácie jednotlivých molekúl STAT (STAT5 vs. STAT1) alebo z prípadnej aktivácie alternatívnych signálnych dráh.
ĎALŠIE FAKTORY OVPLYVŇUJÚCE HETEROGENITU Ph-NEGATÍVNYCH MPN
Charakteristiky pacienta
Fenotyp MPN a jeho prognóza sú ovplyvnené aj vekom, pohlavím a komorbiditou pacienta. Výskyt MPN sa všeobecne zvyšuje s vekom, pričom medián veku nástupu PV je 65 rokov, 68 rokov u ET a 70 rokov u PMF [66]. So zvyšujúcim sa vekom zároveň stúpa riziko trombotických komplikácií a progresie ochorenia. To pravdepodobne súvisí s celkovým vplyvom starnutia a hromadenia voľných radikálov (teória oxidačného stresu a starnutia) na akumuláciu somatických mutácií a rozvoj klonálnej hematopoézy [67,68]. Nie je prekvapením, že bola popísaná významná asociácia medzi fajčením a rozvojom MPN [69]. V priebehu starnutia dochádza vplyvom chronického zápalu a prepínania metabolizmu krvotvorných kmeňových buniek z glykolýzy na oxidatívnu fosforyláciu, ako aj vplyvom myeloidného posunu krvotvorby k rozvoju klonálnych pre-leukemických stavov označovaných ako CHIP [70–72]. CHIP je kľúčový rizikový faktor vedúci k získaniu JAK2 V617F somatickej mutácie (obr. 2A) alebo zrýchlenej (sub) klonálnej expanzie preexistujúceho minoritného klonu u MPN (obr. 2B) a/alebo prípadnej transformácie do sAML.
Image 2. Dynamický proces vývoja MPN. Doposiaľ prezentovaný, klasický model, model (A), ktorý popisuje, že penetrancia MPN závisí od veku jedinca, typu mutácií a komplexných interakcií dedičného faktora, mikroprostredia kostnej drene a environmentálneho prostredia, ktoré sa spoločne podieľajú na konverzii polyklonálnej hematopoézy na monoklonálnu, s možným medzistupňom v podobe CHIP. Nadmerná klonálna expanzia so sebou prináša riziko vzniku ďalších mutácií (napr. v génoch špecifi ckých pre AML – NRAS, FLT3, TP53, RUNX1, NF-E2 a i. [49]) a transformácie do sAML. Nový model (B) založený na retrospektívnej analýze buniek krvotvorných línií dospelých pacientov až po embryogenézu [20,21]. Model ukazuje, že získanie „driver“ JAK2 V617F (príp. DNMT3A) mutácie sa dá vystopovať až do prenatálneho obdobia. Následne dochádza k veľmi pomalej expanzii mutovaného klonu a trvá desiatky rokov, než klonálna frakcia dosiahne 1 %. Rýchlosť klonálnej expanzie a akvizície ďalších mutácií rozhoduje o klinickej manifestácii ochorenia. ![Dynamický proces vývoja MPN. Doposiaľ prezentovaný, klasický model, model (A), ktorý popisuje, že penetrancia
MPN závisí od veku jedinca, typu mutácií a komplexných interakcií dedičného faktora, mikroprostredia kostnej drene
a environmentálneho prostredia, ktoré sa spoločne podieľajú na konverzii polyklonálnej hematopoézy na monoklonálnu,
s možným medzistupňom v podobe CHIP. Nadmerná klonálna expanzia so sebou prináša riziko vzniku ďalších mutácií (napr.
v génoch špecifi ckých pre AML – NRAS, FLT3, TP53, RUNX1, NF-E2 a i. [49]) a transformácie do sAML. Nový model (B) založený
na retrospektívnej analýze buniek krvotvorných línií dospelých pacientov až po embryogenézu [20,21]. Model ukazuje, že
získanie „driver“ JAK2 V617F (príp. DNMT3A) mutácie sa dá vystopovať až do prenatálneho obdobia. Následne dochádza
k veľmi pomalej expanzii mutovaného klonu a trvá desiatky rokov, než klonálna frakcia dosiahne 1 %. Rýchlosť klonálnej
expanzie a akvizície ďalších mutácií rozhoduje o klinickej manifestácii ochorenia.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/2641d96b8de3eaa535504ac9bb841b99.jpeg)
Pohlavie sa taktiež ukazuje ako významný činiteľ fenotypu a progresie MPN. U žien sa častejšie vyskytuje ET, kým PV a PMF prevládajú u mužského pohlavia. Priebeh ochorenia býva miernejší u žien ako u mužov; navyše ženy majú všeobecne lepšiu prognózu ako muži, u ktorých je pozorované aj vyššie riziko myelofibrotickej transformácie [73]. Ďalšou zložkou prispievajúcou k heterogenite MPN je aj úroveň zásob železa v organizme. Keďže železo je nevyhnutné pre erytropoézu a tvorbu hemoglobínu, jeho počiatočný deficit je spájaný skôr s rozvojom ET ako PV [41].
Heterogenita HSC
V posledných rokoch sa ukazuje, že populácia HSCs nie je homogénnou skupinou buniek, ale obsahuje frakcie HSCs s rozdielnym líniovým potenciálom (tzv. „lineaged biased“ HSCs), ktoré už sú čiastočne líniovo zamerané. Fenotypová špecifikácia MPN môže preto závisieť aj od toho, v akom líniovo preddeterminovanom type HSC JAK2 V617F mutácia nastane [19]. U PV pacientov vzniká JAK2 V617F mutácia pravdepodobne v HSC umiestnenej na vrchole hematopoetickej hierarchie (s väčším multipotentným potenciálom), keďže jej prítomnosť bola zachytená aj v lymfoidnej línii. Tiež sa predpokladá, že stredne vysoká biochemická aktivita JAK2 V617F potláča MPL signalizáciu, a preto je skôr asociovaná s PV fenotypom; pri nízkej aktivite JAK2 V617F zostávajú aktívne signály z TPOR/MPL receptorov, ktoré vedú k rozvoju ET [74].
Mikroprostredie kostnej drene a zápalové cytokíny
Mikroprostredie kostnej drene zohráva kľúčovú úlohu v regulácii hematopoézy a jeho narušenie sa podieľa na rozvoji mnohých hematologických malignít. Ukazuje sa, že aj u MPN, rôzne nehematopoetické bunky kostnej drene, ako napr. endoteliálne bunky alebo mesenchymálne stromálne bunky, kooperujú s mutovanými MPN klonmi a spoločne vytvárajú niku podporujúcu propagáciu a progresiu MPN [19]. Nie je však úplne jasné, nakoľko je aberantné mikroprostredie kostnej drene priamo zodpovedné za heterogenitu MPN alebo je len jej odzrkadlením.
Janusove kinázy sú kritickými mediátormi cytokínovej a chemokínovej signalizácie a signalizácie rastovými faktormi [75]. Dysregulácia JAK2/STAT signalizácie u MPN podporuje tvorbu mikroprostredia v kostnej dreni, ktoré sa vyznačuje aberantnou syntézou zápalových cytokínov a chemokínov (napr. interferónu g – IFN - g, tumor nekrotizujúceho faktora a – TNF-a, transformujúceho rastového faktora b – TGF-b alebo interleukínu 1b – IL-1b) [76–78]. Tieto následne spúšťajú systémovú a chronickú zápalovú odpoveď spojenú so zvýšenou koncentráciou zápalových markerov v cirkulácii. Myšie modely ukázali, že zápalové cytokíny prispievajú k takej remodelácii mikroprostredia kostnej drene, ktorá potláča normálnu hematopoézu a podporuje transformáciu do myelofibrózy a leukémie. Napriek výraznému chronickému zápalu je však kumulatívny výskyt blastickej transformácie u PV a ET (v porovnaní s transformáciou CML) relatívne nízky. Nedávna štúdia ukázala, že JAK2 V617F-mutantné bunky si v zápalovom prostredí indukujú ochranný program, sprostredkovaný fosfatázou DUSP1 (dual specificity phosphatase 1), ktorý udržuje ich proliferačnú schopnosť a zároveň ich chráni pred akumuláciou poškodenia DNA a myelofibrotickou a leukemickou transformáciou [79].
ZÁVER
Rozvoj MPN a ich prípadná progresia do sAML je dlhotrvajúci a niekoľkostupňový proces asociovaný s klonálnou selekciou mutovaných HSCs (obr. 2). Molekulárna diagnostika a biológia spolu s rozsiahlymi epidemiologickými štúdiami významným spôsobom rozšírili naše poznatky o patogenéze MPN. Ukazuje sa, že genetické pozadie jedinca vytvára základ pre familiárnu predispozíciu k rozvoju MPN. Vrodené rizikové alely môžu modulovať biologické vlastnosti HSCs a tým im poskytovať selekčnú výhodu. Na podklade mitotickej rekombinácie a homozygotizácie rizikových alel a v súčinnosti so získanými somatickými mutáciami môže postupne dochádzať k rozvoju CHIP. So zvyšujúcim sa vekom a získaním somatickej „driver“ mutácie sa následne naplno rozvíja klonálna hematopoéza, ktorá sa môže manifestovať vo forme chronickej myeloproliferácie a v tomto stave pretrvávať aj roky (obr. 2A). Podľa nového, alternatívneho modelu vzniku MPN dochádza k získaniu somatickej „driver“ mutácie veľmi skoro (dokonca pred narodením), ale k signifikantnej klonálnej expanzii dôjde až po desiatkach rokov v súvislosti so zmienenými rizikovými faktormi spojenými so starnutím krvotvorby (obr. 2B). K transformácii do sAML dochádza v dôsledku akumulácie ďalších mutácií, ktoré zvyšujú onkogénny potenciál klonu. Paralelne môže vznikať aj niekoľko rôznych klonov, nesúcich odlišné somatické mutácie. Tieto klony môžu mať aj odlišné fenotypové charakteristiky a vykazovať rôznu citlivosť na liečbu a schopnosť vyvolať relaps ochorenia.
Faktory, ktoré vedú k rozvoju MPN aj tie, ktoré prispievajú k ich výraznej fenotypovej variabilite sú heterogénne a doposiaľ nie dostatočne vysvetlené. Ďalší intenzívny výskum je preto nevyhnutný, aby sme lepšie pochopili patogenézu MPN a mohli nové poznatky úspešne integrovať do klinickej praxe s cieľom spresniť diagnostiku, prognostiku a liečbu MPN.
ZOZNAM POUŽITÝCH SKRATIEK
AML – akútna myeloidná leukémia
aUPD – získaná uniparentálna dizómia
ATM – ataxia telangiectasia mutated
ASXL1 – additional sex comb-like 1
BCR: ABL1 – breakpoint cluster region: Abelson
CALR – kalretikulín
CHEK2 – checkpoint kináza 2
CHIP – klonálna hematopoéza s neurčitým potenciálom
CML – chronická myeloidná leukémia
CNL – chronická neutrofilná leukémia
DNMT3 – DNA (cytozín–5) –metyltransferáza 3A
DUSP1 – dual specificity phosphatase 1
EPOR – erytropoetínový receptor
ET – esenciálna trombocytémia
EZH2 – enhancer of zeste homolog 2
FH – fumarát hydratáza
FLT3 – Fms related receptor tyrosine kinase 3
G–CSFR – receptor pre kolónie granulocytov stimulujúci faktor
GFI1B – growth factor independence 1b
GWAS – celogenómová asociačná štúdia
HBS1L-MYB – intergénová oblasť medzi HBS1L1 a MYB
HSC – hematopoetická kmeňová bunka
IFN g – interferón g
IL-1b – interleukín 1b
JAK2 – Janusova kináza 2
mCALR – mutovaný CALR
MDS – myelodysplastický syndróm
MECOM – MDS1 and EVI1 complex locus
MPL (TPOR) – trombopoetínový receptor
MPN – myeloproliferatívne neoplázie
MRE11 – meiotic recombination 11 homolog
NF–E2 – nuclear factor erythroid–2
NBN – nibrín
NGS – next generation sequencing
NRAS – neuroblastoma RAS viral oncogene homolog
Ph – chromozóm Filadelfia
PINT – p53 induced transcript
PMF – primárna myelofibróza
PV – polycytémia vera
RUNX1 – runt-related transcription factor 1
sAML – sekundárna akútna myeloidná leukémia
SF3B1 – splicing factor 3b subunit 1
SH2B3 – SH2B adaptorový proteín 3
SRSF2 – serine and arginine rich splicing factor 2
STAT – signal transducer and activator of transcription
TERT – telomerázová reverzná transkriptáza
TET2 – tet metylcytozín dioxygenáza 2
TGF b – transformujúci rastový faktor b
TNF a – tumor nekrotizujúci faktor a
TM2D3 – TM2 domain containing 3
TPOR (MPL) – trombopoetínový receptor
TP53 – tumorový proteín p53
U2AF1 – U2 small nuclear RNA auxiliary factor 1
PODIEL AUTOROV NA PRÍPRAVE RUKOPISU
BK – príprava rukopisu a obrázkovej dokumentácie
KHK – podiel na príprave rukopisu
VD a MH – korekcia a revízia rukopisu
POĎAKOVANIE
Práca vznikla za podpory Ministerstva zdravotníctva Českej republiky (NU21-03-00338) a Interného grantu Univerzity Palackého (IGA_LF_2021_004). Ďakujeme prof. MUDr. Dagmar Pospíšilovej, Ph.D. za cenné pripomienky pri príprave rukopisu.
ČESTNÉ PREHLÁSENIE AUTOROV
Autori práce potvrdzujú, že v súvislosti s témou, vznikom a publikovaním tohto článku nie sú v strete záujmov a vznik ani publikovanie článku nebolo podporené žiadnou farmaceutickou firmou.
Do redakce doručeno dne 7. 5. 2021.
Přijato po recenzi dne 13. 5. 2021.
doc. Mgr. Monika Horváthová, Ph.D.
Ústav biologie
LF UP v Olomouci
Hněvotínská 3
775 15 Olomouc
e-mail: monika.horvathova@upol.cz
Sources
- Dameshek W. Some specultation on the myeloproliferative syndromes. Blood. 1951; 6 : 372–375.
- Rumi E, Cazzola M. Diagnosis, risk stratification, and response evaluation in classical myeloproliferative neoplasms. Blood. 2017; 129 : 680–692.
- Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Heath Organization classification of myeloid neoplasms and acute leukemia. Blood. 2016; 127 : 2391–2405.
- Kralovics R, Stockton DW, Prchal JT. Clonal hematopoiesis in familial polycythemia vera suggests the involvement of multiple mutational events in the early pathogenesis of the disease. Blood. 2003; 102 : 3793–3796.
- Landgren O, Goldin LR, Kristinsson SY, Helgadottir EA, Samuelsson J, Bjorkholm M. Increased risks of polycythemia vera, essential thrombocythemia, and myelofibrosis among 24,577 first-degree relatives of 11,039 patients with myeloproliferative neoplasms in Sweden. Blood. 2008; 112 : 2199–2204.
- Rumi E, Passamonti F, Della Porta, MG, et al. Familial chronic myeloproliferative disorders: clinical phenotype and evidence of disease anticipation. J Clin Oncol. 2007; 25 : 5630 – 5635.
- Tegg EM, Thomson RJ, Stankovich JM, et al. Anticipation in familial hematologic malignancies. Blood. 2011; 117 : 1308–1310.
- Nowell PC, Hungerford DA. Chromosome studies on normal and leukemic human leukocytes. J Natl Cancer Inst. 1960; 25 : 85–109.
- Ren, R. Mechanisms of BCR-ABL in the pathogenesis of chronic myelogenous leukaemia. Nat Rev Cancer. 2005; 5 : 172–183.
- Nieborowska-Skorska M, Kopinski PK, Ray R, et al. Rac2-MRC-cIII-generated ROS cause genomic instability in chronic myeloid leukemia stem cells and primitive progenitors. Blood. 2012; 119 : 4253–4263.
- Baxter E, Scott L, Cambell P, et al. Acquired mutation of the tyrosine kinase JAK2 in human myeloproliferative disorder. Lancet. 2005; 365 : 1054–1061.
- Kralovics R., Passamonti F., Buser A, et al. A gain-of-function mutation of JAK2 in myeloproliferative disorders. N Engl J Med. 2005; 352 : 1779–1790.
- James C, Ugo V, Le Couedic J, et al. A unique clonal JAK2 mutation leading to constitutive signalling causes polycythaemia vera. Nature. 2005; 434 : 1144–1148.
- Levine RL, Wadleigh M, Cools J, et al. Activating mutation in the tyrosine kinase JAK2 in polycythemia vera, essential thrombocythemia, and myeloid metaplasia with myelofibrosis. Cancer Cell. 2005; 7 (4): 387–397.
- Klampfl T, Gisslinger H, Harutyunyan AS, et al. Somatic mutations of calreticulin in myeloproliferative neoplasms. N Engl J Med 2013; 369 : 2379–2390.
- Nangalia J, Massie CE, Baxter EJ, et al. Somatic CALR mutations in myeloproliferative neoplasms with nonmutated JAK2. N Eng J Med. 2013; 369 : 2391–2405.
- Defour JP, Chachoua I, Pecquet C, Constantinescu SN. Oncogenic activation of MPL/thrombopoietin receptor by 17 mutations at W515: implications for myeloproliferative neoplasms. Leukemia. 2016; 30 : 1214–1216.
- Pardanani AD, Levine RL, Lasho T, et al. MPL515 mutations in myeloproliferative and other myeloid disorders: a study of 1182 patients. Blood. 2006; 108 : 3472–3476.
- O‘Sullivan J, Mead AJ. Heterogeneity in myeloproliferative neoplasms: Causes and consequences. Adv Biol Regul. 2019; 71 : 55–68.
- Van Egeren D, Escabi J, Nguyen M, et al. Reconstructing the lineage histories and differentiation trajectories of individual cancer cells in myeloproliferative neoplasms. Cell Stem Cell. 2021; 28 : 514–523.
- Williams N, Lee J, Moore L, et al. Phylogenetic reconstruction of myeloproliferative neoplasm reveals very early origins and lifelong evolution. bioRxiv; publikováno elektronicky 9. novembra 2020. doi: 10.1101/2020.11.09.374710.
- Jatiani SS, Baker SJ, Silverman LR, Reddy EP. JAK/STAT pathways in cytokine signaling and myeloproliferative disorders. Genes Cancer. 2010; 1 : 979–993.
- Takahashi K, Patel KP, Kantarjian H, et al. JAK2 p.V617F detection and allele burden measurement in peripheral blood and bone marrow aspirates in patients with myeloproliferative neoplasms. Blood. 2013; 122 : 3784–3786.
- Jaiswal S, Fontanillas P, Flannick J, et al. Age-related clonal hematopoiesis associated with adverse outcomes. N Engl J Med. 2014; 371 : 2488–2498.
- Scott L. The JAK2 exon 12 nutations: a comprehensive review. Am J Hematol. 2011; 86 : 668–676.
- Gold LI, Eggleton P, Sweetwyne MT, et al. Calreticulin: non-endoplasmic reticulum functions in physiology and disease. Faseb J. 2010; 24 : 665–683.
- Pietra D, Rumi E, Ferretti VV, et al. Differential clinical effects of different mutation subtypes in CALR-mutant myeloproliferative neoplasms. Leukemia. 2016; 30 : 431–438.
- Kaushansky K. Thrombopoietin. N Engl J Med. 1998; 339 : 746–754.
- Staerk J, Lacout C, Sato T, Smith SO, Vainchenker W, Constantinescu SN. An amphipathic motif at the transmembrane-cytoplasmic junction prevetns autonomous activation of the thrombopoietin receptor. Blood. 2006; 107 : 1864–1871.
- Haider M, Elala YC, Gangat N, Hanson CA, Tefferi A. MPL mutations and palpable splenomegaly are independent risk factors for fibrotic progression in essential thrombocythemia. Blood Canc J. 2016; 10: e347.
- Ding J, Komatsu H, Wakita A, et al. Familial essential thrombocythemia associated with a dominant-positive activating mutation of the c-MPL gene, which encodes for the receptor for thrombopoietin. Blood. 2004; 103 : 4198–4200.
- Beer PA, Campbell PJ, Scott LM, et al. MPL mutations in myeloproliferative disorders: analysis of the PT-1 cohort. Blood. 2008; 112 : 141–149.
- Milosevic Feenstra JD, Nivarthi H, Gisslinger H, et al. Whole-exome sequencing identifies novel MPL and JAK2 mutations in triple-negative myeloproliferative neoplasms. Blood. 2016; 127 : 325–332.
- Harutyunyan AS, Kralovics R. Role of germline genetic factors in MPN pathogenesis. Hematol/Oncol Clin North Am. 2012; 1037–1051.
- Cabagnols X, Favale F, Pasqiuer F, et al. Presence of atypical thrombopoietin receptor (MPL) mutations in triple-negative essiental thrombocythemia patients. Blood. 2016; 127 : 333–342.
- Beer PA, Jones AV, Bench AJ, et al. Clonal diversity in the myeloproliferative neoplasms: independent origins of genetically distinct clones. Br J Haematol. 2009; 144 : 904–908.
- Usseglio F, Beaufils N, Calleja A, Raynaud S, Gebart J. Detection of CALR and MPL mutations in low allelic burden JAK2 V617F essential thrombocythemia. J Mol Diagn. 2017; 19 : 92–98.
- Bernal M, Jiménez P, Puerta J, Ruíz-Cabello F, Jurado M. Co-mutated CALR and MPL driver genes in a patient with myeloproliferative neoplasm. Ann Hematol. 2017; 96 : 1399–1401.
- Thompson ER, Nguien T, Kankanige Y, et al. Clonal independence of JAK2 and CALR or MPL mutations in comutated myeloproliferative neoplasms demonstrated by single cell DNA sequencing. Haematologica. 2021; 106 : 313–315.
- Lundberg P, Karow A, Nienhold R, et al. Clonal evolution and clinical correlates of somatic mutations in myeloproliferative neoplasms. Blood. 2014; 123 : 2220–2228.
- Grinfeld J, Nangalia J, Green AR. Molecular determinants of pathogenesis and clinical phenotype in myeloproliferative neoplasms. Haematologica. 2017; 102 : 2–12.
- Guglielmelli P, Lasho TL, Rotunno G, et al. The number of prognostically detrimental mutations and prognosis in primary myelofibrosis: an international study of 797 patients. Leukemia. 2014; 28 : 1804–1810.
- Delhommeau F, Dupont S, Della Valle V, et al. Mutation in TET2 in myeloid cancers. N Engl J Med. 2009; 360 : 2289–2301.
- Stegelmann F, Bullinger L, Schlenk RF, et al. DNMT3A mutations in myeloproliferative neoplasms. Leukemia. 2011; 25 : 1217–1219.
- Ortmann CA, Kent DG, Nangalia J, et al. Effect of mutation order on myeloproliferative neoplasms. N Engl J Med. 2015; 372 : 601–612.
- Nangalia J, Nice FL, Wedge DC, et al. DNMT3A mutations occur early or late in patients with myeloproliferative neoplasms and mutation order influences phenotype Haematologica. 2015; 100: e438–e442.
- O’Sullivan J, Panchal A, Yap C, et al. The mutational landscape in hydroxycarbomide-resistant/intolerant essential thrombocythemia treated on the MAJIC-ET study. Hemasphere. 2018; 2 : 714.
- Zhang SJ, Rampal R, Manhouri T, et al. Genetic analysis of patients with leukemic transformation of myeloproliferative neoplasms shows recurrent SRSF2 mutations that are associated with adverse outcome. Blood. 2012; 119 : 4480–4485.
- Rampal R, Ahn J, Abdel-Wahab O, et al. Genomic and functional analysis of leukemic transformation of myeloproliferative neoplasms. Proc Natl Acad Sci USA. 2014; 111: E5401–E5410.
- Jutzi JS, Bogeska R, Nikoloski G, et al. MPN patients harbor recurrent truncating mutations in transcription factor NF-E2. J Exp Med. 2013; 210 : 1003–1019.
- Ward AF, Braun BS, Shannon KM. Targeting oncogenic Ras signaling in hematologic malignancies. Blood. 2012; 120 : 3397–3406.
- Jones AV, Chase A, Silver RT, et al. JAK2 haplotype is a major risk factor for the development of myeloproliferative neoplasms. Nat Genet. 2009; 41 : 446–449.
- Hermouet S, Vilaine M. The JAK2 46/1 haplotype: a marker of inappropriate myelomonocytic response to cytokine stimulation, leading to increased risk of inflammation, myeloid neoplasm, and impaired defense against infection? Haematologica. 2011; 96 : 1575–1579.
- Jäger R, Harutyunyan AS, Rumi E, et al. Common germline variation at the TERT locus contributes to familial clustering of myeloproliferative neoplasms. Am J Hematol. 2014; 89 : 1107–1110.
- Tapper W, Jones AV, Kralovics R, et al. Genetic variation at MECOM, TERT, JAK2 and HBS1L-MYB predisposes to myeloproliferative neoplasms. Nat Commun. 2015; 6 : 6691.
- Hinds DA, Barnolt K, Mesa RA, el al. Germ line variants predispose to both JAK2 V617F clonal hematopoiesis and myeloproliferative neoplasms. Blood. 2016; 128 : 1121–1128.
- Loh PR, Genovese G, McCaroll SA. Monogenic and polygenic inheritance become instruments for clonal selection. Nature. 2020; 584 : 136–141.
- Bao EL, Nandakumar SK, Liao X. Inherited myeloproliferative neoplasm risk affects haematopoietic stem cells. Nature. 2020; 586 : 769–775.
- Mambet C, Babosova O, Defour JP, et al. Cooccurring JAK2 V617F and R1063H mutations increase JAK2 signaling and neutrophilia in myeloproliferative neoplasms. Blood. 2018; 132 : 2695–2699.
- Lanikova L, Babosova O, Swierczek S, et al. Coexistence of gain-of-function JAK2 germ line mutations with JAK2V617F in polycythemia vera. Blood. 2016; 128 : 2266–2270.
- Schulze S, Stengel R, Jaekel N, et al. Concomitant and noncanonical JAK2 and MPL mutations in JAK2V617F ‐ and MPLW515 L‐positive myelofibrosis. Genes Chromos Cancer. 2019; 58 : 747–755.
- Benton CB, Prajwal CB, DiNardo CD, et al. Janus Kinase 2 variants asscociated with the transformation of myeloproliferative neoplasms into acute myeloid leukemia. Cancer. 2019; 125 : 1855–1866.
- Marty C, Saint‐Martin C, Pecquet C, et al. Germ‐line JAK2 mutations in the kinase domain are responsible for hereditary thrombocytosis and are resistant to JAK2 and HSP90 inhibitors. Blood. 2014; 123 : 1372–1383.
- Ricci K, Huber E, Raj A, et al. Compound heterozygosity of two novel JAK2 mutations in hereditary essential thrombocythemia implicates important monomer-monomer interactions in thrombopoiesis signaling. Blood. 2016; 128 : 3137.
- Kapralova K, Horvathova M, Pecquet C, et al. Cooperation of germline JAK2 mutations E846D and R1063H in hereditary erythrocytosis with megakaryocytic atypia. Blood. 2016; 128 : 1418–1423.
- Srour SA, Devesa SS, Morton LM, et al. Incidence and patient survival of myeloproliferative neoplasms and myelodysplastic/myeloproliferative neoplasms in the United States, 2001-12. Br J Haematol. 2016; 174 : 382–396.
- Harman D. The free radical theory af aging: effect of age on serum copper levels. J Gerontol. 1965; 20 : 151–153.
- Kurosawa S, Iwama A. Aging and leukemic evolution of hematopoietic stem cells under various stress conditions. Inflamm Regen. 2020; 40 : 29.
- Sørensen AL, Hasselbalch HC. Smoking and Philadelphia-negative chronic myeloproliferative neoplasms. Eur J Haematol. 2016; 97 : 63–69.
- Schultz MB, Sinclair DA. When stem cells grow old: phenotypes and mechanisms of stem cell aging. Development. 2016; 143 : 3–14.
- Kovtonyuk LV, Fritsch K, Feng X et al. Inflamm-aging of hematopoiesis, hematopoietic stem cells, and the bone marrow microenvironment. Front Immunol. 2016; 7 : 502.
- Ho YH, Méndez-Ferrer S. Microenvironmental contributions to hematopoietic stem cell aging. Haematologica. 2020; 105 : 38–46.
- Barraco D, Mora B, Guglielmelli P, et al. Gender effect on phenotype and genotype in patients with post-polycythemia vera and post-essential thrombocythemia myelofibrosis: results from the MYSEC project. Blood Cancer J. 2018; 8 : 89.
- Pecquet C, Diaconu CC, Staerk J, et al. Thrombopoietin receptor down-modulation by JAK2 V617F: restoration of receptor levels by inhibitors of pathologic JAK2 signaling and of proteasomes. Blood. 2012; 119 : 4625–4635.
- Parganas E, Wang D, Stravopodis D, et al. Jak2 is essential for signaling through a variety of cytokine receptors. Cell. 1998; 93 : 385–395.
- Hasselbalch HC, Bjørn RnME. MPNs as inflammatory diseases: the evidence, consequences, and perspectives. Mediators Inflamm. 2015; 2015: e102476.
- Vaidya R, Gangat N, Jimma T, et al. Plasma cytokines in polycythemia vera: phenotypic correlates, prognostic relevance, and comparison with myelofibrosis. Am J Hematol. 2012; 87 : 1003–1005.
- Pourcelot E, Trocme C, Mondet J, Bailly S, Toussaint B, Mossuz P. Cytokine profiles in polycythemia vera and essential thrombocythemia patients: clinical implications. Exp Hematol. 2014; 42 : 360–368.
- Stetka J, Vyhlidalova P, Lanikova L, et al. Addiction to DUSP1 protects JAK2V617F-driven polycythemia vera progenitors against inflammatory stress and DNA damage, allowing chronic proliferation. Oncogene. 2019; 38 : 5627–5642.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today
2021 Issue 3-
All articles in this issue
- Nové poznatky v patofyziológii Ph-negatívnych myeloproliferatívnych neoplázií
- Změny v imunitním systému u neléčených nemocných s chronickou lymfocytární leukémií – část 2: nespecifická imunita
- POEMS syndrom – vzácné onemocnění asociované s monoklonální gamapatií a polyneuropatií: diagnostika a terapie
- Laboratorní diagnostika imunitně podmíněných trombocytopenií
- Ph negativní myeloproliferativní neoplázie na českých hematologických centrech – analýza dat MIND
- Kryokonzervované směsné trombocyty v náhradním roztoku
- Mnohočetná plazmocytóza lymfatických uzlin s přítomností monoklonální gamapatie – plazmocelulární neoplázie či indolentní B-lymfom?
- Primář MUDr. Jiří Horák, 11. 6. 1936 – 21. 6. 2021
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Laboratorní diagnostika imunitně podmíněných trombocytopenií
- Nové poznatky v patofyziológii Ph-negatívnych myeloproliferatívnych neoplázií
- POEMS syndrom – vzácné onemocnění asociované s monoklonální gamapatií a polyneuropatií: diagnostika a terapie
- Kryokonzervované směsné trombocyty v náhradním roztoku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

