-
Medical journals
- Career
Kryokonzervované směsné trombocyty v náhradním roztoku
Authors: H. Lejdarová 1,2; R. Pacasová 1; N. Poloková 1; S. Michlíčková 1; L. Tesařová 3; I. Koutná 3
Authors‘ workplace: Transfuzní a tkáňové oddělení, FN Brno 1; LF MU, Brno 2; Mezinárodní centrum klinického výzkumu, FN u sv. Anny, Brno 3
Published in: Transfuze Hematol. dnes,27, 2021, No. 3, p. 254-261.
Category: Original Papers
doi: https://doi.org/10.48095/cctahd2021254Overview
Hlavní nevýhodou běžně používaných nativních trombocytů je krátká doba použití, která obvykle nepřesahuje 5 dní. Může tak docházet k jejich omezené dostupnosti. Kryokonzervace trombocytů umožňuje prodloužení doby skladování trombocytových transfuzních přípravků až na 2 roky, pokud jsou uchovávány při teplotě –80 °C. Fakultní nemocnice Brno zavedla metodu kryokonzervace trombocytů při –80 °C v 5–6% roztoku dimethylsulfoxidu. K mražení jsou využívány směsné trombocyty z buffy-coatu krevní skupiny 0, které jsou po rozmražení rekonstituovány pomocí náhradního roztoku SSP+. Autoři předkládají výsledky srovnávací studie kryokonzervovaných a nativních trombocytů, která předcházela uvedení nových produktů do klinické praxe. Byly hodnoceny tyto parametry: obsah a koncentrace trombocytů, pH, objem, ztráta trombocytů během mražení, obsah dimethylsulfoxidu, obsah reziduální plazmy, obsah celkového proteinu, titr AB0 protilátek a swirling. Viskoelastické vlastnosti byly měřeny rotační tromboelastografií a obsah trombocytárních mikropartikulí byl stanoven pomocí průtokového cytometru. Vyrobené kryokonzervované trombocyty dosahují předepsaných kvalitativních parametrů a zachovávají si průměrně 83,6 % původního obsahu trombocytů. Zanedbatelný obsah reziduální plazmy vede k nízkému obsahu celkové bílkoviny (0,3 g/terapeutickou dávku) a k velmi nízkému titru AB0 protilátek (0–2). Kryokonzervované trombocyty krevní skupiny 0 rekonstituované pomocí SSP+ lze proto považovat za AB0 univerzální produkty, a to i pro klinické stavy, při kterých jsou vyžadovány promyté trombocyty. Kryokonzervované trombocyty vykazují zkrácení doby vzniku koagula a 25× vyšší obsah trombocytárních mikropartikulí ve srovnání s nativními krevními destičkami. Tyto vlastnosti spolu s dlouhou dobou použitelnosti předurčují využití kryokonzervovaných trombocytů zejména v urgentních stavech provázených masivním krvácením.
Klíčová slova:
kryokonzervované trombocyty – směsné trombocyty – dimethylsulfoxid – trombocytární mikropartikule – náhradní roztok pro trombocyty
ÚVOD
Transfuze trombocytových transfuzních přípravků jsou indikovány v profylaxi a léčbě krvácení pacientů s trombocytopenií, popřípadě trombocytopatií. Trombocyty (TRC) lze získat z aferézy od jednoho dárce nebo z plné krve od většího počtu dárců [1,2]. Jejich častá omezená dostupnost souvisí s krátkou dobou použitelnosti a také s faktem, že se přípravě trombocytových transfuzních přípravků věnují jen některá zařízení transfuzní služby. Kryokonzervace TRC je proto do budoucna možnou cestou, jak tuto situaci řešit [3,4]. Zatímco u chronických pacientů, jejichž převahu tvoří nemocní s hematoonkologickými diagnózami, lze hemoterapii ve většině případů předem plánovat, u mnohočetných poranění, transplantací a jiných urgentních stavů to možné není. Transfuze TRC tak musí být zajišťovány z dostupných skladových rezerv vyrobených původně pro chronické pacienty, což může způsobovat jejich kritický nedostatek.
Metodu mražení TRC publikovali v 70. letech minulého století Valeri et al. [5]. Kromě využití kryokonzervovaných TRC v armádě byla v počátcích pozornost zaměřena také na zajištění TRC pro aloimunizované pacienty. Prodloužení doby použitelnosti z obvyklých 5 dní na 2 roky má s rostoucí spotřebou tohoto typu transfuzního přípravku stále širší uplatnění [6].
Mražení způsobuje nevratné poškození buněk. Proto je nezbytné použití kryoprotektivních látek, které tomuto poškození brání. Jako nejvhodnější se pro účel kryokonzervace TRC jeví dimethylsulfoxid (DMSO), přestože je známý svojí toxicitou. V dávce nad 1 g/kg hmotnosti příjemce transfuze způsobuje bolest hlavy, nauzeu a vazokonstrikci [7]. Obsah DMSO musí být z tohoto důvodu ve finálním produktu snížen. Lze toho docílit několika způsoby: redukcí objemu po rozmražení, promytím po rozmražení nebo redukcí objemu s odstraněním DMSO před zmražením [3]. Poslední jmenovaný způsob, který je Valeriho modifikací původní metody [8], se pro svoji jednoduchost používá nejčastěji [4,9]. Celkem 95 % použitého DMSO je při něm odstraněno ještě před procesem mražení. Konečné množství DMSO ve finálním produktu se díky tomuto výrobnímu postupu pohybuje průměrně kolem 1,4 g na terapeutickou dávku (TD) [7]. Obsah DMSO se tedy za použití tohoto postupu nachází bezpečně pod hranicí toxicity, a to i v případě podání většího počtu transfuzí [10]. K resuspenzi koncentrátu TRC po rozmražení lze použít plazmu, náhradní roztoky pro TRC nebo fyziologický roztok [8,9,11–13].
Kryokonzervované TRC jsou ve srovnání s nativními produkty charakterizovány vyšší mírou aktivace spojenou s nárůstem exprese markerů aktivace CD62P (P-selektin) a CD63 [12–14]. Kryokonzervované TRC rovněž exprimují na svém povrchu velké množství molekul fosfatidylserinu a obsahují signifikantně větší množství fosfatidylserin pozitivních trombocytárních mikropartikulí (TMP). TMP mají v porovnání s TRC 50–100× vyšší prokoagulační aktivitu a vedou k rychlejší tvorbě koagula [7]. Související vysoká hemostatická účinnost kryokonzervovaných TRC není podle dosavadních zkušeností spojena se zvýšeným rizikem vzniku trombotických komplikací a jako nejperspektivnější se jeví jejich využití v urgentních stavech provázených masivním krvácením [3,14].
První zkušenosti s kryokonzervací TRC v ČR získala Ústřední vojenská nemocnice v Praze [15]. Současný zvýšený zájem o skladování TRC ve zmraženém stavu souvisí především s krizovou krevní politikou. Krizová transfuzní centra mají v případě mimořádné události povinnost dodat bezodkladně 50 TD TRC [16]. Vzhledem k relativně nízkým počtům běžně skladovaných trombocytových přípravků v těchto centrech byla přijata varianta zajištění krizové rezervy TRC s využitím kryokonzervace. Nebyla však definována jednotná metodika přípravy, která se liší jak typem použitého vstupního materiálu (aferetické nebo směsné TRC), tak typem resuspenzního roztoku (plazma nebo náhradní roztok pro TRC). Porovnávání kvality a účinnosti kryokonzervovaných TRC mezi jednotlivými výrobci je proto obtížné.
V předloženém sdělení autoři prezentují metodiku mražení TRC používanou ve Fakultní nemocnici Brno (FN Brno) a výsledky validační studie, která předcházela uvedení nového typu transfuzního přípravku do praxe. Cílem studie bylo porovnání kvalitativních parametrů kryokonzervovaných směsných trombocytů (trombocyty z buffy-coat směsné, deleukotizované, kryokonzervované, TBSDK) a nativních směsných trombocytů (trombocyty z buffy-coat směsné, deleukotizované, resuspendované v náhradním roztoku, TBSDR).
METODIKA
K mražení byly použity směsné deleukotizované TRC z buffy-coatu krevní skupiny 0, bez rozlišení RhD. Rekonstituce byla provedena za použití náhradního roztoku SSP+. Všechny odběry plné krve použité pro přípravu TBSDR pocházely od dobrovolných bezpříspěvkových dárců krve. Metoda používaná ve FN Brno vychází z publikovaných zkušeností zahraničních autorů [6,8,13,14]. Byla modifikována tak, aby byla proveditelná v podmínkách libovolného zařízení transfuzní služby bez nutnosti použití laminárního boxu nebo 30% DMSO připravovaného v lékárně.
Výroba nativních trombocytových transfuzních přípravků určených ke kryokonzervaci
Standardní jednotky plné krve byly odebrány (den 0) do odběrové soupravy Macopharma s in-line filtrací s obsahem 63 ml CPD a 100 ml SAGM (Quadruple Top-Bottom LCRD 450 ML CPD/SAGM, Macopharma, Francie). Po zpracování plné krve byly vzniklé buffy-coatu skladovány při 20–24 °C do následujícího dne, kdy byly vyrobeny TBSDR (den 1). Čtyři buffy-coaty krevní skupiny 0 byly smíchány s 250 ml náhradního roztoku pro TRC SSP+ (SSP+, Macopharma, Francie) a centrifugovány (Heraeus Cryofuge 16, Heraeus, SRN) při 852xg po dobu 8 minut. Výsledná suspenze TRC s poměrem SSP+ a plazmy 70 : 30 byla deleukotizována (Platelet Filter System ATSBC1ESB, PALL Medical, Portsmouth, VB). Směsné TRC byly umístěny do skladovacího vaku pro TRC o objemu 1 000 ml (Storage bag in Platelet Filter System ATSBC1ESB, PALL Medical, Portsmouth, VB) a skladovány při teplotě 20–24 °C za stálé agitace (Helmer PC2200h, Helmer Inc., IN, USA) do následujícího dne (den 2) [17].
Kryokonzervace trombocytových transfuzních přípravků
V den 2 byly před zamražením nejprve odebrány vzorky nativních TRC k vyšetření vybraných parametrů kvality. Ke kryokonzervaci byl použit 30% roztok DMSO připravený smísením 100% DMSO (100% CryoSure – DMSO, Wak-Chemie Medical GMBH, SRN) a roztoku SSP+ v DMSO-odolném kryovaku o objemu 600 ml (Maco Biotech Freezing EVA bag, Macopharma, Francie). Sterilita byla při přípravě 30% DMSO zajištěna pomocí sterilní jehly a sterilní stříkačky, kterou byl 100% DMSO přidán přes Cryo prep set s DMSO odolným bakteriálním filtrem (Closed Cryo Prep Set, BELDICO SA/NV, Belgie) sterilně připojeným ke kryovaku s roztokem SSP+. Manipulaci proto nebylo nutné provádět v laminárním boxu. Suspenze TRC byla nejprve přepuštěna do sterilně připojeného kryovaku o objemu 600 ml. Následně byl za jemného promíchávání k TRC přidán ze sterilně napojeného kryovaku (TCD B40, M. Device Group, Southport, VB) odpovídající objem 30% roztoku DMSO tak, aby konečná koncentrace DMSO v suspenzi trombocytů byla 5–6 %.
Po přidání DMSO a promíchání byla suspenze TRC centrifugována při 1997xg po dobu 10 minut (Heraeus Cryofuge 16, Heraeus, SRN). Většina supernatantu byla následně pomocí manuálního lisu odstraněna, v kryovaku byl ponechán sediment TRC s malým množstvím supernatantu o celkovém objemu přibližně 25 ml. Kryovak se suspenzí TRC v 5–6% DMSO byl uložen do hliníkového obalu (Cardboard Cassettes H01FCB Range, Macopharma, Francie) a zmražen při teplotě –80 °C. Následující den (den 3) byl kryovak se zmraženými TRC přemístěn z hliníkového obalu do ochranné papírové obálky a dále skladován při teplotě –80 °C.
Rozmražení, rekonstituce
Rozmražení trombocytů bylo provedeno v rozmrazovací vodní lázni (BOECO PWB-4, Unimed Praha, s.r.o, ČR) temperované na teplotu 37 °C. Uzavřeným způsobem pomocí sterilní svářečky (TCD B40, M. Device Group, VB) byl k rozmraženým TRC přidán náhradní roztok SSP+ temperovaný na pokojovou teplotu v rozmezí 20–24 °C o objemu asi 200 ml [8,12,13].
Sledované parametry
Předmětem porovnání byly vzorky ze vstupních nativních TBSDR a vzorky z TBSDK skladovaných méně než 1 rok od zmražení, po jejich rozmražení a rekonstituci. Vzorky k laboratorní analýze byly odebírány u TBSDR před dalším zpracováním kryokonzervací, TBSDK bezprostředně po rozmražení, nejpozději do 1 hodiny.
Objem produktů (ml) byl stanoven pomocí hmotnosti (elektronická váha KERN EW, Kern-Sohn GmbH, SRN) a odpovídajícího hmotnostního koeficientu, který byl pro TBSDR 1 031 g/ml (70 % SSP+ a 30 % plazmy) a pro TBSDK 1 010 g/ml (100 % SSP+). Počet TRC (×109/TD) a koncentrace TRC (×109/ml) byly stanovovány pomocí hematologického analyzátoru (Sysmex KX-21N, Sysmex, Japonsko). Hodnota pH byla měřena pH metrem s korekcí pro 22 °C (FE20 Kit, Mettler-Toledo, InLab Routine Pro, Švýcarsko). Vířivost TRC (swirling) byla posuzována vizuálně a vyhodnocena podle intenzity (0–3).
Obsah DMSO (g/TD) ve zmraženém (TBSDKZ) a rekonstituovaném (TBSDK) produktu byl stanoven na základě výpočtů k jednotlivým výrobním krokům podle přidaného množství 30% DMSO (ml) do vstupního materiálu (TBSDR). Přepočet byl realizován pomocí stanoveného vztahu, kdy 1 ml 30% DMSO obsahoval 0,33 g DMSO.
Obsah reziduální plazmy TBSDK byl stanoven na základě obsahu plazmy v TBSDR a postupného ředění po přidání známého objemu SSP+ po rozmražení. Koncentrace celkové bílkoviny (g/l) byla stanovena turbidimetrickou metodou, určenou pro stanovení koncentrace celkové bílkoviny do 2 g/l (TPUC3, Roche; Cobas 8000, Roche) ze vzorku odebraného z TBSDK. Obsah celkové bílkoviny v produktu (g/TD) byl stanoven přepočtem na celkový objem TBSDK. Přítomnost anti-A a anti-B protilátek (IgM) byla stanovena titrací supernatantu získaného po centrifugaci vzorku odebraného z TBSDR a vzorku TBSDK. Titrace byla provedena pomocí solného testu zkumavkovou metodou při 20 °C. K průkazu protilátek byly použity diagnostické erytrocyty (diagnostické erytrocyty A1,B, Sanguin Reagents, Holandsko).
Viskoelastické vlastnosti byly stanoveny pomocí rotační tromboelastografie (ROTEM, Tem Innovations GmbH, SRN) vyhodnocením testu EXTEM a FIBTEM (ex-tem S a fib-tem S, Tem Inovations GmbH, SRN) podle instrukcí výrobce s užším zaměřením na dobu vzniku koagula (clotting time – CT) a maximální pevnost koagula (maximum clot firmness – MCF). CT (s) bylo definováno jako doba od začátku měření do vytvoření koagula o velikosti 2 mm v průměru. Parametr MCF (mm) charakterizuje zejména jeho stabilitu a pevnost. Funkční aktivita trombocytů (ATRC) byla vypočítána ze vzorce: ATRC = MCFEXTEM – MCFFIBTEM. Rozdíl v MCF v testu EXTEM a FIBTEM je vyjádřením příspěvku trombocytů k pevnosti koagula. V rámci studie byly vzorky TBSDR a TBSDK k měření připraveny v deleukotizované plné krvi bez TRC odstraněných při deleukotizaci. Přidáním vzorků TBSDR nebo TBSDK do deleukotizované plné krve byly simulovány poměry v oběhu příjemce po transfuzi TRC [3]. FIBTEM-CT ukazuje pouze aktivitu fibrinogenu a o příspěvku TRC k tvorbě koagula nevypovídá, proto tento parametr nebyl analyzován [3,14].
Pomocí průtokové cytometrie (CytoFlex, Beckman Coulter, Brea, Kanada) byl stanoven obsah TMP. Vzorky TBSDR a TBSDK byly centrifugovány za účelem izolace TRC a TMP. TRC byly izolovány centrifugací při 1 500 xg po dobu 15 min při pokojové teplotě. Výsledný supernatant byl centrifugován při 12 000 xg po dobu 5 min při pokojové teplotě za vzniku sedimentu, který byl ještě částečně kontaminován TRC. TMP byly izolovány centrifugací zbytku supernatantu při 16 000 xg po dobu 30 min při 4 °C. Všechny částice (TRC i TMP) byly identifikovány pomocí povrchového TRC znaku CD61 (použitá protilátka: anti-CD61, Miltenyi Biotec, SRN) a následně odlišeny podle velikosti.
Statistická analýza
Výsledky jsou vyjádřeny ve formě deskriptivní statistiky jako medián (med.), 25/75 percentil (perc.), minimum/maximum (min./max.) a hodnoceny pomocí bivalentního Mann-Whitneyho testu. Za hladinu významnosti je standardně považována hodnota a = 0,05. Statistické zpracování dat bylo provedeno softwarem GraphPad Prism version 7.03 for Windows (GraphPad Software, La Jolla California USA).
VÝSLEDKY
V rámci studie byly porovnávány vlastnosti TBSDR (n = 22) a TBSDK (n = 17) ve stanovených parametrech. Běžně sledované ukazatele kontroly kvality jsou zaznamenány v tab. 1. Koncentrace a obsah TRC v TBSDK byly podle očekávání nižší (TBSDR: med. 915×109/l, 227×109/T.D.; TBSDK: med. 790×109/l, 193×109/T.D.), oba porovnávané typy přípravků vykazují srovnatelný objem a pH. Medián ztráty TRC v TBSDK ve srovnání s TBSDR v souvislosti s manipulací byl 16,4 % (25/75 perc.: 8,8/24,2; min./max.: 0/30). Ve vzorcích TRC připravených k mražení byl měřen obsah DMSO (tab. 2). Ve zmraženém koncentrátu TRC (TBSDKZ) odpovídal obsah DMSO předpokladu 5–6 % uvedeném v metodice (med. 5,1 %) a po rekonstituci klesl na 0,5 %, což odpovídá mediánu absolutní hodnoty 1,3 g/TD. Vířivost TRC byla silnější v souboru TBSDR, kdy všechny zařazené produkty vykazovaly swirling nejvyššího stupně. Výsledky v souboru TBSDK byly slabší, ale všechny produkty alespoň slabou vířivost měly (tab. 3).
Table 1. Kvalitativní parametry. Přehled měřených kvalitativních parametrů u TBSDR a TBSDK – objem, koncentrace a obsah TRC, pH po zmražení a rekonstituci. 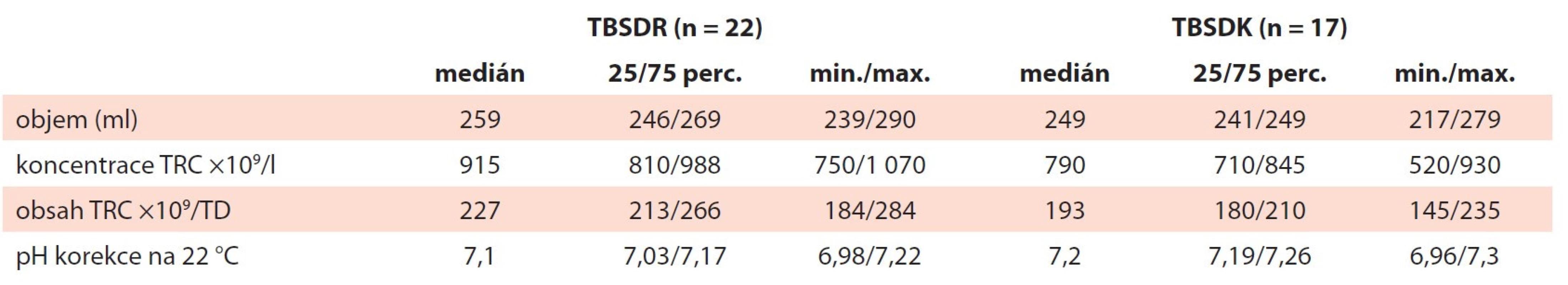
min./max. – minimální/maximální hodnota, perc. – percentil, TBSDK – trombocyty z buffy-coatu směsné deleukotizované kryokonzervované, TBSDR – trombocyty z buffy-coatu směsné deleukotizované resuspendované, TD – terapeutická dávka, TRC – trombocyty Table 2. Obsah dimethylsulfoxidu. Obsah DMSO byl měřen v těsně před zmražením (TBSDKZ) a po rozmražení a rekonstituci (TBSDK). 
DMSO – dimethylsulfoxid, min./max. – minimální/maximální hodnota, perc. – percentil, TBSDK – trombocyty z buffy-coatu směsné deleukotizované kryokonzervované, TBSDKZ – trombocyty z buffy-coatu směsné deleukotizované kryokonzervované zmrazené, TD – terapeutická dávka Table 3. Vířivost (swirling) byla hodnocena vizuálně na škále od 0 do 3. Všechny hodnocené TBSDR vykazují nejvyšší stupeň vířivosti (3). TBSDK mají vířivost méně intenzivní, nicméně ve všech případech viditelnou alespoň slabě (1–2). 
min./max. – minimální/maximální hodnota, perc. – percentil, TBSDK – trombocyty z buffy-coat směsné deleukotizované kryokonzervované, TBSDR – trombocyty z buffy-coat směsné deleukotizované resuspendované Obsah reziduální plazmy a celkové bílkoviny byly signifikantně nižší u TBSDK (tab. 4). Obsah plazmy (med. 2,9 %) korespondoval s absolutním objemem plazmy (med. 4,2 ml) a obsahem celkové bílkoviny (med. 0,3 g/TD). S poklesem obsahu plazmy po rekonstituci souvisí i očekávaný pokles titru AB0 protilátek třídy IgM. Nejvyšší zaznamenaný titr v TBSDR byl 16, po zmražení a rekonstituci se titr přirozených AB0 protilátek pohyboval mezi 0 a 2 (tab. 5).
Vzájemnou kontaminaci ve vzorcích izolovaných TRC a TMP z obou typů porovnávaných produktů znázorňuje graf 1 2A. Kontaminace TMP vzorků krevními destičkami byla v TBSDR i TBSDK velmi nízká. Obdobně nízká byla zaznamenána i kontaminace TRC vzorků mikropartikulemi v TBSDR, zatímco signifikantní nárůst TMP byl prokázán v TBSDK. Z relativního počtu TMP/1 000 TRC (graf 2B) vyplývá, že počet TMP vzroste po kryokonzervaci přibližně 25×.
Vlastnosti vzniklého koagula při použití TBSDR a TBSDK byly hodnoceny rotační tromboelastografií (tab. 6). Výsledky dokládají rychlejší tvorbu koagula (zkrácení EXTEM-CT) a jeho nižší pevnost (EXTEM-MCF) v případě TBSDK. Hodnota FIBTEM-MCF byla redukována v obou typech produktů ve srovnání s EXTEM-MCF v souvislosti s působením použitého inhibitoru funkce TRC v testu.
Table 4. Obsah plazmy a celkové bílkoviny. 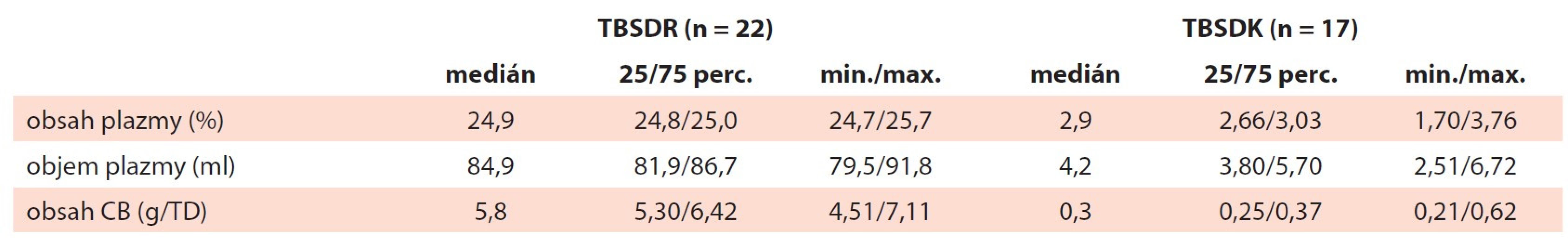
CB – celková bílkovina, min./max. – minimální/maximální hodnota, perc. – percentil, TBSDK – trombocyty z buffy-coat směsné deleukotizované kryokonzervované, TBSDR – trombocyty z buffy-coat směsné deleukotizované resuspendované, TD – terapeutická dávka Table 5. Titr AB0 protilátek (IgM) před zmražením (TBSDR) a po rozmražení a rekonstituci (TBSDK). 
*statisticky významný rozdíl (p < 0,05)
min./max. – minimální/maximální hodnota, perc. – percentil, TBSDK – trombocyty z buffy-coat směsné deleukotizované kryokonzervované, TBSDR – trombocyty z buffy-coat směsné deleukotizované resuspendovanéGraph 1. Obsah trombocytárních mikropartikulí.
Levá část grafu obsahuje příklady výsledků jednotlivých měření, v pravé části jsou graficky znázorněné hodnoty všech provedených měření. Část 2A znázorňuje obsah TMP v obou srovnávaných typech transfuzních přípravků. U TBSDK je patrný jejich několikanásobný nárůst. Část 2B přináší informace o obsahu TMP v přepočtu na 1 000 TRC.
Table 6. Viskoelastické vlastnosti. Vzorky vytvořené smísením TBSDR a TBSDK a deleukotizované trombocytopenické plné krve byly analyzovány pomocí rotační tromboelastografi e. 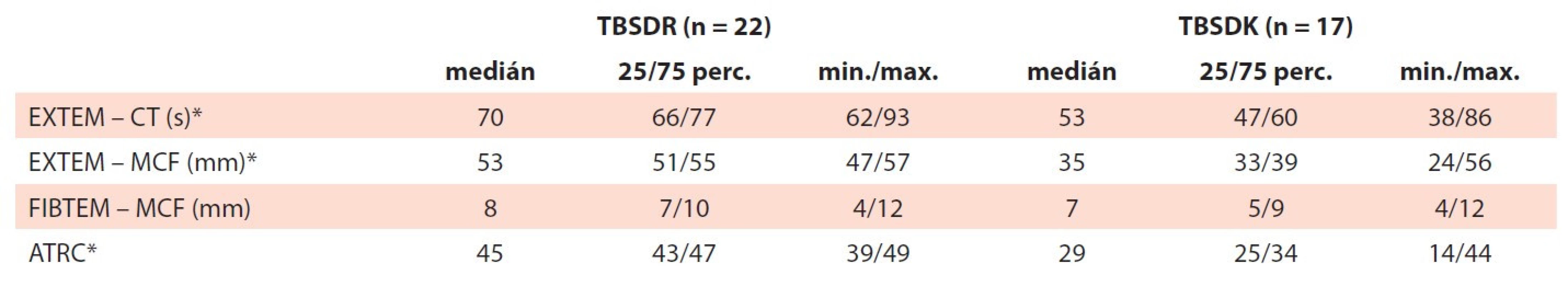
*statisticky významný rozdíl (p < 0,05)
ATRC – funkční aktivita trombocytů, CT – doba vzniku koagula, EXTEM, FIBTEM – tromboelastografi cké testy, MCF – pevnost koagula, min./max. – minimální/maximální hodnota, perc. – percentil, TBSDK – trombocyty z buffy-coat směsné deleukotizované kryokonzervované, TBSDR – trombocyty z buffy-coat směsné deleukotizované resuspendovanéDISKUZE
Z provedené validační studie vyplývá, že TBSDK dosahují požadovaných kvalitativních parametrů [17]. Ztráty TRC v souvislosti s procesem kryokonzervace a následné rekonstituce představují v naší studii přibližně 16,4 %, což je výsledek srovnatelný s nejlepšími dosaženými publikovanými daty, přičemž průměrná ztráta se pohybuje kolem 28 % [10]. Znamená to, že si TBSDK zachovaly 83,6 % původního obsahu TRC před zmražením. Toto zjištění svědčí o vysoké kvalitě zpracování a o přesvědčivém naplnění požadavku stanoveném evropským doporučením, které vyžaduje obsah TRC nad 50 % hodnoty před zmražením [17]. Současně byl potvrzen očekávaný fakt, že obsah DMSO v jednotlivých produktech je zanedbatelný. Pohybuje se kolem 1,3 g/TD, což rovněž odpovídá publikovaným výsledkům [7].
Řada prací uvádí snížení až vymizení intenzity vířivosti u kryokonzervovaných TRC. Tento fenomén souvisí zejména se změnou diskoidního tvaru TRC ve sférický [6,10]. Všechny hodnocené TBSDK v našem souboru měly slabší, ale viditelnou vířivost ve srovnání s TBSDR.
Rozmražení a rekonstituce TRC je jednoduchým a nenáročným procesem, a to zejména je-li použit náhradní roztok pro TRC, v našem případě SSP+. Náhradní roztoky jsou skladovány při pokojové teplotě a připraveny k okamžitému použití. Rozmražení kryokonzervovaného koncentrátu TRC trvá ve vodní lázni s ohledem na jeho velmi malý objem přibližně 2 min, celý proces je dokončen nejpozději do 10 min. V případě použití plazmy se rekonstituce prodlouží o přibližně 20 min nutných k rozmražení plazmy [12]. Náhradní roztoky nabízejí kromě rychlejší manipulace i další výhody. Mají přesně definovaný obsah a signifikantně snižují riziko potransfuzních reakcí. Nezanedbatelnou výhodou je i fakt, že ušetřenou plazmu lze využít pro jiné účely [8,12,13]. Klinická aplikace čerstvé zmražené plazmy je v současné době na ústupu a v situacích, kde je to možné, má být nahrazena koncentráty koagulačních faktorů, případně hromadně vyráběnou směsnou plazmou ošetřenou patogen redukční technologií [18].
Odstraněním většiny supernatantu ještě před zmražením suspenze TRC je redukován téměř veškerý objem plazmy původního produktu. Medián obsahu reziduální bílkoviny v TBSDK byl 0,3 g/TD. Jedná se o hodnotu nižší, než je hranice stanovená pro promyté transfuzní přípravky (0,5 g/jednotku) [17]. Kryokonzervované TRC rekonstituované pomocí náhradního roztoku proto mohou být použity u pacientů se selektivním IgA deficitem a po závažných alergických reakcích na bílkoviny plazmy, protože obsahem plazmy odpovídají promytým transfuzním přípravkům [19].
S nízkým obsahem plazmy v TBSDK souvisí také očekávaný velmi nízký titr AB0 protilátek (IgM 0–2). Lze proto konstatovat, že použití náhradního roztoku SSP+ umožňuje využití TBSDK krevní skupiny 0 jako univerzálních transfuzních přípravků v krevní skupině AB0 bez rizika hemolytické potransfuzní reakce. Mezinárodně uznávanou hranicí pro akceptovatelnou výši titru AB0 protilátek v TRC krevní skupiny 0 pro jinoskupinové použití je hodnota 64 [20,21]. České doporučení stanovuje jako bezpečný titr 32 [22].
Výsledky tromboelastografického měření se vzorky plné krve potvrdily dostupná data o rychlejší tvorbě koagula u TBSDK (kratší EXTEM-CT). Pevnost vzniklého koagula (EXTEM-MCF) byla u TBSDK nižší [3,14]. Hodnota FIBTEM-MCF byla redukována v obou typech produktů ve srovnání s EXTEM-MCF, což souvisí s efektem cytochalasinu D, který v testu FIBTEM-MCF slouží jako inhibitor funkce TRC k odlišení příspěvku fibrinogenu k MCF. Prezentované výsledky jsou ve shodě s publikovanými daty, která dokládají, že TBSDK si zachovávají významnou část své aktivity. Vedou k tvorbě primární zátky rychleji, přispívají ke vzniku méně pevného, ale dostatečně stabilního koagula pro zástavu krvácení, a jsou proto hemostaticky vysoce účinné [3,10,14,21,23–25].
Vysoká hemostatická účinnost TBSDK koreluje s přibližně 25násobným zvýšením počtu TMP ve srovnání s TBSDR. Výsledky našich měření potvrzují závěry předchozích studií [7,14]. TMP zvyšují tvorbu trombinu, což by mohlo být spojeno s vyšším rizikem hyperkoagulačních stavů [3,7]. Dosavadní klinické zkušenosti však nenaznačují, že by v souvislosti s použitím kryokonzervovaných TRC narůstalo riziko tromboembolických komplikací nebo jiných závažných nežádoucích reakcí [3,10,14,21,23,24].
ZÁVĚR
Kryokonzervace umožňuje prodloužit dobu skladování TRC z 5–7 dní až na 2 roky. Kryokonzervované TRC vyrobené ve FN Brno vyhovují ve všech požadovaných kvalitativních parametrech, a jsou proto nadějnou alternativou k nativním přípravkům, jejichž hlavním limitem je velmi krátká skladovací doba. V současné době se kryokonzervované TRC ve FN Brno využívají u urgentních stavů s masivním krvácením, kdy nejsou dostupné nativní trombocytové transfuzní přípravky. Do budoucna mohou kryokonzervované TRC představovat záložní rezervu v nemocnicích, které jsou v současné době závislé na dovozu trombocytových transfuzních přípravků z jiných center. Podmínkou je vybavení pracoviště mrazicím zařízením s možností dlouhodobého skladování při teplotě –80 °C. Dostupná jsou mrazicí zařízení o malém objemu 80–100 l různých výrobců. Proces rozmražení a rekonstituce je nekomplikovaný a je proveditelný v kterékoli krevní bance. Rozšířením obecného povědomí o kryokonzervovaných TRC s prodlouženou dobou použitelnosti a možnostech skladování v krevních bankách by se mohla dostupnost trombocytových transfuzních přípravků v ČR zásadním způsobem zvýšit.
SEZNAM ZKRATEK
ATRC – funkční aktivita trombocytů
CB – celková bílkovina
CT – doba vzniku koagula (clotting time)
ČR – Česká republika
DMSO – dimethylsulfoxid
FN Brno – Fakultní nemocnice Brno
MCF – pevnost koagula (maximum clot firmness)
med. – medián
min./max. – minimální /maximální hodnota
perc. – percentil
TBSDK – trombocyty z buffy-coat směsné deleukotizované kryokonzervované
TBSDR – trombocyty z buffy-coat směsné deleukotizované resuspendované
TBSDKZ – trombocyty z buffy-coat směsné deleukotizované kryokonzervované zmrazené
TD – terapeutická dávka
TMP – trombocytární mikropartikule
TRC – trombocyty
Podíl autorů na přípravě rukopisu
HL – design studie, analýza dat, zhotovení první verze rukopisu
RP – design studie, kritická revize rukopisu
NP, SM – pořizování dat
LT, IK – pořizování dat
Poděkování
Kolegům z KARIM FN Brno za pomoc při provádění tromboelastografických měření.
Podpořeno ze státního rozpočtu prostřednictvím MŠMT, projektem velké infrastruktury EATRIS-CZ (Identifikační kód LM2018133) v rámci aktivity Projekty velkých infrastruktur pro VaVal.
Čestné prohlášení autora
Prohlašuji, že v souvislosti s tématem, vznikem a publikací článku, nejsem ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne: 9. 3. 2021.
Přijato po recenzi dne: 10. 6. 2021.
MUDr. Hana Lejdarová
Transfuzní a tkáňové oddělení
FN Brno
Jihlavská 20
625 00 Brno
e-mail: lejdarova.hana@fnbrno.cz
Sources
- Schrezenmeier H, Seifried E. Buffy-coat-derived pooled platelet concentrates and apheresis platelet concentrates: which product type should be preferred? Vox Sang. 2010; 99 : 1–15.
- Lejdarová H. Trombocyty z aferézy a z plné krve – srovnání kvality a bezpečnosti. Transfuze Hematol Dnes. 2016; 22 : 244–253.
- Cid J, Escolar G, Galan A, et al. In vitro evaluation of the hemostatic effectiveness of cryopreserved platelets. Transfusion. 2016; 56 : 580–586.
- Johnson L, Reade MC, Hyland RA, Tan S, Marks DC. In vitro comparison of cryopreserved and liquid platelets: potential clinical implications. Transfusion. 2015; 55 : 838–847.
- Valeri CR. Hemostatic effectiveness of liquid-preserved and previously frozen human platelets. N Engl J Med. 1974; 290 : 353–358.
- Hornsey VS, McMillan L, Morrison A, Drummond O, MacGregor IR, Prowse CV. Freezing of buffy coat-derived, leukoreduced platelet concentrates in 6 percent dimethyl sulfoxide. Transfusion. 2008; 48 : 2508–2514.
- Johnson L, Raynel S, Seghatchian J, Marks DC. Platelet microparticles in cryopreserved platelets: Potential mediators of haemostasis. Transfusion Apheresis Sci. 2015; 53 : 146–152.
- Valeri CR, Ragno G, Khuri S. Freezing human platelets with 6 percent dimethyl sulfoxide with removal of the supernatant solution before freezing and storage at –80 °C without postthaw processing. Transfusion. 2005; 45 : 1890–1898.
- Bohoněk M. Kryokonzervace krve – historie, metody a současnost. Transfuze Hematol Dnes. 2013; 19 : 44–50.
- Slichter SJ, Jones M, Ransom J, et al. Review of in vivo studies of dimethyl sulfoxide cryopreserved platelets. Transfusion Med Rev. 2014; 28 : 212–225.
- Cohn CS, Dumont LJ, Lozano M, et al. Vox Sanguinis International Forum on platelet cryopreservation: Summary. Vox Sang. 2017; 112 : 684–688.
- Johnson L, Reid S, Tan S, Vidovic D, Marks DC. PAS-G supports platelet reconstitution after cryopreservation in the absence of plasma. Transfusion. 2013; 53 : 2268–2277.
- Johnson LN, Winter KM, Reid S, Hartkopf-Theis T, Marks DC. Cryopreservation of buffy-coat-derived platelet concentrates in dimethyl sulfoxide and platelet additive solution. Cryobiology. 2011; 62 : 100–106.
- Johnson L, Coorey CP, Marks DC. The hemostatic acitivity of cryopreserved platelets is mediated by phosphatidylserine-expressing platelets and platelet microparticles. Transfusion. 2014; 54 : 1917–1926.
- Bohoněk M, Kutáč D, Landová L, et al. Kryokonzervované trombocyty v klinické praxi: srovnávací studie s nativními trombocyty. Transfuze Hematol Dnes. 2016; 22 : 268–278.
- Ministerstvo zdravotnictví České republiky. Metodika systému zajištění přípravků a krevních derivátů při mimořádných událostech a krizových stavech. Vest Minist zdrav Čes repub. 2017; 2017 : 3–11.
- European Directorate for the Quality of Medicines & Health Care. Guide to the preparation, use and quality assurance of blood components, 20th ed. Strasbourg, EDQM Publishers, 2020.
- Spahn DR, Bouillon B, Cerny V, et al. The European guideline on management of major bleeding and coagulopathy following trauma: fifth edition. Crit Care. 2019; 23 : 98.
- Anani W, Triulzi D, Yazer MH, Qu L. Relative IgA-deficient recipients have an increased risk of severe allergic transfusion reactions. Vox Sang. 2014; 107 : 389–392.
- Shehata N, Tinmouth A, Naglie G, Freedman J, Wilson K. ABO identical versus non identical platelet transfusion: a systematic review. Transfusion. 2009; 49 : 2442–2453.
- Khuri S, Healey N, MacGregor H, et al. Comparison of the effects of transfusions of cryopreserved and liquid-preserved platelets on hemostasis and blood loss after cardiopulmonary bypass. J Thoracic Cardiovasc Surg. 1999; 117 : 172–183.
- Doporučení Společnosti pro transfuzní lékařství ČLS JEP, č.STL2015_12 ze dne 01.09.2015 verze 1, dostupné z: https: //www.transfuznispolecnost.cz/doporucene-postupy/doporucene-postupy-pro-podani-transfuznich-pri - pravku-230.
- Lelkens CCM, Koning JG, de Kort B, Floot IBG, Noorman F. Experiences with frozen blood products in the Netherlands military. Transfusion Apheresis Sci. 2006; 34 : 289–298.
- Kelly K, Dumont LJ. Frozen platelets. Transfusion Apheresis Sci. 2019; 58 : 23–29.
- Bohonek M, Kutac D, Landova L, et al. The use of cryopreserved platelets in the treatment of polytraumatic patients with massive bleeding. Transfusion. 2019; 59 (S2): 1474–1478.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today
2021 Issue 3-
All articles in this issue
- Nové poznatky v patofyziológii Ph-negatívnych myeloproliferatívnych neoplázií
- Změny v imunitním systému u neléčených nemocných s chronickou lymfocytární leukémií – část 2: nespecifická imunita
- POEMS syndrom – vzácné onemocnění asociované s monoklonální gamapatií a polyneuropatií: diagnostika a terapie
- Laboratorní diagnostika imunitně podmíněných trombocytopenií
- Ph negativní myeloproliferativní neoplázie na českých hematologických centrech – analýza dat MIND
- Kryokonzervované směsné trombocyty v náhradním roztoku
- Mnohočetná plazmocytóza lymfatických uzlin s přítomností monoklonální gamapatie – plazmocelulární neoplázie či indolentní B-lymfom?
- Primář MUDr. Jiří Horák, 11. 6. 1936 – 21. 6. 2021
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Laboratorní diagnostika imunitně podmíněných trombocytopenií
- Nové poznatky v patofyziológii Ph-negatívnych myeloproliferatívnych neoplázií
- POEMS syndrom – vzácné onemocnění asociované s monoklonální gamapatií a polyneuropatií: diagnostika a terapie
- Kryokonzervované směsné trombocyty v náhradním roztoku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

